Andy Gabriel Rivera Flores, Scherezada María Isabel Mejía Loza, Nuria Pérez y López, Edgar Torres López, Mauricio Alejandro Oviedo Maglione, Felipe Zamarripa Dorsey
Servicio de Gastroenterología. Hospital Juárez de México. México
Acta Gastroenterol Latinoam 2019;49(2):110-118
Recibido: 23/04/2018 / Aprobado: 27/05/2018 / Publicado en www.actagastro.org el 17/06/2019
Resumen
Los principales patógenos asociados a la peritonitis bacteriana espontánea (PBE) son E. coli (46%), Streptococcus (19%) y Klebsiella (9%) con buena respuesta al tratamiento con cefalosporinas en los Estados Unidos y en países europeos. Se ha registrado a nivel mundial un incremento de la resistencia antibiótica. Objetivos. Conocer los patógenos más frecuentes de PBE, determinar su respuesta al tratamiento convencional, la resistencia antimicrobiana y la mortalidad intrahospitalaria en pacientes cirróticos con PBE. Material y métodos. Se realizó un estudio descriptivo, prospectivo, transversal en pacientes cirróticos descompensados con PBE en el Hospital Juárez de México en el período entre marzo del 2016 y marzo de 2017. Resultados. Se incluyó a 68 pacientes adultos con PBE, de los cuales 36 eran mujeres (53%) y 32 hombres (47%), con una edad mediana de 52 años (44-60). El agente causal más frecuente fue E. coli y E. coli betalactamasa de espectro extendido (BLEE). El resultado de los antibiogramas muestra una alta resistencia (80- 100%) al tratamiento con cefalosporinas de tercera generación y quinolonas. Además se encontró un 60% de patógenos multidroga resistente (MDR): E. coli BLEE 26%, y el resto cada uno con un 4% (S. aureus MRS, Candida albicans, Sterotrophomonas maltophila, Pseudomonas putid, Serratia, Enterococos resistentes a vancomicina (VRE)). Se documentó una mortalidad intrahospitalaria en los pacientes con PBE MDR del 92% y 60% en PBE no MDR (p = 0,03). Conclusiones. El patógeno más frecuente fue E. coli y E. coli BLEE, con una resistencia del 80-100% al tratamiento recomendado como de primera línea en las guías internacionales. Por lo tanto, consideramos que en nuestra población el tratamiento de primera línea debe ser meropenem más vancomicina o linezolid.
Palabras claves. Peritonitis bacteriana espontánea, mortalidad, agentes causales, resistencia antimicrobiana.
Spontaneous bacterial peritonitis: pathogens and antibiotic resistance in cirrhotic patients at the Hospital Júarez de México
Summary
The principal pathogens associated with spontaneous bacterial peritonitis (PBE) are E. coli (46%) Streptococcus (19%) and Klebsiella (9%). Although there has been a worldwide increase in antibiotic resistance they still have a good response to treatment with third generation cephalosporins in the USA and Europe. Objectives. To identify the most frequent pathogens of spontaneous bacterial peritonitis (SBP), to determine its response to conventional treatment, antimicrobial resistance and intra-hospital mortality in decompensated cirrhotic patients with SBP. Materials and methods. A descriptive, prospective, cross-sectional study was performed in decompensated cirrhotic patients with SBP at the Hospital Juárez de México from March 2016 to March 2017. Results. It was included 68 adult patients with SBP. 36 were women (53%) and 32 men (47%), with a median age of 52 years (44-60). The most frequent causative agent was E. coli and E. coli beta – lactamase extended spectrum (ESBL). The result of susceptibility demonstrates a high resistance (80- 100%) to treatment with third generation cephalosporins and qu inolonas. In addition, 60% of multidrug-resistant pathogens (MDR) were found: E. coli BLEE 26%, and the rest each with 4% (S. Aureus MRS, Candida albicans, Sterotrophomonas maltophila, Pseudomonas putid, Serratia, vancomycin – resistant Enterococci (VRE)). In-hospital mortality was documented in patients with MDR PBE of 92% and 60% in non-MDR PBE (p = 0.03). Conclusions. the most frequent pathogen was E. coli and E. coli BLEE with a resistance of 80-100% to the recommended first-line treatment in the international guidelines. That is why, we consider in our population meropenem plus vancomycin or linezolid as the first line treatment.
Key words. Spontaneous bacterial peritonitis, mortality, pathogens, antibiotic resistence.
Abreviaturas
PBE: peritonitis bacteriana espontánea.
SBP: spontaneous bacterial peritonitis.
PMN: polimorfonucleares.
MDR: multidroga resistente.
BGP: bacterias Gram positivas.
BGN: bacterias Gram negativas.
MRSA: Staphylococcus aureus meticilina resistente.
NASH: enfermedad del hígado graso no alcohólico.
LRA: lesión renal aguda.
E. coli: Escherichia coli.
BLEE: betalactamasas de espectro extendido.
S. aureus: Staphylococcus aureus.
VRE: Enterococos vancomicina resistente.
TMP-SX: trimetoprima-sulfametosazol.
La peritonitis bacteriana espontánea (PBE) es la infección del líquido ascítico sin una causa intraabdominal conocida, con un recuento de polimorfonucleares (PMN) > 250 células/mm3 con cultivo positivo y PBE asociada a cuidados de salud: diagnóstico dentro de las 48 horas de admisión hospitalaria en pacientes que tuvieron contacto con el sistema de salud en los últimos 90 días.1, 2 Se presenta en el 2-3% de los pacientes ambulatorios y el 11% de los hospitalizados.3
Los síntomas más frecuentes de PBE son: fiebre (68%), alteración del estado mental (61%), dolor abdominal (46%), escalofríos, náuseas y vómito.4 Cabe recordar que el 30% de los pacientes con PBE son asintomáticos.5-7 Por esta razón a todo paciente cirrótico con ascitis admitido en el hospital, independientemente de su cuadro clínico, se le debe realizar una paracentesis diagnóstica con estudio citoquímico del líquido e introducir 10 ml de la muestra en un frasco de hemocultivo (estándar de oro) para aerobios y anaerobios. El cultivo convencional tiene una sensibilidad del 35% contra el 80% en los frascos de hemocultivo. Existe mayor sensibilidad y especificidad para la positividad de los cultivos con un valor de PMN mayor de 500. Las bacterias Gram positivas (BGP) tienen menos de 250 PMN comparadas con las bacterias Gram negativas (BGN), que tienen valores mayores de 250 PMN. La tinción Gram es raramente útil y no se recomienda.7, 8
En estudios realizados entre 1998 y 2012 se reporta las BGN en el 55%, siendo las más frecuentes: E. coli (33%), Klebsiella pneumoniae (8%) y Pseudomonas (1%). Las BGP están en segundo lugar con 43%, siendo frecuentes: Streptococcos (15%), Enterococcos (9%), Staphylococus (13%). Además, se reportaron bacterias muy raras como: Listeria, Streptococcus bovis, Bordetella bronchiseptica, Candida, Pasteurella multocida, Leclercia adecarboxylata, Salmonella paratyphi A, Streptococcus viridans, Staphylococcus saccharolyticus.9
El tratamiento recomendado son las cefalosporinas de tercera generación (cefotaxina 2 g IV cada 8 horas, ceftriaxona 1-2 G IV cada 24 horas) y quinolonas (ciprofloxacino 400 mg IV cada 12 horas), sin embargo, hay un incremento en la resistencia de aproximadamente 23- 44% y 38-50%, respectivamente. Hay estudios asiáticos que demuestran un incremento en las bacterias betalactamasas resistentes (Enterococcus faecium, Staphylococcus aureus meticilina resistente (MRSA), no así en Europa, en donde se reporta una disminución de la resistencia antimicrobiana.10, 11
Objetivos
- Conocer los patógenos causales de la PBE en pacientes cirróticos del Servicio de Gastroenterología del Hospital Juárez de México.
- Determinar si hay respuesta al tratamiento con cefalo sporinas y resistencia antimicrobiana en pacientes cirróticos con PBE en nuestro medio.
- Exponer las comorbilidades que tenían estos pacientes.
- Determinar la mortalidad durante su estancia intrahospitalaria.
Material y métodos
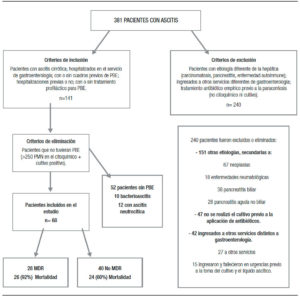
Estudio prospectivo, descriptivo y de corte transversal entre marzo de 2016 y marzo de 2017, realizado en el Servicio de Gastroenterología del Hospital Juárez de México, hospital universitario de tercer nivel. Se estudió a 68 pacientes con PBE que cumplieron con los criterios de inclusión: pacientes con ascitis cirrótica; hospitalizados en el Servicio de Gastroenterología; con o sin cuadros previos de PBE; hospitalizaciones previas o no; con o sin tratamiento profiláctico para PBE que tuvieran cultivo positivo y citoquímico con más de 250 PMN. Se excluyeron: pacientes con etiología diferente de la hepática (carcinomatosis, pancreatitis, enfermedad autoinmune); ingresados a otros servicios diferentes de Gastroenterología; tratamiento antibiótico empírico previo a la paracentesis (no citoquímico ni cultivo) (Figura 1).
A todos los pacientes se les realizaron estudios de laboratorio (biometría hemática, pruebas de función hepática y tiempos de coagulación), se determinaron las escalas pronósticas Meld Na y Child-Pugh, se tomó citoquímico (al ingreso y a las 48 horas), cultivo y antibiograma de líquido ascítico. Una vez realizado el protocolo se inició tratamiento en los pacientes con > PMN de 250 cel/mm3 con ceftriaxona 2 g IV cada 24 horas junto con albúmina 1,5 g/kg el primer día y 1g/kg el tercer día. Si a las 48-72 horas no había descenso del 25% de PMN o mejoría del cuadro clínico se consideró falla terapéutica y se cambió el esquema antibiótico de acuerdo con los resultados del cultivo de cada paciente o de forma empírica si el resultado se encontraba pendiente. Se determinó la mortalidad intrahospitalaria de los pacientes con PBE.
Análisis estadístico
Se utilizó el software SPSS V. 23. Los resultados fueron analizados con promedios y desviaciones estándar para variables cuantitativas, Chi cuadrado para establecer una asociación o dependencia de las variables analizadas considerando estadísticamente significativo si tenía un valor de p < 0,05.
El trabajo fue aceptado por el comité de ética y de ensayos clínicos. Todo paciente firmó un consentimiento informado de conformidad con el proyecto.
Resultados
En el período de tiempo establecido se estudió a 68 pacientes cirróticos descompensados con PBE, 36 mujeres (53%); edad mediana de 52 años (rango: 44-60). La media de Meld Na fue de 20 puntos, teniendo un estadio Child Pugh C el 74% de los pacientes; el 70 % tenían menos de dos comorbilidades y el 74% de los pacientes fallecieron intrahospitalariamente (Tabla 1).
El alcohol y el NASH fueron la etiología más frecuente en los pacientes con PBE (Tabla 2). El 96% de los pacientes con PBE tienen una comorbilidad asociada, la más frecuente fue la lesión renal aguda (LRA) en el 62% y 30% más de dos comorbilidades con una mortalidad intrahospitalaria del 70% (Tabla 3). De los factores de riesgo para PBE el único estadísticamente significativo con una p = 0,03 fue la mortalidad intrahospitalaria (Tabla 4).
De los 68 cultivos positivos para PBE el agente causal más frecuente fue E. coli y E. coli BLEE con 26% cada uno; dentro los gérmenes MDR podemos encontrar: E. coli BLEE (26%), el resto cada una con un 4% (S. aureus MRS, Candida albicans, Sterotrophomonas maltophila, Pseudomonas putid, Serratia, Enterococos vancomicina resistente (VRE) (Tabla 5).
Tabla 1. Características demográficas de los pacientes con PBE.
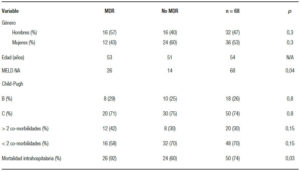
Tabla 2. Comorbilidades asociadas en los pacientes con PBE.
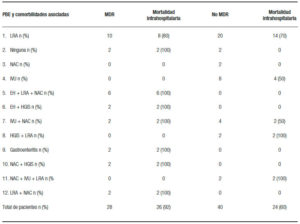
Tabla 3. Etiología de la cirrosis y su correlación con PBE.
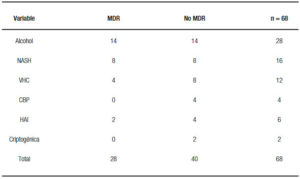
Tabla 4. Factores de riesgo para PBE MDR.
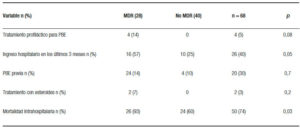
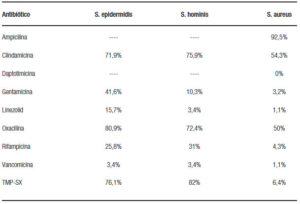
El resultado de los antibiogramas muestra una alta resistencia al tratamiento convencional con cefalosporinas de tercera generación, quinolonas y penicilinas con un rango de 60-100% a pesar de no ser PBE MDR; encontrándose menor resistencia con TMP-SX, carbapenémicos, aminoglucósidos, daptomicina, linezolid o vancomicina (Tablas 6 y 7).
Tabla 6. Resistencia antimicrobiana en bacterias gram negativas.
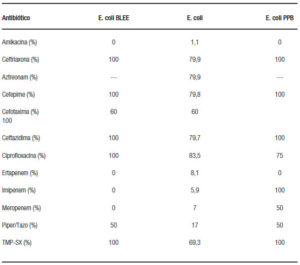
Tabla 7. Resistencia antimicrobiana en bacterias gram positivas.
Discusión
En México hay pocos estudios de resistencia antimicrobiana en PBE. En Latinoamérica, estudios realizados en Colombia, Cuba o Brasil reportan como el germen más frecuente la Escherichia coli (E. coli), con un porcentaje que va del 25 al 75%.12-14 En Europa y EE.UU. predominan en el 60% los BGN seguidos de BGP (22- 30%) y hongos (6%). Llama la atención que a partir de 2009 se documenta un aumento en BGP y microorganismos multirresistentes asociado al uso de quinolonas como tratamiento profiláctico (ocasionando un aumento en la resistencia antimicrobiana y de BGP) y nosocomiales.
Los patógenos más frecuentemente aislados a partir del 2009 son: Enterobacteriaceae productor de BLEE, BGN no fermentadores (Pseudomonas aeruginosa), Staphylococcus aureus (S. aureus) MRSA y ERV.15,16 Esta tendencia se observa en nuestro estudio, siendo los patógenos más frecuentes las BGN (E. coli 26%, E. coli BLEE 26%) y BGP (S. aureus 18%, MRSA 4%) con casos aisaldos de infecciones fúngicas (cándida 100%).
Hay una gran preocupación a nivel mundial por el aumento de la resistencia a los antimicrobianos, que actualmente se ha asociado casi exclusivamente a PBE nosocomial; sin embargo, estos pacientes se encuentran en una zona gris por las infecciones asociadas a los cuidados de la salud cuya diferencia con las infecciones nosocomiales parece ser tenue en cuanto a la epidemiología y los resultados, ya que para ambas constituyen un factor de riesgo independiente para la mortalidad intrahospitalaria y a 30 días, la cual puede ascender hasta un 58,7% frente a la infección adquirida en la comunidad, que tiene una mortalidad reportada a 30 días del 37,3%.17-20 Es por este motivo que se han realizado estudios de revisión sistemática en el 2017 que demuestran que el shock séptico asociado a PBE tiene mal pronóstico (mortalidad 80%).21 Llama la atención que en nuestro estudio la mortalidad intrahospitalaria en PBE MDR fue del 92% siendo estadísticamente significativo, como principal factor de riesgo el ingreso hospitalario 3 meses previos en un 57% sin ser estadísticamente significativo; sin embargo la mortalidad en PBE no MDR fue del 60%, por consiguiente en nuestro hospital la mortalidad es mucho mayor a la descrita en las diversas literaturas antes mencionadas, haciendo hincapié que tenemos un número pequeño de pacientes (68 cultivos para PBE).
Las comorbilidades asociadas a PBE en nuestro estudio fueron del 96%, siendo la más frecuente LRA, por consiguiente, es importante a futuro realizar estudios con PBE y comorbilidades ya que pueden influir en la mortalidad de estos pacientes.
La terapia antimicrobiana apropiada debe administrarse tan pronto como sea posible, la no administración apropiada aumenta la mortalidad hospitalaria 1,86 veces por hora.22 Desafortunadamente, incluso los protocolos de tratamiento dependen de los datos microbiológicos obsoletos que todavía apoyan el uso de cefalosporinas de tercera generación como primera línea terapéutica. En el 2013 la Asociación Europea para el Estudio del Hígado recomendó diferentes opciones terapéuticas para PBE nosocomial, como piperacilina/tazobactam o meropenem más daptomicina. Concluyendo que las cefalosporinas de tercera generación tienen una baja cobertura antimicrobiana para su tratamiento y en zonas donde hay una alta prevalencia de VRE, MRSA o E. coli BLEE deben recibir tratamiento empírico de primera línea con altas dosis de daptomicina (8-12 mg/kg por 24 h) con meropenem (1 g/8 h) y un betalactámico activo contra MRSA. Al tener el resultado del cultivo se debe iniciar un esquema antimicrobiano con un espectro más estrecho (estrategia de desaceleración temprana).23-27 En Latinoamérica, un estudio realizado por el grupo GERMEN entre los años 2011 y 2013, en el cual se realizó cultivo de líquido ascítico en pacientes de UCI, no UCI, ambulatorios y urgencias, encontró un perfil de resistencia para cefalosporinas del 10%, quinolonas 30%, aminoglucosidos 16%, carbapenemicos 15% y TMP-SX 40%, llamando la atención la poca resistencia a clindamicina, oxacilina y tetraciclinas.27, 28 En nuestro estudio encontramos una alta resistencia (80-100%) a cefalosporinas, quinolonas y betalactámicos; coincidiendo con los datos expresados en las últimas revisiones europeas. Podríamos considerar que somos una zona de alta prevalencia de VRE, MRSA o E. coli BLEE; sin embargo, en nuestro hospital muchos pacientes a pesar de no ser MDR tuvieron mala respuesta al tratamiento convencional, por lo que sugerimos que el tratamiento de primera línea sea con carbapenémicos, vancomicina, linezolid, TMP-SX, fosfomicina para disminuir la mortalidad que es alta en nuestro medio.
Conclusión
En nuestros pacientes el patógeno más frecuente fue E. coli y E. coli BLEE con poca repuesta a las opciones terapéuticas recomendadas y una mortalidad elevada. Consideramos por nuestros resultados que el tratamiento de primera línea debe ser de amplio espectro con carbapenémicos y vancomicina o linezolid por la poca resistencia a estos y una segunda línea basada en TMP-SX o fosfomicina. Por lo anterior, consideramos que se debe revalorar las guías de tratamiento para PBE de acuerdo con cada institución y país además de realizar un estudio multicéntrico para determinar la resistencia antimicrobiana en México y valorar el inicio de esquemas antibióticos más agresivos de manera empírica y así ofrecer una mejor sobrevida a estos pacientes.
Sostén económico o patrocinio. Ninguno.
Referencias
- Conn HO, Fessel JM. Spontaneous bacterial peritonitis in cirrhosis: variations on a theme. Medicine 1971; 50: 161-197.
- Runyon BA. Management of adult patients with ascites due to cirrhosis: an update. Hepatology 2009; 49: 2087-2107.
- Wiest R, Krag A, Gerbes A. Spontaneous bacterial peritonitis: recent guidelines and beyond. Gut 2012; 61: 297-310.
- Evans LT, Kim WR, Poterucha JJ, Kamath PS. Spontaneous bacterial peritonitis in asymptomatic outpatients with cirrhotic ascites. Hepatology 2003; 37: 897-901.
- Alaniz C, Regal RE. Spontaneous bacterial peritonitis: a review of treatment options. P T 2009; 34: 204-210.
- Jain P. Spontaneous bacterial peritonitis: few additional points. World J Gastroentero: WJG 2009; 15: 5754-5755.
- Moore KP, Aithal GP. Guidelines on the management of ascites in cirrhosis. Gut 2006; 55: 1-12.
- Fernández J, Navasa M, Planas R, Montoliu S, Monfort D, Soriano G, Vila C, Pardo A, Quintero E, Vargas V, Such J, Ginès P, Arroyo V. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology 2007; 133: 818-824.
- Dever JB, Sheikh MY. Review article: spontaneous bacterial peritonitis – bacteriology, diagnosis, treatment, risk factors and prevention. Aliment Pharmacol Ther 2015; 41: 1116-1131.
- EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal, syndrome in cirrhosis. J Hepatol 2010; 53: 397-417.
- Astencio Rodríguez G, Espinosa Rivera F, Sainz López SM, Castro Caballero K, Pomares Pérez YM. Peritonitis bacteriana espontánea en el paciente con cirrosis hepática. Rev Cubana Med 2010; 49: 248-362.
- Salinas Gómez DC. Caracterización clínica, citoquímica y microbiológica de pacientes cirróticos con peritonitis bacteriana en la Fundación Cardioinfantil 2014. Disponible en: http://repository. urosario.edu.co/handle/10336/4987
- Do Amaral Ferreira M, Bicca Thiele G, Marconcini ML, Dantas- Corrêa EB, Schiavon Lde L, Narciso-Schiavon JL. Clinical and laboratorial features of spontaneous bacterial peritonitis in southern Brazil. Rev Col Gastroentero 2013; 28: 191-198.
- Bobadilla M, Sifuentes J, García-Tsao G. Improved method for bacteriological diagnosis of spontaneous bacterial peritonitis. J Clin Microbiol 1989; 27: 2145-2147.
- Fiore M, Maraolo AE, Gentile I Borgia G, Leone S, Sansone P, Passavanti MB, Aurilio C, Pace MC. Nosocomial spontaneous bacterial peritonitis antibiotic treatment in the era of multi-drug resistance pathogens: A systematic review. World J Gastroenterol 2017; 23: 4654-4660.
- Fernández J, Arroyo V. Bacterial infections in cirrhosis: a growing problem with significant implications. Clin Liver Dis 2013; 2: 102-105.
- Jalan R, Fernández J, Wiest R, Schnabl B, Moreau R, Angeli P, Stadlbauer V, Gustot T, Bernardi M, Canton R, Albillos A, Lammert F, Wilmer A, Mookerjee R, Vila J, García-Martínez R, Wendon J, Such J, Córdoba J, Sanyal A, García-Tsao G, Arroyo V, Burroughs A, Ginès P. Bacterial infections in cirrhosis: a position statement based on the EASL Special Conference 2013. J Hepatol 2014; 60: 1310-1324.
- Dever JB, Sheikh MY. Review article: spontaneous bacterial peritonitis-bacteriology, diagnosis, treatment, risk factors and prevention. Aliment Pharmacol Ther 2015; 41: 1116-1131.
- European Association for the study of the liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53: 397-417.
- Cheong HS, Kang CI, Lee JA, Moon SY, Joung MK, Chung DR, Koh KC, Lee NY, Song JH, Peck KR. Clinical significance and outcome of nosocomial acquisition of spontaneous bacterial peritonitis in patients with liver cirrhosis. Clin Infect Dis 2009; 48: 1230-1236.
- Solà E, Solé C, Ginès P. Management of uninfected and infected ascites in cirrhosis. Liver Int 2016; 36: 109-115.
- Merli M, Lucidi C, Giannelli V, Giusto M, Riggio O, Falcone M, Ridola L, Attili AF, Venditti M. Cirrhotic patients are at risk for health care-associated bacterial infections. Clin Gastroenterol Hepatol 2010; 8: 979-985.
- Karvellas CJ, Abraldes JG, Arabi YM, Kumar A. Cooperative Antimicrobial Therapy of Septic Shock (CATSS) Database Research Group. Appropriate and timely antimicrobial therapy in cirrhotic patients with spontaneous bacterial peritonitis-associated septic shock: a retrospective cohort study. Aliment Pharmacol Ther 2015; 41: 747-757.
- Runyon BA, AASLD. Introduction to the revised American Association for the study of liver diseases practice guideline management of adult patients with ascites due to cirrhosis 2012. Hepatology 2013; 57: 1651-1653.
- Fiore M. Letter: the emergence of multi-drug resistant spontaneous bacterial peritonitis: a new challenge for the hepatologist? Aliment Pharmacol Ther 2016; 43: 944-945.
- Fiore M, Andreana L. The possible role of Anti-Methicillin-Resistant Staphylococcus Aureus antimicrobial agents in spontaneous bacterial peritonitis. Infect Dis Rep 2015; 7: 6286.
- Fiore M. Spontaneous bacterial peritonitis due to multidrug resistant bacteria: are the current guidelines outdated? Eur J Gastroenterol Hepatol 2016; 28: 731.
- Germen G. Programa de Vigilancia de Resistencia Bacteriana. Disponible en: http://www.grupogermen.org/2013.
- Lontos S, Grow PJ, Vaughan RB, Angus PW. Norfloxacin and trimethoprim-sulfamethoxazole therapy have similar efficacy in prevention of spontaneous bacterial peritonitis. J Gastroenterol Hepatol 2007; 23: 252-255.
Correspondencia: Andy Gabriel Rivera Flores
Ahuehuetes 102, San Bartolo Atepehuacan, Gustavo a Madero. Ciudad de México, México
Tel.: +52 155 17721399
Correo electrónico: andyrivera48@hotmail.com
Acta Gastroenterol Latinoam 2019;49(2):110-118
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE