Alejandro Mínguez ID· Pilar Nos ID
Hospital Universitario y Politécnico La Fe de Valencia, España.
Acta Gastroenterol Latinoam 2022;52(3):334-343
Recibido: 22/08/2022 / Aceptado: 23/09/2022 / Publicado online el 29/09/2022 / https://doi.org/10.52787/agl.v52i3.245
La enfermedad inflamatoria intestinal (EII) agrupa una serie de trastornos crónicos del tracto gastrointestinal caracterizados por presentar fases de actividad inflamatoria que alternan con otras de remisión de la enfermedad. La EII tiene un curso evolutivo difícil de predecir, sin tendencia a la curación espontánea.1, 2 Existen 3 subtipos principales: la enfermedad de Crohn (EC), la colitis ulcerosa (CU) y la colitis pendiente de clasificar. En la EC la localización más frecuente es la ileocecal y normalmente presenta al inicio un patrón inflamatorio que evoluciona hacía un patrón estenosante o fistulizante, dado su carácter transmural, con necesidad de cirugía hasta en el 80% de los pacientes. La CU, limitada a la mucosa y submucosa del colon, suele presentarse con lesiones superficiales y se extiende desde el recto proximalmente. La colitis pendiente de clasificar presenta características de ambas entidades y no es posible definir su naturaleza.3
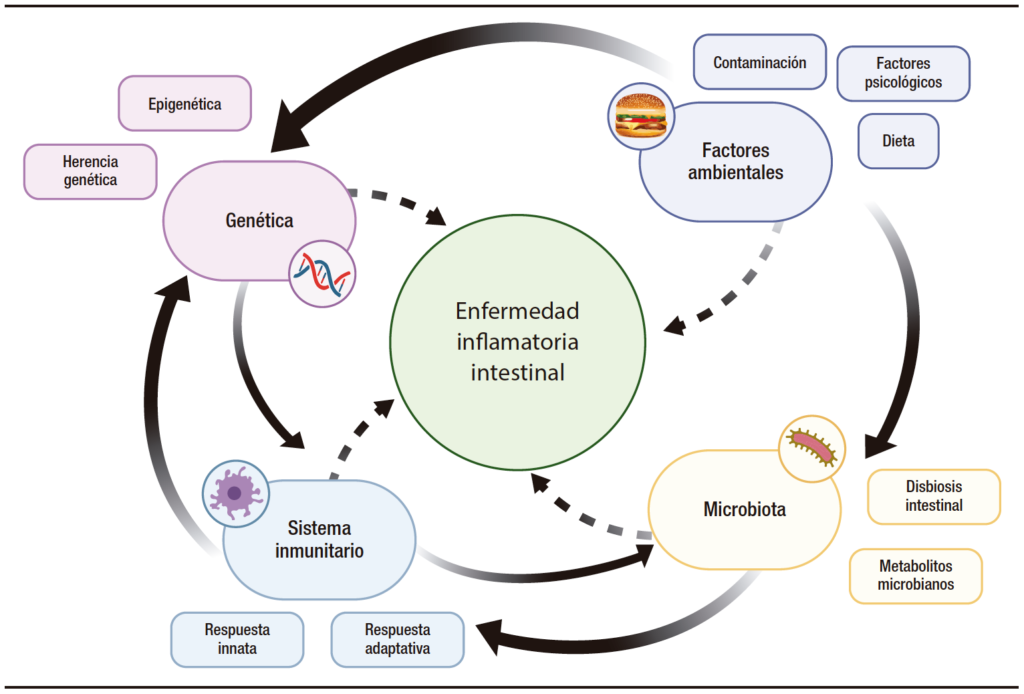
La etiopatogenia es compleja y multifactorial, y en ella participan cuatro pilares principales: el sistema inmunológico alterado, la susceptibilidad genética del huésped, la microbiota intestinal y los factores ambientales.4 En la Figura 1 se representa la etiopatogenia de la EII. A pesar de los importantes avances logrados en los últimos años en esos campos, todavía existe mucha controversia y desconocimiento de los determinantes y los predictores de la enfermedad.5 La inflamación del tracto gastrointestinal está mediada fundamentalmente por una respuesta inmune descontrolada, que provoca una alteración en las vías de señalización y síntesis de citoquinas pro y antiinflamatorias. De hecho, la mayoría de las terapias actuales de la EII (fármacos biológicos y moléculas pequeñas) consisten en el bloqueo de estas moléculas o sus mecanismos intermedios. Algunos ejemplos de ello son el infliximab, que es un anti-factor de necrosis tumoral α; el vedolizumab, cuya diana es la integrina α4β7 del tubo digestivo, impidiendo la migración linfocitaria hacia el tejido intestinal evitando la unión a MAdCAM-1 y reduciendo así la inflamación; el ustekinumab, que bloquea la acción de las proteínas proinflamatorias IL-12 e IL-23; y el tofacitinib en la CU que bloquea las proteínas JAK y sus vías de señalización. Están en desarrollo nuevas moléculas con mayor selectividad para estas vías de señalización (V565, filgotinib, upadacitinib, ozanimod, guselkumab, brakizumab, mirikizumab, risankizumab o etrolizumab, entre otros).
Figura 1. Etiopatogenia de la enfermedad inflamatoria intestinal
A pesar de que en la última década se ha producido una revolución en el arsenal terapéutico de la EII, entre un 10-40% de los pacientes no responden a la pauta de inducción de la remisión (lo que se conoce como no respuesta o fracaso primario) y, entre los pacientes respondedores, hasta un 30-40% perderá la respuesta durante el tratamiento de mantenimiento (no respuesta secundaria o fracaso secundario). Por tanto, a largo plazo, solamente un tercio de los pacientes acabará respondiendo a estos fármacos.6 Las causas clásicas de estos fallos primario y secundario al fármaco son: el fracaso farmacocinético (niveles bajos de fármaco en sangre sin presencia de anticuerpos anti-fármaco en sangre), el farmacodinámico (no se produce el efecto deseado del fármaco con niveles adecuados en sangre) y el inmunogénico (niveles bajos del fármaco en presencia de anticuerpos anti-fármaco).7, 8
Existen diferentes abordajes terapéuticos para la EII. Inicialmente se abogaba por una estrategia step-up basada en la escalada progresiva del tratamiento hacia fármacos en principio más eficaces, pero no exentos de efectos adversos. Posteriormente hubo una inclinación, especialmente en la EC, hacia la estrategia top-down, en la que se propuso un tratamiento precoz más ambicioso para lograr la remisión rápida de la enfermedad.9 El objetivo de esta estrategia es evitar complicaciones a largo plazo y mortalidad, previniendo la lesión intestinal permanente. De hecho, actualmente se aboga por seguir una estrategia “treat to target”, donde se proponen diferentes objetivos terapéuticos y plazos temporales para conseguirlos. La curación mucosa sería el objetivo principal y, como objetivos aún más ambiciosos, podría estar la curación histológica y la curación transmural en la EC. En todas estas estrategias, no obstante, estaríamos realizando un tratamiento que podríamos catalogar “de grupo” cuyas consecuencias podrían ser el sobretratamiento o el infratratamiento de un subgrupo de pacientes, en función de la estrategia seleccionada.
El arsenal terapéutico del que disponemos actualmente para la EII es extenso y, como ya se ha comentado previamente, se espera la aprobación de un gran número de nuevos fármacos biológicos y moléculas pequeñas en los próximos años. En general, el tratamiento de la EII se selecciona en función de la gravedad de los síntomas, las características de la enfermedad (subtipo, localización), las características del paciente (edad, comorbilidades) y los antecedentes de tratamientos previos. Podemos obtener todos estos datos de la clínica, analítica, los estudios de imagen y endoscópicos y los antecedentes del paciente. No obstante, conforme avanza el conocimiento de la fisiopatología de la EII, vamos obteniendo más datos (epidemiológicos, genéticos, moleculares y microbiológicos) que probablemente nos permitirán elegir el fármaco adecuado para cada paciente en cada momento.10 Los estudios patogénicos parecen indicar que las alteraciones inmunológicas podrían ser diferentes entre pacientes, e incluso ser secuenciales, según los tratamientos administrados. Por ello, para el futuro del manejo de las EII, un objetivo importante es el desarrollo de una medicina individualizada y personalizada, que pueda determinar qué alteración inmunológica prevalece en un individuo concreto, con el fin de seleccionar el tratamiento más adecuado.11
En este contexto aparece el concepto de Medicina de Precisión (MP) en la EII, con la finalidad de trasladar los avances en biología molecular a la práctica clínica.12 Aunque se trata de una estrategia de tratamiento que en nuestra especialidad se encuentra en sus fases iniciales, la realidad es que ya lleva establecida mucho tiempo en otras especialidades médicas, siendo la Oncología la más representativa.5 Debemos diferenciar la MP de la medicina personalizada, ya que son dos conceptos similares que pueden llegar a confundirse. En primer lugar, la medicina personalizada se refiere a los tratamientos dirigidos a pacientes individualmente, desde una perspectiva clínica, mientras que la MP identifica subgrupos de estratificación de riesgo mediante información biológica, molecular y de biomarcadores, que van más allá del individuo aislado.13
En la MP es fundamental una visión global e interconectada de todos los componentes de la enfermedad. El sufijo -oma (genoma, proteoma, microbioma) hace referencia a todos los constituyentes que son considerados colectivamente, mientras que el sufijo -omica (genómica, proteómica, microbiomica) se refiere al estudio en profundidad de estos constituyentes considerados en conjunto, para comprender la función de los componentes combinados en un proceso biológico.14, 15 La interacción de los diferentes -omas entre sí es de utilidad para comprender por qué una persona está sana y otra desarrolla una enfermedad, o por qué un paciente responde adecuadamente a un tratamiento y otro no. El concepto de interactoma define una red biológica en la que múltiples -omas interactúan para alcanzar un resultado biológico particular.16 Este interactoma se encuentra en homeostasis en las personas sanas, pero los pacientes con enfermedades como la EII, pueden tener -omas dominantes que desarrollen o mantengan la enfermedad.17
Actualmente disponemos de predictores subóptimos del curso de la enfermedad. Los biomarcadores pronósticos ideales serían los que pueden ser evaluados al diagnóstico o lo más cerca posible del mismo para maximizar la ventana de oportunidad que existe precozmente en esta enfermedad, antes de que acontezca un daño intestinal relevante. Al contrario, el valor pronóstico de los biomarcadores disminuye cuanto más se aleja del momento del diagnóstico, como por ejemplo en la EC, donde la inflamación sostenida ya ha podido causar daños irreversibles.5 A continuación describiremos los predictores del curso de la enfermedad y de la respuesta al tratamiento de los que disponemos actualmente.
1. Predictores clínicos
Respecto a los predictores clínicos del curso de la enfermedad, dentro de los más utilizados en la práctica clínica actual, se encuentra el tabaquismo. Es el más conocido y ampliamente estudiado, en el que se ha visto una clara relación con el empeoramiento del curso clínico de la EC. Sin embargo, en el curso de la CU parece que podría aliviar la sintomatología. De hecho, es habitual encontrarnos un primer brote o una recaída de la enfermedad tras el cese del hábito tabáquico en pacientes con CU.18
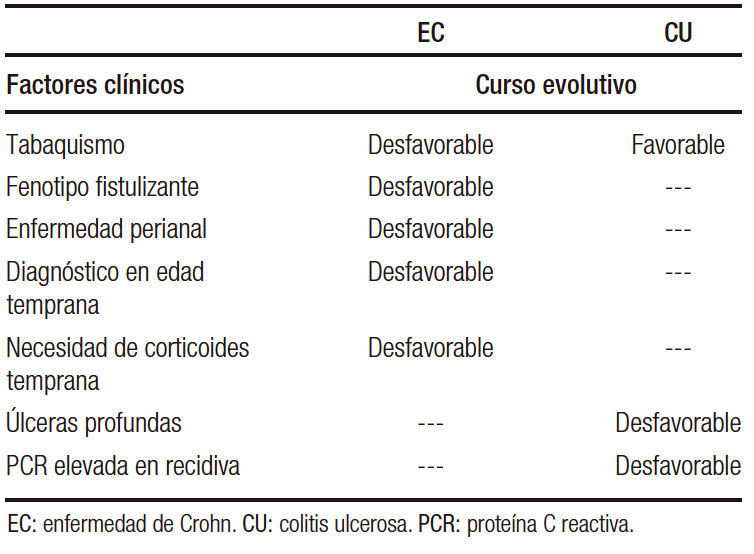
En la EC, la enfermedad perianal, el fenotipo fistulizante/estenosante,19 el diagnóstico temprano, la afectación alta y la necesidad de corticoides también son predictores de mal pronóstico.20, 21 En la CU destacan como predictores clínicos las ulceraciones profundas en la endoscopia y herramientas predictivas clásicas como el Índice de True-love Witt’s.22, 23 El Índice de Oxford evalúa la proteína C reactiva (PCR) y el número de deposiciones sanguinolentas al tercer día para decidir iniciar un tratamiento de rescate en un brote grave de CU.24 Los principales factores clínicos predictores del curso evolutivo se expresan en la Tabla 1.
Tabla 1. Factores clínicos predictores en enfermedad inflamatoria intestinal
Respecto a los predictores clínicos de respuesta al tratamiento, en todos los fármacos biológicos, aunque particularmente con vedolizumab, se ha demostrado mayor respuesta al anti-TNF en el paciente naive.25 De hecho, se ha desarrollado un modelo tanto en EC como en CU para predecir la remisión libre de corticoides con vedolizumab basado en la ausencia de exposición previa a un fármaco anti-TNF, la albúmina basal y otras características específicas de cada subtipo de EII, validado posteriormente con adecuada capacidad predictiva y pronóstica.26 Además, en EC se han identificado predictores de respuesta al tratamiento con ustekinumab, como por ejemplo no presentar ninguna cirugía previa y un fenotipo de la enfermedad no complicada (características, no obstante, que reflejan un curso más agresivo de la enfermedad).27
Estos predictores no sirven para seleccionar subgrupos de tratamiento ni para guiar las decisiones terapéuticas, ya que en realidad se trata de asociaciones débiles entre el factor de riesgo y un curso evolutivo desfavorable, más que de verdaderos factores predictivos. Por tanto, no existen modelos predictivos validados de estratificación de riesgo en EII.28
2. Predictores genéticos
La genética está implicada en la susceptibilidad para desarrollar una EII, pero también puede influir en el fenotipo de la enfermedad, en el curso clínico y en la respuesta al tratamiento.5, 29 El peso de la genética es mucho mayor en la EC que en la CU.30
En las últimas décadas, debido en gran parte al desarrollo de análisis y secuenciación pangenómicos que han permitido el diseño de estudios de asociación del genoma completo, genoma-wide association studies (GWAS), se han identificado numerosos single nucleotie polymorphisms (SNPs) implicados en la EII.31, 32 Así, las mutaciones de la oligomerización por unión de nucleótidos que contienen la proteína 2, nucleotide-binding oligomerization domain containing protein 2 (NOD2) o dominio reclutador de caspasa 15 (CARD15), se han relacionado con una mayor susceptibilidad a padecer EC y a un peor pronóstico.33 Por su parte, también se han encontrado otros SNPs relacionados con la CU.34, 35
Todos estos hallazgos nos han ayudado a comprender mejor la participación etiopatogénica genética en la enfermedad. No obstante, aunque se pensaba que a más variantes de susceptibilidad o alelos de riesgo, más grave podría ser la enfermedad, no se han detectado resultados satisfactorios en los estudios realizados.36 Por tanto, la experiencia preliminar con predictores genéticos en EII no ha sido la deseada.
Es en la farmacogenética donde la genética ha podido asentarse como herramienta predictiva en la EII. Respecto a los predictores genéticos de respuesta al tratamiento, ya es habitual en la práctica clínica que se analice el genotipo de la tiopurin metil transferasa (TMPT) o su actividad enzimática antes de iniciar un tratamiento con tiopurinas. El motivo de realizar este cribado pretratamiento es la mielosupresión grave que ocurre en 1 de cada 300 pacientes aproximadamente tratados con tiopurinas.37 Mientras un 90% de caucásicos presentan una actividad TMPT normal (forma salvaje homocigota), un 10% tienen una actividad intermedia (heterocigotos) y un 0,3% no presentan actividad enzimática. Es en este último grupo donde ocurre la mielosupresión grave con el tratamiento con tiopurinas. Sin embargo, dado que existe una fuerte correlación entre el genotipo de la TMPT y su fenotipo (la actividad enzimática), y que se han dado casos de mielosupresión grave en pacientes con forma salvaje homocigota y heterocigota, actualmente se prefiere medir la actividad enzimática en lugar de realizar el cribado genético.38 Aunque no se respalda el cribado genético o enzimático de la TMPT en las guías de práctica clínica de diferentes sociedades científicas (ECCO, AGA, CAG), la FDA sí recomienda realizarlo antes del inicio del tratamiento.39 Recientemente se ha encontrado otro SNP en el gen NUDT15 que se asocia a la mielosupresión inducida por tiopurina.40
Con respecto a los fármacos anti-TNF, los resultados del estudio PANTS8 demostraron que la variante HLA-DQA1*05, típica de la celiaquía, se asociaba a una mayor formación de anticuerpos anti-fármaco (inmunogenicidad). La determinación pretratamiento de la variante mencionada podría tener importantes implicancias para seleccionar un tratamiento concreto o proponer un tratamiento combinado con inmunosupresores para disminuir la inmunogenicidad, a cambio de un mayor riesgo de eventos adversos.
Otro estudio de farmacogenética identificó 3 SNPs en Fas ligando-843 C/T, Fas-670 G/A y caspasa9 93 C/T que influían en la respuesta a infliximab en la EC. Los 3 SNPs combinados con factores clínicos y bioquímicos formaron un modelo predictivo de respuesta baja, media o alta a infliximab en la primera infusión del fármaco.41
3. Factores ambientales
A pesar de la implicación de la genética en la EII, las variantes genéticas solamente contribuyen a explicar la heredabilidad de la EC y de la CU en un 26 y 19% respectivamente.42 Dentro de la ingente información sobre los mecanismos epidemiológicos, recientemente lo que ha conseguido centrar más el interés es la participación de la dieta. Determinados antígenos alimentarios específicos pueden provocar inflamación intestinal. Estudios recientes han demostrado que los cambios ambientales pueden modular la expresión génica a través de mecanismos epigenéticos.43, 44 Los principales predictores epigenéticos implicados en la EII son la metilación del DNA, la modificación de histonas y la acción de RNA reguladores. Todos estos factores están actualmente en constante proceso de revisión y merecerían un capítulo completo pese a la escasa aplicabilidad clínica actual.
4. Factores inmunologicos
Clásicamente, las citoquinas producidas por los linfocitos T helper tipo 1 (Th1) se relacionaban con la alteración inflamatoria en la EC mientras que las citoquinas producidas por los linfocitos T helper tipo 2 (Th2) se han relacionado más con la CU. Las IL-23, IL-21, IL-17 y los linfocitos T helper tipo 17 (Th17) juegan un papel esencial en la EII.45 Los linfocitos Th1 y Th17 crean citoquinas proinflamatorias que superan a las antiinflamatorias liberadas por los LT reguladores (Treg). Los niveles de IL-17, IL-21, IL-22 e IL-26 están hiperregulados en la mucosa intestinal de los pacientes con EC.46 Por otra parte, IL-12 e IL-23 se encuentran involucradas en la activación y diferenciación de células Natural Killer y linfocitos TCD4+. La invasión y reclutamiento de antígenos bacterianos anormales en las células epiteliales intestinales desencadena la estimulación de los linfocitos Th1 y Th17, que secretarán IL-12, IL-23, IL-6, y TNF-alfa, ocasionando daño inflamatorio crónico y disfunción de la barrera endotelial.
En cuanto a los predictores inmunológicos de la respuesta al tratamiento, existen diversas publicaciones que se han centrado en el estudio de las principales poblaciones linfocitarias y las interleuquinas más relacionadas con la EII, especialmente cómo aumentan o disminuyen sus concentraciones con el tratamiento seleccionado. La mayoría de las vías inflamatorias son inducidas por activación de las células T intestinales a través de mediadores inflamatorios. Se ha demostrado que los pacientes con buen pronóstico de la enfermedad presentan una disminución de los linfocitos TCD8+47 y en los pacientes con peores resultados y más recaídas los linfocitos TCD8+ aumentan.48 Hay estudios que han investigado la posibilidad de medir la IL-22 (reguladora de la cascada de señalización de la IL-23, y por tanto relacionada con la actividad de la enfermedad inflamatoria) como predictor de respuesta inmunológica, con resultados prometedores.49 En un estudio de pacientes con EC activa en tratamiento con ustekinumab, se evaluaron 25 citoquinas en las semanas 8, 16, 32 y 52 y se compararon los pacientes respondedores con los no respondedores al tratamiento.50 Solo la IL-17, principal citoquina de los linfocitos Th17, se asoció con la respuesta al tratamiento. No se realizaron análisis multivariados por no encontrar otras citoquinas implicadas.
Otro estudio que se realizó en 30 pacientes naive al anti-TNF, con EC activa, en los que se utilizó infliximab con pauta de inducción estándar (5 mg/kg a las 0, 2 y 6 semanas), se propuso determinar el valor predictivo de respuesta en un perfil de citoquinas. Se seleccionaron 15 citoquinas y se definió la respuesta al tratamiento como una caída de la calprotectina fecal (CF) desde la semana 0 hasta la semana 14, mediante valores comparados en escala logarítmica. Demostraron que los niveles de TNF-alfa disminuidos y los de IL-13 elevados se asociaron a una buena respuesta bioquímica en la semana 14, mientras que una IL-13 elevada y una IL-7 disminuida predijeron una adecuada respuesta tras el periodo de inducción. Finalmente, los niveles de oncostatina M y TNF-alfa aumentados predijeron una falta de respuesta primaria al fármaco.51
La IL-12 y el α inducen la diferenciación de linfocitos Th1 y el factor de crecimiento β, mientras que la IL-23 y otras citoquinas proinflamatorias (IL-1b e IL-6) son esenciales para la inducción de los linfocitos hacia la vía Th17. Un estudio que seleccionó prospectivamente pacientes que iniciaban un tratamiento biológico (ustekinumab, infliximab y adalimumab) y cuantificó el perfil de citoquinas antes del inicio y durante el tratamiento biológico objetivó como el ustekinumab actuaba principalmente suprimiendo la vía Th17 y que tras el uso de un anti-TNF aumentaban los linfocitos Treg.52 La importancia de la IL-23 en la patogénesis tanto de la EC como de la CU, así como en otras enfermedades autoinmunes, está fuera de toda duda. Terapias dirigidas a la subunidad p40 compartida en IL-12 e IL-23, como el ustekinumab, son útiles en la práctica clínica actual para la EII; recientes estudios de fase 2 respaldan el uso del bloqueo específico de p19 en EC y UC con fármacos más específicos como guselkumab o risankizumab. Es fundamental identificar a los pacientes que se beneficiarían de esta inhibición más selectiva de la vía de señalización mediante biomarcadores.53 Otro estudio demostró como la IL-8 y la MIP-1b disminuyeron en suero durante la inducción con infliximab, mientras que la IL-6 a las 8 semanas tras la inducción puede predecir la respuesta posterior al infliximab en la CU.54
Las citoquinas también se han utilizado para evaluar el riesgo de recurrencia en pacientes con EC intervenida. En un estudio en el que se intervinieron 61 pacientes con EC ileocecal, se analizaron las citoquinas y la CF antes y después de la intervención quirúrgica. La combinación de niveles de CF, IL-6 y e INF-γ a los 6 meses de la cirugía obtuvo un modelo predictivo con un área bajo la curva de 0,90 para predecir la recurrencia precoz.55
La proteína de unión a IL-22 disminuye con el tratamiento efectivo anti-TNF, excepto en el fracaso primario con el fármaco56 y, aunque no pueda ser un biomarcador predictivo al inicio del tratamiento, puede servir como marcador de eficiencia terapéutica. Por su parte, se ha asociado con ausencia de respuesta a anti-TNF y probablemente a tratamientos frente α4β7, en pacientes tanto con EC como con CU, a una vía de señalización específica del receptor colónico de IL-7.57 Ya existen ensayos clínicos que evalúan la terapia combinada de dos fármacos biológicos, como el ensayo que evalúa la terapia con guselkumab (anti IL-23) y golimumab (anti-TNF) en CU, que además de proporcionar datos útiles sobre la eficacia y seguridad de guselkumab, ampliará nuestro conocimiento sobre la eficacia y toxicidad de fármacos biológicos combinados, un campo nuevo y atractivo.58
También se han estudiado otros anticuerpos, como los anticuerpos anti-nucleares (ANA) o los anticuerpos citoplasmáticos perinucleares anti-neutrófilo (p-ANCA), como predictores de respuesta a fármacos. Una positividad de ANA pretratamiento con fármacos anti-TNF se asocia a mayor probabilidad de fracaso y a reacciones adversas al fármaco.59 Por su parte, los valores de p-ANCA negativos se asocian a una mayor respuesta a fármacos anti-TNF-alfa.60
Por otro lado, la oncostatina M, un miembro de la familia de las citoquinas inflamatorias de la IL-6, se ha asociado con mayor actividad de la enfermedad inflamatoria. El aumento del fracaso del tratamiento con anti-TNF se asocia con una mayor expresión de oncostatina M pretratamiento, convirtiéndola en un biomarcador potencial y objetivo terapéutico en EII.61 La utilización de nuevos biomarcadores predictivos como TREM-1 es prometedora, pero todavía está lejos su aplicación en la práctica clínica.
5. Predictores bioquímicos en suero y heces
Otros predictores del curso de la enfermedad muy utilizados actualmente son la PCR y la CF. Una elevación de la PCR se correlaciona con una mayor necesidad de cirugía e ingresos en pacientes con EC. Sin embargo, es un marcador de inflamación activa no sólo intestinal, sino general, por lo que no sería un biomarcador predictivo ideal para la EII.62
En este sentido, disponemos de la CF, marcador específico de inflamación intestinal que se ha asociado con la cicatrización mucosa y es útil tanto para valorar la actividad inflamatoria como para predecir la recaída y la respuesta al tratamiento. En la CU valores menores de 50 μg/g predijeron la respuesta endoscópica en la semana 10 en pacientes tratados con infliximab,63 mientras que, en EC, el estudio POCER informó que una concentración de más de 100 μg/g se asociaba con la recurrencia endoscópica (Rutgeerts score ≥ i2).64 Sin embargo, todavía existen pocos estudios publicados sobre su papel en la predicción del curso de la enfermedad y es un biomarcador con mucha variabilidad entre cohortes e incluso en el mismo paciente.
La albúmina sérica se relaciona con la farmacocinética de los fármacos anti-TNF. Niveles más bajos de albúmina se correlacionan con un aclaramiento más rápido del fármaco y, por tanto, peores resultados clínicos. Una concentración baja de albúmina en suero se ha asociado con el riesgo de colectomía en CU,65 mientras que los niveles más altos de albumina sérica en pacientes con CU se relacionan con una respuesta más alta a fármacos anti-TNF. Esta asociación no se ha encontrado en pacientes con EC.28
Se necesitan más estudios para evaluar el potencial de marcadores bioquímicos fecales para predecir respuesta y remisión en la EII.
6. Predictores microbiológicos
La EII se relaciona con alteraciones cualitativas y cuantitativas del microbiota intestinal. La composición de la microbiota es menos diversa y rica en pacientes con EII y se vuelve más variada en pacientes en remisión.66 Es característica una reducción de la proporción de Firmicutes y el incremento de la proporción de Proteobacteria y Actinobacteria.67 Sin embargo, más allá de los cambios puntuales en algunas especies, lo que realmente es importante en la fisiopatogenia de la EII es la disbiosis, un desbalance en toda la población microbiana intestinal. Algunos de los predictores del microbioma del curso de la enfermedad más estudiados son los anticuerpos circulantes contra antígenos bacterianos (anti-L2, anti-ompC, ASCA, pANCA, flagelina anti-CBir1), que se han relacionado con fenotipos más complejos y mayor necesidad de cirugía.68, 69 No obstante, no queda claro si están presentes como causa o como efecto de una enfermedad más grave, dado que su seropositividad aumenta con la duración de la enfermedad;70 no son útiles entonces para guiar el tratamiento en la EC.70 Tampoco queda claro si es una relación causal (la disbiosis causa inflamación) o mera consecuencia o epifenómeno (la inflamación provoca disbiosis).
Por otra parte, se están estudiando como posibles predictores de respuesta al tratamiento con anti-TNF las concentraciones de butirato, un ácido grado de cadena corta, con resultados prometedores.5 Se ha demostrado un incremento en el número de pacientes en remisión, lo cual es consistente con el aumento de bacterias productoras de ácidos grasos de cadena corta. No obstante, estos hallazgos podrían únicamente reflejar una menor carga inflamatoria, por lo que debemos ser cautelosos en la interpretación de estos resultados.5
7. Niveles del fármaco y anticuerpos
Actualmente el mejor predictor de respuesta a un tratamiento para la EII, ya sea un fármaco inmunosupresor, biológico o una molécula pequeña, se basa en confirmar la adecuada exposición al fármaco empleado, es lo que llamamos monitorización de niveles de fármacos o Therapeutic Drug Monitorization (TDM). Medir los niveles del fármaco nos permite minimizar la toxicidad y maximizar la eficacia.71 Actualmente la formación de anticuerpos anti-fármaco biológico se puede medir mediante 3 técnicas: ensayo por inmunoabsorción ligado a enzimas, Enzyme-Linked ImmunoSorbent Assay (ELISA), cromatografía líquida de alta presión basada en el ensayo de cambio de movilidad homogénea y radioinmunoensayo (RIE).
Aunque con los fármacos biológicos tenemos más datos del uso de niveles para guiar el tratamiento, se han publicado trabajos sobre la medición de la 6-tioguanina (6-TG), un metabolito de la 6-MP, para guiar el tratamiento con inmunosupresores tiopurínicos. Dubinsky col.72 demostró que las concentraciones del metabolito 6-TG > 235 pmol/108 glóbulos rojos, respondían con mayor probabilidad al tratamiento que aquellos pacientes con concentraciones bajas del metabolito. Sin embargo, se necesitan más estudios para justificar el uso de la concentración de 6-TG para monitorizar la dosis de las tiopurinas.
El estudio PANTS demostró que el único factor que se asoció en forma independiente con la falta de respuesta primaria a la terapia anti-TNFα fue una baja concentración del fármaco en la semana 14.8 Aun así, estos niveles los tenemos una vez que el tratamiento ya se ha iniciado, y además se ha demostrado que la monitorización y optimización prospectiva de la dosis de infliximab en pacientes con EC no mejoraba los resultados clínicos.73 En el estudio SONIC (2010), se demostró claramente que la combinación del fármaco biológico con un inmunosupresor aumentaba los niveles del fármaco en sangre y disminuía los anticuerpos anti-fármaco biológico.74
La TDM y la medición de anticuerpos anti-fármaco nos ayudarán a decidir la actitud a implementar ante una pérdida de respuesta secundaria al fármaco biológico.75 Los análisis de costo utilidad demostraron que el uso de la TDM es costo-efectiva.76
8. Monitorización basada en el paciente en la EII
Finalmente, la gran revolución tecnológica de los últimos años, el aumento de la asistencia sanitaria con un incremento de la incidencia de la EII, la mayor carga laboral y los cambios en la relación médico-paciente hacia la implicación activa del enfermo en la toma de decisiones sobre su propia salud, han promovido el desarrollo de diferentes herramientas que permitan adaptarnos a las expectativas y la demanda sanitaria actual. Algunos ejemplos de ello son la telemedicina y las herramientas de cribado de actividad inflamatoria domiciliario, así como la mayor información para los pacientes disponible en páginas web y congresos de diferentes sociedades científicas.
Así, otro enfoque de la medicina personalizada sería darle más peso al paciente a la hora de realizar el seguimiento activo de su enfermedad. Se han realizado estudios que han demostrado la seguridad y efectividad de esta estrategia de automanejo.77
Conclusiones
La explosión de nuevos tratamientos biológicos y moléculas pequeñas para la EII que se ha iniciado en los últimos años y se consolidará en la próxima década, ha impulsado la necesidad de predecir que tratamiento seleccionar para cada paciente individualmente. Necesitamos herramientas predictivas que se puedan emplear antes de iniciar el tratamiento, para utilizar el que tiene mejor capacidad de funcionar en cada subgrupo de pacientes. La mejora de la predicción en la EII es una de las mayores necesidades no cubiertas en el manejo y en el campo de investigación de esta enfermedad.10
Los biomarcadores han sido reconocidos como un apoyo fundamental para predecir la respuesta terapéutica y mejorar su eficacia y seguridad. A través de la enorme cantidad de datos -omicos integrados colectivamente se han identificado múltiples biomarcadores posibles. La respuesta terapéutica está influenciada habitualmente por factores ambientales e intrínsecos del paciente, y la incorporación de estos marcadores podría ayudar a construir un modelo predictivo de confianza. Sin embargo, todavía no disponemos de biomarcadores pronósticos y predictivos con una alta sensibilidad y especificidad para los tratamientos biológicos y moléculas pequeñas en la EII.
Propiedad intelectual. Los autores declaran que los datos, la figura y la tabla presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Mínguez A, Nos P. Medicina de precisión en la enfermedad inflamatoria intestinal. Acta Gastroenterol Latinoam. 2022;52(3):334-343. https://doi.org/10.52787/agl.v52i3.245
Referencias
- Gomollón F, Dignass A, Annese V, Tilg H, Van Assche G, Lindsay JO, et al. ECCO. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management. J Crohns Colitis. 2017 Jan;11(1): 3-25.
- Magro F, Gionchetti P, Eliakim R, Ardizzone S, Armuzzi A, Barreiro-de Acosta M, et al. European Crohn’s and Colitis Organisation [ECCO]. Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra-intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo-anal Pouch Disorders. J Crohns Colitis. 2017 Jun 1;11(6):649-670.
- Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology. 2011 May;140(6):1785-94.
- de Souza HSP, Fiocchi C, Iliopoulos D. The IBD interactome: an integrated view of aetiology, pathogenesis and therapy. Nat Rev Gastroenterol Hepatol. 2017 Dec;14(12):739-749.
- Noor NM, Verstockt B, Parkes M, Lee JC. Personalised medicine in Crohn’s disease. Lancet Gastroenterol Hepatol. 2020 Jan;5(1):80-92.
- Ding NS, Hart A, De Cruz P. Systematic review: predicting and optimising response to anti-TNF therapy in Crohn’s disease – algorithm for practical management. Aliment Pharmacol Ther. 2016 Jan;43(1):30-51.
- Fine S, Papamichael K, Cheifetz AS. Etiology and management of lack or loss of response to anti-tumor necrosis factor therapy in patients with inflammatory bowel disease. Gastroenterol Hepatol (N Y). 2019 Dec;15(12):656-665.
- Kennedy NA, Heap GA, Green HD, Hamilton B, Bewshea C, Walker GJ, et al. Predictors of anti-TNF treatment failure in anti-TNF-naive patients with active luminal Crohn’s disease: a prospective, multicentre, cohort study. Lancet Gastroenterol Hepatol. 2019 May;4(5):341-353.
- D’Haens G, Baert F, van Assche G, Caenepeel P, Vergauwe P, Tuynman H, et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn’s disease: an open randomised trial. Lancet. 2008 Feb 23;371(9613):660-667.
- Carpio D. Farmacología de la enfermedad inflamatoria intestinal. En: Gomollon F, Hinojosa J, Gassull MA. Enfermedad inflamatoria intestinal. IV Edición. GETECCU
- Flamant M, Roblin X. Inflammatory bowel disease: towards a personalized medicine. Therap Adv Gastroenterol. 2018 Jan 10;11:1756283X17745029.
- National Research Council (US) Committee on A Framework for Developing a New Taxonomy of Disease. Toward Precision Medicine: Building a Knowledge Network for Biomedical Research and a New Taxonomy of Disease. Washington (DC): National Academies Press (US); 2011.
- Schleidgen S, Klingler C, Bertram T, Rogowski WH, Marckmann G. What is personalized medicine: sharpening a vague term based on a systematic literature review. BMC Med Ethics 2013;14:55.
- Winkler H. Verbreitung und Ursache der Parthenogenesis im Pflanzenund Tierreiche [Distribution and cause of parthenogenesis in plants animal kingdoms]. Jena, Germany: Verlag Von Gustav Fischer; 1920
- Pe ina-Šlaus N, Pe ina M. Only one health, and so many omics. Cancer Cell Int 2015;15:64.
- Vidal M, Cusick ME, Barabási AL. Interactome networks and human disease. Cell. 2011 Mar 18;144(6):986-98.
- Lloyd-Price J, Arze C, Ananthakrishnan AN, et al.; IBDMDB Investigators. Multi-omics of the gut microbial ecosystem in inflammatory bowel diseases. Nature 2019;569:655-62.
- Rozich JJ, Holmer A, Singh S. Effect of Lifestyle Factors on Outcomes in Patients With Inflammatory Bowel Diseases. Am J Gastroenterol. 2020 Jun;115(6):832-840.
- Pittet V, Rogler G, Michetti P, Fournier N, Vader JP, Schoepfer A, et al. Penetrating or stricturing diseases are the major determinants of time to first and repeat resection surgery in Crohn’s disease. Digestion. 2013;87(3):212-21.
- Beaugerie L, Seksik P, Nion-Larmurier I, Gendre JP, Cosnes J. Predictors of Crohn’s disease. Gastroenterology. 2006 Mar; 130(3):650-6.
- Torres J, Caprioli F, Katsanos KH, Lobatón T, Micic D, Zerôncio M, et al. Predicting Outcomes to Optimize Disease Management in Inflammatory Bowel Diseases. J Crohns Colitis. 2016 Dec;10(12):1385-1394.
- Meyers S, Lerer PK, Feuer EJ, Johnson JW, Janowitz HD. Predicting the outcome of corticoid therapy for acute ulcerative colitis. Results of a prospective, randomized, double-blind clinical trial. J Clin Gastroenterol. 1987 Feb;9(1):50-4.
- Kumar S, Ghoshal UC, Aggarwal R, Saraswat VA, Choudhuri G. Severe ulcerative colitis: prospective study of parameters determining outcome. J Gastroenterol Hepatol. 2004 Nov;19(11):1247-52.
- Travis SP, Farrant JM, Ricketts C, Nolan DJ, Mortensen NM, Kettlewell MG, et al. Predicting outcome in severe ulcerative colitis. Gut. 1996 Jun;38(6):905-10.
- Feagan BG, Rubin DT, Danese S, Vermeire S, Abhyankar B, Sankoh S, et al. Efficacy of Vedolizumab Induction and Maintenance Therapy in Patients With Ulcerative Colitis, Regardless of Prior Exposure to Tumor Necrosis Factor Antagonists. Clin Gastroenterol Hepatol. 2017 Feb;15(2):229-239.e5.
- Dulai PS, Singh S, Casteele NV, Meserve J, Winters A, Chablaney S, et al. Development and validation of clinical scoring tool to predict outcomes of treatment with vedolizumab in patients with ulcerative colitis. Clin Gastroenterol Hepatol. 2020 Dec;18(13):2952-2961.e8.
- Barré A, Colombel JF, Ungaro R. Review article: predictors of response to vedolizumab and ustekinumab in inflammatory bowel disease. Aliment Pharmacol Ther 2018;47:896-905.
- Gisbert JP, Chaparro M. Predictors of primary response to biologic treatment [Anti-TNF, Vedolizumab, and Ustekinumab] in patients with inflammatory bowel disease: from basic science to clinical practice. Crohns Colitis 2020;14:694-709
- Borg-Bartolo SP, Boyapati RK, Satsangi J, Kalla R. Precision medicine in inflammatory bowel disease: concept, progress and challenges. F1000Res 2020;9.
- Tysk C, Lindberg E, Jarnerot G, Floderus-Myrhed B. Ulcerative colitis and Crohn’s disease in an unselected population of monozygotic and dizygotic twins. A study of heritability and the influence of smoking. Gut 1988 29:990-996
- Jostins L, Ripke S, Weersma RK, Duerr RH, McGovern DP, Hui KY, et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 2012 Nov 1;491(7422):119-24.
- Zhang YZ, Li YY. Inflammatory bowel disease: pathogenesis. World J Gastroenterol 2014;20:91-99.
- Nasir BF, Griffiths L, Nasir A, Roberts R, Barclay M, Gearry R, et al. Perianal disease combined with NOD2 genotype predicts need for IBD-related surgery in Crohn’s disease patients from a population-based cohort. J Clin Gastroenterol. 2013 Mar;47(3):242-5.
- Yang SK, Hong M, Zhao W, Jung Y, Tayebi N, Ye BD, et al. Genome-wide association study of ulcerative colitis in Koreans suggests extensive overlapping of genetic susceptibility with Caucasians. Inflamm Bowel Dis 2013,19:954
- Juyal G, Negi S, Sood A, Gupta A, Prasad P, Senapati S, et al. Genome-wide association scan in north Indians reveals three novel HLA-independent risk loci for ulcerative colitis. Gut 2015. 64:571-579.
- Weersma RK, Stokkers PC, van Bodegraven AA, van Hogezand RA, Verspaget HW, de Jong DJ, et al. Molecular prediction of disease risk and severity in a large Dutch Crohn’s disease cohort. Gut. 2009 Mar;58(3):388-95.
- McLeod HL, Siva C. The thiopurine S-methyltransferase gene locus – implications for clinical pharmacogenomics. Pharmacogenomics. 2002 Jan;3(1):89-98.
- Donnan JR, Ungar WJ, Mathews M, Rahman P. Systematic review of thiopurine methyltransferase genotype and enzymatic testing strategies. Ther Drug Monit. 2011 Apr;33(2):192-9.
- Booth RA, Ansari MT, Loit E, Tricco AC, Weeks L, Doucette S, et al. Assessment of thiopurine S-methyltransferase activity in patients prescribed thiopurines: a systematic review. Ann Intern Med. 2011 Jun 21;154(12):814-23, W-295-8.
- Yang SK, Hong M, Baek J, Choi H, Zhao W, Jung Y, et al. A common missense variant in NUDT15 confers susceptibility to thiopurine-induced leukopenia. Nat Genet. 2014 Sep;46(9):1017-20.
- Hlavaty T, Ferrante M, Henckaerts L, Pierik M, Rutgeerts P, Vermeire S. Predictive model for the outcome of infliximab therapy in Crohn’s disease based on apoptotic pharmacogenetic index and clinical predictors. Inflamm Bowel Dis 2007.13:372-379
- Cowen L, Ideker T, Raphael BJ, Sharan R. Network propagation: a universal amplifier of genetic associations. Nat Rev Genet. 2017 Sep;18(9):551-562.
- Sedivy JM, Banumathy G, Adamsal PD. Aging by epigenetics – a consequence of chromatin damage? Exp Cell Res. 2008;314:1909-17.
- Bird A. Perceptions of epigenetics. Nature. 2007 May 24; 447(7143):396-8.
- Dige A, Støy S, Rasmussen TK, Kelsen J, Hvas CL, Sandahl TD, et al. Increased levels of circulating Th17 cells in quiescent versus active Crohn’s disease. J Crohns Colitis. 2013 Apr;7(3):248-55.
- Bogaert S, Laukens D, Peeters H, Melis L, Olievier K, Boon N, et al. Differential mucosal expression of Th17-related genes between the inflamed colon and ileum of patients with inflammatory bowel disease. BMC Immunol. 2010 Dec 13;11:61
- McKinney EF, Lee JC, Jayne DRW, Lyons PA, Smith KGC. T-cell exhaustion, co-stimulation and clinical outcome in autoimmunity and infection. Nature 2015; 523: 612-16.
- Allez M, Auzolle C, Ngollo M, Bottois H, Chardiny V, Corraliza AM, et al. T cell clonal expansions in ileal Crohn’s disease are associated with smoking behaviour and postoperative recurrence. Gut. 2019 Nov;68(11):1961-1970.
- Sands BE, Chen J, Feagan BG, Penney M, Rees WA, Danese S, et al. Efficacy and Safety of MEDI2070, an Antibody Against Interleukin 23, in Patients With Moderate to Severe Crohn’s Disease: A Phase 2a Study. Gastroenterology. 2017 Jul;153(1):77-86.e6.
- Schulte L, Beck A, Hofelich J, Reuther HS, Klaus J. Real-Life Ustekinumab Response and Blood Cytokine Profiles in Patients with Crohn’s Disease. Am J Gastroenterol Hepatol. 2020;1(1):1006.
- Mateos B, Sáez-González E, Moret I, Hervás D, Iborra M, Cerrillo E, et al. Plasma Oncostatin M, TNF-α, IL-7, and IL-13 Network Predicts Crohn’s Disease Response to Infliximab, as Assessed by Calprotectin Log Drop. Dig Dis. 2021;39(1):1-9.
- Ihara Y, Torisu T, Miyawaki K, Umeno J, Kawasaki K, Hirano A, et al. Ustekinumab Improves Active Crohn’s Disease by Suppressing the T Helper 17 Pathway. Digestion. 2021;102(6):946-955.
- Sewell GW, Kaser A. Interleukin-23 in the Pathogenesis of Inflammatory Bowel Disease and Implications for Therapeutic Intervention. J Crohns Colitis. 2022 May 11;16 (Supplement_2):ii3-ii19.
- Sato S, Chiba T, Nakamura S, Matsumoto T. Changes in cytokine profile may predict therapeutic efficacy of infliximab in patients with ulcerative colitis. J Gastroenterol Hepatol. 2015 Oct;30(10):1467-72.
- Cerrillo E, Moret I, Iborra M, Pamies J, Hervás D, Tortosa L, et al. A Nomogram Combining Fecal Calprotectin Levels and Plasma Cytokine Profiles for Individual Prediction of Postoperative Crohn’s Disease Recurrence. Inflamm Bowel Dis. 2019 Sep 18;25(10):1681-1691
- Pelczar P, Witkowski M, Perez LG, Kempski J, Hammel AG, Brockmann L, et al. A pathogenic role for T cell-derived IL-22BP in inflammatory bowel disease. Science 2016; 354:358-362.
- Belarif L, Danger R, Kermarrec L, Nerrière-Daguin V, Pengam S, Durand T, et al. IL-7 receptor influences anti-TNF responsiveness and T cell gut homing in inflammatory bowel disease. J Clin Invest 2019:129:1910-1925
- Parigi TL, Iacucci M, Ghosh S. Blockade of IL-23: What is in the Pipeline? J Crohns Colitis. 2022 May 11;16 (Supplement_2):ii64-ii72.
- Santos-Antunes J, Nunes AC, Lopes S, Macedo G. The relevance of vitamin D and antinuclear antibodies in patients with inflammatory bowel disease under anti-TNF treatment: a prospective study. Inflamm Bowel Dis 2016; 22:1101-1106
- Nguyen DL, Nguyen ET, Bechtold ML. pANCA positivity predicts lower clinical response to infliximab therapy among patients with IBD. South Med J 2015;108:139-143.
- Verstockt S, Verstockt B, Vermeire S. Oncostatin M as a new diagnostic, prognostic and therapeutic target in inflammatory bowel disease (IBD). Expert Opin Ther Targets 2019;23:943-954.
- Choi CH, Song ID, Kim YH, Koo JS, Kim YS, Kim JS, et al. Efficacy and safety of infliximab therapy and predictors of response in korean patients with Crohn’s disease: a nationwide, multicenter study. Yonsei Med J 2016;57:1376-1385.
- De Vos M, Louis EJ, Jahnsen J, Vandervoort JG, Noman M, Dewit O, et al. Consecutive fecal calprotectin measurements to predict relapse in patients with ulcerative colitis receiving infliximab maintenance therapy. Inflamm Bowel Dis. 2013 Sep;19 (10):2111-7.
- Wright EK, Kamm MA, De Cruz P, Hamilton AL, Ritchie KJ, Krejany EO, et al. Measurement of fecal calprotectin improves monitoring and detection of recurrence of Crohn’s disease after surgery. Gastroenterology. 2015 May;148(5):938-947.e1.
- Ho GT, Mowat C, Goddard CJ, Fennell JM, Shah NB, Prescott RJ, et al. Predicting the outcome of severe ulcerative colitis: development of a novel risk score to aid early selection of patients for second-line medical therapy or surgery. Aliment Pharmacol Ther. 2004 May 15;19(10):1079-87.
- Kolho KL, Korpela K, Jaakkola T, Pichai MV, Zoetendal EG, Salonen A, et al. Fecal Microbiota in Pediatric Inflammatory Bowel Disease and Its Relation to Inflammation. Am J Gastroenterol. 2015 Jun;110(6):921-30.
- Kostic AD, Xavier RJ, Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead. Gastroenterology 2014;146:1489-99.
- Choung RS, Princen F, Stockfisch TP, Torres J, Maue AC, Porter CK, et al. Serologic microbial associated markers can predict Crohn’s disease behaviour years before disease diagnosis. Aliment Pharmacol Ther. 2016 Jun;43(12):1300-10.
- Zhang Z, Li C, Zhao X, Lv C, He Q, Lei S, et al. Anti-Saccharomyces cerevisiae antibodies associate with phenotypes and higher risk for surgery in Crohn’s disease: a meta-analysis. Dig Dis Sci. 2012 Nov;57(11):2944-54.
- Maaser C, Sturm A, Vavricka SR, Kucharzik T, Fiorino G, Annese V, et al. ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 1: Initial diagnosis, monitoring of known IBD
detection of complications. J Crohns Colitis. 2019 Feb 1;13 (2):144-164. - Mosli MH, Sandborn WJ, Kim RB, Khanna R, Al-Judaibi B, Feagan BG. Toward a personalized medicine approach to the management of inflammatory bowel disease. Am J Gastroenterol. 2014 Jul;109(7):994-1004.
- Dubinsky MC, Lamothe S, Yang HY, Targan SR, Sinnett D, Théorêt Y, et al. Pharmacogenomics and metabolite measurement for 6-mercaptopurine therapy in inflammatory bowel disease. Gastroenterology. 2000 Apr;118(4):705-13.
- Fiocchi C. Inflammatory bowel disease: complexity and variability need integration. Front Med 2018;5:75.
- Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med. 2010 Apr 15;362(15):1383-95.
- Guerra I, Chaparro M, Bermejo F, Gisbert JP. Utility of measuring serum concentrations of anti-TNF agents and anti-drug antibodies in inflammatory bowel disease. Curr Drug Metab. 2011 Jul;12(6):594-8.
- Velayos FS, Kahn JG, Sandborn WJ, Feagan BG. A test-based strategy is more cost effective than empiric dose escalation for patients with Crohn’s disease who lose responsiveness to infliximab. Clin Gastroenterol Hepatol. 2013 Jun;11(6):654-66.
- Pedersen N, Elkjaer M, Duricova D, Burisch J, Dobrzanski C, Andersen NN, et al. eHealth: individualisation of infliximab treatment and disease course via a self-managed web-based solution in Crohn’s disease. Aliment Pharmacol Ther. 2012 Nov;36(9):840-9.
Correspondencia: Alejandro Mínguez Sabater
Correo electrónico: alejandromsab11@gmail.com
Acta Gastroenterol Latinoam 2022;52(3):334-343
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE