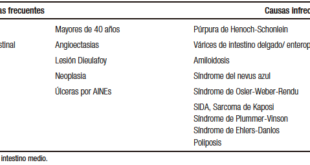
Diego Haberman1 ID· Sandra Basso2 ID· Mariano Volpacchio1 ID· Analía Gubitosi2 ID· María Cristina Nazar2 ID· Paola Visbal1 ID· María Florencia Ranero1 ID
1 Diagnóstico por Imágenes. Centro Rossi.
2 Sección páncreas. Hospital de Gastroenterología Carlos B. Udaondo.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2024;54(1):14-30
Recibido: 08/01/2024 / Aceptado: 01/03/2024 / Publicado online el 25/03/2024 / https://doi.org/10.52787/agl.v54i1.392
Resumen
La pancreatitis autoinmune es una forma específica de pancreatitis recurrente y crónica, en cuya etiopatogenia participan mecanismos inmunológicos. Históricamente se han descripto dos variedades de la enfermedad, cada una de ellas con particularidades clínicas, bioquímicas e histológicas. En forma reciente fue descripto un tercer subtipo, que es consecuencia de efectos adversos relacionados con el tratamiento con inmunoterapia, la cual tiene indicación creciente en diversos tumores. El diagnóstico de la enfermedad es un desafío para los profesionales, entre otros motivos debido a su presentación clínica heterogénea, que incluye la ictericia obstructiva en la pancreatitis autoinmune tipo 1 y el dolor abdominal en el tipo 2, pudiendo simular patologías más graves, como es el adenocarcinoma ductal del páncreas. Los biomarcadores séricos (IgG4) cumplen un papel relevante en el diagnóstico, pero en ocasiones pueden tener valores normales, en particular en la pancreatitis autoinmune tipo 2, o estar elevados en otras patologías. Los métodos de estudio por imágenes no invasivos, en particular la colangio-pancreatografia por resonancia magnética con contraste intravenoso, tienen un rol central en el proceso diagnóstico de esta enfermedad. En el presente artículo revisaremos los aspectos imagenológicos de la pancreatitis autoinmune y las manifestaciones extra-pancreáticas de la enfermedad sistémica por IgG4, los rasgos que la diferencian con el cáncer de páncreas y los criterios radiológicos de respuesta al tratamiento con corticoides.
Palabras claves. Pancreatitis autoinmune, pancreatitis autoinmune tipo 1, pancreatitis autoinmune tipo 2, pancreatitis autoinmune tipo 3, resonancia magnética, hallazgos por rasgos imagenológicos típicos y atípicos.
Role of Imaging in Autoimmune Pancreatitis
Summary
Autoimmune pancreatitis is a specific form of chronic recurrent pancreatitis whose etiopathogenesis involves immunological mechanisms. Historically, two varieties of the disease have been described, each with clinical, biochemical and histological particularities. Recently, a third subtype has been described as a consequence of the adverse effects associated with immunotherapy, which is increasingly indicated for several tumors. The diagnosis of autoimmune pancreatitis is a challenge for professionals, in part because of its heterogeneous clinical presentation, which includes obstructive jaundice in type 1 autoimmune pancreatitis and abdominal pain in type 2, and can mimic more serious pathologies such as pancreatic ductal adenocarcinoma. Serum biomarkers (IgG4) play an important role in the diagnosis, but they can sometimes be normal, especially in type 2 autoimmune pancreatitis, or be elevated in other pathologies. Non-invasive imaging techniques, in particular magnetic resonance cholangiopancreatography with intravenous contrast, play a central role in the diagnostic process of the disease. In this article, we review the imaging aspects of autoimmune pancreatitis and the extrapancreatic manifestations of systemic IgG4 disease, the features that differentiate it from pancreatic cancer and we evaluate the radiological criteria for response to corticosteroid treatment.
Keywords. Autoimmune pancreatitis, autoimmune pancreatitis type 1, autoimmune pancreatitis type 2, autoimmune pancreatitis type 3, magnetic resonance, typical and atypical imaging features.
Abreviaturas
ADC: Coeficiente de difusion aparente.
ACDP: Adenocarcinoma ductal del páncreas.
CEP: Colangitis esclerosante primaria.
CPRE: Colangiografia retrógrada endoscópica.
DWI: Difusión por resonancia magnética.
EII: Enfermedad inflamatoria intestinal.
GEL: Lesiones epiteliales granulociticas.
PAI: Pancreatitis autoinmune.
RM: Resonancia magnética.
TC: Tomografía computada.
Introducción
La pancreatitis autoinmune (PAI) es una forma específica de enfermedad fibroinflamatoria recurrente, con epidemiología, presentación clínica e histología polifacética. A pesar de los avances en la comprensión de la enfermedad, la etiopatogenia no ha sido definida con exactitud; se postula un origen multifactorial y es primordial el mecanismo inmunológico. Se trata de una enfermedad ocasionada por una respuesta inmune celular exagerada, con una etapa inicial inflamatoria caracterizada por la presencia de linfocitos B y T y producción de citoquinas que inducen el cambio de células B a células plasmáticas productoras de IgG4. Los plasmablastos son impulsores del daño tisular a través de la producción de moléculas citolíticas y activación de los fibroblastos. Luego, en la etapa fibrótica, los macrófagos y fibroblastos producen la matriz extracelular y la reacción estromal. Estudios basados en el perfil clínico e histopatológico de los pacientes revelan la existencia de dos subtipos de la enfermedad con particularidades inherentes a cada una de ellas. Recientemente ha sido descripta una tercera variante, vinculada al uso de inmunoterapia (checkpoint inhibitors), utilizada en el tratamiento sistémico de distintos tumores.1-4
PAI tipo 1. Linfoplasmocítica esclerosante
Se acepta que la PAI tipo 1 representa el compromiso pancreático de una enfermedad fibroinflamatoria sistémica relacionada a IgG4, con compromiso de otros órganos. La colangiopatía, la fibrosis retroperitoneal y la nefritis son hallazgos frecuentes. Tiene predilección por el sexo masculino con una edad media aproximada de 60 años, se presenta clínicamente con ictericia obstructiva indolora, puede acompañarse de insuficiencia exocrina, endocrina o pérdida de peso, siendo poco usuales los eventos de pancreatitis aguda. En el laboratorio se constata un incremento sérico de los anticuerpos IgG4 típicamente duplicando el valor normal, inmunoglobulina G total aumentada e hipergammaglobulinemia. En la histología presenta rasgos característicos que incluyen la presencia de densos infiltrados de células plasmáticas, predominantemente periductales, fibrosis estoriforme (en remolino), venulitis obliterativa, abundantes células plasmáticas IgG4 positivas (> 10 – 50 por campo de alto aumento) y relación plasmocitos IgG4 (+)/IgG (+) > 40%.5-7
PAI tipo 2. Ductocéntrica idiopática
Comparte aspectos histológicos con la PAI 1, como son los infiltrados linfoplasmocitarios, la flebitis obliterativa y la fibrosis, pero de menor magnitud. Se caracteriza por tener una mayor afectación de los conductos, con infiltración de neutrófilos intraepiteliales e intraductales que conducen a la obliteración y destrucción ductal, conocidas como GEL. Los pacientes suelen ser más jóvenes, sin predilección por sexo, presentándose clínicamente con dolor abdominal y pancreatitis aguda. No hay elevación sérica de IgG4 y no se asocia a lesiones en otros órganos vinculadas a IgG4, sin embargo, se ha demostrado una fuerte asociación con la enfermedad inflamatoria intestinal (EII) y particularmente con la colitis ulcerosa.8,9
PAI tipo 3. Inducida por inmunoterapia
La inmunoterapia utilizada en forma creciente en diversos tumores, incluso como primera línea de tratamiento, puede predisponer con diferente frecuencia y severidad a eventos adversos que afectan distintos órganos. Los inhibidores de los puntos de control inmunológico regulan la activación y proliferación de linfocitos T, incrementando la actividad de las células TCD8+ antitumorales. La injuria pancreática por inmunoterapia se observa con mayor frecuencia en pacientes con melanoma y tumores genitourinarios; habitualmente son asintomáticos y se diagnostican por elevación en sangre de enzimas pancreáticas, en los casos sintomáticos presentan pancreatitis leve.5-10
Debido a lo heterogéneo de la enfermedad, el adecuado diagnóstico de la PAI es un desafío complejo que requiere un abordaje multidisciplinario. Existen diversos consensos y guías de recomendación para el diagnóstico, entre los que se destacan los criterios de la Clínica Mayo, HISORt, las guías japonesas y el consenso de la Asociación Internacional de Pancreatología. Las imágenes tienen una participación fundamental entre los elementos cardinales para el diagnóstico de PAI propuestos por las diferentes guías, no solo para evaluar los cambios parenquimatosos y ductales, sino también para determinar el compromiso de otros órganos que puedan apoyar el diagnóstico. En cuanto a los pacientes diagnosticados y tratados, las imágenes cumplen un rol importante en la evaluación de la respuesta a los corticoides.11-13
Rol de las imágenes en la PAI
El diagnóstico por imagen es una herramienta fundamental en el manejo integral de los pacientes con pancreatitis autoinmune. Si bien la ecografía y la TC son métodos de gran valor, en la actualidad la RM es la técnica de elección. Es un método con gran capacidad en la caracterización de los diferentes tejidos, y en el caso de la PAI permite evaluar con gran eficacia la presencia y magnitud de los cambios inflamatorios, así como también el desarrollo de fibrosis. Otra virtud fundamental es que ofrece la posibilidad de estudiar el conducto pancreático a través de las secuencias de colangio-RM, siendo las modificaciones ductales un criterio primordial en el diagnóstico. La evaluación dinámica con el contraste intravenoso con secuencias volumétricas, tanto por TC como por RM, revelan los cambios en la perfusión del órgano, ya que la PAI presenta un patrón de realce parenquimatoso muy característico.14-16
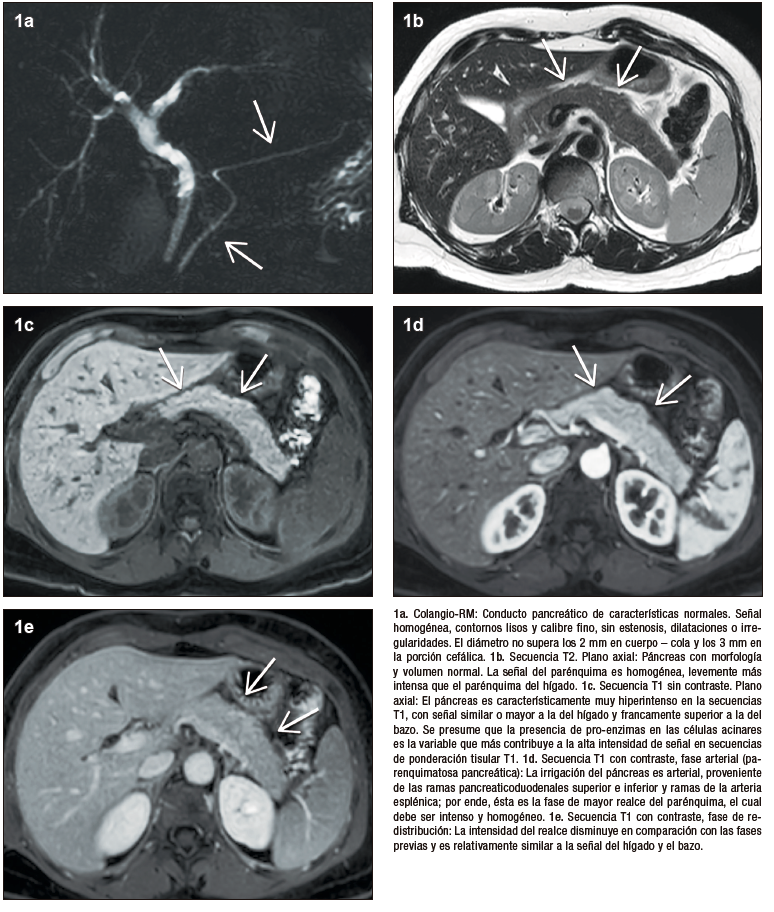
Figura 1. Páncreas normal
Manifestaciones parenquimatosas
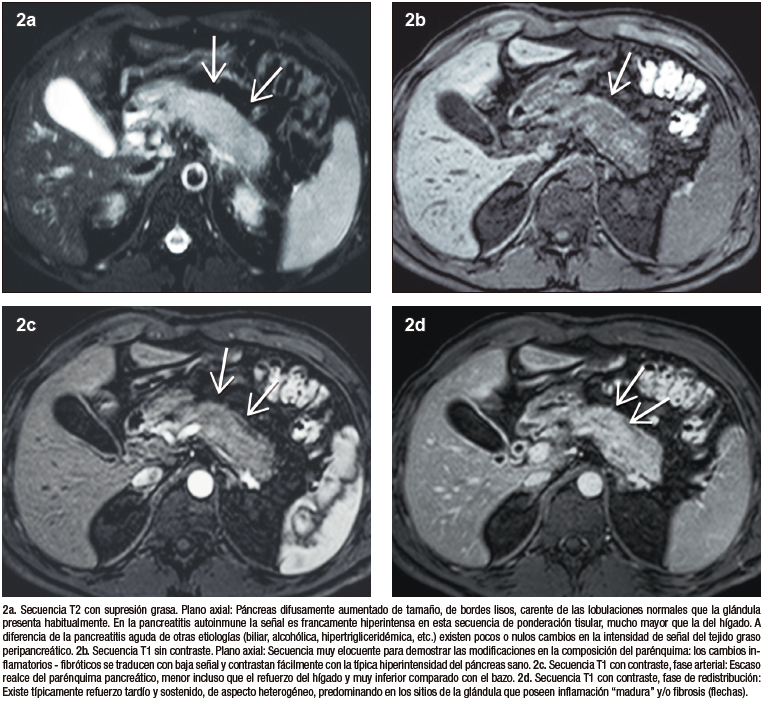
La característica imagenológica distintiva de la pancreatitis autoinmune es un agrandamiento difuso del órgano, que pierde su fisonomía glandular, presenta bordes de aspecto liso y resulta en el denominado “páncreas en salchicha”. Esta presentación se considera típica y por ende el nivel de certeza diagnóstica con este patrón radiológico es elevado. Las formas “atípicas”, focales o segmentarias son menos frecuentes, pero plantean un mayor desafío, dado que pueden simular al adenocarcinoma ductal.
Las células acinares ricas en proenzimas determinan que el páncreas sano tenga alta intensidad de señal en las secuencias de ponderación tisular T1. En la PAI los densos infiltrados inflamatorios producen una disminución difusa de la señal normal en T1, observándose un parénquima hipointenso en relación al hígado o a sectores no afectados de la propia glándula. Las secuencias de difusión evalúan el movimiento de las moléculas de agua en los tejidos, siendo por lo tanto un biomarcador subrogante de proliferación celular. En el caso de la PAI los abundantes acúmulos de linfocitos y plasmocitos ocasionan dificultad para que las moléculas de agua se muevan libremente, existiendo por ende restricción en la difusión. Esto se traduce con señal hiperintensa en las imágenes DWI y con señal hipointensa en el mapa de ADC.
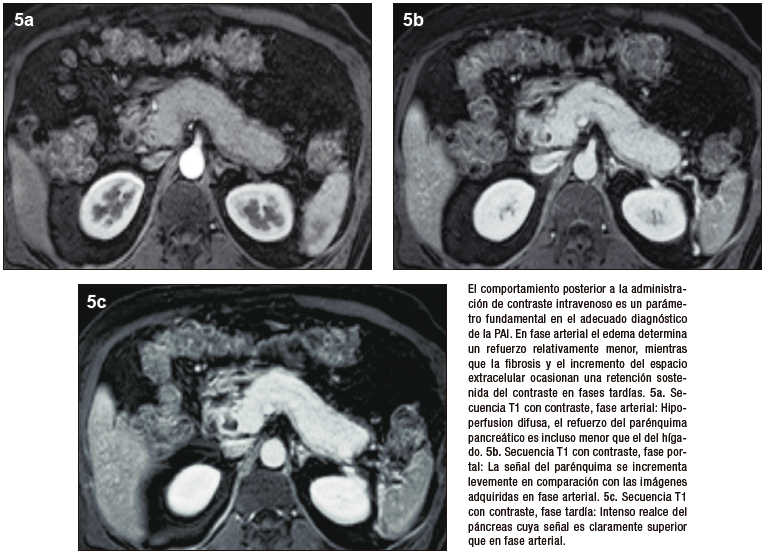
La valoración del patrón de perfusión del páncreas es otro elemento diagnóstico central y puede ser evaluado de manera muy eficiente con la administración del contraste intravenoso, tanto por TC (yodo) como por RM (gadolinio). El protocolo incluye la adquisición de imágenes sin contraste, en fases parenquimatosa pancreática (arterial), portal y de redistribución. El páncreas normal, debido a su irrigación, realza intensamente en la fase parenquimatosa pancreática, mientras que en la PAI existe típicamente una reducción del refuerzo en forma global, o eventualmente en los casos de eventos focales, hipoperfusión de los sectores comprometidos de la glándula. En la fase portal suele existir tendencia a un incremento del realce glandular, mientras que en la fase de redistribución existe un refuerzo parenquimatoso, con retención sostenida del mismo en tiempos tardíos, consecuencia del ensanchamiento del espacio extracelular y la fibrosis. Se trata de una enfermedad dinámica, progresiva, pudiendo alternar áreas de inflamación reciente, con otras más maduras, presencia de fibrosis, incluso zonas de parénquima respetado interpuesto. Esta heterogeneidad temporal y espacial se traduce en ocasiones con un patrón de densidad / señal y realce glandular moteado, parcheado. Los cambios en la composición estructural del órgano pueden ser detectados por TC, pero dada su gran habilidad en diferenciar los diferentes tejidos (elevada resolución tisular), la RM es la modalidad preferida.17
Figura 2. Rasgos imagenológicos típicos de la PAI
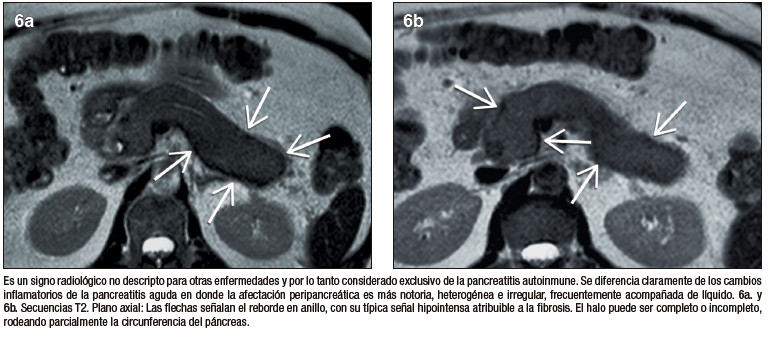
El signo del halo es un reborde en anillo, en forma de cápsula, peripancreático, rodeando en forma completa o parcial el parénquima de la glándula. Es un signo imagenológico que no ha sido descripto para otras enfermedades del páncreas y se lo considera exclusivo de la PAI. Si bien es un rasgo radiológico característico, su frecuencia de presentación en estudios de RM oscila entre 18 y 47% según diversos estudios que investigaron este signo. Se postula que corresponde a la extensión extra-pancreática de los cambios inflamatorios y la fibrosis; característicamente presenta señal hipointensa en las secuencias T1 y T2 con realce post-contraste en fase tardía.18
Figura 3. Señal heterogénea, parcheada
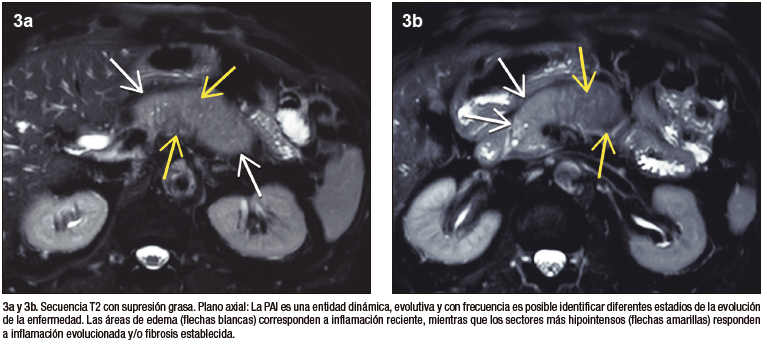
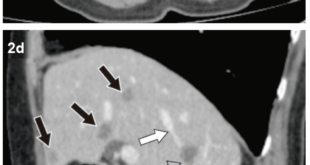
Figura 4. Secuencia de difusión
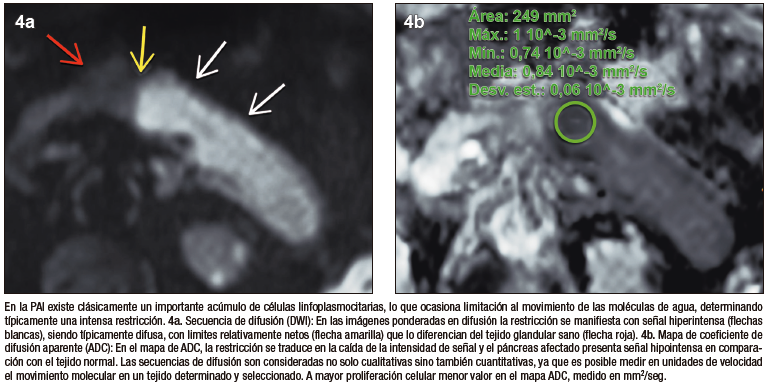
Figura 7. Signo del halo con contraste
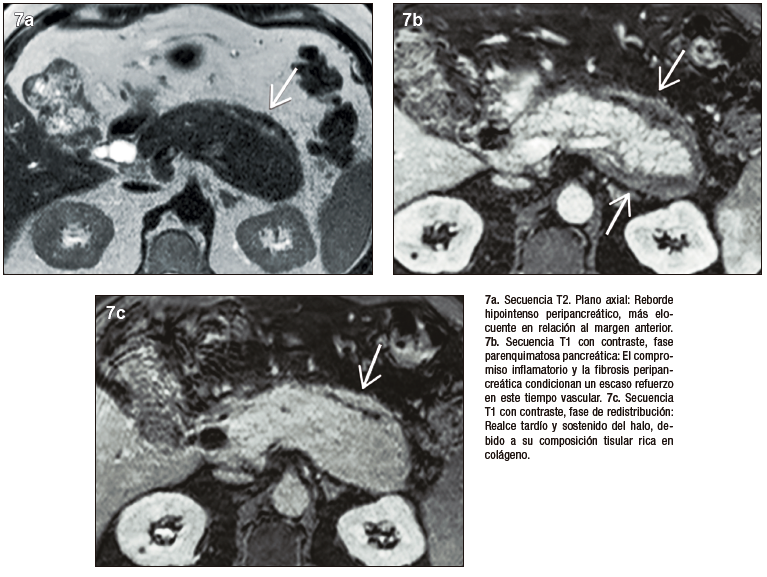
Figura 8. PAI tipo 3, inducida por inmunoterapia
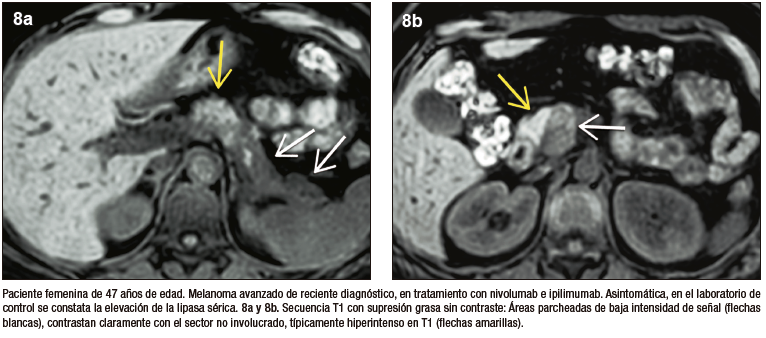
Figura 8. PAI tipo 3, inducida por inmunoterapia (Continuación)
Un artículo de la Universidad de Verona del año 2011 analizó en forma retrospectiva los estudios de RM de 27 pacientes con diagnóstico de PAI, 23 de ellos con confirmación histopatológica, 4 por criterios positivos, incluyendo serología y respuesta a los corticoides. En el 52% de los pacientes se comprobó el compromiso difuso de todo el páncreas, mientras que en el 48% el compromiso inflamatorio fue focal – segmentario. De este subgrupo con compromiso parenquimatoso parcial, 54% presentaba afectación de la cabeza y 46% de la región corpocaudal pancreática. En el 100% de los pacientes se demostró hipointensidad en secuencias T1 y en 93% señal hiperintensa en T2. En la evaluación dinámica post-contraste 93% (23/27) de los pacientes presentaron hipoperfusión en fase parenquimatosa pancreática y 70% (19/27) realce tardío y sostenido.19
Manifestaciones ductales
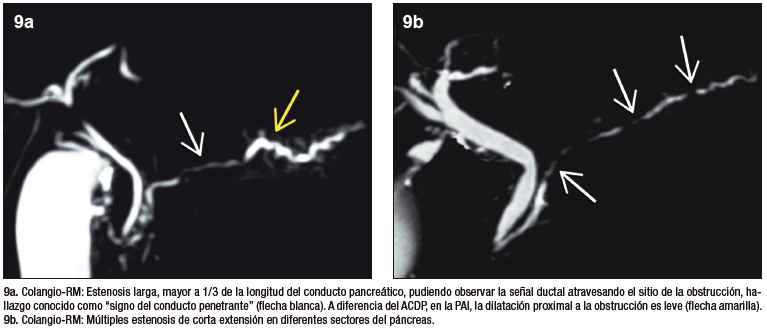
Los cambios ductales de la PAI, si bien han sido descripto para CPRE, pueden ser documentados de manera muy elocuente por colangio-RM. Se utilizan secuencias radiales, con diferentes ángulos de rotación, orientando la adquisición específicamente al conducto pancreático, así como también secuencias volumétricas que permiten reconstruir la vía biliar y el conducto pancreático en
3 dimensiones. Los criterios ductales aceptados son la estenosis prolongada (> 1/3 de la longitud) del conducto pancreático o bien estrechamientos multifocales en diferentes sectores de la glándula. Suele observarse una leve dilatación ductal, proximal a la estenosis. La visualización del conducto pancreático dentro de la lesión parenquimatosa es conocida con el nombre de “signo del conducto penetrante” y es característico de los procesos inflamatorios, a diferencia del cáncer, donde la señal del conducto se interrumpe de manera abrupta.
Figura 9. Manifestaciones ductales
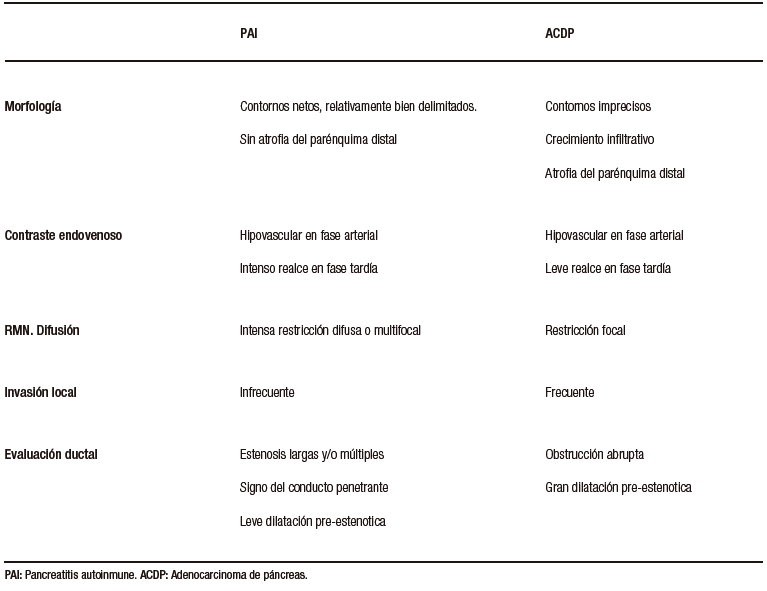
Diagnóstico diferencial con el adenocarcinoma pancreático
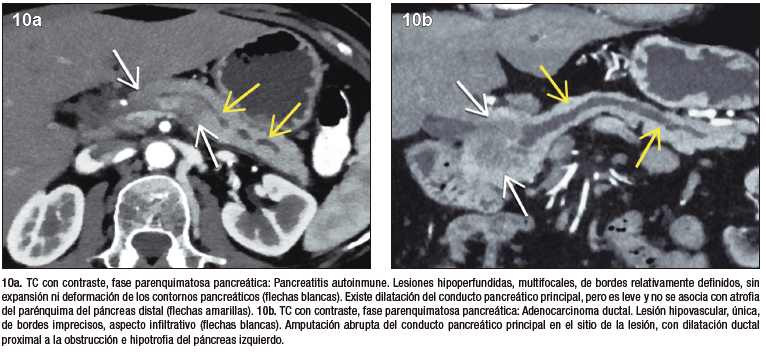
La PAI y el ACDP tienen una epidemiología en común, prevaleciendo en pacientes de sexo masculino, adultos, en la 5° y 6° década de la vida. Comparten también una presentación clínica similar correspondiente a ictericia. Si bien la forma difusa de la PAI puede ser diferenciada imagenológicamente del ACDP, su forma focal, no tan infrecuente, representa un desafío complejo y plantea la necesidad imperiosa de diferenciarlo del cáncer. El ACDP presenta típicamente bordes imprecisos, debido a su crecimiento infiltrativo, mientras que en la PAI podemos hallar límites más netos, relativamente mejor delimitados. Es frecuente la invasión local, con compromiso vascular en el ACDP, lo cual suele ser extremadamente infrecuente en la PAI.
En adquisiciones dinámicas post-contraste intravenoso, ambas entidades suelen ser lesiones hipovasculares en fase arterial. El ACDP es un tumor con gran desmoplasia, si bien presenta frecuentemente realce en fases tardías, en la PAI este refuerzo suele ser más pronunciado y persistente. En RM la secuencia de difusión, dada su elevada sensibilidad, puede contribuir en la diferenciación, particularmente por su aspecto y distribución. En la PAI la restricción puede ser multifocal, contribuyendo a identificar focos inflamatorios adicionales que pueden pasar desapercibidos en otros métodos, incluso en otras secuencias de RM. Se ha descripto que la magnitud de la restricción es superior en la PAI, frente al ACDP, debido al denso acúmulo celular linfoplasmocitario. Un metaanálisis publicado en Radiology en el año 2014 revisó los valores del mapa de coeficiente de difusión aparente en pacientes con lesiones pancreáticas, incluyendo ACDP, tumores neuroendocrinos, pancreatitis aguda, pancreatitis crónica y PAI. De todas las entidades incluidas, la PAI fue la que mostró la media de ADC más baja, correspondiendo a 0,9 x 10-3 mm2/seg, mientras que el adenocarcinoma mostró una media de 1,3 x 10-3 mm2/seg.20
Si bien hipotéticamente podríamos utilizar la determinación cuantitativa para diferenciar ambas entidades, la distribución y morfología de las áreas de restricción a la difusión son de mayor utilidad en la práctica clínica cotidiana.
La evaluación ductal contribuye al diagnóstico diferencial. El ACDP provoca obstrucción abrupta del conducto pancreático, existiendo gran dilatación proximal al tumor y atrofia del parénquima distal. En los tumores de la cabeza del páncreas se obstruye no solo el conducto pancreático sino también el conducto colédoco ocasionando una gran dilatación de la vía biliar. En la PAI las estenosis son más largas o eventualmente múltiples, solemos hallar el signo del conducto penetrante, visualizando la señal ductal transcurriendo por el sitio de la lesión. A diferencia del ACDP, en la PAI focal la dilatación pre-estenótica del conducto suele ser muy leve, habitualmente sin dilatación de ramas laterales y no se asocia a la atrofia del páncreas distal.21,22
Figura 10. Diagnóstico diferencial entre PAI y ACDP
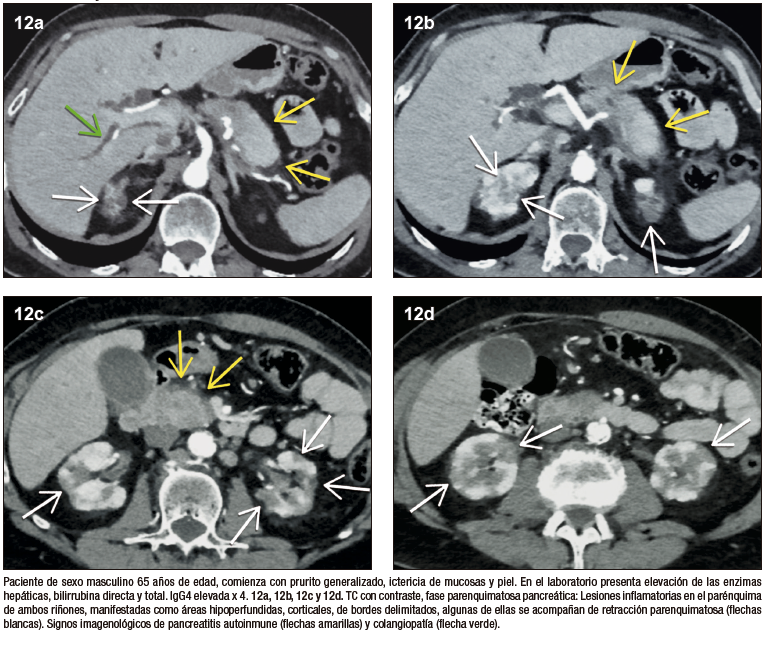
Manifestaciones extra-pancreáticas en PAI 1
Considerando que la PAI tipo 1 es la manifestación pancreática del compromiso sistémico por IgG4, el compromiso de otros órganos es un sello distintivo y un criterio decisivo en el diagnóstico de la enfermedad.
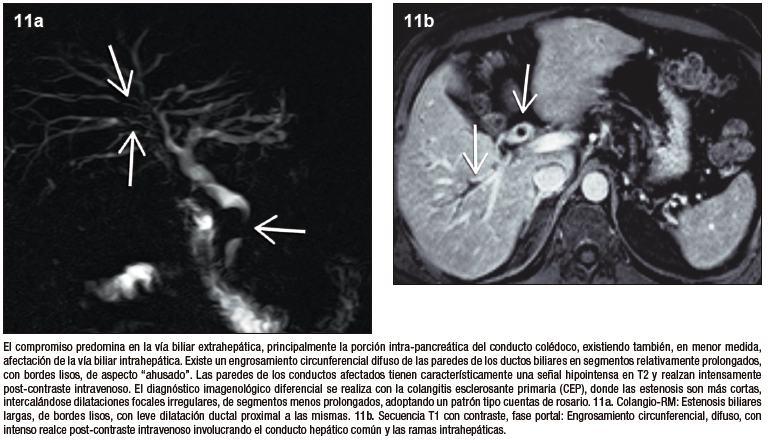
Colangiopatía IgG4
La vía biliar es el sitio más frecuentemente afectado, con una prevalencia reportada de 60 a 85% de los pacientes. En la enorme mayoría de los casos existe también compromiso del páncreas, muy excepcionalmente puede presentarse colangiopatía IgG4 sin afectación pancreática. Los sectores comprometidos de la vía biliar muestran engrosamiento parietal circunferencial, difuso, de segmentos relativamente prolongados. Existe moderado a intenso realce post-contraste de las paredes de los conductos involucrados y en la RM con secuencias de difusión suele observarse restricción. El conducto colédoco distal intra-pancreático es el sector que se ve involucrado con mayor frecuencia y conlleva una dilatación leve a moderada de la vía biliar proximal, condicionando la típica presentación clínica de ictericia obstructiva que suelen tener estos pacientes. Las manifestaciones radiológicas pueden asemejarse a la CEP, pero existen sutiles diferencias que contribuyen a su distinción. En la CEP predomina el compromiso de la vía biliar intrahepática, las estenosis son más cortas y alternan con dilataciones saculares múltiples, conformando un patrón tipo “cuentas de rosario” o “árbol podado”, en contraposición de las estenosis largas y continuas de la colangiopatía IgG4.23-26
Nefritis
El compromiso renal ha sido reportado en un 30 a 35% de los pacientes. Las alteraciones inflamatorias suelen ser bilaterales, con compromiso cortical periférico, morfología triangular, de bordes rectos o eventualmente redondeados. Con menor frecuencia puede existir compromiso urotelial. Las lesiones son hipovasculares en fase arterial, con refuerzo tardío y sostenido. En la RM característicamente tienen señal hipointensa en las secuencias T1 y T2 debido al componente fibroso, y muestran moderada restricción a la difusión. El diagnóstico diferencial imagenológico es la pielonefritis infecciosa, sin embargo, el contexto de aparición es distinto y no genera dificultad en su adecuada interpretación.27
Fibrosis retroperitoneal
Tiene una prevalencia de 10 a 20% de los pacientes con PAI tipo 1. Se caracteriza por la presencia de un tejido sólido, redondeado, con aspecto de “masa”, típicamente rodeando a la arteria aorta – arterias iliacas y en ocasiones a los uréteres, provocando uronefrosis. En RM la señal en secuencias de ponderación tisular T1 y T2 varía de acuerdo al grado de actividad inflamatoria, mientras que la madurez del colágeno y la fibrosis establecida van a determinar un refuerzo post-contraste tardío y sostenido.28, 29
Asociación con colitis ulcerosa en PAI 2
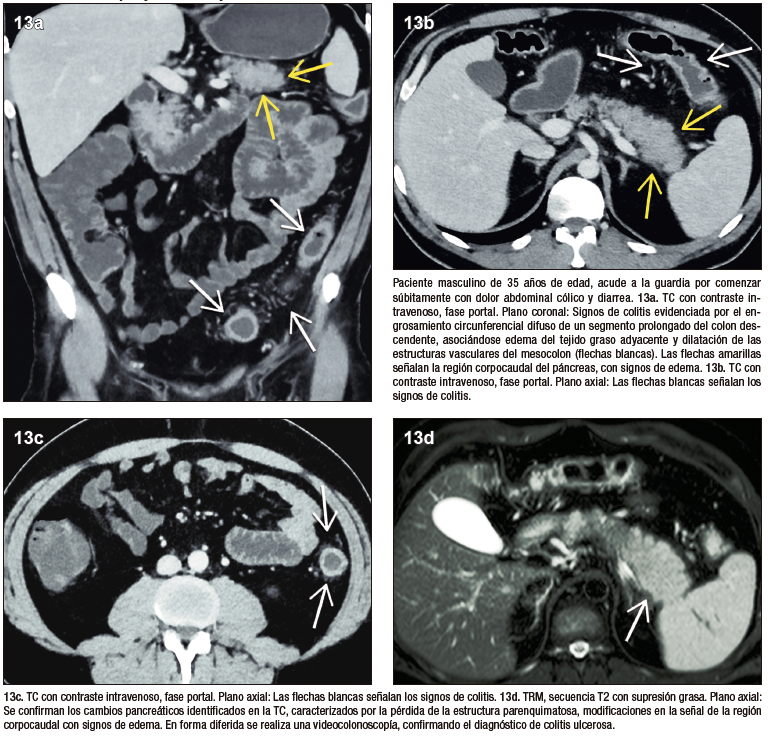
La asociación entre la pancreatitis autoinmune tipo 2 y la enfermedad inflamatoria intestinal, especialmente la colitis ulcerosa, ha sido ampliamente descripta, estudiada y establecida. El Consenso Internacional de Criterios Diagnósticos de la PAI publicado en el año 2011 incluye esta asociación como criterio que contribuye al diagnóstico de la enfermedad. En la mayoría de los casos la PAI se desarrolla en pacientes con diagnóstico ya establecido previamente de colitis ulcerosa, con una baja prevalencia de instalación sincrónica o enfermedad pancreática precediendo la intestinal. Los pacientes se presentan con cuadros de pancreatitis aguda, manifestando dolor abdominal epigástrico, que no puede ser claramente relacionado con el compromiso intestinal.30,31
Figura 13. PAI 2 y enfermedad inflamatoria intestinal (CU)
Evaluación de la respuesta al tratamiento
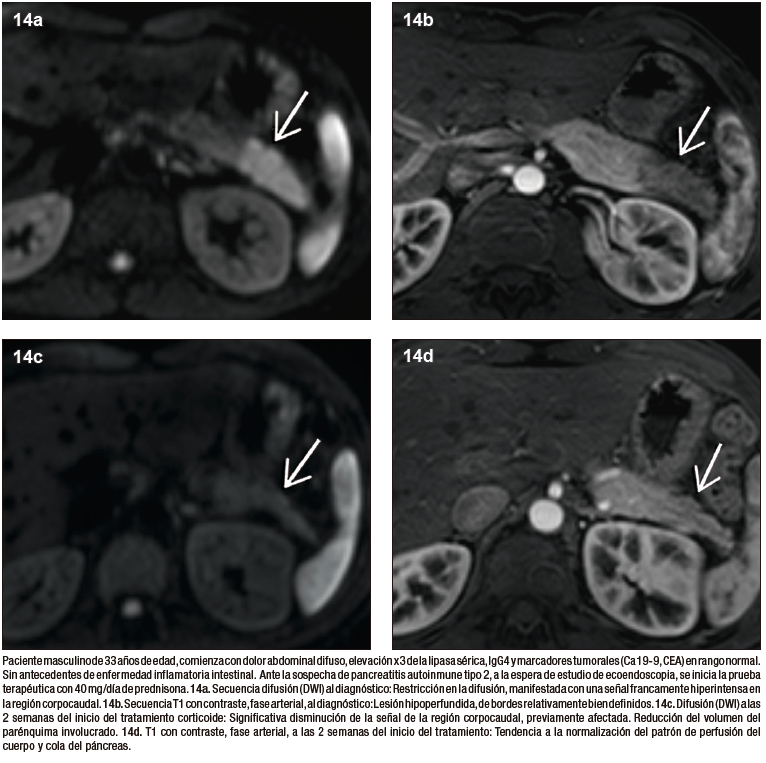
Las imágenes cumplen un papel importante en la evaluación de la respuesta al tratamiento corticoide, incluso la prueba terapéutica positiva con mejoría imagenológica, representa uno de los criterios diagnósticos cardinales por la mayoría de las guías de recomendación. Antes de iniciar la prueba terapéutica se recomienda descartar en forma exhaustiva la posibilidad de cáncer, especialmente en las formas focales, contemplando la biopsia ecoendoscópica entre los gestos diagnósticos. Ambos subtipos de la enfermedad muestran típicamente una respuesta rápida y excelente, habitualmente con menor tasa de recaídas en la PAI 2 en comparación con el subtipo 1. El control imagenológico se realiza en general a las 2 semanas de la instauración del tratamiento. Cuando es favorable se identifica la disminución de tamaño del páncreas, la normalización de la densidad / señal y del patrón de realce parenquimatoso en las secuencias post-contraste intravenoso. En la RM las secuencias de difusión representan un biomarcador de respuesta, siendo el aumento de la señal en el mapa de ADC un excelente predictor. En cuanto a las imágenes ductales, una respuesta favorable se traduce en la remisión de las estenosis, con tendencia a la restitución del calibre ductal normal. Las manifestaciones extra-pancreáticas muestran una similar tasa de respuesta que el páncreas.32 – 34
Figura 14. Respuesta a los corticoides
Conclusión
Las imágenes no invasivas cumplen un rol central en el diagnóstico de los pacientes con sospecha de PAI. Existen manifestaciones imagenológicas típicas consistentes en aumento difuso del tamaño de la glándula, con bordes lisos y el signo del halo, o bien atípicas con presentación focal y aspecto de masa. La resonancia magnética con contraste y colangiopancreato-RM representan las técnicas de elección, debido a su mayor capacidad para la caracterización tisular y la valoración del conducto pancreático. La evaluación radiológica del compromiso de otros órganos contribuye fuertemente a la confirmación de la presunción diagnóstica, siendo la vía biliar el sitio más frecuentemente afectado. En el seguimiento de la enfermedad las imágenes tienen un rol muy importante en la evaluación de la respuesta al tratamiento con corticoides.
Consentimiento para la publicación. Para la confección de este manuscrito se utilizaron datos anonimizados que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos, las figuras y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Haberman D, Basso S, Volpacchio M y col. Rol del diagnóstico por imágenes en la pancreatitis autoinmune. Acta Gastroenterol Latinoam. 2024;54(1):14-30. https://doi.org/10.52787/agl.v54i1.392
Referencias
- Yoshida K, Toki F, Takeuchi T, Watanabe S, Shiratori K, Hayashi N. Chronic pancreatitis caused by an autoimmune abnormality. Proposal of the concept of autoimmune pancreatitis. Dig Dis Sci. 1995 Jul;40(7):1561-8.
- Kamisawa T, Funata N, Hayashi Y, Eishi Y, Koike M, Tsuruta K, et al. A new clinicopathological entity of IgG4-related autoimmune disease. J Gastroenterol. 2003;38(10):982-4.
- Okazaki K, Uchida K, Ohana M, Nakase H, Uose S, Inai M, et al. Autoimmune-related pancreatitis is associated with autoantibodies and a Th1/Th2-type cellular immune response. Gastroenterology. 2000 Mar;118(3):573-81.
- Sayed Ahmed A, Abreo M, Thomas A, Chari ST. Type 3 autoimmune pancreatitis (immune checkpoint inhibitor-induced pancreatitis). Curr Opin Gastroenterol. 2022 Sep 1;38(5):516-20.
- Kamisawa T, Egawa N, Nakajima H, Tsuruta K, Okamoto A. Extrapancreatic lesions in autoimmune pancreatitis. J Clin Gastroenterol. 2005 Nov-Dec;39(10):904-7.
- Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, et al. Histopathological features of diagnostic and clinical relevance in autoimmune pancreatitis: a study on 53 resection specimens and 9 biopsy specimens. Virchows Arch. 2004 Dec;445(6):552-63.
- Klöppel, Günter, Bence Sipos, Giuseppe Zamboni, Motohiro Kojima, and Toshio Morohoshi. 2007. “Autoimmune Pancreatitis: Histo- and Immunopathological Features”. Journal of Gastroenterology 42 Suppl 18 (May): 28-31.
- St, Chari. 2010. “The Autoimmune Pancreatitis International Cooperative Study Group (APICS). Histopathologic and Clinical Subtypes of Autoimmune Pancreatitis: The Honolulu Consensus Document.” Pancreas 39: 549-54.
- Notohara K, Burgart LJ, Yadav D, Chari S, Smyrk TC. Idiopathic chronic pancreatitis with periductal lymphoplasmacytic infiltration: clinicopathologic features of 35 cases. Am J Surg Pathol. 2003 Aug;27(8):1119-27.
- Thomas AS, Abreo M, Sayed SA, Sireesha Yedururi YW, Chari ST. Autoimmune Pancreatitis Secondary to Immune Checkpoint Inhibitor Therapy (Type 3 AIP): Insights Into a New Disease From Serial Pancreatic Imaging. Gastroenterology. 2023 Jan;164(1):154-5.
- Chari ST, Smyrk TC, Levy MJ, Topazian MD, Takahashi N, Zhang L, et al. Diagnosis of autoimmune pancreatitis: the Mayo Clinic experience. Clin Gastroenterol Hepatol. 2006 Aug;4(8):1010-6; quiz 934.
- Tetsuo H, Masaru K, Yutaka A, Kazuichi O, Terumi K. Diagnostic criteria for autoimmune pancreatitis by the Japan Pancreas Society. J Jpn Pancreas Soc. 2002;17:585-7.
- Shimosegawa T, Chari ST, Frulloni L, Kamisawa T, Kawa S, Mino-Kenudson M, et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas. 2011 Apr;40(3):352-8.
- Khandelwal A, Shanbhogue AK, Takahashi N, Sandrasegaran K, Prasad SR. Recent advances in the diagnosis and management of autoimmune pancreatitis. AJR Am J Roentgenol. 2014 May;202(5):1007-21.
- Vlachou PA, Khalili K, Jang HJ, Fischer S, Hirschfield GM, Kim TK. IgG4-related sclerosing disease: autoimmune pancreatitis and extrapancreatic manifestations. Radiographics. 2011 Sep-Oct;31(5):1379-402.
- Sahani DV, Kalva SP, Farrell J, Maher MM, Saini S, Mueller PR, et al. Autoimmune pancreatitis: imaging features. Radiology. 2004 Nov;233(2):345-52.
- Martínez-de-Alegría A, Baleato-González S, García-Figueiras R, Bermúdez-Naveira A, Abdulkader-Nallib I, Díaz-Peromingo JA, et al. IgG4-related Disease from Head to Toe. Radiographics. 2015 Oct 16;35(7):2007-25.
- Takahashi M, Fujinaga Y, Notohara K, Koyama T, Inoue D, Irie H, et al. Diagnostic imaging guide for autoimmune pancreatitis. Jpn J Radiol. 2020 Jul;38(7):591-612.
- Manfredi R, Frulloni L, Mantovani W, Bonatti M, Graziani R, Pozzi Mucelli R. Autoimmune Pancreatitis: Pancreatic and Extrapancreatic MR Imaging-MR Cholangiopancreatography Findings at Diagnosis, after Steroid Therapy, and at Recurrence. Radiology. 2011 Aug 1;260(2):428-36.
- Barral M, Taouli B, Guiu B, Koh DM, Luciani A, Manfredi R, et al. Diffusion-weighted MR imaging of the pancreas: current status and recommendations. Radiology. 2015 Jan;274(1):45-63.
- Sugiyama Y, Fujinaga Y, Kadoya M, Ueda K, Kurozumi M, Hamano H, et al. Characteristic magnetic resonance features of focal autoimmune pancreatitis useful for differentiation from pancreatic cancer. Jpn J Radiol. 2012 May;30(4):296-309.
- Pozzi Mucelli R, Negrelli R, Boninsegna E, Mehrabi S, Manfredi R. Resonancia magnética de la pancreatitis autoinmune: una revisión de la literatura. Revista Argentina de Radiología. 2016 Oct 1;80(4):268-75.
- Hamano H, Arakura N, Muraki T, Ozaki Y, Kiyosawa K, Kawa S. Prevalence and distribution of extrapancreatic lesions complicating autoimmune pancreatitis. J Gastroenterol. 2006 Dec;41(12):1197-205.
- Kamisawa T, Nakajima H, Egawa N, Funata N, Tsuruta K, Okamoto A. IgG4-related sclerosing disease incorporating sclerosing pancreatitis, cholangitis, sialadenitis and retroperitoneal fibrosis with lymphadenopathy. Pancreatology. 2006;6(1-2):132-7.
- Nakazawa T, Ohara H, Sano H, Aoki S, Kobayashi S, Okamoto T, et al. Cholangiography can discriminate sclerosing cholangitis with autoimmune pancreatitis from primary sclerosing cholangitis. Gastrointest Endosc. 2004 Dec;60(6):937-44.
- Arikawa S, Uchida M, Kunou Y, Uozumi J, Abe T, Hayabuchi N, et al. Comparison of sclerosing cholangitis with autoimmune pancreatitis and infiltrative extrahepatic cholangiocarcinoma: multidetector-row computed tomography findings. Jpn J Radiol. 2010 Apr;28(3):205-13.
- Takahashi N, Kawashima A, Fletcher JG, Chari ST. Renal Involvement in Patients with Autoimmune Pancreatitis: CT and MR Imaging Findings. Radiology. 2007 Mar 1;242
(3):791-801. - Naitoh I, Nakazawa T, Ohara H, Ando T, Hayashi K, Tanaka H, et al. Clinical significance of extrapancreatic lesions in autoimmune pancreatitis. Pancreas. 2010 Jan;39(1):e1-5.
- Sohn JH, Byun JH, Yoon SE, Choi EK, Park SH, Kim MH, et al. Abdominal extrapancreatic lesions associated with autoimmune pancreatitis: radiological findings and changes after therapy. Eur J Radiol. 2008 Sep;67(3):497-507.
- Lorenzo D, Maire F, Stefanescu C, Gornet JM, Seksik P, Serrero M, et al. Features of Autoimmune Pancreatitis Associated with Inflammatory Bowel Diseases. Clin Gastroenterol Hepatol. 2018 Jan;16(1):59-67.
- Nikolic S, Lanzillotta M, Panic N, Brismar TB, Moro CF, Capurso G, et al. Unraveling the relationship between autoimmune pancreatitis type 2 and inflammatory bowel disease: Results from two centers and systematic review of the literature. United European Gastroenterol J. 2022 Jun;10(5):496-506.
- Chari ST, Takahashi N, Levy MJ, Smyrk TC, Clain JE, Pearson RK, et al. A diagnostic strategy to distinguish autoimmune pancreatitis from pancreatic cancer. Clin Gastroenterol Hepatol. 2009 Oct;7(10):1097-103.
- Sahani DV, Sainani NI, Deshpande V, Shaikh MS, Frinkelberg DL, Fernandez-del Castillo C. Autoimmune Pancreatitis: Disease Evolution, Staging, Response Assessment, and CT Features That Predict Response to Corticosteroid Therapy. Radiology. 2009 Jan 1;250(1):118-29.
- Manfredi R, Graziani R, Cicero C, Frulloni L, Carbognin G, Mantovani W, et al. Autoimmune Pancreatitis: CT Patterns and Their Changes after Steroid Treatment. Radiology. 2008 May 1;247(2):435-43.
Correspondencia: Diego Haberman
Correo electrónico: diegohaberman@gmail.com
Acta Gastroenterol Latinoam 2024;54(1):14-30
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE