Rodrigo Castaño Llano1 ID· Amy Piñeres2 ID· Jeronimo Toro Calle3 ID· Sandra Molina Meneses1 ID· William Valencia Gomez4 ID· Juan Esteban Puerta Botero5 ID
1 Instituto de Cancerología Clínica Las Américas.
2 Centro Oncológico de Antioquia.
3 Clínica CES.
4 Hospital General de Medellín.
5 Universidad CES.
Colombia.
Acta Gastroenterol Latinoam 2022;52(2):241-250
Recibido: 14/02/2022 / Aceptado: 26/05/2022 / Publicado online el 27/06/2022 / https://doi.org/10.52787/agl.v52i2.179
Resumen
Introducción. Ante la alta prevalencia de infección por Helicobacter pylori a nivel mundial y la gran resistencia de esta bacteria a los antibióticos, se ha hecho necesario el uso de terapias más agresivas para erradicar la infección. Por esta razón se propone el uso como primera línea de una terapia dual ampliada frente a la terapia cuádruple convencional utilizada para el tratamiento de esta patología. Objetivos. Evaluar y comparar la eficacia y seguridad de la terapia cuádruple con bismuto (TCB) contra la terapia dual con dosis altas (TDA) de esomeprazol y amoxicilina como terapia empírica de primera línea para erradicar la infección por Helicobacter pylori. Pacientes y métodos. Ensayo prospectivo; se incluyeron 266 pacientes infectados por Helicobacter pylori sin tratamiento previo, aleatorizados para recibir terapia cuádruple con bismuto (esomeprazol 40mg dos veces por día, 2 tabletas de subsalicilato de bismuto de 262mg bid, amoxicilina 1gr bid y levofloxacina 500mg bid) por 14 días o terapia dual ampliada (esomeprazol 40mg tid, amoxicilina 1gr tid) por 14 días. La erradicación de la infección se evaluó mediante la prueba del aliento seis a ocho semanas luego de terminada la terapia. Los eventos adversos y el cumplimiento se evaluaron con cuestionarios realizados en un seguimiento telefónico o presencial. Resultados. Las características demográficas, clínicas y endoscópicas fueron similares entre los grupos. Las tasas de erradicación por intención de tratar (133 pacientes en cada grupo) fueron del 84,9% para la TCB y del 88,7% para la TDA (p = 0,36). Las tasas de erradicación por protocolo fueron del 90.3% para la TCB y del 96,6% para la TDA (p = 0,04). La prevalencia de efectos secundarios fue del 36.8% para la TCB y del 16,5% para la TDA (p < 0,001). Conclusiones. La terapia dual ampliada indujo una tasa de erradicación de la infección por Helicobacter pylori significativamente mayor que la terapia cuádruple con bismuto. Además, se evidencio una mayor adherencia al tratamiento con la terapia dual ampliada. Por otra parte, la terapia cuádruple con bismuto presentó mayores efectos adversos. La importancia de este estudio es la demostración de que en Colombia la terapia dual puede usarse como terapia de erradicación de primera línea para Helicobacter pylori.
Palabras claves. Helicobacter pylori, terapia cuádruple con bismuto, terapia dual con dosis altas, efectos adversos.
First-Line Eradication of Helicobacter pylori with High-Dose Dual Therapy Versus Quadruple Therapy with Bismuth for 14 Days: A Multicenter, Prospective and Randomized Study
Summary
Introduction. Given the high prevalence of Helicobacter pylori infection worldwide and the high antibiotic resistance for the pathogen, the use of aggressive treatments to eradicate the infection has become necessary. For this reason, the use of extended dual therapy is proposed as first line versus conventional quadruple therapy used to treat this pathology. Objectives. To evaluate and compare the efficacy and safety of quadruple bismuth therapy (BQT) versus high-dose dual therapy (HDT) of esomeprazole and amoxicillin as first-line empirical therapy to eradicate Helicobacter pylori infection. Patients and Methods. Prospective trial that included 266 H. pylori-naive infected patients, randomized to receive either BQT (esomeprazole 40 mg bid, bismuth subsalicylate 262 mg bid, amoxicillin 1 g bid and levofloxacin 500 mg bid) for 14 days or an HDT (esomeprazole 40 mg tid, amoxicillin 1 g tid) for 14 days. Eradication of infectione was assessed through a breath test six to eight weeks after completion of therapy. Adverse events and compliance were assessed with questionnaires carried out by telephone or personal contact. Results. Demographic, clinical and endoscopic characteristics were similar between groups. The intention-to-treat (ITT) eradication rates (133 patients in each group) were 84.9% in the BQT group and 88.7% in the HDT group (p = 0.36). Per protocol eradication rates were 90.3% in BQT and 96.6% in HDT (p = 0.04). The prevalence of side effects after BQT was 36.8%, significantly higher than that of the HDT group (16.5%) (p < 0.001); with a tendency to lower compliance of patients with BQT (p = 0.06). Conclusions. Extended dual therapy induced a significantly higher eradication rate of Helicobacter pylori infection than bismuth-containing quadruple therapy. In addition, it showed a higher compliance rate. On the other hand, quadruple bismuth therapy presented more adverse effects. The importance of this study is the demonstration that dual therapy can be used as first-line eradication therapy for Helicobacter pylori in Colombia.
Keywords. Helicobacter pylori, bismuth quadruple therapy, high dose dual therapy, adverse effects.
Abreviaturas
TCB: Terapia cuádruple con bismuto.
TDA: Terapia dual ampliada.
H. pylori: Helicobacter pylori.
IBP: Inhibidor de bomba de protones.
PAC13: Prueba de aliento con urea C13.
ITT: Intención de tratar.
IC: Intervalo de confianza.
SPSS: Statistical package for social sciences.
Introducción y objetivos
La infección por Helicobacter pylori (H. pylori) afecta a más del 50% de la población y se asocia al desarrollo de la enfermedad ulcerosa péptica, el cáncer gástrico y el linfoma de tejido linfoide asociado a la mucosa gástrica, entre otras enfermedades.1 Su prevalencia en Colombia ha disminuido del 69% en el 2003 al 36,4% en el 2015.2,3
El aumento de la resistencia bacteriana en el mundo, especialmente a la claritromicina,4,5 hace que el tratamiento contra H. pylori sea un reto que requiere usar tratamientos más efectivos según los resultados locales.6 El consenso de Kyoto sugiere usar regímenes empíricos que erradiquen el H. pylori en más del 90%.7 El Consenso Maastricht V realizado en Florencia recomienda la terapia cuádruple con o sin bismuto como tratamiento empírico de primera línea contra el H. pylori, consistente en un inhibidor de la bomba de protones (IBP), amoxicilina, metronidazol y claritromicina durante 10 a 14 días, para lograr una tasa de erradicación superior al 90%.8
Por otro lado, la terapia dual a dosis altas, consistente en la administración de amoxicilina (≥ 2 gr/día) e IBP más de dos veces al día durante 14 días, fue introducida por primera vez a mediados de los años noventa.9 Este esquema ha reportado una mayor eficacia (más del 90%) en estudios recientes,10-13 además ha sido refrendado en dos metaanálisis.14,15
Hasta la fecha, ningún estudio ha evaluado y comparado la eficacia de la terapia cuádruple con bismuto frente a la terapia dual con altas dosis de esomeprazol y amoxicilina en Colombia. Este es el primer ensayo controlado aleatorizado que evalúa y compara la eficacia, efectos adversos y el cumplimiento de la terapia cuádruple con bismuto y de una terapia dual de dosis altas como enfoque empírico de primera línea para erradicar la infección por H. pylori en Colombia.
Pacientes y Métodos
Diseño y población
Ensayo prospectivo aleatorizado y controlado. Se incluyeron 266 pacientes. Los criterios de inclusión fueron: pacientes con manifestaciones dispépticas y biopsias por endoscopía confirmatorias de infección por H. pylori (no se hizo test de ureasa).
El estudio se realizó en tres centros hospitalarios de la ciudad de Medellín, Colombia, entre marzo de 2018 y octubre de 2020. Se obtuvo el consentimiento informado por escrito de todos los participantes antes de prescribir el tratamiento de erradicación.
Los criterios de exclusión fueron: tratamiento previo de erradicación de H. pylori, antecedentes alérgicos conocidos a cualquiera de los medicamentos utilizados en el estudio, uso en los últimos dos meses de IBP, sales de bismuto o antibióticos, cirugía previa del tracto gastrointestinal superior, enfermedades graves (cardiovasculares, pulmonares, renales o hepáticas), una enfermedad maligna durante los cinco años anteriores, adicción al alcohol o a las drogas ilícitas, trastornos psiquiátricos o neurológicos graves, mujeres embarazadas o en período de lactancia, edad menor de 18 o mayor de 70 años y la negativa para firmar el consentimiento informado.
Intervención
Los participantes fueron asignados aleatoriamente a uno de los dos tratamientos mediante una lista generada por el programa EPIDAT 4.2. Se utilizó el módulo de muestreo con la asignación de sujetos a tratamiento, en una relación 1:1. El grupo TDA recibió una terapia dual de altas dosis: esomeprazol 40 mg tres veces al día (30 minutos antes del desayuno, almuerzo y cena) y amoxicilina 1 gr tres veces al día durante 14 días. El grupo TCB recibió esomeprazol 40 mg dos veces al día, 2 tabletas de subsalicilato de bismuto de 262 mg dos veces al día, amoxicilina 1 gr dos veces al día y levofloxacina 500 mg dos veces al día durante 14 días; el esomeprazol y el bismuto se administraron 30 minutos antes del desayuno y la cena; la amoxicilina y la levofloxacina se administraron 30 minutos después del desayuno y la cena. Al final del tratamiento fueron evaluados los acontecimientos adversos y el cumplimiento terapéutico. Los efectos secundarios se valoraron mediante un cuestionario estructurado.
El hábito del cigarrillo se definió como el consumo de más de un paquete de cigarrillos a la semana, y el hábito de alcohol se definió como el consumo de más de 50 g (2 vasos) de alcohol al día en los últimos seis meses. Los participantes con úlceras duodenales y/o gástricas se consideraron como el grupo con úlcera péptica, mientras que aquellos que no tenían úlceras se consideraron como el grupo con dispepsia no ulcerosa.
Seguimiento, efectos adversos y cumplimiento
El personal médico explicó minuciosamente a todos los participantes los regímenes de tratamiento y los posibles efectos adversos asociados. Se entregaron instrucciones, tanto verbales como escritas, sobre la importancia de tomar la medicación en los horarios establecidos, y se les recomendó no suspenderla en caso de presentar efectos adversos leves o moderados. Se aconsejó a los participantes que llamaran al médico (RC, AP) si tenían efectos secundarios graves. Se citó a los pacientes entre una y dos semanas después de finalizado el tratamiento para evaluar el cumplimiento y determinar la incidencia de efectos adversos. Éstos se detectaron mediante un cuestionario con preguntas abiertas, y se agruparon en: leves (sin interferencia en la rutina diaria), moderados (efectos limitados en la rutina diaria), graves (efectos marcados en la rutina diaria y suspensión de la medicación) y serios (muerte, hospitalización, discapacidad o intervención necesaria para la prevención de daños permanentes).
Seis a 8 semanas después del final del tratamiento se realizó una prueba del aliento con urea C13 (PAC13) para evaluar la tasa de erradicación de H. pylori. No se permitió el uso de IBP, bloqueadores del receptor H2, ni de antibióticos durante las cuatro semanas anteriores a la prueba del aliento con urea. El resultado negativo de PAC13 se consideró como una erradicación exitosa de H. pylori. En caso de fracaso de la erradicación (definido como un resultado positivo de la PAC13), los pacientes recibieron un tratamiento de segunda línea.
Análisis estadístico
Se calculó el tamaño de la muestra antes del inicio del estudio, basándose en los datos disponibles en la literatura, asumiendo una tasa de erradicación del 90% para la terapia cuádruple con bismuto y para la terapia dual de dosis alta, para detectar una diferencia del 15% en las tasas de erradicación entre los dos grupos de terapia farmacológica, con una potencia del 80%. Se estimó una pérdida máxima de seguimiento del 10%. El cálculo del tamaño final de la muestra fue 250 pacientes (al menos 130 pacientes por grupo) con un margen de error del 5%. Los resultados de este estudio se analizaron en una población por intención de tratar (ITT) y en una población por protocolo, con un intervalo de confianza (IC) del 95% para cada grupo de tratamiento. El análisis ITT incluyó a todos los pacientes aleatorizados que habían tomado al menos una dosis de la medicación del estudio. El análisis por protocolo incluyó sólo a los pacientes que habían realizado un seguimiento correcto y un cumplimiento de la totalidad del tratamiento con cada medicamento. Para todas las demás variables, se utilizó la prueba exacta de Fisher y la prueba t de Student. Los análisis estadísticos se realizaron mediante el Statistical Package for Social Sciences (SPSS) versión 21 (IBM Corp., Armonk, NY, USA). Un valor p < 0,05 se consideró estadísticamente significativo.
Aspectos éticos
El protocolo del estudio fue aprobado por el Comité de Ética Médica de la Clínica El Rosario, de la ciudad de Medellín, y se llevó a cabo de acuerdo con los principios de la Declaración de Helsinki y las normas de la Buena Práctica Clínica. Los participantes dieron voluntariamente su consentimiento informado para participar en el estudio. Todos los autores tuvieron acceso a los datos del estudio y revisaron y aprobaron el manuscrito final.
Resultados
Características de los pacientes
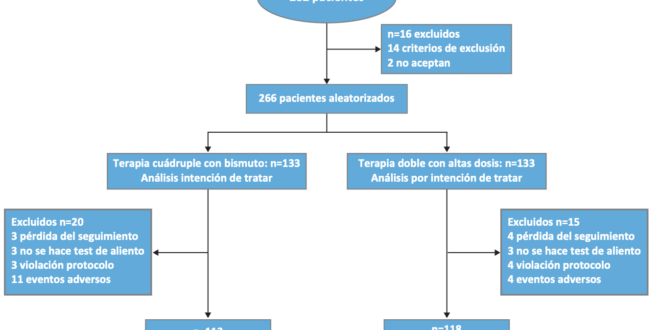
Se evaluaron 282 pacientes para el estudio, de ellos 14 presentaron criterios de exclusión (8 por haber recibido terapia en el último mes con IBP, 2 por haber recibido terapias previas para H. pylori, 2 por alergia a la penicilina, 1 por enfermedad maligna intercurrente, 1 por gastrectomía previa) y 2 no aceptaron participar. En total 266 pacientes fueron asignados al azar al grupo de TDA (n = 133) o al grupo TCB (n = 133). Todos los participantes fueron incluidos en el análisis por intención de tratar (ITT). El diagrama de flujo del estudio se presenta en la Figura 1.
Figura 1. Diagrama de flujo del estudio
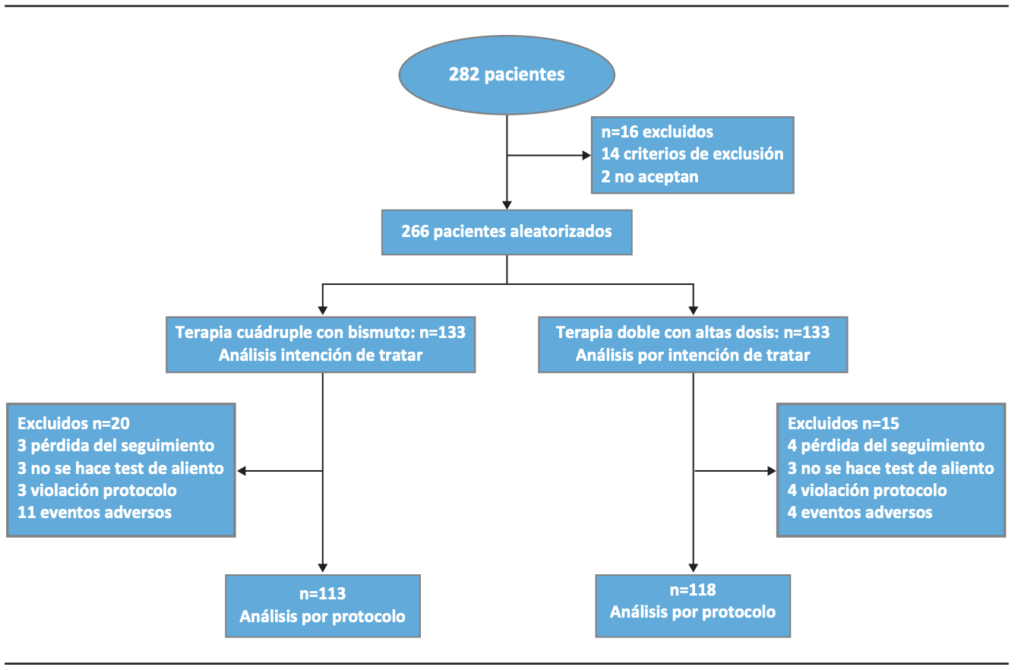
Con respecto al análisis demográfico de los dos grupos de estudio, la evaluación de las diferencias en sexo, edad, índice de masa corporal, antecedentes como tabaquismo y consumo de alcohol, no mostraron diferencias significativas. En cuanto a las características clínicas y endoscópicas, no hubo diferencias significativas entre los grupos terapéuticos. Los datos de referencia previos al tratamiento se presentan en la Tabla 1.
Tabla 1. Características demográficas y endoscópicas de los pacientes
Tasa de erradicación
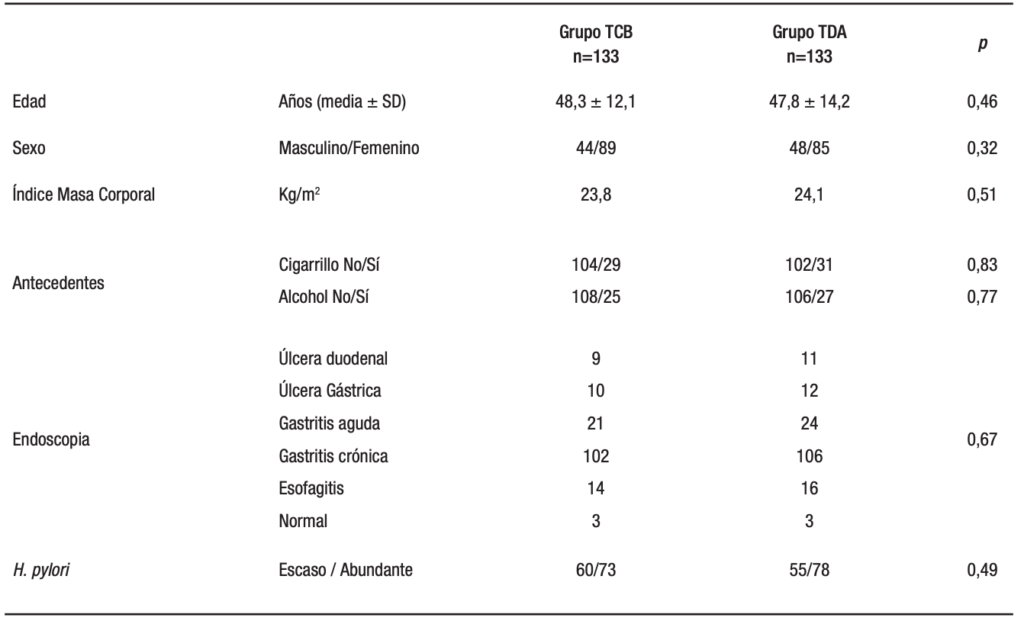
La tasa de erradicación por ITT fue del 84,9% y 88,7% respectivamente en los grupos de TCB y TDA (p = 0,36). La tasa de erradicación por protocolo fue del 90,3% y 95,7% respectivamente en los grupos con TCB y TDA (p = 0,04). Las tasas de erradicación de los dos protocolos mediante el análisis ITT y PP se muestran en la Tabla 2.
Tabla 2. Eficacia en la erradicación del H. pylori de ambos tratamientos
Tasas de eventos adversos y cumplimento de la terapia
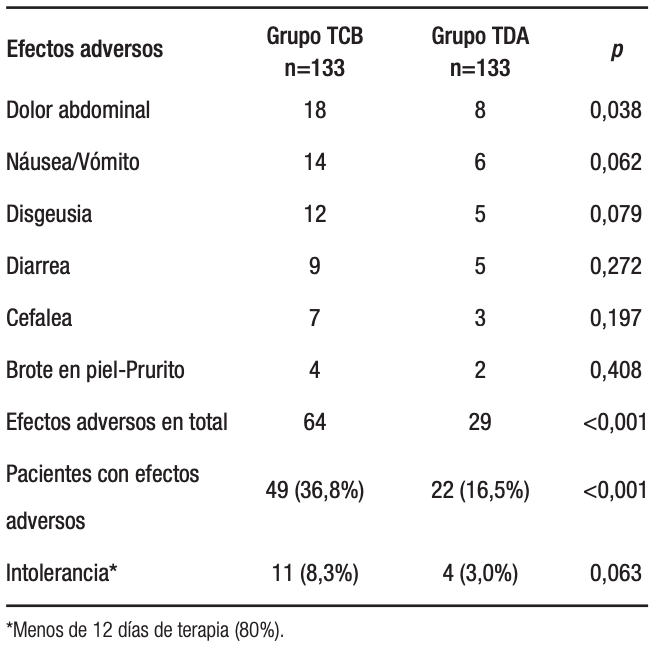
Las tasas de eventos adversos fueron del 16,5% en el grupo TDA y del 36,8% en el grupo TCB (p < 0,01) (Tabla 3). Estos efectos adversos incluyeron dolor abdominal, náuseas y vómitos, disgeusia, diarrea, cefalea, y prurito y/o erupción cutánea. En un grupo de pacientes perturbaron notablemente las actividades diarias, lo que motivó la suspensión de la terapia, con una tasa de intolerancia del 3% para el grupo con TDA y del 8,3% en el grupo con TCB (p = 0,06).
Tabla 3. Efectos adversos y cumplimiento de la terapia
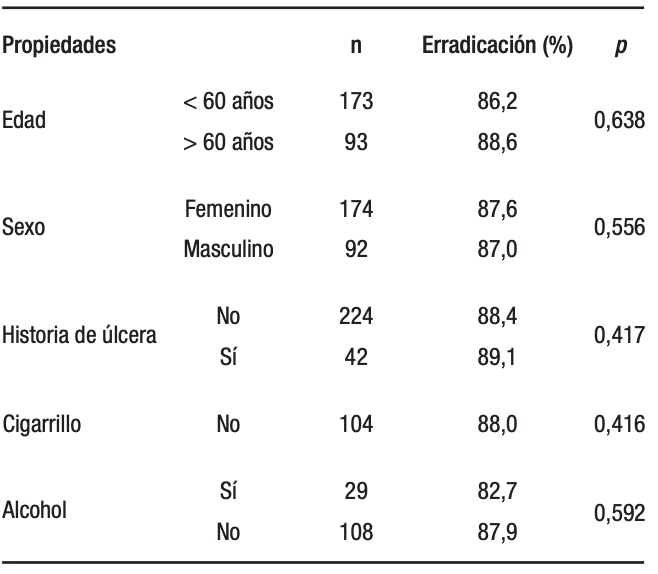
Como se muestra en la Tabla 4, el análisis univariado mostró que no había ningún factor clínico significativo que influyera en la eficacia del tratamiento de erradicación del H. pylori.
Tabla 4. Análisis univariado de los factores clínicos que influyen en la eficacia del tratamiento de erradicación de H. pylori
Discusión
La curación de la infección por H. pylori es un reto, debido a que ninguno de los regímenes terapéuticos propuestos logra la erradicación de la bacteria en todos los casos. Por el contrario, existe evidencia de que la tasa de éxito de las diferentes terapias de primera línea es cada vez menor, por lo que un alto número de pacientes requiere dos o más esquemas de tratamiento.16
Entre los distintos factores que intervienen en el fracaso de la terapia de erradicación, se afirma que ejerce un papel fundamental la resistencia primaria a la claritromicina y al metronidazol, sobre todo cuando coexisten. Sin embargo, incluso después de adoptar el régimen terapéutico de primera línea en función del patrón de resistencia bacteriana, la tasa de curación sigue siendo inferior al 90%.17 Por lo tanto, los regímenes terapéuticos empíricos pueden ser infructuosos, y la combinación de fármacos es motivo de preocupación en la erradicación del H. pylori.18
Desde hace más de treinta años, Bayerdörffer describió la terapia dual con altas dosis para la erradicación del H. pylori.9 Se considera que esta terapia logra una buena tasa de erradicación debido a la baja resistencia de H. pylori a la amoxicilina.8,19,20 Esto se debe principalmente a que las mutaciones simultáneas en múltiples sitios de los genes relacionados con la proteína de unión a la penicilina para dar lugar a una resistencia significativa, es poco frecuente.21 En segundo lugar, la amoxicilina tiene una vida media corta en el plasma, y como antibiótico dependiente del tiempo, su efecto bactericida depende del porcentaje de tiempo de concentración plasmática superior a la concentración mínima inhibitoria. En comparación con el esquema rutinario de dos dosis diarias, el esquema de dosificación de tres o cuatro veces al día dio lugar a un mayor porcentaje de tiempo de concentración plasmática, logrando un mejor efecto bactericida.22 En tercer lugar, el efecto bactericida de la amoxicilina depende del pH, lo que significa que la supresión eficaz del ácido gástrico impide que la amoxicilina se descomponga en el estómago, lo que a su vez aumenta la biodisponibilidad y la concentración plasmática, mejorando la eficacia de la erradicación de H. pylori.23
El efecto inhibidor de los IBP sobre el ácido gástrico se ve afectado por el polimorfismo del gen CYP2C19, y las correspondientes mutaciones puntuales del gen dieron lugar a distintos tipos metabólicos, produciendo diferencias significativas en el efecto de la supresión del ácido gástrico durante la dosificación rutinaria de los IBP.24-26 Cuando los IBP se administran tres a cuatro veces al día, se obtiene un efecto de supresión de la acidez gástrica estable y suficiente, independiente del polimorfismo. Cuando la mediana del pH intragástrico fue > 6 o el pH intragástrico de todo el día fue ≥ 4 en más del 90% del tiempo27 las cepas de H. pylori se encontraron en un estado de crecimiento y reproducción activos y se volvieron más sensibles a la amoxicilina.28
En cuanto a la eficacia, los resultados de este estudio mostraron que la tasa de erradicación por ITT fue del 84,9% para la TCB y 88,7% para la TDA (p = 0,36), mientras que la tasa de erradicación PP fue del 90,3% y 95,7% en los grupos con TCB y TDA respectivamente, significativamente mayor para la TDA (p = 0,04), lo que coincide con lo reportado en los últimos metaanálisis que la comparan con otras terapias de primera línea.15,29
El interés por la terapia dual como tratamiento de primera línea se revitalizó en la última década; los datos están resumidos en la Tabla 5. No fue posible realizar un análisis de datos agrupados fiable debido a que se probaron diferentes IBP, dosis y duración de la terapia.
Tabla 5. Estudios con tasas de erradicación con terapia dual alta como primera línea de tratamiento
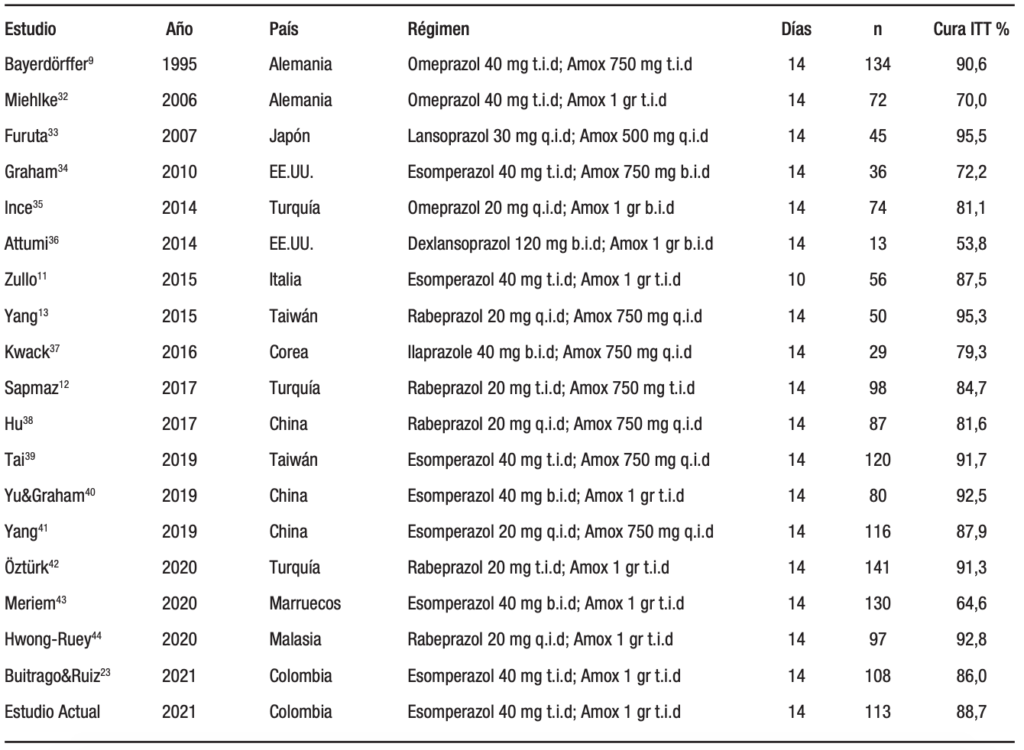
Un estudio realizado en 2019 por el Graham y col.30 mostró una alta tasa de erradicación del H. pylori con la terapia dual aumentada o de altas dosis, con o sin bismuto (por protocolo 93,3% versus 96,1%; p = 0,494 y por intención de tratar 88,8% versus 92,5%; p = 0,416); se encontró que la adición del bismuto solo fue beneficiosa para el subgrupo de pacientes fumadores. El artículo concluye que la terapia dual de altas dosis de catorce días fue eficaz y segura para el tratamiento de primera línea, en una región de alta prevalencia de resistencia a los antibióticos. Esta condición de región con alta prevalencia de resistencia a los antibióticos se aplica a nuestra localidad, e incluso en Bogotá, como lo avala un estudio con coautoría de Graham.31
La resistencia a los antibióticos y el mal cumplimiento son los factores de riesgo más importantes para el fracaso de la erradicación. Dado que las cepas siguen siendo sensibles a la amoxicilina y la resistencia secundaria sigue siendo rara, la terapia dual es un régimen de erradicación que vale la pena recomendar. A diferencia de la claritromicina/levofloxacina, la amoxicilina no es susceptible a los factores derivados de las variaciones entre las regiones, la población y los antecedentes de medicación. La aplicación de la terapia dual ayuda a prevenir el uso irracional de los antibióticos y frena la tendencia al aumento de la resistencia a los medicamentos. En teoría, la reducción de los tipos de antibióticos es útil para mitigar los posibles efectos adversos de la erradicación de la infección por H. pylori, como la alteración de la flora intestinal, la resistencia secundaria de otras bacterias y el impacto en el metabolismo corporal. Aunque la terapia dual consiste sólo en dos fármacos, y tanto el IBP como la amoxicilina tienen buena seguridad y tolerabilidad, la dosificación frecuente podría tener un impacto adverso en el cumplimiento. En este estudio, se logró un buen cumplimiento mediante una explicación y comunicación eficaces antes de indicar la medicación.
Recientemente se ha aprobado el vonoprazan, un bloqueador de ácido competitivo con el potasio, para tratar la infección por H. pylori; se lo considera un agente más rápido, potente y de acción más prolongada que los IBP tradicionales.45 Un estudio retrospectivo realizado en una pequeña muestra en Japón demostró que la terapia dual con vonoprazan 20 mg dos veces por día y amoxicilina 500 mg tid durante 7 días ha logrado una tasa de erradicación del 92,9% en el análisis ITT.46 Por lo tanto, es imperativo realizar más ensayos clínicos para evaluar la eficacia de la terapia dual sustituyendo los IBP tradicionales por vonoprazan.
En cuanto a los efectos adversos, en la TDA se presentan en menor medida que en las terapias cuádruples, independientemente de la duración, mientras que la terapia cuádruple con bismuto durante 14 días representó mayores efectos adversos que la terapia secuencial, la terapia híbrida y la terapia concomitante por más de 10 días.
El presente estudio tiene como limitaciones que se ha realizado sólo en tres centros, y se necesitan estudios multicéntricos para determinar la eficacia de la erradicación en diferentes regiones, poblaciones y condiciones en el futuro. En segundo lugar, en este estudio no se midieron el pH intragástrico ni la concentración plasmática de amoxicilina en los pacientes, por lo que no se puede extraer ninguna conclusión sobre la coherencia entre la eficacia de erradicación y el mecanismo bactericida de la terapia dual. En tercer lugar, debe confirmarse si los resultados de este estudio son adecuados para otras poblaciones (europeas y americanas) con la realización de nuevas investigaciones.
Conclusiones
En comparación con la terapia triple más bismuto, la terapia dual de altas dosis por 14 días con esomeprazol (40 mg tres veces por día) y amoxicilina (1000 mg tres veces por día) ha logrado mayores tasas de erradicación, ha presentado menos eventos adversos y un mejor cumplimiento en pacientes tratados por infección por H. pylori. Se evidenció una tendencia a una menor tasa de cumplimiento con una prevalencia de eventos adversos significativamente mayor con la terapia cuádruple con bismuto.
Agradecimientos. Especial reconocimiento al Proyecto sostenibilidad de la Vicerrectoría de Investigación de la Universidad de Antioquia, Medellín-Colombia, por su apoyo.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos, las tablas y las figuras presentes en el manuscrito son originales y fueron realizados en sus instituciones pertenecientes.
Financiamiento. Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Castaño Llano R, Piñeres A, Toro Calle J y col. Erradicación de primera línea de Helicobacter pylori con terapia dual de altas dosis versus terapia cuádruple con bismuto por 14 días: estudio multicéntrico, prospectivo y aleatorizado. Acta Gastroenterol Latinoam. 2022; 52(2):241-250. https://doi.org/10.52787/agl.v52i2.179
Referencias
- Jessurun J. Helicobacter pylori: an evolutionary perspective. Histopathology. 2021 Jan 1;78(1):39-47.
- Bravo LE, Cortes A, Carrascal E, Jaramillo R, Garcia LS, Bravo PE, et al. Helicobacter pylori: patología y prevalencia en biopsias gástricas en Colombia. Colombia Médica. 2003;34(3):124-31.
- Correa G. S, Cardona A. AF, Correa G. T, Correa L. LA, García G. HI, Estrada M. S. Prevalence of Helicobacter pylori and histopathological features in gastric biopsies from patients with dyspeptic symptoms at a referral center in Medellin. Revista Colombiana de Gastroenterologia. 2016 Jan 1;31(1):9-15.
- Roldan I, Castaño R, Navas M. Mutaciones en el gen ARNr 23S de Helicobacter pylori asociadas con resistencia a claritromicina en pacientes atendidos en una unidad de endoscopia en Medellín, Colombia. Biomédica. 2019 Aug 1;39(Supl 2):117-29.
- Castaño R, Ruiz M, Martínez C, Naranjo F, Campuzano-Maya G, Sanín E, et al. Evaluación para comparar dos esquemas de terapia estándar (7 frente a 10 días) contra el Helicobater pylori, con seguimiento clínico a un año. Rev Colomb Gastroenterol. 2012;27(7):80-7.
- Castaño R, Ruiz M, Campuzano-Maya G, Sanín F, Puerta J, Calvo-Betancur V, et al. Estudio aleatorizado comparando una primera línea de terapia estándar contra H. pylori con claritromicina versus levofloxacina por 10 días. Rev Colomb Gastroenterol. 2013;28(2):101-8.
- Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015 Sep;64(9):1353-67.
- Malfertheiner P, Megraud F, ’morain O. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 2017;66:6-30.
- Bayerdörffer E, Miehlke S, Mannes GA, Sommer A, Höchter W, Weingart J, et al. Double-blind trial of omeprazole and amoxicillin to cure Helicobacter pylori infection in patients with duodenal ulcers. Gastroenterology. 1995;108(5):1412-7.
- Miehlke S, Mannes GA, Lehn N, Hele C, Stolte M, Bayerdörffer E. An increasing dose of omeprazole combined with amoxycillin cures Helicobacter pylori infection more effectively. Alimentary Pharmacology and Therapeutics. 1997;11(2):323-9.
- Zullo A, Ridola L, De Francesco V, Gatta L, Hassan C, Alvaro D, et al. High-dose esomeprazole and amoxicillin dual therapy for first-line Helicobacter pylori eradication: A proof of concept study. Annals of Gastroenterology. 2015;28(4):448-51.
- Sapmaz F, Kalkan IH, Atasoy P, Basyigit S, Guliter S. A Non-Inferiority Study : Modified Dual Therapy Consisting Higher Doses of Rabeprazole Is as Successful as Standard Quadruple Therapy in Eradication of Helicobacter pylori. 2015;6:1-6.
- Yang JC, Lin CJ, Wang HL, Chen J De, Kao JY, Shun CT, et al. High-dose dual therapy is superior to standard first-line or rescue therapy for Helicobacter pylori infection. Clinical Gastroenterology and Hepatology. 2015;13(5):895-905.e5.
- Zhu YJ, Zhang Y, Wang TY, Zhao JT, Zhao Z, Zhu JR, et al. High dose PPI-amoxicillin dual therapy for the treatment of Helicobacter pylori infection: a systematic review with meta-analysis. Therapeutic Advances in Gastroenterology. 2020;13:1-12.
- Yang X, Wang JX, Han SX, Gao CP. High dose dual therapy versus bismuth quadruple therapy for Helicobacter pylori eradication treatment: A systematic review and meta-analysis. Medicine (United States). 2019;98(7):1-7.
- Shah SC, Iyer PG, Moss SF. AGA Clinical Practice Update on the Management of Refractory Helicobacter pylori Infection: Expert Review. Gastroenterology. 2021 Apr 1;160(5):1831-41.
- Zagari RM, Frazzoni L, Marasco G, Fuccio L, BAZZOLi F. Treatment of Helicobacter pylori infection: A clinical practice update. Vol. 112, Minerva Medica. Edizioni Minerva Medica; 2021. p. 281-7.
- Zullo A. The current role of dual therapy for treatment of Helicobacter pylori: Back to the future? European Journal of Gastroenterology and Hepatology. 2020;32(5):555-6.
- Shah SC, Iyer PG, Moss SF. AGA Clinical Practice Update on the Management of Refractory Helicobacter pylori Infection: Expert Review. Gastroenterology. 2021;160(5):1831-41.
- Caldas M, Pérez-Aisa Á, Castro-Fernández M, Bujanda L, Lucendo AJ, Rodrigo L, et al. European registry on Helicobacter pylori management: Effectiveness of first and second-line treatment in Spain. Antibiotics. 2021;10(1):1-15.
- Megraud F, Bruyndonckx R, Coenen S, Wittkop L, Huang TD, Hoebeke M, et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 2021 May 10.
- Yun J, Wu Z, Qi G, Han T, Zhang D. The high-dose amoxicillin-proton pump inhibitor dual therapy in eradication of Helicobacter pylori infection. Expert Review of Gastroenterology and Hepatology. 2021;15(2):149-57.
- Buitrago-Laguado EJ, Ruiz-Linares CE. Tesis – Eficacia de la terapia dual para erradicación de H. pylori en una población colombiana. [Bogotá]: Universidad Nacional de Colombia; 2021.
- Lima JJ, Thomas CD, Barbarino J, Desta Z, Van Driest SL, El Rouby N, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for CYP2C19 and Proton Pump Inhibitor Dosing. Clinical Pharmacology and Therapeutics. 2020;0(0):1-7.
- Arévalo-Galvis A, Otero-Regino WA, Ovalle-Celis GN, Rodríguez-Gómez ER, Trespalacios-Rangel AA. Prevalence of CYP2C19 polymorphism in Bogotá, Colombia: The first report of allele *17. PLoS ONE. 2021;16(1 January 2021):1-12.
- Díaz-Ordóñez L, Ramírez-Montaño D, Candelo E, González-Restrepo C, Silva-Peña S, Rojas CA, et al. Evaluation of CYP2C19 Gene Polymorphisms in Patients with Acid Peptic Disorders Treated with Esomeprazole. Pharmacogenomics and Personalized Medicine. 2021 Apr;Volume 14:509-20.
- Sahara S, Sugimoto M, Uotani T, Ichikawa H, Yamade M, Kagami T, et al. Potent gastric acid inhibition over 24 hours by 4-times daily dosing of esomeprazole 20 mg. Digestion. 2015 Jun 15;91(4):277-85.
- Wang YC, Chen YP, Ho CY, Liu TW, Chu CH, Wang HY, et al. The Impact of Gastric Juice pH on the Intraluminal Therapy for Helicobacter pylori Infection. J Clin Med. 2020 Jun 14;9(6):1852.
- Zhu YJ, Zhang Y, Wang TY, Zhao JT, Zhao Z, Zhu JR, et al. High dose PPI-amoxicillin dual therapy for the treatment of Helicobacter pylori infection: a systematic review with meta-analysis. Vol. 13, Therapeutic Advances in Gastroenterology. SAGE Publications Ltd; 2020.
- Yu L, Luo L, Long X, Liang X, Ji Y, Graham DY, et al. High-dose PPI-amoxicillin dual therapy with or without bismuth for first-line Helicobacter pylori therapy: A randomized trial. Helicobacter. 2019 Aug 1;24(4).
- Trespalacios-Rangél AA, Otero W, Arévalo-Galvis A, Poutou-Piñales RA, Rimbara E, Graham DY. Surveillance of levofloxacin resistance in helicobacter pylori isolates in Bogotá-Colombia (2009-2014). PLoS ONE. 2016 Jul 1;11(7).
- Miehlke S, Hansky K, Schneider-Brachert W, Kirsch C, Morgner A, Madisch A, et al. Randomized trial of rifabutin-based triple therapy and high-dose dual therapy for rescue treatment of Helicobacter pylori resistant to both metronidazole and clarithromycin. Alimentary Pharmacology and Therapeutics. 2006 Jul;24(2):395-403.
- Furuta T, Shirai N, Kodaira M, Sugimoto M, Nogaki A, Kuriyama S, et al. Pharmacogenomics-based tailored versus standard therapeutic regimen for eradication of H. pylori. Clinical Pharmacology and Therapeutics. 2007 May 10;81(4):521-8.
- Graham DY, Javed SU, Keihanian S, Abudayyeh S, Opekun AR. Dual proton pump inhibitor plus amoxicillin as an empiric anti-H. pylori therapy: Studies from the United States. Journal of Gastroenterology. 2010;45(8):816-20.
- Ince AT, Tozlu M, Baysal B, Şentürk H, Arici S, Oz̈den A. Yields of dual therapy containing high-dose proton pump inhibitor in eradication of H. pylori positive dyspeptic patients. Hepato-Gastroenterology. 2014 Jul 1;61(133):1454-8.
- Attumi TA, Graham DY. High-Dose Extended-Release Lansoprazole (Dexlansoprazole) and Amoxicillin Dual Therapy for Helicobacter pylori Infections. Helicobacter. 2014;19(4):319-22.
- Kwack W, Lim Y, Lim C, Graham DY. High Dose Ilaprazole/Amoxicillin as First-Line Regimen for Helicobacter pylori Infection in Korea. Gastroenterol Res Pract. 2016;2016:1648047.
- Zhou C, Hu Y, Xiao Y, Yin W. Current treatment of tracheoesophageal fistula. Ther Adv Respir Dis. 2017;11(4):173-80.
- Tai WC, Liang CM, Kuo CM, Huang PY, Wu CK, Yang SC, et al. A 14 day esomeprazole- And amoxicillin-containing high-dose dual therapy regimen achieves a high eradication rate as first-line anti-Helicobacter pylori treatment in Taiwan: a prospective randomized trial. Journal of Antimicrobial Chemotherapy. 2019;74(6):1718-24.
- Yu L, Luo L, Long X, Liang X, Ji Y, Graham DY, et al. High-dose PPI-amoxicillin dual therapy with or without bismuth for first-line Helicobacter pylori therapy: A randomized trial. Helicobacter. 2019 Aug 1;24(4).
- Yang J, Zhang Y, Fan L, Zhu YJ, Wang TY, Wang XW, et al. Eradication Efficacy of Modified Dual Therapy Compared with Bismuth-Containing Quadruple Therapy as a First-Line Treatment of Helicobacter pylori. American Journal of Gastroenterology. 2019;114(3):437-45.
- Öztürk K, Kurt Ö, Çelebi G, Şarlak H, Karakaya MF, Demirci H, et al. High-dose dual therapy is effective as first-line treatment for Helicobacter pylori infection. Turkish Journal of Gastroenterology. 2020;31(3):234-8.
- Meriem Z, Elmekkaoui A, Bouqfar M, Zazour A, Khannoussi W, Kharrasse G, et al. Non-Bismuth Quadruple Therapy, Sequential Therapy or High-Dose Esomeprazole and Amoxicillin Dual Therapy for First-Line Helicobacter pylori Eradication: A Prospective Randomized Study. Cureus. 2020;12(12).
- Hwong-Ruey Leow A, Chang JV, Goh KL. Searching for an optimal therapy for H. pylori eradication: High-dose proton-pump inhibitor dual therapy with amoxicillin vs. standard triple therapy for 14 days. Helicobacter. 2020;25(5):10-4.
- Abadi ATB, Ierardi E. Vonoprazan and Helicobacter pylori treatment: A lesson from Japan or a limited geographic phenomenon? Vol. 10, Frontiers in Pharmacology. Frontiers Media S.A.; 2019.
- Furuta T, Yamade M, Kagami T, Uotani T, Suzuki T, Higuchi T, et al. Dual Therapy with Vonoprazan and Amoxicillin Is as Effective as Triple Therapy with Vonoprazan, Amoxicillin and Clarithromycin for Eradication of Helicobacter pylori. Vol. 101, Digestion. S. Karger AG; 2020. p. 743–51.
Correspondencia: Juan Esteban Puerta Botero
Correo electrónico: jepuerta96@gmail.com
Acta Gastroenterol Latinoam 2022;52(2):241-250
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE