Jorge A Olmos1 ID· John E Pandolfino2 ID· María M Piskorz3 ID· Natalia Zamora4 ID· Miguel A Valdovinos Díaz5 ID· José M Remes Troche6 ID· Mauricio Guzmán7 ID· Albis Hani8 ID· Luis R Valdovinos García9 ID· Hannah Pitanga Lukashok10 ID· Gerson Domingues11 ID· Eduardo Vesco12 ID· Mariel Mejia Rivas13 ID· Luis F Pineda Ovalle14 ID· Daniel Cisternas15 ID· Marcelo Vela16 ID
1 Jefe Sector Neurogastroenterología del Hospital de Clínicas José de San Martín, Universidad de Buenos Aires. Buenos Aires, Argentina.
2 Profesor de Medicina y jefe de Gastroenterología y Hepatología en la Facultad de Medicina Feinberg de la Universidad Northwestern. Chicago (IL), Estados Unidos.
3 Médica de planta del Sector Neurogastroenterología del Hospital de Clínicas José de San Martín, Universidad de Buenos Aires. Buenos Aires, Argentina.
4 Médica reumatóloga y coordinadora de las Guías de Práctica Clínica de la Sociedad Argentina de Reumatología. Reumatóloga de planta en el Hospital San José de Pergamino. Buenos Aires, Argentina.
5 Profesor titular de Gastroenterología. UNAM. Jefe del Laboratorio de Motilidad GI. Departamento de Gastroenterología, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Ciudad de México, México.
6 Jefe del Laboratorio de Fisiología Digestiva y Motilidad Gastrointestinal. Director Instituto de Investigaciones Médico Biológicas de la Universidad Veracruzana. Veracruz, México. Director Medical Biological Research Institute.
7 Jefe de Unidad de Neurogastroenterología, Servicio de Gastroenterología. Hospital San Martín de La Plata. Buenos Aires, Argentina.
8 Profesora titular Medicina Interna y Gastroenterología. Hospital San Ignacio-Pontificia Universidad Javeriana. Bogotá, Colombia. Presidente Sociedad Latinoamericana Neurogastroenterología.
9 Adscripto del Laboratorio de Motilidad Gastrointestinal Fundación Clínica Médica Sur. Ciudad de México. México.
10 Jefa del Servicio de Motilidad Digestiva Instituto Ecuatoriano de Enfermedades Digestivas – IECED. Guayaquil, Ecuador.
11 Profesor adjunto de Gastroenterología. Universidad Estatal de Río de Janeiro. Río de Janeiro, Brasil.
12 Médico gastroenterólogo. Jefe de la Unidad de Neuromotilidad de la clínica Angloamericana. Lima, Perú. Profesor invitado de la Universidad Nacional Mayor de San Marcos. Lima, Perú.
13 Médica adscripta del Servicio de Medicina Interna, Gastroenterología y Endoscopía Digestiva, Hospital Vivian Pellas. Managua, Nicaragua.
14 Jefe del Servicio de Neurogastroenterología y Motilidad Instituto Gut Médica. Bogotá, Colombia.
15 Jefe del Laboratorio de Fisiología Digestiva. Clínica Alemana de Santiago, Facultad de Medicina. Universidad del Desarrollo. Clínica Alemana. Santiago de Chile, Chile.
16 Profesor de Medicina y Director de Patología Esofágica. División de Gastroenterología y Hepatología, Clinica Mayo. Scottsdale, Arizona, Estados Unidos.
Acta Gastroenterol Latinoam 2022;52(2):175-240
Recibido: 10/05/2022 / Aceptado: 12/06/2022 / Publicado online el 27/06/2022 / https://doi.org/10.52787/agl.v52i2.210
Resumen
La enfermedad por reflujo gastroesofágico (ERGE) es sumamente prevalente en nuestro medio. Sus síntomas son variados y los mecanismos fisiopatológicos son múltiples. Por lo tanto, el diagnóstico de esta entidad suele ser complejo. Han sido descriptos una serie de métodos diagnósticos. No obstante, el patrón de oro continúa siendo el tiempo de exposición ácida, medido durante el monitoreo ambulatorio de reflujo a través de pH-metría. El objetivo de este primer consenso latinoamericano fue evaluar críticamente, sobre la base de las mejores evidencias disponibles a la fecha, los diferentes métodos diagnósticos propuestos para la ERGE y emitir recomendaciones consensuadas luego de la discusión entre un grupo de expertos y una votación. Este consenso fue desarrollado por un grupo de expertos a partir de una búsqueda sistemática de la literatura y utilizando la metodología GRADE (Grading of Recommendations Assessment, Development and Evaluation) para la evaluación de la calidad de la evidencia y la decisión de la fuerza de recomendación. Se emitieron recomendaciones en cuanto a la utilidad de diferentes métodos diagnósticos en relación con la ERGE.
Palabras claves. Enfermedad por reflujo gastroesofágico, monitoreo ambulatorio de reflujo.
Latin American Consensus on the Diagnosis of Gastroesophageal Reflux Disease
Summary
Gastroesophageal reflux disease (GERD) is very common in Latin America. GERD symptoms can vary widely, and there are multiple pathophysiological mechanisms underlying the disease. Therefore, diagnosing GERD can be a complex process, and a diverse set of diagnostic tools has been described. However, the diagnostic gold standard continues to be esophageal acid exposure time measured during ambulatory reflux monitoring. The goal of this Latin American consensus was to assess the various diagnostic tools available for GERD, based on the best current evidence, and to provide consensus recommendations following discussion and voting by experts in the field. This consensus was developed by a group of experts based on a systematic search of the literature, using GRADE (Grading of Recommendations Assessment, Development and Evaluation) methodology to assess the quality of the evidence and assign strength for each recommendation regarding the utility of different GERD diagnostic tools. Este documento es avalado por la siguientes sociedades científicas: Sociedad Argentina de Gastroenterología (SAGE), American Neurogastroenterology and Motility Society (ANMS), Asociación Colombiana de Gastroenterología, Asociación Mexicana de Gastroenterología (AMG), Federação Brasileira de Gastroenterologia (FBG), Sociedad Chilena de Gastroenterología (SChGE), Sociedad de Gastroenterología del Perú, Organización Panamericana de Gastroenterología (OPGE).
Keywords. Gastroesophageal reflux disease, ambulatory reflux monitoring.
Este documento es avalado por la siguientes sociedades científicas: Sociedad Argentina de Gastroenterología (SAGE), American Neurogastroenterology and Motility Society (ANMS), Asociación Colombiana de Gastroenterología, Asociación Mexicana de Gastroenterología (AMG), Federação Brasileira de Gastroenterologia (FBG), Sociedad Chilena de Gastroenterología (SChGE), Sociedad Ecuatoriana de Gastroenterología, Organización Panamericana de Gastroenterología (OPGE).
Abreviaturas
ERGE: Enfermedad por reflujo gastroesofágico.
DTNC: Dolor torácico no cardiogénico.
TEA: Tiempo de exposición ácida.
PICO: Siglas en inglés de población, intervención, comparación y resultados.
RR: Riesgo de ratios.
IC: Intervalo de confianza.
IBP: Inhibidores de la bomba de protones.
EGD: esofagogastroduodenoscopía
MII-pH: Impedancia intraluminal multicanal con pH-metría.
RDQ: Cuestionario de enfermedad por reflujo.
GSRS: Escala de calificación de síntomas gastrointestinales.
GIS: Escala de impacto de la enfermedad por reflujo gastroesofágico.
EE: Esofagitis erosiva.
LA: Los Ángeles.
VPN: Valor predictivo negativo.
VPP: Valor predictivo positivo.
ERNE: Enfermedad por reflujo no erosiva.
H2RA: Antagonistas del receptor H2.
EIE: Espacio intercelular del epitelio esofágico.
LR: Siglas en inglés de likelihood ratio.
SAP: Siglas en inglés de probabilidad de asociación de síntomas.
IS: Índice sintomático.
pH-CI: pH-metría con cápsula inalámbrica.
SEE: Síndromes extraesofágicos.
RLF: Reflujo laringofaríngeo.
SH: Scores histológicos.
DIS: Siglas en inglés de espacios intercelulares dilatados.
BID: Siglas en inglés de dos veces al día.
QID: Siglas en inglés de una vez al día.
ONG: Oído, nariz y garganta.
ACG: Siglas en inglés de Colegio Americano de Gastroenterología.
AGA: Siglas en inglés de Asociación Americana de Gastroenterología.
NBI: Siglas en inglés de imagen de banda estrecha.
pH-C: pH-metría con catéter.
PSPW: Siglas en inglés de onda peristáltica inducida por deglución post-reflujo.
PSPWI: Índice de PSPW.
IBNM: Impedancia basal nocturna media.
IBM: Impedancia basal de la mucosa.
HRM: Siglas en inglés de manometría de alta resolución.
UEG: Unión esofagogástrica.
EEI: Esfínter esofágico inferior.
DC: Diafragma crural.
MEI: Motilidad esofágica inefectiva.
PB: Presión basal.
RTEEI: Relajación transitoria del esfínter esofágico inferior.
HRM-IMP: Siglas en inglés de manometría esofágica de alta resolución combinada con impedanciometría.
EG: Eructos gástricos.
ESG: Eructos supragástricos.
Confección de preguntas PICO
Jorge Atilio Olmos (JAO)
John Eric Pandolfino (JEP)
María Marta Piskorz (MMP)
Mauricio Guzmán (MG)
Albis Hani (AH)
Hannah Pitanga Lukashok (HPL)
José María Remes Troche (JMRT)
Miguel Ángel Valdovinos Díaz (MAVD)
Luis Raúl Valdovinos García (LRVG)
Eduardo Vesco (EV)
Luis Fernando Pineda Ovalle (LFPO)
Daniel Cisternas (DC)
Gerson Domingues (GD)
Mariel Mejía Rivas (MMR)
Marcelo Vela (MV)
Búsqueda bibliográfica
Natalia Zamora (NZ)
Grupo de metodología GRADE
Natalia Zamora (NZ)
Juan P. Stefanolo (JPS)
Panel de expertos
Jorge A. Olmos
John Pandolfino
María Marta Piskorz
Mauricio Guzmán
Albis Hani
Hannah Pitanga Lukashok
José María Remes Troche
Miguel Ángel Valdovinos Díaz
Luis Raúl Valdovinos Díaz
Eduardo Vesco
Luis Fernando Pineda Ovalle
Daniel Cisternas
Gerson Domingues
Mariel Mejía Rivas
Marcelo Vela
Redacción de las recomendaciones
Jorge A. Olmos
María M. Piskorz
Revisores
Marcelo Vela
John E. Pandolfino
Resumen de todas las recomendaciones
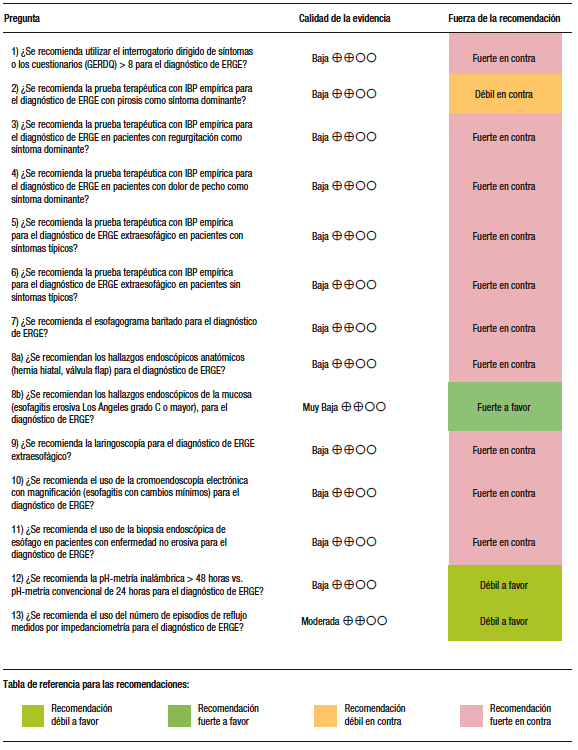
Resumen de todas las recomendaciones
Introducción
Objetivo y metodología
Los síntomas de la enfermedad por reflujo gastroesofágico (ERGE) son sumamente prevalentes en nuestro medio. A pesar de la escasez de datos en Latinoamérica, un estudio realizado en la Argentina reportó un 23% de prevalencia de síntomas típicos de ERGE (pirosis, regurgitación) frecuentes (al menos una vez por semana).1 Esta prevalencia resultó ser de las más altas del mundo, junto con los Estados Unidos y el Reino Unido, entre otros.2 Sin embargo, otro estudio realizado en Colombia reportó una prevalencia de síntomas frecuentes de ERGE del 11,98%.3
Los síntomas de ERGE son varios e incluyen la pirosis y la regurgitación (síntomas esofágicos típicos), el dolor torácico no cardiogénico (DTNC) y algunos síntomas extraesofágicos como la tos, la disfonía, el carraspeo y el globo faríngeo.4 Por otro lado, existen algunos confundidores de la ERGE, como los eructos supragástricos y el síndrome de rumiación.5
Los mecanismos que llevan a la generación de estos síntomas son también varios y a veces complejos, e incluyen no solamente defectos anatómicos y alteraciones fisiológicas, sino también hipersensibilidad e hipervigilancia en algunos pacientes.6 Por ello, es importante recordar que los síntomas debidos a reflujo gastroesofágico dependen no solo de la intensidad del estímulo ocurrido en el esófago, sino también del grado de sensibilidad del individuo en ese momento. El flujo de información aferente desde el esófago hasta la corteza cerebral ocurre a través de diversas neuronas, cada una de ellas susceptible de ser modulada.7,8 La determinación del grado de sensibilización de un individuo dado es difícil y, habitualmente, en la práctica clínica no están disponibles métodos diagnósticos para medir o confirmar la presencia de hipersensibilidad. En el ámbito clínico, por lo general, se asume que un proceso de hipersensibilidad está contribuyendo a los síntomas si los métodos diagnósticos habituales son negativos para evidencia de reflujo patológico.
El diagnóstico de ERGE, por lo tanto, es mucho más difícil de lo que se cree habitualmente.9
El objetivo de este primer consenso latinoamericano fue el de evaluar críticamente, sobre la base de las mejores evidencias disponibles a la fecha, los diferentes métodos diagnósticos propuestos para la ERGE y emitir recomendaciones consensuadas luego de la discusión entre un grupo de expertos y una votación.
A lo largo de todo el documento, la variable utilizada como patrón de oro para definir la ERGE ha sido el tiempo de exposición ácida (TEA), medido durante pH-metría ambulatoria. Esta es una variable acerca de la cual existe evidencia acumulada durante más de treinta años. Se ha demostrado que es la de mayor reproducibilidad entre las variables de la pH-metría.10 Además, se ha demostrado consistentemente que predice la respuesta al tratamiento médico11-13 y quirúrgico.14-16 Más importante aún, se ha demostrado que es un predictor de respuesta al tratamiento independientemente del resultado de las otras múltiples variables utilizables para diagnosticar la ERGE.12,15,16
Hay que tener en cuenta que los puntos de corte para definir la ERGE sobre la base del TEA han variado. Hasta el consenso de Lyon, se consideraba patológico cuando era mayor al 4,0% del tiempo total. El reciente consenso de Lyon sugiere establecer el diagnóstico de ERGE cuando el TEA es mayor al 6,0% y descartarlo si es menor al 4,0%, estableciendo un “área gris” entre TEA 4%-6%, en la que no está aún establecido con certeza el diagnóstico de ERGE.17 Esta sugerencia ha tenido un enorme impacto en la práctica clínica y en el desarrollo de guías clínicas, pues no permite el uso de la enorme mayoría de la evidencia previa basada en un corte único de TEA de alrededor del 4,0%, generando además un subgrupo específico de pacientes, de “área gris”, que requieren ser estudiados dirigidamente en investigaciones futuras.
Es en este contexto en el que se desarrolla este consenso latinoamericano de ERGE. Este documento es el fruto de casi dos años de trabajo de revisión de la literatura e intenta ser una guía de manejo diagnóstico de la ERGE en Latinoamérica, considerando las realidades locales.
Metodología
Equipos involucrados
Este consenso fue desarrollado por dos grupos con diferentes funciones: un equipo de metodología encargado de las búsquedas bibliográficas y del desarrollo de las guías, y otro grupo de panel de expertos, quienes realizaron las preguntas de relevancia clínica y llevaron a cabo el proceso de votación.
Las búsquedas bibliográficas fueron efectuadas por una experta en metodología GRADE (NZ), mientras que el equipo para llevar a cabo la revisión sistemática de la literatura estuvo conformado por dos metodólogos (NZ, JPS). Además, este equipo llevó a cabo la evaluación de calidad de los artículos y la creación de tablas GRADE (Grading of Recommendations Assessment, Development, and Evaluation) y apéndices.
El grupo de panel de expertos no estuvo involucrado en el proceso de revisión de la literatura y estuvo conformado por quince gastroenterólogos con experiencia clínica en la enfermedad por reflujo gastroesofágico.
Ambos equipos declararon no presentar conflictos de interés relevantes para el desarrollo de las guías.
Desarrollo de las preguntas PICO
El panel de expertos llevó a cabo el proceso de selección de las preguntas importantes relacionadas con el diagnóstico de la enfermedad por reflujo gastroesofágico para el armado de las preguntas en formato PICO (población, intervención, comparación y resultados o desenlaces).
Con respecto a las intervenciones y los comparadores, fueron discutidos y seleccionados entre ambos equipos, para poder contar con un adecuado balance entre factibilidad y relevancia clínica.
Revisión sistemática de la literatura
Se realizaron revisiones sistemáticas de la literatura para identificar la evidencia relevante a las preguntas PICO. Las bases de datos utilizadas fueron MedLine (PubMed), Lilacs y biblioteca Cochrane. Además, la literatura gris fue obtenida, en mayor medida, de resúmenes de congresos. Las revisiones fueron realizadas empleando términos específicos y palabras clave relacionadas con los dominios de interés. Se excluyeron las revisiones narrativas, los reportes de casos y los editoriales. Las búsquedas fueron ejecutadas hasta mayo de 2021.
Selección de estudios
El proceso de selección de artículos fue realizado en el software Rayyan.18 El proceso de tamizaje de títulos, de resúmenes y de artículos completos fue llevado a cabo por dos revisores independientes. Los artículos incluidos fueron juzgados y seleccionados para cada pregunta PICO.
Extracción de datos y análisis
La extracción de datos para cada pregunta PICO fue realizada en RevMan software.19 La metodología GRADE fue seguida para la inclusión, teniendo en cuenta la mayor calidad de la evidencia, por ejemplo, entre ensayos clínicos sobre estudios observacionales. Los outcomes continuos fueron analizados usando el método de inversa de varianza en modelo de efectos aleatorizados, y reportados como media con un 95% de intervalo de confianza y desvío estándar. Los dicotómicos fueron incluidos y analizados por el método Mantel-Haenszel en modelo de efectos aleatorizados, y reportados como riesgo de ratios (RR) con un 95% de intervalo de confianza (IC).
Evaluación de calidad y formulación del reporte de la evidencia
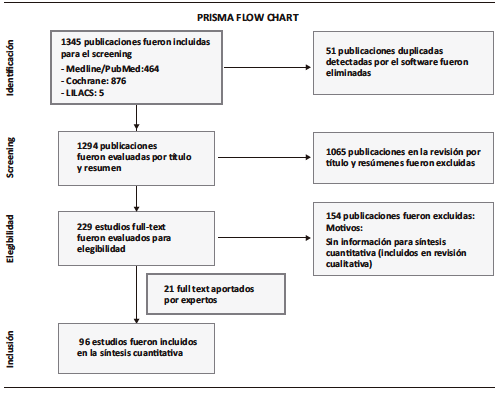
Se exportó cada carpeta creada en RevMan software al GRADE software20 para la creación de las tablas con el resumen de la evidencia. La evaluación de la calidad fue evaluada y realizada por dos evaluadores independientes, siguiendo los estándares de GRADE. Los conflictos fueron resueltos por consenso. La evaluación para cada outcome incluyó el análisis de los siguientes ítems: riesgo de sesgo, posibilidad de sesgo de publicación, inconsistencia, incongruencia en dirección de la evidencia e imprecisión. La metodología GRADE diferencia cuatro niveles de calidad, basados en el grado de confianza que la medida de efecto alcanza, luego del análisis de los estudios agrupados. Por este motivo, la calidad de la evidencia final de cada outcome es alta, moderada, baja o muy baja. Ante la ausencia de evidencia o cuando esta solo fue obtenida a través de opinión de expertos, el outcome fue catalogado como de calidad muy baja. Además, a los estudios diagnósticos se les hizo la evaluación de calidad según el instrumento QUADAS 2.21 Se adjunta el diagrama de flujo considerando el PRISMA22 para el reporte de pasos de la revisión sistemática (Figura 1).
Figura 1. Diagrama de flujo
De la evidencia a las recomendaciones
Cada recomendación fue realizada teniendo en cuenta el balance entre los beneficios de cada método diagnóstico o tratamiento, considerado sobre el daño que este puede ejercer y la calidad de la evidencia brindada. Una recomendación puede ser a favor o en contra de la intervención y a su vez ser fuerte o débil. De acuerdo con GRADE, esta diferencia radica en que una recomendación es fuerte si la mayor parte del panel de expertos confía en que los beneficios superan ampliamente a los daños o viceversa. Una recomendación débil puede presentar algo de incertidumbrespecto del beneficio y el daño, o bien poseer una calidad de evidencia baja y muy baja a la hora de realizar la recomendación.
Consenso
El panel de expertos recibió oportunamente el reporte de la evidencia para ser revisado antes de la votación. En la reunión en la que se hicieron las recomendaciones, los expertos recibieron, además, un resumen oral con la evidencia seleccionada de cada pregunta PICO. El proceso de votación fue anónimo y fue efectuado en la plataforma de Zoom software,23 para la elaboración de cada recomendación. Cuando en la votación no se alcanzó el consenso del 70% en primera instancia, los miembros llevaron a cabo discusiones antes de votar nuevamente, con un máximo permitido de tres votaciones para cada pregunta PICO.
1. ¿Se recomienda el interrogatorio dirigido a síntomas o de cuestionarios (GerdQ) para el diagnóstico de la ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
No existe una prueba estándar de oro para diagnosticar la ERGE. Es por ello que el diagnóstico se basa en una combinación de métodos, tales como: el análisis de síntomas, la respuesta al uso empírico de inhibidores de bomba de protones (IBP), la esofagogastroduodenoscopía (EGD) y las pruebas de monitoreo ambulatorio de reflujo como pH-metría e impedancia intraluminal multicanal con pH-metría (MII-pH). La pirosis y la regurgitación son los síntomas más comunes, pero, a pesar de ser considerados síntomas típicos de ERGE, su capacidad de predicción diagnóstica es muy limitada. En una revisión sistemática, se encontró que la pirosis tiene una sensibilidad del 30% y una especificidad del 62% para el diagnóstico de la ERGE en comparación con la EGD.24 En el caso de la regurgitación, los valores de sensibilidad y especificidad son del 76% y 96%, respectivamente.
Se han desarrollado varios cuestionarios estandarizados para diagnosticar la ERGE y reducir la necesidad de procedimientos invasivos. El GerdQ ha sido el cuestionario más ampliamente usado.25 Este fue desarrollado para su uso clínico en pacientes de atención primaria y se construyó a partir de un estudio internacional grande de pacientes con síntomas gastrointestinales superiores.26 Las preguntas del GerdQ se derivaron del cuestionario de enfermedad por reflujo (RDQ), la escala de calificación de síntomas gastrointestinales (GSRS) y la escala de impacto de la enfermedad por reflujo gastroesofágico (GIS). La puntuación de 8 para el cuestionario GerdQ es el punto de corte que alcanzó la mayor eficiencia para diagnosticar la ERGE (similar al diagnóstico del interrogatorio de síntomas por gastroenterólogo), con una especificidad del 71,4% y una sensibilidad del 64,6%.
La pregunta PICO fue confeccionada sobre la base de una población de pacientes con síntomas típicos de ERGE, como intervención el cuestionario GerdQ y el interrogatorio dirigido, como comparador el TEA patológico y como desenlace el diagnóstico de la ERGE.
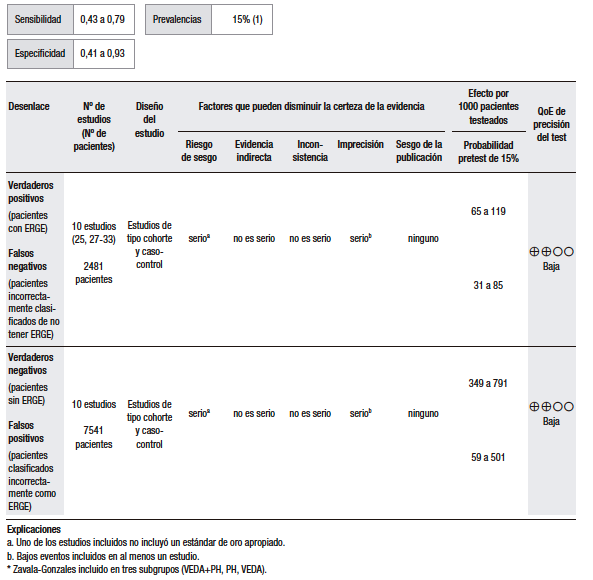
En cuanto a la síntesis cuantitativa (Tabla 1), se consideró una prevalencia de ERGE del 15%. Se analizaron diez estudios observacionales que evaluaron la utilidad del GerdQ con una puntuación > 8 para discriminar la ERGE respecto del TEA patológico. Los rangos de sensibilidad y especificidad fueron muy amplios (43% al 79% y 41% al 93%, respectivamente). En general, los pacientes con ERGE demostrada tienden a tener puntuaciones más altas, pero muchos pacientes con esofagitis tienen puntuaciones bajas.25,27-33
Un estudio multicéntrico en China investigó la utilidad del cuestionario GerdQ en 8065 pacientes con síntomas gastrointestinales superiores a los que se les había realizado una EGD.27 En todos los pacientes, el cuestionario GerdQ fue aplicado antes de la EGD. En esta serie, el 17,8% presentaron esofagitis erosiva (EE), de los cuales en un 90% fue esofagitis grado A de la clasificación de Los Ángeles (LA) y en el 43,2% de ellos la puntuación GerdQ fue > 8. Por otro lado, en el grupo de pacientes con GerdQ > 8, el 30% tuvieron EE y el 70% restante fueron normales. El estudio concluye que la EE se relaciona con las puntuaciones más altas del GerdQ, pero que hasta un tercio de los pacientes con EE se presentan sin síntomas típicos y, por lo tanto, una puntuación baja del GerdQ no puede excluir la enfermedad de manera confiable.
En un estudio noruego que incluyó a 169 pacientes, se comparó el diagnóstico basado en síntomas versus el cuestionario GerdQ.25 En todos los pacientes, se hizo EGD, valoración de síntomas, pH-metría y tratamiento de supresión ácida por 4 semanas. El análisis por curva ROC arrojó que la puntuación de 9 del GerdQ tenía el mayor rendimiento diagnóstico: sensibilidad de 66%; especificidad de 64%; valor predictivo negativo (VPN) de 22%; valor predictivo positivo (VPP) de 92%. El estudio concluye que en pacientes con síntomas sugestivos de ERGE el punto de corte de 9 del GerdQ ofrece una predicción limitada en el diagnóstico y que un curso corto con IBP no adiciona valor.
En otro estudio, se comparó el rendimiento diagnóstico del GerdQ con la cápsula de pH-metría inalámbrica de 48 horas en 358 pacientes.29 La especificidad y la sensibilidad fueron de 75% (IC 95%, 64%-85%) y 43% (IC 95%, 34%-53%), respectivamente, quedando claro que el cuestionario resulta en un número considerablemente alto de falsos negativos.
En Europa oriental, en un pequeño estudio que incluyó a 28 pacientes, se evaluaron los cuestionarios GerdQ y GSRS para el diagnóstico de la ERGE, comparados con la pH-impedancia esofágica (MII-pH).31 El cuestionario GerdQ mostró una correlación estadísticamente significativa entre la puntuación total del cuestionario, el TEA, el número de episodios de reflujo ácido y el número de episodios de reflujo líquido. La sensibilidad, la especificidad y la precisión diagnóstica fueron del 78,6%, 92,9% y 85,7%, respectivamente. El estudio, sin embargo, tiene serias debilidades en relación con el tamaño de la muestra, que es muy pequeña, y el hecho de que no informan los hallazgos de la EGD, lo cual es fundamental para establecer la utilidad de los cuestionarios en los grupos de EE y enfermedad por reflujo no erosiva (ERNE).
En un estudio japonés, se evaluó la utilidad del GerdQ en la población general vía web y en la hospitalaria vía e-mail.30 Fueron incluidos 863 participantes. El punto de corte > 8 tuvo el área bajo la curva y el VPP más altos al compararlos con la EE (p = 0,02). Sin embargo, no se hizo el monitoreo de pH en la población estudiada por mail, lo cual no permitió diferenciar a los pacientes con ERNE verdadero de los pacientes con pirosis funcional.
El cuestionario GerdQ también ha sido evaluado en la población Latinoamericana. En México, se evaluó en un estudio la utilidad diagnóstica del cuestionario GerdQ para el diagnóstico de la ERGE en pacientes de la atención médica primaria.32 Trescientos pacientes adultos fueron incluidos; a todos se les realizó EGD. En los casos de endoscopía normal, se hizo pH-metría de 24 horas, previa interrupción de los IBP o antagonistas del receptor H2 (H2RA) por 7 días. La pH-metría se consideró anormal si el TEA fue mayor a 4,2%. La sensibilidad, la especificidad y el VPP del GerdQ en comparación con el estándar de oro (EGD + pH-metría) fueron de 72%, 72% y 87%, respectivamente.
Finalmente, en un estudio japonés con 636 pacientes, el rendimiento diagnóstico del GerdQ fue evaluado frente a la MII-pH de 24 horas, la prueba con IBP y la medición del espacio intercelular del epitelio esofágico (EIE).33 A todos los participantes se les hizo el cuestionario GerdQ, EGD (con medición del EIE 2 cm por encima de la línea Z), MII-pH de 24 horas y un curso de esomeprazol por dos semanas. Cuando se definió una puntuación de GerdQ de ≥ 8 como valor de corte, la sensibilidad, especificidad, likelihood ratio (LR) positivo, LR negativo, VPP y VPN de GerdQ para el diagnóstico de la ERGE fueron del 57,7%, 48,9%, 1,13, 0,87, 58,3%. y 48,3%, respectivamente.
En conclusión, la ERGE no puede diagnosticarse solamente sobre la base de los síntomas, ya que muchos pacientes con síntomas típicos no tienen la enfermedad y algunos pacientes con ERGE demostrada pueden ser asintomáticos. Por otra parte, los trastornos funcionales esofágicos y los desórdenes motores comparten manifestaciones clínicas similares a las de la ERGE y, por ello, es necesario el uso de pruebas diagnósticas para precisarlo. Debido a esto, el cuestionario GerdQ, un instrumento basado en síntomas, no tiene utilidad en la práctica clínica como método diagnóstico y no permite evitar el uso de pruebas más específicas. Sin embargo, es importante recalcar que los estudios realizados para documentar el alcance diagnóstico de este cuestionario usan en las pruebas de referencia parámetros de anormalidad que hoy están siendo reevaluados y que tienen una alta heterogeneidad y notables deficiencias metodológicas.
En la discusión de esta pregunta con el grupo de expertos, se planteó que los diferentes fenotipos de la ERGE y algunas otras entidades, como los trastornos motores del esófago, comparten los mismos síntomas. Los cuestionarios tendrían su utilidad para diferenciar los síntomas de dispepsia de la ERGE y como tamizaje en el contexto de estudios epidemiológicos poblacionales, pero no son adecuados para establecer el diagnóstico de ERGE y tomar una conducta terapéutica en consecuencia. El acuerdo logrado fue del 73%.
Tabla 1.
Pregunta 1: ¿Cuál es el rendimiento diagnóstico del interrogatorio dirigido de síntomas o los cuestionarios (GerdQ) > 8 para el diagnóstico de ERGE?
2. ¿Se recomienda la prueba terapéutica empírica con IBP para el diagnóstico de ERGE en pacientes con pirosis como síntoma dominante?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: DÉBIL EN CONTRA
La ERGE es una entidad muy frecuente y el tratamiento empírico con IBP es, habitualmente, el primer paso en el diagnóstico y en el manejo.
Los IBP bloquean de manera irreversible la bomba de protones ATPasa H+K+, que se encuentra en las células parietales gástricas.34 La producción de ácido se suprime hasta que se regeneren nuevas bombas de protones, por lo que el IBP debe ser administrado cada día, para asegurar la supresión de ácido continua. Los IBP no reducen el número de eventos de reflujo; en cambio, alteran el pH del reflujo a débilmente ácido o alcalino.35
Los síntomas típicos de la ERGE se reducen con el tratamiento con IBP. Esto condujo al desarrollo de la prueba terapéutica empírica con IBP, en lugar de la realización del monitoreo ambulatorio de ERGE, en pacientes con pirosis sin síntomas de alarma.36 Esta prueba fue luego extrapolada también a los pacientes con regurgitación como síntoma dominante, a pacientes con DTNC y a pacientes con síntomas extraesofágicos.
La pregunta PICO ha sido confeccionada tomando como población a pacientes con pirosis como síntoma dominante, como intervención a la prueba terapéutica empírica con IBP, como comparador al TEA patológico y como desenlace al diagnóstico de la ERGE.
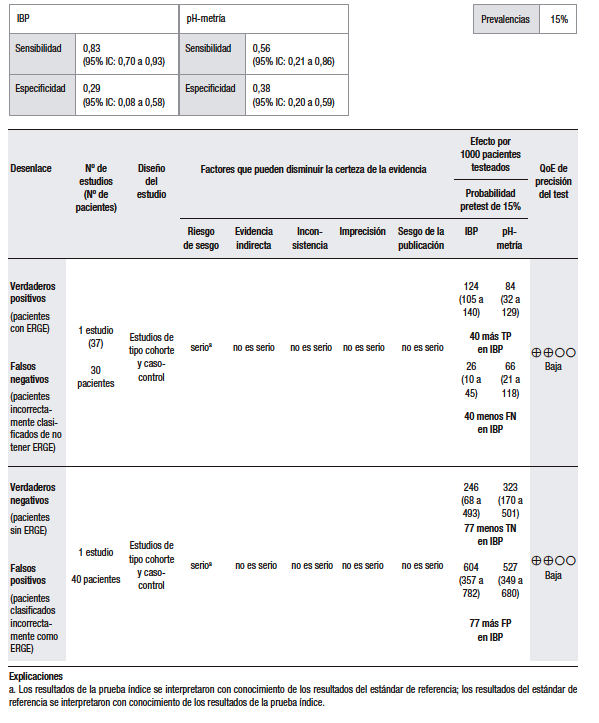
El análisis cuantitativo (Tabla 2) se realizó sobre la base de un estudio.37 Considerando una prevalencia de ERGE del 15%, se calculó una sensibilidad del 86% (IC 95% 70-93) y una especificidad del 29% (IC 95% 8-58) para la prueba empírica con IBP, en comparación con el TEA. El estudio analizado es un ensayo clínico doble ciego, aleatorizado y controlado con placebo, en el que se evaluó la precisión diagnóstica de la prueba con omeprazol a altas dosis para la detección de la ERGE. En este sentido, se incluyó a 43 pacientes con al menos tres episodios de pirosis por semana durante al menos los últimos tres meses, a los que se les realizó EGD y pH-metría de 24 horas. Se midió la respuesta al omeprazol versus el placebo en pacientes con ERGE positivo y ERGE negativo, definido como la presencia de esofagitis erosiva en la EGD o una pH-metría anormal. De los 42 pacientes que completaron el estudio, 35 (83%) fueron clasificados como ERGE positivos y 7 (17%) como ERGE negativos. Veintiocho pacientes de los ERGE positivos y 3 de los negativos respondieron al test de omeprazol, resultando en una sensibilidad del 80% (IC 95% 66,7-93,3) y una especificidad del 57,1% (IC 95% 20,5-93,8).37 Hay que tener en cuenta que este análisis fue realizado sobre la base de un único estudio, con un tamaño muestral pequeño, por lo que nos encontramos con un nivel de imprecisión elevado.
Tabla 2.
Pregunta 2: ¿Cuál es la utilidad diagnóstica de la prueba terapéutica con IBP empírica vs. pH-metría para el diagnóstico de ERGE con pirosis como síntoma dominante?
En un metaanálisis, se mostró que la sensibilidad de la prueba con IBP de 7 días para resolver la pirosis fue del 71% en presencia de esofagitis erosiva y del 78% cuando la pH-metría fue anormal.24 Sin embargo, cuando se considera la pirosis no investigada, la especificidad de la prueba con IBP fue subóptima (41% y 54%, respectivamente), lo que implica una mezcla de mecanismos de ERGE y no ERGE subyacentes.38
El tratamiento con IBP a corto plazo cura la esofagitis en un 72% al 83% de pacientes (comparado con 18% a 20% para el placebo),38,39 pero resuelve la pirosis en solo el 56% al 77% de los pacientes con esofagitis (con 4-12 semanas de tratamiento).40-42
La dosis estándar de IBP resuelve la pirosis en solo un 37% al 61% de los pacientes sin esofagitis erosiva o con pirosis no investigada.38,42-44
En la discusión con el grupo de expertos se planteó que, a pesar de que el uso de la prueba empírica con IBP es algo que se realiza habitualmente en la práctica clínica en pacientes con pirosis, sobre todo en pacientes jóvenes y sin síntomas de alarma, existe un efecto placebo del IBP que hace que la prueba sea poco específica. Además, no se trataría de un método adecuado para hacer diagnóstico de ERGE y tomar una conducta terapéutica en consecuencia. El acuerdo fue del 67%.
3. ¿Se recomienda la prueba terapéutica empírica con IBP para el diagnóstico de ERGE en pacientes con regurgitación como síntoma dominante?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
Además de la pirosis, la regurgitación también se considera un síntoma típico de la ERGE. Según los metaanálisis, cuando la regurgitación es el síntoma dominante, los IBP ofrecen muy poco beneficio.44 Hay que considerar que este dato surge de ensayos clínicos aleatorizados y controlados con placebo, en los que se evalúa la mejoría clínica, sin hacer una comparación válida para establecer el diagnóstico de ERGE.
A diferencia de en los pacientes con pirosis, los IBP reducen los síntomas en solo el 26% al 64% de los pacientes con regurgitación como síntoma dominante, solo un 17% más de pacientes que los que reciben placebo.45,46
La pregunta PICO ha sido confeccionada tomando como población a pacientes con regurgitación como síntoma dominante, como intervención la prueba terapéutica empírica con IBP, como comparador el TEA patológico y como desenlace el diagnóstico de ERGE.
El análisis cuantitativo se realizó sobre la base de un estudio47 (Tabla 3).
Tabla 3.
Pregunta 3: ¿Cuál es la utilidad diagnóstica de la prueba terapéutica con IBP empírica para el diagnóstico de ERGE en pacientes con regurgitación como síntoma dominante?
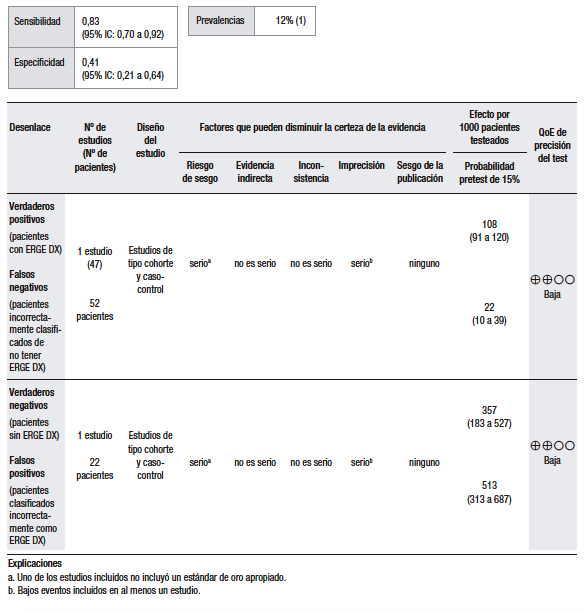
Considerando una prevalencia de ERGE del 15%, se calculó una sensibilidad del 83% (IC 95% 70-92) y una especificidad del 41% (IC 95% 21-64) para la prueba empírica con IBP en pacientes con regurgitación como síntoma dominante.
En el estudio de Aanen y col., se evaluó la precisión diagnóstica de la prueba empírica con IBP en pacientes con síntomas sugestivos de ERGE de la atención primaria. En este estudio, no se aclara puntualmente si los pacientes presentaban regurgitación como síntoma dominante. Los pacientes con síntomas extraesofágicos fueron excluidos. El diagnóstico de ERGE se estableció con base en una probabilidad de asociación de síntomas (SAP) positiva. La sensibilidad de la prueba con IBP fue del 91% (IC 95% 78-96) y la especificidad, del 26% (IC 95% 10-49).47 Hay que considerar que, además de no responder adecuadamente a la pregunta PICO, este trabajo fue realizado utilizando definiciones operativas inadecuadas y sobre la base de un tamaño muestral pequeño, lo que conlleva una importante imprecisión.
En la discusión con el grupo de expertos, se planteó que hay que considerar que, en pacientes con regurgitación como síntoma dominante, la respuesta a IBP reportada en los metaanálisis es pobre. Además de esto, en este grupo de pacientes, hay que considerar fuertemente la probabilidad de confundidores como los trastornos motores del esófago, los eructos y la rumiación. Por lo tanto, el grupo de expertos considera, con un acuerdo del 80%, que en pacientes con regurgitación como síntoma primario el uso de la prueba empírica con IBP no sería adecuada para hacer el diagnóstico de ERGE y tomar una conducta terapéutica en consecuencia.
4. ¿Se recomienda la prueba terapéutica con IBP empírica para el diagnóstico de ERGE en pacientes con dolor torácico como síntoma dominante?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
El DTNC se define como un dolor indistinguible del dolor causado por isquemia cardíaca, después de que esta enfermedad haya sido descartada.48 La ERGE y los trastornos de motilidad esofágica frecuentemente se asocian a este síntoma. La prevalencia de ERGE en DTNC es del 30% al 60%49 y, por ello, la prueba terapéutica con IBP ha sido recomendada como abordaje inicial por muchos expertos.
La pregunta PICO ha sido confeccionada tomando como población a pacientes con dolor torácico como síntoma dominante, como intervención la prueba terapéutica empírica con IBP, como comparador el TEA patológico y como desenlace el diagnóstico de ERGE.
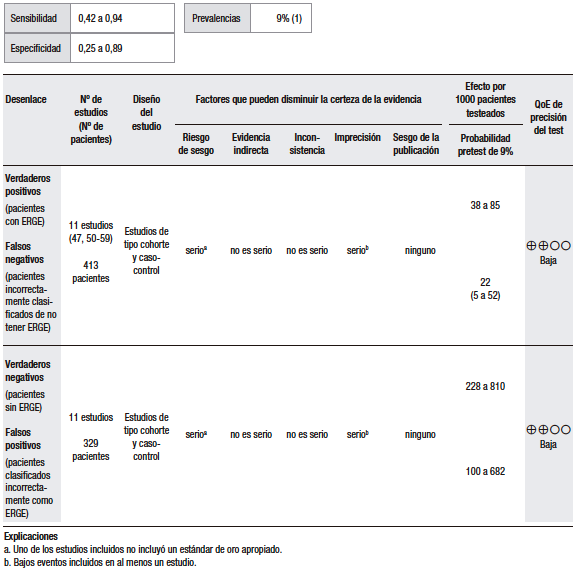
Considerando una prevalencia de ERGE del 15% (pretest), el análisis cuantitativo fue realizado sobre la base de once estudios (ensayos clínicos y serie de casos) que evaluaron la capacidad de la prueba empírica con IBP en el DTNC como síntoma dominante. Se evaluó la capacidad de esta prueba para discriminar a pacientes con diagnóstico de ERGE en relación con el TEA patológico. En estos estudios, se observó una alta heterogeneidad, diferencias considerables en el diseño, las dosis del IBP y la duración del tratamiento. Además, los tamaños de muestra fueron pequeños y existió un riesgo alto de sesgo. En conjunto, se reportó una sensibilidad del 42%-94% y una especificidad del 25%-89%.47,50-59 (Tabla 4).
Tabla 4.
Pregunta 4: ¿Cuál es la utilidad diagnóstica de la prueba terapéutica con IBP empírica para el diagnóstico de ERGE en pacientes con dolor de pecho como síntoma dominante?
En una revisión sistemática, se encontró que la prueba con IBP para el diagnóstico de ERGE en DTNC tiene una sensibilidad y una especificidad del 89% y del 88%, respectivamente.60 Por otra parte, la EGD en pacientes con DTNC presenta cambios específicos de ERGE en el 14% al 29%61 y la pH-metría esofágica sin IBP es anormal hasta en el 60% de los casos.62 Por todo lo anterior, la prueba diagnóstica con IBP se ha propuesto como método inicial más eficiente debido a que es simple, segura y no invasiva.63 En un estudio holandés, se evaluó la prueba con IBP para el diagnóstico de ERGE en 90 pacientes de atención primaria, tomando como referencia el resultado de la SAP de la pH-metría esofágica de 24 horas.47 Después de la pH-metría, todos recibieron esomeprazol 40 mg en dosis única por 13 días. La sensibilidad de la prueba empírica con IBP fue de 0,91 (IC 95% 0,78-0,96) y la especificidad de 0,26 (IC 95% 0,10-0,49), lo cual demuestra que el valor adicional del tratamiento a corto plazo con IBP para diagnosticar la ERGE es, en general, limitado.
En un estudio aleatorizado cruzado doble ciego, se evaluó el uso de rabeprazol en dosis altas en pacientes con DTNC y sospecha de ERGE.52 A todos los pacientes se les hizo EGD y pH-metría de 24 horas. Todos los pacientes fueron tratados con rabeprazol 20 mg dos veces al día o placebo, por 7 días; el orden de exposición a placebo e IBP fue asignado aleatoriamente. De los 35 pacientes incluidos, 16 (46%) tuvieron diagnóstico de ERGE y, de estos, 12 (75%) tuvieron una mejoría significativa con rabeprazol versus 3 (19%) con placebo (p = 0,029). En contraste, en los 19 pacientes sin ERGE, solo 2 (11%) mejoraron con la medicación y 4 (21%) con placebo (p = 0,6599). La sensibilidad y la especificidad calculadas en este ensayo con rabeprazol fueron del 75% y 90%, respectivamente.
En otro estudio similar, el lansoprazol en dosis altas (60 mg am y 30 mg pm) durante 7 semanas fue comparado con placebo en 40 pacientes con DTNC, luego de realizar EGD y pH-metría.50 En 18 pacientes (45%) se encontró EE y/o prueba de pH anormal (ERGE positivo) y en 22 (55%) ambos exámenes fueron normales (ERGE negativo). De los 18 pacientes con ERGE, 14 (78%) del grupo con lansoprazol y 4 (22%) del grupo placebo tuvieron respuesta sintomática positiva (p = 0,0143). En el grupo sin ERGE, 2 de los 22 pacientes (9,1%) mejoraron con la medicación versus 8 (36,3%) con el placebo (p = 0,75). La sensibilidad y la especificidad de la prueba con lansoprazol fueron del 78% y 80%, respectivamente.
Fass y col. realizaron un estudio con omeprazol para evaluar no solo el rendimiento diagnóstico, sino también el ahorro potencial en costos.53 Se incluyó a 40 pacientes y, en todos, se hizo un estudio inicial de pH-metría y EGD. Luego, en un estudio ciego y cruzado, se comparó omeprazol 40 mg am versus placebo por 7 días. El 78% (18/23) del grupo de ERGE positivo y el 14% (2/14) del grupo ERGE negativo tuvieron una respuesta positiva a la prueba con IBP (p < 0,01). Los valores de sensibilidad y especificidad para esta prueba fueron del 78% (IC 95%, 61,4–95,1) y 85,7% (IC 95% 67,4–100). Se estimó un ahorro de 573 dólares por paciente y una reducción del 59% en el número de procedimientos diagnósticos.
Con el fin de establecer la duración óptima de la prueba con IBP en pacientes con DTNC, se hizo un estudio en 42 pacientes asiáticos.55 Luego de realizar la EGD y la pH-metría, los pacientes fueron tratados con rabeprazol 20 mg dos veces por día por 14 días y, en todos, se evaluó la respuesta clínica en forma individual durante la semana uno y la semana dos. No hubo diferencias entre los dos grupos con DTNC durante la primera semana (ERGE positivo 8,5% versus ERGE negativo 6,23%). Sin embargo, durante la segunda semana, el grupo con ERGE tuvo una mayor tasa de respuesta positiva al IBP versus el grupo sin ERGE (13,81% vs 7,27%, respectivamente, p = 0,001). La sensibilidad para la prueba fue del 81% y la especificidad de 62%. El estudio sugiere que la prueba empírica con IBP en el diagnóstico de ERGE relacionado con DTNC debe tener una duración mínima de dos semanas antes de considerarse negativo.
Un estudio cruzado doble ciego controlado con placebo evaluó la prueba con omeprazol en dosis altas de 40 mg dos veces al día por 14 días en 42 pacientes con un estudio de perfusión miocárdica con Tc99m normal.58 A todos les hicieron EGD, manometría esofágica y pH-metría de 24 horas antes del tratamiento. El dolor mejoró en el 71% del grupo que recibió IBP y en el 18% del grupo placebo (p < 0,001). La respuesta al omeprazol fue del 90% en el grupo ERGE positiva versus 39% en el ERGE negativa.
En Corea, se evaluó en un estudio la utilidad diagnóstica del lansoprazol 30 mg día versus placebo por 14 días, en 90 pacientes clasificados en dos grupos de edad: mayores y menores de 40 años.56 El 23% de los pacientes jóvenes y el 38% de los mayores de 40 años tuvieron diagnóstico de DTNC relacionado con ERGE basado en la presencia de EE en la EGD o en una pH-metría anormal (p = 0,144). La prueba con IBP mejoró los síntomas significativamente en el grupo con ERGE versus el grupo sin ERGE, independientemente del grupo etario.
En China, se evaluó el tratamiento con lansoprazol versus placebo por 4 semanas para el diagnóstico de ERGE en 68 pacientes con DTNC y EGD normal.59 En el grupo de lansoprazol, una mayor proporción de pacientes con reflujo anormal documentado por pH-metría tuvieron una mejoría sintomática en comparación con los de reflujo normal (92% versus 33%, respectivamente; OR 22, IC 95%: 2,3 – 201,8; p = 0.001), dando valores de sensibilidad, especificidad, VPP, VPN y exactitud de 92%, 67%, 58%, 94% y 75%, respectivamente. En el grupo placebo no hubo diferencias entre los pacientes con reflujo normal y anormal (35% versus 33%).
En Arizona, se incluyó en un estudio a 94 pacientes con DTNC, a quienes se les realizó EGD y pH-metría esofágica de 24 horas.51 A los pacientes con índice sintomático (IS) > 50% se les administró una prueba con IBP (rabeprazol, lansoprazol u omeprazol) en dosis única por una semana. Cuarenta y siete pacientes (50%) tuvieron ERGE demostrada en la EGD o en la pH-metría y 47 (50%) no tuvieron diagnóstico objetivo de ERGE. Solo 9 (19,1%) pacientes del grupo ERGE positivo y 5 (10,6 %) del grupo ERGE negativo tuvieron un IS > 50% (p = ns). Ocho de los 9 pacientes (89%) que tuvieron un IS positivo en el grupo con ERGE y 2 de 5 pacientes (40%) en el grupo sin ERGE respondieron a la prueba con IBP. Según estos datos, el IS positivo es infrecuente en pacientes con DTNC con o sin ERGE y el uso de este índice agrega poco valor al diagnóstico de esta entidad.
Finalmente, en un estudio, se evaluó el rendimiento de la prueba con IBP para el diagnóstico de ERGE en DTNC en pacientes estudiados con pH-metría por cápsula inalámbrica (pH-CI).57 Hicieron una EGD y un estudio con pH-CI de 48 horas en todos los pacientes, que luego recibieron rabeprazol 20 mg dos veces por día durante 2 semanas. La prevalencia de ERGE fue del 66,7% (18/27). La proporción de pacientes que tuvieron una mejoría total o parcial del DTNC fue significativamente mayor en los pacientes con ERGE que en aquellos sin ERGE: 15/18 (83,3%) versus 1/9 (11%) (p < 0,001).
En conclusión, el paso más importante al momento de evaluar a un paciente con dolor torácico es asegurarse de que no es de causa cardiogénica. En los pacientes con ERGE y dolor torácico como síntoma dominante la prueba empírica con IBP puede ser de utilidad en casos de individuos jóvenes y sin síntomas de alarma. Los resultados más favorables de la prueba se obtienen cuando las pruebas objetivas de la ERGE, como la pH-metría o la EGD, son anormales.
En la discusión con el grupo de expertos se planteó, con un acuerdo del 87%, que, en el contexto del DTNC, los IBP son de utilidad cuando la ERGE ya está confirmada. Sin embargo, su uso de manera empírica no es adecuado, ya que podría diferirse el diagnóstico por el efecto placebo. Por otro lado, hay que considerar que el dolor torácico puede ser una manifestación clínica de varias condiciones, tanto esofágicas como extraesofágicas, que requieren una cuidadosa valoración.
5. ¿Se recomienda la prueba terapéutica con IBP empírica para el diagnóstico de ERGE extraesofágico (disfonía, tos, asma) en pacientes con síntomas típicos de ERGE (pirosis, regurgitación)?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
El consenso de Montreal ha clasificado las manifestaciones de ERGE en síndromes esofágicos o síndromes extraesofágicos (SEE).4 Además, en el SEE, se han incluido las manifestaciones atípicas de ERGE, como el asma, la tos crónica, la laringitis, el globus, la molestia faríngea, la disfonía y la carraspera, que son cada vez más reconocidas por médicos generales, gastroenterólogos, neumonólogos y otorrinolaringólogos.64 Sin embargo, la correlación entre SEE y ERGE es dudosa y sigue siendo muy difícil de comprobar.65 Además, es una condición que ha llevado a gastos sustanciales en el sistema de salud pública. Se ha demostrado que el costo de la evaluación y el tratamiento en el primer año de pacientes con SEE es cinco veces mayor que el costo que generan aquellos con síntomas típicos de reflujo y es muy cercano a los costos globales por cáncer en los Estados Unidos.66
Las herramientas diagnósticas comúnmente usadas en el SEE incluyen la laringoscopía, la EGD, la pH-metría o MII-pH ambulatoria. Nuevas tecnologías han sido propuestas, como la impedancia mucosa medida durante la EGD, pero hasta el momento no se ha demostrado que tenga un papel claro en la evaluación del SEE relacionado con ERGE.65 En realidad, los pacientes con sospecha de SEE deben someterse a una investigación que combine los datos clínicos, los resultados de las pruebas diagnósticas y la respuesta al tratamiento.65
Para formular la pregunta PICO, se consideró como población a los pacientes con SEE relacionados con ERGE (tos, disfonía, asma) y síntomas típicos de reflujo (pirosis y regurgitación), como intervención la prueba terapéutica empírica con IBP, como comparación el TEA patológico y como desenlace el diagnóstico de ERGE extraesofágico.
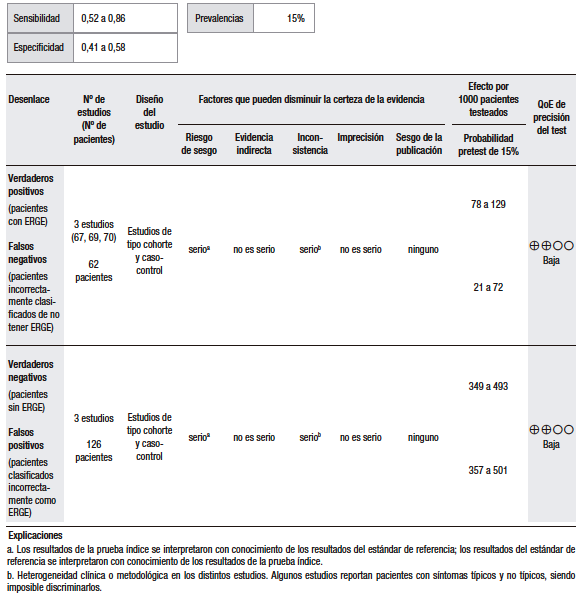
Para la síntesis cuantitativa fueron incluidos tres estudios.67-69 La prevalencia considerada de ERGE fue del 15% (pretest). A pesar de que la pregunta PICO fue planteada considerando el escenario clínico de pacientes con SEE y síntomas típicos de ERGE, estos estudios evaluaron la resolución del SEE después del tratamiento empírico con IBP en pacientes con y sin síntomas típicos de reflujo. Por lo tanto, consideramos que esta fue una limitante para poder responder directamente la pregunta PICO. Más allá de esta consideración, la sensibilidad ha variado de 52% a 86% y la especificidad, de 41% a 58% (Tablas 5 y 6). Los estudios han tenido diseños y metodologías considerablemente diferentes, lo que ha contribuido a la heterogeneidad de los resultados. La pequeña cantidad de la muestra también ha sido una limitación en todos los estudios.
Tabla 5 y 6.
Preguntas 5 y 6: ¿Cuál es la utilidad diagnóstica de la prueba terapéutica con IBP empírica para el diagnóstico de ERGE extraesofágico en pacientes con y sin síntomas típicos?
En el estudio de Metz y col.,67 el objetivo fue determinar si el tratamiento empírico con omeprazol podría de manera confiable identificar a los pacientes con laringitis por reflujo y evitar los exámenes complementarios en 10 pacientes con SEE, 8 de ellos con ERGE comprobada y 6 con síntomas típicos asociados. No hubo grupo placebo. El desenlace fue la resolución de todos los síntomas laríngeos al final del tratamiento empírico. La respuesta al omeprazol fue positiva en 6 de 10 pacientes. Los autores concluyeron que la prueba empírica con omeprazol podría ser útil en la confirmación de la laringitis por reflujo, pero que había posibilidad de falsos positivos y falsos negativos.
El objetivo del segundo estudio fue evaluar los beneficios de la terapia con omeprazol en pacientes con sospecha de reflujo laringofaríngeo (RLF) para determinar la dosis óptima y la duración de la prueba diagnóstica. Cien pacientes con laringitis posterior y más de un síntoma atípico de RLF, de entre 14 y 68 años de edad, fueron tratados con omeprazol (20mg, 40mg, > 40mg) por 4 semanas, divididos en 3 subgrupos y un grupo tratado solamente con modificaciones en el estilo de vida y dieta. El 21% de los pacientes tenían EE. El desenlace fue la mejoría de por lo menos el 50% de los síntomas y en la satisfacción del paciente con el tratamiento. Al final de 4 semanas, el 65% de los pacientes fueron clasificados como respondedores (p = 0,05) y los mejores resultados fueron en pacientes que recibieron omeprazol más de 20 mg al día 6.67,69,70
El tercero es un estudio abierto de cohorte prospectiva en 85 pacientes, para evaluar si el IBP dos veces al día (BID) es más efectivo que una vez al día (QID) para el tratamiento de RLF. Fueron incluidos pacientes diagnosticados con RLF basados en síntomas de oído, nariz y garganta (ONG) y hallazgos laringoscópicos. Poco más del 50% de los pacientes presentaban síntomas típicos asociados. A través de un cuestionario se accedió a los datos demográficos, síntomas de ONG, severidad de los síntomas y exposición a otros potenciales irritantes laríngeos. Antes del inicio del tratamiento, los pacientes fueron estudiados con manometría esofágica, pH-metría de 24 horas y EGD. Los pacientes fueron asignados de manera consecutiva a tres grupos: IBP BID (lansoprazol 30 mg BID), IBP BID + H2RA (omeprazol 20mg BID + ranitidina 300mg cada noche), o IBP QID (esomeprazol 40 mg QID). La respuesta al tratamiento fue definida como respuesta sintomática con mejoría de más del 50% en relación al IS basal. En dos meses, la respuesta del grupo IBP ocurrió en 15/30 pacientes (50%); IBP + H2RA en 15/30 pacientes (50%); e IBP QID en 7/25 pacientes (28%), p = 0,03. No hubo diferencia estadística entre los dos grupos IBP BID con o sin H2RA. Entre los no respondedores del grupo IBP QID, 7/13 (54%) obtuvieron respuesta con 2 meses adicionales de IBP BID. En el seguimiento a los 4 meses, un 22% adicional de respuesta fue obtenida en los dos grupos de IBP BID (43/60, 72%). El estudio concluyó que la supresión ácida agresiva con IBP BID durante por lo menos 4 meses es necesaria para el tratamiento del RLF.69
Por otro lado, en un estudio aleatorizado controlado con placebo en el que se evaluó el efecto del esomeprazol 40 mg BID por 16 semanas en 770 pacientes con asma, se reveló que, en un subgrupo de pacientes con síntomas típicos de ERGE y síntomas respiratorios nocturnos, tendría algún beneficio en la mejoría del flujo espiratorio pico. Hay que tener en cuenta, sin embargo, que esta mejoría estuvo en el borde de la significancia estadística.71
En la Guía Clínica del Colegio Americano de Gastroenterología (ACG) para Diagnóstico y Manejo de la Enfermedad por Reflujo Gastroesofágico se sugiere para aquellos pacientes que presentan ambos síntomas, esofágicos y extraesofágicos, el tratamiento empírico con IBP 2 veces al día por 8 a 12 semanas antes del estudio diagnóstico.72
El grupo de expertos votó mayoritariamente (73%) fuerte en contra de la recomendación sobre el uso de IBP empíricos en pacientes con SEE y síntomas típicos de ERGE. Se discutió que, en el caso de no poder contar con la disponibilidad de la realización de un monitoreo ambulatorio de reflujo, podría tener algún rol, pero que de ninguna manera esta prueba podría servir para hacer diagnóstico de ERGE.
6. ¿Se recomienda la prueba terapéutica con IBP empírica para el diagnóstico de ERGE extraesofágico (disfonía, tos, asma) en pacientes SIN síntomas típicos de ERGE (pirosis, regurgitación)?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
Es interesante que, en algunos ámbitos de la práctica clínica, la ERGE se considera una causa posible de SEE, aun en pacientes sin síntomas típicos, que no responden a dosis máximas de IBP y que tienen estudios negativos de MII-pH.73
Para formular la pregunta PICO, se consideró como población a los pacientes con SEE relacionados con ERGE (tos, disfonía, asma) y sin síntomas típicos de reflujo (pirosis y regurgitación), como intervención la prueba terapéutica empírica con IBP, como comparación el TEA anormal y como desenlace el diagnóstico de ERGE extraesofágico (Tablas 5 y 6).
Como en la pregunta PICO previa, se presentó la limitante de que los trabajos publicados no discriminaron el SEE según pacientes con y sin síntomas típicos de ERGE. Los datos utilizados para el análisis cuantitativo son los mismos que en la pregunta PICO anterior.
En cuanto al análisis cualitativo, el estudio TOPPITIS es un estudio aleatorizado, fase III, doble ciego, controlado con placebo, en el que se incluyó a 346 pacientes con síntomas faríngeos persistentes y un score de índice de síntomas de reflujo ≥ 10, tratados con 30 mg de lansoprazol BID por 16 semanas. El objetivo primario fue el de evaluar la respuesta sintomática. El principal resultado fue que el grupo con lansoprazol no obtuvo resultados significativamente mejores en comparación con el grupo placebo, en ninguno de los tres parámetros medidos de evaluación de respuesta al tratamiento (Reflux Symptom Index, Comprehensive Reflux Symptom Score and Laryngopharyngeal Reflux – Health Related Quality of Life). En resumen, no se ha detectado evidencia del beneficio del tratamiento con lansoprazol en pacientes con síntomas faríngeos persistentes.73
Debido a las dificultades para establecer la asociación de SEE con ERGE y el elevado costo de la evaluación y el tratamiento al primer año,66 la Guía Clínica del ACG para Diagnóstico y Manejo de la ERGE y la Actualización de Práctica Clínica de la Asociación Americana de Gastroenterología (AGA) recomiendan descartar otras causas de los síntomas. Además, los pacientes que presentan manifestaciones extraesofágicas de ERGE sin síntomas típicos deben someterse a test para el diagnóstico de reflujo antes del tratamiento con IBP.6,72
En conclusión, el bajo número de estudios, el pequeño tamaño muestral y la metodología considerablemente diferente entre los estudios llevan a una calidad de evidencia baja para considerar el uso de IBP como prueba terapéutica en pacientes con sospecha de ERGE extraesofágica sin síntomas típicos.
El 100% de los participantes del grupo de expertos votó fuertemente en contra de esta recomendación.
7. ¿Se recomienda el esofagograma baritado para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
El esofagograma baritado es una prueba de utilidad para el estudio de las enfermedades del esófago, y una de sus mayores ventajas es su amplia disponibilidad. La Organización Mundial de Gastroenterología considera que esta prueba podría ser de utilidad para la evaluación de la anatomía esofágica.74
El esofagograma tiene una pobre correlación con el monitoreo ambulatorio de reflujo, que es el estándar de referencia actual para el diagnóstico de ERGE. Por tal motivo, la guía clínica del ACG no recomienda el uso de esofagograma como una prueba diagnóstica para ERGE.72 Asimismo, el consenso de Lyon para el diagnóstico de ERGE no toma en cuenta el esofagograma como una prueba diagnóstica.17 Vale la pena destacar que existe una modalidad de este estudio, conocida como esofagograma cronometrado, que es una variante con la cual podemos valorar el vaciamiento esofágico y convertir el esofagograma en una prueba funcional que resulta útil en la acalasia, pero no en la ERGE.75
Para formular la pregunta PICO, se consideró como población a los pacientes con síntomas de ERGE, como intervención el esofagograma baritado, como comparación el TEA anormal y como desenlace el diagnóstico de ERGE.
Con respecto a la síntesis cuantitativa de los datos (Tabla 7), se encontró información cuantitativa en dos estudios. Considerando una prevalencia de ERGE del 15%, se calculó una sensibilidad del 50% (IC 95% 32-68) y una especificidad del 64% (IC 95% 45-80) para el esofagograma en relación con el diagnóstico de ERGE. En el primer estudio incluido, el grupo de Castell y col.76 valoró a un grupo de 125 pacientes que fueron sometidos a un esofagograma baritado y una pH-metría convencional de 24 horas. Se valoró, durante el esofagograma baritado, la presencia o ausencia de hernia hiatal, la presencia o ausencia de reflujo espontáneo y, finalmente, la presencia o ausencia de reflujo durante la maniobra de sifón de agua. Se encontró que, cuando se observó reflujo espontáneo en el esofagograma, el 68% presentó una pH-metría positiva, cuando se presentó reflujo durante la maniobra de sifón de agua el 65% presentó una pH-metría positiva y el 70% de los pacientes con hernia hiatal presentó una pH-metría positiva. Se calculó una sensibilidad del 26% y una especificidad del 77% para el reflujo espontáneo; para hernia hiatal una sensibilidad del 43% y una especificidad del 65% y, al agregar al esofagograma la prueba de sifón de agua, se aumentó la sensibilidad al 92%, pero se perdió la especificidad, que resultó en cero.
Tabla 7.
Pregunta 7: ¿Cuál es la utilidad diagnóstica del esofagograma baritado para el diagnóstico de ERGE?
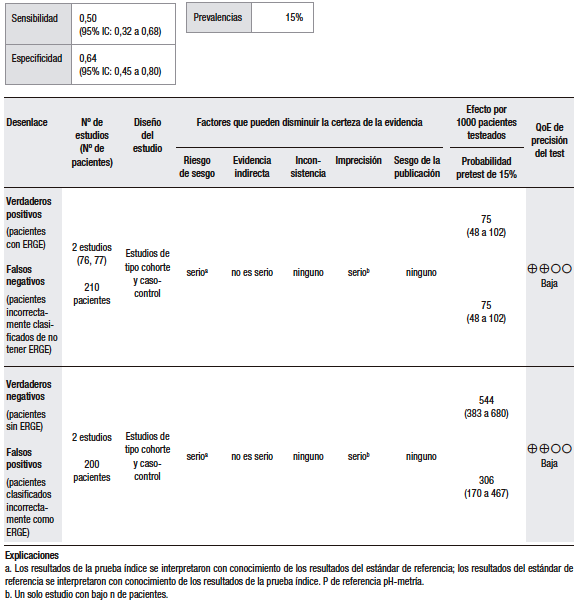
El segundo estudio con información extraíble encontrado fue realizado por el grupo de Serena-Gallegos D. y col.77 En este estudio, se compararon los resultados del esofagograma con estudios funcionales esofágicos (pH-metría y manometría esofágica). Se incluyó a 65 pacientes. De estos, 35 pacientes tenían pH-metría y esofagograma baritado. La cantidad de falsos negativos en este estudio para el esofagograma fue de 55%, los falsos positivos fueron el 31% y solo el 30% de los pacientes tenían una pH-metría positiva y reflujo en el esofagograma. Se calculó una sensibilidad del 50%, especificidad del 64%, VPP de 68% y VPN de 45% para el esofagograma, en comparación con la pH-metría como estándar de referencia.
De esta manera, y de acuerdo con nuestro análisis, puede concluirse que el esofagograma como prueba diagnóstica tiene baja sensibilidad, especificidad y concordancia, en comparación con la pH-metría para el diagnóstico de ERGE. Vale la pena destacar que el esofagograma continúa siendo una prueba útil para la investigación de anormalidades anatómicas.
El grupo de expertos estuvo 100% de acuerdo en la falta de utilidad del esofagograma baritado para el diagnóstico de ERGE.
8. ¿Se recomiendan los hallazgos endoscópicos para el diagnóstico de ERGE?
En relación con esta pregunta, el grupo de expertos decidió subdividirla en dos ítems para una mejor evaluación. Por lo tanto, en la pregunta 8a se evaluó el hallazgo endoscópico de hernia hiatal, y en la 8b, el de esofagitis erosiva en sus diferentes grados.
8a. ¿Se recomienda el hallazgo endoscópico de hernia hiatal y alteración de la válvula flap para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
La EGD es una herramienta utilizada con frecuencia para el diagnóstico de síntomas gastrointestinales superiores como los ocasionados por la ERGE.74 Dado que es una herramienta asequible, se utiliza ante determinadas situaciones clínicas y como tamizaje en poblaciones bien definidas.74 La hernia hiatal puede observarse con facilidad cuando se realiza una EGD y se ha demostrado que el tamaño de la hernia está correlacionado con la gravedad de la ERGE, es decir, a mayor tamaño de la hernia, mayor es el grado de esofagitis en la EGD y mayor el TEA durante la pH-metría.78 Sin embargo, el hecho de encontrar una hernia hiatal por sí sola durante la EGD no equivale a la presencia de ERGE.79 Otro de los elementos que se evalúan durante la realización de una EGD es la válvula flap. Esta evaluación se lleva a cabo durante la maniobra de retroflexión y se clasifica de acuerdo con la Clasificación de Hill.80,81
Por este motivo, nos preguntamos si la presencia de hernia hiatal tiene alguna utilidad para el diagnóstico de ERGE.
Para formular la pregunta PICO, se consideró como población a los pacientes con síntomas de ERGE, como intervención el hallazgo de hernia hiatal y alteración de la válvula flap en la EGD, como comparación el TEA anormal y como desenlace el diagnóstico de ERGE.
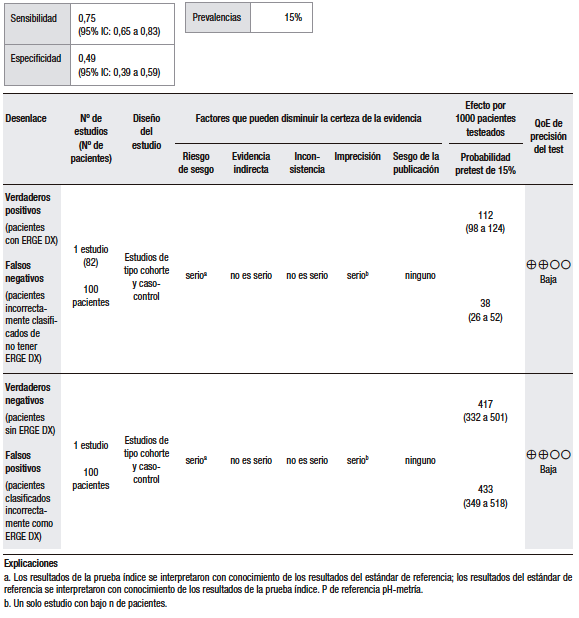
En la síntesis cuantitativa de los datos (Tabla 8), se encontró información extraíble en un estudio en el que se analizó la presencia de hernia hiatal en la EGD, en relación con el diagnóstico de ERGE mediante pH-metría. En este estudio, Johnson y col.82 evaluaron a un grupo de 220 pacientes consecutivos, en los cuales se registró la presencia de síntomas típicos de ERGE. Se realizó pH-metría como estándar de referencia y EGD. En este estudio, el 20% de los pacientes con sintomatología típica no presentó pH-metría positiva. Se encontró una hernia hiatal mayor a 2 cm en el 63% de los pacientes. El 57% de los pacientes que presentaron hernia hiatal tenían pH-metría positiva. El 75% de los pacientes que presentaron erosiones esofágicas tenían pH-metría positiva. Se calculó una sensibilidad del 75%, en comparación con la pH-metría, y una especificidad del 49%, con un VPP del 57% para la presencia de hernia hiatal para el diagnóstico de ERGE.
Tabla 8.
Pregunta 8: ¿Cuál es la utilidad diagnóstica de los hallazgos endoscópicos (según Los Ángeles) para el diagnóstico de ERGE? –HERNIA HIATAL–
Por otro lado, hay que considerar que existe una relación entre el grado de válvula flap, definida por la Clasificación de Hill,80,81 y la esofagitis erosiva. En el estudio de Kim y col., se incluyó a un grupo de 608 pacientes en los cuales se realizó EGD, manometría esofágica y pH-metría de 24 horas. Se encontró EE leve (grado A y B de LA) en 68 pacientes y EE severa (C y D de LA) en solo 5 casos. Es importante destacar que el análisis de estos casos fue retrospectivo y se desconoce el uso de IBP previo al procedimiento endoscópico. En este estudio, solo el 12% de los pacientes estudiados presentaron erosiones en la mucosa durante la EGD. La presencia de erosiones durante la EGD presentó una asociación fuerte (OR 9,8 IC 95%, 5,6-17,2) con los grados más altos de válvula flap.83
En el segundo estudio analizado, que fue realizado por el grupo de Lin B y col., se evaluó a una población de 506 pacientes con síntomas de ERGE. Se les realizó EGD y se documentó el grado de válvula flap y la presencia de erosiones en el esófago. Se encontró a un total de 125 pacientes con erosiones esofágicas, según la clasificación de LA (grado A: 93 pacientes, grado B: 29 pacientes, grado C: 2 pacientes y grado D: 1 paciente). La frecuencia de pacientes con válvulas flap anormales (grados III o IV de la clasificación de Hill) fue del 27%, de los cuales el 42% tenían EE.84
Analizando estos datos, se demuestra la pobre asociación que tiene la hernia hiatal como predictor de la ERGE.
El 87% de los expertos estuvo de acuerdo con que la presencia de hernia hiatal y la alteración de la válvula flap en la EGD, si bien son un hallazgo importante, no serían de utilidad para el diagnóstico de ERGE.
8b. ¿Se recomienda el hallazgo endoscópico de esofagitis erosiva (según la clasificación de Los Ángeles) para el diagnóstico de ERGE?
Calidad de la evidencia: MUY BAJA ⨁○○○
Fuerza de recomendación: FUERTE A FAVOR
La EGD tiene utilidad diagnóstica en la ERGE. La indicación principal para realizar una EGD en un paciente con síntomas de ERGE es la presencia de síntomas de alarma como disfagia, anemia, pérdida de peso, falta de respuesta al tratamiento y otras indicaciones como el tamizaje de esófago de Barrett en pacientes con factores de riesgo.17,72,74 Para poder realizar diagnóstico de ERGE a través de la EGD, es necesario encontrar rupturas de la mucosa, conocidas como erosiones.17 Las erosiones en la mucosa se clasifican según la clasificación de LA85 grado A: rupturas o erosiones menores a 5 mm; grado B: rupturas mayores a 5 mm; grado C: rupturas que toman pliegues pero abarcan menos del 75% de la circunferencia de la mucosa, y grado D: rupturas que toman más del 75% de la circunferencia de la mucosa.85
Por este motivo, nos preguntamos cuál es la utilidad de los hallazgos endoscópicos de EE según la clasificación de LA para el diagnóstico de ERGE.
Para formular la pregunta PICO, se consideró como población a los pacientes con síntomas de ERGE, como intervención el hallazgo de EE en la EGD, como comparación el TEA anormal y como desenlace el diagnóstico de ERGE.
No encontramos información extraíble para poder realizar un análisis cuantitativo de esta pregunta PICO. Por ello, este documento no incluye una tabla que sintetice estudios para extraer sensibilidad y especificidad.
Según el consenso de Lyon y de Porto, la esofagitis de alto grado (LA grados C o D), el esófago de Barrett de segmento largo (≥ 3 cm) o la estenosis péptica se consideran evidencia confirmatoria de ERGE.17,86,87 Sin embargo, la esofagitis erosiva se encuentra en solo el 30% de los pacientes con pirosis y sin tratamiento previo y en menos del 10% de los pacientes que reciben IBP.88,89 Además, la mayor parte de las esofagitis de grado bajo, particularmente LA grado A, son inespecíficas, y se encuentran en el 5% al 7,5% de los controles asintomáticos.90-92
Cuando está bien definida, la esofagitis LA grado B proporciona una evidencia adecuada para el inicio del tratamiento médico de la ERGE. No obstante, existe una variabilidad interobservador, lo que llevó a un panel de expertos en los consensos de Lyon y Porto a concluir que se requiere la evidencia adicional de una pH-metría antes de confirmar el diagnóstico.17,87,93
A pesar de esto, en las guías recientemente publicadas del ACG, un grupo de expertos considera la esofagitis a partir del grado B prueba objetiva de ERGE.72
Con esta información, puede concluirse que la EGD es una prueba útil para diagnosticar la ERGE cuando se encuentran erosiones de la mucosa en un grado severo.
El panel de expertos estuvo de acuerdo en un 93% en que es posible realizar el diagnóstico de ERGE sobre la base del hallazgo de EE LA C o mayor.
En relación con el esófago de Barrett y la estenosis peptica, está bien documentada su asociación con la ERGE y avalada en los consensos de Lyon y Porto,17, 87 por lo que no fue tratado particularmente en este consenso.
9. ¿Se recomienda la laringoscopía para el diagnóstico de reflujo laringofaríngeo?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
El RLF es un subtipo de la ERGE extraesofágica. Se trata de una condición desafiante, dado que no existe en la actualidad un patrón de oro para su diagnóstico o tratamiento, por lo que representa una fuerte carga en los costos del sistema de salud. El RLF ha sido implicado en varios síntomas, que incluyen disfonía, tos, carraspeo y globus faríngeo. También se cree que podría contribuir a la génesis de otras patologías como la rinitis, la sinusitis y la otitis media.94
Se estima que del 20%-60% de la población norteamericana presenta síntomas compatibles con RLF y un 10% consultan al otorrinolaringólogo al menos una vez en su vida.95,96 El alto número de consultas y de prescripciones llevaron a que haya un fuerte impacto económico en relación con esta entidad. Entre 1990 y el 2001, se registró un aumento de 14 veces en las prescripciones de IBP.97 Se estima que los costos relacionados con la evaluación y el tratamiento del RLF superan 5,6 veces a los de la ERGE típica y superan también los costos anuales por cáncer.66
A pesar de la falta de un patrón de oro, es habitual que los médicos generalistas, los otorrinolaringólogos, los alergistas y los gastroenterólogos realicen el diagnóstico de RLF sobre la base de la presencia de síntomas y los hallazgos laringoscópicos.98
Es importante considerar que existe una serie de condiciones que pueden presentarse con los mismos síntomas y hallazgos laringoscópicos que el RLF. El algoritmo diagnóstico comienza siempre con una adecuada anamnesis y un examen clínico, e incluye la laringoscopía con el objetivo de descartar otras condiciones diferentes al RLF, como el cáncer, los papilomas, la candidiasis o los granulomas, entre otras.99 Los signos laringoscópicos que han sido asociados a RLF son múltiples y variables, destacándose entre ellos el edema y eritema de las cuerdas vocales, la obliteración ventricular y la pseudosulcus ovalis.100
Belafsky y col. desarrollaron el reflux finding score (RFS), que evalúa la severidad de 8 hallazgos laringoscópicos (edema subglótico, obliteración ventricular, eritema/hiperemia, edema de las cuerdas vocales, edema laríngeo difuso, hipertrofia de la comisura posterior, tejido de granulación y excesivo moco endolaríngeo). Este score tiene un rango de 0 (normal) a 26 (peor score posible), siendo sugestivo de RLF un valor mayor a 11.101, 102
Sin embargo, la laringoscopía como método para diagnosticar el RLF ha sido criticada por su falta de especificidad, poca confiabilidad y elevada variabilidad interobservador.103-105 En un estudio, se encontró que el 86% de los voluntarios sanos tenían hallazgos en la hipofaringe que se habían asociado con ERGE cuando los videos de la laringoscopía fueron evaluados de forma cegada por otorrinolaringólogos expertos en RLF.106 En otro estudio, se observó que hasta el 93% de los sujetos asintomáticos presentaron hallazgos laringoscópicos de irritación laríngea posterior.107 Por otro lado, el diagnóstico de RLF basado en hallazgos laringoscópicos hace que se indiquen tratamientos innecesarios. En un estudio, se mostró que un grupo de pacientes con diagnóstico de RLF sobre la base de los síntomas y la laringoscopía no mejoró luego de la realización de una funduplicatura de Nissen.108 Además, en un metaanálisis de 8 estudios aleatorizados y controlados, no se observó una reducción de los síntomas luego de 8 a 16 semanas de tratamiento con IBP en pacientes con RLF.109
La pregunta PICO fue confeccionada tomando como población a los pacientes con síntomas de RLF, como intervención la laringoscopía, como comparador el monitoreo ambulatorio de reflujo con medición de TEA y como resultado el diagnóstico de ERGE.
Para el análisis cuantitativo (Tabla 9), se logró extraer información de los trabajos de Herbella y Woo.110, 111 Se determinó que la laringoscopía tiene una sensibilidad del 86% (95% IC: 71 a 85) y una especificidad del 9% (95% IC: 3 a 22) para el diagnóstico de ERGE. Cabe destacar que se trata de dos estudios con un número pequeño de pacientes incluidos y con un alto riesgo de sesgo.
Tabla 9.
Pregunta 9: ¿Cuál es la utilidad diagnóstica de la laringoscopía para el diagnóstico de ERGE extraesofágico?
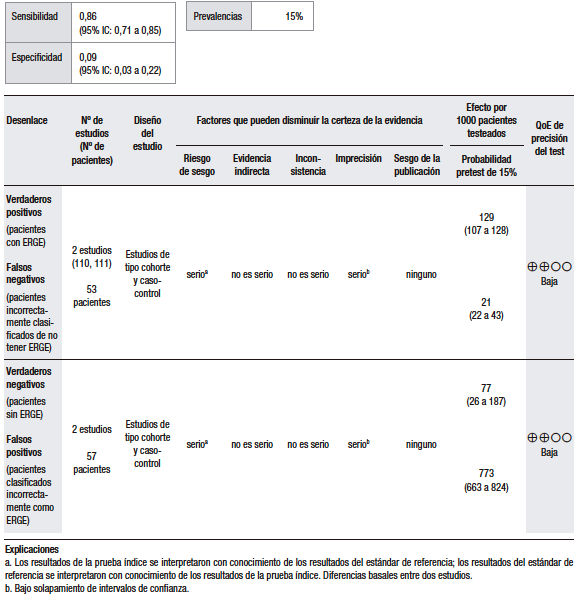
Herbella y col. estudiaron a 79 pacientes con diagnóstico de RLF sobre la base de los síntomas. Treinta y seis (46%) pacientes presentaron diagnóstico de ERGE sobre la base de un score de De Meester mayor a 14,7%, y de reflujo faríngeo sobre la base de un TEA mayor al 1% medido por pH-metría con doble sensor esofágico y faríngeo. Veinticinco de estos pacientes (69%) presentaron un TEA anormal proximal y distal. La laringoscopía como test diagnóstico de ERGE tuvo una sensibilidad del 86% (IC 70-95%), una especificidad del 9% (IC 3-22%), una precisión del 44% (IC 33-55%), un VPP del 44% (IC 32-57%) y un VPN del 44% (IC 13-78%).(110) Hay que considerar que en este trabajo se consignó el score de De Meester para realizar el diagnóstico de ERGE, lo cual ya no se considera adecuado.
Woo y col. evaluaron a 31 pacientes con globus. Diecisiete de estos pacientes tuvieron hallazgos laringoscópicos anormales: eritema faríngeo (12), paquidermia interaritenoideo (11), edema laríngeo (11), eritema aritenoide (9) y moco espeso (3). En la pH-metría con doble sensor se encontró que 21 pacientes (68%) tuvieron diagnóstico de ERGE. No se observó una asociación significativa entre los hallazgos laringoscópicos y la pH-metría anormal.111
Para concluir, a pesar de la variabilidad metodológica de los estudios publicados y el uso de diferentes métodos diagnósticos y criterios para definir la ERGE, la laringoscopía no parece ser un método adecuado para definir el diagnóstico de RLF.
El panel de expertos estuvo de acuerdo en un 100% en recomendar en contra de los hallazgos laringoscópicos para el diagnóstico de ERGE. A pesar de que en pacientes con síntomas extraesofágicos es un estudio importante con el objetivo de descartar otras condiciones, no sería un método adecuado para realizar el diagnóstico de ERGE.
10. ¿Se recomienda la cromoendoscopía electrónica con magnificación (para detectar esofagitis con cambios mínimos) para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
Sobre la base de los hallazgos de la EGD, los pacientes con ERGE pueden clasificarse en tres grupos: enfermedad por reflujo no erosiva (ERNE), EE y esófago de Barrett.4,112 La ERNE se ha definido como la presencia de síntomas de ERGE, EGD negativa y TEA anormal.4 Debido a que la ERNE representa hasta el 70% de los casos de la ERGE, la EGD estándar es una prueba poco sensible para el diagnóstico de ERGE.92,113
Por tal motivo, se han desarrollado nuevas técnicas de endoscopía cuyo objetivo es la detección de lesiones superficiales o muy pequeñas que no pueden ser identificadas por la endoscopía convencional. Estas modalidades endoscópicas incluyen la endoscopía con luz blanca de alta definición, la cromoendoscopía, la endoscopía de magnificación y la cromoendoscopía electrónica (imagen de banda estrecha o NBI, por sus siglas en inglés, y el I-scan).113 Las lesiones detectadas con estas técnicas se han denominado “esofagitis con cambios mínimos”.113 Es importante conocer la evidencia científica que defina cuál es la utilidad de la cromoendoscopía electrónica en el diagnóstico de ERGE.
Para elaborar la pregunta PICO, se tomó como población a los pacientes con síntomas de ERGE sin evidencia de lesiones en la endoscopía de luz convencional, como grupo control a los sujetos sin síntomas de ERGE y endoscopía negativa y como desenlace el diagnóstico de ERGE. En contraste con otras preguntas PICO en este consenso, para esta pregunta no se utiliza como comparador el monitoreo ambulatorio de reflujo con medición de TEA, debido a la carencia de estudios al respecto.
La cromoendoscopía electrónica fue evaluada en dos estudios (Tabla 10). En el análisis cuantitativo, considerando una prevalencia de ERGE del 15%, se calculó un rango de sensibilidad entre los estudios que oscila entre el 48% y el 75% y una especificidad de entre 83% y 100% para la cromoendoscopía como prueba diagnóstica.
Tabla 10.
Pregunta 10: ¿Cuál es la utilidad diagnóstica de la cromoendoscopía electrónica con magnificación (esofagitis con cambios mínimos) para el diagnóstico de ERGE?
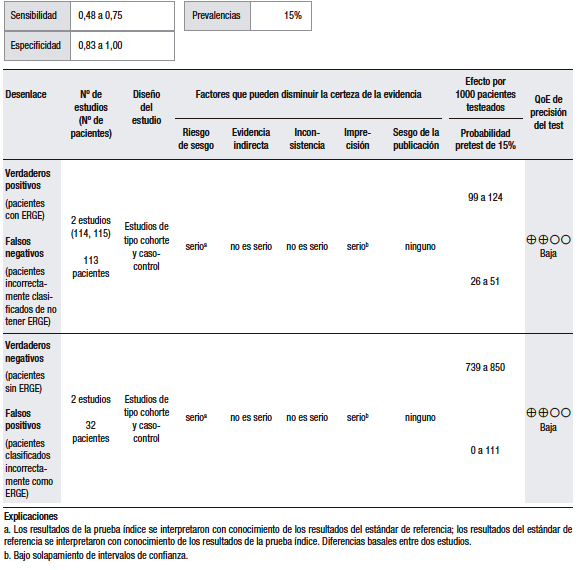
Sharma y col., en un estudio en 50 pacientes (20 con síntomas de reflujo y 30 controles) sin evidencia de esofagitis en la endoscopía de luz blanca de alta resolución, observaron que el uso de NBI identificó varias lesiones endoscópicas que fueron significativamente más frecuentes en los pacientes con ERNE, en comparación con los controles. Las lesiones mínimas incluyeron anormalidades en las asas capilares intrapapilares (número, dilatación o tortuosidad), presencia de microerosiones, vascularidad y un patrón cresta-velloso (ridge-villous) de la unión escamocolumnar. La concordancia intraobservador para estos cambios con NBI fue de baja a moderada (k 0,39-0,52) y la concordancia interobservador fue de moderada a buena (k 0,48-0,88). La sensibilidad y la especificidad estimadas para el hallazgo de dilatación de asas capilares intrapapilares fue del 80% y 83,3%, respectivamente.114
Rey col. evaluaron la utilidad de la cromoendoscopía electrónica usando I-Scan y la compararon con la cromoendoscopía con lugol en 65 pacientes con ERNE y 27 controles. La biopsia esofágica se utilizó como estándar de oro. Los resultados mostraron que la cromoendoscopía electrónica con I-Scan tiene una sensibilidad del 100% y una especificidad del 82%, en contraste con la cromoendoscopía con lugol que tuvo una sensibilidad del 92% y una especificidad del 50% (Tabla 10).115 Es importante notar que la biopsia esofágica (el estándar de oro usado en este estudio) tiene serias limitantes para diagnosticar la ERGE (véase la pregunta 12 más adelante).
Para que estas tecnologías sean consideradas una herramienta diagnóstica en los pacientes con ERNE, deben cumplir con ciertos criterios, que incluyen: 1) los hallazgos endoscópicos identificados con estas técnicas deben ser reproducibles, con una elevada concordancia intra e interobservador; 2) deben distinguir a los pacientes con ERNE de los sujetos sanos; 3) los pacientes con una prueba positiva deben responder a una terapia específica antirreflujo, en comparación con aquellos con una prueba negativa; 4) las lesiones deben cicatrizar con la terapia antirreflujo y 5) deben estar ampliamente disponibles y tener un costo razonable. De acuerdo con estos criterios, se concluye que, aunque la cromoendoscopía electrónica y otras técnicas endoscópicas parecen ser prometedoras para el diagnóstico de ERGE, la evidencia aún es insuficiente para considerarlas útiles, ya que los estudios son limitados, en poblaciones pequeñas y todavía no existen estudios que demuestren que los pacientes con hallazgos catalogados como esofagitis con cambios mínimos respondan a la terapia antisecretora con cicatrización de las lesiones.
El grupo de expertos opinó, con un consenso del 80%, que, sobre la base de la evidencia actual, no es posible recomendar estas técnicas para el diagnóstico de ERGE. Quizás, en el futuro, en la medida en que exista mayor evidencia y mejoras en la tecnología, podría llegar a ser una técnica de utilidad.
11. ¿Se recomienda la biopsia endoscópica de esófago en pacientes con enfermedad no erosiva para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
Si bien la evaluación de la ERGE mediante una pH-metría de 24 horas se considera el patrón de oro, el uso de sonda se asocia a malestar en la mayoría de los pacientes.116-118 Por otro lado, la evaluación endoscópica macroscópica es subóptima. En ese contexto, sería ideal que, en la misma endoscopía índice, se pudiera evaluar certeramente la posibilidad de reflujo gastroesofágico patológico.
La evaluación de la llamada esofagitis microscópica comenzó durante la década de 1970, coincidentemente con la posibilidad de tomar muestras de biopsia a través de la EGD.119 Componentes del material refluido, especialmente el ácido, son capaces de inducir cambios, que incluyen hiperplasia de la capa celular basal, elongación de las papilas, dilatación de los espacios intercelulares (espongiosis), necrosis/erosiones y la presencia de infiltrado celular inflamatorio con eosinófilos, linfocitos, mastocitos y polimorfonucleares.
Para elaborar la pregunta PICO, se tomó como población a los pacientes con síntomas de ERGE sin evidencia de lesiones en la endoscopía de luz convencional, como intervención los hallazgos histológicos (scoring histológico (SH)), como comparador el TEA patológico y como desenlace el diagnóstico de ERGE.
El análisis cuantitativo hecho sobre la base de la revisión de estudios que han evaluado hallazgos histológicos como diagnóstico de ERGE ha mostrado un rendimiento solo moderado, con una sensibilidad y una especificidad de entre el 60% y el 85% (Tabla 11).120-122 El principal impedimento para su utilización en la práctica clínica es su baja especificidad, pues se ha descrito que entre el 15% y el 37% de los individuos sanos asintomáticos tienen scores histológicos por sobre los valores de corte.120, 121 A esto debe agregarse que, si bien la evidencia es contradictoria, se ha mostrado en estudios que scores histológicos combinados no son capaces de diferenciar entre ERNE y pirosis funcional.123, 124
A pesar de los intentos formales para la estandarización de la evaluación histológica,125, 126 los estudios aún difieren en las variables incluidas (variables altamente sensibles, pero poco específicas, como la hiperplasia basal, y otras más específicas, pero poco sensibles, como los infiltrados celulares) y la forma de evaluarlos (cuantitativa o semicuantitativa), determinando valores de corte muy diferentes (Tabla 11 SH). Tampoco se ha estandarizado el sitio de obtención de las muestras: la sensibilidad de los hallazgos aumenta más cerca de la línea Z127 y en la zona correspondiente a la curvatura menor.128 En la tabla de los pacientes con SH, se incluyeron 5 estudios; para una prevalencia de ERGE del 15%, el rango de sensibilidad y de especificidad fue de 67% a 85% y de 63% y 91%, respectivamente.
Tabla 11 SH.
Pregunta 11 SH: ¿Cuál es la utilidad diagnóstica de la biopsia endoscópica de esófago en pacientes con enfermedad no erosiva (scoring histológico) para el diagnóstico de ERGE?
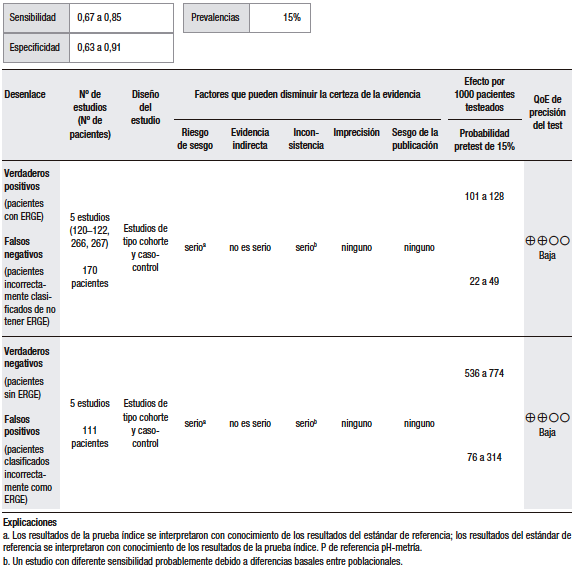
Dentro de las variables histológicas más estudiadas está el aumento del espacio intercelular (espongiosis), que ha mostrado una certeza subóptima para diferenciar la ERGE de individuos sanos y de pirosis funcional (Tabla 11 DIS).33,120 En el análisis cuantitativo de los pacientes con espacios intercelulares dilatados (DIS), se incluyeron dos estudios. Para una prevalencia del 15% de ERGE, los rangos de sensibilidad y especificidad observados fue el siguiente: 61% y 87% para la sensibilidad y 56% y 70% para la especificidad.
Tabla 11 DIS.
Pregunta 11 DIS: ¿Cuál es la utilidad diagnóstica de la biopsia endoscópica de esófago en pacientes con enfermedad no erosiva para el diagnóstico de ERGE?
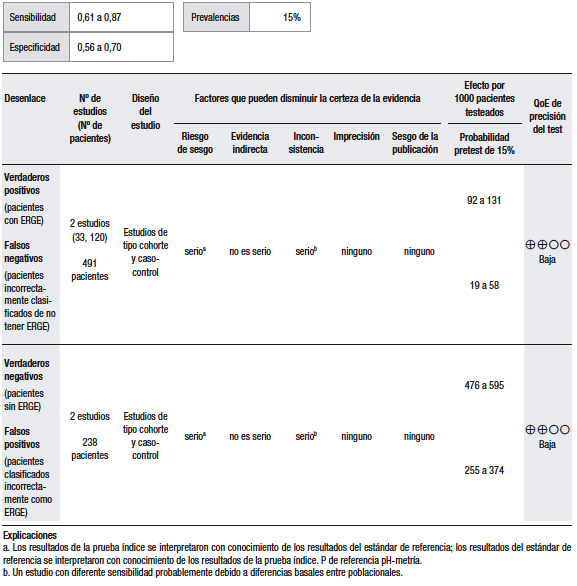
Esta capacidad está dada casi solo a expensas de los individuos con EE, pues no es clara su capacidad de diferenciar la ERNE de la pirosis funcional.33,123,129,130 Esto se debe de manera importante a que la espongiosis parece ser una forma estereotipada de respuesta del epitelio esofágico ante diversas noxas/patologías, como la esofagitis linfocítica,131 la esofagitis eosinofílica,132 el cáncer de esófago,133 la candidiasis esofágica134 e incluso patologías extraluminales como la obesidad135 o la ansiedad.136 Se ha descrito un aumento transitorio de los espacios intercelulares minutos tras la acidificación del esófago,137 lo que podría explicar que entre el 25 y el 30% de los individuos sanos presenten espongiosis.120,122,127
Dada esta certeza subóptima, debida básicamente a problemas de especificidad, no es recomendable el reemplazo de los actuales patrones de oro por el diagnóstico histológico. Considerando el requerimiento de un procedimiento aparte y la presencia de un patólogo experto, tampoco parece recomendable el uso complementario de la biopsia para el diagnóstico positivo de ERGE, más allá de su utilidad en el diagnóstico diferencial de esofagitis eosinofílica. Esto está en línea con lo referido en otras guías de manejo publicadas hasta hoy.17,74,138
El panel de expertos estuvo un 100% de acuerdo en que, en la actualidad, no es una técnica adecuada para realizar el diagnóstico de ERGE.
12. En el diagnóstico de ERGE, ¿se recomienda la pH-metría inalámbrica de al menos 48 horas versus la pH-metría convencional de 24 horas?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: DEBIL A FAVOR
La medición ambulatoria del pH esofágico es considerada la prueba más útil para la detección y cuantificación del reflujo gastroesofágico. Además, permite establecer la asociación entre los síntomas y los episodios de reflujo.72 La pH-metría con catéter (pH-C) o la pH-CI son las dos técnicas más utilizadas para medir el TEA en pacientes con sospecha de ERGE. La pH-C consiste en la medición del pH esofágico mediante un catéter que se coloca por vía nasal en el esófago. El catéter puede tener uno o varios sensores de pH. El sensor distal se coloca a 5 cm del esfínter esofágico inferior, el cual debe ser identificado mediante manometría esofágica. El catéter se conecta a un aparato de registro portátil y la medición del pH esofágico puede hacerse hasta por 24 horas. La pH-CI consiste en la fijación a la pared esofágica de una cápsula inalámbrica con un sensor de pH, a 6 cm de la unión esofagogástrica, identificada mediante una EGD. Las mediciones del pH se transmiten por telemetría a un aparato de registro portátil. Esta tecnología permite el monitoreo del pH hasta por 96 horas.139 Es importante conocer la evidencia científica acerca de las ventajas y desventajas de ambas técnicas para el diagnóstico de ERGE.
Para la elaboración de la pregunta PICO, se consideró a la población de pacientes con síntomas de ERGE, se compararon ambas técnicas de pH y los desenlaces fueron la tolerancia, la exactitud diagnóstica y las dificultades técnicas.
La tolerancia, la seguridad, las dificultades técnicas y la utilidad diagnóstica de ambas pruebas han sido evaluadas en una revisión sistemática de Kessels y col.140 En el análisis cuantitativo, se incluyeron 10 estudios en los que se comparó la seguridad de la pH-C versus la pH-CI.11-20 (Tabla 12a) El dolor torácico y la sensación de cuerpo extraño ocurrieron más frecuentemente con la pH-CI que con la pH-C. En contraste, el dolor nasal y de garganta, la disfagia y la dificultad para comer o beber fueron más frecuentes con el monitoreo con pH-C que con pH-CI. El malestar general y la interferencia con las actividades diarias fueron más comunes con la pH-C y el grado de satisfacción con el procedimiento fue mayor con la pH-CI. Otros efectos adversos encontrados con ambos procedimientos fueron tos, cefalea, trastornos del sueño, dolor abdominal, náuseas y vómitos. Por otro lado, las dificultades técnicas entre ambos procedimientos fueron evaluadas en 9 estudios, 1 de los cuales se realizó en niños.116,118,141-145-149 No se encontraron diferencias entre pH-C y pH-CI en el estudio en la población pediátrica. En adultos, el porcentaje de dificultades técnicas fue más alto con la pH-CI que con la pH-C. El riesgo de tener problemas técnicos fue 3 veces mayor con la pH-CI que con la pH-C. El desprendimiento prematuro de la cápsula, las fallas para fijar la cápsula y la intolerancia en su inserción fueron los problemas más comunes con la pH-CI. La incomodidad del catéter y el subsecuente retiro del sistema fueron los más comunes con la pH-C.
Tabla 12a
Pregunta 12: En el diagnóstico de ERGE, ¿cuál es la ventaja de la pH-metría inalámbrica > 48 horas vs. pH-metría convencional de 24 horas?
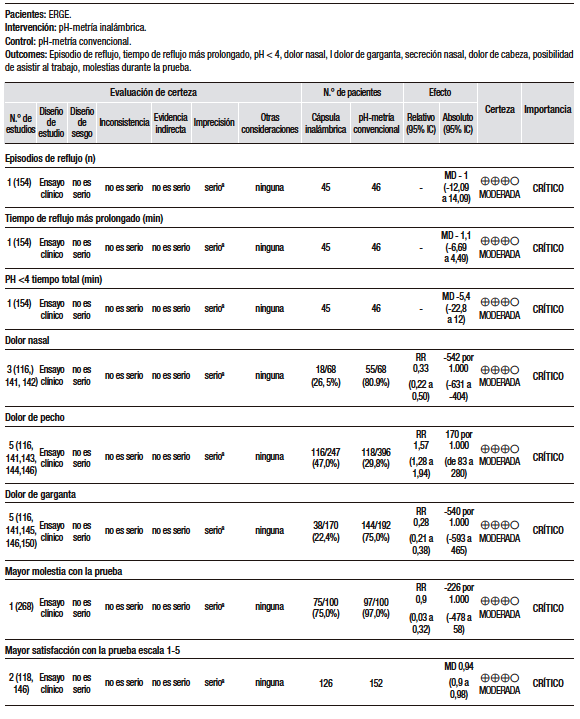
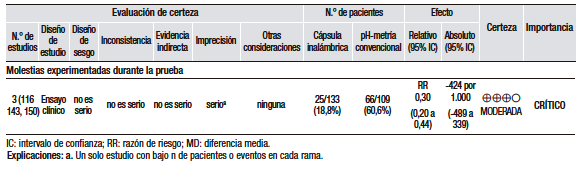
La utilidad diagnóstica fue evaluada en 8 estudios.142,148-154 Los criterios para considerar una prueba positiva o negativa fueron variables entre los estudios e incluyeron el porcentaje total de pH >4 en la mayoría o el análisis del peor día en otros. En general, la utilidad diagnóstica de la pH-CI fue mayor que la de la pH-C. El estudio de mayor calidad reportó que la pH-CI tuvo la mejor sensibilidad y especificidad (86,4% y 77,8%, respectivamente) cuando se consideró una prueba positiva para ERGE definida por un pH <4 de más del 4,4% del tiempo total de monitoreo (Tabla 12b).142 En el análisis cuantitativo se ingresaron tres estudios, se calculó un rango de sensibilidad del 74% al 88% y de especificidad del 80% al 93%.
Tabla 12b.
Pregunta 12: En el diagnóstico de ERGE, ¿cuál es la ventaja de la pH-metría inalámbrica > 48 horas vs. pH-metría convencional de 24 horas?
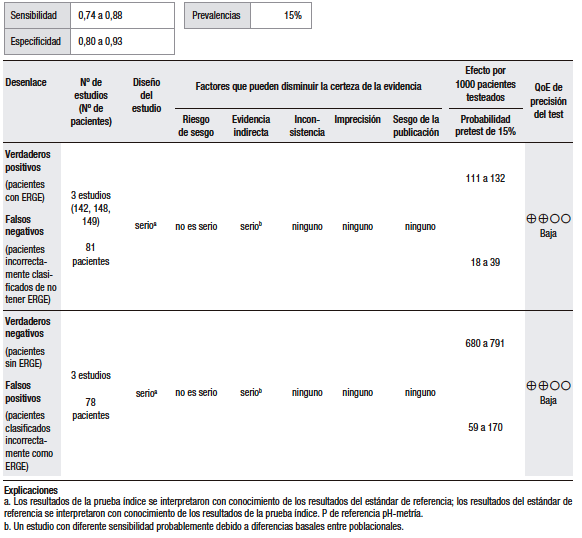
En varios estudios, se ha evaluado la utilidad de prolongar el estudio con pH-CI hasta por 96 horas. Prakash y col. mostraron que prolongar el estudio de 1 a 2 días registra dos veces más el número de síntomas disponibles para establecer la asociación con episodios de reflujo. Las 24 horas adicionales incrementan la detección de exposición esofágica al ácido en un 12,4% de los sujetos estudiados.155 Scarpulla y col. demostraron que la extensión del estudio a 96 horas aumenta la sensibilidad del 63% en 24 horas al 83% a las 48 horas y al 91% a las 72 horas.156 Patel y col. mostraron que la medición del pH por 4 días aumentó la exactitud diagnóstica en un 20% usando el IS.157
Además, la medición del pH por 96 horas permite la evaluación de los pacientes sin y con tratamiento con IBP. Garrean y col. estudiaron el efecto del tratamiento con IBP en el pH esofágico, evaluando a los pacientes los dos primeros días de monitoreo sin tratamiento y los días 3 y 4 con tratamiento con IBP. Los autores demostraron que el IS, el índice de sensibilidad sintomática y la SAP se redujeron significativamente en los días 3 y 4 después del inicio del tratamiento.158
En resumen, se concluye que la medición del reflujo gastroesofágico con la pH-CI es mejor tolerada por el paciente que la pH-C. La pH-CI tiene mayor sensibilidad y especificidad diagnóstica que la pH-C. La medición prolongada del pH con la cápsula inalámbrica hasta por 96 horas permite una detección mayor de síntomas y de exposición esofágica al ácido que el estudio de 24 horas con pH-C. Además, es posible realizar una medición del reflujo sin y con tratamiento antisecretor de ácido, lo que permitiría categorizar a los pacientes en aquellos que responden a IBP y los refractarios.
El panel de expertos consideró, con un acuerdo del 67%, que hay mayor probabilidad de detección de eventos con el registro de pH-CI, se supera la variabilidad diaria en el registro del pH y, además, genera menor incomodidad que el pH-C y el paciente puede mantener una vida más normal. Sin embargo, no sabemos si la pH-CI predice una mejor respuesta al tratamiento, ya que el aumento en la tasa de falsos positivos relacionado con pH-Cl no ha sido clarificado. Por otro lado, los costos son elevados y en varios países de Latinoamérica la disponibilidad todavía es baja.
13. ¿Se recomienda utilizar el número de episodios de reflujo medido por impedanciometría/pH para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: DÉBIL A FAVOR
La MII-pH de 24 horas, además de medir el TEA a través del electrodo de pH, mide la impedancia (inversa de la conductividad) a través de una serie de electrodos que se encuentran a lo largo del catéter. Mediante esta propiedad, pueden detectarse todos los episodios de reflujo (líquido, gas o mixto) y pueden categorizarse en ácidos (con pH <4) y no ácidos (con pH> 4, subcategorizados como débilmente ácidos o débilmente alcalinos).
En pacientes con síntomas refractarios a IBP y sin EE severa (LA C o D) ni esófago de Barrett, está consensuado realizar el monitoreo ambulatorio de reflujo (pH-C, MII-pH o pH-CI) sin tratamiento con IBP (OFF IBP) para documentar la presencia o ausencia de reflujo patológico.17 En pacientes con ERGE comprobada y síntomas persistentes, debe realizarse MII-pH con IBP (ON IBP), para entender si los síntomas persistentes están relacionados con el reflujo.17,87 Cuando se realiza la prueba ON IBP, se requiere el uso de MII-pH para detectar la presencia de reflujo débilmente ácido o no ácido, que podría contribuir a la asociación síntoma-reflujo y no será detectado por monitoreo de pH solo.16
La medición del número de episodios de reflujo (ácidos, débilmente ácidos o débilmente alcalinos) es sobreestimada por el análisis automático, por lo que requiere una revisión manual.159 El Consenso de Lyon propuso que más de 80 episodios de reflujo en 24horas es definitivamente anormal, menos de 40 es fisiológico y valores intermedios son inconclusos.17
Para la confección de la pregunta PICO, se tomó como población a los pacientes con síntomas de ERGE, como intervención el número de episodios de reflujo, como comparador el TEA y como desenlace el diagnóstico de ERGE.
En base a la evidencia disponible, no fue posible realizar un análisis cuantitativo adecuado que responda directamente la pregunta PICO (Tabla 13). Sobre la base de una prevalencia de ERGE del 15%, se calculó una sensibilidad del 75% (IC 95% 65-82).
Tabla 13.
Pregunta 13: ¿Cuál es la utilidad diagnóstica del número de episodios de reflujo medido por impedanciometría para el diagnóstico de ERGE?
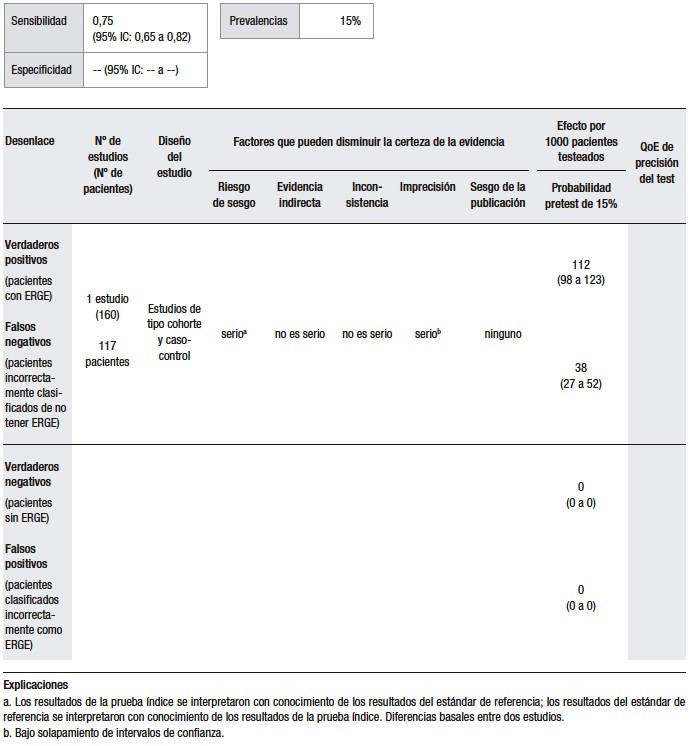
En el estudio incluido en esta tabla, Masiak y col. compararon los datos de la MII-pH de 213 pacientes con síntomas de ERGE (117 ERNE) con los de 21 controles sanos. Se determinó que la sensibilidad de la MII-pH para la detección de reflujo ácido resultó ser del 75% (IC 95% 65-82). Hay que considerar que se trata de un estudio con una importante imprecisión y un alto riesgo de sesgo.160
A pesar de que los estudios piloto iniciales resultaban muy prometedores en relación con la utilidad del número de episodios de reflujo medido por MII-pH,35 posteriormente surgieron algunos estudios observacionales en pacientes no seleccionados con síntomas de ERGE, en los que el número de episodios de reflujo no resultó ser un predictor independiente de respuesta al tratamiento. Patel y col. observaron que, en 128 pacientes con un seguimiento de cinco años, el número de episodios de reflujo no resultó ser un parámetro predictor de respuesta clínica al tratamiento médico.15 Zerbib y col., en el año 2012, evaluaron la respuesta al tratamiento con IBP en 100 pacientes con pirosis o regurgitación. El número de episodios de reflujo no resultó ser un predictor de respuesta al tratamiento en el análisis uni y multivariado.161
Posteriormente, se publicaron dos ensayos clínicos aleatorizados y controlados, en los que se observó que, en pacientes altamente seleccionados, con regurgitación como síntoma dominante, el número de episodios de reflujo resultó ser un predictor de respuesta a la colocación de un esfínter magnético. Bell y col. mostraron una mejoría de los episodios de regurgitación después de la colocación de un esfínter magnético, en pacientes con un número aumentado de episodios de reflujo en la MII-pH de 24 horas.162 Por otro lado, Rogers y col. determinaron que, en 152 pacientes con regurgitación como síntoma dominante, refractaria al tratamiento con IBP, que fueron aleatorizados a recibir tratamiento médico o a colocación de un esfínter magnético, el número de episodios de reflujo de más de 80 en el estudio ON IBP resultó ser un predictor de respuesta al tratamiento.163
A pesar de esto, en las últimas guías publicadas por la AGA, se establece la realización de un monitoreo ambulatorio de reflujo prolongado a través de una pH-CI en pacientes con síntomas de ERGE refractarios y con una EGD normal. De esta forma, no se toma en consideración como un elemento de importancia el número de episodios de reflujo para el diagnóstico de ERGE.6
Para concluir, la baja calidad de los estudios publicados limita el adecuado análisis cuantitativo de la pregunta PICO. Sin embargo, el número de episodios de reflujo es una métrica que podría proveer información muy útil para entender los mecanismos de los síntomas y pronóstica en relación con la respuesta al tratamiento médico o quirúrgico, principalmente en pacientes con regurgitación como síntoma dominante.
El panel de expertos considera, con un acuerdo del 93%, que la medición del número de episodios de reflujo resultaría de utilidad como información complementaria, en el caso de que se realice una MII-pH OFF IBP como primer estudio. En pacientes con síntomas refractarios a IBP, fundamentalmente regurgitación, la medición del número de episodios de reflujo en la MII-pH ON IBP podría proveer información pronóstica en relación con la respuesta al tratamiento. Por lo antedicho, el panel de expertos recomendó de manera débil a favor de la medición del número de episodios de reflujo.
14. ¿Se recomienda el uso de los nuevos parámetros de impedanciometría (PSPWI e impedancia basal nocturna media) para el diagnóstico de ERGE?
Para facilitar la comprensión de esta pregunta, el grupo de expertos decidió dividirla en dos (a y b).
14a. ¿Se recomienda el uso del PSPWI para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
Un mecanismo descripto para disminuir la presencia de ácido en el esófago (clearance químico) consiste en una onda de peristalsis primaria gatillada por la presencia de reflujo, que lleva saliva al lumen esofágico. Dado su alto contenido de bicarbonato, la saliva contribuye a la normalización del pH.164 Este mecanismo se conoce como onda peristáltica inducida por deglución post-reflujo (PSPW, según sus siglas en inglés) y su alteración se ha descrito como un mecanismo fisiopatológico relevante en la ERGE.165 Recientemente, se ha descrito el índice de PSPW (PSPWI), que corresponde al porcentaje de eventos de reflujo que son seguidos de una PSPW.
Para la confección de la pregunta PICO, se tomó como población a los pacientes con síntomas de ERGE, como intervención el PSPWI, como comparador el TEA y como desenlace el diagnóstico de ERGE.
Se ha reportado que el PSPWI no se modifica significativamente tras el tratamiento médico o quirúrgico.166,167 Para el análisis cuantitativo, se han considerado estudios provenientes de Europa que han mostrado una adecuada certeza diagnóstica del PSPWI para el diagnóstico de ERGE, especialmente en términos de sensibilidad, tanto para estudios con, como sin IBP (Tabla 14a).167,168 Sin embargo, un reciente estudio en Asia mostró una menor certeza diagnóstica para diferenciar la ERGE de la pirosis funcional (Tabla 14a), además de un valor de corte sugerido notoriamente menor al previamente descrito.169 Basado en una prevalencia del 15% de ERGE, el PSPWI tuvo un rango de sensibilidad de entre el 79% y 100% y un rango de especificidad de entre el 65% y 87%.
Tabla 14a.
Pregunta 14 PSPWI: ¿Cuál es la utilidad diagnóstica del PSPWI para el diagnóstico de ERGE?
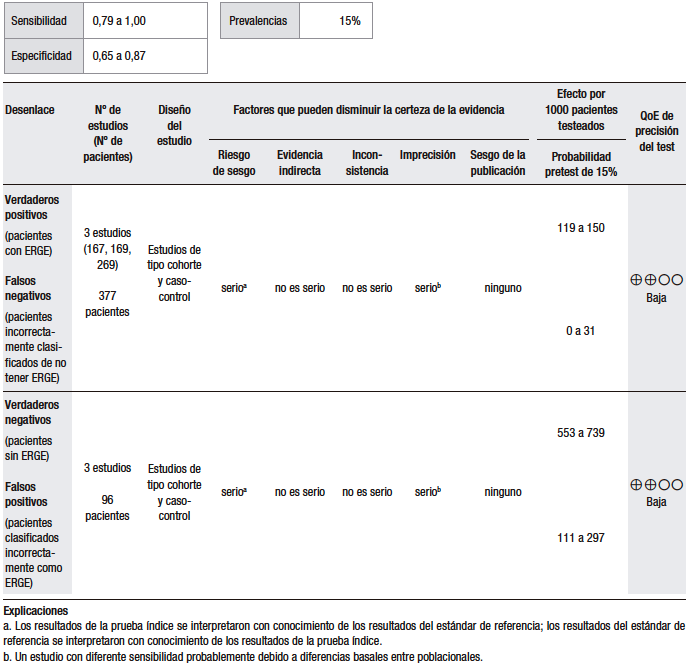
La mayor cantidad de información reportada en relación con el PSPWI es, sin embargo, en su rol de predictor de respuesta al tratamiento, tanto médico166,168 como quirúrgico,168 en el contexto de la ERGE. Recientemente, se publicó un artículo europeo que muestra que el PSPWI es útil como predictor de respuesta al tratamiento en pacientes con TEA intermedio (4-6%).170 No obstante, debe consignarse que un reciente estudio multicéntrico realizado en Europa y los Estados Unidos no logró demostrar una diferencia en el PSPWI entre los respondedores y los no respondedores a la escalada de terapia en la ERGE, utilizando MII-pH ON IBP.171
Dada la ausencia de un valor de corte universalmente establecido, la dificultad en su determinación (debe hacerse de forma manual) y los rangos subóptimos de sensibilidad y especificidad, el uso del PSPWI no está aún establecido ampliamente. Puede recomendarse su uso como adyuvante en el diagnóstico, por ejemplo, en caso de TEA intermedios y/o en estudios ON IBP.
El panel de expertos considera, con un 100% de acuerdo, que esta métrica no sería de utilidad para el diagnóstico de ERGE, aunque podría tener alguna utilidad en la evaluación de pacientes que se encuentran en el área gris (TEA 4-6%).
14b. ¿Se recomienda el uso de impedancia basal nocturna media para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: DÉBIL A FAVOR
Como se ha descripto, el material refluido puede inducir daño en la mucosa esofágica, lo que se traduce en un aumento de los espacios intercelulares. Esto determina que la mucosa aumente su capacidad de conducir electricidad, existiendo una buena correlación entre la integridad y la impedancia de la mucosa,172 incluso en ausencia de esofagitis macroscópica.173
La correcta evaluación de la impedancia mucosa requiere un estrecho contacto entre esta y la sonda, en lo posible evitando que en la interfaz exista gas o líquido que interfiera con las mediciones. Para esto, se han utilizado sondas especializadas para ser afrontadas directamente sobre la mucosa durante la visión endoscópica174,175 o sondas con un balón que pueden inflarse, asegurando el contacto estrecho con la mucosa.176 Sin embargo, la forma más estudiada y más ampliamente disponible (ya que usa la misma sonda que para la realización de una MII-pH habitual) es la llamada impedancia basal nocturna media (IBNM). Se evalúa promediando la impedancia medida en el canal más distal de la sonda en tres períodos de 10 minutos durante la noche, para disminuir la probabilidad de que exista gas y/o líquido en el lumen esofágico.177
Para la confección de la pregunta PICO, se tomó como población a los pacientes con síntomas de ERGE, como intervención la IBNM, como comparador el TEA y como desenlace el diagnóstico de ERGE.
En relación con el análisis cuantitativo, los estudios que han evaluado la IBNM en ausencia de IBP, han mostrado un buen rendimiento diagnóstico. Se incluyeron seis estudios en el análisis cuantitativo, observándose un rango de sensibilidad y especificidad del 78%-94% y 54%-90%, respectivamente (Tabla 14b),168,169,178,179 especialmente cuando la comparación es entre individuos con ERGE versus controles sanos.180
Tabla 14b.
Pregunta 14 IBNM: ¿Cuál es la utilidad diagnóstica de IBMN para el diagnóstico de ERGE?
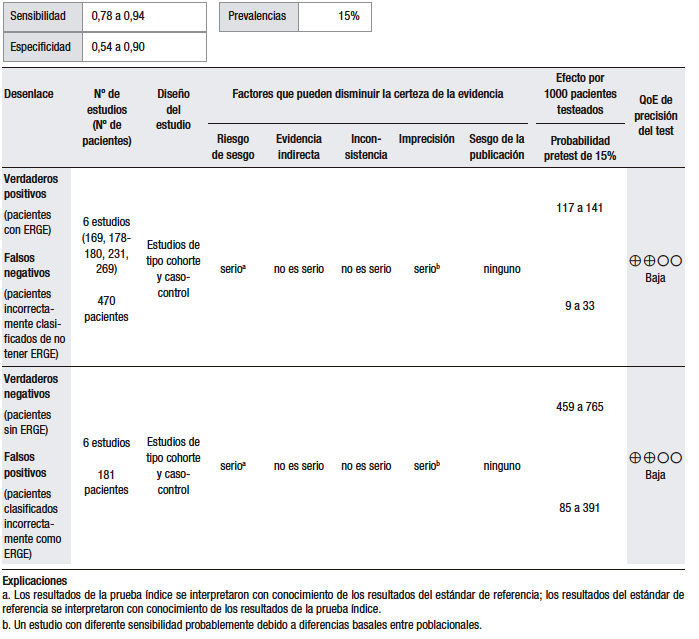
Frazzoni y col. reportaron una sensibilidad muy baja (43%), aunque hay que considerar que el estudio fue realizado con IBP. Se ha reportado un aumento de la IBNM tras el tratamiento con IBP.181 Además, este estudio no incluyó a pacientes con EE, siendo que es este grupo el que presenta los valores más bajos de IBNM.178
Debe consignarse que se ha reportado que hasta un 30%-40% de los pacientes sintomáticos con IBNM baja presentan TEA normales,182,183 lo que cuestiona la especificidad de este hallazgo.
Además, debe destacarse que existen diversos valores de corte sugeridos para la IBNM, entre 1100 y 2300 Ohms. Las razones para tal disparidad no se conocen, pero es posible que tengan que ver con factores genéticos/raciales. Pineda-Ovalle y col. reportaron una IBNM promedio de 1880 Ohms en 65 controles sanos, por debajo del criterio diagnóstico utilizado en los estudios europeos (alrededor de 2200 Ohms).180 Por otro lado, Sifrim y col. reportaron valores de IBNM en el canal 5 de 1400 y 1500 Ohms dependiendo del equipo utilizado (Diversatek o Laborie) en el análisis de 391 trazados realizados a controles sanos.184
Interesantemente, múltiples estudios han mostrado que la IBNM predice respuesta al tratamiento médico166,182,183,185 y quirúrgico.168,182 Sin embargo, es importante destacar que, en varios estudios, no se ha logrado demostrar que la IBNM prediga respuesta al tratamiento de manera independiente si en los modelos de regresión logística se incluyen variables como el PSPWI168 o el TEA.171,183 Por lo tanto, no es posible predecir la respuesta al tratamiento, por ejemplo, en el contexto de IBMN baja y TEA normal. Por otro lado, en varios estudios se ha mostrado la capacidad de predecir la respuesta al tratamiento en el contexto de TEA intermedios (entre 4% y 6%).170,182
Dado lo antedicho, la evaluación de la IBMN durante un estudio de MII-pH OFF IBP parece promisoria como elemento adyuvante en la toma de decisiones, en especial en el contexto de TEA intermedios (entre 4% y 6%).17 No existen suficientes datos aún que permitan sugerir su uso para reemplazar los patrones de oro tradicionales para diagnosticar la ERGE.
El panel de expertos considera, con un acuerdo del 73%, que la IBNM es una métrica que podría ser de utilidad para el diagnóstico de ERGE, por lo que recomiendan su uso.
15. ¿Se recomienda el uso de los índices (IS y SAP) en pacientes con síntomas de ERGE esofágico y extraesofágico?
Para mejorar la claridad de la pregunta, el panel de expertos decidió dividirla en dos: a. pacientes con ERGE esofágico y b. pacientes con ERGE extraesofágico.
15a. ¿Se recomienda el uso de los índices (IS y SAP) en pacientes con síntomas de ERGE esofágico?
Calidad de la evidencia: MUY BAJA ⨁○○○
Fuerza de recomendación: DÉBIL A FAVOR
El monitoreo ambulatorio de reflujo, como se ha dicho, está indicado en pacientes con síntomas de reflujo refractarios al tratamiento, en los que no se ha observado la presencia de EE o esófago de Barrett en la EGD.87 Un TEA anormal (mayor al 6%) equivale a un diagnóstico de ERGE.17 Sin embargo, esto no responde la pregunta de si los síntomas están o no relacionados con el reflujo.186 El IS y el SAP fueron desarrollados para responder esta pregunta.187 Es muy importante tener en cuenta que estas métricas surgieron para la pH-metría sin monitoreo de impedancia y para los síntomas típicos de reflujo (pirosis, dolor torácico y regurgitación). Posteriormente, se han extrapolado para ser utilizadas en la MII-pH, para evaluar síntomas atípicos y para distinguir la hipersensibilidad al reflujo de la pirosis funcional.188
Por otro lado, los síntomas de ERGE percibidos por los pacientes son la principal razón por la que consultan al médico y adhieren al tratamiento y, además, en el caso de ser refractarios, son la principal razón para la realización de estudios adicionales.189,190 Tanto el monitoreo de pH solo como la combinación con impedanciometría proporcionan información en cuanto al análisis de la relación temporal entre los síntomas y los episodios de reflujo, aunque la metodología es diferente.187 En el monitoreo de pH, se toma en cuenta la relación temporal que existe entre los episodios de caída del pH y los síntomas. En cambio, en la MII-pH, se consideran tanto los episodios de reflujo ácidos como los no ácidos.
La ventana temporal que se utiliza en este análisis es de dos minutos.191,192
El IS es el porcentaje de síntomas precedidos por episodios de reflujo. El punto de corte óptimo cuando se analiza la pirosis como síntoma es del 50%.193,194 La SAP y la estimación probabilística de Ghillebert (GPE) utilizan cálculos estadísticos más complejos para expresar la probabilidad de asociación entre los síntomas y los episodios de reflujo. La SAP se considera positiva cuando existe una probabilidad de menos del 5% de que esta asociación ocurra por azar.195,196 Resumiendo, el IS refleja el tamaño del efecto y la SAP, la probabilidad. Estas dos métricas se consideran complementarias y son cruciales para diferenciar entre la hipersensibilidad al reflujo y la pirosis funcional en pacientes con TEA normal.188,197 La combinación de IS y SAP positivos provee la mejor evidencia de que existe una asociación clínicamente relevante entre los síntomas y los episodios de reflujo.62,87,198 Tanto el IS como el SAP son predictivos del efecto del tratamiento médico y quirúrgico, independientemente del TEA.15,199-201
Por otro lado, estos índices sirven para subclasificar a los pacientes con síntomas de ERGE en sus diferentes fenotipos (ERGE, hipersensibilidad al reflujo y pirosis funcional), lo cual tiene la utilidad de poder determinar los mecanismos fisiopatológicos, así como de definir la mejor estrategia terapéutica.
En el año 2016, el Consenso de Porto actualizado recomendó el cálculo de la asociación sintomática (IS y SAP) tanto durante la pH-metría como durante la MII-pH para establecer la relación entre los síntomas y los episodios de reflujo y definió que el TEA anormal con SAP y IS positivos representan la evidencia más fuerte de ERGE.87
Para la confección de la pregunta PICO, se consideró a la población de pacientes con síntomas de ERGE típico, como intervención los índices positivos (IS y SAP), como comparación los índices negativos y como desenlace la respuesta a diferentes modalidades terapéuticas.
En pacientes con síntomas de ERGE no seleccionados, el IS y la SAP resultaron ser predictores de respuesta tanto al tratamiento médico como al quirúrgico, independientemente del TEA.15,87,200-203 Sin embargo, se trata de estudios realizados sobre la base de tamaños muestrales pequeños, con alto riesgo de sesgo y en los que se utilizaron diferentes metodologías diagnósticas.
Por otro lado, un estudio publicado recientemente contradice esta evidencia. Choksi y col. analizaron los datos de la SAP en una serie retrospectiva de 205 pacientes a los que se les había realizado una pH-CI de 48 horas OFF IBP para la evaluación de síntomas refractarios. Dividieron a los pacientes en grupos con y sin esofagitis y con TEA normal y anormal. Encontraron que la SAP no resultó ser un parámetro útil para distinguir la pirosis funcional de la hipersensibilidad al reflujo. Además, el 18% de los pacientes tuvo valores de SAP discordantes entre los días 1 y 2 de la pH-metría, lo que llevó a diferentes diagnósticos (pirosis funcional o hipersensibilidad al reflujo) en cada día de monitoreo. Además, en un subanálisis de 58 pacientes a los que se les había realizado una funduplicatura, una SAP positiva no fue predictora de respuesta al tratamiento.204 A partir de esta publicación, dos editoriales cuestionaron el valor de la utilización de los índices sintomáticos para el diagnóstico de ERGE.186,205
Posteriormente, Spechler y col. publicaron en el año 2019 un osado ensayo clínico aleatorizado, en el que evaluaron el tratamiento médico versus el quirúrgico. Incluyeron a 78 pacientes altamente seleccionados con pirosis refractaria y SAP positiva (ERGE e hipersensibilidad al reflujo). El éxito del tratamiento fue significativamente superior con la cirugía que con el tratamiento médico. Un 71% de los pacientes con hipersensibilidad al reflujo (TEA negativo y SAP positivo) y un 62% de los pacientes con ERGE (TEA positivo y SAP positivo) tuvieron respuesta a la cirugía. En este estudio, en el que se valora un outcome duro, como es la respuesta a la cirugía antirreflujo, se valoriza la utilidad de la SAP como predictor de respuesta al tratamiento, de manera independiente al TEA.206
Como desventajas de la medición de los índices sintomáticos, hay que considerar que la precisión de estos depende de la frecuencia de los síntomas consignados por el paciente. Por lo tanto, es importante que el paciente reciba instrucciones precisas. Si se utiliza MII-pH, se requiere, además, una revisión manual. Asimismo, existe variabilidad diaria.
Para concluir, a pesar de que la evidencia científica es contradictoria en relación con la utilidad de los índices sintomáticos como predictores de respuesta al tratamiento en pacientes con ERGE típica, estos podrían ser de utilidad en pacientes seleccionados.
El panel de expertos considera, con un acuerdo del 73%, que estos índices deben utilizarse como complemento de los parámetros clásicos para el diagnóstico de ERGE, y no para tomar una conducta terapéutica exclusivamente sobre la base de estos. Cuando los índices son positivos en pacientes con TEA anormal, estos son de utilidad, porque dan confianza en relación con que los síntomas están causados por la ERGE, sobre todo cuando tanto el IS como la SAP son positivos. La recomendación resultó ser débil a favor.
15b. ¿Se recomienda el uso de los índices (IS y SAP) en pacientes con síntomas de ERGE extraesofágico?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
Determinar la asociación entre los síntomas extraesofágicos laringopulmonares (como tos o disfonía) y la ERGE a menudo representa un desafío. Las etiologías de la tos crónica pueden incluir el goteo posnasal y la bronquitis no asmática, entre otras, además de la ERGE. Asimismo, los síntomas laríngeos, como la disfonía, pueden tener múltiples etiologías no relacionadas con la ERGE.
Para la confección de la pregunta PICO, se tomó como población a los pacientes con síntomas de ERGE extraesofágico, como intervención los índices IS y SAP positivos, como comparador los índices negativos y como desenlace la respuesta terapéutica a los IBP o a la cirugía antirreflujo.
No se ha encontrado en la búsqueda bibliográfica información para poder realizar un análisis cuantitativo de esta pregunta PICO.
Hersh y col., en el año 2010, realizaron un análisis retrospectivo de 53 pacientes con tos crónica. En el análisis multivariado, la SAP resultó ser un predictor de respuesta al tratamiento.207
Sin embargo, Kavitt y col., en el año 2012, utilizaron un sistema de monitoreo acústico para evaluar la relación entre los episodios de tos consignados por el paciente y el audio. Seis observadores independientes evaluaron el audio. Se observó una diferencia significativa entre los episodios de tos consignados por los pacientes y el audio.208
Por este motivo, el Consenso de Porto y el de Lyon recomendaron agregar un detector de tos (por ejemplo, un catéter de MII-pH con un sensor de presión), para identificar el momento exacto de los eventos de tos.17,87,209-210 Sin este dispositivo, la medición de los índices sintomáticos en relación con la tos y los episodios de reflujo no sería adecuado.
El grupo de expertos consideró, con un acuerdo del 80%, que los índices sintomáticos no son adecuados para la evaluación de los síntomas extraesofágicos en relación con la ERGE.
16. ¿Se recomienda el RESTECH para el diagnóstico de reflujo laringofaríngeo?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
El monitoreo con doble sensor (esofágico y faríngeo) y la MII-pH han sido considerados los estándares de oro para la detección de RLF. Sin embargo, en los estudios publicados actualmente se reportan resultados discordantes y poco confiables.211 El sistema de medición del pH faríngeo (RESTECH) fue desarrollado en el 2009 para la detección de ácido en forma líquida o en aerosol en la hipofaringe durante 24 horas, siendo una prueba menos invasiva y más tolerable para el paciente.96
Para la confección de la pregunta PICO, se tomó como población a los pacientes con síntomas de RLF, como intervención el RESTECH, como comparador al TEA patológico y como desenlace el diagnóstico de ERGE extraesofágico.
Los estudios en los que se ha comparado la utilidad del monitoreo faríngeo versus el esofágico para predecir la respuesta a los IBP en pacientes con sospecha de RLF sugieren que la sonda orofaríngea puede tener una mayor capacidad predictiva positiva que la medición del TEA, pero estos hallazgos se basan en estudios en pocos pacientes.211-213,228,229
Willhelm y col., en el 2016, realizaron un monitoreo de 24 horas con RESTECH a 10 pacientes con gastrectomía total y sin síntomas de reflujo, y encontraron que la prueba fue patológica en un 60% de los casos,230 lo cual pone en duda la utilidad de esta prueba diagnóstica en el RLF.
En la síntesis cuantitativa, se incluyeron dos estudios, observándose un rango de sensibilidad del 61%-68% y una especificidad del 71%-100%. De todas formas, debe tenerse en cuenta el bajo número de estudios y la heterogeneidad entre ellos, lo cual no permite elaborar conclusiones sólidas acerca de la utilidad de la prueba RESTECH en los diferentes escenarios clínicos. Los datos son muy limitados y se necesitan más estudios.
El panel de expertos considera, con un acuerdo del 87%, que, en la actualidad, no hay evidencia para recomendar su uso, pero podría ser de utilidad a futuro si nuevos estudios de alta calidad apoyan su utilidad.
Tabla 16.
Pregunta 16: ¿Cuál es la utilidad diagnóstica del RESTECH (pH-metría proximal) para el diagnóstico de RLF?
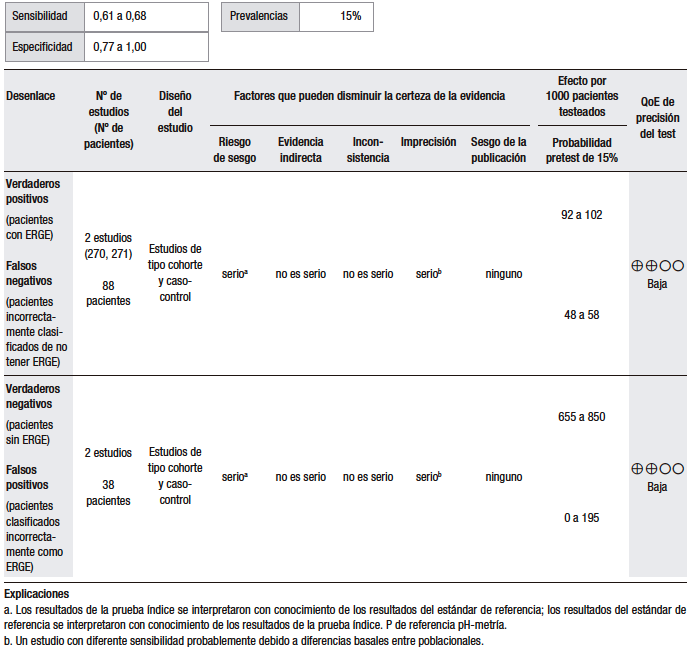
17. ¿Se recomienda la detección de pepsina en saliva para el diagnóstico del reflujo laringofaríngeo?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
El RLF es el movimiento retrógrado del contenido gastroduodenal (ácido y enzimas tales como la pepsina) dentro de la laringofaringe, produciendo directa o indirectamente síntomas y daños morfológicos de estas estructuras.96,211 Los síntomas típicos del RLF incluyen disfonía, globo faríngeo, tos crónica y aclaramiento de garganta, entre otros.212 Existen datos no concluyentes en cuanto a la verdadera prevalencia del RLF, pero representa aproximadamente un 10% de las consultas al otorrinolaringólogo y se estima una prevalencia del 10%-30% en la población occidental.213 El principal problema radica en que los métodos diagnósticos existentes no son lo suficientemente precisos para el diagnóstico de RLF y los síntomas asociados a esta entidad pueden ser causados por múltiples etiologías distintas a la ERGE.
Se ha demostrado que, además del ácido, hay otros componentes en el material refluido que pueden ocasionar daño a los tejidos, como la pepsina, los ácidos biliares y la tripsina.214 La pepsina es producida por las células principales de las glándulas gástricas como una proenzima, el pepsinógeno, el cual, por efecto del pH ácido, se hidroliza y adquiere su capacidad enzimática.214-217 La pepsina tiene el potencial de causar daño a los tejidos y se ha detectado en el oído medio de pacientes con otitis media, en lágrimas y en saliva.218-223 Estos hallazgos constituyen una evidencia del reflujo del contenido gástrico hacia estructuras de la vía aérea superior.
Para la confección de la pregunta PICO, se tomó como población a los pacientes con síntomas de RLF, como intervención la detección de pepsina en saliva, como comparador el TEA patológico y como desenlace el diagnóstico de ERGE extraesofágico.
Numerosos estudios han reportado la utilidad diagnóstica de la pepsina en el RLF.224-227 En un reciente metaanálisis en el que se incluyeron 11 estudios, se encontró que la sensibilidad y la especificidad de la pepsina para el diagnóstico del RLF es de un 64% y 68% respectivamente, pero, en la práctica, la ausencia de un estándar de oro limita su aplicabilidad. En este metaanálisis, se observó una notable heterogeneidad en los estudios en cuanto a los métodos diagnósticos, los criterios de exclusión y el material utilizado para la detección de la pepsina.226 Este punto es importante, ya que la fiabilidad de la detección de la pepsina depende de la técnica utilizada (inmunoanálisis, ELISA, o Western blot), los valores establecidos para determinar el resultado, el número de muestras necesarias para establecer el diagnóstico de RLF y el tiempo en el que deben tomarse las muestras.
En el análisis cuantitativo, la calidad de la evidencia de los 10 estudios incluidos resultó baja (Tabla 17).
Existe un riesgo de sesgo elevado, ya que los investigadores no estaban “ciegos” para el resultado de la prueba en comparación. En su mayoría, los investigadores que realizaron la prueba de pepsina en saliva fueron los mismos que realizaron la prueba considerada estándar de oro. Los resultados de los diferentes estudios muestran rendimientos diagnósticos variables (una sensibilidad que oscila entre 37%-77% y una especificidad de entre 43%-89%), lo cual disminuye la precisión de los resultados obtenidos.
Tabla 17.
PREGUNTA 17: ¿Cuál es la utilidad diagnóstica de la pepsina para el diagnóstico de RLF?
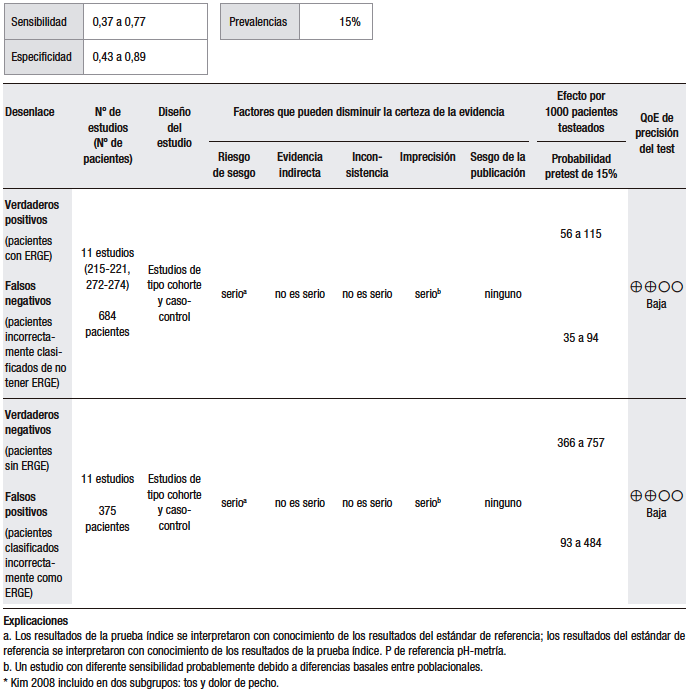
Esto puede deberse a diferencias en las características basales de la población, pero, además, a diferencias en los procesos para la recolección de la muestra y su procesamiento, incluyendo la existencia de diferentes puntos de corte para determinar el nivel de pepsina anormal en saliva. No se mencionan los VPP y VPN en cada estudio, para tener una mejor apreciación del verdadero rendimiento diagnóstico. En general la prueba de pepsina en saliva podría tener utilidad, pero se necesitan más estudios con un mayor número de pacientes y con protocolos y diseños homogéneos para poder generar conclusiones más fuertes.
El grupo de expertos no recomienda su uso, con un 73% de acuerdo.
18. ¿Se recomienda el uso de impedancia mucosa para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: DÉBIL EN CONTRA
La técnica de MII-pH permite detectar el reflujo ácido y no ácido, y parece tener un papel definido en el diagnóstico de ERGE (véase la pregunta PICO 13) y la evaluación de síntomas refractarios en pacientes con ERGE confirmada (véase la pregunta PICO 20).
Excepto durante los episodios de reflujo y las degluciones, la luz esofágica permanece colapsada y los anillos de impedancia del catéter para MII-pH están en estrecho contacto con la mucosa esofágica. Como se explica en la pregunta PICO 14b, el nivel de impedancia basal resultante está determinado por la conductividad eléctrica intrínseca de la pared esofágica circundante.231 Ya que el daño al epitelio esofágico provocado por el reflujo ácido crónico ocasiona una caída en la impedancia basal, estas mediciones pueden tener cierta utilidad para el diagnóstico de ERGE. La medición de la impedancia basal en la mayoría de los estudios se realiza a través de períodos variables y los niveles de impedancia cambian fácilmente durante la ingestión de alimentos, la deglución de saliva, los episodios de reflujo o los cambios de pH. Por lo tanto, el momento y la duración de la evaluación son fundamentales para obtener una medición válida.232
Por estas consideraciones es que se evalúa la técnica de la medición directa de la impedancia basal de la mucosa (IBM), técnica que consiste en medir la impedancia basal directamente a través de un catéter con dos anillos de voltaje en su porción distal, que se introduce por el canal del endoscopio y puede realizarse durante el procedimiento.
Para la confección de la pregunta PICO, se tomó como población a los pacientes con síntomas de ERGE, como intervención la técnica de la IBM, como comparador el TEA patológico y como desenlace el diagnóstico de ERGE.
En la síntesis cuantitativa, se incluyó un estudio en el quee se enroló a pacientes con diagnóstico de ERGE con EE y se comparó con un segundo grupo sin ERGE.174 La sensibilidad fue del 89% (IC 95% 67-99) y la especificidad del 67% (IC 95% 46-83) para la impedancia mucosa como prueba diagnóstica (Tabla 18).
Si bien es cierto que los autores concluyen que la técnica es útil para el diagnóstico de ERGE, surgen algunas controversias en relación con las conclusiones. En primer lugar, es un estudio con un escaso número de pacientes y la técnica no ha sido replicada en otro lugar. Por otro lado, los investigadores ya tenían conocimiento del diagnóstico en los pacientes, lo que podría significar un sesgo muy marcado durante la interpretación. Además, en el protocolo, se usa un catéter que se mide en un tiempo fijo, por lo que no podríamos saber qué pasaría si se midiera en otras circunstancias (comida, noche, paciente parado, etcétera).174
Tabla 18.
PREGUNTA 18: ¿Cuál es la utilidad diagnóstica del uso de la impedancia mucosa para el diagnóstico de ERGE?
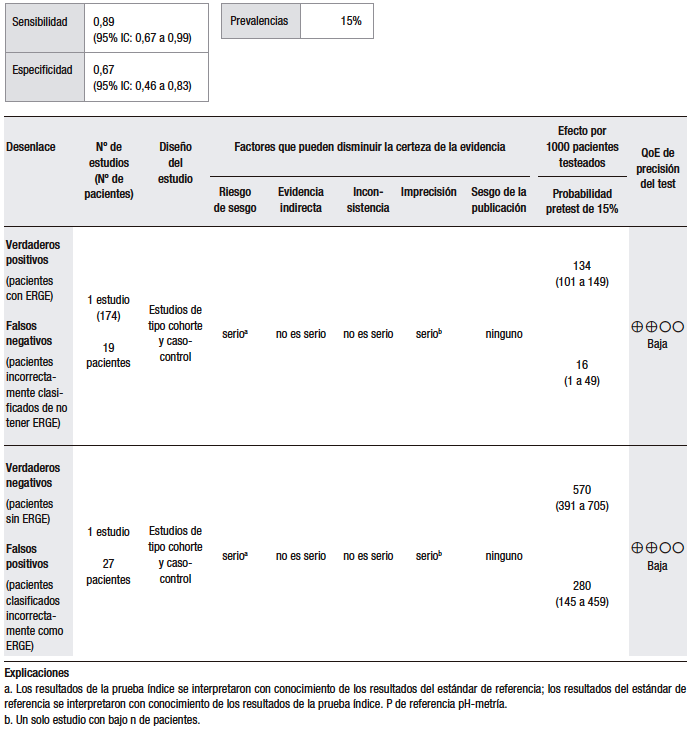
Existe otro estudio con más pacientes, realizado en el 2015,175 pero la controversia radica en que fue hecho por el mismo grupo del estudio anterior, lo que también le da un sesgo a los resultados.
Por el momento, faltan más estudios con un mayor número de pacientes para poder validar la técnica, por lo que aún no se recomienda como método diagnóstico de ERGE.
El grupo de expertos considera, con un acuerdo del 87%, que esta técnica no es aún adecuada para realizar diagnóstico de ERGE y para tomar una conducta en consecuencia.
19. ¿Se recomienda el uso de los hallazgos en manometría esofágica de alta resolución (HRM) para el diagnóstico de ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE EN CONTRA
La unión esofagogástrica (UEG) sirve como una barrera mecánica y fisiológica entre el esófago y el estómago, evitando el reflujo espontáneo hacia el esófago, al mismo tiempo que permite la relajación inducida por la deglución para transmitir el bolo ingerido al estómago. La UEG está compuesta por el esfínter esofágico inferior (EEI) y el diafragma crural (DC) superpuesto.233 Durante la inspiración normal, el DC se contrae, aumentando la presión del EEI y proporcionando una eficiente barrera mecánica para evitar el reflujo desde el estómago.234
La manometría convencional y la radiografía de contraste del esófago han proporcionado antecedentes sobre el valor de la evaluación de la UEG en la ERGE, pero los correlatos con HRM aún no han sido identificados ni reconocidos hasta la actualidad.235
En estudios fisiopatológicos, se ha demostrado que una barrera antirreflujo disfuncional y un aclaramiento esofágico deteriorado contribuyen a la ERGE. La hipotensión del EEI y la hernia hiatal son mecanismos que contribuyen a una barrera antirreflujo disfuncional, mientras que los defectos peristálticos conducen a un aclaramiento deficiente del reflujo y, por lo tanto, a una exposición prolongada al ácido esofágico. Estos hallazgos, sin embargo, se observaron principalmente con la manometría convencional.236
La HRM permite una medición más precisa del patrón de motilidad esofágica, lo que sugiere la posibilidad de medir las diferencias entre los pacientes con ERGE y los controles y, tal vez, utilizar la HRM como una herramienta para predecir la ERGE.237
A partir de esta premisa es que se construye la pregunta PICO, en relación con definir la utilidad de los hallazgos de la HRM en el diagnóstico de la ERGE, teniendo como población a pacientes con síntomas de ERGE, como intervención las diferentes métricas que se obtienen en la HRM, como comparación el TEA patológico y como resultado el diagnóstico de ERGE.
La motilidad esofágica inefectiva (MEI) es una entidad reconocida desde la era del trazado de línea convencional, definida como contracciones esofágicas distales de baja amplitud (< 30 mmHg) en el 50% o más de las degluciones húmedas.238 Con esta definición, en los estudios han sido evaluados pacientes con síntomas de ERGE, siendo contradictorios los hallazgos.239
Con una baja calidad de la evidencia, la capacidad de la HRM con MEI de discriminar pacientes con diagnóstico de ERGE respecto del TEA patológico arroja una sensibilidad del 27% (IC 95% 18-37) y una especificidad del 77% (IC 95% 67-85) (Tabla 19a).
Tabla 19a.
Pregunta 19a MEI (motilidad esofágica inefectiva): ¿Cuál es la utilidad diagnóstica de los hallazgos en HRM para el diagnóstico de ERGE?
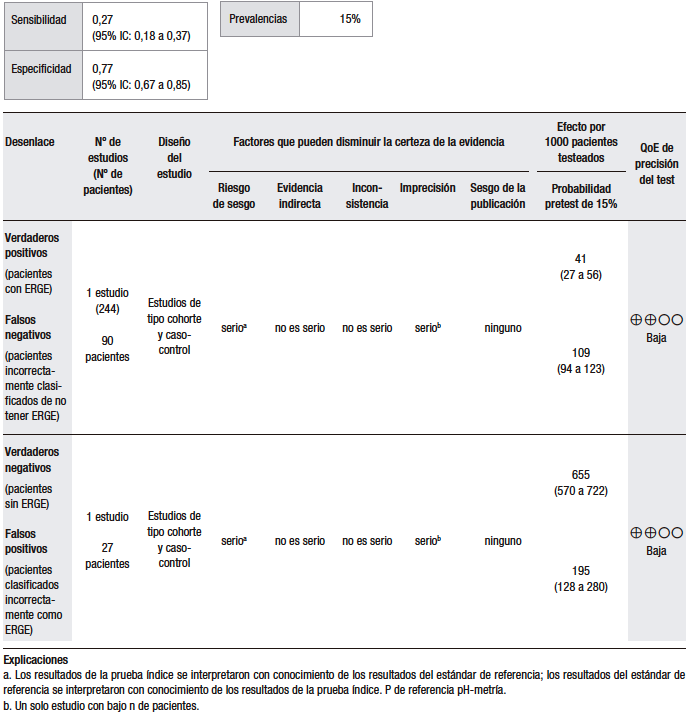
Algunos estudios a pequeña escala que incluyeron a menos de 50 sujetos con MEI han comparado la carga de reflujo entre los pacientes con MEI con aquellos con motilidad normal. Los resultados han variado desde ninguna asociación entre MEI y ERGE hasta una asociación clara con MEI y TEA, pero no hay diferencias en los parámetros de la MII-pH.239-242
Otra de las mediciones que se obtienen con la HRM es la presión basal (PB) del EEI. La UEG es una estructura dependiente de la estrecha relación anatómica entre el esófago distal, el hiato diafragmático y el estómago. Es importante reconocer que esta relación no es estática y que una “hernia” fisiológica puede ocurrir durante la peristalsis primaria o la secundaria, la distensión esofágica y la relajación temporal de la EEI.243
En un estudio, se encontró que los pacientes con ERGE tenían una PB del EEI más baja que los pacientes sin ERGE. Cuando se evaluó la capacidad de la integral contráctil de la UEG para discriminar pacientes con ERGE de pacientes con pirosis funcional, la sensibilidad reportada fue del 58% (IC 95% 47-68) y la especificidad del 65% (IC 95% 55-75) (Tabla 19b). El estudio fue retrospectivo y con conocimiento del diagnóstico de los pacientes, lo que condiciona una baja calidad de evidencia, con serios riesgos de sesgo.244
Tabla 19b.
Pregunta 19b UGE-CI (integral contráctil de la uge): ¿Cuál es la utilidad diagnóstica de los hallazgos en HRM para el diagnóstico de ERGE?
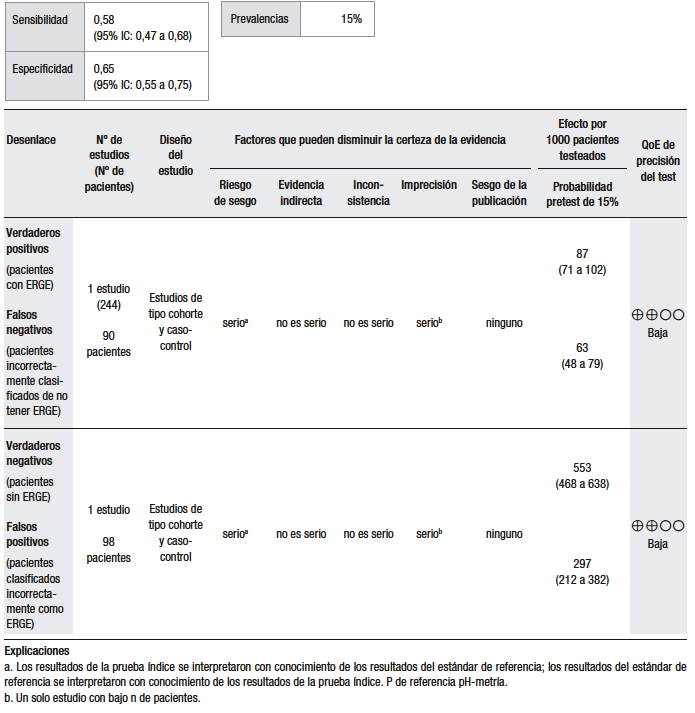
Van Hoeij y col. evaluaron a 69 pacientes con ERGE y a 40 sujetos sanos, y describieron todas las variables de HRM calculando su valor predictivo. El objetivo fue determinar la relación entre las anomalías de la HRM y la ERGE y aclarar en qué medida la HRM puede predecir la ERGE. En la regresión logística múltiple, se encontró que tanto la amplitud de onda media como la ausencia de una hernia hiatal resultaron predictores independientes de la ERGE, pero con un valor predictivo bajo. En este trabajo, la presencia de hernia de hiato, la amplitud de contracción baja y la presión del EEI se asociaron con la ERGE, pero no predijeron la enfermedad con suficiente precisión.245
En el siguiente análisis, se compararon algunos parámetros de la HRM entre pacientes con ERGE y con pirosis funcional. Se describen solo los hallazgos significativos. Respecto de las presiones basales del EEI, con una calidad de la evidencia moderada, la presión del EEI en pacientes con ERGE presentó una media de presión de 7,93 mm Hg (IC 95% 8,67-7,19), menor respecto de los pacientes con pirosis funcional. Con mayor imprecisión y calidad de la evidencia, la integral contráctil de la UGE también fue menor en los pacientes con ERGE respecto de los pacientes con pirosis funcional. De forma similar, con muy baja calidad de la evidencia, los pacientes con ERGE presentaron más frecuentemente ausencia de peristalsis y hernia hiatal (Tabla 19c).246,247
Tabla 19c.
Pregunta Pico 19c: ¿Cuál es la utilidad diagnóstica de los hallazgos en HRM para el diagnóstico de ERGE?
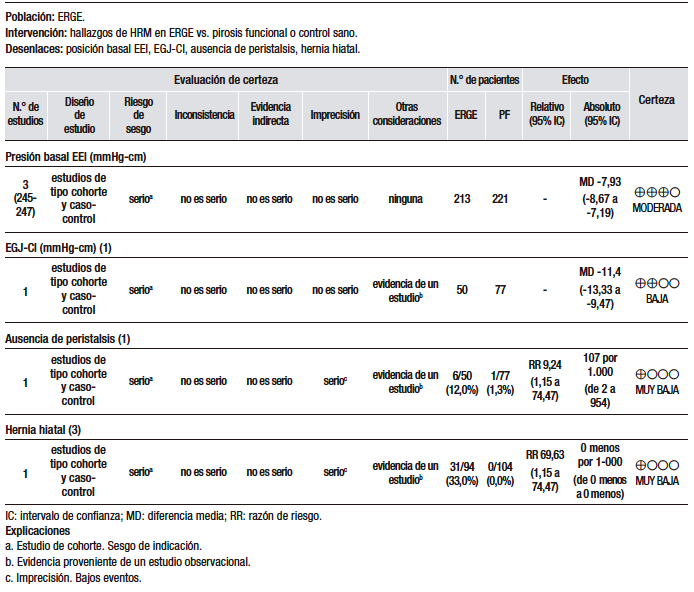
Sobre la base de todo lo analizado, encontramos que existen diferencias entre los parámetros que se evalúan en la HRM entre pacientes con ERGE y controles sanos, y que se aprecia con más frecuencia una baja amplitud de la onda esofágica, una menor presión basal del EEI y una mayor frecuencia de hernia hiatal en pacientes con ERGE. El valor predictivo de estos hallazgos en la HRM para detectar la ERGE en pacientes es muy bajo. Por esta razón, la HRM no puede utilizarse para predecir la ERGE.
El panel de expertos consideró, con un acuerdo del 100%, que la HRM claramente no es un método adecuado para realizar el diagnóstico de ERGE. Sin embargo, puede aportar información en cuanto a los posibles mecanismos involucrados y, fundamentalmente, permite descartar la presencia de trastornos motores del esófago como un diagnóstico diferencial.
20. En pacientes con ERGE confirmada refractaria a IBP, ¿se recomienda la pH-impedanciometría (MII-pH) intraterapéutica por sobre la pH-metría convencional en términos del cambio en la conducta terapéutica?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE A FAVOR
En la actualidad, entre un 30% y 40% de los pacientes con síntomas de ERGE no responden completamente al tratamiento con IBP.248 Es un hecho que el término ERGE “refractaria” se utilizó durante mucho tiempo sin tener una definición precisa al respecto, llevando a que las distintas interpretaciones condicionaran decisiones diagnósticas y terapéuticas muy heterogéneas. Recientemente, un grupo de expertos de las Asociaciones Europeas y Norteamericana de Neurogastroenterología (ESNM/ANMNS) realizaron un consenso en el que se establecieron definiciones precisas al respecto.5 De acuerdo con ese consenso, es crucial distinguir entre síntomas refractarios (es decir, síntomas que pueden o no estar relacionados con la ERGE), síntomas de ERGE refractario (es decir, síntomas persistentes en pacientes con ERGE comprobada, independientemente de la relación con el reflujo en curso) y ERGE refractaria (es decir, evidencia objetiva de ERGE a pesar del manejo médico adecuado).
Así, la “ERGE refractaria” se define como la evidencia objetiva persistente de ERGE a pesar del tratamiento médico (dosis estándar de IBP durante 8 semanas).5 La evidencia “objetiva” es la presencia o persistencia de EE o TEA patológico y/o un número elevado de episodios de reflujo en la monitorización del reflujo realizada durante la terapia con IBP. Es decir, es necesaria la reevaluación mediante estudios endoscópicos, de pH-metría y de MII-pH. Es importante aclarar que la realización de estas pruebas debe realizarse CON tratamiento (ON IBP), ya que el objetivo es demostrar que los mecanismos fisiopatológicos asociados a los síntomas (reflujo ácido, débilmente ácido, no-ácido, gas, mixto, etc.) persisten a pesar del tratamiento médico.
Con respecto a qué es mejor, si realizar pH-metría o MII-pH en estos pacientes, desde el advenimiento de la MII-pH se describió que esta técnica ayuda a caracterizar mejor los episodios de reflujo (en especial, detecta los episodios de reflujo no ácido), lo que permite establecer una asociación reflujo-síntoma que no era posible detectar con la pH-metría convencional. Por ejemplo, Mainie I. y col., en un estudio realizado en 168 pacientes a los que se les realizó MII-pH mientras recibían doble dosis de IBP, demostraron que hasta el 37% de los sujetos tenían una asociación sintomática positiva con episodios de reflujo no ácido.249 En otro estudio similar, Karamanolis G. y col. reportaron que el 21% de los pacientes con ERGE refractaria pueden tener síntomas asociados a reflujo no ácido durante una MII-pH.250
Para la confección de la pregunta PICO, se tomó como población a pacientes con ERGE confirmada (previa EE LA C o D, o pH-metría sin IBP anormal) refractaria a IBP, como intervención la MII-pH intraterapéutica, como comparador la pH-metría y como desenlace el cambio en la conducta terapéutica.
Aunque existen estudios de series de casos y retrospectivos, se desconoce cuál es la ganancia en el rendimiento diagnóstico para apoyar el uso de MII-pH sobre la pH-metría convencional en la ERGE refractaria y, sobre todo, qué implicaciones terapéuticas conllevan.
Pritcher y col. estudiaron la capacidad que tiene la MII-pH de predecir el reflujo, de tal manera que pueda convertirse en el estándar de oro para los pacientes con ERGE refractaria. En este estudio, los autores demostraron que el 36% de los pacientes tuvo una MII-pH anormal, mientras que el porcentaje de pacientes con una pH-metría anormal fue de 28%. La sensibilidad y la especificidad calculada fueron de 93% y 40%, respectivamente (Tabla 20a). En este sentido, los autores concluyeron que, en pacientes con ERGE refractaria, la monitorización combinada de MII-pH representa una mejor estrategia individual para la evaluación de los síntomas de reflujo.251
Tabla 20a.
Pregunta 20a: En pacientes con ERGE confirmada refractaria a IBP, ¿cuál es el aporte adicional de la pH-impedanciometría intraterapéutica por sobre la pH-metría convencional en términos de cambio en la conducta terapéutica?
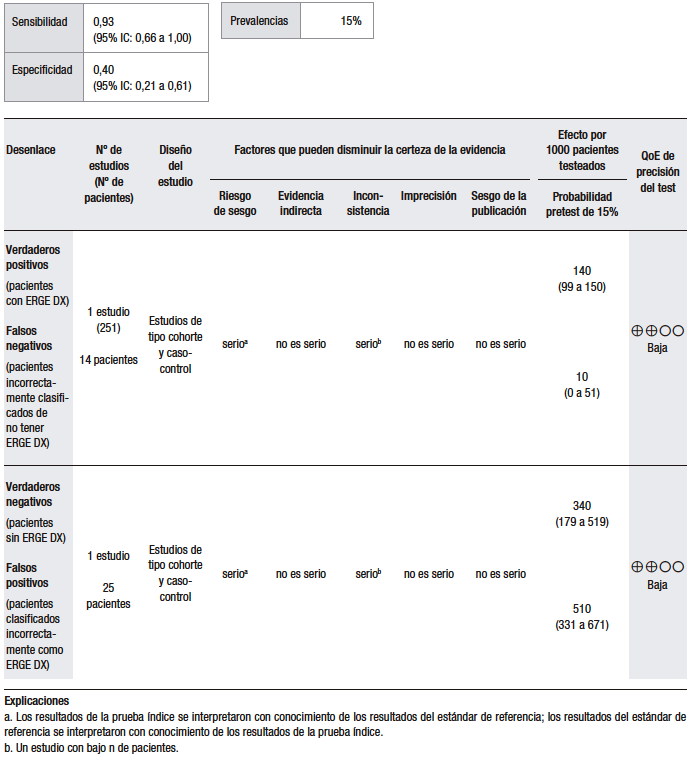
Considerando que la MII-pH puede normar la conducta terapéutica en los pacientes con ERGE refractaria, podrían tenerse en cuenta las siguientes opciones:
a) Si se demuestra que existe un TEA anormal y una asociación sintomática con reflujo (ácido o no ácido), el cambio en la conducta terapéutica debería incluir entonces el uso de una terapia antisecretora más potente con IBP (aumentar o duplicar la dosis) o debería valorarse la posibilidad de los nuevos fármacos, como los P-CAB (bloqueadores de ácido competitivos con potasio).5,252 Además, en algunos casos seleccionados, podría ofrecerse a estos pacientes la posibilidad de un tratamiento quirúrgico.206
b) En un estudio de MII-pH normal, prácticamente se excluye el diagnóstico de ERGE refractaria y se plantea la posibilidad entonces de que el paciente tenga un trastorno funcional esofágico, específicamente pirosis funcional. En este caso, la neuromodulación podría ser el tratamiento de elección.
La evidencia sobre cuál es el cambio en la conducta terapéutica al utilizar MII-pH sobre pH-metría se muestra en la Tabla 20b.
Tabla 20b.
Pregunta 20b: En pacientes con ERGE confirmada refractaria a IBP, ¿cuál es el aporte adicional de la pH-impedanciometría intraterapéutica por sobre la pH-metría convencional en términos de cambio en la conducta terapéutica?
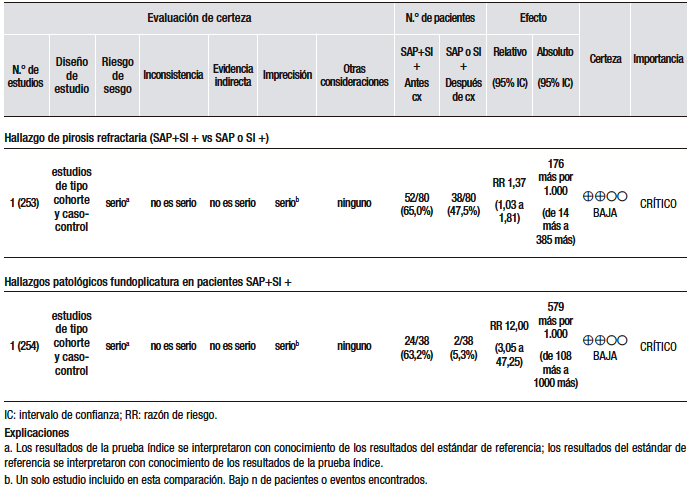
Con respecto a las opciones de tratamiento médico, no existen estudios al respecto que hayan comparado la superioridad de un IBP sobre otro en la ERGE refractaria.5 Por otro lado, se ha explorado si el uso de procinéticos (como la mosaprida, la domperidona o la prucaloprida) pueden ser de utilidad; sin embargo, no se ha demostrado su eficacia. Aunque se ha descrito que los medicamentos que actúan sobre las relajaciones transitorias del EEI (RTEEI) (como, por ejemplo, el baclofeno y el lesogaberan) pueden ser útiles en los pacientes con ERGE refractaria, la presencia de efectos secundarios importantes limita su uso y recomendación.5
Con respecto al tratamiento quirúrgico, la evidencia muestra que la funduplicatura puede ser útil en casos bien seleccionados. En el primer estudio, Frazzoni M. y col. evaluaron a 80 pacientes con síntomas de ERGE refractaria en pacientes con ERNE y demostraron que la asociación sintomática positiva durante la MII-pH permite detectar un mayor número de pacientes que el solo análisis individual de los síntomas con la pH-metría (65% vs. 47,5%, p = 0,038, RR 1,37). En este estudio, resultó también interesante el hecho de que los pacientes con MII-pH positiva tuvieron una mayor prevalencia de hernia hiatal e hipotensión del EEI que los pacientes con pirosis funcional.253 Estos hallazgos podrían sugerir la posibilidad de un tratamiento quirúrgico para este grupo de pacientes. En el segundo estudio, el mismo grupo de autores evaluó en 38 pacientes con ERGE refractaria si la MII-pH podía identificar a aquellos que podrían beneficiarse de una funduplicatura laparoscópica.254 En un seguimiento a 3 años, los autores encontraron que el 89% (34/38) de los pacientes refirieron mejoría posterior a la cirugía. Los criterios asociados a la respuesta terapéutica fueron la presencia preoperatoria de un IS/SAP positivo en la MII-pH ON IBP, un TEA anormal y un número anormal de reflujos totales.
Recientemente, Spechler y col. publicaron un ensayo clínico controlado que comparó el tratamiento médico contra el quirúrgico en verdaderos pacientes con ERGE refractaria verdadera/confirmada. Estos pacientes fueron aleatorizados a recibir tratamiento quirúrgico (funduplicatura de Nissen laparoscópica), tratamiento médico activo (omeprazol más baclofeno, con desipramina añadida según los síntomas) o tratamiento médico de control (omeprazol más placebo). El resultado primario fue el éxito del tratamiento, definido como una disminución al año del 50% o más en la puntuación de calidad de vida relacionada con la salud de la ERGE (rango 0 a 50, donde las puntuaciones más altas indican peores síntomas). De un total de 78 pacientes, el éxito con cirugía (18 de 27 pacientes, 67 %) fue significativamente superior al del tratamiento médico activo (7 de 25 pacientes, 28%; p = 0,007) o al del tratamiento médico de control (3 de 26 pacientes, 12%, p < 0,001). Los autores concluyeron que, en este grupo altamente seleccionado de pacientes, la cirugía es superior al tratamiento médico.206
También recientemente, en una colaboración multicéntrica en la que de forma retrospectiva se analizaron los registros de pacientes con síntomas persistentes de reflujo a pesar de la doble dosis de IBP, se demostró que tener una MII-pH ON IBP anormal permite que se tome la decisión de intensificar el tratamiento e, incluso, de considerar la cirugía, particularmente en la ERGE con regurgitación predominante.171
El grupo de expertos considera, con un acuerdo del 100%, que, en este subgrupo de pacientes en los que se llega a esta instancia en la evaluación, la MII-pH es el mejor método para definir la conducta a seguir, ya que ayuda a entender el porqué de la falla del IBP. Además, si el paciente tiene un número importante de episodios de reflujo, ayuda a definir una ulterior conducta quirúrgica.
21. En pacientes con pirosis refractaria a IBP (ERGE no confirmada), ¿se recomienda la pH-impedanciometría (MII-pH) OFF IBP por sobre la pH-metría convencional en términos de cambio en la conducta terapéutica?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: Débil A FAVOR
Si consideramos al grupo de pacientes que tienen “síntomas refractarios” de reflujo (asociados o no a ERGE), es indispensable tener un marcador objetivo que permita establecer la presencia de ERGE y la relación de los síntomas con el TEA anormal.5 En este sentido, es indudable que la presencia de erosiones (en especial las esofagitis grados C-D de LA) en un estudio endoscópico confirma el diagnóstico de ERGE. En aquellos pacientes con una endoscopía negativa, la medición del TEA y su asociación sintomática es crucial. Esto debe realizarse mediante pH-metría o MII-pH SIN tratamiento (OFF IBP), ya que el objetivo es confirmar la ERGE. Esta recomendación es clara y está presente en múltiples guías y consensos ya que, además de confirmar la ERGE, permite establecer los diagnósticos de hipersensibilidad esofágica y pirosis funcional.5, 6, 72
Para la confección de la pregunta PICO, se tomó como población a los pacientes con pirosis refractaria a IBP, ERGE que no haya sido confirmada a través de EGD (ERNE, esofagitis LA A y B), como intervención la MII-pH OFF IBP, como comparador la pH-metría y como desenlace el cambio en la conducta terapéutica.
Es importante determinar cuál es la evidencia con respecto al uso de la MII-pH sobre la pH-metría convencional y cuál es su impacto en la conducta terapéutica. La evidencia al respecto se presenta en la Tabla 21. En la síntesis cuantitativa, se incluyó un solo estudio, que evidencia que la MII-pH OFF IBP detecta cambios en la conducta terapéutica (mayor rédito diagnóstico) más frecuentemente que la pH-metría convencional, con un RR de 1,31 (95% IC 1,02 a 1,70).
Bredenoord A. J. y col. realizaron un estudio con el objetivo de comparar el rendimiento del análisis de la asociación síntoma-reflujo entre pH-metría convencional y MII-pH. Para esto, estudiaron a 60 pacientes con síntomas de ERGE y se evaluaron once tipos de reflujo basados en combinaciones de la magnitud de la caída del pH, el nadir del pH y la naturaleza del reflujo (gas y líquido) en trazados de impedancia. Para cada tipo de reflujo, evaluaron el IS y la SAP. Los autores encontraron que la proporción de pacientes con SAP positiva (≥ 95,0%) varió entre 62,5% y 77,1%, dependiendo de la definición de episodios de reflujo. Cuando se usaron los parámetros de pH e impedancia para identificar el reflujo, una mayor proporción de pacientes tuvo una SAP positiva que con pH solo (77,1% vs. 66,7%, p < 0,05). Los autores concluyeron que la monitorización con MII-pH debe realizarse preferentemente después de la interrupción del tratamiento con IBP, en comparación con solo pH-metría, porque este enfoque parece ofrecer la mejor oportunidad para evaluar una relación entre los síntomas y el reflujo.255 Al igual que lo planteado en la pregunta 20, poder definir el subgrupo de pacientes debería asociarse con un cambio en la conducta terapéutica. Sin embargo, la evidencia al respecto es escasa y limitada.
El panel de expertos considera, con un acuerdo del 93%, que la MII-pH es un método más adecuado en comparación con la pH-metría convencional en el caso que se considere un cambio en la conducta terapéutica, a pesar de que la evidencia es escasa y de baja calidad.
Tabla 21.
Pregunta 21: En pacientes con pirosis refractaria a IBP, ¿cuál es el aporte adicional de la pH-impedanciometría OFF IBP por sobre la pH-metría convencional en términos de cambio en la conducta terapéutica?
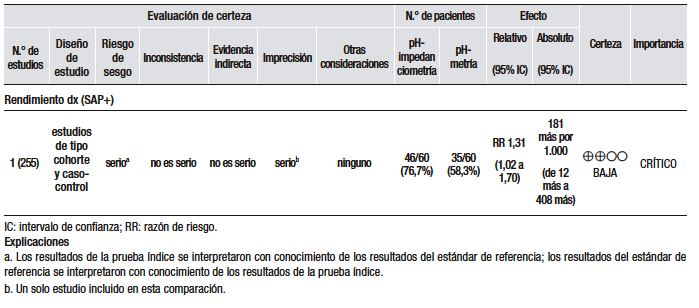
22. En pacientes con regurgitación refractaria a IBP, ¿se recomienda la realización de pH-impedanciometría (MII-pH) ante la sospecha de rumiación como confundidor de la ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: DÉBIL EN CONTRA
Hasta un 40% de los pacientes con síntomas sospechosos de ERGE no responden, o lo hacen parcialmente, a la terapia con IBP.5 La regurgitación posprandial persistente puede encontrarse en hasta un 40% de los pacientes con sospecha de ERGE que no responden a IBP. Una vez confirmada la ERGE, hasta un 20% de estos pacientes pueden tener un síndrome de rumiación posprandial.256 Dado que la distinción clínica de regurgitación posprandial y rumiación suele ser muy difícil, surge la necesidad de un método objetivo.
El síndrome de rumiación es un desorden funcional gastrointestinal de etiología desconocida, caracterizado por la regurgitación hacia la boca, muchas veces repetitiva, de la comida recientemente ingerida, en ausencia de anormalidades estructurales.257 Los episodios de rumiación han sido demostrados y caracterizados mediante diferentes estudios funcionales, siendo la manometría esofágica de alta resolución combinada con impedanciometría (HRM-IMP) uno de los métodos más utilizados actualmente.258
En la evaluación de los pacientes con síntomas sospechosos de ERGE refractarios al tratamiento con IBP, suele utilizarse la MII-pH para confirmar o descartar la ERGE y para caracterizar los distintos fenotipos. Nos preguntamos qué papel cumple este método en la identificación de episodios de rumiación.
Para la confección de la pregunta PICO, se tomó como población a pacientes con regurgitación refractaria a IBP, como intervención la MII-pH, como comparador la HRM-IMP con protocolo posprandial y como desenlace el diagnóstico de rumiación.
En la síntesis cuantitativa de esta pregunta (Tabla 22), se incluyó solamente un estudio con bajo número de pacientes, en donde inicialmente se identificó un patrón de rumiación (score de rumiación) en la MII-pH en quienes tenían confirmación de esta mediante HRM-IMP con protocolo posprandial, para luego aplicarlo en pacientes con síntomas de ERGE que no responden al tratamiento con IBP, con la finalidad de diagnosticar rumiación. El score de rumiación propuesto (0 a 2 puntos) tiene en cuenta el número de reflujos no ácidos posprandiales por hora (cutoff 3/hora: 1 punto) y el IS posprandial con regurgitación (cutoff 60%: 1 punto). En el trabajo analizado, se consideró que los pacientes presentaban rumiación con un score de 1 o 2 puntos. De esta manera, si este arroja 1 punto, puede diagnosticarse rumiación con una sensibilidad del 91,7% y una especificidad del 78,6%. Un score de 2 puntos provee una alta especificidad (93%), pero con una baja sensibilidad diagnóstica (58%).
Tabla 22
Pregunta 22: En pacientes con síntomas refractarios a IBP, ¿debemos considerar la realización de impedanciometría/ph (vs. no hacerla) ante la sospecha de rumiación como confundidores de la ERGE?
Además, los datos cuantitativos de este estudio muestran que los pacientes con rumiación presentaron más frecuentemente episodios de reflujo respecto de los controles sanos (diferencia media de 64, IC 95% 30,76-97,24). De forma similar, la exposición del bolo fue mayor en los pacientes que presentaron rumiación, en comparación con los controles sanos (diferencia media de 3,7 IC 95% 2,75-4,66).
La utilización de la MII-pH, si bien no constituye el método diagnóstico de elección para la rumiación, podría orientarnos en su identificación con una adecuada precisión, sobre todo, en aquellos pacientes con alta sospecha clínica y que presentan regurgitación posprandial como síntoma principal.
El panel de expertos considera, con un acuerdo del 80%, que, en la actualidad, el patrón de oro para el diagnóstico del síndrome de rumiación lo constituye la HRM-IMP con protocolo posprandial. No hay suficiente evidencia para utilizar con confianza el score que surge de la MII-pH para el diagnóstico de esta entidad.
23. En pacientes con síntomas de ERGE refractaria a IBP y eructos frecuentes, ¿se recomienda la realización de impedanciometría/pH (MII-pH) ante la sospecha de eructos supragástricos como confundidores de la ERGE?
Calidad de la evidencia: BAJA ⨁⨁○○
Fuerza de recomendación: FUERTE A FAVOR
El eructo se define como el escape audible de aire desde el esófago o el estómago hacia la faringe.259 Si bien todos los sujetos sanos presentan eructos, estos se consideran molestos cuando se convierten en excesivos y/o desencadenan síntomas de reflujo.260 Se han identificado dos tipos de eructos: los eructos gástricos (EG) y los eructos supragástricos (ESG). Los EG son un fenómeno fisiológico y constituyen el mecanismo reflejo que previene la acumulación excesiva de gas en el estómago y su pasaje al duodeno. Durante cada deglución, una pequeña cantidad de aire es ingerida. La acumulación de aire causa distensión del estómago proximal, lo cual, mediante un reflejo vagal, resulta en una RTEEI. A través de esta RTEEI, el aire es venteado fuera del estómago. En este caso, la dirección del aire es retrógrada, es decir, desde el estómago hacia el esófago, para luego pasar a la faringe y ser expulsado.261 A diferencia de este último, los ESG se consideran un trastorno de la conducta. En este caso, el paciente succiona el aire, que rápidamente es llevado al esófago y es seguido de su rápida expulsión. Este mecanismo de succión se genera como consecuencia de una contracción brusca y voluntaria del diafragma.262
Una correcta historia clínica a menudo puede orientarnos en la identificación del tipo de eructo. No obstante, la monitorización con MII-pH de 24 horas es la modalidad diagnóstica de elección, ya que proporciona la evidencia objetiva del sentido del movimiento del gas en el esófago, así como su eventual relación con el reflujo y los síntomas del paciente.5 De esta manera, en la MII-pH el ESG presenta un patrón típico que se caracteriza por una entrada rápida de aire, que se observa como un aumento anterógrado de la impedancia (mayor a 1000 Ohms), seguida inmediatamente por una expulsión retrógrada del aire, que se evidencia como un retorno de la impedancia a la línea de base.
Se ha postulado que los ESG en forma excesiva constituyen una causa importante de refractariedad al tratamiento con IBP en los pacientes con ERGE.258,260,262 Los mecanismos propuestos por los cuales los ESG se vinculan con los síntomas de ERGE serían tanto mediante la capacidad de estos de desencadenar episodios de reflujo como por la distensión esofágica que generan.263
La prevalencia de ESG en la ERGE es variable. En los pacientes con ERGE confirmada y refractarios al tratamiento con IBP, la prevalencia reportada es del 42%.264 Asimismo, la prevalencia de ESG es variable según el fenotipo de reflujo: 37,7% en la ERNE, 39,7% en el esófago hipersensible y 22% en la pirosis funcional.265
La importancia de la identificación de los ESG radica en que estos constituyen, como dijimos, una causa de refractariedad al tratamiento de la ERGE con IBP. De igual manera, el tratamiento con terapia cognitivo conductual reduce la cantidad de ESG y la exposición ácida asociada a estos.264
En este sentido, nos preguntamos si, en los pacientes con síntomas refractarios a IBP, debe considerarse la realización de MII-pH ante la sospecha de ESG como confundidor de la ERGE.
Para la confección de la pregunta PICO, se tomó como población a pacientes con síntomas de ERGE refractarios a IBP y eructos frecuentes, como intervención la MII-pH, como comparador la pH-C o la pH-CI y como desenlace el diagnóstico de eructos.
En el análisis cuantitativo de esta pregunta (Tabla 23a), se incluyó un estudio con baja calidad de evidencia y bajo número de pacientes, en el que se identificaron ESG en 50 pacientes con síntomas típicos de ERGE y en 10 voluntarios sanos.261 En ambos casos, los pacientes fueron estudiados mediante monitoreo ambulatorio con MII-pH OFF IBP. Los ESG fueron identificados en 24 de los 50 pacientes con síntomas de ERGE, con una incidencia media de 13/24hs (rango intercuartil: 6-52). En 5 de los voluntarios sanos se identificaron ESG con una incidencia de 2/24hs (rango intercuartil: 1-6). Por lo tanto, se deduce que la incidencia de ESG es mayor en los pacientes con síntomas de ERGE que en los controles. En este estudio, se observó que el 48% de los pacientes con síntomas de ERGE presentan ESG con una asociación temporal con los eventos de reflujo, la mayoría dentro del segundo previo al inicio del episodio de reflujo (30%). Con menor frecuencia, es posible observar ESG durante el episodio de reflujo (18%). El 52% restante de los ESG en estos pacientes no se asociaron con episodios de reflujo. Además, los ESG preceden tanto a los reflujos ácidos como a los no ácidos. Los episodios de reflujo asociados a ESG no difieren de los que no se asocian a ESG en términos de extensión proximal, tiempo de clearance de volumen o de ácido y nadir de pH. En cuanto a la expresión clínica en términos de síntomas típicos de ERGE, los episodios de reflujo asociados a ESG no difieren de aquellos no asociados.
Por otro lado, 25 de los 50 pacientes con síntomas de ERGE reportaron eructos como un síntoma molesto, habiéndose encontrado ESG en 15 de estos pacientes, mientras que en los otros 25 pacientes que no reportaron al eructo como molesto se encontró ESG solamente en 9 pacientes.
Si bien este trabajo de Hemmink no alcanza a responder la pregunta PICO en cuestión, debido a que no se trata de una población con síntomas de ERGE refractarios al tratamiento con IBP, explicaría a través de dos tablas cuestiones relacionadas con esta.
En primer término, la Tabla 23a evalúa la capacidad de la MII-pH para discriminar al eructo (supragástrico) percibido como molesto por el paciente en el contexto de síntomas de ERGE, con una sensibilidad del 60% y una especificidad del 64%.
Tabla 23a
Pregunta 23a: En pacientes con síntomas refractarios a IBP, ¿debemos considerar la realización de impedanciometría/ ph ante la sospecha de eructos supragástricos como confundidores de la ERGE?
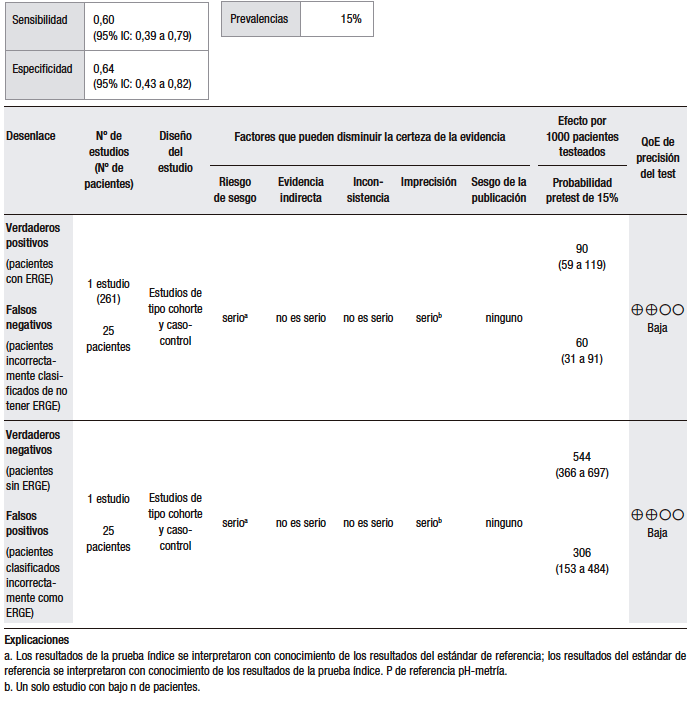
Por otro lado, la Tabla 23b demuestra que, al identificar a 2 grupos de pacientes con síntomas típicos de ERGE (pirosis, dolor de pecho y regurgitación), que fueron divididos según la presencia de ESG positivos (ESG+) o negativos (ESG-) por medio de MII-pH, la exposición ácida entre ambos grupos (mayor para el grupo ESG+) no mostró diferencias estadísticamente significativas. De esta forma, podría decirse, indirectamente, que la presencia de ESG no se asocia a una mayor exposición ácida, como posible causa de ERGE refractaria, en comparación con los SGB.
Tabla 23b
Pregunta 23b: En pacientes con síntomas refractarios a IBP, ¿debemos considerar la realización de impedanciometría/ph ante la sospecha de eructos supragástricos como confundidores de la ERGE?
 alt=»» width=»697″ height=»329″ />
alt=»» width=»697″ height=»329″ />
En conclusión, puede afirmarse que la realización de MII-pH en pacientes con síntomas de ERGE refractarios a IBP permite confirmar la presencia de ESG objetivamente, y que es de esperar encontrar en este grupo más cantidad de ESG que en los controles, sin diferencias significativas en la exposición ácida esofágica.
El panel de expertos considera, con un acuerdo del 93%, que la MII-pH es un método adecuado a considerar en pacientes con eructos frecuentes y síntomas de ERGE refractarios a IBP. Este método sería costo efectivo en esta población y, además, tiene una utilidad en relación con el cambio en la conducta terapéutica.
Agradecimientos. Los autores desean agradecer al Dr. Juan P. Stefanolo por su valiosa contribución con la selección de estudios incluidos y juicio de calidad de los datos. Además, agradecemos a la Sociedad Argentina de Gastroenterología – SAGE (presidente Dr. Alfredo Currás) por permitirnos realizar el meeting de votación en sus instalaciones y por su compromiso con la difusión del documento. Agradecemos también a la OPGE (presidente Dr. Arnoldo Riquelme) por su compromiso con la difusión del documento.
Propiedad intelectual. Los autores declaran que los datos, las tablas y las figuras presentes en el manuscrito son originales y fueron realizados en sus instituciones pertenecientes.
Financiamiento. Se obtuvo financiamiento parcial de parte de Medtronic para la realización de este consenso. La empresa brindó apoyo logístico para organizar las reuniones del grupo de expertos. La empresa no influyó ni tuvo ninguna participación en el desarrollo de las preguntas, la búsqueda bibliográfica, el análisis de los datos, el proceso de votación, las recomendaciones finales o la preparación del manuscrito que describe el consenso. Además, este consenso se ha realizado con completa independencia editorial.
Conflictos de interés. Los conflictos de interés de los expertos se enumeran a continuación.
JAO: declara haber participado como consultor o disertante y haber recibido un grant de la empresa Medtronic.
JEP: declara haber participado como speaker y consultor y haber recibido un grant para investigación por parte de Medtronic. Además, refiere poseer propiedad intelectual e intereses comerciales con Medtronic.
MMP: declara haber recibido un grant de Medtronic.
MAVD: declara no tener conflictos de interés.
JMRT: declara no tener conflictos de interés.
MG: declara haber participado como consultor o disertante de la empresa Medtronic.
AH: declara no tener conflictos de interés.
LRVG: declara no tener conflictos de interés.
HPL: declara no tener conflictos de interés.
GD: declara no tener conflictos de interés.
EV: declara no tener conflictos de interés.
MMR: declara no tener conflictos de interés.
LFPO: declara no tener conflictos de interés.
DC: declara no tener conflictos de interés.
MV: declara haber recibido apoyo no monetario en equipamiento e instalaciones y haber participado como consultor de las empresas Medtronic y Diversatek.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Olmos J A, Pandolfino J E, Piskorz M M y col. Consenso latinoamericano de diagnóstico de la enfermedad por reflujo gastroesofágico. Acta Gastroenterol Latinoam. 2022;52(2):175-240. https://doi.org/10.52787/agl.v52i2.210
Referencias
- Chiocca JC, Olmos JA, Salis GB, Soifer LO, Higa R, Marcolongo M, et al. Prevalence, clinical spectrum and atypical symptoms of gastro-oesophageal reflux in Argentina: a nationwide population-based study. Aliment Pharmacol Ther. 2005;22(4):331-42.
- El-Serag HB, Sweet S, Winchester CC, Dent J. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut. 2014;63(6):871-80.
- Páramo-Hernández DB, Albis R, Galiano MT, de Molano B, Rincón R, Pineda-Ovalle LF, et al. Prevalencia de síntomas del reflujo gastroesofágico y factores asociados: una encuesta poblacional en las principales ciudades de Colombia. Revista colombiana de Gastroenterología. 2016;31(4):337-46.
- Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R, the Global Consensus Group. The Montreal Definition and Classification of Gastroesophageal Reflux Disease: A Global Evidence-Based Consensus [Internet]. The American Journal of Gastroenterology. 2006;101:1900-20. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2006.00630.x
- Zerbib F, Bredenoord AJ, Fass R, Kahrilas PJ, Roman S, Savarino E, et al. ESNM/ANMS consensus paper: Diagnosis and management of refractory gastro-esophageal reflux disease. Neurogastroenterol Motil. 2021;33(4):e14075.
- Yadlapati R, Gyawali CP, Pandolfino JE. Personalized Approach to the Evaluation and Management of Gastroesophageal Reflux Disease. Clin Gastroenterol Hepatol [Internet]. 2022 Feb 2. Disponible en: http://dx.doi.org/10.1016/j.cgh.2022.01.025
- Hoff DAL, McMahon B, Gregersen H. Esophageal multimodal stimulation and sensation [Internet]. Annals of the New York Academy of Sciences. 2018;1434:210-8. Disponible en: http://dx.doi.org/10.1111/nyas.13730
- Ustaoglu A, Woodland P. Esophageal afferent innervation and its role in gastro-esophageal reflux disease symptoms. Curr Opin Gastroenterol. 2021;37(4):372-7.
- Lacy BE, Weiser K, Chertoff J, Fass R, Pandolfino JE, Richter JE, et al. The Diagnosis of Gastroesophageal Reflux Disease [Internet]. The American Journal of Medicine. 2010;123:583-92. Disponible en: http://dx.doi.org/10.1016/j.amjmed.2010.01.007
- Wiener GJ, Morgan TM, Copper JB, Castell DO, Sinclair JW, Richter JE. Ambulatory 24-hour esophageal pH monitoring. Dig Dis Sci. 1988;33(9):1127-33.
- de Bortoli N, Martinucci I, Savarino E, Bellini M, Bredenoord AJ, Franchi R, et al. Proton pump inhibitor responders who are not confirmed as GERD patients with impedance and pH monitoring: who are they? Neurogastroenterol Motil. 2014;26(1):28-35.
- Wang AJ, Wang H, Xu L, Lv NH, He XX, Hong JB, et al. Predictors of clinical response of acid suppression in Chinese patients with gastroesophageal reflux disease. Dig Liver Dis. 2013;45(4):296-300.
- Ribolsi M, Savarino E, De Bortoli N, Balestrieri P, Furnari M, Martinucci I, et al. Reflux pattern and role of impedance-pH variables in predicting PPI response in patients with suspected GERD-related chronic cough. Aliment Pharmacol Ther. 2014;40(8):966-73.
- Francis DO, Goutte M, Slaughter JC, Garrett CG, Hagaman D, Holzman MD, et al. Traditional reflux parameters and not impedance monitoring predict outcome after fundoplication in extraesophageal reflux. Laryngoscope. 2011;121(9):1902-9.
- Patel A, Sayuk GS, Gyawali CP. Acid-based parameters on pH-impedance testing predict symptom improvement with medical management better than impedance parameters. Am J Gastroenterol. 2014;109(6):836-44.
- Patel A, Sayuk GS, Gyawali CP. Parameters on esophageal pH-impedance monitoring that predict outcomes of patients with gastroesophageal reflux disease. Clin Gastroenterol Hepatol. 2015;13(5):884-91.
- Gyawali CP, Prakash Gyawali C, Kahrilas PJ, Savarino E, Zerbib F, Mion F, et al. Modern diagnosis of GERD: the Lyon Consensus [Internet]. Gut. 2018;67:1351-62. Disponible en: http://dx.doi.org/10.1136/gutjnl-2017-314722
- Ouzzani M, Hammady H, Fedorowicz Z, Elmagarmid A. Rayyan-a web and mobile app for systematic reviews. Syst Rev. 2016;5(1):210.
- Collaboration C. Review Manager (RevMan) [Computer Program] Version 5.2. 3, The Nordic Cochrane Centre, Copenhagen, 2012. Health Psychol Rev. 2014;17.
- GRADEpro GDT. GRADEpro Guideline Development Tool [Software]. McMaster University, 2015 (developed by Evidence Prime, Inc.). Disponible en:gradepro. org.: Evidence Prime. Inc;
- Ciapponi A. QUADAS-2: instrumento para la evaluación de la calidad de estudios de precisión diagnóstica. Evidencia, actualización en la práctica ambulatoria [Internet]. 2015;18(1). Disponible en: https://www.evidencia.org/index.php/Evidencia/article/view/6341
- Moher D, Liberati A, Tetzlaff J, Altman DG, The PRISMA Group. Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement [Internet]. PLoS Medicine. 2009;6:e1000097. Disponible en: http://dx.doi.org/10.1371/journal.pmed.1000097
- Blokdyk G. Zoom Software a Complete Guide – 2020 Edition. Emereo Pty Limited; 2020. 306 p.
- Numans ME, Lau J, de Wit NJ, Bonis PA. Short-term treatment with proton-pump inhibitors as a test for gastroesophageal reflux disease: a meta-analysis of diagnostic test characteristics. Ann Intern Med. 2004;140(7):518-27.
- Jonasson C, Wernersson B, Hoff DAL, Hatlebakk JG. Validation of the GerdQ questionnaire for the diagnosis of gastro-oesophageal reflux disease. Aliment Pharmacol Ther. 2013;37(5):564-72.
- Dent J, Vakil N, Jones R, Bytzer P, Schöning U, Halling K, et al. Accuracy of the diagnosis of GORD by questionnaire, physicians and a trial of proton pump inhibitor treatment: the Diamond Study. Gut. 2010;59(6):714-21.
- Bai Y, Du Y, Zou D, Jin Z, Zhan X, Li ZS, et al. Gastroesophageal Reflux Disease Questionnaire (GerdQ) in real-world practice: a national multicenter survey on 8065 patients. J Gastroenterol Hepatol. 2013;28(4):626-31.
- Jones R, Junghard O, Dent J, Vakil N, Halling K, Wernersson B, et al. Development of the GerdQ, a tool for the diagnosis and management of gastro-oesophageal reflux disease in primary care [Internet]. Alimentary Pharmacology & Therapeutics. 2009;30:1030-8. Disponible en: http://dx.doi.org/10.1111/j.1365-2036.2009.04142.x
- Lacy BE, Chehade R, Crowell MD. A Prospective Study to Compare a Symptom-Based Reflux Disease Questionnaire to 48-h Wireless pH Monitoring for the Identification of Gastroesophageal Reflux (revised 2-26-11) [Internet]. American Journal of Gastroenterology. 2011;106:1604-11. Disponible en: http://dx.doi.org/10.1038/ajg.2011.180
- Suzuki H, Matsuzaki J, Okada S, Hirata K, Fukuhara S, Hibi T. Validation of the GerdQ questionnaire for the management of gastro-oesophageal reflux disease in Japan. United European Gastroenterol J. 2013;1(3):175-83.
- Zaika S, Paliy I, Chernobrovyi V, Ksenchyn OO. The study and comparative analysis of GerdQ and GSRS Questionnaires on gastroesophageal reflux disease diagnostics. Prz Gastroenterol. 2020;15(4):323-9.
- Zavala-Gonzales MA, Azamar-Jacome AA, Meixueiro-Daza A, de la Medina AR, Job RHJ, Roesch-Dietlen F, et al. Validation and Diagnostic Usefulness of Gastroesophageal Reflux Disease Questionnaire in a Primary Care Level in Mexico [Internet]. Journal of Neurogastroenterology and Motility. 2014;20:475-82. Disponible en: http://dx.doi.org/10.5056/jnm14014
- Zhou LY, Wang Y, Lu JJ, Lin L, Cui RL, Zhang HJ, et al. Accuracy of diagnosing gastroesophageal reflux disease by GerdQ, esophageal impedance monitoring and histology [Internet]. Journal of Digestive Diseases. 2014;15:230-8. Disponible en: http://dx.doi.org/10.1111/1751-2980.12135
- Gyawali CP, Fass R. Management of Gastroesophageal Reflux Disease. Gastroenterology. 2018;154(2):302-18.
- Vela MF, Camacho-Lobato L, Srinivasan R, Tutuian R, Katz PO, Castell DO. Simultaneous intraesophageal impedance and pH measurement of acid and nonacid gastroesophageal reflux: effect of omeprazole. Gastroenterology. 2001;120(7):1599-606.
- Kahrilas PJ, Shaheen NJ, Vaezi MF, Hiltz SW, Black E, Modlin IM, et al. American Gastroenterological Association Medical Position Statement on the management of gastroesophageal reflux disease. Gastroenterology. 2008;135(4):1383-91, 1391.e1-5.
- Fass R, Ofman JJ, Gralnek IM, Johnson C, Camargo E, Sampliner RE, et al. Clinical and economic assessment of the omeprazole test in patients with symptoms suggestive of gastroesophageal reflux disease. Arch Intern Med. 1999;159(18):2161-8.
- Weijenborg PW, Cremonini F, Smout AJP, Bredenoord AJ. PPI therapy is equally effective in well-defined non-erosive reflux disease and in reflux esophagitis: a meta-analysis [Internet]. Neurogastroenterology & Motility. 2012;24:747-e350. Disponible en: http://dx.doi.org/10.1111/j.1365-2982.2012.01888.x
- Khan M, Santana J, Donnellan C, Preston C, Moayyedi P. Medical treatments in the short term management of reflux oesophagitis. Cochrane Database Syst Rev. 2007;(2):CD003244.
- Chiba N, De Gara CJ, Wilkinson JM, Hunt RH. Speed of healing and symptom relief in grade II to IV gastroesophageal reflux disease: a meta-analysis. Gastroenterology. 1997;112(6):1798-810.
- Sabesin SM, Berlin RG, Humphries TJ, Bradstreet DC, Walton-Bowen KL, Zaidi S. Famotidine Relieves Symptoms of Gastroesophageal Reflux Disease and Heals Erosions and Ulcerations: Results of a Multicenter, Placebo-Controlled, Dose-Ranging Study. Arch Intern Med. 1991;151(12):2394-400.
- Dean BB, Gano AD Jr, Knight K, Ofman JJ, Fass R. Effectiveness of proton pump inhibitors in nonerosive reflux disease. Clin Gastroenterol Hepatol. 2004;2(8):656-64.
- Sigterman KE, van Pinxteren B, Bonis PA, Lau J, Numans ME. Short-term treatment with proton pump inhibitors, H2-receptor antagonists and prokinetics for gastro-oesophageal reflux disease-like symptoms and endoscopy negative reflux disease [Internet]. Cochrane Database of Systematic Reviews. 2013. Disponible en: http://dx.doi.org/10.1002/14651858.cd002095.pub5
- Boeckxstaens G, El-Serag HB, Smout AJP, Kahrilas PJ. Symptomatic reflux disease: the present, the past and the future [Internet]. Gut. 2014;63:1185-93. Disponible en: http://dx.doi.org/10.1136/gutjnl-2013-306393
- Kahrilas PJ, Howden CW, Hughes N. Response of regurgitation to proton pump inhibitor therapy in clinical trials of gastroesophageal reflux disease. Am J Gastroenterol. 2011;106(8):1419-25; quiz 1426.
- Kahrilas PJ, Jonsson A, Denison H, Wernersson B, Hughes N, Howden CW. Regurgitation is less responsive to acid suppression than heartburn in patients with gastroesophageal reflux disease. Clin Gastroenterol Hepatol. 2012;10(6):612-9.
- Aanen MC, Weusten BLA, Numans ME, de Wit NJ, Baron A, Smout AJP. Diagnostic value of the proton pump inhibitor test for gastro-oesophageal reflux disease in primary care [Internet]. Alimentary Pharmacology and Therapeutics. 2006;24:1377-84. Disponible en: http://dx.doi.org/10.1111/j.1365-2036.2006.03121.x
- Fass R, Achem SR. Noncardiac chest pain: epidemiology, natural course and pathogenesis. J Neurogastroenterol Motil. 2011;17(2):110-23.
- Park SH, Choi JY, Park EJ, Lee JJ, Lee S, Na JO, et al. Prevalence of Gastrointestinal Diseases and Treatment Status in Noncardiac Chest Pain Patients. Korean Circ J. 2015;45(6):469-72.
- Bautista J, Fullerton H, Briseno M, Cui H, Fass R. The effect of an empirical trial of high-dose lansoprazole on symptom response of patients with non-cardiac chest pain – a randomized, double-blind, placebo-controlled, crossover trial [Internet]. Alimentary Pharmacology & Therapeutics. 2004;19:1123-30. Disponible en: http://dx.doi.org/10.1111/j.1365-2036.2004.01941.x
- Dekel R, Martinez-Hawthorne SD, Guillen RJ, Fass R. Evaluation of symptom index in identifying gastroesophageal reflux disease-related noncardiac chest pain. J Clin Gastroenterol. 2004;38(1):24-9.
- Dickman R, Emmons S, Cui H, Sewell J, Hernandez D, Esquivel RF, et al. The effect of a therapeutic trial of high-dose rabeprazole on symptom response of patients with non-cardiac chest pain: a randomized, double-blind, placebo-controlled, crossover trial [Internet]. Alimentary Pharmacology and Therapeutics. 2005;22:547-55. Disponible en: http://dx.doi.org/10.1111/j.1365-2036.2005.02620.x
- Fass R, Brian Fennerty M, Ofman JJ, Gralnek IM, Johnson C, Camargo E, et al. The clinical and economic value of a short course of omeprazole in patients with noncardiac chest pain [Internet]. Gastroenterology. 1998;115:42-9. Disponible en: http://dx.doi.org/10.1016/s0016-5085(98)70363-4
- Kim BJ, Choi SC, Kim JJ, Rhee JC, Rhee PL. Pathological bolus exposure plays a significant role in eliciting non-cardiac chest pain [Internet]. Journal of Gastroenterology and Hepatology. 2010;25:1855-60. Disponible en: http://dx.doi.org/10.1111/j.1440-1746.2010.06415.x
- Kim JH, Sinn DH, Son HJ, Kim JJ, Rhee JC, Rhee PL. Comparison of one-week and two-week empirical trial with a high-dose rabeprazole in non-cardiac chest pain patients. J Gastroenterol Hepatol. 2009;24(9):1504-9.
- Ko SY, Kim SI, Kim JH, Lee JH, Lee KJ, Hong SN, et al. Clinically distinct characteristics in patients younger than 40 years old with non-cardiac chest pain. J Gastroenterol Hepatol. 2012;27(9):1484-9.
- Mohd H, Qua CS, Wong CH, Azman W, Goh KL. Non-cardiac chest pain: Prevalence of reflux disease and response to acid suppression in an Asian population [Internet]. Journal of Gastroenterology and Hepatology. 2009;24:288-93. Disponible en: http://dx.doi.org/10.1111/j.1440-1746.2008.05702.x
- Pandak WM, Arezo S, Everett S, Jesse R, DeCosta G, Crofts T, et al. Short course of omeprazole: a better first diagnostic approach to noncardiac chest pain than endoscopy, manometry, or 24-hour esophageal pH monitoring. J Clin Gastroenterol. 2002;35(4):307-14.
- Xia HHX, Lai KC, Lam SK, Hu WHC, Wong NYH, Hui WM, et al. Symptomatic response to lansoprazole predicts abnormal acid reflux in endoscopy-negative patients with non-cardiac chest pain. Aliment Pharmacol Ther. 2003;17(3):369-77.
- Wertli MM, Ruchti KB, Steurer J, Held U. Diagnostic indicators of non-cardiovascular chest pain: a systematic review and meta-analysis. BMC Med. 2013;11:239.
- Williams JF, Sontag SJ, Schnell T, Leya J. Non-cardiac chest pain: the long-term natural history and comparison with gastroesophageal reflux disease. Am J Gastroenterol. 2009;104(9):2145-52.
- Kushnir VM, Sayuk GS, Gyawali CP. Abnormal GERD parameters on ambulatory pH monitoring predict therapeutic success in noncardiac chest pain. Am J Gastroenterol. 2010;105(5):1032-8.
- George N, Abdallah J, Maradey-Romero C, Gerson L, Fass R. Review article: the current treatment of non-cardiac chest pain [Internet]. Alimentary Pharmacology & Therapeutics. 2016;43:213-39. Disponible en: http://dx.doi.org/10.1111/apt.13458
- O’Hara J, Stocken DD, Watson GC, Fouweather T, McGlashan J, MacKenzie K, et al. Use of proton pump inhibitors to treat persistent throat symptoms: multicentre, double blind, randomised, placebo controlled trial [Internet]. BMJ. 2021. P. m4903. Disponible en: http://dx.doi.org/10.1136/bmj.m4903
- Vaezi MF, Katzka D, Zerbib F. Extraesophageal Symptoms and Diseases Attributed to GERD: Where is the Pendulum Swinging Now? Clin Gastroenterol Hepatol. 2018;16(7):1018-29.
- Francis DO, Rymer JA, Slaughter JC, Choksi Y, Jiramongkolchai P, Ogbeide E, et al. High economic burden of caring for patients with suspected extraesophageal reflux. Am J Gastroenterol. 2013;108(6):905-11.
- Metz D, Childs M, Ruiz C, Weinstein G. Pilot study of the oral omeprazole test for reflux laryngitis∂∂∂[Internet]. Otolaryngology – Head and Neck Surgery. 1997;116:41-6. Dis-ponible en: https://journals.sagepub.com/doi/full/10.1016/S0194-59989770350-4
- Siupsinskiene N, Adamonis K. Diagnostic test with omeprazole in patients with posterior laryngitis. Medicina. 2003;39(1):47-55.
- Park W, Hicks DM, Khandwala F, Richter JE, Abelson TI, Milstein C, et al. Laryngopharyngeal Reflux: Prospective Cohort Study Evaluating Optimal Dose of Proton-Pump Inhibitor Therapy and Pretherapy Predictors of Response [Internet]. The Laryngoscope. 2005;115:1230-8. Disponible en: http://dx.doi.org/10.1097/01.mlg.0000163746.81766.45
- Šiupšinskienè N, Adamonis K. Diagnostic test with omeprazole in patients with posterior laryngitis. Medicina. 2003;39(1):47-55.
- Kiljander TO, Harding SM, Field SK, Stein MR, Nelson HS, Ekelund J, et al. Effects of esomeprazole 40 mg twice daily on asthma: a randomized placebo-controlled trial. Am J Respir Crit Care Med. 200615;173(10):1091-7.
- Katz PO, Dunbar KB, Schnoll-Sussman FH, Greer KB, Yadlapati R, Spechler SJ. ACG Clinical Guideline for the Diagnosis and Management of Gastroesophageal Reflux Disease. Am J Gastroenterol. 20221;117(1):27-56.
- de Bortoli N, Nacci A, Savarino E, Martinucci I, Bellini M, Fattori B, et al. How many cases of laryngopharyngeal reflux suspected by laryngoscopy are gastroesophageal reflux disease-related? World J Gastroenterol. 2012;18(32):4363-70.
- Hunt R, Armstrong D, Katelaris P, Afihene M, Bane A, Bhatia S, et al. World Gastroenterology Organisation Global Guidelines: GERD Global Perspective on Gastroesophageal Reflux Disease. J Clin Gastroenterol. 2017;51(6):467-78.
- Yadlapati R, Kahrilas PJ, Fox MR, Bredenoord AJ, Prakash Gyawali C, Roman S, et al. Esophageal motility disorders on high-resolution manometry: Chicago classification version 4.0©. Neurogastroenterol Motil. 2021;33(1):e14058.
- Johnston BT, Troshinsky MB, Castell JA, Castell DO. Comparison of barium radiology with esophageal pH monitoring in the diagnosis of gastroesophageal reflux disease. Am J Gastroenterol. 1996;91(6):1181-5.
- Serna-Gallegos D, Basseri B, Bairamian V, Pimentel M, Soukiasian HJ. Gastroesophageal reflux reported on esophagram does not correlate with pH monitoring and high-resolution esophageal manometry. Am Surg. 2014;80(10):1026-9.
- Jones MP, Sloan SS, Rabine JC, Ebert CC, Huang CF, Kahrilas PJ. Hiatal hernia size is the dominant determinant of esophagitis presence and severity in gastroesophageal reflux disease. Am J Gastroenterol. 2001;96(6):1711-7.
- Kahrilas PJ. The role of hiatus hernia in GERD. Yale J Biol Med. 1999;72(2-3):101-11.
- Hill LD, Kozarek RA, Kraemer SJM, Aye RW, Dale Mercer C, Low DE, et al. The gastroesophageal flap valve: in vitro and in vivo observations [Internet]. Gastrointestinal Endoscopy. 1996;44:541-7. Disponible en: http://dx.doi.org/10.1016/s0016-5107(96)70006-8
- Hill LD, Kozarek RA. The Gastroesophageal Flap Valve [Internet]. Journal of Clinical Gastroenterology. 1999;28:194-7. Disponible en: http://dx.doi.org/10.1097/00004836-199904000-00002
- Johnsson F, Joelsson B, Gudmundsson K, Greiff L. Symptoms and endoscopic findings in the diagnosis of gastroesophageal reflux disease. Scand J Gastroenterol. 1987;22(6):714-8.
- Kim GH, Song GA, Kim TO, Jo HJ, Kim DH, Heo J, et al. Endoscopic grading of gastroesophageal flap valve and atrophic gastritis is helpful to predict gastroesophageal reflux. J Gastroenterol Hepatol. 2008;23(2):208-14.
- Lin BR, Wong JM, Chang MC, Liao CC, Yang PM, Jeng JH, et al. Abnormal gastroesophageal flap valve is highly associated with gastroesophageal reflux disease among subjects undergoing routine endoscopy in Taiwan. J Gastroenterol Hepatol. 2006;21(3):556-62.
- Armstrong D. Endoscopic evaluation of gastro-esophageal reflux disease. Yale J Biol Med. 1999;72(2-3):93-100.
- Lundell LR, Dent J, Bennett JR, Blum AL, Armstrong D, Galmiche JP, et al. Endoscopic assessment of oesophagitis: clinical and functional correlates and further validation of the Los Angeles classification. Gut. 1999;45(2):172-80.
- Roman S, Gyawali CP, Savarino E, Yadlapati R, Zerbib F, Wu J, et al. Ambulatory reflux monitoring for diagnosis of gastro-esophageal reflux disease: Update of the Porto consensus and recommendations from an international consensus group. Neurogastroenterol Motil. 2017;29(10):e13067.
- Savarino E, Zentilin P, Savarino V. NERD: an umbrella term including heterogeneous subpopulations. Nat Rev Gastroenterol Hepatol. 2013;10(6):371-80.
- Poh CH, Gasiorowska A, Navarro-Rodríguez T, Willis MR, Hargadon D, Noelck N, et al. Upper GI tract findings in patients with heartburn in whom proton pump inhibitor treatment failed versus those not receiving antireflux treatment. Gastrointest Endosc. 2010;71(1):28-34.
- Akdamar K, Ertan A, Agrawal NM, McMahon FG, Ryan J. Upper gastrointestinal endoscopy in normal asymptomatic volunteers. Gastrointest Endosc. 1986;32(2):78-80.
- Takashima T, Iwakiri R, Sakata Y, Yamaguchi D, Tsuruoka N, Akutagawa K, et al. Endoscopic reflux esophagitis and Helicobacter pylori infection in young healthy Japanese volunteers. Digestion. 201220;86(1):55-8.
- Zagari RM, Fuccio L, Wallander MA, Johansson S, Fiocca R, Casanova S, et al. Gastro-oesophageal reflux symptoms, oesophagitis and Barrett’s oesophagus in the general population: the Loiano-Monghidoro study. Gut. 2008;57(10):1354-9.
- Jobe BA, Richter JE, Hoppo T, Peters JH, Bell R, Dengler WC, et al. Preoperative diagnostic workup before antireflux surgery: an evidence and experience-based consensus of the Esophageal Diagnostic Advisory Panel. J Am Coll Surg. 2013;217(4):586-97.
- Book DT, Rhee JS, Toohill RJ, Smith TL. Perspectives in laryngopharyngeal reflux: an international survey. Laryngoscope [Internet]. 2002. Disponible en: https://onlinelibrary.wiley.com/doi/abs/10.1097/00005537-200208000-00014?casa_token=15h
l6yJMjvoAAAAA:bZBu-XfNXXrP9ofjyiRNOEB17VTIyVs4Q0
ehranWLCGp4aOJMjHFYYhqGNbd_btkZs-K3StInD_ecJEk - Reulbach TR, Belafsky PC, Blalock PD, Koufman JA, Postma GN. Occult laryngeal pathology in a community-based cohort. Otolaryngol Head Neck Surg. 2001;124(4):448-50.
- Koufman JA, Aviv JE, Casiano RR, Shaw GY. Laryngopharyngeal reflux: position statement of the committee on speech, voice, and swallowing disorders of the American Academy of Otolaryngology-Head and Neck Surgery. Otolaryngol Head Neck Surg. 2002;127(1):32-5.
- Altman KW, Stephens RM, Lyttle CS, Weiss KB. Changing impact of gastroesophageal reflux in medical and otolaryngology practice. Laryngoscope. 2005;115(7):1145-53.
- Francis DO, Vaezi MF. Should the Reflex Be Reflux? Throat Symptoms and Alternative Explanations. Clin Gastroenterol Hepatol. 2015;13(9):1560-6.
- Barrett CM, Patel D, Vaezi MF. Laryngopharyngeal Reflux and Atypical Gastroesophageal Reflux Disease. Gastrointest Endosc Clin N Am. 2020;30(2):361-76.
- Barry DW, Vaezi MF. Laryngopharyngeal reflux: More questions than answers. Cleve Clin J Med. 2010;77(5):327-34.
- Belafsky PC, Postma GN, Koufman JA. The validity and reliability of the reflux finding score (RFS). Laryngoscope. 2001;111(8):1313-7.
- Dhillon VK, Akst LM. How to Approach Laryngopharyngeal Reflux: An Otolaryngology Perspective. Curr Gastroenterol Rep. 2016;18(8):44.
- Vaezi MF, Hicks DM, Abelson TI, Richter JE. Laryngeal signs and symptoms and gastroesophageal reflux disease (GERD): a critical assessment of cause and effect association. Clin Gastroenterol Hepatol. 2003;1(5):333-44.
- Branski RC, Bhattacharyya N, Shapiro J. The reliability of the assessment of endoscopic laryngeal findings associated with laryngopharyngeal reflux disease. Laryngoscope. 2002;112(6):1019-24.
- Chang BA, Danielle MacNeil S, Morrison MD, Lee PK. The Reliability of the Reflux Finding Score Among General Otolaryngologists [Internet]. Journal of Voice. 2015;29:572-7. Disponible en: http://dx.doi.org/10.1016/j.jvoice.2014.10.009
- Hicks DM, Ours TM, Abelson TI, Vaezi MF, Richter JE. The prevalence of hypopharynx findings associated with gastroesophageal reflux in normal volunteers. J Voice. 2002;16(4):564-79.
- Milstein CF, Charbel S, Hicks DM, Abelson TI, Richter JE, Vaezi MF. Prevalence of laryngeal irritation signs associated with reflux in asymptomatic volunteers: impact of endoscopic technique (rigid vs. flexible laryngoscope). Laryngoscope. 2005;115(12):2256-61.
- Swoger J, Ponsky J, Hicks DM, Richter JE, Abelson TI, Milstein C, et al. Surgical fundoplication in laryngopharyngeal reflux unresponsive to aggressive acid suppression: a controlled study. Clin Gastroenterol Hepatol. 2006;4(4):433-41.
- Qadeer MA, Phillips CO, Lopez AR, Steward DL, Noordzij JP, Wo JM, et al. Proton pump inhibitor therapy for suspected GERD-related chronic laryngitis: a meta-analysis of randomized controlled trials. Am J Gastroenterol. 2006;101(11):2646-54.
- Herbella FAM, Andolfi C, Vigneswaran Y, Patti MG, Pinna BR. Importance of esophageal manometry and pH monitoring for the evaluation of otorhinolaryngologic (ENT) manifestations of GERD. A multicenter study. J Gastrointest Surg. 2016;20(10):1673-8.
- Woo P, Noordzij P, Ross JA. Association of esophageal reflux and globus symptom: comparison of laryngoscopy and 24-hour pH manometry. Otolaryngol Head Neck Surg. 1996;115(6):502-7.
- Fass R, Ofman JJ. Gastroesophageal reflux disease-should we adopt a new conceptual framework? Am J Gastroenterol. 2002;97(8):1901-9.
- Ronkainen J, Aro P, Storskrubb T, Johansson SE, Lind T, Bolling-Sternevald E, et al. High prevalence of gastroesophageal reflux symptoms and esophagitis with or without symptoms in the general adult Swedish population: a Kalixanda study report. Scand J Gastroenterol. 2005;40(3):275-85.
- Sharma P, Wani S, Bansal A, Hall S, Puli S, Mathur S, et al. A Feasibility Trial of Narrow Band Imaging Endoscopy in Patients with Gastroesophageal Reflux Disease [Internet]. Gastroenterology. 2007;133:454-64. Disponible en: http://dx.doi.org/10.1053/j.gastro.2007.06.006
- Rey JW, Deris N, Marquardt JU, Thomaidis T, Moehler M, Kittner JM, et al. High-definition endoscopy with iScan and Lugol’s solution for the detection of inflammation in patients with nonerosive reflux disease: histologic evaluation in comparison with a control group [Internet]. Diseases of the Esophagus. 2016;29:185-1. Disponible en: http://dx.doi.org/10.1111/dote.12308
- Wong WM, Bautista J, Dekel R, Malagon IB, Tuchinsky I, Green C, et al. Feasibility and tolerability of transnasal/per-oral placement of the wireless pH capsule vs. traditional 24-h oesophageal pH monitoring–a randomized trial. Aliment Pharmacol Ther. 2005;21(2):155-63.
- Fass R, Hell R, Sampliner RE, Pulliam G, Graver E, Hartz V, et al. Effect of ambulatory 24-hour esophageal pH monitoring on reflux-provoking activities. Dig Dis Sci. 1999;44(11):2263-9.
- Sweis R, Fox M, Anggiansah R, Anggiansah A, Basavaraju K, Canavan R, et al. Patient acceptance and clinical impact of Bravo monitoring in patients with previous failed catheter-based studies. Aliment Pharmacol Ther. 2009;29(6):669-76.
- Ismail-Beigi F, Horton PF, Pope CE 2nd. Histological consequences of gastroesophageal reflux in man. Gastroenterology. 1970;58(2):163-74.
- Savarino E, Zentilin P, Mastracci L, Dulbecco P, Marabotto E, Gemignani L, et al. Microscopic esophagitis distinguishes patients with non-erosive reflux disease from those with functional heartburn. J Gastroenterol. 2013;48(4):473-82.
- Kandulski A, Jechorek D, Caro C, Weigt J, Wex T, Mönkemüller K, et al. Histomorphological differentiation of non-erosive reflux disease and functional heartburn in patients with PPI-refractory heartburn. Aliment Pharmacol Ther. 2013;38(6):643-51.
- Mastracci L, Spaggiari P, Grillo F, Zentilin P, Dulbecco P, Ceppa P, et al. Microscopic esophagitis in gastro-esophageal reflux disease: individual lesions, biopsy sampling, and clinical correlations. Virchows Arch. 2009;454(1):31-9.
- Cui R, Zhang H, Zhou L, Lu J, Xue Y, Wang Y, et al. Diagnostic value of dilated intercellular space and histopathologic scores in gastroesophageal reflux disease. Dis Esophagus. 2015;28(6):530-7.
- Bowrey DJ, Williams GT, Clark GWB. Histological changes in the oesophageal squamous mucosa: correlation with ambulatory 24 hour pH monitoring. J Clin Pathol. 2003;56(3):205-8.
- Fiocca R, Mastracci L, Riddell R, Takubo K, Vieth M, Yerian L, et al. Development of consensus guidelines for the histologic recognition of microscopic esophagitis in patients with gastroesophageal reflux disease: the Esohisto project. Hum Pathol. 2010;41(2):223-31.
- Schneider NI, Plieschnegger W, Geppert M, Wigginghaus B, Hoess GM, Eherer A, et al. Validation study of the Esohisto consensus guidelines for the recognition of microscopic esophagitis (histoGERD Trial). Hum Pathol. 2014;45(5):994-1002.
- Zentilin P, Savarino V, Mastracci L, Spaggiari P, Dulbecco P, Ceppa P, et al. Reassessment of the Diagnostic Value of Histology in Patients with GERD, Using Multiple Biopsy Sites and an Appropriate Control Group [Internet]. The American Journal of Gastroenterology. 2005;100:2299-306. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2005.50209.x
- Edebo A, Vieth M, Tam W, Bruno M, van Berkel AM, Stolte M, et al. Circumferential and axial distribution of esophageal mucosal damage in reflux disease. Dis Esophagus. 2007;20(3):232-8.
- Caviglia R, Ribolsi M, Maggiano N, Gabbrielli AM, Emerenziani S, Guarino MPL, et al. Dilated intercellular spaces of esophageal epithelium in nonerosive reflux disease patients with physiological esophageal acid exposure. Am J Gastroenterol. 2005;100(3):543-8.
- Caviglia R, Ribolsi M, Gentile M, Rabitti C, Emerenziani S, Guarino MPL, et al. Dilated intercellular spaces and acid reflux at the distal and proximal oesophagus in patients with non-erosive gastro-oesophageal reflux disease. Aliment Pharmacol Ther. 2007;25(5):629-36.
- Purdy JK, Appelman HD, Golembeski CP, McKenna BJ. Lymphocytic Esophagitis [Internet]. American Journal of Clinical Pathology. 2008;130:508-13. Disponible en: http://dx.doi.org/10.1309/d3pcf6d6yymqrx9a
- Katzka DA, Ravi K, Geno DM, Smyrk TC, Iyer PG, Alexander JA, et al. Endoscopic Mucosal Impedance Measurements Correlate With Eosinophilia and Dilation of Intercellular Spaces in Patients With Eosinophilic Esophagitis [Internet]. Clinical Gastroenterology and Hepatology. 2015;13:1242-8.e1. Disponible en: http://dx.doi.org/10.1016/j.cgh.2014.12.032
- Takubo K, Honma N, Aryal G, Sawabe M, Arai T, Tanaka Y, et al. Is There a Set of Histologic Changes That Are Invariably Reflux Associated? [Internet]. Archives of Pathology & Laboratory Medicine. 2005;129:159-63. Disponible en: http://dx.doi.org/10.5858/2005-129-159-itasoh
- Demir D, Doğanavşargil B, Sarsık B, Sezak M, Tunçyürek M. Is it possible to diagnose infectious oesophagitis without seeing the causative organism? A histopathological study. Turk J Gastroenterol. 2014;25(5):481-7.
- Blevins CH, Dierkhising RA, Geno DM, Johnson ML, Vela MF, Ravi K, et al. Obesity and GERD impair esophageal epithelial permeability through 2 distinct mechanisms. Neurogastroenterol Motil. 2018;30(10):e13403.
- Farré R, De Vos R, Geboes K, Verbecke K, Vanden Berghe P, Depoortere I, et al. Critical role of stress in increased oesophageal mucosa permeability and dilated intercellular spaces. Gut. 2007;56(9):1191-7.
- Bove M, Vieth M, Dombrowski F, Ny L, Ruth M, Lundell L. Acid Challenge to the Human Esophageal Mucosa: Effects on Epithelial Architecture in Health and Disease [Internet]. Digestive Diseases and Sciences. 2005;50:1488-96. Disponible en: http://dx.doi.org/10.1007/s10620-005-2867-3
- Katz PO, Gerson LB, Vela MF. Guidelines for the Diagnosis and Management of Gastroesophageal Reflux Disease [Internet]. American Journal of Gastroenterology. 2013;108:308-28. Disponible en: http://dx.doi.org/10.1038/ajg.2012.444
- Chae S, Richter JE. Wireless 24, 48, and 96 Hour or Impedance or Oropharyngeal Prolonged pH Monitoring: Which Test, When, and Why for GERD? [Internet]. Current Gastroenterology Reports. 2018;20. Disponible en: http://dx.doi.org/10.1007/s11894-018-0659-0
- Kessels SJM, Newton SS, Morona JK, Merlin TL. Safety and Efficacy of Wireless pH Monitoring in Patients Suspected of Gastroesophageal Reflux Disease: A Systematic Review. J Clin Gastroenterol. 2017;51(9):777-88.
- Andrews CN, Sadowski DC, Lazarescu A, Williams C, Neshev E, Storr M, et al. Unsedated peroral wireless pH capsule placement vs. standard pH testing: a randomized study and cost analysis. BMC Gastroenterol. 2012;12:58.
- Wenner J, Johnsson F, Johansson J, Öberg S. Wireless Esophageal pH Monitoring Is Better Tolerated than the Catheter-Based Technique: Results from a Randomized Cross-Over Trial [Internet]. The American Journal of Gastroenterology. 2007;102:239-45. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2006.00939.x
- Grigolon A, Bravi I, Cantù P, Conte D, Penagini R. Wireless pH monitoring: Better tolerability and lower impact on daily habits [Internet]. Digestive and Liver Disease. 2007;39:720-4. Disponible en: http://dx.doi.org/10.1016/j.dld.2007.05.011
- Bradley AG, Crowell MD, DiBaise JK, Kim HJ, Burdick GE, Fleischer DE, et al. Comparison of the impact of wireless versus catheter-based pH-metry on daily activities and study-related symptoms. J Clin Gastroenterol. 2011;45(2):100-6.
- Schneider JH, Kramer KM, Königsrainer A, Granderath FA. Ambulatory pH: monitoring with a wireless system [Internet]. Surgical Endoscopy. 2007;21:2076-80. Disponible en: http://dx.doi.org/10.1007/s00464-007-9301-1
- Croffie JM, Fitzgerald JF, Molleston JP, Gupta SK, Corkins MR, Pfefferkorn MD, et al. Accuracy and Tolerability of the Bravo Catheter-free pH Capsule in Patients Between the Ages of 4 and 18 Years [Internet]. Journal of Pediatric Gastroenterology & Nutrition. 2007;45:559-63. Disponible en: http://dx.doi.org/10.1097/mpg.0b013e3180dc9349
- Azzam RS, Sallum RAA, Brandão JF, Navarro-Rodriguez T, Nasi A. Comparative study of two modes of gastroesophageal reflux measuring: conventional esophageal pH monitoring and wireless pH monitoring [Internet]. Arquivos de Gastroenterologia. 2012;107-12. Disponible en: http://dx.doi.org/10.1590/s0004-28032012000200003
- Varannes SBD, des Varannes SB. Simultaneous recordings of oesophageal acid exposure with conventional pH monitoring and a wireless system (Bravo) [Internet]. Gut. 2005;54:1682-6. Disponible en: http://dx.doi.org/10.1136/gut.2005.066274
- Håkanson BS, Berggren P, Granqvist S, Ljungqvist O, Thorell A. Comparison of wireless 48-h (Bravo) versus traditional ambulatory 24-h esophageal pH monitoring [Internet]. Scandinavian Journal of Gastroenterology. 2009;44:276-83. Disponible en: http://dx.doi.org/10.1080/00365520802588109
- Pandolfino JE, Richter JE, Ours T, Guardino JM, Chapman J, Kahrilas PJ. Ambulatory esophageal pH monitoring using a wireless system [Internet]. The American Journal of Gastroenterology. 2003;98:740-9. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2003.07398.x
- Wenner J, Hall M, Höglund P, Johansson J, Johnsson F, Öberg S. Wireless pH Recording Immediately Above the Squamocolumnar Junction Improves the Diagnostic Performance of Esophageal pH Studies [Internet]. The American Journal of Gastroenterology. 2008;103:2977-85. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2008.02174.x
- Bansal A, Wani S, Rastogi A, Rastogi K, Goyal A, Hall S, et al.
Impact of Measurement of Esophageal Acid Exposure Close to the Gastroesophageal Junction on Diagnostic Accuracy and Event-Symptom Correlation [Internet]. American Journal of Gastroenterology. 2009;104:2918-25. Disponible en: http://dx.doi.org/10.1038/ajg.2009.506 - Ayazi S, Lipham JC, Portale G, Peyre CG, Streets CG, Leers JM, et al. Bravo Catheter-Free pH Monitoring: Normal Values, Concordance, Optimal Diagnostic Thresholds, and Accuracy [Internet]. Clinical Gastroenterology and Hepatology. 2009;7:60-7. Disponible en: http://dx.doi.org/10.1016/j.cgh.2008.08.020
- Yang XJ, Gan T, Wang L, Liao Z, Tao XH, Shen W, et al. Wireless esophageal pH capsule for patients with gastroesophageal reflux disease: a multicenter clinical study. World J Gastroenterol. 201428;20(40):14865-74.
- Prakash C, Clouse RE. Value of extended recording time with wireless pH monitoring in evaluating gastroesophageal reflux disease [Internet]. Clinical Gastroenterology and Hepatology. 2005;3:329-34. Disponible en: http://dx.doi.org/10.1016/s1542-3565(05)00021-2
- Scarpulla G, Camilleri S, Galante P, Manganaro M, Fox M. The Impact of Prolonged pH Measurements on the Diagnosis of Gastroesophageal Reflux Disease: 4-Day Wireless pH Studies [Internet]. The American Journal of Gastroenterology. 2007;102:2642-7. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2007.01461.x
- Patel R, Kumar A, Jacobs JW, Chae S, Richter JE. Su1096 – 96-Hour Esophageal PH Monitoring: The Tiebreaker for Abnormal Demeester Score and Symptom Index [Internet]. Gastroenterology. 2018;154:S-486. Disponible en: http://dx.doi.org/10.1016/s0016-5085(18)31852-3
- Garrean CP, Zhang Q, Gonsalves N, Hirano I. Acid reflux detection and symptom-reflux association using 4-day wireless pH recording combining 48-hour periods off and on PPI therapy. Am J Gastroenterol. 2008l;103(7):1631-7.
- Roman S, Bruley des Varannes S, Pouderoux P, Chaput U, Mion F, Galmiche JP, et al. Ambulatory 24-h oesophageal impedance-pH recordings: reliability of automatic analysis for gastro-oesophageal reflux assessment. Neurogastroenterol Motil. 2006;18(11):978-86.
- Masiak W, Wallner G, Wallner J, Pedowski T, Solecki M. Combined Esophageal Multichannel Intraluminal Impedance and pH Monitoring (MII -pH) in the Diagnostics and Treatment of Gastroesophageal Reflux Disease and its Complications [Internet]. Polish Journal of Surgery. 2011;83. Disponible en: http://dx.doi.org/10.2478/v10035-011-0076-7
- Zerbib F, Belhocine K, Simon M, Capdepont M, Mion F, Bruley des Varannes S, et al. Clinical, but not oesophageal pH-impedance, profiles predict response to proton pump inhibitors in gastro-oesophageal reflux disease. Gut. 2012;61(4):501-6.
- Bell R, Lipham J, Louie BE, Williams V, Luketich JD. Randomized controlled trial of Magnetic Sphincter Augmentation (MSA) vs. omeprazole in gerd patients with regurgitation: initial results from the caliber trial. Gastroenterology. 2017;152(5):S1309.
- Rogers BD, Valdovinos LR, Crowell MD, Bell R, Vela MF, Gyawali CP. Number of reflux episodes on pH-impedance monitoring associates with improved symptom outcome and treatment satisfaction in gastro-oesophageal reflux disease (GERD) patients with regurgitation. Gut. 2021;70(3):450-5.
- Helm JF, Dodds WJ, Pelc LR, Palmer DW, Hogan WJ, Teeter BC. Effect of esophageal emptying and saliva on clearance of acid from the esophagus. N Engl J Med. 1984;310(5):284-8.
- Frazzoni M, Bertani H, Manta R, Mirante VG, Frazzoni L, Conigliaro R, et al. Impairment of chemical clearance is relevant to the pathogenesis of refractory reflux oesophagitis [Internet]. Digestive and Liver Disease. 2014;46:596-602. Disponible en: http://dx.doi.org/10.1016/j.dld.2014.03.005
- Frazzoni L, Frazzoni M, de Bortoli N, Tolone S, Furnari M, Martinucci I, et al. Postreflux swallow-induced peristaltic wave index and nocturnal baseline impedance can link PPI-responsive heartburn to reflux better than acid exposure time. Neurogastroenterol Motil [Internet]. 2017;29(11). Disponible en: http://dx.doi.org/10.1111/nmo.13116
- Frazzoni M, Manta R, Mirante VG, Conigliaro R, Frazzoni L, Melotti G. Esophageal chemical clearance is impaired in gastro-esophageal reflux disease – a 24-h impedance-pH monitoring assessment [Internet]. Neurogastroenterology & Motility. 2013;25:399-e295. Disponible en: http://dx.doi.org/10.1111/nmo.12080
- Frazzoni M, de Bortoli N, Frazzoni L, Tolone S, Furnari M, Martinucci I, et al. The added diagnostic value of postreflux swallow-induced peristaltic wave index and nocturnal baseline impedance in refractory reflux disease studied with on-therapy impedance-pH monitoring. Neurogastroenterol Motil [Internet]. 2017;29(3). Disponible en: http://dx.doi.org/10.1111/nmo.12947
- Sun YM, Gao Y, Gao F. Role of Esophageal Mean Nocturnal Baseline Impedance and Post-reflux Swallow-induced Peristaltic Wave Index in Discriminating Chinese Patients With Heartburn. J Neurogastroenterol Motil. 2019;25(4):515-20.
- Ribolsi M, Frazzoni M, Marabotto E, De Carlo G, Ziola S, Maniero D, et al. Novel impedance-pH parameters are associated with proton pump inhibitor response in patients with inconclusive diagnosis of gastro-oesophageal reflux disease according to Lyon Consensus. Aliment Pharmacol Ther. 2021;54(4):412-8.
- Gyawali CP, Prakash Gyawali C, Tutuian R, Zerbib F, Rogers BD, Frazzoni M, et al. Value of pH Impedance Monitoring While on Twice-Daily Proton Pump Inhibitor Therapy to Identify Need for Escalation of Reflux Management [Internet]. Gastroenterology. 2021;161:1412-22. Disponible en: http://dx.doi.org/10.1053/j.gastro.2021.07.004
- Farre R, Blondeau K, Clement D, Vicario M, Cardozo L, Vieth M, et al. Evaluation of oesophageal mucosa integrity by the intraluminal impedance technique [Internet]. Gut. 2011;60:885-92. Disponible en: http://dx.doi.org/10.1136/gut.2010.233049
- Kessing BF, Bredenoord AJ, Weijenborg PW, Hemmink GJM, Loots CM, Smout AJPM. Esophageal acid exposure decreases intraluminal baseline impedance levels. Am J Gastroenterol. 2011;106(12):2093-7.
- Saritas Yuksel E, Higginbotham T, Slaughter JC, Mabary J, Kavitt RT, Garrett CG, et al. Use of direct, endoscopic-guided measurements of mucosal impedance in diagnosis of gastroesophageal reflux disease. Clin Gastroenterol Hepatol. 2012;10(10):1110-6.
- Ates F, Yuksel ES, Higginbotham T, Slaughter JC, Mabary J, Kavitt RT, et al. Mucosal Impedance Discriminates GERD From Non-GERD Conditions [Internet]. Gastroenterology. 2015;148:334-43. Disponible en: http://dx.doi.org/10.1053/j.gastro.2014.10.010
- Patel DA, Higginbotham T, Slaughter JC, Aslam M, Yuksel E, Katzka D, et al. Development and Validation of a Mucosal Impedance Contour Analysis System to Distinguish Esophageal Disorders [Internet]. Gastroenterology. 2019;156:1617-26.e1. Disponible en: http://dx.doi.org/10.1053/j.gastro.2019.01.253
- Martinucci I, de Bortoli N, Savarino E, Piaggi P, Bellini M, Antonelli A, et al. Esophageal baseline impedance levels in patients with pathophysiological characteristics of functional heartburn [Internet]. Neurogastroenterology & Motility. 2014;26:546-55. Disponible en: http://dx.doi.org/10.1111/nmo.12299
- Kandulski A, Weigt J, Caro C, Jechorek D, Wex T, Malfertheiner P. Esophageal intraluminal baseline impedance differentiates gastroesophageal reflux disease from functional heartburn. Clin Gastroenterol Hepatol. 2015;13(6):1075-81.
- Hoshikawa Y, Sawada A, Sonmez S, Nikaki K, Woodland P, Yazaki E, et al. Measurement of Esophageal Nocturnal Baseline Impedance: A Simplified Method [Internet]. Journal of Neurogastroenterology and Motility. 2020;26:241-7. Disponible en: http://dx.doi.org/10.5056/jnm19183
- Pineda-Ovalle LF, Galindo-M P, Borráez-Segura BA, Guio A, Angarita-Santos O, Arbeláez-Méndez VH, et al. Eficacia diagnóstica de la impedancia basal nocturna media, un nuevo parámetro para el estudio de la enfermedad por reflujo gastroesofágico [Internet]. Revista Colombiana de Gastroenterología. 2018;33:211. Disponible en: http://dx.doi.org/10.22516/25007440.287
- van Rhijn BD, Weijenborg PW, Verheij J, van den Bergh Weerman MA, Verseijden C, van den Wijngaard RMJGJ,
et al. Proton pump inhibitors partially restore mucosal integrity in patients with proton pump inhibitor-responsive esophageal eosinophilia but not eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2014;12(11):1815-23.e2. - Rengarajan A, Savarino E, Della Coletta M, Ghisa M, Patel A, Gyawali CP. Mean Nocturnal Baseline Impedance Correlates With Symptom Outcome When Acid Exposure Time Is Inconclusive on Esophageal Reflux Monitoring. Clin Gastroenterol Hepatol. 2020;18(3):589-95.
- Patel A, Wang D, Sainani N, Sayuk GS, Gyawali CP. Distal mean nocturnal baseline impedance on pH-impedance monitoring predicts reflux burden and symptomatic outcome in gastro-oesophageal reflux disease. Aliment Pharmacol Ther. 2016;44(8):890-8.
- Sifrim D, Roman S, Savarino E, Bor S, Bredenoord AJ, Castell D, et al. Normal values and regional differences in oesophageal impedance-pH metrics: a consensus analysis of impedance-pH studies from around the world. Gut [Internet]. 2020. Disponible en: http://dx.doi.org/10.1136/gutjnl-2020-322627
- Bortoli N de, de Bortoli N, Martinucci I, Savarino E, Tutuian R, Frazzoni M, et al. Association Between Baseline Impedance Values and Response Proton Pump Inhibitors in Patients With Heartburn [Internet]. Clinical Gastroenterology and Hepatology. 2015;13:1082-8.e1. Disponible en: http://dx.doi.org/10.1016/j.cgh.2014.11.035
- Triggs JR, Kahrilas PJ. Editorial: symptom association probability during reflux testing-what is the gain? Aliment Pharmacol Ther. Wiley; 2018;47(9):1317-8.
- Bredenoord AJ, Weusten BLAM, Smout AJPM. Symptom association analysis in ambulatory gastro-oesophageal reflux monitoring. Gut. 2005;54(12):1810-7.
- Aziz Q, Fass R, Gyawali CP, Miwa H, Pandolfino JE, Zerbib F. Functional Esophageal Disorders. Gastroenterology [Internet]. 2016. Disponible en: http://dx.doi.org/10.1053/j.gastro.2016.02.012
- Scarpellini E, Ang D, Pauwels A, De Santis A, Vanuytsel T, Tack J. Management of refractory typical GERD symptoms. Nat Rev Gastroenterol Hepatol. 2016;13(5):281-94.
- Tack J, Pandolfino JE. Pathophysiology of Gastroesophageal Reflux Disease. Gastroenterology. 2018;154(2):277-88.
- Lam HG, Breumelhof R, Roelofs JM, Van Berge Henegouwen GP, Smout AJ. What is the optimal time window in symptom analysis of 24-hour esophageal pressure and pH data? Dig Dis Sci. 1994;39(2):402-9.
- Herregods TVK, Pauwels A, Tack J, Smout AJPM, Bredenoord AJ. Reflux-cough syndrome: Assessment of temporal association between reflux episodes and cough bursts. Neurogastroenterol Motil [Internet]. 2017;29(12). Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/nmo.13129
- Wiener GJ, Richter JE, Copper JB, Wu WC, Castell DO. The symptom index: a clinically important parameter of ambulatory 24-hour esophageal pH monitoring. Am J Gastroenterol. 1988;83(4):358-61.
- Singh S, Richter JE, Bradley LA, Haile JM. The symptom index. Differential usefulness in suspected acid-related complaints of heartburn and chest pain. Dig Dis Sci. 1993;38(8):1402-8.
- Ghillebert G, Janssens J, Vantrappen G, Nevens F, Piessens J. Ambulatory 24 hour intraoesophageal pH and pressure recordings v provocation tests in the diagnosis of chest pain of oesophageal origin. Gut. 1990;31(7):738-44.
- Weusten BL, Roelofs JM, Akkermans LM, Van Berge-Henegouwen GP, Smout AJ. The symptom-association probability: an improved method for symptom analysis of 24-hour esophageal pH data. Gastroenterology. 1994;107(6):1741-5.
- Gaddam S, Wani S, Ahmed H, Maddur P, Hall SB, Gupta N, et al. The impact of pre-endoscopy proton pump inhibitor use on the classification of non-erosive reflux disease and erosive oesophagitis. Aliment Pharmacol Ther. 2010;32(10):1266-74.
- Kushnir VM, Sathyamurthy A, Drapekin J, Gaddam S, Sayuk GS, Gyawali CP. Assessment of concordance of symptom reflux association tests in ambulatory pH monitoring. Aliment Pharmacol Ther. 2012;35(9):1080-7.
- Watson RG, Tham TC, Johnston BT, McDougall NI. Double blind cross-over placebo controlled study of omeprazole in the treatment of patients with reflux symptoms and physiological levels of acid reflux–the “sensitive oesophagus” [Internet]. Gut. 1997;40:587-90. Disponible en: http://dx.doi.org/10.1136/gut.40.5.587
- Taghavi SA, Ghasedi M, Saberi-Firoozi M, Alizadeh-Naeeni M, Bagheri-Lankarani K, Kaviani MJ, et al. Symptom association probability and symptom sensitivity index: preferable but still suboptimal predictors of response to high dose omeprazole. Gut. 2005;54(8):1067-71.
- Aanen MC, Weusten BLAM, Numans ME, de Wit NJ, Samsom M, Smout AJPM. Effect of proton-pump inhibitor treatment on symptoms and quality of life in GERD patients depends on the symptom-reflux association. J Clin Gastroenterol. 2008;42(5):441-7.
- Watson RG, Tham TC, Johnston BT, McDougall NI. Double blind cross-over placebo controlled study of omeprazole in the treatment of patients with reflux symptoms and physiological levels of acid reflux–the“ sensitive oesophagus.” Gut. 1997;40(5):587-90.
- Diaz S, Aymerich R, Clouse RE, Freedland KE, Prakash C, Soper NJ. The symptom association probability (SAP) is superior to the symptom index (SI) for attributing symptoms to gastroesophageal reflux: validation using outcome from laparoscopic antireflux surgery (LARS). In: Gastroenterology. WB SAUNDERS CO INDEPENDENCE SQUARE WEST CURTIS CENTER, STE 300, PHILADELPHIA; 2002:A75-A75.
- Choksi Y, Slaughter JC, Sharda R, Higginbotham T, Lal P, Vaezi MF. Symptom association probability does not reliably distinguish functional heartburn from reflux hypersensitivity. Aliment Pharmacol Ther. 2018;47(7):958-65.
- Marabotto E, Furnari M, Giannini EG, Savarino V, Savarino E. Letter: it is time to adopt new objective parameters to accurately identify patients with functional heartburn [Internet]. Alimentary Pharmacology & Therapeutics. 2018;48:107-8. Disponible en: http://dx.doi.org/10.1111/apt.14800
- Spechler SJ, Hunter JG, Jones KM, Lee R, Smith BR, Mashimo H, et al. Randomized Trial of Medical versus Surgical Treatment for Refractory Heartburn [Internet]. New England Journal of Medicine. 2019;381:1513-23. Disponible en: http://dx.doi.org/10.1056/nejmoa1811424
- Hersh MJ, Sayuk GS, Gyawali CP. Long-term therapeutic outcome of patients undergoing ambulatory pH monitoring for chronic unexplained cough. J Clin Gastroenterol. 2010;44(4):254-60.
- Kavitt RT, Higginbotham T, Slaughter JC, Patel D, Yuksel ES, Lominadze Z, et al. Symptom reports are not reliable during ambulatory reflux monitoring. Am J Gastroenterol. 2012;107(12):1826-32.
- Rosen R, Amirault J, Heinz N, Litman H, Khatwa U. The sensitivity of acoustic cough recording relative to intraesophageal pressure recording and patient report during reflux testing. Neurogastroenterol Motil. 2014;26(11):1635-41.
- Xiao Y, Carson D, Boris L, Mabary J, Lin Z, Nicodème F,
et al. The acoustic cough monitoring and manometric profile of cough and throat clearing. Dis Esophagus. 2014;27(1):5-12. - Lechien JR, Akst LM, Hamdan AL, Schindler A, Karkos PD, Barillari MR, et al. Evaluation and Management of Laryngopharyngeal Reflux Disease: State of the Art Review [Internet]. Otolaryngology-Head and Neck Surgery. 2019;160:762-82. Disponible en: http://dx.doi.org/10.1177/0194599819827488
- Koufman JA. The Otolaryngologic Manifestations of Gastroesophageal Reflux Disease (GERD): A Clinical Investigation of 225 Patients Using Ambulatory 24-Hour pH Monitoring and an Experimental Investigation of the Role of Acid and Pepsin in the Development of Laryngeal [Internet]. The Laryngoscope. 1991;101:1-78. Disponible en: http://dx.doi.org/10.1002/lary.1991.101.s53.1
- Groome M, Cotton JP, Borland M, McLeod S, Johnston DA, Dillon JF. Prevalence of Laryngopharyngeal Reflux in a Population with Gastroesophageal Reflux [Internet]. The Laryngoscope. 2007;117:1424-8. Disponible en: http://dx.doi.org/10.1097/mlg.0b013e31806865cf
- Li Y, Xu G, Zhou B, Tang Y, Liu X, Wu Y, et al. Effects of acids, pepsin, bile acids, and trypsin on laryngopharyngeal reflux diseases: physiopathology and therapeutic targets [Internet]. European Archives of Oto-Rhino-Laryngology. 2021. Disponible en: http://dx.doi.org/10.1007/s00405-021-07201-w
- Du X, Wang F, Hu Z, Wu J, Wang Z, Yan C, et al. The diagnostic value of pepsin detection in saliva for gastro-esophageal reflux disease: a preliminary study from China [Internet]. BMC Gastroenterology. 2017;17. Disponible en: http://dx.doi.org/10.1186/s12876-017-0667-9
- Guo Z, Wu Y, Chen J, Zhang S, Zhang C. The Role of Salivary Pepsin in the Diagnosis of Gastroesophageal Reflux Disease (GERD) Evaluated Using High-Resolution Manometry and 24-Hour Multichannel Intraluminal Impedance-pH Monitoring [Internet]. Medical Science Monitor. 2020;16. Disponible en: http://dx.doi.org/10.12659/msm.927381
- Hayat JO, Gabieta-Somnez S, Yazaki E, Kang JY, Woodcock A, Dettmar P, et al. Pepsin in saliva for the diagnosis of gastro-oesophageal reflux disease [Internet]. Gut. 2015;64:373-80. Disponible en: http://dx.doi.org/10.1136/gutjnl-2014-307049
- Kim TH, Lee KJ, Yeo M, Kim DK, Cho SW. Pepsin Detection in the Sputum/Saliva for the Diagnosis of Gastroesophageal Reflux Disease in Patients with Clinically Suspected Atypical Gastroesophageal Reflux Disease Symptoms [Internet]. Digestion. 2008;77:201-6. Disponible en: http://dx.doi.org/10.1159/000143795
- Matsumura T, Arai M, Suzuki T, Hoppo T, Seki Y, Kasamatsu S, et al. Clinical utility of salivary pepsin measurement in patients with proton pump inhibitor-refractory gastroesophageal reflux disease symptoms: a prospective comparative study [Internet]. Esophagus. 2020;17:339-47. Disponible en: http://dx.doi.org/10.1007/s10388-020-00714-z
- Saritas Yuksel E, Hong SKS, Strugala V, Slaughter JC, Goutte M, Garrett CG, et al. Rapid salivary pepsin test: blinded assessment of test performance in gastroesophageal reflux disease. Laryngoscope. 2012;122(6):1312-6.
- Weitzendorfer M, Antoniou SA, Schredl P, Witzel K, Weitzendorfer IC, Majerus A, et al. Pepsin and oropharyngeal pH monitoring to diagnose patients with laryngopharyngeal reflux [Internet]. The Laryngoscope. 2020;130:1780-6. Disponible en: http://dx.doi.org/10.1002/lary.28320
- Dogru M, Kuran G, Haytoglu S, Dengiz R, Arikan OK. Role of Laryngopharyngeal Reflux in the Pathogenesis of Otitis Media with Effusion [Internet]. The Journal of International Advanced Otology. 2015;11:66-71. Disponible en: http://dx.doi.org/10.5152/iao.2015.642
- Iannella G, Di Nardo G, Plateroti R, Rossi P, Plateroti AM, Mariani P, et al. Investigation of pepsin in tears of children with laryngopharyngeal reflux disease [Internet]. International Journal of Pediatric Otorhinolaryngology. 2015;79:2312-5. Disponible en: http://dx.doi.org/10.1016/j.ijporl.2015.10.034
- Sereg-Bahar M, Jerin A, Jansa R, Stabuc B, Hocevar-Boltezar I. Pepsin and bile acids in saliva in patients with laryngopharyngeal reflux – a prospective comparative study [Internet]. Clinical Otolaryngology. 2015;40:234-9. Disponible en: http://dx.doi.org/10.1111/coa.12358
- Samuels TL, Johnston N. Pepsin as a Marker of Extraesophageal Reflux [Internet]. Annals of Otology, Rhinology & Laryngology. 2010;119:203-8. Disponible en: http://dx.doi.org/10.1177/000348941011900310
- Wang J, Zhao Y, Ren J, Xu Y. Pepsin in saliva as a diagnostic biomarker in laryngopharyngeal reflux: a meta-analysis. Eur Arch Otorhinolaryngol. 2018;275(3):671-8.
- Calvo-Henríquez C, Ruano-Ravina A, Vaamonde P, Martínez-Ca
poccioni G, Martín-Martín C. Is Pepsin a Reliable Marker of Laryngopharyngeal Reflux? A Systematic Review [Internet]. Otolaryngology-Head and Neck Surgery. 2017;157:385-91. Disponible en: http://dx.doi.org/10.1177/0194599817709430 - Merati AL, Lim HJ, Ulualp SO, Toohill RJ. Meta-analysis of upper probe measurements in normal subjects and patients with laryngopharyngeal reflux. Ann Otol Rhinol Laryngol. 2005;114(3):177-82.
- Vaezi MF, Schroeder PL, Richter JE. Reproducibility of proximal probe pH parameters in 24-hour ambulatory esophageal pH monitoring. Am J Gastroenterol. 1997;92(5):825-9.
- Wilhelm D, Jell A, Feussner H, Schmid RM, Bajbouj M, Becker V. Pharyngeal pH monitoring in gastrectomy patients – what do we really measure? [Internet]. United European Gastroenterology Journal. 2016;4:541-5. Disponible en: http://dx.doi.org/10.1177/2050640615617637
- Zhong C, Duan L, Wang K, Xu Z, Ge Y, Yang C, et al. Esophageal intraluminal baseline impedance is associated with severity of acid reflux and epithelial structural abnormalities in patients with gastroesophageal reflux disease. J Gastroenterol. 2013;48(5):601-10.
- Kim BS, Park SY, Lee DH, Cho EA, Jun CH, Park CH, et al. Utility of baseline impedance level measurement in patients with gastroesophageal reflux symptoms [Internet]. Scandinavian Journal of Gastroenterology. 2016;51:1-7. Disponible en: http://dx.doi.org/10.3109/00365521.2015.1042031
- Mittal RK, Balaban DH. The Esophagogastric Junction [Internet]. New England Journal of Medicine. 1997;336:
924-32. Disponible en: http://dx.doi.org/10.1056/nejm19970
3273361306 - Kwiatek MA, Pandolfino JE, Kahrilas PJ. 3D-high resolution manometry of the esophagogastric junction [Internet]. Neurogastroenterology & Motility. 2011;23:e461-9. Disponible en: http://dx.doi.org/10.1111/j.1365-2982.2011.01733.x
- Murray JA, Clouse RE, Conklin JL. Components of the standard oesophageal manometry [Internet]. Neurogastroenterology and Motility. 2003;15:591-606. Disponible en: http://dx.doi.org/10.1046/j.1365-2982.2003.00446.x
- Savarino E, Giacchino M, Savarino V. Dysmotility and reflux disease [Internet]. Current Opinion in Otolaryngology & Head and Neck Surgery. 2013:11. Disponible en: http://dx.doi.org/10.1097/moo.0b013e3283658edf
- Fox MR, Bredenoord AJ. Oesophageal high-resolution manometry: moving from research into clinical practice [Internet]. Gut. 2008;57:405-23. Disponible en: http://dx.doi.org/10.1136/gut.2007.127993
- Blonski W, Vela M, Safder A, Hila A, Castell DO. Revised Criterion for Diagnosis of Ineffective Esophageal Motility Is Associated with More Frequent Dysphagia and Greater Bolus Transit Abnormalities [Internet]. The American Journal of Gastroenterology. 2008;103:699-704. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2007.01593.x
- Ho SC, Chang CS, Wu CY, Chen GH. Ineffective esophageal motility is a primary motility disorder in gastroesophageal reflux disease. Dig Dis Sci. 2002;47(3):652-6.
- Shetler KP, Bikhtii S, Triadafilopoulos G. Ineffective esophageal motility: clinical, manometric, and outcome characteristics in patients with and without abnormal esophageal acid exposure [Internet]. Diseases of the Esophagus. 2017;30:1-8. Disponible en: http://dx.doi.org/10.1093/dote/dox012
- Kasamatsu S, Matsumura T, Ohta Y, Hamanaka S, Ishigami H, Taida T, et al. The Effect of Ineffective Esophageal Motility on Gastroesophageal Reflux Disease. Digestion. 2017;95(3):221-8.
- Liu L, Li S, Zhu K, Yu W, Wang H, Guo J, et al. Relationship between esophageal motility and severity of gastroesophageal reflux disease according to the Los Angeles classification. Medicine. 2019;98(19):e15543.
- Kahrilas PJ, Kim HC, Pandolfino JE. Approaches to the diagnosis and grading of hiatal hernia [Internet]. Best Practice & Research Clinical Gastroenterology. 2008;601-16. Disponible en: http://dx.doi.org/10.1016/j.bpg.2007.12.007
- Rengarajan A, Bolkhir A, Gor P, Wang D, Munigala S, Gyawali CP. Esophagogastric junction and esophageal body contraction metrics on high-resolution manometry predict esophageal acid burden. Neurogastroenterol Motil. 2018;30(5):e13267.
- van Hoeij FB, Smout AJ, Bredenoord AJ. Predictive value of routine esophageal high-resolution manometry for gastro-esophageal reflux disease. Neurogastroenterol Motil. 2015;27(7):963-70.
- Wang F, Li P, Ji GZ, Miao L, Fan Z, You S, et al. An analysis of 342 patients with refractory gastroesophageal reflux disease symptoms using questionnaires, high-resolution manometry, and impedance-pH monitoring. Medicine. 2017;96(5):e5906.
- Ribolsi M, Savarino E, Rogers B, Rengarajan A, Della Coletta M, Ghisa M, et al. High-resolution Manometry Determinants of Refractoriness of Reflux Symptoms to Proton Pump Inhibitor Therapy [Internet]. Journal of Neurogastroenterology and Motility. 2020;26:447-54. Disponible en: http://dx.doi.org/10.5056/jnm19153
- Delshad SD, Almario CV, Chey WD, Spiegel BMR. Prevalence of Gastroesophageal Reflux Disease and Proton Pump Inhibitor-Refractory Symptoms [Internet]. Gastroenterology. 2020;158:1250–61.e2. Disponible en: http://dx.doi.org/10.1053/j.gastro.2019.12.014
- Mainie I, Tutuian R, Shay S, Vela M, Zhang X, Sifrim D,
et al. Acid and non-acid reflux in patients with persistent symptoms despite acid suppressive therapy: a multicentre study using combined ambulatory impedance-pH monitoring. Gut. 2006;55(10):1398-402. - Karamanolis G, Kotsalidis G, Triantafyllou K, Polymeros D, Gaglia A, Fessatou S, et al. Yield of combined impedance-pH monitoring for refractory reflux symptoms in clinical practice. J Neurogastroenterol Motil. 2011;17(2):158-63.
- Pritchett JM, Aslam M, Slaughter JC, Ness RM, Garrett CG, Vaezi MF. Efficacy of esophageal impedance/pH monitoring in patients with refractory gastroesophageal reflux disease, on and off therapy. Clin Gastroenterol Hepatol. 2009l;7(7):743-8.
- Abe Y, Koike T, Saito M, Okata T, Nakagawa K, Hatta W, et al. The Ameliorating Effect of Switching to Vonoprazan: A Novel Potassium-Competitive Acid Blocker in Patients with Proton Pump Inhibitor Refractory Non-Erosive Reflux Disease [Internet]. Digestion. 2021;102:480-8. Disponible en: http://dx.doi.org/10.1159/000506152
- Frazzoni M, Conigliaro R, Mirante VG, Melotti G. The added value of quantitative analysis of on-therapy impedance-pH parameters in distinguishing refractory non-erosive reflux disease from functional heartburn [Internet]. Neurogastroenterology & Motility. 2012;24:141-e87. Disponible en: http://dx.doi.org/10.1111/j.1365-2982.2011.01800.x
- Frazzoni M, Piccoli M, Conigliaro R, Manta R, Frazzoni L, Melotti G. Refractory gastroesophageal reflux disease as diagnosed by impedance-pH monitoring can be cured by laparoscopic fundoplication. Surg Endosc. 2013;27(8):2940-6.
- Bredenoord AJ, Weusten BLAM, Timmer R, Conchillo JM, Smout AJPM. Addition of esophageal impedance monitoring to pH monitoring increases the yield of symptom association analysis in patients off PPI therapy. Am J Gastroenterol. 2006;101(3):453-9.
- Nakagawa K, Sawada A, Hoshikawa Y, Nikaki K, Sonmez S, Woodland P, et al. Persistent Postprandial Regurgitation vs. Rumination in Patients with Refractory Gastroesophageal Reflux Disease Symptoms: Identification of a Distinct Rumination Pattern Using Ambulatory Impedance-pH Monitoring [Internet]. American Journal of Gastroenterology. 2019;114:1248-55. Disponible en: http://dx.doi.org/10.14309/ajg.0000000000000295
- Halland M, Pandolfino J, Barba E. Diagnosis and Treatment of Rumination Syndrome [Internet]. Clinical Gastroenterology and Hepatology. 2018;16:1549-55. Disponible en: http://dx.doi.org/10.1016/j.cgh.2018.05.049
- Saleh CMG, Bredenoord AJ. Utilization of Esophageal Function Testing for the Diagnosis of the Rumination Syndrome and Belching Disorders [Internet]. Gastrointestinal Endoscopy Clinics of North America. 2014;24:633-42. Disponible en: http://dx.doi.org/10.1016/j.giec.2014.06.002
- Stanghellini V, Chan FKL, Hasler WL, Malagelada JR, Suzuki H, Tack J, et al. Gastroduodenal Disorders [Internet]. Gastroenterology. 2016;150:1380-92. Disponible en: http://dx.doi.org/10.1053/j.gastro.2016.02.011
- Kessing BF, Bredenoord AJ, Smout AJP. The Pathophysiology, Diagnosis and Treatment of Excessive Belching Symptoms [Internet]. American Journal of Gastroenterology. 2014;109:1196-203. Disponible en: http://dx.doi.org/10.1038/ajg.2014.165
- Hemmink GJM, Bredenoord AJ, Weusten BLA, Timmer R, Smout AJP. Supragastric Belching in Patients with Reflux Symptoms [Internet]. The American Journal of Gastroenterology. 2009;104:1992-7. Disponible en: http://dx.doi.org/10.1038/ajg.2009.203
- Bredenoord AJ. Management of Belching, Hiccups, and Aerophagia [Internet]. Clinical Gastroenterology and Hepatology. 2013;11:6-12. Disponible en: http://dx.doi.org/10.1016/j.cgh.2012.09.006
- Yadlapati R, Tye M, Roman S, Kahrilas PJ, Ritter K, Pandolfino JE. Postprandial High-Resolution Impedance Manometry Identifies Mechanisms of Nonresponse to Proton Pump Inhibitors [Internet]. Clinical Gastroenterology and Hepatology. 2018;16:211-8.e1. Disponible en: http://dx.doi.org/10.1016/j.cgh.2017.09.011
- Glasinovic E, Wynter E, Arguero J, Ooi J, Nakagawa K, Yazaki E, et al. Treatment of supragastric belching with cognitive behavioral therapy improves quality of life and reduces acid gastroesophageal reflux [Internet]. American Journal of Gastroenterology. 2018;113:539-47. Disponible en: http://dx.doi.org/10.1038/ajg.2018.15
- Sawada A, Fujiwara Y, Sifrim D. Belching in Gastroesophageal Reflux Disease: Literature Review [Internet]. Journal of Clinical Medicine. 2020;9:3360. Disponible en: http://dx.doi.org/10.3390/jcm9103360
- Narayani RI, Burton MP, Young GS. Utility of esophageal biopsy in the diagnosis of nonerosive reflux disease. Dis Esophagus. 2003;16(3):187-92.
- Schindlbeck NE, Wiebecke B, Klauser AG, Voderholzer WA, Müller-Lissner SA. Diagnostic value of histology in non-erosive gastro-oesophageal reflux disease. Gut. 1996;39(2):151-4.
- Gillies RS, Stratford JM, Booth MI, Dehn TCB. Oesophageal pH monitoring using the Bravo catheter-free radio capsule [Internet]. European Journal of Gastroenterology & Hepatology. 2007;19:57-63. Disponible en: http://dx.doi.org/10.1097/meg.0b013e3280116eec
- Frazzoni M, Savarino E, de Bortoli N, Martinucci I, Furnari M, Frazzoni L, et al. Analyses of the Post-reflux Swallow-induced Peristaltic Wave Index and Nocturnal Baseline Impedance Parameters Increase the Diagnostic Yield of Impedance-pH Monitoring of Patients With Reflux Disease. Clin Gastroenterol Hepatol. 2016;14(1):40-6.
- Fuchs HF, Müller DT, Berlth F, Maus MK, Fuchs C, Dübbers M, et al. Simultaneous laryngopharyngeal pH monitoring (Restech) and conventional esophageal pH monitoring-correlation using a large patient cohort of more than 100 patients with suspected gastroesophageal reflux disease. Dis Esophagus [Internet]. 20181;31(10). Disponible en: http://dx.doi.org/10.1093/dote/doy018
- Vailati C, Mazzoleni G, Bondi S, Bussi M, Testoni PA, Passaretti S. Oropharyngeal pH monitoring for laryngopharyngeal reflux: is it a reliable test before therapy? J Voice. 2013;27(1):84-9.
- Dolina J, Konečný Š, Ďurč P, Lačná J, Greguš M, Foret F,
et al. Evaluation of Important Analytical Parameters of the Peptest Immunoassay that Limit its Use in Diagnosing Gastroesophageal Reflux Disease [Internet]. Journal of Clinical Gastroenterology. 2019;53:355-60. Disponible en: http://dx.doi.org/10.1097/mcg.0000000000001066 - Yadlapati R, Kaizer A, Greytak M, Ezekewe E, Simon V, Wani S. Diagnostic performance of salivary pepsin for gastroesophageal reflux disease. Dis Esophagus [Internet]. 2021;34(4). Disponible en: http://dx.doi.org/10.1093/dote/doaa117
- Zeleník K, Hránková V, Vrtková A, Staníková L, Komínek P, Formánek M. Diagnostic Value of the PeptestTM in Detecting Laryngopharyngeal Reflux. J Clin Med Res [Internet]. 2021;10(13). Disponible en: http://dx.doi.org/10.3390/jcm10132996
Correspondencia: Maria Marta Piskorz
Correo electrónico: neurogastrohc@gmail.com
Acta Gastroenterol Latinoam 2022;52(2):175-240
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE






