Oscar Laudanno ID· Betiana Pucci ID · Santiago Brayer ID
Instituto de Investigaciones Médicas Alfredo Lanari Universidad de Buenos Aires.
Acta Gastroenterol Latinoam 2022;52(1):21-35
Recibido: 14/01/2022 / Aceptado: 16/03/2022 / Publicado en www.actagastro.org el 30/03/2022 / https://doi.org/10.52787/agl.v52i1.157
Resumen
El cáncer colorrectal es uno de los principales tumores que afecta a la población mundial. Suele tener una lesión precursora, que son los pólipos colónicos (adenomas y serratos). Su prevención se basa en el tamizaje de la población de riesgo promedio (edad 50-75 años, asintomática y sin antecedentes) y en la identificación de grupos de riesgo. La polipectomía endoscópica es efectiva para reducir la incidencia de cáncer colorrectal y su mortalidad. La tasa de detección de adenomas es un claro marcador de calidad de la colonoscopía y se correlaciona con la incidencia del cáncer de colon de intervalo y la mortalidad por cáncer colorrectal. En los últimos años, se han producido cambios importantes para mejorar la detección de pólipos colónicos, así como actualizaciones de las guías de vigilancia pospolipectomía a partir de nuevos estudios de cohorte. La calidad y los hallazgos de la colonoscopía basal constituyen aspectos claves para la vigilancia. Por otro lado, nuevas guías de los Estados Unidos recomiendan el inicio del cribado a los 45 años a partir de datos de cambios epidemiológicos de las últimas décadas, aunque esta recomendación no es seguida por otros países. El objetivo de este manuscrito es realizar una revisión no sistemática sobre cómo mejorar la detección de pólipos colónicos, la edad de inicio y la finalización del cribado y analizar las nuevas guías de vigilancia pospolipectomía. Además, se contextualizan estas recomendaciones para la Argentina, y se mencionan los ensayos clínicos en curso que pueden mejorar la calidad de la evidencia científica actual.
Palabras claves. Pólipos de colon, vigilancia pospolipectomía, tasa de detección de adenomas, cáncer de colon en jóvenes, cáncer colorrectal en la Argentina.
Updated Detection and Post-Polypectomy Surveillance Recommendations
Summary
Colorectal cancer is a major cause of morbidity and mortality worldwide. Their prevention is based on screening the average risk population (age 50-75, asymptomatic without personal and family history) and the identification of high-risk groups. The vast majority arise from premalignant polyps (adenomas, serrated lesions). Endoscopic polypectomy is effective in reducing colorectal cancer incidence and mortality. The adenoma detection rate is the most important quality measure in colonoscopy and is inversely correlated with the risk of interval cancer and mortality. Over the last years, several new technical-quality recommendations and new devices became available to improve polyp’s detection and new post-polypectomy surveillance guidelines have been published. The quality and findings of the baseline colonoscopy will determine surveillance intervals. On the other hand, the newest guidelines from the United States recommend colorectal cancer screenings begin at the age of 45 based on new epidemiological data. However, not all countries followed this recommendation. The purpose of this review is to analyze techniques and devices to improve the adenoma detection rate, new post-polypectomy surveillance guidelines, and the age to start and stop colorectal cancer screening. Contextualize data in Argentina and discuss the relevant ongoing research.
Keywords. Colorectal polyps, surveillance post-polypectomy, adenoma detection, rate-colon cancer young, adults-colorectal cancer in Argentina.
Abreviaturas
CCR: Cáncer colorrectal.
FIT: Test inmunofecal.
ADR: Tasa de detección de adenomas.
AGA: Asociación Americana de Gastroenterología.
RR: Riesgo relativo.
IC: Intervalo de confianza.
NNT: Número de pacientes a tratar.
MAC: Número medio de adenomas por colonoscopía.
NBI: Narrow band imaging.
BLI: Blue laser imaging.
LCI: Linked-color imaging.
FDA: Food and Drug Administration.
CADe: Sistemas de detección asistidos por computadoras.
CADx: Computer-aided diagnosis system.
ACG: Colegio Americano de Gastroenterología.
ASGE: Sociedad Americana de Endoscopía Digestiva.
USPSTF: US Preventive Services Task Force.
JMAF: Jarabe de maíz de alta fructosa.
ESGE: Sociedad Europea de Endoscopía Digestiva.
DBG: Displasia de bajo grado.
DAG: Displasia de alto grado.
ABR: Adenoma de bajo riesgo.
SIR: Razón de incidencia estandarizada.
AA: Adenoma avanzado.
IC: Intervalo de confianza.
RME: Razón de mortalidad estandarizada.
RTM: Razón de tasa de mortalidad.
NSH 1 Y 2: Nurses’ Healt Study.
HPFS: Health Professionals Follow-up Study.
PS: Pólipo serrato.
ESMO: European Society for Medical Oncology.
NCCN: National Comprehensive Cancer Network.
PAF: Poliposis adnomatosa familiar.
MAP: Poliposis asociada al MUTYH.
PPAP: Poliposis asociada al análisis pomerasa.
OR: Odds ratio.
INC: Instituto Nacional del Cáncer.
AMBA: Área Metropolitana de Buenos Aires.
PAMI: Programa de Atención Médica Integral.
SAGE: Sociedad de Gastroenterología Argentina.
ENDIBA: Endoscopistas Digestivos de Buenos Aires.
EPoS: European Polyp Surveillance.
Introducción
El cáncer colorrectal (CCR) es una de las neoplasias malignas más comunes tanto en hombres como mujeres y constituye la tercera causa de muerte a nivel global dentro de los tumores malignos, en ambos sexos. Según los datos de GLOBOCAN 2020, CCR representa el 10% de todos los cánceres a nivel mundial y del 9,4% de todas las muertes por cáncer. Su prevalencia se ha incrementado de forma alarmante1,2 y se correlaciona con el desarrollo económico de los países, siendo mayor en aquellos con alto índice de desarrollo humano (Human Development Index, en inglés).3 Aproximadamente el 70% de los CCR se desarrollan a partir de pólipos adenomatosos y un 25-30%, a partir de pólipos serratos sésiles.4 Los datos que surgieron a partir del National Polyp Study establecieron que la polipectomía endoscópica es efectiva en reducir la incidencia y la mortalidad por CCR.5 La prevalencia de adenomas y pólipos serratos es alta en la población general (alrededor del 25-50% de las personas con edad de cribado) en comparación con el riesgo de CCR en esta misma población que es de alrededor del 5% a lo largo de la vida. Es evidente que solo un bajo porcentaje de estos progresan a CCR.6, 7
Distintas guías internacionales y nacionales recomiendan su tamizaje con el objetivo de disminuir la morbimortalidad. Las principales estrategias de tamizaje recomendadas son a través de herramientas no invasivas, como es la sangre oculta en materia fecal, mediante un método moderno como el test inmunofecal (FIT, por sus siglas en inglés) o a través de exámenes más invasivos como la colonoscopía, que ofrece la ventaja de realizar polipectomía de ser necesario. En los Estados Unidos, la modalidad predominante de cribado es la colonoscopía en forma oportunística, mientras que, en Europa y el Reino Unido, la modalidad que predomina es el FIT con programas de cribado organizados a través de los estados.8-11
El objetivo de esta revisión es discutir los cambios producidos en los últimos años en la mejora de la detección de pólipos colónicos, además de actualizar las guías de vigilancia pospolipectomía, dado que tanto las guías europeas, como las de los Estados Unidos y del Reino Unido fueron actualizadas en el 2020.
Cómo mejorar la detección de pólipos colónicos
Es indudable que la tasa de detección de adenomas (ADR, por sus siglas en inglés) es uno de los mejores indicadores de calidad en colonoscopía, y un ADR alto se correlaciona con una reducción significativa del cáncer colorrectal de intervalo y la mortalidad por CCR.12, 13 Es por ello que el ADR es clave a la hora de recomendar los intervalos de vigilancia pospolipectomía.14 Por otro lado, debemos tener presente que la colonoscopía es un método imperfecto de cribado. Un metaanálisis de colonoscopías en tándem (dos estudios realizados el mismo día al mismo paciente con el mismo operador) muestra una pérdida de detección de adenomas del 26%, 9% para adenomas avanzados y 27% para pólipos serratos.15
Cada endoscopista, individualmente y en su grupo de trabajo, debe conocer su ADR para poder implementar estrategias de mejora, de ser necesarias. Estudios como el de Kaminski y col.13 han demostrado un alto riesgo de cáncer de intervalo cuando el ADR es menor a 20%. Esto plantea la necesidad de mejorar la expertise para la detección de adenomas. Pero ¿los endoscopistas llevan un registro de su ADR? Carecemos de datos en la Argentina, pero los que provienen de Europa plantean que son minoritarios los endoscopistas que rutinariamente miden su ADR.16 Por lo que el primer paso es conocer nuestro ADR e implementar distintas estrategias y, en caso de ser necesario, mejorarlo. El estándar mínimo tanto en los Estados Unidos como Europa es del 25%,17, 18 pero no se conoce aún cual es el ADR que debería ser el estándar, aunque estudios como el de Kaminski y col.13 muestran que elevar el ADR, por encima del 34%, se asocia a una mayor reducción del cáncer de intervalo.
Hay distintas recomendaciones a la hora de mejorar nuestro ADR y el objetivo de esta revisión es plantear aquellas que son, a criterio de los autores, las más relevantes o, al menos, hacia dónde se dirige el avance en el campo de la detección.
1. Entrenamiento
Este entrenamiento no solo debe ser de una llegada correcta a ciego, sino que debe conocerse la clasificación de París para poder diferenciar los distintos tipos de lesiones. Muchas de estas lesiones pueden tener una morfología muy sutil para ser detectadas, como sucede con los pólipos serratos y las lesiones planas o deprimidas en el colon proximal. Es clave la educación para el reconocimiento de las lesiones y cabe destacar distintos programas educacionales como el EQUIP en los Estados Unidos19 o el de Kaminski y col.20 en Polonia que, utilizando herramientas simples de entrenamiento, han logrado mejorar el ADR de los participantes.
Estos datos ponen en el centro de la discusión el entrenamiento y el reentrenamiento para mantener un ADR adecuado, así como la necesidad de programas de aseguramiento de calidad tanto para los endoscopistas como para los pacientes.
2. Limpieza colónica adecuada
Es indudable que una preparación colónica de buena calidad impacta en el ADR. Estudios como el de Chokshi y col.21 muestran que, al repetir una colonoscopía por preparación subóptima, más del 30% de los pacientes tenían adenomas y un 18% eran avanzados. En nuestro medio, la escala de Boston es la más usada para evaluar el nivel de preparación del colon. Esta se mide durante la retirada del equipo, luego de lavar y aspirar los restos, y tiene una buena replicación inter e intraobservador.22 Si la preparación no fue adecuada, se recomienda repetir la colonoscopía al año. Si la institución tiene una tasa de preparación inadecuada elevada, es decir, > 15%, deben revisarse los protocolos de preparación y educación del paciente. La preparación colónica en dosis divididas (split dose, en inglés) debe ser el estándar. La primera parte de esta se toma el día previo y la segunda parte, 4-5 horas antes del horario programado para la colonoscopía o en el mismo día, finalizando dos horas antes del horario del turno. De acuerdo con las normas de la Asociacion Americana de Anestesiología, dos horas de ayuno luego de la ingesta de líquidos claros es suficiente.23 Esto no solo mejora la escala de limpieza colónica, sino que es mejor tolerada y más segura para el paciente, ya que permite una adecuada hidratación. En un estudio randomizado-controlado, Radaelli y col. demostraron que la preparación colónica en dosis divididas mejora significativamente el ADR (53% vs. 40,9%, RR 1.22, IC 95%: 1.03 – 1.46, p < 05).24
3. Técnica
Una vez llegado al ciego, la retirada del equipo debe ser minuciosa y con un tiempo no menor a seis minutos en procedimientos donde la indicación fue de vigilancia o tamizaje, sin contar el tiempo que se destine a biopsias o polipectomías. Estudios recientes como el de Zhao y col.,25 randomizados-controlados, muestran que un tiempo de retirada de nueve minutos es superior a seis minutos, ya que prolongar el tiempo de retirada incrementó el ADR en colon proximal (21,4% vs. 11,9%, p < 0,001), mejoró el ADR de los endoscopistas menos experimentados (36,8% vs. 23,5%, p < 0,001) y la tasa de detección de pólipos (58% vs. 47,8%, p < 0,001).25
Todos estos datos refuerzan la necesidad de una técnica cuidadosa de colonoscopía, con visualización proximal de los pliegues, lavado para eliminar detritus y una insuflación adecuada. Por todo esto, es natural que la duración del tiempo de retirada sea mayor a nueve minutos.
4. Doble inspección del colon derecho
En el colon derecho, se encuentran habitualmente las lesiones más dificultosas de reconocer, ya sea porque son serratas o porque son planas. En distintos estudios,26, 27 se ha mostrado que examinar dos veces el colon derecho (una de ellas puede ser en retroflexión) mejora el ADR. La evidencia actual señala que la protección contra el cáncer de intervalo es mucho más complicada en el colon derecho que en el izquierdo, y por ello surge esta recomendación.
5. Rotación del paciente durante el retiro del endoscopio
Con el cambio de posición del paciente se logra una mejor distensión del colon. De esta forma, el decúbito lateral izquierdo distiende el colon derecho, la posición supina distiende el transverso y el decúbito lateral derecho, el colon izquierdo. Los estudios realizados principalmente en el Reino Unido, donde la sedación anestésica es más superficial, muestran que esta maniobra mejora el ADR. En nuestro medio, donde la colonoscopía suele realizarse con sedación profunda, esta maniobra plantea cierta dificultad para su implementación.28
6. La enfermedad diverticular como factor de riesgo de adenomas
La diverticulosis colónica presenta factores de riesgo similares al cáncer de colon (dieta baja en fibra, rica en grasas, obesidad, etc.). En un estudio reciente de Laudanno y col.29 que evaluó a 779 pacientes con FIT positivo como parte de un programa de tamizaje, se demostró que los pacientes con divertículos tuvieron una mayor prevalencia de adenomas y adenomas avanzados en la colonoscopía. El ADR fue del 41,6% vs. 33,6%, p < 0,01, OR 2,29 (IC 95%: 1,66-3,13), y de 19,8% adenomas avanzados vs. 6,7%, p < 0,01, OR 3,40; IC 95%: 2,11-5,55. Esta asociación debe alertar a los endoscopistas, sobre todo en el contexto de programas de tamizaje con FIT.
7. Equipos de alta definición
La utilización de estos equipos es un aspecto relevante, debido a los costos que tienen. En distintos estudios se han comparado la tasa de detección de adenomas, así como de lesiones serratas, utilizando equipos de visión tradicional con luz blanca versus equipos de alta definición con luz blanca. En un reciente metaanálisis,30 en el que solo se incluyeron estudios randomizados-controlados, se ha mostrado que los equipos de alta resolución mejoran el ADR en comparación con los equipos tradicionales (40% vs. 35%; RR 1,13; 95% IC 1,05-1,22; p = 0,001), y esta mejora también se extiende a la mayor detección de adenomas avanzados y lesiones serratas. Debemos destacar que esta diferencia es pequeña, mostrando un número de pacientes a tratar (NNT, por sus siglas en inglés) de 23 sin encontrar diferencias en el número de adenomas por colonoscopía (MAC, por sus siglas en inglés). El MAC constituye otro indicador importante de calidad en endoscopía. Esta mejora en el ADR es particularmente importante en aquellos endoscopistas con un ADR alto, > 35%, con colonoscopía tradicional, lo que se debe a que les permite detectar lesiones más pequeñas.
8. Colonoscopía por inmersión en agua
Tanto la modalidad del recambio del contenido colónico por agua clara (water exchange) como la colonoscopía bajo agua (water immersion) muestran datos que mejoran el ADR, en particular en colon derecho.31
9. Accesorios para mejorar la exposición de la mucosa colónica
Dentro de este grupo, debemos considerar los Endocuff®, EndoRings® y Caps® transparentes que, con su diseño particular, permiten aplanar los pliegues y exponer mejor la mucosa a evaluar. Estos accesorios han mostrado mejorar el ADR en aquellos endoscopistas con baja detección de adenomas, pero no tanto en el grupo con mayor tasa de detección. De esta forma, metaanálisis de estudios randomizados-controlados como el de Williet y col.32 han mostrado que el Endocuff® es útil en aquellos endoscopistas con un ADR bajo o moderado (< 35%), mientras que estudios como el de Rex y col.33 muestran que son útiles aun en endoscopistas con alto ADR (> 45%). Es de destacar que el uso de Endocuff® no reduce la maniobrabilidad del colonoscopio durante la inserción y disminuye el tiempo del examen, sin reducir la tasa de detección de adenomas. Otro aspecto que debemos mencionar es su utilidad en el entrenamiento endoscópico.
10. Endoscopios de imagen avanzada
Los nuevos endoscopios que utilizan NBI (narrow band imaging), BLI (blue laser imaging), LCI (linked-color imaging) tienen mayor aplicabilidad para mejorar la caracterización de pólipos y lesiones planas, así como de determinar su grado de invasividad en lesiones avanzadas.34
11. Inteligencia artificial
Esta área ha crecido en forma significativa en los últimos años con los primeros prototipos ya disponibles. Estos sistemas informáticos emulan la mente humana, con la ventaja de poder manejar el big data, datos que al cerebro humano le tomaría años clasificar. Se está aplicando en el área de imágenes (radiología, mamografía, tomografía axial computada, resonancia magnética) y actualmente en la endoscopía, particularmente en colon, donde prometen mejorar la tasa de detección de adenomas y caracterizar mejor las lesiones. Permiten mantener la atención constante en el procedimiento endoscópico, así como mejorar la semiología endoscópica de todo hallazgo en tiempo real, y podrían ser de gran valor para el trabajo del endoscopista. En el 2021, la FDA (Food and Drug Administration) aprobó el sistema GI Genius (Medtronic) para su uso en la práctica clínica. Estudios randomizados, como el de Repici y col.,35 han comparado el ADR utilizando equipos de alta resolución con CADe (computer-aided detection systems) vs. control (sin CADe). El ADR fue significativamente mayor con CADe (54,8%) vs. sin CADe (40,4%), con un RR de 1,30; IC 95%: 1,14-1,45, p < 0,001. También mejoró en forma significativa el número de adenomas por colonoscopía (1,07 ± 1,54 vs. 0,71 ± 1,20 razón tasa incidencia, 1,46; IC 95%: 1,15-1,86). Datos similares fueron encontrados por Wang y col.36 en un estudio prospectivo, de colonoscopía en tándem, que muestra una disminución de pólipos no detectados con el sistema CADe del 13,89% (IC 95%: 8,24-19,54%) comparado con estudios de colonoscopía con alta definición y monitores de alta definición sin CADe (40%, IC 95%: 31,23-48,77%, p < 0,0001). Si bien es necesaria una mayor cantidad de estudios de validación, y en particular de impacto clínico, es muy probable que la aplicación de estos sistemas mejore nuestro ADR. Sin embargo, hay aspectos que necesitan mayor clarificación. Los equipos de inteligencia artificial no han demostrado mejorar la detección de adenomas grandes ni de CCR. Si bien pueden detectar una mayor cantidad de pólipos, quizá nos lleva a detectar pólipos con escaso o nulo potencial maligno. Actualmente, se encuentran en desarrollo equipos que permiten una mejor clasificación de las lesiones (computer-aided diagnosis system o CADx) y que van a permitir clasificar mejor aquellos pólipos pequeños que requieran o no ser extraídos. Desde el punto de vista regulatorio, la FDA clasifica a estos equipos como de clase II, de bajo a mediano riesgo basado principalmente en el concepto de detección, pero es indudable que estos equipos producen impacto en el corto y largo plazo. Debemos contar con más datos de riesgo-beneficio, dado que pueden producir un profundo impacto en millones de individuos que forman parte de los programas de cribado. Estas tecnologías tienen, además, falsos positivos en las imágenes (relacionados a burbujas, pliegues, restos fecales), que si son demasiados pueden generar burnout en los endoscopistas que las utilizan.
Hechas todas estas consideraciones, no podemos dejar de reforzar la idea de que comenzar a medir nuestro ADR es el punto de inicio y que, si consideramos que es necesario mejorarlo, deberíamos implementar algunas de las estrategias revisadas.37
Edad de inicio
Es imposible hacer una revisión del tema sin hacer algunos comentarios respecto de la edad de inicio del tamizaje del CCR en población de riesgo promedio (asintomática y sin factores de riesgo personales ni familiares) y los cambios producidos en los últimos años.
En 2018, la American Cancer Society38 recomendó iniciar el cribado a partir de los 45 años. Esta recomendación fue seguida, recientemente, tanto por el American College of Gastroenterology,9 la USMSTF (U.S. Multi-Society Task Force, AGA, ACG, ASGE),39 y la USPSTF (US Preventive Services Task Force),40 sobre la base de los datos de Siegel y col.41 que muestran un aumento de la incidencia del CCR en menores de 50 años, 1,1% de incremento por año desde el 2006 al 2015. Este incremento es tanto para colon (0,7% por año) como para recto (1,7% por año). Estudios posteriores de modelización matemática, en los que se incorporan datos tales como años de vida ganados, incidencia y mortalidad del CCR, número de estudios de cribado necesarios y eventos adversos, muestran que es costo-efectivo iniciar el cribado a esta edad. Esta recomendación del American College of Gastroenterology es condicional con bajo nivel de evidencia. Una recomendación similar es la realizada por la US Preventive Services Task Force (USPSTF) GRADE B (moderado beneficio neto), manteniendo una recomendación GRADE A (beneficio neto sustancial) de iniciarla a partir de los 50 años. La USMSTF le asigna una recomendación débil con una baja calidad de evidencia.
Los estudios realizados en pacientes con CCR menores de 50 años muestran algunas particularidades. Son predominantemente de colon izquierdo o de recto y con una histopatología más agresiva, de tipo mucinoso o en anillo de sello. El antecedente familiar de CCR es poco frecuente: cerca del 80% de los pacientes no tienen antecedentes familiares. Por otro lado, los datos epidemiológicos que muestran un aumento del CCR en menores de 50 años son desiguales a nivel mundial. Siegel y col.42 realizaron un estudio sobre datos mundiales de CCR en menores de 50 años y encontraron que estos son heterogéneos. Países como los Estados Unidos, Canadá y Australia, entre otros, muestran un aumento de la incidencia en jóvenes, pero, en otros países, o no hay cambios o bien reflejan un descenso (como Italia, Austria, etc.). Este incremento en aquellos países se vincula parcialmente a lo que se denomina “efecto de la cohorte de nacimiento”. Se estima que las personas nacidas alrededor de 1990 duplican y cuadriplican el riesgo de cáncer de colon y de recto, respectivamente, y que el punto de inflexión se inició hacia 1960. Las razones para explicarlo son complejas y multifactoriales, pero se piensa que la epidemia de obesidad, las comidas rápidas, la ingesta de azúcares procesados, en particular JMAF (Jarabe de maíz de alta fructosa), y los cambios en la microbiota constituyen importantes factores de riesgo. Desde lo epidemiológico, nos encontramos en una etapa de transición de los tipos de cáncer. Hay un descenso progresivo de los tumores asociados al tabaco y a las infecciones y un incremento de los tumores asociados al desarrollo económico y la obesidad, no solo del CCR, sino también de los cánceres de páncreas, vesícula, riñón, cuerpo de útero y mieloma.38, 43, 44 No disponemos de datos de la Argentina al respecto.
Las recomendaciones de comenzar el tamizaje en menores de 50 años no son seguidas por la Canadian Task Force, el European Council ni el American College of Physicians, quienes mantienen la edad de inicio a los 50 años.45, 10, 46
En el Reino Unido, la edad de cribado fue hasta hace muy poco a partir de los 60 años, y desde abril 2021 se decidió comenzar el tamizaje, en forma progresiva, a partir de los 50 años. Este cambio es parte de su plan de trabajo, a largo plazo, en función de poder incrementar la capacidad de realizar colonoscopías ante un FIT positivo. Su cribado es a través de FIT, cada dos años.11
Adultos mayores
Es indudable que el aumento de la expectativa de vida ha acrecentado la población adulta mayor, con un importante impacto en la salud pública. En esta población, debemos tener presente no solo la expectativa de vida, sino también que las complicaciones de los procedimientos como la colonoscopía se incrementan.38 En un metaanálisis sobre eventos adversos de la colonoscopía en adultos mayores realizado por Day y col.,47 se encontró un aumento significativo de estos. Los octogenarios tuvieron un 60% más de riesgo de perforación colónica que la población más joven. Estos datos no hacen más que alertar respecto de que la edad y las comorbilidades de los pacientes son factores de riesgo independientes de las complicaciones poscolonoscopía.
La guía más reciente de la USPSTF recomienda una estrategia individualizada entre los 76-85 años basada en el estado de salud de la persona y la historia de tamizaje, así como las preferencias del paciente. Recomendación C (bajo beneficio neto).38 Un paciente en este grupo etario, con buen estado de salud y que nunca realizó un examen de tamizaje sería el ejemplo de paciente con mayor beneficio.
Vigilancia pospolipectomía
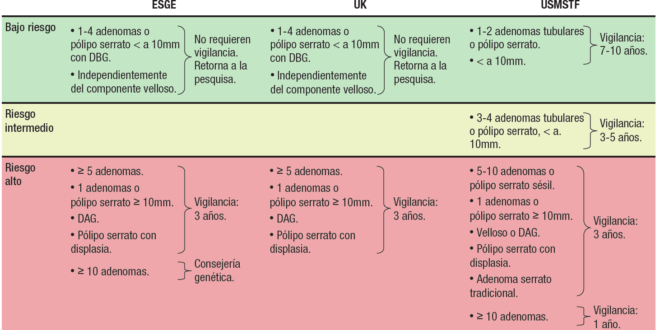
Las guías de práctica clínica recomiendan la colonoscopía periódica de vigilancia luego de la extracción de un adenoma de colon, con el objetivo de reducir la incidencia y mortalidad del CCR. El riesgo de desarrollar adenomas avanzados y CCR metacrónico está en relación con los hallazgos en la colonoscopía basal (tamaño de los pólipos, número, histología). En el año 2020, se actualizaron las guías de vigilancia pospolipectomía de los Estados Unidos,48 Europa49 y el Reino Unido50 (Tabla 1).
Tabla 1. Guías actualizadas de vigilancia pospolipectomía. ESGE, UK y USMSTF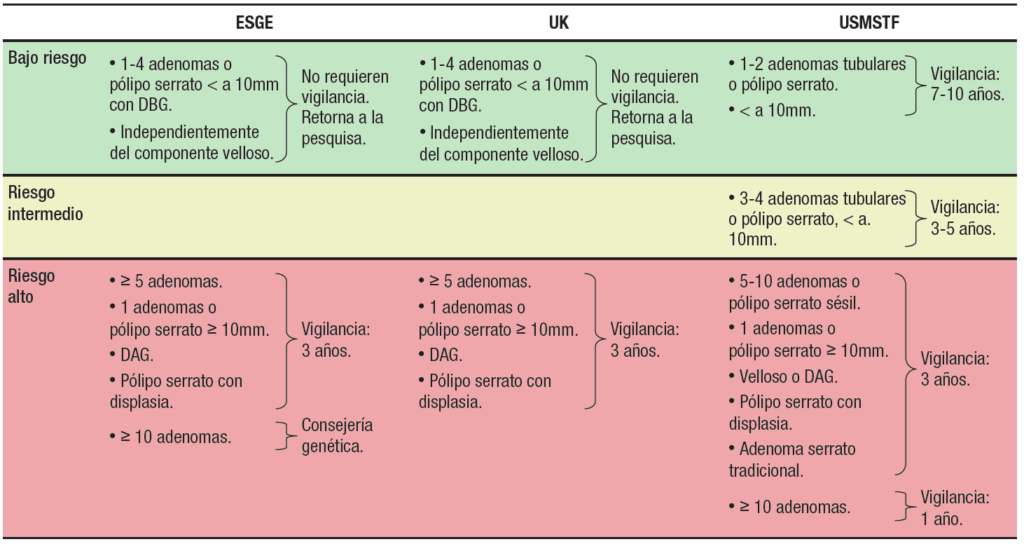 DBG: displasia de bajo grado; DAG: Displasia de alto grado.
DBG: displasia de bajo grado; DAG: Displasia de alto grado.
Revisar las nuevas guías implica necesariamente hablar de calidad. Es de vital importancia entender que los cambios en las recomendaciones actuales se basan en la implementación de colonoscopías de alta calidad y en las que la colonoscopía basal es la clave para esta vigilancia. Esta colonoscopía de calidad debe ser realizada por operadores con un ADR satisfactorio (> 30% hombres y > 20% mujeres), con un 95% de llegada a ciego (si excluimos los exámenes con preparación inadecuada), preparación adecuada para detectar lesiones > 5 mm (escala de Boston ≥ 6 con un score en cada segmento ≥ 2) y en la que todos los pólipos detectados sean extraídos en forma adecuada. Dada la importancia que tiene el tamaño del pólipo en los intervalos de vigilancia, se recomienda, además, que este sea documentado con una foto que lo muestre junto a una pinza de biopsia abierta o un ansa, en especial cuando son mayores de 10 mm debido a que implican un alto riesgo. En contraposición, las guías británicas recomiendan estimar el tamaño de los pólipos en la medición histopatológica debido a que tendría menor variación. Cuando la extracción fue en fragmentos (piecemeal), debe utilizarse la foto-documentación.
Los principales cambios en las guías de los Estados Unidos, Europa y el Reino Unido se orientan a recomendar intervalos de vigilancia más largos en aquellos pacientes a los cuales se les extrajo pólipos adenomatosos de bajo riesgo y mantener intervalos más cortos para aquellos con adenomas de alto riesgo.
El gran cambio es la recomendación de intervalos de vigilancia de 7-10 años o volver al tamizaje a 10 años para aquellos pacientes con adenomas de bajo riesgo, ya que esto representa la mayor proporción de los pacientes en vigilancia. Esto se basa en datos de estudios que muestran un riesgo de CCR equivalente con los pacientes que tienen una colonoscopía normal (Tabla 2).
Tabla 2. Incidencia y mortalidad de CCR en grupos de bajo y alto riesgo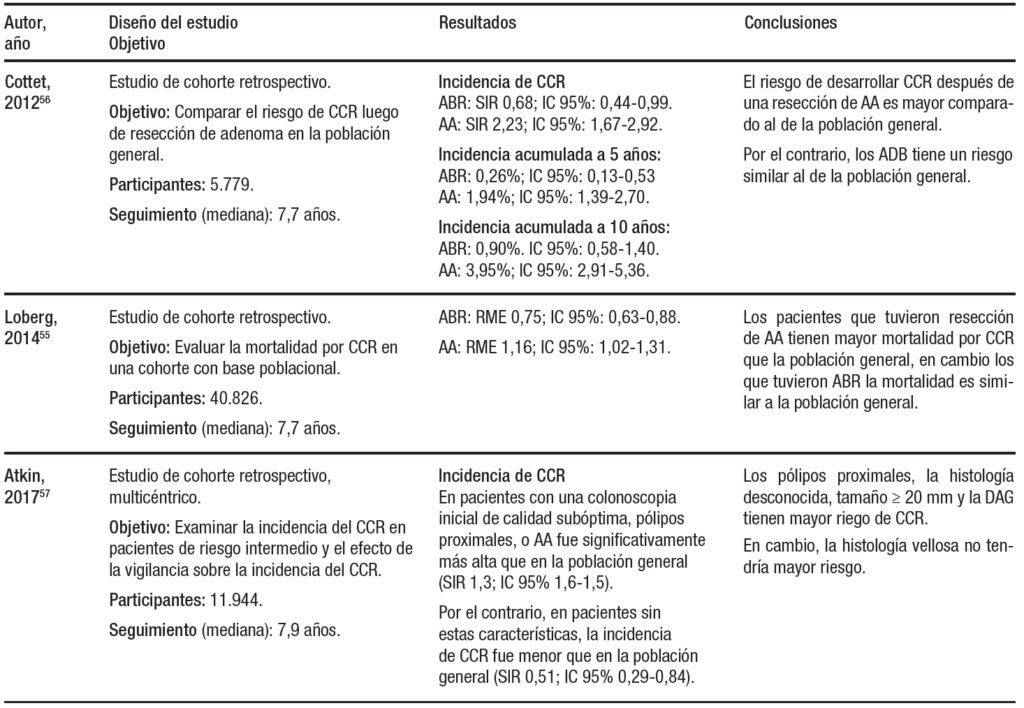
ABR: Adenoma de bajo riesgo. AA: adenoma avanzado. DAG: Displasia de alto grado. SIR: Razón de incidencia estandarizada. RME: razón de mortalidad estandarizada. RTM: Razón de tasa de mortalidad. HR: Hazard ratio. PS: Pólipo serrato. NSH 1 y 2: Nurses’ Health Study. HPFS: Health Professionals Follow-up Study. a-HR: hazard ratio ajustado.
Lamentablemente, debemos mencionar que distintos estudios muestran una baja adherencia a las guías de seguimiento pospolipectomía. Un metaanálisis reciente51 mostró que más del 50% de los pacientes tenían colonoscopías de seguimiento inadecuadas (intervalo muy corto o largo). En este metaanálisis, debemos destacar el estudio de Esteban y col. realizado en la Argentina, en el cual a uno de cada tres pacientes se les realizó una colonoscopía inadecuada de vigilancia, particularmente para pólipos hiperplásicos.52 Evidentemente, esto produce una utilización inadecuada de los recursos.
Pacientes de bajo riesgo
La guía de los Estados Unidos de la USMSTF incluye en este grupo a los pacientes que tienen en la colonoscopía basal 1 o 2 adenomas tubulares < de 10 mm. Se recomienda un intervalo de vigilancia de 7 a 10 años, y no de 10 años, debido a que aún no está claro si el riesgo de CCR puede disminuirse aún más, así como la posibilidad de que este riesgo disminuido observado, en algunos estudios, se deba a que a los pacientes se les realizó colonoscopía de vigilancia previa, lo que afecta los resultados posteriores. Recomendación fuerte. Calidad de la evidencia moderada.
Dos metaanálisis importantes modificaron las recomendaciones en este grupo de pacientes. En el primero53 se incluyeron siete estudios con 11.387 pacientes y mostró una tasa de neoplasia avanzada (adenomas ≥ 10 mm, componente velloso, displasia de alto grado o CCR) del 3,6% en individuos con adenomas de bajo riesgo basales en comparación con el 1,6% de los individuos con colonoscopía normal (RR 1,8; IC 95%: 1,3-2,6). Estos autores concluyeron que el riesgo de neoplasia avanzada metacrónica, en el grupo de pacientes de bajo riesgo, es similar al de la población de riesgo promedio con una colonoscopía normal. El otro metaanálisis, más reciente,54 mostró una incidencia acumulada a cinco años de adenomas avanzados en el seguimiento del 4,9% en el grupo de adenomas de bajo riesgo (IC 95%: 3,18-6.97), y del 3,3% en el grupo sin adenomas (IC 95%: 1,85-5,10). En contraposición, el mismo estudio mostró una incidencia acumulada a cinco años de adenomas avanzados en el grupo de alto riesgo del 17,1% (IC 95%: 11,97-23). Por otro lado, un estudio noruego de cohorte55 evaluó el riesgo de muerte por CCR en pacientes a los cuales se les removió un adenoma colorrectal (polipectomía). Incluyó a 40.826 pacientes, de los cuales a 23.449 se les removieron adenomas de bajo riesgo (1 adenoma), con un seguimiento medio de 7,7 años (máximo 19 años). Este grupo tuvo una mortalidad 25% menor a la población general por CCR. Otro estudio francés de cohorte56 encontró datos similares para pacientes con adenomas no avanzados.
La guía europea (ESGE) plantea cambios más profundos. No recomienda vigilancia pospolipectomía, sino volver al tamizaje a 10 años (como un estudio sin pólipos adenomatosos) cuando la remoción del pólipo fue completa, presencia de 1 a 4 pólipos, tamaño < de 10 mm con displasia de bajo grado, independientemente de la histología (componente velloso), e incluyen los pólipos serratos < de 10mm, sin displasia. Recomendación fuerte con moderado nivel de evidencia.
Sus fundamentos se basan en estudios más recientes como los de Atkin y col.,57 Lee y col.,58 Wieszczy y col.,59 Click y col.,60 Lieberman y col.61 y He y col.62 (Tabla 2).
Con respecto al número de adenomas, debemos destacar el estudio reciente de Wieszczy y col.,59 que incluyó a 236.089 pacientes como parte del Programa Nacional de Cáncer Colorrectal de Polonia, con un seguimiento medio de 7,7 años, que mostró que el número de adenomas, así como un adenoma < 20 mm, no incrementan la incidencia y mortalidad por CCR, y más aún, que los pacientes tenían una menor mortalidad que la población general.
Respecto del componente velloso en la histología, distintos estudios y metaanálisis han mostrado que este componente no es un factor de riesgo independiente de incidencia y mortalidad por CCR.58, 63 Las guías británicas nunca lo incluyeron y sus argumentos son la falta de acuerdo entre los patólogos para evaluar el componente velloso. A esto se suma el reciente estudio de Atkin y col.56 que muestra que el componente velloso no es un factor de riesgo para CCR a largo plazo.
Como fue comentado previamente, la guía europea tampoco recomienda una vigilancia especial para los pólipos serratos < 10 mm sin displasia. Esto se fundamenta en varios estudios, pero en particular en el reciente de He y col.62 Este estudio retrospectivo incluyó a 122.899 pacientes y mostró que los pacientes que tenían pólipos serratos < 10 mm sin displasia tenían un riesgo similar de CCR metacrónico cuando se los comparaba con pacientes sin adenomas (HR 1,25, IC 95%: 0,76-2,08) p = 0,38.
La guía británica recomienda que, si en la colonoscopía basal no hay pólipos de riesgo, el paciente no debe realizarse colonoscopía de vigilancia y continuar con su programa de prevención. Recomendación fuerte, grado de evidencia bajo.
Grupos de alto riesgo
Todas las guías reconfirman la necesidad de una vigilancia con colonoscopía a los tres años en los pacientes con pólipos adenomatosos de alto riesgo, es decir, aquellos que tienen un tamaño ≥ 10 mm, cinco o más adenomas, o presencia de displasia de alto grado. En la guía de la USMSTF, se le asigna a este grupo el componente histológico velloso, mientras que no ocurre lo mismo con la guía europea, como fue comentado anteriormente. Los datos que apoyan esta recomendación surgen de múltiples estudios, en particular los de Wieszczy y col.58 y Click y col.59 En este último, se incluyó a 15.935 pacientes, 2.882 con adenomas avanzados de inicio, y que luego de trece años de media de seguimiento, este grupo tenía un mayor riesgo de CCR comparado con el grupo de pacientes sin adenomas iniciales (RR 2,7; IC 95% 1,9-3,7; p < 0,001). A pesar de esta recomendación, aún no es claro el intervalo óptimo y la calidad de la evidencia es pobre, por lo que debemos mencionar el estudio que se está realizando en estos momentos, European Polyp Surveillance, que está evaluando si este intervalo se puede extender a cinco años.
Riesgo intermedio
La guía USMSTF asigna un seguimiento de entre 3-5 años cuando al paciente se le resecaron 3-4 adenomas < 10 mm. Esta población es cada vez más frecuente, dada las mejoras en la calidad tanto de los estudios como de los equipos de endoscopía. Esta recomendación está basada en bajos niveles de evidencia. Pero, por otro lado, este grupo de pacientes podría ser pasible de la denominada “paradoja de detección de múltiples adenomas”, es decir, que la detección de múltiples adenomas expone por un lado al paciente a una vigilancia a tres años, pero, además, podría ser un marcador de una colonoscopía cuidadosa, de muy alta calidad y un riesgo muy bajo de CCR.
Pólipos serratos
La guía europea establece que los pólipos serratos < 10 mm, sin displasia, no requieren vigilancia especial, sino retomar el tamizaje a diez años. Además, recomienda que los pólipos serratos ≥ 10 mm, o que tengan displasia, o serratos tradicionales, requieren vigilancia como grupo de alto riesgo a los tres años.61, 64 Por otra parte, debemos destacar que la presencia de un adenoma avanzado con un sincrónico serrato (de cualquier tipo) es de alto riesgo de adenomas avanzados metacrónicos, pero no se menciona un seguimiento especial.65
La guía de la USMSTF tiene diferencias en la vigilancia posrresección de este tipo de lesiones. Cuando estas son 1-2 lesiones serratas < 10 mm, plantea una vigilancia en 5-10 años, y para aquellas lesiones ≥ 10 mm o con displasia, una vigilancia más intensiva a tres años (Tabla 2).
Aún hoy, hay variaciones en la interpretación, por parte de los patólogos, de las lesiones serratas versus las hiperplásicas, y es por ello que la guía recomienda un enfoque conservador, con una vigilancia de 3-5 años, en pólipo hiperplásico ≥ 10 mm.
Múltiples adenomas
La guía europea recomienda que ante la detección de más de diez adenomas, los pacientes deben ser derivados para consejería genética. Si bien la guía americana no es explícita en este punto, lo recomienda. Esto se encuentra en línea según lo recomendado por distintas sociedades, como la ESMO (European Society for Medical Oncology) o la NCCN (National Comprehensive Cancer Network). El objetivo es buscar mutaciones asociadas a la PAF (poliposis adenomatosa familiar) o su forma atenuada, al MAP (poliposis asociada al MUTYH) o al PPAP (poliposis asociada al análisis polimerasa). Además, si el paciente tiene más de veinte adenomas en el tiempo, también está recomendada la consejería.
Resección en fragmentos (piecemeal)
La guía europea es clara respecto de que toda resección en piecemeal de un pólipo > 20 mm requiere un control a los 3-6 meses, y luego a los 12 meses. La guía británica contiene una recomendación similar, pero amplía el control de los 2-6 meses ante lesiones no pediculadas de 10-19 mm de tamaño, adenomas con alto grado de displasia o serratos con cualquier grado de displasia en los que no pueda determinarse si fue posible una remoción completa de la lesión.
Vigilancia pospolipectomía en adultos mayores
Como se mencionó previamente, los adultos mayores tienen mayor riesgo de complicaciones luego de una colonoscopía, ya sean estas inherentes al procedimiento (perforación, sangrado) o cardiovasculares y renales. Este riesgo aumentado se da tanto en el contexto de cribado y de vigilancia o como en el estudio por síntomas.
La guía europea recomienda suspenderla luego de los 80 años o antes, si se piensa que la expectativa de vida va a estar limitada por las comorbilidades del paciente. Esto sobre la base de que el cribado está recomendado hasta los 75 años y quizás el paciente tuvo resección de una lesión de alto riesgo, con lo cual es recomendable su vigilancia.
La guía británica recomienda no realizar vigilancia pospolipectomía en forma rutinaria luego de los 75 años o cuando las comorbilidades del paciente sugieren una expectativa de vida menor a diez años. Debemos destacar el estudio de Tran y col.,66 en una población del Kaiser Permanente Southern California, que evaluó el impacto de la colonoscopía de vigilancia pospolipectomía en adultos mayores. Este estudio de cohorte, retrospectivo, incluyó a 4.834 pacientes mayores de 75 años y a 22.929 pacientes entre los 50-74 años, también de vigilancia, considerados controles de referencia. La incidencia de CCR en los > 75 años fue del 0,24 por 1.000 personas/año vs 3,61 por 1.000 personas/año en el grupo control de referencia. Donde, además, una edad > 75 años, un score de Charlson > 2 se asociaban en forma independiente a un mayor riesgo de internación por complicaciones a treinta días (OR 1,28, IC 95%: 1,07-1,53, p = 0,006 y 2,54, IC 95%: 2,06-3,14, p < 0,001, respectivamente). Sus conclusiones fueron que los adultos mayores de 75 años en plan de vigilancia pospolipectomía tienen una menor incidencia de CCR y, por contraposición, un mayor aumento del riesgo de complicaciones poscolonoscopía.
La implementación de herramientas de cálculo para estimar la expectativa de vida del paciente podría ser de utilidad para asistir en nuestra recomendación. Por ejemplo, la disponible en https://eprognosis.ucsf.edu/calculators.php de la Universidad de California, San Francisco.
Test inmunofecales (FIT)
La guía europea no encuentra evidencia actual suficiente para recomendarlos en la vigilancia pospolipectomía.
Colonoscopía virtual
La guía británica considera que es una alternativa aceptable, en la vigilancia pospolipectomía, cuando la colonoscopía fue incompleta o las condiciones clínicas del paciente no la permiten. Los estudios que apoyan su uso son escasos.
Video cápsula de colon
La guía británica es la única que la menciona y, hasta el momento, no encuentra evidencia suficiente para recomendarla.
Historia familiar
La guía europea no recomienda cambios en la estrategia de vigilancia pospolipectomía en aquellos pacientes con historia familiar de CCR.
Aplicabilidad en la Argentina
La creación, en el año 2010, del Instituto Nacional del Cáncer (INC), dependiente del Ministerio de Salud de la Nación y, en particular, el Programa Nacional de Prevención y Detección Temprana del Cáncer Colorrectal constituyen dos hitos muy importantes para disminuir la incidencia y mortalidad del CCR en la Argentina.
Según los datos de Globocan 2020, de la Organización Mundial de la Salud, en la Argentina67 el CCR es el segundo en incidencia y mortalidad, tanto en mujeres como en hombres, aunque no se disponen de datos de muchas provincias ni de la Ciudad Autónoma de Buenos Aires. De la provincia de Buenos Aires solo hay datos incluidos a partir del registro de Bahía Blanca. No hay datos del Área Metropolitana de Buenos Aires (AMBA), área que representa más del 37% de la población del país, según el último censo.
En el 2018, en el Instituto de Investigaciones Médicas Alfredo Lanari, perteneciente a la Universidad de Buenos Aires, se inició un programa organizado de tamizaje en una población con FIT, principalmente del PAMI (Programa de Atención Médica Integral), y con el apoyo del INC. Los datos iniciales de nuestro programa fueron presentados en el Congreso Argentino de Gastroenterología del año 2018.68 Se analizó a los primeros 265 pacientes ingresados y consideramos que el dato más relevante fue que con una edad promedio de 69 años, un 20% de pacientes > 75 años, solo un 22.3% de los pacientes habían realizado algún cribado previo. Debemos remarcar que nuestra población vive en la Ciudad Autónoma de Buenos Aires. La última Encuesta Nacional de Factores de Riesgo, realizada en 2018, muestra que a solo un 31,6% de la población en edad de cribado (50-75 años) se le realizó algún tipo de examen. Hay una mejora respecto de la encuesta del 2013, cuando solo un 24,5% de la población se había realizado algún tipo de examen, pero claramente esta mejora es insuficiente.69, 70
Estos datos son similares a los publicados por Casal y col. en el 2009,71 en los que en una población de la Ciudad de Buenos Aires perteneciente a la obra social de la Universidad de Buenos Aires, solo un 33% de los encuestados en edad de cribado habían realizado algún tipo de examen de tamizaje. A estos datos preocupantes, debemos agregarle el estudio de Sanguinetti y col.72 en el que evaluaron el conocimiento sobre CCR en la ciudad de Salta, mediante una encuesta a la población en edad de cribado, y más del 90% de los encuestados tenían conocimiento nulo o insuficiente, y en el que, además, los autores encontraron una correlación con la vulnerabilidad social. Estamos lejos de los datos de los Estados Unidos con cerca del 70% de la población cribada o de la Unión Europea con más del 50% de cribado entre los distintos países.73
Para nuestro conocimiento, la Argentina no dispone de datos epidemiológicos sobre CCR en jóvenes. Los datos mundiales muestran heterogeneidad entre los países, como fue comentado, y es por ello que consideramos que debemos apostar a mejorar nuestro cribado en la población de 50-75 años y no tanto pensar en bajar la edad de tamizaje. Sí creemos que debemos estar muy alertas en los jóvenes ante la presencia de síntomas o cuando haya antecedentes familiares.
Por otro lado, para implementar las guías de vigilancia pospolipectomía es vital la calidad de la colonoscopía basal de referencia. Creemos que este aspecto se viene mejorando año a año a través de la educación iniciada en nuestras sociedades científicas (SAGE, ENDIBA, Cirugía).
Debemos respetar los intervalos de vigilancia. Los datos disponibles de la Argentina52 no son muy alentadores y, por lo tanto, debemos trabajar fuertemente en la educación desde nuestras sociedades científicas.
Ensayos clínicos que pueden aportar evidencia relevante
Cribado: los datos del estudio Colonprev de Quintero E y col.74 están próximos a conocerse. Este estudio randomizado está comparando la colonoscopía vs. FIT en el cribado del CCR en población de riesgo promedio respecto de la reducción de la mortalidad por CCR. Los datos iniciales fueron presentados en el 2012 y se aguardan los datos a diez años. Debemos agregar que, con la pandemia de covid-19, la utilización del FIT como modalidad de cribado se ha extendido más, aun en los Estados Unidos, donde la colonoscopía es la principal estrategia de cribado. En los próximos años, contaremos con los datos del ensayo NordICC75 (ensayo randomizado de los países nórdicos, Holanda y Polonia) que evalúa la colonoscopía como cribado, frente al no cribado, en la incidencia y mortalidad en CCR.
Vigilancia pospolipectomía: las recomendaciones que tenemos, en la actualidad, se basan en estudios observacionales, algunos realizados en las décadas de 1980 y 1990, en los que el objetivo fue detectar adenomas avanzados metacrónicos como subrogantes del CCR. Estas guías fueron desarrolladas por consenso de opinión y no basadas en evidencia de alta calidad. No contamos a la fecha con estudios randomizados-controlados que evalúen el impacto de los intervalos de vigilancia en la incidencia del CCR como objetivo primario. Esto en parte explica las discrepancias que plantean las guías actuales. Debemos mencionar distintos estudios que se encuentran en marcha y que quizás en los próximos años arrojen datos con mayor evidencia. En Europa, se encuentran en curso tres estudios muy importantes: EPoS (European Polyp Surveillance) I, II, III.76 EPoS I está evaluando al grupo de pacientes con adenomas de bajo riesgo (1-2 adenomas, < 10 mm, sin displasia de alto grado); para esto, ha randomizado a 13.746 pacientes a vigilancia a 5-10 años y la otra rama, a 10 años. EPoS II está evaluando al grupo de pacientes con adenomas de alto riesgo (3 o más adenomas, o un adenoma > 9 mm o con displasia de alto grado o con > 25% de componente velloso), para lo cual ha randomizado a 13.704 pacientes a vigilancia a 3-5-10 años vs. 5-10 años. Por último, EPoS III es un estudio observacional en pacientes con pólipos serratos.
En los Estados Unidos, se está desarrollando el estudio FORTE, similar al EPoS I.77
Conclusiones
El objetivo central de la vigilancia pospolipectomía es reducir el riesgo de CCR. No disponemos de evidencia de alta calidad respecto de que la vigilancia pospolipectomía reduzca la incidencia y mortalidad por CCR. Mientras esperamos los datos de los estudios randomizados-controlados para mejorar la evidencia, las guías actuales nos plantean que los adenomas de bajo riesgo (< 10 mm, 1-2 en número), que representan al principal grupo de pacientes, no requieren vigilancia especial a 7-10 años. Este es el gran cambio, ya que es el grupo más amplio de pacientes. Por otro lado, se refuerza la indicación de vigilancia a tres años del grupo de pacientes con adenomas avanzados. La vigilancia no debe ser indefinida; hay una edad a partir de la cual no es claro su beneficio, si es claro, que aumentan considerablemente los riesgos de la colonoscopía.
En la Argentina, debemos trabajar fuertemente en mejorar el cribado de nuestra población de riesgo promedio, pero también debemos necesariamente discutir nuestra capacidad de respuesta a través de la colonoscopía. Es necesario mejorar nuestros registros para tener datos propios, y así poder implementar políticas públicas acordes. Debemos trabajar en la calidad en colonoscopía, con programas que aseguren dicha calidad. Finalmente, es importante respetar los intervalos de vigilancia pospolipectomía recomendados para un uso adecuado de los recursos.
Propiedad intelectual. Los autores declaran que los datos y las tablas presentes en el manuscrito son originales y fueron realizados en sus instituciones pertenecientes.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Laudanno O, Pucci B, Brayer S. Detección y vigilancia pospolipectomía de pólipos colónicos. Acta Gastroenterol Latinoam. 2022;52(1):21-35. / https://doi.org/10.52787/agl.v52i1.157
Referencias
- Globocan 2020. Disponible en: https://gco.iarc.fr/today/data/factsheets/cancers/8-Colon-fact-sheet.pdf (acceso en enero de 2021).
- Guren M. The global challenge of colorectal cancer. Gastroenterology & Hepatology. 2019;4(12):894-5.
- Goodzardi E, Beiranvand R, Naemi H, et al. Worldwide incidence and mortality of colorectal cancer and human development index (HDI): an ecological study. WJCR. 2019;6:e1433.
- Ijspeert JE, Vermeulen L, Meijer GA, et al. Serrated neoplasia-role in colorectal carcinogesis and clinical implications. Nat Rev Gastroenterol Hepatol. 2015;12:401-9.
- Zauber A, Winawer S, O Brien M, et al. Colonoscopic polypectomy and long term prevention of colorectal-cancer deaths. N Engl J Med. 2012;366:687-96.
- Lieberman DA, Weiss DG, Bond JH, et al. Use of colonoscopy to screen asymptomatic adults for colorectal cancer, Veterans Affairs Cooperative Study. N Engl J Med. 2000;343:162-8.
- Hassan C, Pickhardt PJ, Kim DH, et al. Systematic review: distribution of advanced neoplasia according to polyp size at screening colonoscopy. Aliment Pharmacol Ther. 2010; 31:210-7.
- Gualdrini U y cols. Guía del Instituto Nacional del Cáncer 2011.
- Shaukat A, Kahi C, Burke C, et al. ACG Clinical Guidelines: Colorectal Cancer Screening 2021. Am J Gastroenterol. 2021;116:458-79.
- European Commission. Council recommendation of 2 December 2003 on cancer screening (2003/878/EC). Brussels: European Union, 2003.5.
- Bowel Cancer Screening. Disponible en: https://www.nhs.uk/conditions/bowel-cancer-screening/ (acceso en enero de 2022).
- Kaminski MF, Regula J, et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med. 2010;362: 1795-803.
- Kaminski MF, et al. Increased rate of adenoma detection associates with reduced risk of colorectal cancer and death. Gastroenterology. 2017;153:98-105.
- Corley D, Jensen CD, Marks AR, et al. Adenoma detection rate and risk of colorectal cancer and death. N Engl J Med. 2014;370:1298-306.
- Zhao S, Wang S, Pan P, et al. Magnitude, Risk factors, and Factors Associated with Adenoma Miss Rate of Tandem Colonoscopy: A Systematic Review and Meta-analysis. Gastroenterology. 2019;156:1661-74.
- Riemann JF, Agrawal A, Amaro P, et al. Adoption of colonoscopy quality measures across Europe: the European Colonoscopy Quality Investigation (ECQI) Group experience. United European Gastroenterol J. Epub, 13 de abril de 2018.
- Rex D, Schoenfeld N, Cohen J, et al. Quality indicators for colonoscopy. Gastrointest Endosc. 2015;81:31-53.
- Buenas prácticas endoscópicas. Actividad de Tendiendo Puentes, 2019. Acta Gastroenterol Latinoam. 2020;50(4):1-109.
- Wallace M, Crook J, Thomas C, et al. Effect of an endoscopic quality improvement program on adenoma detection rates: a multicenter cluster-randomized controlled trial in a clinical practice setting (EQUIP-3). Gastrointest Endosc. 2017;85: 538-45.
- Kaminski M, Anderson J, Roland V, et al. Leadership training to improve adenoma detection rate in screening colonoscopy: a randomized trial. Gut. 2016;65:616-24.
- Chokshi R, Hovis C, Hollander T, et al. Prevalence of missed adenomas in patients with inadequate bowel preparation on screening colonoscopy. Gastrointest Endosc. 2012;75:1197-203.
- Calderwood A, Jacobson B. Comprehensive validation of the Boston Bowel Preparation Scale. Gastrointest Endosc. 2010; 72:686-92.
- Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: application to healthy patients undergoing elective procedures: an updated report by the American Society of Anesthesiologists Committee on Standards and Practice Parameters. Anesthesiology. 2011;114:495-511.
- Radaelli F, Paggi S, Hassan C, et al. Split-dose preparation for colonoscopy increases adenoma detection rate: a randomised controlled trial in an organised screening programme. Gut. 2017;66:270-7.
- Zhao S, Yang X, Wang S, et al. Impact of 9-minute withdrawal time on the Adenoma Detection Rate: A Multicenter Randomized Controlled trial. Clinical Gastroenterology & Hepatology 2020; en prensa. Disponible en: https://doi.org/10.1016/j.cgh.2020.11.019 (acceso en febrero de 2022).
- Rex, D. How I approach retroflexion and prevention of right-sided colon cancer following colonoscopy. Am J Gastroenterol. 2016;111:9-11.
- Nuñez Rodríguez M, Diez Redondo P, Riu Pons F, et al. Proximal retroflexion versus second forward view of the right colon during screening colonoscopy: A multicentre randomized controlled trial. UEG Journal. 2020;8:725-35.
- Nutalapati V, Desai M, Thoguluva-Chandrasekar V, et al. Effect of dynamic position changes on adenoma detection rate during colonoscope withdrawal: systematic review and meta-analysis. Endoscopy International Open. 2020;8:1842-9.
- Laudanno O, Pucci B, Ahumarn G, et al. Diverticular disease as a harbinger of underlying colorectal adenomas. Gastrointest Endosc. 2020;91:6S.
- Tziatzios G, Gkolfakis P, Lazaridis L, et al. High-definition colonoscopy for improving adenoma detection: a systematic review and meta-analysis of randomized controlled studies. Gastrointest Endosc. 2020;91:1027-36.
- Hsieh Y, Tseng C, Hu C, et al. Prospective multicenter randomized controlled trial comparing adenoma detection rate in colonoscopy using water exchange, wáter inmersión and air insufflation. Gastrointest Endosc. 2017;86:192-201.
- Williet N, Tournier Q, Vernet C, et al. Effect of Endocuff-assisted colonoscopy on adenoma detection rate: meta-analysis of randomized controlled trials. Endoscopy Epub, 26 de abril de 2018.
- Rex D, Repici A, Gross S, et al. High definition colonoscopy versus Endocuff versus EndoRings versus full-spectrum endoscopy for adenoma detection at colonoscopy: a multicenter randomized trial. Gastrointest Endosc. 2018;88:335-44.
- Hammad H, Kaltenbach T, Soetikno R. Image-enhanced endoscopy: How far do we need to go? Gastrointest Endosc. 2017;86: 698-9.
- Repici A, Badalamenti M, Maselli R, et al. Efficacy of Real-Time Computer-Aided Detection of Colorectal Neoplasia in a Randomized Trial. Gastroenterology. 2020;159:512-20
- Wang P, Liu P, Glissen Brown J, et al. Lower Adenoma Miss Rate of Computer-Aided Detection-Assisted Colonoscopy vs Routine White-Light Colonoscopy in a Prospective Tandem Study. Gastroenterology. 2020;159:1252-61.
- Mori Y, Bretthauer M, Kalager M. Hopes and Hypes for Artificial Intelligence in Colorectal Cancer Screening. Gastroenterology. 2021;161:774-7.
- Wolf A, Fontham E, Church T, et al. Colorectal cancer screening for average-risk adults: 2018 guideline update from the American Cancer Society. CA Cancer J Clin. 2018;68:250-81.
- Patel S, May F, Anderson J, et al. Updates on Age to Start and Stop Colorectal Cancer Screening: Recommendations from the U.S. Multi-Society Task Force on Colorectal Cancer. Gastroenterology. 2022;162:285-99.
- USPSTF, Davidson K, Barry M, et al. Screening for colorectal cancer: US Preventive Services Task Force recommendation statement. JAMA. 2021;325:1965-77.
- Siegel R, Medhanie G, Fedewa S, et al. State variation in early-onset colorectal cancer in the United States, 1995-2015. J Natl Cancer Inst. 2019;111:1104-6.
- Siegel R, Torre L, Soerjomataram I, et al. Global patterns and trends in colorectal cancer incidence in young adults. Gut. 2019;68:2179-85.
- Joh H, Lee D, Hur J, et al. Simple Sugar and Sugar-Sweetened Beverage Intake During Adolescence and Risk of Colorectal Cancer Precursors. Gastroenterology. 2021;161:128-42.
- Chu H. Bringing Primary and Secondary Prevention Into Play in Community Prevention of Gastrointestinal Cancers. Gastroenterology. 2021;161:1787-805.
- Canadian Task Force. Disponible en: www.canadiantaskforce.ca/colorectal-cancer (acceso en enero de 2022).
- Qaseem A, Crandall C, Mustafa R, et al. Screening for colorectal cancer in asymptomatic average-risk adults: a guidance statement from the American College of Physicians. Ann Inter Med. 2019;171:643-54.
- Day l, Kwon A, Inadomi J, et al. Adverse events in older patients undergoing colonoscopy: a systematic review and meta-analysis. Gastrointest Endosc. 2011;74:885-96.
- Gupta S, Lieberman D, Anderson J, et al. Recommendations for Follow-Up After Colonoscopy and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastrointest Endosc. 2020;91:463-85.
- Hassan C, Antonelli G, Dumonceau J, et al. Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline-Update 2020.
- Rutter M, East J, Rees C, et al. British Society of Gastroenterology/Association of Coloproctology of Great Britain and Ireland/Public Health England post-polypectomy and post-colorectal cancer resection surveillance guidelines. Gut. 2020;69: 201-23.
- Djinbachian R, Dubé J, Durand M, et al. Adherence to post-polypectomy surveillance guidelines: a systematic review and meta-analysis. Endoscopy. 2019;51:673-83.
- Esteban S, Ricci R, Terrasa S, et al. Colonoscopy overuse in colorectal cancer screening and associated factors in Argentina: a retrospective cohort study. BMC Gastroenterol. 2017; 17:1-7.
- Hassan C, Gimeno-Garcia A, Kalager M, et al. Systematic review with meta-analysis: the incidence of advanced neoplasia after polypectomy in patients with and without low-risk adenomas. Aliment Pharmacol Ther. 2014; 39:905-12.
- Dube C, Yakubu M, McCurdy B, et al. Risk of advanced adenoma, colorectal cancer, and colorectal cancer mortality in people with low-risk adenomas at baseline colonoscopy: a systematic review and meta-analysis. Am J Gastroenterol. 2017; 112:1790-801.
- Loberg M, Kalager M, Holme O, et al. Long-term colorectal-cancer mortality after adenoma removal. N Engl J Med. 2014;371: 799-807.
- Cottet V, Jooste V, Fournel I, et al. Long-term risk of colorectal cancer after adenoma removal: a population-based cohort study. Gut. 2012;61:1180-6.
- Atkin W, Wooldrage K, Brenner A, et al. Adenoma surveillance and colorectal cancer incidence: a retrospective, multicentre, cohort study. The Lancet Oncology. 2017;18:823-34.
- Lee J, Jensen C, Levin T, et al. Long-term risk of colorectal cancer and related death after adenoma removal in a large, community based population. Gastroenterology. 2020; 158:884-94.
- Wieszczy P, Kaminski M, Franczyk R, et al. Colorectal cancer incidence and mortality after removal of adenomas during screening colonoscopies. Gastroenterology. 2020;158:875-83.
- Click B, Pinsky P, Hickey T, et al. Association of colonoscopy adenoma findings with long-term colorectal cancer incidence. JAMA. 2018;319:2021-31.
- Lieberman D, Sullivan B, Hauser E, et al. Baseline colonoscopy findings associated with 10 years outcome in a screening cohort undergoing colonoscopy surveillance. Gastroenterology. 2020; 158:862-74.
- He X, Hang D, Wu K, et al. Long-term risk of colorectal cancer after removal of conventional adenomas and serrated polyps. Gastroenterology. 2020;158:852-61.
- de Jonge V, Sint Nicolaas J, van Leerdam M, et al. Systematic literature review and pooled analyses of risk factors for finding adenomas at surveillance colonoscopy. Endoscopy. 2011;43: 560-74.
- Holme Ø, Bretthauer M, Eide TJ, et al. Long-term risk of colorectal cancer in individuals with serrated polyps. Gut. 2015;64: 929-36.
- Anderson J, Butterly L, Robinson C, et al. Risk of metachronous high risk adenomas and large serrated polyps in individuals with serrated polyps on index colonoscopy: data from the New Hampshire Colonoscopy Registry. Gastroenterology. 2018; 154:117-27.
- Tran AH, Man NgorEW, Wu BU. Surveillance colonoscopy in elderly patients: a retrospective cohort study. JAMA Intern Med. 2014;174:1675-168.
- Globocan 2020. Disponible en: https://gco.iarc.fr/Argentina (acceso en enero de 2022).
- Pucci B, Laudanno O, Lafage M, y col. Cribado Cáncer Colorrectal mediante test de inmunoensayo fecal. Resultados iniciales de la implementación del Programa Nacional de Prevención y Detección Temprana del Cáncer Colorrectal en un hospital universitario. Acta Gastroenterol Latinom. 2018;48(1).
- Steinberg L, Pereyra L. Vigilancia colonoscópica: ¿el talón de Aquiles de la prevención del cáncer colorrectal? Acta Gastroenterol Latinoam. 2020;50:96-103.
- 4 Encuesta Nacional de Factores de Riesgo. 2019. Disponible en: www.indec.gob.ar
- Casal E, Velázquez E, Mejía R, y col. Rastreo del cáncer colorrectal. Conocimiento y actitud de la población. Medicina (Buenos Aires). 2009;69:135-42.
- Sanguinetti J, León de la Fuente R. ¿Qué saben de tamizaje de cáncer de colon y recto quienes deben hacérselo? Conocimiento sobre prevención de cáncer de colon y vulnerabilidad social. Acta Gastroenterol Latinom. 2019;49:349-55.
- Inadomi J, Issaka R, Green B. What multilevel interventions do we need to increase the colorectal cancer screening rate to 80%? Clin Gastroenterol Hepatol. 2021;19:633-45.
- Quintero e, Castells A, Bujanda L, et al. Colonoscopy versus Fecal Immunochemical Testing in Colorectal-Cancer Screening. N Engl J Med. 2012;366:697-706.
- Kamisnki M, Bretthauer M, Zauber A, et al. The NordICC Study: Rationale and design of a randomized trial on colonoscopy screening for colorectal cancer. Endoscopy. 2012; 44:695-702.
- Jover R, Bretthauer M, Dekker E, et al. Rationale and design of the European Polyp Surveillance (EPOS) trials. Endoscopy. 2016;48:571-8.
- ClinicalTrials.gov. Five or Ten Year Colonoscopy for 1-2 Non-Advanced Adenomatous Polyps (FORTE), sponsor: National Cancer Institute.
Correspondencia: Oscar Laudanno
Correo electrónico: oscarlaudanno@gmail.com
Acta Gastroenterol Latinoam 2022;52(1):21-35
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE