Javier Chahuan ID· Margarita Pizarro ID· Arnoldo Riquelme ID
Departamento de Gastroenterología, Escuela de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
Acta Gastroenterol Latinoam 2022;52(1):36-46
Recibido: 04/02/2022 / Aceptado: 20/03/2022 / Publicado en www.actagastro.org 30/03/2022 / https://doi.org/10.52787/agl.v52i1.176
Resumen
La infección gástrica por Helicobacter pylori tiene una prevalencia variable a nivel mundial. En Latinoamérica, puede superar el 50% de infectados. Se asocia a patologías como la úlcera péptica, el cáncer gástrico, el linfoma MALT y la púrpura trombocitopénica inmune, entre otras. No hay un método diagnóstico óptimo y la presencia puede ser detectada tanto por métodos invasivos, que requieren una endoscopía digestiva alta, como no invasivos. Dentro de los invasivos, contamos con la prueba rápida de ureasa, la histología, las pruebas moleculares, como reacción en cadena de la polimerasa, y el cultivo. Por su parte, los no invasivos incluyen la prueba de aire espirado, el antígeno en deposiciones de Helicobacter pylori, reacción en cadena de la polimerasa en deposiciones y la serología. La prueba diagnóstica a utilizar depende del escenario clínico, y deben conocerse los beneficios y debilidades de cada método. Es importante considerar la edad del paciente, sus factores de riesgo de cáncer gástrico, la necesidad de endoscopía por esta u otra causa, la disponibilidad de las pruebas diagnósticas y el costo, entre otros.
Palabras claves. Helicobacter pylori, diagnóstico, pruebas diagnósticas.
Diagnostic Methods for the Detection of Helicobacter Pylori Infection: Which and When to Order?
Summary
Gastric infection by Helicobacter pylori has a variable prevalence worldwide. In Latin America, it can exceed 50% of infected people. It is associated with peptic ulcer, gastric cancer, MALT lymphoma, immune thrombocytopenic purpura, among other pathologies. There is no optimal diagnostic method, and its presence can be detected by both invasive methods that require an upper gastrointestinal endoscopy, and non-invasive methods. Within the invasive, we have the rapid urease test, histology, molecular tests such as polymerase chain reaction and culture. On the other hand, non-invasive tests include the breath test, Helicobacter pylori antigen in stools, polymerase chain reaction in stools and serology. Depending on the clinical scenario, the diagnostic test to be used, its benefits and weaknesses should be known. It is important to consider the age of the patient, their gastric cancer risk factors, the need for endoscopy for this or another reason, the availability of diagnostic tests and the cost, among others.
Keywords. Helicobacter pylori, diagnosis, diagnostic tests.
Abreviaturas
H. pylori: Helicobacter pylori.
MALT: Tejido linfoide asociado a mucosas.
ELISA: Enzyme-Linked ImmunoSorbent Assay.
PRU: Prueba rápida de ureasa.
PCR: Reacción en cadena de la polimerasa.
PAS-AB: Periodic acid Schiff-Alcian blue.
ADN: Ácido desoxirribonucleico.
OLGA: Operative Link on Gastritis Assessment.
Introducción
Helicobacter pylori (H. pylori) es una bacteria gram negativa que ha acompañado constantemente al ser humano en los procesos migratorios, y se hipotetiza que se estableció en el estómago del ser humano hace al menos 100.000 años.1
No fue hasta la década de los ochenta que los australianos, Robin Warren y Barry Marshall, encontraron, en pacientes con gastritis crónica o úlcera gástrica o duodenal que se sometían a endoscopía digestiva alta, un bacilo curvo, microaerofílico y flagelado.2 A raíz de esto, posteriormente, ganaron el premio Nobel de Fisiología y Medicina por el descubrimiento de la H. pylori.3
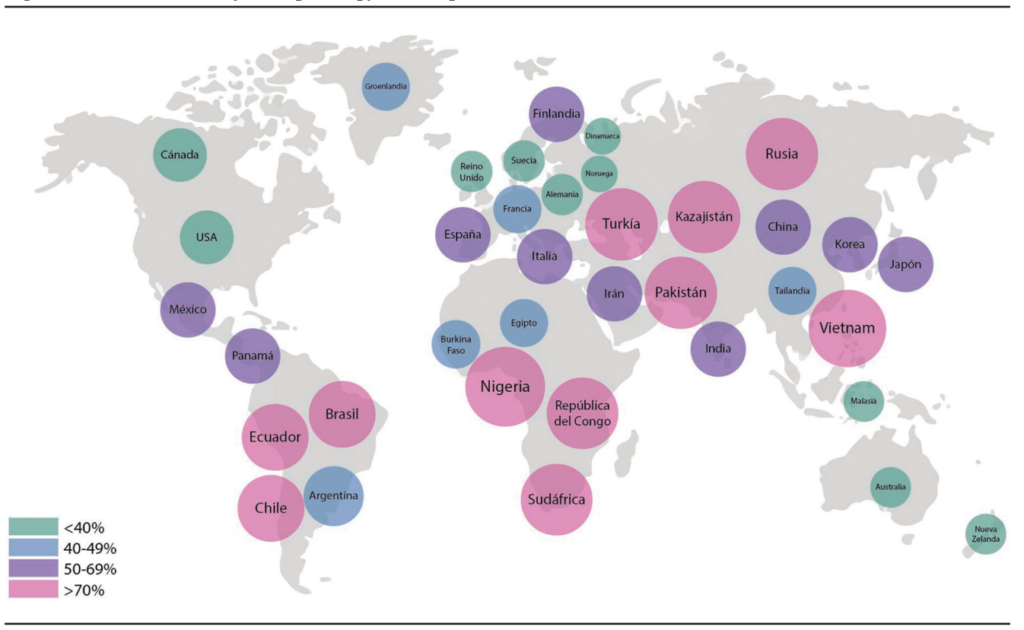
H. pylori infecta de manera variable a la población mundial. Su prevalencia varía de acuerdo con el nivel educacional, el número de hermanos, el hacinamiento y las condiciones de higiene, entre otros factores, y se observan, además, diferencias en la prevalencia dentro de un mismo país.4 En áreas como Latinoamérica y el Caribe, la prevalencia puede llegar a ser mayor del 60%.5 En la Argentina, particularmente, se ha visto en niños sintomáticos con edad media cercana a 10 años una prevalencia del 41,2% entre 2002 y 2004, pero ha disminuido al 26% entre 2007 y 2009, al ser diagnosticado por prueba de aire espirado.6 En otro estudio, que incluyó adultos y niños, se detectó mediante una prueba serológica una prevalencia de infección por H. pylori cercana al 35%.7
En la Figura 1, se presenta una estimación de la prevalencia de infección por H. pylori en distintas regiones del mundo.
Figura 1. Prevalencia de infección por H. pylori. Adaptado.5,8-9
H. pylori logra sobrevivir a la acidez gástrica debido a que presenta una enzima llamada ureasa que transforma la urea en dióxido de carbono y amoníaco, lo que eleva el pH alrededor de la bacteria.10
La presencia de H. pylori, en el estómago, genera gastritis crónica en todos los individuos que la poseen, por lo que debe considerarse una infección a pesar de que el paciente sea completamente asintomático.11
Además de eso, en algunos individuos, se asocia a distintas patologías gastrointestinales. Dentro de ellas, se encuentra la úlcera péptica, tanto gástrica como duodenal.12 El tratamiento de la infección por H. pylori es eficaz para prevenir la recurrencia de la enfermedad péptica,13 lo que es concordante con el hecho de que a medida que disminuye la prevalencia de infección por H. pylori, también lo hace la incidencia de úlcera péptica (principalmente la duodenal).14
H. pylori, por otra parte, es considerada un carcinógeno tipo I por la Organización Mundial de la Salud15 y presenta factores de virulencia conocidos, como las proteínas cagA y vacA,16 para el desarrollo de cáncer gástrico. La erradicación de la bacteria ha demostrado disminuir la incidencia de éste.17
Dentro de otras asociaciones, se encuentra el linfoma MALT (tejido linfoide asociado a mucosas/mucosa associated lymphoid tissue). Se ha observado que cerca de un 80% de los pacientes con esta patología presentan infección por H. pylori,18 y la erradicación de H. pylori logra la regresión de la lesión en la mayoría de los linfomas localizados en el estómago,19 siendo una parte fundamental del tratamiento.
H. pylori se relaciona también con la púrpura trombocitopénica inmune,20 y cuando se erradica la bacteria, los pacientes tienen mejor respuesta plaquetaria.21 También se ha encontrado que pacientes con infección por H. pylori presentan más riesgo de anemia ferropriva,22 por lo que se sugiere buscar y tratar la infección en pacientes con anemia ferropriva no explicada, luego de estudio endoscópico inicial.23 En la misma línea, la infección por H. pylori puede disminuir los niveles de vitamina B12 y la erradicación de la infección se asocia a un incremento de los niveles de está.24
Existen también otras múltiples patologías relacionadas, con distinto grado de asociación, a la infección por H. pylori, entre ellas neurológicas, cardiovasculares, endocrinológicas y dermatológicas.25
El tratamiento de erradicación ha ido variando debido a que existe una creciente resistencia antimicrobiana, que ha motivado el desarrollo de diferentes esquemas alternativos de antibióticos, con o sin bismuto, y han variado también los métodos diagnósticos que, al permitir evaluar la sensibilidad antibiótica, posibilitarían una terapia personalizada.26
En el presente trabajo, presentaremos las diferentes pruebas diagnósticas de la infección por H. pylori, analizando sus ventajas y desventajas.
Métodos diagnósticos
Los métodos diagnósticos de infección por H. pylori pueden clasificarse en invasivos (si requieren tomar una muestra mediante endoscopía digestiva alta) y no invasivos. Existen numerosos métodos diagnósticos en el mercado y no hay un gold standard definido, debido a las limitaciones de cada uno de los exámenes, por lo que en algunos artículos se considera la suma de más de una prueba diagnóstica como el gold standard.
Por esta razón, al evaluar una nueva prueba diagnóstica, resulta de especial importancia analizar los métodos, observando cuál fue considerado el gold standard.8
Métodos no invasivos
Serología
La serología, a través de la medición de anticuerpos en sangre contra distintas proteínas de H. pylori, tiene la limitación de que un resultado positivo puede no indicar efectivamente una infección actual, ya que los títulos pueden mantenerse incluso en pacientes en los que ya fue erradicada la bacteria, y también porque podría haber reactividad cruzada con otros microorganismos, lo que hace que la especificidad sea menor.27-29 Existen numerosos kits en el mercado, que utilizan diferentes técnicas como ELISA (Enzyme-Linked ImmunoSorbent Assay) o inmunocromatografía, entre otros. Las pruebas rápidas tienen resultados muy variables dependiendo del kit usado.30 Por estas razones, en términos generales, la serología no debería usarse para monitorizar la erradicación de la terapia.30
Antígeno en deposiciones de H. pylori
Es una herramienta útil que logra, mediante anticuerpos policlonales o monoclonales, la detección de antígenos de H. pylori. Permite realizar el diagnóstico de infección por H. pylori previo a terapia y, además, es útil para evaluar la erradicación.31
Los antígenos pueden ser detectados mediante inmunoensayos enzimáticos o inmunocromatográficos.32
Un metaanálisis de estudios que utilizaban como diagnóstico el antígeno en deposiciones de H. pylori, publicado en 2006, mostró una sensibilidad de 94% y una especificidad del 97% previo al tratamiento, al incluir las pruebas diagnósticas monoclonales. En pacientes que ya han recibido terapia, la sensibilidad de las pruebas monoclonales alcanzó un 93% y una especificidad del 96%. Las pruebas, cuya técnica era policlonal, tenían menor exactitud, especialmente en el postratamiento.31
Más recientemente, una revisión Cochrane que incluyó 29 estudios que evaluaban el antígeno en deposiciones de H. pylori en casi 3.000 pacientes, con 1.311 casos positivos para infección por H. pylori, mostró una sensibilidad del 83% (con una especificidad fija a 90%) y que se pierden 89 casos de H. pylori por cada mil personas testeadas.33
En nuestro medio, resulta de gran utilidad el antígeno en deposiciones de H. pylori, especialmente para confirmar la efectividad del tratamiento, dadas la gran disponibilidad y facilidad para realizarlo, en comparación con la endoscopía digestiva alta o la prueba de aire espirado.
Hay que tener precaución en pacientes que estén cursando un cuadro diarreico, ya que podría reducirse la concentración antigénica y llevar a un falso negativo.32
El uso de inhibidores de bomba de protones disminuye la sensibilidad del antígeno en deposiciones de H. pylori, por lo que, previo a su uso, debe suspenderse.34 Cabe destacar que la suspensión de inhibidores de bomba de protones (dos semanas) y la toma de muestras lejos del uso de antibióticos (cuatro semanas) son recomendaciones generales para evitar falsos negativos, tanto de todas las pruebas invasivas como de las no invasivas, y no se trata de una condición particular del antígeno en deposiciones.
Prueba de aire espirado
El mecanismo de acción de este método diagnóstico consiste en la hidrólisis de urea usando isótopos del carbono, y una vez que se administra por vía oral, la enzima ureasa de H. pylori produce, de manera importante, amoníaco y dióxido de carbono, el cual se difunde por la sangre hacia los pulmones, permitiendo así su medición35 (Figura 2).
Figura 2. Mecanismo de detección de prueba de aire espirado con urea marcada con 13C o 14C. Adaptado.8-9
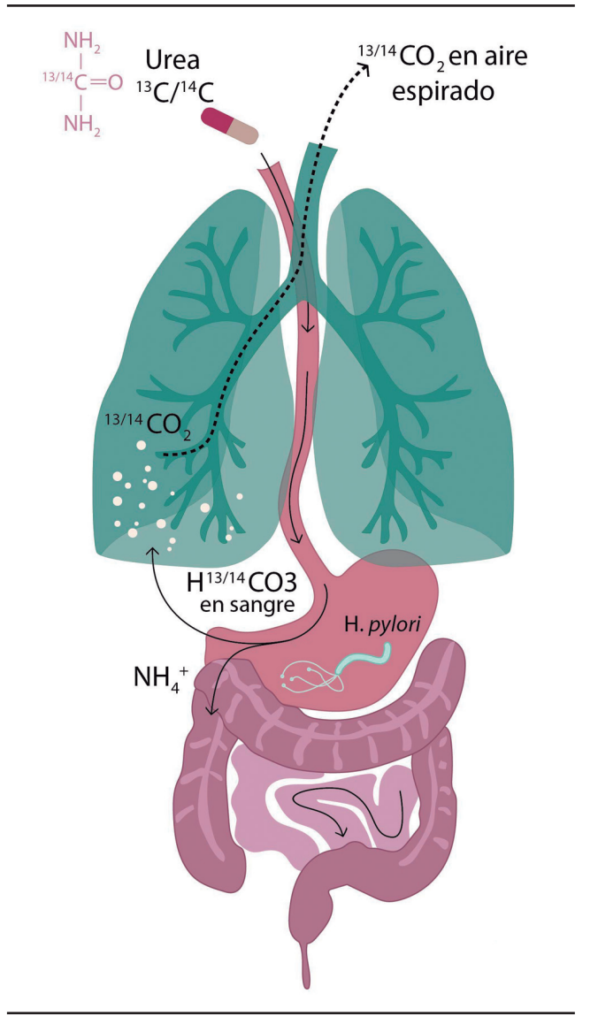
Existe esta prueba usando 13C o 14C, pero en general la prueba de 14C es menos utilizada por tratarse de un isótopo radioactivo, por lo que hay que tener precaución, especialmente en mujeres embarazadas y personas jóvenes.36
La prueba de aire espirado es un método efectivo para diagnóstico de H. pylori y es el mejor recomendado para buscar de manera no invasiva H. pylori previo al tratamiento (estrategia de testear y tratar), de acuerdo con el consenso Maastricht V/Florence.11
Se han realizado estudios de costo-efectividad de la prueba de aire espirado con urea para el diagnóstico de H. pylori, mediante la estrategia de testear y tratar, en pacientes con dispepsia, y se ha comparado con el manejo sintomático y la endoscopía digestiva alta como primera aproximación. Para el objetivo de alivio de dispepsia, la estrategia de testear y tratar mediante el uso de prueba de aire espirado es la más costo-efectiva. Otros outcomes de costo-efectividad incluyeron la prevención de úlcera péptica y el desarrollo de cáncer gástrico.37
La sensibilidad de este método supera el 90% en distintos metaanálisis.33,36
La alta sensibilidad y especificidad se suma a la aceptación de los pacientes porque es una prueba fácil de realizar y que puede llevarse a cabo en una visita a la unidad clínica (no requiere volver en un segundo momento a entregar muestras, como en el caso del antígeno en deposiciones), por lo que se trata de los métodos no invasivos más utilizados en el ámbito clínico ambulatorio. Dentro de sus limitaciones, la prueba de aire espirado se considera de alto riesgo de transmisión de Sars-Cov-2,38 por lo que, en caso de no urgencia, debe ser pospuesta. En nuestro medio, algunas unidades de pruebas funcionales en Chile han suspendido los estudios de aire espirado, acotando la disponibilidad de esta prueba por el riesgo de transmisión de aerosoles, pero se trata de una condición transitoria y veremos el lugar que ocupan estas pruebas al finalizar la pandemia de COVID-19.
Otro punto que debe considerarse es que los inhibidores de bomba de protones también disminuyen la sensibilidad de esta prueba, por su efecto sobre H. pylori, y se prefiere suspenderlos por dos semanas, previo al examen.39
Dentro de los falsos positivos, se incluyen otras bacterias portadoras de ureasa que pueden estar en la boca o el intestino, tales como Proteus mirabilis, Citrobacter freundii, Klebsiella pneumoniae, Enterobacter cloacae y Staphylococcus aureus.40-41
Se ha usado la prueba de aire espirado como método para chequear la erradicación, y, en ese caso, se recomienda hacerlo al menos cuatro semanas luego de finalizado el tratamiento, para evitar falsos negativos.42
Métodos invasivos
Prueba rápida de ureasa
La prueba rápida de ureasa (PRU) es una prueba de diagnóstico indirecta, que evalúa la presencia de la enzima ureasa en una biopsia gástrica, por lo que solo detecta infección activa y no infección pasada.43 La muestra gástrica entra en contacto con la urea y, mediante la acción de la enzima ureasa, se hidroliza y forma CO2 y amoníaco, lo que genera un cambio de pH que se detecta mediante un cambio colorimétrico44 (Figura 3).
Figura 3. Mecanismo de acción de la prueba rápida de ureasa. Adaptado.8-9
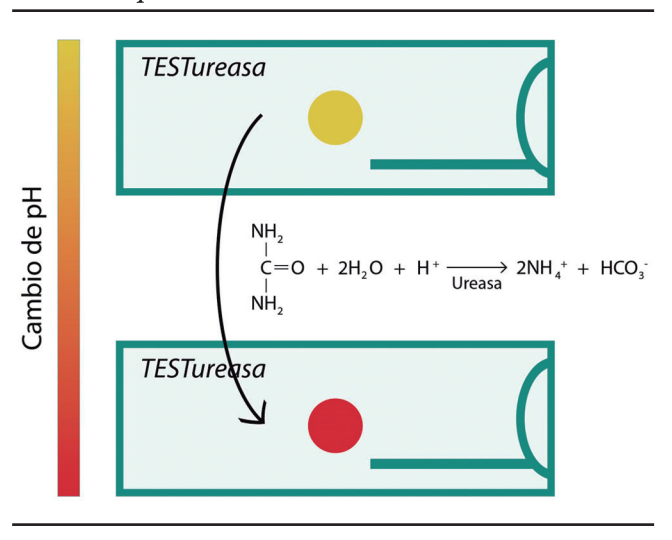
Las biopsias gástricas pueden tomarse del antro o del cuerpo gástrico o bien incluir en una misma placa ambas biopsias juntas, lo que mejora su detección y acorta el tiempo de un resultado positivo.45
Existen pruebas rápidas de ureasa que pueden mantenerse a temperatura ambiente, con resultados que pueden estar en una hora, lo que permite que, una vez que el paciente se recupera de la sedación de la endoscopía digestiva alta, pueda ya obtener el resultado y así iniciar el tratamiento precozmente.46 Además, se ha demostrado la posibilidad de realizar una PCR (reacción en cadena de la polimerasa) usando la misma muestra de la prueba rápida de ureasa.47
La sensibilidad varía entre valores cercanos al 80% y hasta más del 95%, con especificidades superiores al 95%.43,48-49
Dentro de los falsos positivos, se encuentran bacterias productoras de ureasa que pueden estar ubicadas en el estómago.41
Dentro de los falsos negativos, encontramos diferentes situaciones que disminuyen la carga bacteriana del estómago, como el uso de antibióticos o bismuto,42 y también en pacientes que se presentan con hemorragia digestiva50 y el uso de inhibidores de bomba de protones.51
Histología
La detección de H. pylori, a través de la histología, se realiza mediante el uso de diferentes tinciones, tales como hematoxilina-eosina, tinción de Giemsa, PAS-AB (periodic acid Schiff-Alcian blue), entre otras.52-53
La tinción de Giemsa es la que se prefiere, debido a que ha demostrado ser más específica que la hematoxilina-eosina54 y tendría mayor sensibilidad en detectar la infección por H. pylori en pacientes con gastritis crónica.55
La técnica histológica presenta sensibilidad y especificidad variables, pero puede llegar al orden del 95% o más.56-57
La técnica histológica tiene la ventaja de que permite, además de pesquisar la presencia de H. pylori, evaluar el estado de la mucosa gástrica y detectar si hay atrofia gástrica o metaplasia intestinal.57 El uso de biopsias protocolizadas, como el protocolo de Sydney modificado,58 que incluye biopsias de antro, ángulo y cuerpo gástrico, permitiría tener una mayor área donde buscar la bacteria, especialmente en pacientes que tienen cambios atróficos del antro.59
Además, el uso de inmunohistoquímica puede aumentar la sensibilidad de este método diagnóstico11 y disminuir la variabilidad interobservador, ya que es capaz de interpretar, con mayor precisión, la presencia de H. pylori versus flora diferente que pueda verse similar en la histología.60
Las limitaciones incluyen que no es un procedimiento inmediato y que requiere patólogos entrenados en la detección de la bacteria, entre otras.57
Dentro de los falsos negativos, se encuentran los pacientes que están usando inhibidores de bomba de protones, que pueden reducir la carga bacteriana.42
Cultivo
El cultivo de H. pylori a partir de biopsias gástricas está poco disponible en la práctica clínica habitual. Además, para poder aislar la bacteria hay una serie de factores que deben tomarse en cuenta, como la calidad de la muestra, la presencia de flora comensal, el tiempo que puede transcurrir hasta el cultivo y el transporte. Requiere, además, un personal altamente capacitado y toma varios días para que la H. pylori logre crecer.61 La ventaja del cultivo es que permite evaluar la sensibilidad a diferentes antibióticos,44 lo que es de utilidad en pacientes que han fallado con varios esquemas de tratamiento.
Debido a las dificultades técnicas, la tasa de un cultivo exitoso con crecimiento de la bacteria es variable, lográndose entre un 45%-75% aproximadamente,62-65 con especificidades que llegan al 100%.65
Estudios moleculares
La PCR es un método diagnóstico que permite la pesquisa de H. pylori, y también la búsqueda de genes de resistencia a antibióticos.8 Existen diferentes genes que pueden evaluarse, como ureA, ureC, 16SrRNA, 23SrRNA y Hsp60.44 Hay métodos comerciales de PCR en tiempo real y también se describen in house-PCR.66, 67
La PCR puede realizarse a partir de la muestra tomada en la prueba rápida de ureasa47 y permite evaluar la presencia de la bacteria y si presenta resistencia a claritromicina y/o levofloxacino. Es de especial utilidad en pacientes que han fallado a terapia.
Respecto de la sensibilidad y la especificidad de este método, pueden presentar valores cercanos a 97-100%,66-67 pero muchas veces es difícil de interpretar ya que el gold standard no existe y la PCR podría detectar a pacientes con la infección que otros métodos tradicionales no detectan.66
En nuestro laboratorio, logramos rescatar ácido desoxirribonucleico (ADN) bacteriano, en muestras de prueba rápida de ureasa, que se mantuvieron congeladas a -20°C por algunos meses (Chahuán J, et al., datos presentados en el XLVIII Congreso Chileno de Gastroenterología de 2021, trabajo libre plenario N°4).
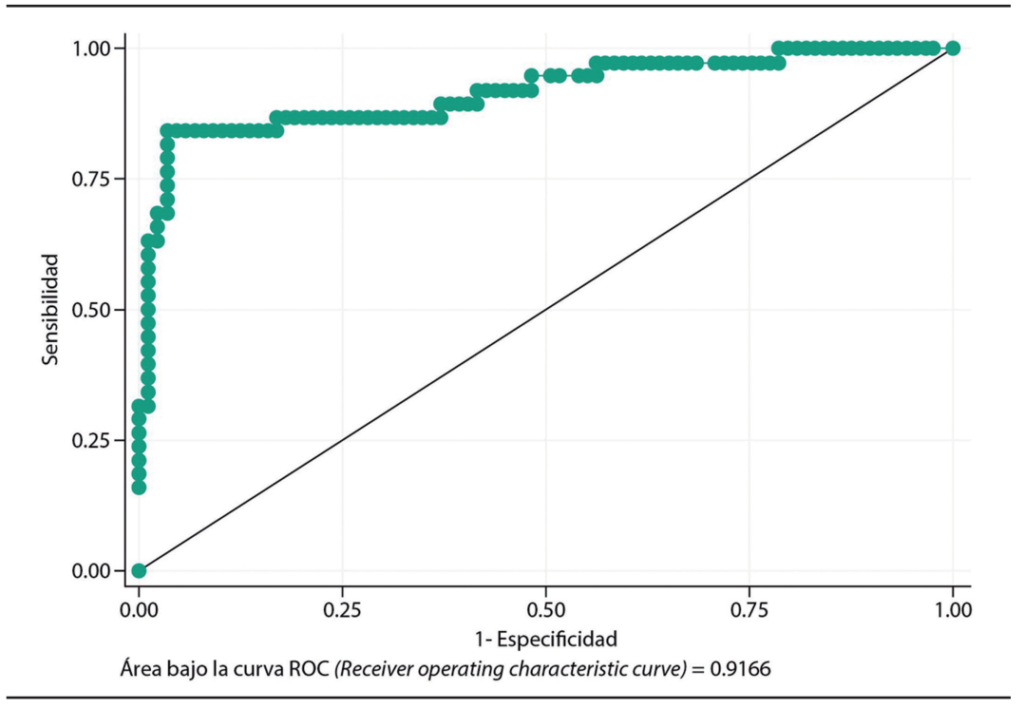
La PCR, mediante la amplificación de un gen conservado de la bacteria, resultó un método diagnóstico efectivo para la pesquisa de H. pylori. La Figura 4 muestra la curva ROC, al compararla con prueba rápida de ureasa + histología, como gold standard. Obtuvimos una sensibilidad de 0,84 y una especificidad de 0,97, con un área bajo la curva 0,92 (IC 95% 0,85-0,98) (Chahuán J, et al., datos no publicados pero presentados en el XLVIII Congreso Chileno de Gastroenterología de 2021, trabajo libre plenario N° 4).
Figura 4. Curva ROC de PCR en tiempo real al compararla con prueba rápida de ureasa + histología como gold standard. (Chahuán J, et al., no publicado y presentado en el XLVIII Congreso Chileno de Gastroenterología de 2021, trabajo libre plenario N°4).
Por otra parte, con la PCR en tiempo real puede medirse, además, la carga bacteriana, la cual es mayor en pacientes con gastropatía nodular.68
Se ha evaluado también el estudio de PCR en tiempo real junto con detección de resistencia a claritromicina en deposiciones en 1.200 pacientes y se ha comparado con cultivo y PCR en biopsias gástricas, con resultados prometedores que alcanzan una sensibilidad y una especificidad mayores al 95%,69 lo que sería un método no invasivo de detección, pero que aún no está fácilmente disponible en nuestro medio y faltan probablemente más estudios que demuestren su utilidad.
Discusión
La infección por H. pylori representa un gran impacto en la población ya que se asocia a múltiples patologías, tales como la úlcera péptica, el cáncer gástrico y patologías hematológicas, entre otras. Existe una variada disponibilidad de métodos para pesquisar la infección, ya sean invasivos, que requieren de una endoscopía digestiva alta, como no invasivos. Las pruebas diagnósticas deben elegirse tomando en consideración distintos aspectos, como la edad del paciente, antecedente de infección previa, factores de riesgo de cáncer gástrico, disponibilidad en el medio en que se encuentre el paciente y el costo, entre otros.
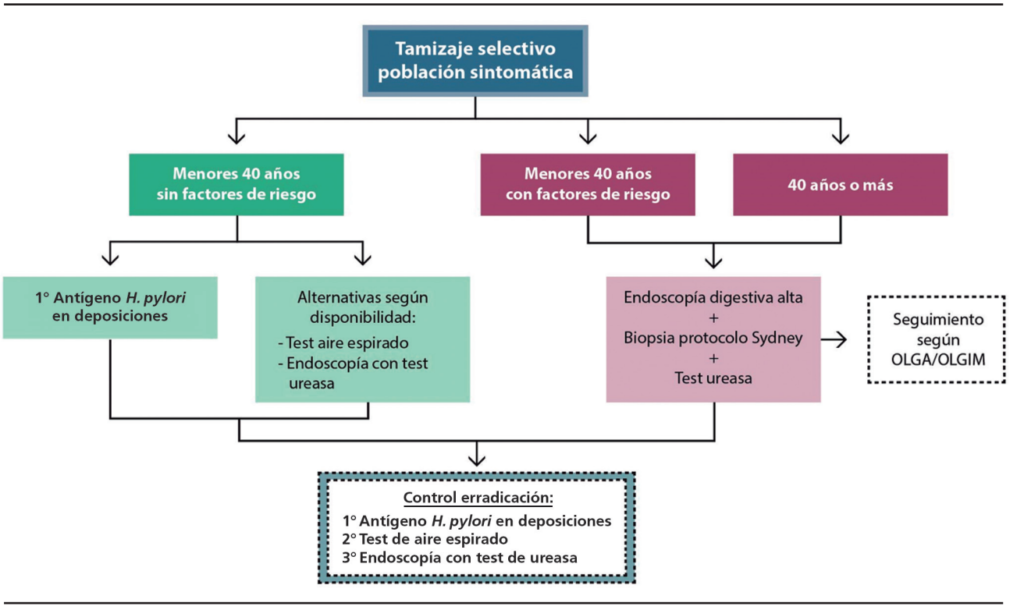
Nuestra perspectiva es que, en pacientes sintomáticos de bajo riesgo de cáncer gástrico, sin signos de alarma, menores de 40 años, pueden preferirse métodos no invasivos, como el antígeno en deposiciones70 o la prueba de aire espirado (actualmente con limitaciones por la pandemia de COVID-19). Para el control de la erradicación, también son una excelente alternativa los métodos no invasivos, salvo que el paciente tenga indicación de endoscopía digestiva alta por otra causa (por ejemplo: control de úlcera gástrica).
Si el paciente tiene síntomas o signos de alarma como disfagia, baja de peso, anemia, antecedentes familiares de primer grado de cáncer gástrico o es mayor de 40 años, se prefiere el uso de métodos invasivos, a través de la endoscopía digestiva alta con prueba rápida de ureasa y/o tinción en biopsia gástrica. Si tiene familiares con cáncer gástrico de primer grado o tiene hallazgos endoscópicos sugerentes de atrofia o metaplasia intestinal, la toma de biopsias también permite definir el seguimiento endoscópico según OLGA (Operative Link on Gastritis Assessment).71 Es importante que los pacientes que se sometan a estudios diagnósticos suspendan fármacos que pueden llevar a falsos negativos, especialmente los inhibidores de bomba de protones.11
En pacientes que han fallado a varios esquemas de tratamiento, sugerimos el uso de pruebas moleculares como PCR en tiempo real y/o cultivo, con lo que puede evaluarse la sensibilidad antibiótica (en nuestro medio, contamos con evaluación de resistencia a claritromicina y levofloxacino), lo que permitiría un tratamiento dirigido, que aumentaría el éxito terapéutico.
En la Figura 5, se muestra un esquema de tamizaje de pacientes sintomáticos, indicando el método diagnóstico que sugerimos según características particulares.
Figura 5. Métodos de diagnóstico, según el tamizaje selectivo de los pacientes de acuerdo con su edad y los factores de riesgo asociados. Adaptado.8,70
Otro escenario que puede enfrentarse en el contexto de la estrategia de testear y tratar, especialmente en estudios poblacionales, son los pacientes con serología de H. pylori positiva, lo que implica una infección actual o pasada. En este sentido, antes de considerar tratar hay que tener en cuenta si el paciente ha recibido un tratamiento previo y, si no lo ha hecho, si es posible erradicar y luego chequear la erradicación con otro método no invasivo, como antígeno en deposiciones o prueba de aire espirado (Figura 6).
Figura 6. Escenario de estudios poblacionales
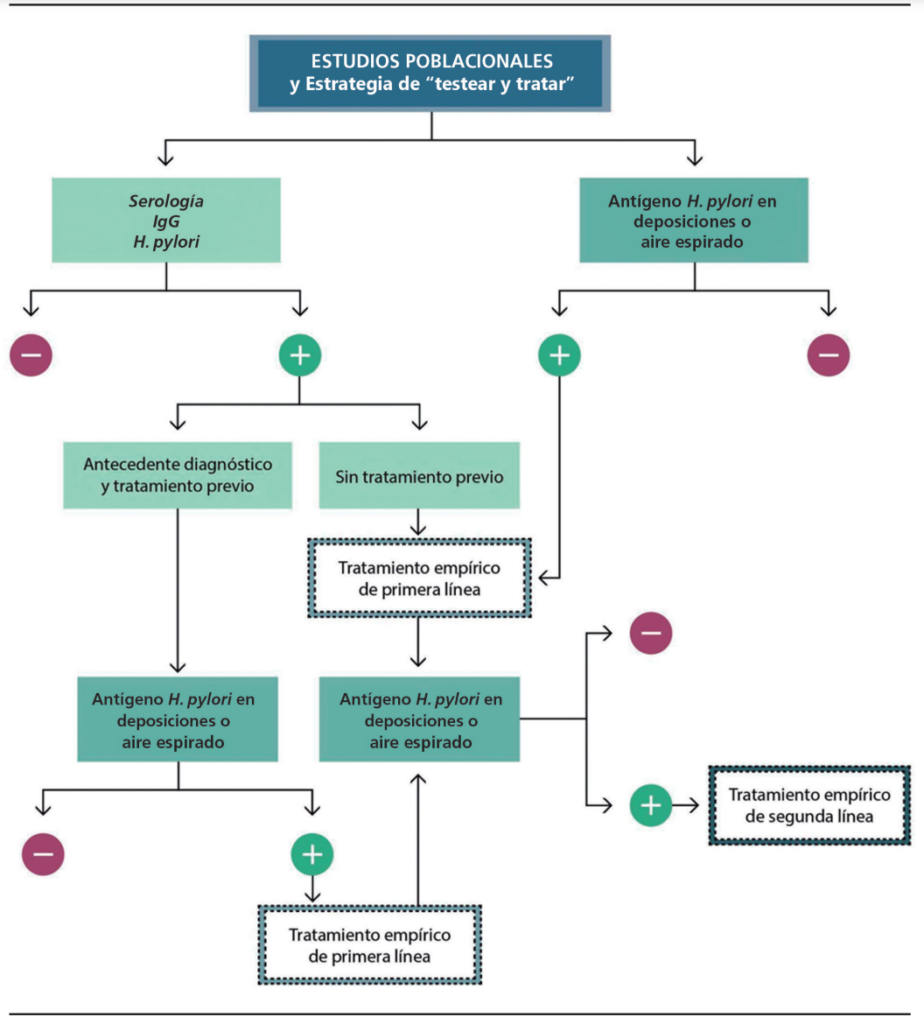
Lamentablemente, al no contar con un gold standard, tendremos que considerar que la detección de la infección puede requerir más de un método diagnóstico, lo que es de especial relevancia en pacientes que han tenido alguna complicación asociada a la infección (como úlcera péptica, por ejemplo) o que tienen riesgo aumentado de cáncer gástrico.
Agradecimientos. Agradecimiento especial a Valentina Riquelme L. Centro UC Síndrome de Down, Escuela de Medicina, Pontificia Universidad Católica de Chile, quien editó o creó las figuras e ilustraciones presentadas en el presente artículo.
Soporte financiero. Parcialmente financiado por los proyectos FONIS SA19/0188 «Cost-effectiveness of new population screening strategies for gastric cancer control in Chile», y LEGACy «CeLac and European consortium for a personalized medicine approach to Gastric Cancer» N° 825832 del programa Horizon 2020 de la Unión Europea.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y fueron realizados en las instituciones a las que pertenecen.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica latinoamericana. This is an open-access article released under the terms of the Creative Commons Attribution (CC BY-NC-SA 4.0) license, which allows non-commercial use, distribution, and reproduction, provided the original author and source are acknowledged.
Cite este artículo como: Chahuan J, Pizarro M, Riquelme A. Métodos diagnósticos para la detección de infección por Helicobacter pylori. ¿Cuál y cuándo deben solicitarse?. Acta Gastroenterol Latinoam. 2022;52(1):36-46. https://doi.org/10.52787/agl.v52i1.176
Referencias
- Correa P, Piazuelo MB. Evolutionary History of the Helicobacter pylori Genome: Implications for Gastric Carcinogenesis. Gut Liver. 2012;6(1):21-8.
- Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1(8390):1311-5.
- Watts G. Nobel prize is awarded to doctors who discovered H. pylori. BMJ. 2005;331(7520):795.
- Porras C, Nodora J, Sexton R, Ferreccio C, Jiménez S, Domínguez RL, et al. Epidemiology of Helicobacter pylori infection in six Latin American countries (SWOG Trial S0701). Cancer Causes Control. 2013;24(2):209-15.
- Hooi JKY, Lai WY, Ng WK, Suen MMY, Underwood FE, Tanyingoh D, et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017;153(2):420-9.
- Janjetic MA, Goldman CG, Barrado DA, Cueto Rua E, Balcarce N, Mantero P, et al. Decreasing trend of Helicobacter pylori infection in children with gastrointestinal symptoms from Buenos Aires, Argentina. Helicobacter. 2011;16(4):316-9.
- Olmos JA, Ríos H, Higa R. Prevalence of Helicobacter pylori infection in Argentina: results of a nationwide epidemiologic study. Argentinean Hp Epidemiologic Study Group. J Clin Gastroenterol. 2000;31(1):33-7.
- Chahuán A. J, Pizarro R. M, Díaz P. LA, Villalón F. A, Riquelme P. A. Métodos de diagnóstico para la detección de la infección por Helicobacter pylori. Gastroenterol latinoam. 2020;31(2):98-106.
- Riquelme A, editor. GASTROENTEROLOGÍA Y HEPATOLOGÍA CLÍNICA. Mediterráneo; 2020.
- Ansari S, Yamaoka Y. Survival of Helicobacter pylori in gastric acidic territory. Helicobacter [Internet]. 2017;22(4). Disponible en: http://dx.doi.org/10.1111/hel.12386
- Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6-30.
- Schöttker B, Adamu MA, Weck MN, Brenner H. Helicobacter pylori infection is strongly associated with gastric and duodenal ulcers in a large prospective study. Clin Gastroenterol Hepatol. 2012;10(5):487-93.e1.
- Ford AC, Gurusamy KS, Delaney B, Forman D, Moayyedi P. Eradication therapy for peptic ulcer disease in Helicobacter pylori-positive people. Cochrane Database Syst Rev. 2016;4:CD003840.
- Xia B, Xia HHX, Ma CW, Wong KW, Fung FMY, Hui CK, et al. Trends in the prevalence of peptic ulcer disease and Helicobacter pylori infection in family physician-referred uninvestigated dyspeptic patients in Hong Kong. Aliment Pharmacol Ther. 2005;22(3):243–9.
- Schistosomes, liver flukes and Helicobacter pylori. IARC Wor-king Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 de junio de 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241.
- Ahn HJ, Lee DS. Helicobacter pylori in gastric carcinogenesis. World J Gastrointest Oncol. 2015;7(12):455-65.
- Lee Y-C, Chiang T-H, Chou C-K, Tu Y-K, Liao W-C, Wu M-S, et al. Association Between Helicobacter pylori Eradication and Gastric Cancer Incidence: A Systematic Review and Meta-analysis. Gastroenterology. 2016;150(5):1113-24.e5.
- Asenjo LM, Gisbert JP. [Prevalence of Helicobacter pylori infection in gastric MALT lymphoma: a systematic review]. Rev Esp Enferm Dig. 2007;99(7):398-404.
- Montalban C, Norman F. Treatment of gastric mucosa-associated lymphoid tissue lymphoma: Helicobacter pylori eradication and beyond. Expert Rev Anticancer Ther. 2006;6(3):361-71.
- Frydman GH, Davis N, Beck PL, Fox JG. Helicobacter pylori Eradication in Patients with Immune Thrombocytopenic Purpura: A Review and the Role of Biogeography. Helicobacter. 2015;20(4):239-51.
- Kim BJ, Kim HS, Jang HJ, Kim JH. Helicobacter pylori Eradication in Idiopathic Thrombocytopenic Purpura: A Meta-Analysis of Randomized Trials. Gastroenterol Res Pract. 2018;2018:6090878.
- Hudak L, Jaraisy A, Haj S, Muhsen K. An updated systematic review and meta-analysis on the association between Helicobacter pylori infection and iron deficiency anemia. Helicobacter [Internet]. 2017;22(1). Disponible en: http://dx.doi.org/10.1111/hel.12330
- Ko CW, Siddique SM, Patel A, Harris A, Sultan S, Altayar O, et al. AGA Clinical Practice Guidelines on the Gastrointestinal Evaluation of Iron Deficiency Anemia. Gastroenterology. 2020;159(3):1085-94.
- Campuzano-Maya G. Hematologic manifestations of Helicobacter pylori infection. World J Gastroenterol. 2014;20(36):12818-38.
- Gravina AG, Priadko K, Ciamarra P, Granata L, Facchiano A, Miranda A, et al. Extra-Gastric Manifestations of Helicobacter pylori Infection. J Clin Med Res [Internet]. 2020;9(12). Disponible en:: http://dx.doi.org/10.3390/jcm9123887
- Villalón F A, Reyes P D, Ortiz O J, Gándara F V, Díaz P LA, Chahuán A J, et al. Tratamiento y manejo de la infección por Helicobacter pylori. Gastroenterol latinoam. 2020;(3):136-46.
- Harris D P, Serrano H C, González F CG. Utilidad del diagnóstico serológico de la infección por Helicobacter pylori en niños. Rev Chil Pediatr. 2005;76(3):241-51.
- Lindsetmo R-O, Johnsen R, Eide TJ, Gutteberg T, Husum HH, Revhaug A. Accuracy of Helicobacter pylori serology in two peptic ulcer populations and in healthy controls. World J Gastroenterol. 2008;14(32):5039-45.
- Wilcox MH, Dent TH, Hunter JO, Gray JJ, Brown DF, Wight DG, et al. Accuracy of serology for the diagnosis of Helicobacter pylori infection–a comparison of eight kits. J Clin Pathol. 1996;49(5):373-6.
- Burucoa C, Delchier J-C, Courillon-Mallet A, de Korwin J-D, Mégraud F, Zerbib F, et al. Comparative evaluation of 29 commercial Helicobacter pylori serological kits. Helicobacter. 2013;18(3):169-79.
- Gisbert JP, de la Morena F, Abraira V. Accuracy of monoclonal stool antigen test for the diagnosis of H. pylori infection: a systematic review and meta-analysis. Am J Gastroenterol. 2006;101(8):1921-30.
- Atkinson NSS, Braden B. Helicobacter pylori Infection: Diagnostic Strategies in Primary Diagnosis and After Therapy. Dig Dis Sci. 2016;61(1):19-24.
- Best LMJ, Takwoingi Y, Siddique S, Selladurai A, Gandhi A, Low B, et al. Non-invasive diagnostic tests for Helicobater pylori infection. Cochrane Database Syst Rev [Internet]. 2018 [citado el 2 de junio de 2022];(3). Disponible en: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012080.pub2/full
- Kodama M, Murakami K, Okimoto T, Fukuda Y, Shimoyama T, Okuda M, et al. Influence of proton pump inhibitor treatment on Helicobacter pylori stool antigen test. World J Gastroenterol. 2012;18(1):44-8.
- Savarino V, Vigneri S, Celle G. The 13C urea breath test in the diagnosis of Helicobacter pylori infection. Gut. 1999;45(1):I18-22.
- Ferwana M, Abdulmajeed I, Alhajiahmed A, Madani W, Firwana B, Hasan R, et al. Accuracy of urea breath test in Helicobacter pylori infection: meta-analysis. World J Gastroenterol. 2015;21(4):1305-14.
- Beresniak A, Malfertheiner P, Franceschi F, Liebaert F, Salhi H, Gisbert JP. Helicobacter pylori “Test-and-Treat” strategy with urea breath test: A cost-effective strategy for the management of dyspepsia and the prevention of ulcer and gastric cancer in Spain-Results of the Hp-Breath initiative. Helicobacter. 2020;25(4):e12693.
- Siah KTH, Rahman MM, Ong AML, Soh AYS, Lee YY, Xiao Y, et al. The Practice of Gastrointestinal Motility Laboratory During COVID-19 Pandemic: Position Statements of the Asian Neurogastroenterology and Motility Association (ANMA-GML-COVID-19 Position Statements). J Neurogastroenterol Motil. 2020;26(3):299-310.
- Graham DY, Opekun AR, Hammoud F, Yamaoka Y, Reddy R, Osato MS, et al. Studies regarding the mechanism of false negative urea breath tests with proton pump inhibitors. Am J Gastroenterol. 2003;98(5):1005-9.
- Urita Y, Hike K, Torii N, Kikuchi Y, Kanda E, Kurakata H, et al. Breath sample collection through the nostril reduces false-positive results of 13C-urea breath test for the diagnosis of Helicobacter pylori infection. Dig Liver Dis. 2004;36(10):661-5.
- Osaki T, Mabe K, Hanawa T, Kamiya S. Urease-positive bacteria in the stomach induce a false-positive reaction in a urea breath test for diagnosis of Helicobacter pylori infection. J Med Microbiol. 2008;57(Pt 7):814-9.
- Attumi TA, Graham DY. Follow-up Testing After Treatment of Helicobacter pylori Infections: Cautions, Caveats, and Recommendations. Clin Gastroenterol Hepatol. 2011;9(5):373-5.
- Uotani T, Graham DY. Diagnosis of Helicobacter pylori using the rapid urease test. Ann Transl Med. 2015;3(1):9.
- Patel SK, Pratap CB, Jain AK, Gulati AK, Nath G. Diagnosis of Helicobacter pylori: what should be the gold standard? World J Gastroenterol. 2014;20(36):12847-59.
- Moon SW, Kim TH, Kim HS, Ju J-H, Ahn YJ, Jang HJ, et al. United Rapid Urease Test Is Superior than Separate Test in Detecting Helicobacter pylori at the Gastric Antrum and Body Specimens. Clin Endosc. 2012;45(4):392-6.
- Said RM, Cheah P-L, Chin S-C, Goh K-L. Evaluation of a new biopsy urease test: Pronto Dry, for the diagnosis of Helicobacter pylori infection. Eur J Gastroenterol Hepatol. 2004;16(2):195-9.
- Jeon J-S, Kim JK, Kim G-Y. Detection of clarithromycin-resistant Helicobacter pylori by polymerase chain reaction using residual samples from rapid urease test. Indian J Med Microbiol. 2017;35(3):406-9.
- Kuo C-H, Wu D-C, Lu C-Y, Su Y-C, Yu F-J, Lee Y-C, et al. The media of rapid urease test influence the diagnosis of Helicobacter pylori. Hepatogastroenterology. 2002;49(47):1191-4.
- Redéen S, Petersson F, Törnkrantz E, Levander H, Mårdh E, Borch K. Reliability of Diagnostic Tests for Helicobacter pylori Infection. Gastroenterol Res Pract. 2011;2011:940650.
- Lee JM, Breslin NP, Fallon C, O’Morain CA. Rapid urease tests lack sensitivity in Helicobacter pylori diagnosis when peptic ulcer disease presents with bleeding. Am J Gastroenterol. 2000;95(5):1166-70.
- Yakoob J, Jafri W, Abid S, Jafri N, Abbas Z, Hamid S, et al. Role of rapid urease test and histopathology in the diagnosis of Helicobacter pylori infection in a developing country. BMC Gastroenterol. 2005;5:38.
- Alkhamiss AS. Evaluation of Better Staining Method among Hematoxylin and Eosin, Giemsa and Periodic Acid Schiff-Alcian Blue for the Detection of Helicobacter pylori in Gastric Biopsies. Malays J Med Sci. 2020;27(5):53-61.
- Fallone CA, Loo VG, Lough J, Barkun AN. Hematoxylin and eosin staining of gastric tissue for the detection of Helicobacter pylori. Helicobacter. 1997;2(1):32-5.
- Laine L, Lewin DN, Naritoku W, Cohen H. Prospective comparison of H&E, Giemsa, and Genta stains for the diagnosis of Helicobacter pylori. Gastrointest Endosc. 1997;45(6):463-7.
- Boldt MS, Pereira RD, Barbosa AJA. Histological identification of H. pylori stained by hematoxylin-eosin and Giemsa: review for quality control. J Bras Patol Med Lab. 2015;51(2):108-12.
- Crowe SE. Helicobacter pylori Infection. N Engl J Med. 2019;380(12):1158-65.
- Lee JY, Kim N. Diagnosis of Helicobacter pylori by invasive test: histology. Ann Transl Med. 2015;3(1):10.
- Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol. 1996;20(10):1161-81.
- Peixoto A, Silva M, Pereira P, Macedo G. Biopsies in Gastrointestinal Endoscopy: When and How. GE Port J Gastroenterol. 2016;23(1):19-27.
- Jonkers D, Stobberingh E, de Bruine A, Arends JW, Stockbrügger R. Evaluation of immunohistochemistry for the detection of Helicobacter pylori in gastric mucosal biopsies. J Infect. 1997;35(2):149-54.
- Pohl D, Keller PM, Bordier V, Wagner K. Review of current diagnostic methods and advances in Helicobacter pylori diagnostics in the era of next generation sequencing. World J Gastroenterol. 2019;25(32):4629-60.
- Pilotto A, Rassu M, Leandro G, Franceschi M, Di Mario F, Interdisciplinary Group for the Study of Ulcer. Prevalence of Helicobacter pylori resistance to antibiotics in Northeast Italy: a multicentre study. GISU. Interdisciplinary Group for the Study of Ulcer. Dig Liver Dis. 2000;32(9):763-8.
- Destura RV, Labio ED, Barrett LJ, Alcantara CS, Gloria VI, Daez MLO, et al. Laboratory diagnosis and susceptibility profile of Helicobacter pylori infection in the Philippines. Ann Clin Microbiol Antimicrob. 2004;3:25.
- Loffeld RJ, Stobberingh E, Flendrig JA, Arends JW. Helicobacter pylori in gastric biopsy specimens. Comparison of culture, modified giemsa stain, and immunohistochemistry. A retrospective study. J Pathol. 1991;165(1):69–73.
- Grove DI, Koutsouridis G, Cummins AG. Comparison of culture, histopathology and urease testing for the diagnosis of Helicobacter pylori gastritis and susceptibility to amoxycillin, clarithromycin, metronidazole and tetracycline. Pathology. 1998;30(2):183-7.
- Bénéjat L, Ducournau A, Lehours P, Mégraud F. Real-time PCR for Helicobacter pylori diagnosis. The best tools available. Helicobacter. 2018;23(5):e12512.
- Jehanne Q, Bénéjat L, Mégraud F, Bessède E, Lehours P. Evaluation of the AllplexTM H. pylori and ClariR PCR Assay for Helicobacter pylori detection on gastric biopsies. Helicobacter. 2020;25(4):e12702.
- Mansilla-Vivar R, Serrano CA, Palma C, Vera M, Hernandez C, Pizarro M, et al. High Helicobacter pylori Bacterial Load and Low Cytokine Expression Levels Are Associated with Nodular Gastropathy. Dig Dis Sci. 2020;65(2):565-75.
- Pichon M, Pichard B, Barrioz T, Plouzeau C, Croquet V, Fotsing G, et al. Diagnostic Accuracy of a Noninvasive Test for Detection of Helicobacter pylori and Resistance to Clarithromycin in Stool by the Amplidiag H. pylori+ClariR Real-Time PCR Assay. J Clin Microbiol [Internet]. 2020;58(4). Disponible en: http://dx.doi.org/10.1128/JCM.01787-19
- Coppelli L, Díaz LA, Riquelme A, Waeger C, Rollán A, Bellolio E, et al. [Protocolized referral to endoscopy and Helicobacter pylori detected in stools aimed to decrease endoscopy waiting lists]. Rev Med Chil. 2019;147(11):1382-9.
- Rollán A, Cortés P, Calvo A, Araya R, Bufadel ME, González R, et al. Diagnóstico precoz de cáncer gástrico: Propuesta de detección y seguimiento de lesiones premalignas gástricas: protocolo ACHED. Revista Médica de Chile. 2014;142(9):1181-92.
Correspondencia: Arnoldo Riquelme
Correo electrónico: a.riquelme.perez@gmail.com
Acta Gastroenterol Latinoam 2022;52(1):000-000
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE