Michelle Higuera-Carrillo1 ID Silvana Dadán1 ID· Jhon Camacho-Cruz2 ID· Wilson Daza-Carreño1 ID
1 Departamento de Gastroenterología Pediatríca, Grupo de Investigación Gastronutriped, Unidad de Gastroenterología, Hepatología y Nutrición Pediátrica- Gastronutriped, Bogotá, D.C., Colombia.
2 Departamento de Pediatría, Fundación Universitaria de Ciencias de la Salud (FUCS) – Hospital de San José – Sociedad de Cirugía de Bogotá y Fundación Universitaria Sanitas – Clinica Pediatrica Grupo Keralty.
Bogotá, D.C., Colombia.
Acta Gastroenterol Latinoam 2021;51(4):404-412
Recibido: 13/06/2021 / Aceptado: 16/11/2021 / Publicado en www.actagastro.org el 13/12/2021 / https://doi.org/10.52787/SDEE3831
Resumen
La calprotectina fecal es un biomarcador del estado inflamatorio intestinal, que podría ser útil en pediatría como una prueba no invasiva para la diferenciación de trastornos gastrointestinales orgánicos y funcionales. Objetivo. El objetivo de este estudio fue describir los niveles de calprotectina fecal en niños con trastornos gastrointestinales en Colombia. Materiales y métodos. Estudio observacional descriptivo, retrospectivo, de pacientes que consultaron a una unidad de gastroenterología en Colombia, entre 2012 y 2019. Se analizaron datos sociodemográficos, el diagnóstico gastrointestinal, el estado nutricional y los valores de calprotectina fecal. Se realizó una exploración analítica usando un análisis bivariado. Resultados. Se estudiaron 217 pacientes, la mediana de edad fue 20 meses. Ciento cincuenta y seis (72,35%) pacientes presentaron algún trastorno gastrointestinal orgánico, destacándose alergia alimentaria en 106 (46,84%), seguida por síndrome postenteritis en 11 (5,07%). La mediana de la calprotectina fecal fue de 98 µg/g. El 30,41% de los pacientes presentaron calprotectina fecal negativa; 21,2% elevación leve, 17,05% elevación moderada y 31,34% elevación severa. La mediana de la calprotectina fecal en alergia alimentaria fue de 149 µg/g y 198 µg/g en síndrome postenteritis. El grupo con trastornos gastrointestinales funcionales presentó una mediana de calprotectina fecal menor en comparación con la de trastornos gastrointestinales orgánicos (p = 0.0094). Ciento catorce pacientes (52,53%) tuvieron desnutrición, 94 (43,32%) fueron eutróficos y 9 (4%) presentaron sobrepeso, sin diferencias significativas en sus valores de calprotectina fecal. Conclusiones. Los valores de calprotectina fecal en trastornos gastrointestinales orgánicos fueron más altos con relación a los de trastornos gastrointestinales funcionales. Los niveles de calprotectina fecal podrían resultar útiles para diferenciar patologías gastrointestinales funcionales de entidades orgánicas.
Palabras claves. Calprotectina fecal, enfermedades gastrointestinales, pediatría.
Fecal Calprotectin in Gastrointestinal Pathology in Colombian Children: an Observational Study
Summary
Fecal calprotectin is an intestinal biomarker of the intestinal inflammatory state, which could be useful in pediatrics as a non-invasive test for the differentiation of organic and functional gastrointestinal disorders. Objective. The objective of this study was to describe the levels of fecal calprotectin in children with gastrointestinal disorders in Colombia. Materials and methods. Descriptive, retrospective, observational study of patients who consulted a gastroenterology clinic in Colombia between 2012 and 2019. Sociodemographic data, gastrointestinal diagnosis, nutritional status and fecal calprotectin values were analyzed. An analytical exploration was performed using a bivariate analysis. Results. 217 patients were studied, the median age was 20 months. 156 (72.35%) patients presented some organic disease, food allergy 106 (46.84%), followed by post-enteritis syndrome 11 (5.07%). The median fecal calprotectin was 98 µg/g, 30.41% of the patients had negative fecal calprotectin; 21.2% mild elevation, 17.05% moderate elevation, and 31.34% severe elevation. The median fecal calprotectin in food allergy was 149 µg/g and 198 µg/g in post-enteritis syndrome. The functional gastrointestinal disorders group presented a lower median calprotectina fecal compared to organic gastrointestinal disorders (p = 0.0094). 114 patients (52.53%) had malnutrition, 94 (43.32%) were eutrophic and 9 (4%) were overweight, without significant differences in their fecal calprotectin values. Conclusions. The fecal calprotectin values in organic gastrointestinal pathology were higher in relation to those functional. The levels of fecal calprotectin could be useful to differentiate functional gastrointestinal pathologies from organic entities.
Keywords. Fecal calprotectin, gastrointestinal diseases, pediatrics.
Abreviaturas
TGIF: Trastornos gastrointestinales funcionales.
TGI: Trastornos gastrointestinales.
CPF: Calprotectina fecal.
TGIO: Trastornos gastrointestinales orgánicos.
EII: Enfermedad inflamatoria intestinal.
GASTRINUTRIPED: Hepatología y nutrición pediátrica.
AA: Alergia alimentaria.
WAO: World Allergy Organization.
RIQ: Rango intercuartil 25-75.
APLV: Alergia a proteína de leche de vaca.
FQ: Fibrosis quística.
ESPGHAN: Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica.
Introducción
Las enfermedades gastrointestinales constituyen un motivo de consulta frecuente en pediatría.1 Los síntomas gastrointestinales pueden ser secundarios a trastornos orgánicos (menos del 20%), o a trastornos gastrointestinales funcionales (TGIF), según los criterios de Roma IV.1-3
Cuando los trastornos gastrointestinales (TGI) cursan con inflamación intestinal, se requieren procedimientos invasivos, tales como endoscopías, biopsias y pruebas de sangre, para poder confirmar el diagnóstico.3-4 Dichos procedimientos aumentan los costos y la morbimortalidad. También, hay pruebas no invasivas, como la calprotectina fecal (CPF) que, si bien es un marcador no específico, puede estar elevado en trastornos gastrointestinales orgánicos (TGIO) y TGIF. Por lo anterior, las pruebas diagnósticas no invasivas se convierten en una alternativa deseable para el apoyo del clínico y para orientar o confirmar la sospecha diagnóstica.4-5
La CPF es una proteína citosólica de los granulocitos, con propiedades inmunomoduladoras, antimicrobianas y antiproliferativas.3 Constituye el 60% del componente proteico del citosol de los neutrófilos y su presencia en fluidos corporales indica la degranulación de estos por daño celular.4-7 Es un biomarcador estable y sensible del estado inflamatorio intestinal, y resulta de gran utilidad para el seguimiento de algunas patologías de origen inflamatorio y para predecir las recaídas.5-6 Por lo mencionado, podría convertirse en una prueba no invasiva ante la sospecha diagnóstica de los síntomas gastrointestinales en pediatría, para poder detectar patologías diferentes de la enfermedad inflamatoria intestinal (EII).8
El objetivo de este estudio fue describir el comportamiento de los niveles de CPF al momento del diagnóstico de diferentes patologías gastrointestinales y establecer si existen diferencias entre TGIO y TGIF, además del estado nutricional en pacientes que asistieron a un centro ambulatorio de gastroenterología, hepatología y nutrición pediátrica en Colombia.
Materiales y métodos
Diseño de estudio
Se realizó un estudio observacional descriptivo y de corte transversal. Se incluyeron pacientes menores de 18 años que consultaron al centro ambulatorio de gastroenterología, hepatología y nutrición pediátrica (GASTRONUTRIPED), en Bogotá, Colombia.
Selección de casos
Se realizó un muestreo por conveniencia de los casos que cumplieron con los criterios de inclusión. Se revisó la base de datos de pacientes atendidos entre 2012 y 2019 y a quienes se les había solicitado la CPF como parte del esquema diagnóstico. Posteriormente, se seleccionaron las historias clínicas de los pacientes que cumplieron con los criterios de inclusión. Se extrajeron los datos necesarios a una base con la selección del 10% de los registros. Se evaluaron variables sociodemográficas y diagnósticos definitivos, clasificados, según su origen, en orgánico o funcional (acorde con los criterios ROMA IV). Las entidades orgánicas como la alergia alimentaria (AA), definida como una reacción de hipersensibilidad iniciada por mecanismos inmunitarios específicos frente a antígenos de los alimentos, se clasificó según la World Allergy Organization (WAO) y la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica. Además, el síndrome postenteritis se definió como la persistencia de la diarrea por más de quince días, posterior a un episodio agudo de gastroenteritis. La CPF se midió en el mismo laboratorio, bajo la técnica de inmunoensayo enzimático (RIDASCREEN®), y se clasificó según la guía NICE en negativa (< 50 µg/g), leve (50-100 µg/g), moderada (101-200 µg/g) y severa (> 200 µg/g). Se evaluó el estado nutricional acorde con parámetros antropométricos usando WHO Anthro, bajo los indicadores W/H (< 2 years of age) or BMI (> 2 years of age). Se excluyeron pacientes con diagnóstico inconcluso e historias clínicas incompletas.
Análisis estadístico
Se realizó un análisis descriptivo de la información en STATA 13®; las variables cualitativas se presentaron con frecuencias absolutas y relativas; las variables continuas se describieron con medida de tendencia central, y su respectiva medida de dispersión según la distribución de los datos, y las variables categóricas, mediante proporciones. Para comparar las variables categóricas se usó prueba de chi2 y test exacto de Fisher; para las continuas se utilizaron los test de Mann Whitney y Kruskal-Wallis como prueba no paramétrica. Este estudio fue presentado y aprobado por el Comité Institucional de Investigación, basado en la resolución 2378 de 2008 del Ministerio de la Protección Social para las investigaciones con seres humanos.
Resultados
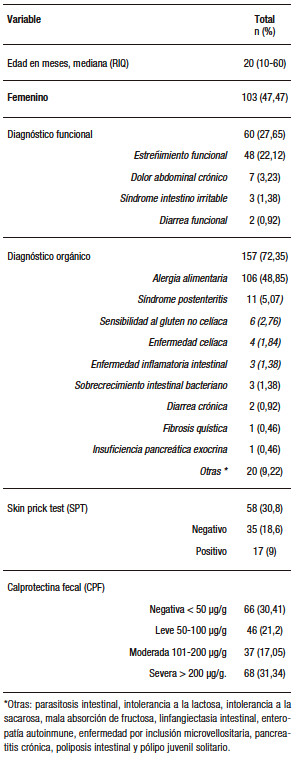
Doscientos diecisiete pacientes tenían consignados los valores de CPF al diagnóstico, y la mediana de edad fue de veinte meses (RIQ 10-60). Las características sociodemográficas se presentan en la Tabla 1. Según el origen, el 72% de los pacientes presentó algún TGIO; la AA fue la entidad más común (49%; 106/217), seguida por el síndrome postenteritis en un 5% (11/217). Dentro de los TGIF, el estreñimiento funcional (EF) se presentó en el 22% (48/217).
Tabla 1. Características clínicas y demográficas de los pacientes con CPF en Gastronutriped, Colombia, 2012-2019.
La mediana de CPF en la muestra total fue de 98 µg/g (RIQ 35-280 µg/g). El 30,41% tuvo CPF negativa. De los pacientes con CPF positiva (> 50 µg/g), 21% en nivel leve, 17% en nivel moderado y 31% en nivel severo. Respecto de la expresión clínica de AA y su valor de CPF, se presenta en la Tabla 2, y en la Tabla 3 se muestran los valores de CPF según los diferentes TGIO y TGIF.
Tabla 2. Niveles de CPF de acuerdo con la expresión clínica de los pacientes con alergia alimentaria. Gastronutriped, Colombia, 2012 -2019.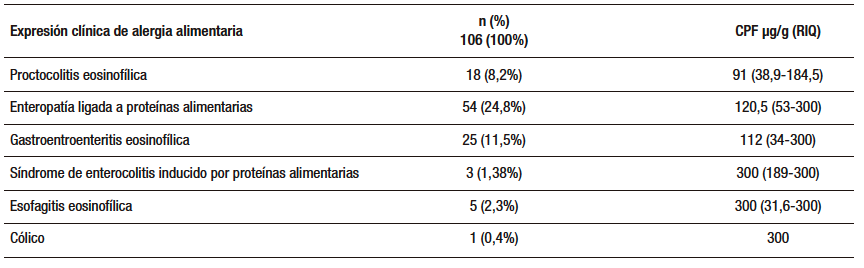
Tabla 3. Niveles de CPF de acuerdo con cada patología. Gastronutriped, Colombia, 2012 -2019.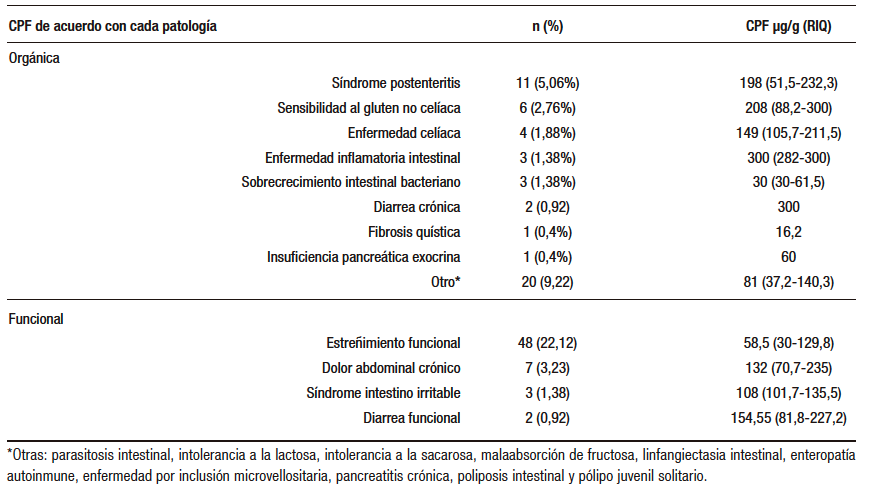
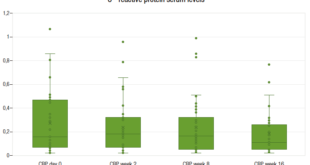
Al comparar los diagnósticos según su origen, el 74% de los pacientes con TGIO tuvieron CPF anormal vs. el 58% en pacientes con TGIF, siendo esta diferencia estadísticamente significativa (p = 0,032) (Figura 1).
Para el grupo con TGIF la mediana de valor de CPF fue de 73,5 µg/g (RIQ 30-139 µg/g) y para el grupo
con TGIO la mediana de CPF fue de 112 µg/g (RIQ 45, 7-300 µg/g), siendo esta diferencia estadísticamente significativa (p = 0,0094).
Figura 1. Niveles de calprotectina fecal en trastornos gastrointestinales funcionales vs. trastornos gastrointestinales orgánicos en Gastronutriped, Colombia, 2012-2019.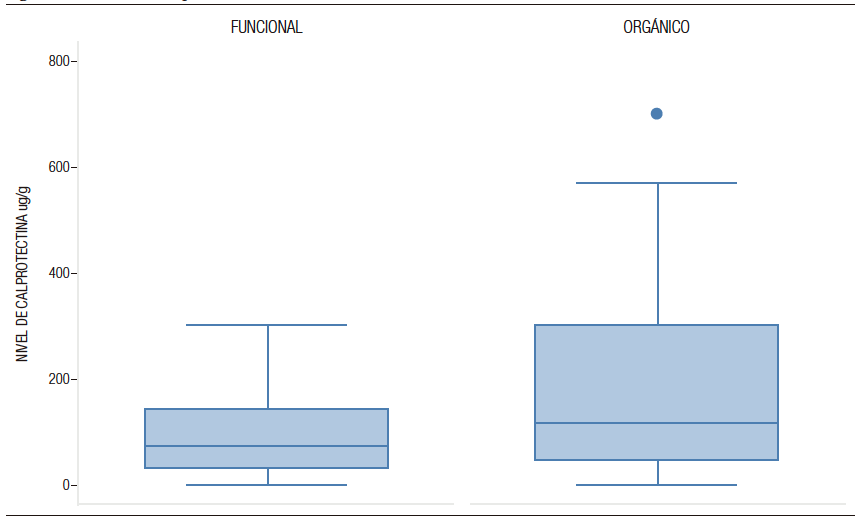
El 53% (n=114) de los pacientes presentó desnutrición, el 43% (n=94) estado nutricional normal y un 4% (n=9) presentaron exceso de peso (Figura 2). En pacientes con desnutrición la mediana de CPF fue de 92 µg/g, de 102,5 µg/g en eutróficos y de 257 µg/g en pacientes con sobrepeso. No hubo diferencias estadísticamente significati-vas entre los niveles de CPF y el estado nutricional (p = 0,450).
Figura 2. Niveles de calprotectina fecal según estado nutricional en pacientes de Gastronutriped, Colombia, 2012-2019.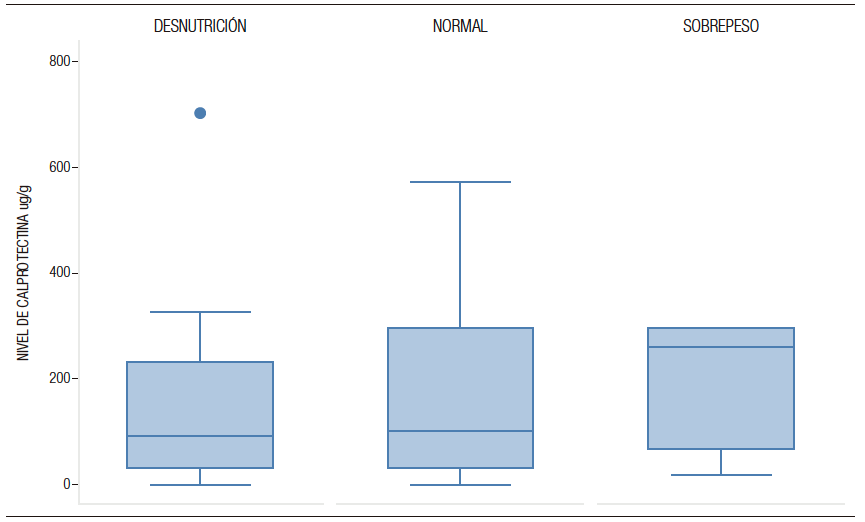
Discusión
Los niveles de calprotectina están elevados en tejidos con procesos inflamatorios, y pareciera existir una correlación entre el grado de inflamación y los niveles de CPF.5-6 La inflamación de la mucosa intestinal, independientemente de la causa que la origine, produce un aumento en la permeabilidad de las membranas, con la consiguiente activación y migración de leucocitos, con lesión y muerte celular, y la consecuente liberación de calprotectina hacia el lumen intestinal.5-6 La unión de la calprotectina con calcio le confiere una gran estabilidad ante cambios de temperatura y pH, manteniéndola detectable hasta por siete días, lo cual la emplaza como un marcador de inflamación ideal.5-6
La CPF se ha estudiado ampliamente como marcador de actividad y recaída en EII tanto en niños como en adultos.7-19 Los resultados establecen una sensibilidad del 100% y una especificidad del 67% en niños con EII5 y una sensibilidad de 94-100% y una especificidad de 71,8-100% en adultos con EII.20 Asimismo, se ha encontrado una alta correlación entre sus valores y los hallazgos endoscópicos e histológicos, que sustenta el uso de esta prueba para el monitoreo de pacientes con EII.7-10, 17 Otras condiciones pueden elevar la CPF, tales como la fibrosis quística, la gastroenteritis, la artritis reumatoide, las infecciones bacterianas, las neoplasias y el uso de antinflamatorios no esteroideos.10,16, 21-23 De hecho, se han encontrado diferencias entre los valores de CPF y el origen de la enfermedad gastrointestinal, ya sea orgánica o funcional. Estos hallazgos podrían sugerir que los niveles de CPF permiten diferenciar los TGIO de los TGIF.5-7 La edad es un factor que podría influir sobre los valores de la CPF. En estudios realizados previamente, se ha documentado que los niveles de CPF son mayores a menor edad24 y, asimismo, los valores de CPF son similares en los lactantes con TGIF (cólico infantil) y los lactantes sanos.21 Lo anterior sustentaría que los lactantes (0-12 meses de edad) tendrían niveles de CPF más altos debido al proceso de maduración del intestino, inversamente proporcional a la permeabilidad de la mucosa.21-25 Es decir, a menor madurez gastrointestinal, mayor permeabilidad, mayor respuesta inflamatoria. Lo mencionado es confirmado por un estudio en niños sanos, en el que la media de CPF fue de 192 μg/g entre 1 y 6 meses de edad, 72 μg/g entre los 6 y 12 meses, 47 μg/g entre 1 y 2 años, 31 μg/g entre los 2 y 3 años, y 36 μg/g entre los 3 y 4 años.26 En este mismo estudio,26 no se encontraron valores elevados de CPF en menores de un año de edad con síntomas gastrointestinales al compararlos con lactantes sanos menores de 1 año de edad, aunque hubo valores superiores de CPF respecto de la media de pacientes sanos en los grupos de 1-2 años y de 2-3 años de edad.26 Li y colaboradores27 tuvieron hallazgos similares en pacientes sanos de 1-18 meses. Un estudio noruego consideró que los valores menores a 100 μg/g de CPF eran normales para los niños de entre 4 y 8 años, y los menores de 50 μg/g lo eran para los niños de entre 8 y 15 años de edad.3 Sin embargo, Bourdillon argumenta que la mayoría de los estudios en niños tienen una limitación por la baja especificidad de la CPF determinada por su variación biológica según edad, factores madurativos del intestino y por la falta de estandarización de los puntos de corte.28 En enfermedades orgánicas, principalmente en EII, se ha encontrado una correlación entre los valores elevados de CPF y los hallazgos histológicos y endoscópicos anormales.8, 23, 30 Olafsdottir, 21 Bonnin,4 Flagstad3 y Komraus15 postularon el uso de la CPF como marcador para medir el nivel de inflamación intestinal, que ayude a diferenciar la patología orgánica de aquella que puede ser funcional. Rodríguez31 y El-Badry32 documentaron valores más altos de CPF en pacientes con otras enfermedades orgánicas diferentes a EII. No obstante, si bien algunos estudios han demostrado diferentes niveles de elevación de CPF en diversas entidades, los resultados no han sido concluyentes.30-34
Teniendo en cuenta lo expuesto y las controversias suscitadas, debería evaluarse si los pacientes con patología digestiva que cursan con inflamación podrían tamizarse según los valores de CPF, que es una prueba de bajo costo y no invasiva. De esta manera, podrían seleccionarse mejor aquellos pacientes que realmente requerirán procedimientos invasivos confirmatorios.3,4,23 En los pacientes con TGIF, Flagstad3 y Bonnin4 no encontraron elevación significativa de la CPF, hallazgo que concuerda con los resultados del presente estudio. Olafsdottir21 analizó los niveles de CPF en pacientes con cólico infantil y no halló diferencias significativas con los valores de niños sanos y de aquellos con intolerancia transitoria a la lactosa. Oord y Hornung26 compararon 75 muestras de pacientes sanos con 157 muestras de pacientes enfermos, encontrando elevaciones por encima del percentil 97 solo en pacientes con EII severa. En este estudio no se midió CPF en pacientes con cólico infantil, y respecto del síndrome de intestino irritable, los pacientes tuvieron valores elevados de CPF, aunque con valores inferiores a los especificados previamente para EII, hallazgo que confirmó Olafsdottir.21
Respecto del estreñimiento, la Sociedad Europea de Gastroenterología, Hepatología y Nutrición pediátrica (ESPGHAN, por sus siglas en inglés) analizó varios estudios sobre el uso de CPF en desórdenes pediátricos. Los resultados obtenidos en muestras de heces de cien niños de 5 a 17 años no mostraron diferencias en los niveles de CPF entre controles sanos y niños con estreñimiento. Ninguno de estos pacientes tuvo la CPF en más de 200 mcg/g,35-37 lo que concuerda con los resultados de nuestro estudio. La posición de ESPGHAN 2021 considera que los niveles de CPF en la mayoría de los niños con estreñimiento funcional no son diferentes de los controles, y recomienda que no debe utilizarse la CPF para diferenciar el estreñimiento funcional del estreñimiento orgánico.35
La CPF se ha usado para el seguimiento de pacientes con AA, específicamente con alergia a proteína de leche vaca (APLV). La CPF podría ser útil para su diagnóstico, en especial en alergias no mediadas por IgE, caracterizadas por manifestaciones tardías e inespecíficas. Sin embargo, los resultados son contradictorios.33 Un estudio realizado por Beser33 en pacientes con APLV, principalmente mediada por IgE, mostró niveles más altos de CPF respecto de sus controles, sin ser estadísticamente significativos. Durante el seguimiento, observaron una disminución de los valores posterior al inicio del tratamiento médico. En el presente estudio, cerca de la mitad de la muestra estuvo conformada por pacientes con diagnóstico de AA de diferentes expresiones clínicas, con predominio de manifestación no IgE. Los valores más altos de CPF se encontraron en el grupo con AA y, particularmente, en el subgrupo con enteropatía alérgica. Como no se tuvo grupo control (pacientes sanos) ni mediciones subsiguientes, no fue posible comparar el impacto del tratamiento sobre los niveles de CPF. Este podría ser un estudio interesante a realizar en el futuro.
Komraus y colaboradores15 midieron CPF en pacientes con colitis eosinofílica, sin hallar aumento estadísticamente significativo. En nuestro estudio, encontramos valores superiores al punto de corte de referencia (menos de 50 µg /g) en pacientes con proctocolitis eosinofílica, aunque no fueron valores estadísticamente significativos diferentes con respecto a otros tipos de AA. Con respecto a la fibrosis quística (FQ), Garg observó diferencias significativas entre los niveles de CPF de pacientes con FQ y los de una población control de 0 a 10 años de edad. La CPF en FQ fue significativamente menor que los controles sanos de 0 a 1 año y se demostró una tendencia ascendente hasta los 4 años. En el grupo de 4-10 años de edad, la CPF fue consistentemente más alta en pacientes con FQ vs. los controles. No se encontraron diferencias entre el género, lo cual había sido descrito previamente por otros autores,21 y finalmente, Liu y colaboradores compararon niños sanos de áreas rural y urbana y documentaron que los pacientes del área rural tenían un estado nutricional más afectado respecto de los del área urbana, así como niveles más elevados de CPF.38 En el presente estudio no se encontraron diferencias de los valores de CPF según el estado nutricional de los pacientes (normal, desnutrición, sobrepeso).
Dentro de las limitaciones de nuestro estudio, encontramos que este se desarrolló en un solo centro de gastroenterología pediátrica y que, al tratarse de un estudio retrospectivo, la recolección de datos se realizó sobre la base de la historia clínica. Además, se empleó solo una técnica de laboratorio para la determinación de CPF (RIDASCREEN®), aunque se ha comparado la efectividad de tres kits de CPF diferentes (Quantum Blue®, EliA™ y RIDASCREEN®) para el diagnóstico inicial en pacientes con sospecha de EII, concluyendo que las precisiones generales de los tres kits son comparables.39
Conclusión
La CPF es un marcador no invasivo de inflamación intestinal, que es utilizada como una prueba para el diagnóstico y el seguimiento de enfermedades de origen inflamatorio. El presente estudio encontró CPF elevada tanto en TGIF como TGIO, con niveles más altos en TGIO. Los niveles de CPF podrían resultar útiles para diferenciar patologías gastrointestinales funcionales de entidades orgánicas. Se requieren más estudios que incluyan población pediátrica de otros países de Latinoamérica para contrastar nuestros hallazgos y para poder determinar posibles puntos de corte de CPF según la edad.
Agradecimientos. Dra. Emilia Prieto por sus aportes durante el desarrollo del trabajo.
Conflictos de interés. No se recibió financiación externa y ninguno de los autores tiene conflictos de intereses que declarar.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos, las tablas y las figuras presentes en el manuscrito son originales y fueron realizados en sus instituciones pertenecientes.
Aviso de derechos de autor
© 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Dadán S, Higuera-Carrillo M, Camacho-Cruz J y col. Calprotectina fecal en patología gastrointestinal en niños colombianos: estudio observacional. Acta Gastroenterol Latinoam. 2021;51(4):404-2. https://doi.org/10.52787/SDEE3831
Referencias
- Di Lorenzo C, Colletti RB, Lehmann HP, Boyle JT, Gerson WT, Hyams JS, et al. Chronic Abdominal Pain In Children: a Technical Report of the American Academy of Pediatrics and the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2005;40(3):249-61.
- Daza W, Agudelo P, Páez E, Dadán S. Trastornos gastrointestinales funcionales en pediatría. Soc Colomb Pediatr. 2010;9:44–60.
- Flagstad G, Helgeland H, Markestad T. Faecal calprotectin concentrations in children with functional gastrointestinal disorders diagnosed according to the Pediatric Rome III criteria. Acta Paediatr. 2010;99(5):734-7.
- Bonnin Tomas A, Vila Vidal M, Rosell Camps A. Fecal calprotectin as a biomarker to distinguish between organic and functional gastrointestinal disease. Rev Esp Enferm Dig. 2007;99(12):689-93.
- Pang T, Leach ST, Katz T, Day AS, Ooi CY. Fecal biomarkers of intestinal health and disease in children. Front Pediatr. 2014;;2:6.
- Besteiro S. Calprotectina fecal. Aplicaciones en gastroenterología. Anu Fund Dr JR Villavicencio. 2004;99(12):087-8.
- Czub E, Nowak JK, Moczko J, Lisowska A, Banaszkiewicz A, Banasiewicz T, et al. Comparison of fecal pyruvate kinase isoform M2 and calprotectin in acute diarrhea in hospitalized children. Sci Rep [Internet]. 2014;4:4769. Disponible en: http://www.scopus.com/inward/record.url?eid=2-s2.0-84899480221&partnerID=tZOtx3y1
- D’Haens G, Ferrante M, Vermeire S, Baert F, Noman M, Moortgat L, et al. Fecal calprotectin is a surrogate marker for endoscopic lesions in inflammatory bowel disease. Inflamm Bowel Dis. 2012;18(12):2218-24.
- Diamanti A, Panetta F, Basso MS, Forgione a., Colistro F, Bracci F, et al. Diagnostic work-up of inflammatory bowel disease in children: The role of calprotectin assay. Inflamm Bowel Dis. 2010;16(11):1926-30.
- Gisbert JP, McNicholl AG. Questions and answers on the role of faecal calprotectin as a biological marker in inflammatory bowel disease. Dig Liver Dis. 2009;41(1):56-66.
- Hanai H, Takeuchi K, Iida T, Kashiwagi N, Saniabadi AR, Matsushita I, et al. Relationship between fecal calprotectin, intestinal inflammation, and peripheral blood neutrophils in patients with active ulcerative colitis. Dig Dis Sci. 2004;49(9):1438-43.
- Joishy ÃM, Davies ÃI, Ahmed ÃM, Wassel J, Davies ÃK, Sayers A, et al. Fecal Calprotectin and Lactoferrin as Noninvasive Markers of Pediatric Inflammatory Bowel Disease. 2008;(14):48-54.
- Sipponen T, Kolho K. Faecal calprotectin in children with clinically quiescent in fl ammatory bowel disease. Scand J Gastroenterol. 2010;45(7-8):872-7.
- Kolho KL, Turner D, Veereman-wauters G, Sladek M, et al. Rapid test for fecal calprotectin levels in children with Crohn disease. J Pediatr Gastroenterol Nutr. 2012;55(4):436-9.
- Komraus M, Wos H, Wiecek S, Kajor M, Grzybowska-chlebowczyk U. Usefulness of Faecal Calprotectin Measurement in Children with Various Types of Inflammatory Bowel Disease. Mediators Inflamm. 2012;2012:608249.
- Langhorst J, Elsenbruch S, Koelzer J, Rueffer A, Michalsen A DG. Non-invasive markers in the assessment of intestinal inflammation in inflamma- tory bowel diseases: performance of fecal lactoferrin, calprotectin, and PMN- elastase, CRP, and clinical indices. Am J Gastroenterol. 2008;103(1):162-9.
- Sidler MA, Leach ST, Day AS. Fecal S100A12 and fecal calprotectin as noninvasive markers for inflammatory bowel disease in children. Inflamm Bowel Dis. 2008;14(3):359-66.
- Walkiewicz D, Werlin SL, Fish D, Scanlon M. Fecal Calprotectin Is Useful in Predicting Disease Relapse in Pediatric Inflammatory Bowel Disease. Inflamm Bowel Dis. 2008;14(5):669-73.
- Belei O, Simedrea I, Ilie R, Daescu C, Tamara M, Militaru A, et al. Correlations of Fecal Calprotectin With Clinical and Endoscopic Scores in Inflammatory Bowel Diseases in Children. Jurnalul Pediatrului. 2011;14(14):55-6.
- Kostakis ID, Cholidou KG. Fecal Calprotectin in Pediatric Inflammatory Bowel Disease: A Systematic Review. Dig Dis Sci. 2013;58(2):309-19.
- Olafsdottir E, Aksnes L, Fluge G, Berstad A. Faecal calprotectin levels in infants with infantile colic healthy infants, children with inflammatory bowel disease, children with recurrent abdominal pain and healthy children. Acta Pediatr. 2002;(12):45-50.
- Sykora J, Siala K, Huml M, Varvarovska J, Schwarz J PR. Evaluation of faecal calprotectin as a valuable non-invasive marker in distinguishing gut pathogens in young children with acute gastroenteritis. Acta Paediatr. 2010;99(9):1389-95.
- Fagerberg UL, Lööf L, Lindholm J, Hansson L-O, Finkel Y. Fecal calprotectin: a quantitative marker of colonic inflammation in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2007;45(4):414-20.
- Joshi S, Lewis SJ, Creanor S, Ayling RM. Original Article Age-related faecal calprotectin, lactoferrin and tumour M2-PK concentrations in healthy volunteers. Ann Clin Biochem. 2010;259-63.
- Hestvik E, Tumwine JK, Tylleskar T, Grahnquist L, Ndeezi G, Kaddu-mulindwa DH, et al. Faecal calprotectin concentrations in apparently healthy children aged 0-12 years in urban Kampala, Uganda: a community-based survey. BMC Pediatr. 2011;5-11.
- Oord T, Hornung N. Fecal calprotectin in healthy children. Scand J Clin Lab Invest. 2014;74(3):254-8.
- Li F, Ma J, Geng S, Wang J, Liu J, Zhang J, et al. Fecal Calprotectin Concentrations in Healthy Children Aged 1-18 Months. PLoS One. 2015;10(3):1-12.
- Bourdillon G, Biskou O, Mackinder M, Khan MJ, Tsiountsioura M, Clark C, et al. The Routine Use of Fecal Calprotectin in Clinical Pediatric Practice: Almost there or Still Issues to Address? Am J Gastroenterol [Internet]. 2013;108(11):1811-3.
- Inst Colomb Bienestar Fam. Encuesta Nacional de la Situación Nutricional en Colombia. Bogotá, Colombia. 2011; Primera edición.
- Henderson P, Anderson NH, Wilson DC. The Diagnostic Accuracy of Fecal Calprotectin During the Investigation of Suspected Pediatric Infl ammatory Bowel Disease: A Systematic Review and Meta-Analysis. Am J Gastroenterol. 2014;109(5):637-45.
- Francisco Rodríguez-Moranta, Triana Lobatón LR-A, Guardiola y J. Calprotectina fecal en el diagnóstico de enfermedades inflamatorias. Gastroenterol Hepatol. 2013;36(6):400-6.
- El-Badry A, Sedrak H, Rashed L. Faecal calprotectin in differentiating between functional and organic bowel diseases. Arab J Gastroenterol. 2010;11(2):70-3.
- Beşer ÖF, Sancak S, Erkan T, Kutlu T, Çokuğraş H, Cokuğraş FÇ. Can fecal calprotectin level be used as a markers of inflammation in the diagnosis and follow-up of cow’s milk protein allergy? Allergy, Asthma Immunol Res. 2014;6(1):33-8.
- Garg M, Leach ST, Coffey MJ, Katz T, Strachan R, Pang T, Needham B, Lui K, Ali F, Day AS, Appleton L, Moeeni V, Jaffe A, Ooi CY. Age-dependent variation of fecal calprotectin in cystic fibrosis and healthy children. J Cyst Fibros. 2017;16(5):631-6.
- Koninckx CR, Donat E, Benninga MA, Broekaert IJ, Gottrand F, Kolho KL, Lionetti P, Miele E, Orel R, Papadopoulou A, Pienar C, Schäppi MG, Wilschanski M, Thapar N. The Use of Fecal Calprotectin Testing in Paediatric Disorders: A Position Paper of the European Society for Paediatric Gastroenterology and Nutrition Gastroenterology Committee. J Pediatr Gastroenterol Nutr. 2021;72(4):617-40.
- Mosli MH, Zou G, Garg SK, et al. C-reactive protein, fecal calprotectin, and stool lactoferrin for detection of endoscopic activity in symptomatic inflammatory bowel disease patients: a systematic review and meta-analysis. Am J Gastroenterol. 2015;110:802-19.
- Mahjoub FE, Zahedi N, Ashjai B, et al. Role of fecal calprotectin in differentiating between Hirschsprung’s disease and functional constipation. Korean J Gastroenterol. 2013;62:288-91.
- Liu J, Sheng X, Hu Y, Yu X, Westcott JE, Miller L V, et al. Fecal calprotectin levels are higher in rural than in urban Chinese infants and negatively associated with growth. BMC Pediatrics. 2012;12(1):1.
- Jang HW, Kim HS, Park SJ et al. Accuracy of three different fecal calprotectin tests in the diagnosis of inflammatory bowel disease. Intest Res. 2016;14(4):305-13.
Correspondencia: Wilson Daza Carreño
Correo electrónico: daza_w@yahoo.com.co
Acta Gastroenterol Latinoam 2021;51(4):404-412
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE