Bernardo A Borráez Segura,1, 2, 3 Iván Martín,2 Jaime A Montoya,3 Oscar Guevara,3 María E Manrique,3 Ricardo Oliveros,3 Caterin Arévalo4
1Universidad Tecnológica de Pereira, Pereira.
2Departamento de Cirugía General, Fundación Clínica Shaio.
3Departamento de Cirugía Gastrointestinal y Endoscopia Digestiva, Instituto Nacional de Cancerología, Universidad Militar Nueva Granada, Bogotá, D.C.
4 Departamento de Cirugía General, Universidad del Sinú, Cartagena de Indias.
Colombia.
Acta Gastroenterol Latinoam 2018;48(4):278-283
Recibido: 18/10/2017 / Aprobado: 15/11/2017 / Publicado en www.actagastro.org el 17/12/2018
Resumen
La gastrectomía en cáncer gástrico, con una adecuada disección ganglionar, es el estándar de manejo quirúrgico; al menos 15 ganglios son requeridos para su estadificación. A pesar de que el número de ganglios resecados está influenciado por múltiples factores, la experticia podría tener un impacto en los resultados de la gastrectomía. Objetivos. Evaluar el número de ganglios disecados y el número de pacientes con márgenes comprometidos por tumor durante una gastrectomía realizada por cirujanos generales (grupo A) y cirujanos gastrointestinales (grupo B). Material y métodos. Revisión de una base de datos de 174 pacientes a los que se les realizó una gastrectomía con intención curativa para cáncer gástrico, entre 2014 y 2016. Se comparó el número de ganglios resecados y la presencia de márgenes comprometidos por tumor en los dos grupos. Resultados. El promedio de ganglios resecados fue de 22,6 ± 9,9 en el grupo A y 33,2 ± 14 en el grupo B (p = 0,0001). Los márgenes comprometidos por tumor en el grupo A y B fueron de 15 y 6,3% respectivamente (p = 0,04). El porcentaje de pacientes con más de 15 y 25 ganglios fue mayor en el grupo B. El análisis multivariado demostró que un número mayor de 25 ganglios fue significativamente correlacionado con el grupo que realizó el procedimiento. Conclusiones. Los resultados de nuestro estudio muestran que la experticia quirúrgica proporcionada por el entrenamiento en cirugía gastrointestinal incrementa el número de ganglios resecados en cáncer gástrico.
Palabras claves. Cáncer gástrico, gastrectomía, cirugía.
The proper surgeon for a proper gastrectomy
Summary
Gastrectomy with a proper nodal dissection is currently the standard management of gastric cancer and at least 15 nodes are required for stratification. Even though, the number of lymph nodes retrieved has been influenced by many factors, surgical expertise may also have an impact in gastrectomy results. Aims. Evaluate the number of lymph nodes retrieved and involved margins patients compromised with tumor during gastrectomy for gastric cancer by general (group A) and gastrointestinal surgeons (group B). Material and methods. Prospective review of a retrospective database of 174 patients to whom underwent curative gastrectomy intention for gastric cancer, between 2014 and 2016. The pathology report, nodal dissection, lymph node ratio and involved margins between groups A and B were compared. Results. The mean numbers of nodes removed during procedure were 22.6 ± 9.9 in group A and 33.2 ± 14 in group B (p = 0.0001). Involved margins in group A and B were of 15 and 6.3% respectively (p = 0.04). The percentage of patients more than 15 and 25 lymph nodes was higher in the group B of patients. Multivariate analysis demonstrated that the number of lymph node retrieved (> 25), was significantly correlated with the group who performed the procedure (p = 0.0001). Conclusions. The results of this study showed that in patients with gastric cancer: Surgical expertise and fellowship training improve the number of lymph nodes retrieved and negative margins. The findings suggest that the proper surgeon play an important role and may improve the survival rate in gastric cancer.
Key words. Gastric cancer, gastrectomy, surgery.
El cáncer de estómago causa gran parte de las muertes en nuestro país y en el mundo, siendo el quinto cáncer más frecuente, y la segunda causa de muerte por cáncer a nivel mundial. Colombia es una zona de alta incidencia en cáncer gástrico con alta mortalidad. La mayoría de los casos son diagnosticados en estadios avanzados y tan solo un 2,5% corresponden a estadios tempranos.1-3
El diagnóstico temprano permite el tratamiento endoscópico en casos selectos, pero la piedra angular del tratamiento con intensión curativa sigue siendo la cirugía asociada a una adecuada disección ganglionar. Por muchos años, la disección ganglionar ha sido un tema de controversia con un mejor control loco-regional, pero con dudas en términos de supervivencia, asociado a una larga y difícil curva de aprendizaje.4, 5
Basado en bases de datos japoneses y coreanos, la American Joint Committee on Cancer recomiendan al menos 15 ganglios evaluados por paciente, tomando este número como estándar para una disección apropiada y demostrando que es un factor pronóstico en la sobrevida de los pacientes con cáncer gástrico. Al igual que en los países asiáticos, la disección estándar en nuestro país es la disección ganglionar D2; para lograr este objetivo en países como Corea, en el Centro Nacional de Cáncer los cirujanos deben observar un gran número de procedimientos y realizar otro número considerable de procedimientos bajo supervisión directa, y utilizando un número de estándar de calidad de 25 ganglios. Lee y col. concluyen que al menos 23 casos u 8 meses de entrenamiento son necesarios para lograr este objetivo en el 92,5% de los casos.4-7
En países como Colombia, con un complejo sistema de salud y un creciente número de casos de cáncer gástrico, no todos los pacientes son operados por cirujanos gastrointestinales (cirujanos generales con especialización de dos años en cirugía gastrointestinal), o cirujanos generales con experiencia en cáncer, y muchos de ellos son intervenidos por cirujanos generales, en algunos casos sin experiencia en el tratamiento de pacientes con cáncer.
Objetivo
Determinar el número de ganglios resecados, así como el número de pacientes con márgenes comprometidos por el tumor durante una gastrectomía realizada por cirujanos generales (grupo A) y cirujanos con un mayor nivel de experticia, dado por el entrenamiento en cirugía gastrointestinal adicional de dos años (grupo B).
Material y métodos
Revisión prospectiva de una base datos cargada retrospectivamente. Se evaluaron las fuentes primarias de 174 pacientes a los que se les realizó una gastrectomía con intención curativa para el tratamiento de cáncer gástrico, entre 2014 y 2016, en diferentes centros quirúrgicos de Bogotá, Colombia.
Se incluyó a todos los pacientes con diagnóstico de cáncer gástrico potencialmente resecable a los que se les realizó una gastrectomía, total o subtotal, con un vaciamiento ganglionar de D2 con abordaje abierto. No se tuvo en cuenta el uso previo de neoadyuvancia o la localización del tumor.
Los tipos de gastrectomía se clasificaron según la 4º versión de las guías japonesas para tratamiento del cáncer. Gastrectomía total: resección total del estómago, que incluye el cardias y el píloro; gastrectomía subtotal: resección parcial distal donde se incluye el píloro y se preserva el cardias. Al menos dos tercios del estómago es resecado.
Para la gastrectomía total la disección ganglionar D2 se definió como la resección de los grupos ganglionares del 1 al 7, 8a, 9, 10, 11p, 11d y 12a, y para la gastrectomía subtotal los grupos ganglionares 1, 3, 4sb, 4d, 5, 6, 7, 8a, 9, 11p, 12a.
Se excluyó a los pacientes con resecciones multiviscerales, gastrectomías paliativas, laparoscópicas y aquellos pacientes a los cuales no se les encontraron los reportes de patología en las fuentes de información primarias.
Se compararon, basados en el reporte de patología, el número de ganglios resecados y los márgenes positivos comprometidos por tumor en los 2 grupos. Adicionalmente, se evaluó la relación ganglionar, que corresponde a la relación entre el número de ganglios comprometidos por tumor y el número de ganglios resecados.
Análisis estadístico
Fue realizado usando SPSS versión (Copyright© SPSS Inc., 2000). Los datos fueron recolectados en el programa Excel. Los datos cuantitativos fueron reportados en medias y desviación estándar (DE). Las proporciones fueron comparadas usando test de χ2 o test de Fisher cuando fue necesario. T de student fue usado para comparar variables. Un nivel de 5% fue usado como criterio de significancia estadística.
Resultados
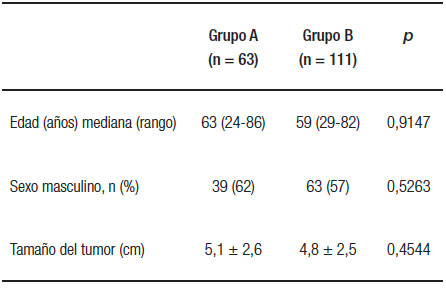
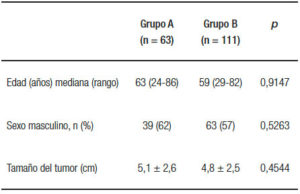
Se realizaron 174 gastrectomías con disección ganglionar D2, de las cuales 60 fueron subtotales y 114 fueron totales. La edad mediana de los pacientes fue de 60 años (rango: 24-86). Ciento dos pacientes (58%) eran de sexo masculino. El tamaño tumoral fue de 5 cm en promedio (rango: 0,5-16). Las características demográficas, así como el tamaño tumoral, se describen en la Tabla 1.
Table 1. Características demográficas y tamaño tumoral.
De las 114 gastrectomías totales, 55 fueron realizadas por el grupo A (48%) y 59 por el grupo B (52%), mientras que de las 60 gastrectomías subtotales solamente 8 fueron realizadas por el grupo A (13%) y 52 por el grupo B (87%).
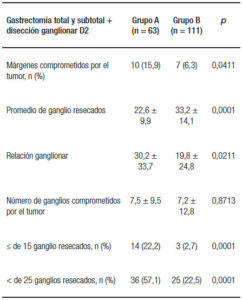
El número de ganglios resecados durante una gastrectomía fue de 22,6 ± 9,9 en el grupo A y 33,2 ± 14,1 en el grupo B. El número de pacientes con márgenes proximales o distales comprometidos por tumor fue de 10 pacientes (15,9%) para el grupo A y 7 pacientes (6,3%) para el grupo B. Los datos de márgenes comprometidos, número de ganglios resecados, así como la relación ganglionar y el número de pacientes con ganglios menores o iguales a 15 y menores de 25 para el grupo general (gastrectomías totales y subtotales) se presentan en la Tabla 2.
Table 2. Comparación de márgenes comprometidos por el tumor, promedio de ganglios resecados, relación ganglionar y número de pacientes con ganglios menores o iguales a 15 y menores de 25 en el grupo general.
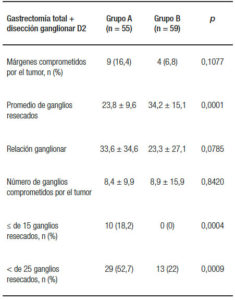
El número de ganglios resecados durante una gastrectomía total fue de 23,8 ± 9,6 en el grupo A y 34,2 ± 15,1 en el grupo B. El número de pacientes con márgenes proximales o distales comprometidos por tumor fue de 9 pacientes (16,4%) para el grupo A y 4 pacientes (6,8%) para el grupo B. Los datos de márgenes comprometidos, número de ganglios resecados, así como la relación ganglionar y el número de pacientes con ganglios menores o iguales a 15 y menores de 25 para el grupo de pacientes con gastrectomía total se presentan en la Tabla 3.
Table 3. Comparación de los márgenes comprometidos por el tumor, promedio de ganglios resecados, relación ganglionar y número de pacientes con ganglios menores o iguales a 15 y menores de 25 en el grupo de pacientes con gastrectomía total.
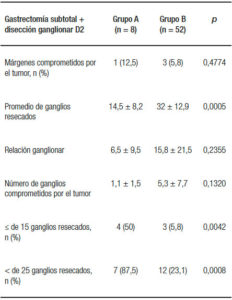
El número de ganglios resecados durante una gastrectomía subtotal fue de 14,5 ± 8,2 en el grupo A y 32 ± 12,9 en el grupo B. El número de pacientes con márgenes proximales o distales comprometidos por tumor fue de 1 paciente (12,5%) para el grupo A y 3 pacientes (5,8%) para el grupo B. Los datos de márgenes comprometidos, número de ganglios resecados, así como la relación ganglionar y el número de pacientes con ganglios menores o iguales a 15 y menores de 25 para el grupo de pacientes con gastrectomía total se presentan en la Tabla 4.
Table 4. Comparación de márgenes comprometidos por el tumor, promedio de ganglios resecados, relación ganglionar y número de pacientes con ganglios menores o iguales a 15 y menores de 25 en el grupo de pacientes con gastrectomía subtotal.
Discusión
Nuestro objetivo fue determinar cuán frecuentemente se lleva a cabo una gastrectomía adecuada para el tratamiento del cáncer gástrico con base en el número de ganglios resecados, así como el número de márgenes comprometidos por tumor en dos grupos de cirujanos (cirujanos generales y gastrointestinales).
El número promedio de ganglios resecados fue menor en pacientes a quienes una gastrectomía total y subtotal les fue realizada por cirujanos generales con una diferencia estadísticamente significativa, y el número de gastrectomías con ganglios menores o iguales a 15 fue mayor en este mismo grupo; los márgenes comprometidos por tumor fueron similares en ambos grupos al separarlos en gastrectomías totales y subtotales. Adicionalmente, en ambos grupos de cirujanos hubo una similar relación ganglionar y un similar número de ganglios comprometidos por tumor. Al comparar el número de gastrectomías con ganglios menores a 25, se encontró que se presentan más frecuentemente en el grupo B, con una diferencia estadísticamente significativa.
El entrenamiento adicional en una subespecialidad en cirugía general puede brindar la oportunidad de dominar nuevas habilidades quirúrgicas y ganar confianza en un campo específico de la cirugía, así como superar tempranamente los baches que se pueden presentar durante una residencia en cirugía. La cirugía gastrointestinal y específicamente la cirugía para el tratamiento del cáncer gástrico requieren habilidades superiores que pueden estar dadas por un entrenamiento adicional o la experiencia propia del cirujano con interés en el tratamiento del cáncer.7, 8
La gastrectomía con intención curativa para el tratamiento del cáncer consta de dos partes, la gastrectomía per se y la linfadenectomía. Nuestro estudio no encontró diferencia estadísticamente significativa con respecto a la presencia de márgenes comprometidos por tumor durante la realización de la gastrectomía entre los diferentes grupos evaluados, pero nuestros resultados muestran que el grupo B de cirujanos se realizó una linfadenectomía adecuada con un mayor número de pacientes con más de 15 y 25 ganglios resecados. Nuestros resultados, en términos de ganglios resecados (grupo A: 22,6 vs. grupo B: 33,2; p = 0,0001), concuerdan con los hallazgos encontrados por Jang y col., donde se reportó un número mayor de ganglios resecados en cirujanos que contaban con un entrenamiento adicional (25 vs. 36 ganglios, p < 0,001), con un aumento en el número de ganglios resecados con el tiempo al adquirir mayor experiencia (27,8 vs. 38,1 ganglios, p < 0,001). Adicionalmente, este estudio y los resultados presentados por Liang y col. reportan un aumento en la supervivencia global a 5 años en pacientes operados por cirujanos especializados y no especializados (50,7 vs. 37,2 %; p < 0,001, respectivamente) con un número mayor de ganglios resecados (22,7 ± 12,4 vs. 12,9 ± 8,3; p < 0,001).9, 10
A pesar de esto, la relación nodal, propuesta como una herramienta de factor pronóstico, es similar en ambos grupos, sin diferencia significativa. En contraparte, una linfadenectomía D2 adecuada, establecida como un número de ganglios mayor a 15, fue realizada más frecuentemente por el grupo B de cirujanos. Además, se evaluó el número de pacientes con un recuento ganglionar mayor a 25 ganglios para ambos procedimientos (gastrectomía total y subtotal), dado que algunos autores como Liu y col. y Chen y col. reportan un impacto mayor en la supervivencia de los pacientes con cáncer gástrico; al igual que con el grupo anterior, el grupo A de cirujanos presentó un número mayor de pacientes con un recuento ganglionar menor de 25 ganglios.11-14
Sin embargo, uno de los hallazgos que llamó nuestra atención fue el bajo número de gastrectomías subtotales realizadas por el grupo de cirujanos generales; se consideró que en ocasiones puede ser un procedimiento de mayor complejidad que una gastrectomía total, pero no se encontró una explicación clara para estos hallazgos.
Finalmente, sabemos que nuestro estudio tiene ciertas limitaciones. Primero, es un estudio retrospectivo con un pequeño número de pacientes, y segundo, el recuento ganglionar puede estar influenciado por múltiples factores, como la edad, el índice de masa corporal, la localización del tumor, el estado inmunológico, la quimioterapia y el patólogo; también existe aún una controversia en la extensión de la linfadenectomía. A pesar de esto, consideramos que nuestros resultados son relevantes para el tratamiento adecuado de los pacientes con cáncer gástrico.
Conclusiones
Los resultados de nuestro estudio sugieren que en pacientes con cáncer gástrico la experiencia proporcionada por el entrenamiento en cirugía gastrointestinal incrementa el número de ganglios resecados, así como la realización de una linfadenectomía adecuada (al menos 15 ganglios). Nuestros hallazgos sugieren que el cirujano adecuado juega un papel crucial para realizar una gastrectomía adecuada, y por ende podría aumentar la supervivencia en pacientes con cáncer gástrico. Por último, consideramos que son necesarios estudios adicionales que evalúen la supervivencia en los diferentes grupos de cirujanos considerados.
Conflictos de interés. Los autores no presentan ningún conflicto de interés.
Referencias
- Yuan SQ, Chen YT, Huang ZP. Equipping the 8th Edition American Joint Committee on Cancer Staging for Gastric Cancer with the 15-Node Minimum: A Population-Based Study Using Recursive Partitioning Analysis. J Gastrointest Surg 2017; 21: 1591- 1598.
- Balakrishnan M, George R, Sharma A, Graham DY. Changing trends in stomach cancer throughout the world. Curr Gastroenterol Rep 2017; 19: 36.
- Luo G, Zhang Y, Guo P, Wang L, Huang Y, Li K. Global patterns and trends in stomach cancer incidence: Age, period and birth cohort analysis. Int J Cancer 2017; 141: 1333-1344.
- Hoshi H. Standard D2 and modified nodal dissection for gastric Surg Oncol Clin N Am 2012; 21: 57-70.
- Degiuli M, De Manzoni G, Di Leo A, D’Ugo D, Galasso E, Marrelli D, Petrioli R, Polom K, Roviello F, Santullo F, Morino M. Gastric cancer: Current status of lymph node dissection. World J Gastroenterol 2016; 22: 2875-2893.
- Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014 (ver. 4). Gastric Cancer 2017; 20: 1-19.
- Grover BT, Kothari SN. Fellowship Training: Need and Contributions. Surg Clin North Am 2016; 96: 47-57.
- Kim ChY, Nam BH, Cho GS, Hyung WJ, Kim MC, Lee HJ, Ryu KW, Ryu SW, Shin DW, Lee JH. Learning curve for gastric cancer surgery based on actual survival. Gastric Cancer 2016; 19: 631-638.
- Jang YJ, Park MS, Park SS, Kim JH, An H, Park SH, Kim SJ, Kim CS, Mok YJ. Surgeon subspecialty as a factor in improving long-term outcomes for gastric cancer: Twenty years of experience in Korea. Arch Surg 2010; 145: 1091-1096.
- Liang Y, Wu L, Wang X, Ding X, Liang H. The positive impact of surgeon specialization on survival for gastric cancer patients after surgery with curative intent. Gastric Cancer 2015; 18: 859-867.
- Kutlu OC, Watchell M, Dissanaike S. Metastatic lymph node ratio successfully predicts prognosis in western gastric cancer patients. Surg Oncol 2015; 24: 84-88.
- Marchet A, Mocellin S, Ambrosi A, Morgagni P, Garcea D, Marrelli D, Roviello F, de Manzoni G, Minicozzi A, Natalini G, De Santis F, Baiocchi L, Coniglio A, Nitti D, Italian Research Group for Gastric Cancer (IRGGC). The ratio between metastatic and examined lymph nodes (N ratio) is an independent prognostic factor in gastric cancer regardless of the type of lymphadenectomy: results from an Italian multicentric study in 1853 patients. Ann Surg 2007; 245: 543-552.
- Chen HN, Chen XZ, Zhang WH, Chen XL, Yang K, Liu JP, Zhang B, Chen ZX, Chen JP, Zhou ZG, Hu JK. Necessity of harvesting at least 25 lymph nodes in patients with stage N2-N3 resectable gastric cancer: a 10-year, single-institution cohort study. Medicine (Baltimore) 2015; 94: e620.
- Liu YY, Fang WL, Wang F, Hsu JT, Tsai CY, Liu KH, Yeh CN, Chen TC, Wu RC, Chiu CT, Yeh TS. Does a Higher Cutoff Value of Lymph Node Retrieval Substantially Improve Survival in Patients With Advanced Gastric Cancer? Time to Embrace a New Digit. Oncologist 2017; 22: 97-106.
Correspondencia: Bernardo A Borráez Segura
Calle 22bis # 48 – 20. Cirugía General. Cirugía Gastrointestinal y Endoscopía Digestiva. Universidad Tecnológica de Pereira. Pereira, Colombia. Tel.: +57 3102570492
Correo electrónico: bborraez@hotmail.com / b.borraez@utp.edu.co
Acta Gastroenterol Latinoam 2018;48(4):278-283
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE