Martín Guidi,1 Cecilia Curvale,1 Analía Pasqua,2 Hui Jer Hwang,1 Hugo Pires,3 Sandra Basso,4 Diego Haberman,5 Pilar Vizcarra,3 Marisa Canicoba,6 Raúl Matanó,1 Oscar Mazza2
1 Hospital de Alta Complejidad en Red “El Cruce”. Florencio Varela, provincia de Buenos Aires.
2 Hospital Italiano de Buenos Aires. Ciudad Autónoma de Buenos Aires.
3 Hospital Interzonal General de Agudos “General San Martín”. La Plata, provincia de Buenos Aires.
4 Hospital de Gastroenterología “Dr. Carlos Bonorino Udaondo”, Ciudad Autónoma de Buenos Aires.
5 Centro Rossi. Ciudad Autónoma de Buenos Aires.
6 Hospital Nacional “Alejandro Posadas”. El Palomar, provincia de Buenos Aires.
Acta Gastroenterol Latinoam 2019;49(4):307-323
Recibido: 31/01/2018 / Aprobado: 03/11/2019 / Publicado en www.actagastro.org el 17/12/2019
Resumen
La pancreatitis aguda (PA) es una condición inflamatoria del páncreas que puede causar injuria local, síndrome de respuesta inflamatoria sistémica, fallo orgánico y muerte. Es una de las patologías gastrointestinales que más comúnmente requieren hospitalización. Su manejo ha cambiado en los últimos años debido a una mejor comprensión de su fisiopatología, la evolución del arsenal terapéutico, los avances en el soporte nutricional, la correcta utilización de los antibióticos y las mejoras en las técnicas miniinvasivas para el tratamiento de las complicaciones locales. Las sociedades médicas realizan guías de tratamiento multidisciplinario y estandarizado que no llegan a tener repercusión clínica, ya que el grado de cumplimiento internacional de ellas es escaso. Este reporte está focalizado en diez medidas trascendentes para el manejo inicial (dentro de las 72 horas) de la PA, período en el cual la toma de decisiones puede alterar el curso de la enfermedad y la duración de la hospitalización. Cada sección de este documento presenta recomendaciones claves vinculadas a cada tópico, seguido de un resumen de recomendaciones.
Palabras claves. Pancreatitis aguda.
Update on the initial management of acute pancreatitis
Summary
Acute pancreatitis (AP) is an inflammatory condition of pancreas that can cause local injury, systemic inflammatory response syndrome, organ failure and death. It is one of the gastrointestinal pathologies that most commonly require hospitalization. Its management has changed in recent years due to a better understanding of its pathophysiology, the evolution of the therapeutic arsenal, advances in nutritional support, the correct use of antibiotics and improvements in minimally invasive techniques for the treatment of local complications. The medical societies carry out multidisciplinary and standardized treatment guidelines that do not have clinical repercussions, since the degree of international compliance of them is scarce. This report focuses on ten important measures for the initial management (within 72 hours) of the PA, a period in which decision-making can alter the course of the disease and the length of hospitalization. Each section of this document presents key recommendations linked to each topic, followed by a summary of recommendations.
Key words. Acute pancreatitis.
Abreviaturas
PA: Pancreatitis aguda.
PAL: Pancreatitis aguda leve.
FO: Fallo orgánico.
PAM: Pancreatitis aguda moderada.
PAG: Pancreatitis aguda grave.
PAC: Pancreatitis aguda crítica.
EUS: Ecoendoscopía.
HAART: Terapia antirretroviral altamente efectiva.
NPI: Necrosis pancreática infectada.
Pa/FiO2 : Presión arterial de oxígeno/fracción inspirada de oxígeno.
BISAP: Bedside index for severity of acute pancreatitis.
SIRS: Síndrome de respuesta inflamatoria sistémica.
AINES: Antinflamatorios no esteroides.
PCA: Bomba de analgesia controlada por el paciente.
NMDA: N-metil de aspartamo.
ANDT: Antidepresivos tricíclicos.
5HT: 5 hidroxitriptamina.
PCR: Proteína C reactiva.
TC: Tomografía computada.
MN: Malnutrición.
MODS: Síndrome de disfunción múltiple de órganos.
NE: Nutrición enteral.
SN: Soporte nutricional.
LB: Litiasis biliar.
CPRE: Colangiopancreatoscopía retrógrada endoscópica.
La pancreatitis aguda (PA) es una condición inflamatoria del páncreas que puede causar injuria local, síndrome de respuesta inflamatoria sistémica, fallo orgánico y muerte. Es una de las patologías gastrointestinales que más comúnmente requieren hospitalización en todo el mundo, con una incidencia anual reportada de 13-45 casos cada 100.000 personas en EE.UU. y un gasto en salud que excede los 2,5 billones de dólares.1 En Latinoamérica se reportó en 2006 una incidencia de 15,9 casos cada 100.000 habitantes en Brasil, una prevalencia del 3% en México, en 2001, y en Perú, según las estadísticas del Ministerio de Salud del año 2009.2, 3 Su manejo ha cambiado en los últimos años debido a una mejor comprensión de su fisiopatología, la evolución del arsenal terapéutico, los avances en el soporte nutricional, la correcta utilización de los antibióticos y las mejoras en las técnicas miniinvasivas para el tratamiento de las complicaciones locales. En un paciente con PA está demostrado que la identificación de los signos de gravedad durante las primeras 72 horas mejora el pronóstico y reduce la mortalidad. En los últimos años se han publicado diferentes guías de tratamiento. Un estudio publicado por Andersson y colaboradores en 2012 concluye que solo el 51% de los hospitales de Suecia disponen de un protocolo estandarizado de tratamiento, aunque la gran mayoría están interesados en participar en un registro sobre PA.4 En otro estudio realizado en Gran Bretaña, Irlanda y Canadá solo el 23% de los hospitales encuestados disponen de un grupo multidisciplinario para el manejo de la PA.5 Otros dos estudios indican un grado muy bajo de cumplimiento de las medidas principales de las guías de tratamiento publicadas.6, 7 En resumen, las sociedades médicas realizan guías de tratamiento multidisciplinario y estandarizado que no llegan a tener repercusión clínica, ya que el grado de cumplimiento internacional de esas guías es escaso. Este reporte está focalizado en diez medidas trascendentes para el manejo inicial (dentro de las 72 horas) de la PA, período en el cual la toma de decisiones puede alterar el curso de la enfermedad y la duración de la hospitalización. Cada sección de este documento presenta recomendaciones claves vinculadas a cada tópico, seguidas de un resumen de recomendaciones en la Tabla 3.
Definiciones
Pancreatitis aguda leve (PAL): Se caracteriza por la ausencia tanto de necrosis (peri) pancreática como de fallo orgánico (FO).
Pancreatitis aguda moderada (PAM): Se caracteriza por la presencia de cualquier tipo de necrosis (peri) pancreática estéril o FO transitorio.
Pancreatitis aguda grave (PAG): Se caracteriza por la presencia de cualquier tipo de necrosis (peri) pancreática infectada o FO persistente.
Pancreatitis aguda crítica (PAC): se caracteriza por la presencia de necrosis (peri) pancreática infectada y FO persistente (peor pronóstico que la PAG).
FO transitorio: datos de FO que se resuelven en un período de 48 horas tras la aplicación de medidas de soporte adecuadas.*
FO persistente: datos de FO que no se resuelven en un período 48 horas tras aplicar las medidas de soporte adecuadas.*
*La Surviving Sepsis Campaing considera que de no presentarse respuesta favorable luego de la aplicación de las medidas de reanimación se podría clasificar el cuadro como FO persistente, sin necesidad de aguardar 48 horas.
Definición de FO: criterios de Marshal modificados.
Pancreatitis aguda: consideraciones diagnósticas
En la práctica cotidiana se acepta que el diagnóstico de PA requiere, al menos, dos de los siguientes tres criterios: dolor abdominal característico, amilasa y/o lipasa (triacilglicerol acilhidrolasa) plasmáticas > 3 veces su valor de referencia máximo y/o evidencia radiológica de pancreatitis.8, 9
Sin embargo, cualquier combinación de estos criterios merece sus consideraciones.
El dolor característico es epigástrico, de inicio agudo, intenso, persistente y, a menudo, irradiado a dorso, pero en algunos pacientes el dolor puede no ser típico.
Es importante tener en cuenta que la lipasa y/o amilasa pueden estar elevadas < 3 veces su valor de referencia máximo y esto podría explicarse por las diferencias en la cinética de ambas enzimas, ya que la lipasa comienza a elevarse dentro de las 4-8 horas posteriores al inicio de la PA, presenta un pico a las 24 horas y comienza a descender dentro de los 8-14 días, mientras que la amilasa a menudo aumenta a las 6-24 horas, usualmente presenta un pico a las 48 horas y típicamente tiende a normalizarse durante los siguientes 5-7 días. Además, la determinación de amilasa puede ser normal en pancreatitis causadas por alcohol o por hipertrigliceridemia.8
Existen aislados casos publicados de PA con lipasa y amilasa normales y esto podría atribuirse a una determinación muy temprana o muy tardía en la evolución de la PA, entre otras posibilidades tales como los sueros hiperlipémicos en las PA por hipertrigliceridemia marcada.10-12
Por otra parte, además de la PA, existen otras situaciones que pueden presentar elevación de estas enzimas.13 La lipasa se produce principalmente en las células acinares pancreáticas, pero también en la lengua, esófago, estómago, duodeno, leucocitos, tejido adiposo, hígado y pulmones; sus niveles pueden aumentar en pancreatitis crónica, tumores pancreáticos, colecistitis aguda, úlceras duodenales, infarto u obstrucción intestinal, trauma, infección por VIH, cetoacidosis diabética y otras condiciones asociadas con isquemia pancreática prolongada. Además, dado que la lipasa se excreta por vía renal, puede estar elevada en el plasma de pacientes con una tasa de filtrado glomerular deteriorada. La macrolipasemia es otra causa de aumento del nivel plasmático de lipasa. Los pacientes diabéticos parecen tener niveles basales de lipasa mayores que los no diabéticos.8 En el caso de la amilasa, existen fuentes extrapancreáticas de la misma y puede estar elevada por diferentes causas (macroamilasemia, insuficiencia renal, enfermedad de las glándulas salivales o ginecológicas, apendicitis, colecistitis, obstrucción o isquemia intestinal, úlcera péptica).
En el caso de los pacientes críticamente enfermos, internados en unidades cerradas por diferentes motivos (infarto de miocardio, por ejemplo), el diagnóstico de una PA es especialmente dificultoso ya que suelen estar imposibilitados de manifestar dolor, por sedación y deterioro de la conciencia, y pueden presentar múltiples causas de hiperlipasemia y/o hiperamilasemia.14, 15 Los pacientes con cetoacidosis diabética pueden presentar dolor abdominal y elevación de enzimas pancreáticas por la misma condición.15 Otra causa de dolor abdominal e hiperenzimemia podría ser la inflamación de tejido pancreático ectópico (pancreatitis ectópica).16 En todos estos escenarios las imágenes tienen un rol importante y, en el caso de la tomografía, es conveniente recordar que el uso de contraste iodado podría estar contraindicado, dependiendo del caso.
Independientemente de todas estas consideraciones, en la práctica diaria el valor de las enzimas pancreáticas no es un parámetro útil para predecir severidad, definir pronóstico ni establecer el momento adecuado para reiniciar la alimentación, realizar una colecistectomía (de ser pertinente de acuerdo con la etiología) o externar a un paciente. La medición seriada de enzimas pancreáticas luego de confirmado el diagnóstico de PA no resulta de utilidad en líneas generales; una excepción podría ser la presencia de signos clínicos de inflamación pancreática o peripancreática persistente.17, 18
Con respecto a las imágenes, en la práctica cotidiana la ecografía es el estudio inicial por imagen más utilizado. La tomografía computada y la resonancia magnética usualmente no son necesarias para establecer el diagnóstico de pancreatitis, y tienen un rol principalmente en los casos donde existe duda diagnóstica.8 La resonancia magnética con técnica de colangiopancreatografía permite establecer el diagnóstico de PA y también definir su etiología en muchos casos.
Recomendaciones
- El diagnóstico de PA requiere, al menos, dos de los siguientes tres criterios: dolor abdominal característico, amilasa y/o lipasa plasmáticas > 3 veces su valor de referencia máximo y/o evidencia radiológica de pancreatitis.
- La tomografía computada y la resonancia magnética usualmente no son necesarias para establecer el diagnóstico de pancreatitis y tienen un rol especialmente en los escenarios que planteen dudas diagnósticas.
- El valor de las enzimas pancreáticas no es un parámetro útil para predecir severidad, definir pronóstico ni establecer el momento adecuado para reiniciar la alimentación, realizar una colecistectomía o externar a un paciente.
Etiología de la pancreatitis aguda
La inflamación aguda del páncreas es el resultado de la combinación de varios factores, incluyendo mecanismos obstructivos, tóxicos, anomalía anatómica y/o genética.
El diagnóstico etiológico de la PA es crucial para prevenir la recurrencia. En la mayoría de los casos no hay dificultad en definir la causa. Sin embargo, aproximadamente el 20-30% de los pacientes presentan PA idiopática a pesar del análisis de laboratorio (incluye trigliceridemia y calcemia), la ecografía abdominal, la tomografía y/o la colangior resonancia magnética.
En nuestro medio, la litiasis biliar es la principal causa de PA, mayor al 80%, seguida por el alcohol.19, 20 Solamente el 2% de las colelitiasis asintomáticas y el 2-3% de los alcohólicos van a desarrollar PA.21, 22
Dado que la microlitiasis no diagnosticada por ecografía abdominal es responsable de 60-80% de las PA idiopáticas, se sugiere una segunda línea de estudios como la colangioRMN y la ecoendoscopía (EUS).23, 24
En pacientes en quienes ya se descartó causa litiásica y alcohólica, debe solicitarse trigliceridemia y calcemia en las primeras horas de la admisión, debido a que el ayuno y el estado hipercatabólico disminuyen su concentración en sangre rápidamente.19, 25
Las drogas más estudiadas como causantes de PA son: la azatioprina y 6-mercaptopurina (riesgo de PA: 3,2-6%), mesalazina, metronidazol, codeína, enalapril, isoniazida, simvastatina, ácido valproico, terapia antirretroviral altamente activa (HAART).26, 27
El tabaquismo es un factor de riesgo independiente para PA. En la PA de causa no biliar los fumadores activos (más de 20 paquetes-año) tienen 2 veces más riesgo (RR: 2,29; IC95%: 1,63-3,22) comparados con no fumadores. El efecto tóxico del tabaco es sinérgico con el alcohol, de manera que en fumadores con consumo de alcohol (> 400 gr/mes) se incrementa 4 veces el riesgo de sufrir PA (RR: 4,12; IC95%: 1,98-8,6). Los fumadores que dejan el hábito tóxico disminuyen el riesgo de PA a niveles correspondientes de los no fumadores después de 20 años de la suspensión.28, 29
El consumo de cannabis podría ser responsable del 2% de los casos de PA idiopática.30
Entre el 5 y 7% de la PA puede ser causada por tumores periampulares sólidos o tumores quísticos de páncreas. Se deben considerar estas etiologías principalmente en personas mayores de 40 años.23
Recomendaciones
- En nuestro país la etiología biliar es la causa más frecuente de PA, seguida del consumo de alcohol.
- Descartadas ambas, calcemia y trigliceridemia deben solicitarse dentro de las primeras horas.
- El tabaquismo es un factor independiente de PA. Debe descartarse patología tumoral en pacientes mayores de 40 años con PA idiopática.
Predictores de severidad
Los pacientes con PA tienen cursos clínicos variables, con un 20% de episodios severos, alcanzando en este grupo una mortalidad del 30%.31-33 Predecir el grado de severidad es uno de los puntos claves en el manejo inicial de la PA, ya que define el traslado a centros de referencia, el ingreso en unidad de cuidados intensivos y/o la implementación de terapéuticas específicas.34, 35
Gran cantidad de scores han sido diseñados, validados y puestos a prueba durante las últimas décadas, sin embargo, persisten las inconsistencias y la falta de consenso. Los scores más históricos y precisos (APACHE y RANSON) están conformados por múltiples determinaciones y se completan a las 48 horas del ingreso, lo que les resta practicidad clínica, mientras que los marcadores individuales promisorios no están ampliamente disponibles.
Los principales determinantes de mortalidad en el curso de una PA son el fallo persistente de órgano (FOP) durante la primera semana, y la necrosis pancreática infectada (NPI), pasados los 5-7 días del inicio del cuadro.35, 36 El FOP se define como aquel que se prolonga por más de 48 horas con compromiso de alguno de los siguientes parámetros: PaO2/Fio2, creatininemia, tensión arterial (score de Marshall).37 Un score de 2 o más puntos en cualquier órgano implica la presencia de fallo de órgano (Tabla 1).
Tabla 1. Score de Marshall: severidad de pancreatitis aguda.

Los predictores de mayor efectividad en las primeras 48 horas son la escala de la Sociedad Japonesa (que cuenta con 21 determinaciones) y el BISAP (Bedside Index for Severity of Acute Pancreatitis) (Tabla 2). Este último cuenta con una sensibilidad de 72%, especificidad 99%, valor predictivo positivo 83%, valor predictivo negativo 98%.35, 38, 39 Sus principales ventajas son: simplicidad y capacidad de ser calculado con mínimos requisitos. La mortalidad de los pacientes se incrementa significativamente a partir de los 3 puntos, alcanzando un 22% con los 5 puntos.
Tabla 2. Índice de severidad de pancreatitis aguda: BISAP.
El diagnóstico de síndrome de respuesta inflamatoria sistémica (SIRS), que forma parte de los criterios del BISAP, cuenta con la mayor sensibilidad entre los marcadores tempranos (95%), pero carece de valor predictivo positivo (15%).35 Esto generaría un falso pronóstico de gravedad entre pacientes con cuadros leves (principalmente en poblaciones de baja incidencia), pero evitaría descuidar a pacientes de curso severo. Complementar este score con otras determinaciones, como las que forman parte del BISAP, incrementa la especificidad y mejora la exactitud diagnóstica.40
La presencia de dos o más de los ítems previos implica el diagnóstico de SIRS. Cuanto más precoz sea su inicio en el curso de la PA, con más cantidad de determinaciones positivas y más prolongado en el tiempo (> 48 horas): mayores posibilidades de severidad en el curso de la PA.41
Entre las determinaciones individuales, la urea y el hematocrito han demostrado tener valor pronóstico. Un valor de urea elevado al ingreso, que no disminuye luego de 24 horas de hidratación amplia, se correlaciona con aumento de la mortalidad. En el mismo sentido, la hemoconcentración (definida con un hematocrito > a 44) se asocia con necrosis pancreática.34, 42
Si bien no forman parte de las determinaciones del ingreso, vale la pena comentar que la proteína C reactiva ha sido validada como marcador de severidad, y la procalcitonina predice con elevada exactitud el desarrollo de necrosis pancreática. Aunque se encuentran disponibles y su determinación resulta muy sencilla, ambas deben ser medidas alrededor de las 72 horas del comienzo del cuadro, lo cual les resta significancia en el momento de mayor definición.34, 35, 42
Debe remarcarse el concepto de que los valores de amilasa y lipasa tienen relevancia en el diagnóstico del episodio de pancreatitis y no así en el pronóstico de esta.
Los actuales sistemas pronósticos han alcanzado su máxima eficacia de predicción. Las combinaciones sofisticadas de determinaciones bioquímicas y estudios por imágenes incrementan mínimamente la exactitud tornando engorrosa su aplicación clínica.43
Recomendaciones
- El fallo de órgano persistente (score de Marshall) y la infección del tejido pancreático y/o peripancreático son los determinantes de severidad.
- Se sugieren como marcadores pronósticos el BISAP (que incluye SIRS) + uremia y hematocrito (al ingreso y a las 24 horas de un tratamiento de hidratación adecuado).
- Amilasa y lipasa NO son determinantes de severidad ni de pronóstico.
Tratamiento del dolor en la PA
El páncreas recibe inervación simpática, parasimpática y sensorial. Casi toda la inervación sensorial del páncreas proviene del sistema esplácnico izquierdo, pero algunas fibras esplácnicas derechas cruzan la línea media para inervarlo. En contraste con el sistema nervioso somático, en el visceral no existe distinción precisa entre receptores sensoriales nociceptivos y no nociceptivos. Al parecer, cuanto más intenso es el estímulo, y más receptores lo captan, más se transforma este de inocuo a nocivo. Por ello, la lesión localizada de una víscera abdominal no suele ser nociva, mientras que la estimulación generalizada, como la distensión de un órgano hueco o la inflamación sí causan dolor.
El dolor atribuido a inflamación pancreática a menudo se irradia al tórax o a los flancos, y causa espasmos reflejos de la musculatura de la espalda, que aparecen como consecuencia de la convergencia del sistema nervioso somático con aferentes viscerales en el asta medular dorsal. Las respuestas simpáticas descendentes ocasionadas por la percepción dolorosa producen una serie de alteraciones indeseables, como íleo, taquicardia, agitación, hipertensión, aumento del consumo de oxígeno, etc., que pueden controlarse, al menos en parte, con una buena analgesia.
Las intervenciones analgésicas en la PA suelen basarse en la administración IV de drogas analgésicas. Los fármacos más utilizados pertenecen a los grupos de los AINES y los opioides. Existen también intervenciones analgésicas más complejas o invasivas, como el bloqueo peridural lumbotorácico, con buenos resultados analgésicos, aunque aún se espera mayor evidencia, especialmente en los pacientes con inestabilidad hemodinámica.44 También existen alternativas terapéuticas como el bloqueo interpleural o del plexo celíaco.
Los opiáceos pueden ser una opción apropiada para el tratamiento del dolor en pancreatitis aguda. Comparados con otras opciones analgésicas, pueden reducir la necesidad de analgesia complementaria. Actualmente, no hay diferencias en el riesgo de complicaciones de la pancreatitis ni en los eventos adversos clínicamente graves entre los opiáceos y otras opciones de analgesia.
Los AINES conforman un amplio grupo de drogas. Entre las más utilizadas para el tratamiento del dolor agudo se encuentran el ibuprofeno, el diclofenac, el ketorolac y los denominados AINES atípicos, dipirona y paracetamol. Son buenos analgésicos para el dolor leve a moderado, aunque encuentran techo analgésico a dosis máximas. Ibuprofeno 2400 mg/día, diclofenac 150 mg/día y ketorolac 90 mg/día son las dosis recomendadas. En el caso del ketorolac no debe utilizarse más de cinco días por el alto riesgo de complicaciones gastrointestinales (úlcera, perforación, hemorragia) y renales. La dipirona o metamizol merece alguna consideración aparte, es una excelente droga analgésica y antipirética, con escasa acción antiinflamatoria y algún mecanismo de acción a nivel central en las vías de neuromodulación. Las dosis de dipirona pueden variar de 1 a 1,5 gr cada 6-8 horas.
Así como los AINES encuentran techo en su acción analgésica, los opioides potentes no lo tienen. Esta es la principal ventaja del uso de opioides en el tratamiento del dolor moderado a severo. El opioide más extendido en el uso clínico es la morfina, y existen alternativas como meperidina, buprenorfina, tramadol, etc. Ninguno de ellos ha demostrado tener mejores resultados. Si bien se propone que la acción anticolinérgica de la meperidina contrarresta la acción sobre el esfínter de Oddi, no hay evidencia clínica de este beneficio. También podría tener un mejor perfil terapéutico el tramadol, que además de tener acción agonista Mu, actúa en la modulación del asta posterior medular; sin embargo, este opioide tiene techo de dosis.
Las dosis de los opioides equipotentes por vía intravenosa en el manejo del dolor agudo son las siguientes:
Meperidina: 1 mg/kg + 3-4 mg/kg/día. Rescates: 0,3 mg/kg/dosis.
Morfina: 0,15 mg/kg + 0,3 – 0,5 mg/kg/día. Rescates: 0,03 mg/kg/dosis.
Tramadol: 1 mg/kg + 3-4 mg/kg/día. Rescates: 0,3 mg/kg/dosis.
El uso de bombas de analgesia controlada por el paciente (PCA) reduce el consumo total de opioides y aumenta la calidad de la analgesia.
El hecho de que la nocicepción es un mecanismo complejo con sistema de modulación a diferentes niveles hace posible el uso de analgesia multimodal, es decir la sumatoria de fármacos que actúen a diferentes niveles de la vía del dolor. Es común la asociación de un AINE con acción periférica y un opioide con acción central. Asimismo, se pueden sumar otras drogas con mecanismos de acción diferentes a modo de coadyuvantes, podemos nombrar a la ketamina por sus acciones sobre el receptor N-metil de aspartamo (NMDA), o a los antidepresivos tricíclicos (ANDT) por sus acciones sobre la 5 HT, así como la gabapentina y la clonidina.
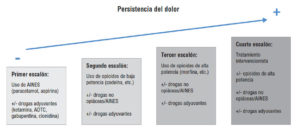
La OMS ha desarrollado la escalera analgésica para los pacientes con dolor oncológico, que se ha adaptado al manejo del dolor agudo y crónico no oncológico con el transcurso del tiempo (Figura 1).
Figura 1. Escalera analgésica de la Organización Mundial de la Salud (modificada por Vargas Schaffer).45
Resucitación con fluidos en PA
En la PA, la inflamación del páncreas y la respuesta inflamatoria sistémica asociada conducen a la extravasación de fluidos al tercer espacio. En los casos severos se produce hipovolemia, hipoperfusión y falla orgánica. La hipovolemia afecta la microcirculación pancreática y puede influir en el desarrollo de necrosis, además de comprometer las funciones renal y cardíaca. El objetivo de la hidratación es mejorar el volumen de fluidos circulante, para mejorar la oxigenación tisular. Por todo lo expuesto, la hidratación es uno de los puntos trascendentales en el manejo de la PA en etapas tempranas.
En la resucitación de fluidos deben evaluarse tres parámetros: tipo de hidratación, protocolo de administración y medición de respuesta al tratamiento implementado.
Respecto del tipo de hidratación, la mayoría de los trabajos y guías recomiendan el uso de cristaloides, en particular el Ringer lactato, basados en trabajos que evalúan la mejoría de la proteína C reactiva (PCR) y de la respuesta inflamatoria sistémica (SIRS).46, 47 No obstante, la supremacía del Ringer lactato sobre otros cristaloides no ha podido demostrarse en otros estudios, que argumentan la falta de impacto en la evolución final.48-53 El uso de coloides se desaconseja, por el riesgo de falla renal y muerte, principalmente ante sepsis severa, con acuerdo en toda la literatura.53-55
En el protocolo de administración, varios trabajos han demostrado que la hidratación rápida y no controlada aumenta los riesgos de infección, síndrome compartimental, necesidad de asistencia respiratoria mecánica y mortalidad.46, 47, 51, 54, 56-60 Por otro lado, la hidratación escasa también es inapropiada.
Debe tenerse en cuenta que la influencia favorable de la hidratación sobre la cascada inflamatoria ocurre en las primeras veinticuatro horas, pero el paciente en ocasiones llega más allá de este lapso.
La velocidad óptima de infusión es de 5-10 ml/h/kg; en la mayoría de los pacientes, la infusión de 2500-4000 ml en las primeras 24 horas es adecuada. No obstante, debe individualizarse según edad y comorbilidades.
La evaluación de la respuesta es fundamental; para ello deberán considerarse parámetros hemodinámicos, presión arterial media de 65-85 mmhg, frecuencia cardíaca menor a 120/min, respiratoria, saturación de oxígeno y diuresis (mayor a 0,5-1 ml/h/kg peso) y parámetros bioquímicos como hematocrito, urea, creatinina y lactato. En pacientes en unidad de terapia intensiva se utilizan parámetros invasivos: variación de volumen sistólico e intratorácico. La presión venosa central ha demostrado no ser un marcador adecuado.61-63
Pese a la gran cantidad de trabajos que aluden al tema, aún hay muchos aspectos que reforzar con evidencia clara.
Recomendaciones
- Realizar hidratación con cristaloides, sin que se puedan recomendar alguno en particular.
- Velocidad de infusión a considerar según comorbilidades.
- Realizarla dentro de las primeras 24 horas de la PA.
- Monitorear la respuesta con parámetros clínicos y bioquímicos.
Utilidad de la tomografía computada en las primeras 72 horas
Aquellos pacientes que al momento de su admisión hospitalaria reúnan los dos primeros criterios no van a requerir estudios por imágenes para confirmar el diagnóstico. De ser necesaria una evaluación mediante imágenes, en esta etapa de la enfermedad la ecografía abdominal es por disponibilidad, costo y rapidez el método más utilizado.
La tomografía computada (TC) es una técnica de gran disponibilidad y cuenta con grandes ventajas, particularmente vinculadas a su confiabilidad y precisión, siendo en la actualidad el método de elección ante la duda diagnóstica.
El protocolo adecuado incluye imágenes en las siguientes fases:
• Fase sin contraste intravenoso: permite evaluar la estructura y densidad basal del páncreas.
• Fase parenquimatosa pancreática: se obtiene aproximadamente a los 40 segundos del inicio de la inyección del contraste intravenoso. Es la fase de máximo realce del parénquima pancreático y donde observaremos alteraciones focales y/o defectos de perfusión.
• Fase portal: se realiza aproximadamente a los 65 segundos; contribuye a la detección y caracterización de complicaciones locales.
La PA es una enfermedad dinámica y evolutiva, que consta de dos fases. La fase temprana tiene una duración aproximada de una semana y el pronóstico está determinado por la magnitud y duración del SIRS. Considerando lo expresado es simple comprender que la TC no tiene un rol establecido en la fase temprana de la PA. Las imágenes se correlacionan pobremente con la severidad del cuadro, el estatus anatómico del páncreas y las eventuales complicaciones locales no predicen gravedad, la cual está determinada por la presencia de falla multiorgánica.
La TC permite determinar complicaciones locales tempranas, entre las que se destacan las colecciones necróticas agudas. De todas maneras, su presencia no modifica la conducta en las primeras 72 horas, excepcionalmente van a necesitar resolución y no es necesario documentarlas.64, 65
La capacidad de la TC para detectar necrosis permite estratificar a los pacientes, de acuerdo con el subtipo de PA, en edematosa o necrotizante. En la fase temprana este método tiene baja sensibilidad en el diagnóstico de necrosis, la cual se desarrolla paulatinamente a medida que se instala y persiste la hipoperfusión (consecuencia de alteración en la microcirculación). En los primeros días algunas áreas hipodensas en las imágenes pueden generar confusión entre edema (pancreatitis edematosa / intersticial) o presencia de necrosis establecida. En la fase tardía, las necrosis, tanto pancreática como peripancreáticas, se delimitan, teniendo la TC elevada precisión en su determinación.66, 67
En definitiva, las indicaciones para la realización de una TC en las primeras 72 horas de una PA son escasas.
No tiene indicación para el diagnóstico de la enfermedad, excepto que la clínica y/o el laboratorio no sean concluyentes. En este escenario, la ecografía abdominal suele ser la primera modalidad de imagen. De no ser categórica, la TC tendría un rol, dada su capacidad de establecer diagnósticos alternativos a PA que cursan con cuadro clínico similar.
Respecto de la etiología de la PA, la TC tampoco cumple un rol determinante. La causa biliar, la más frecuente, suele diagnosticarse mediante laboratorio y ecografía.
No es útil para definir en forma certera el subtipo de pancreatitis en los primeros días, ya que subestima la necrosis en la fase temprana. No tiene rol pronóstico donde los scores clínicos predicen mejor la severidad.
Recomendaciones
- La TC tiene indicación establecida en las primeras 72 horas de la enfermedad ante un paciente que presente deterioro clínico significativo o signos de sepsis que hagan sospechar infección de una colección necrótica aguda.
Uso racional de antimicrobianos
La utilización de antimicrobianos en las primeras 72 horas de la PA es un tema controversial. Por un lado, es indiscutible su rol en el tratamiento de las infecciones establecidas, y se ha propuesto que evitaría el desarrollo de infecciones locales o sistémicas. Por otro lado, su uso inapropiado está asociado a numerosos efectos adversos, como la emergencia de resistencia antimicrobiana, el desplazamiento hacia infecciones fúngicas o el surgimiento de diarrea por antimicrobianos, incluyendo la infección por C. difficile.68-70
Considerando la fisiopatogenia de la PA, es esperable la presencia de un síndrome de respuesta inflamatoria sistémica (SIRS) durante las primeras 48 horas de evolución, por lo que su identificación no es motivo suficiente para indicar antibioticoterapia.71 Asimismo, las infecciones más frecuentes en esta etapa son extrapancreáticas (colangitis concomitante, bacteriemia, neumonía, infección del tracto urinario, infección asociada a catéter), con una incidencia de 25-32%,72, 73 las cuales requieren un manejo diagnóstico y terapéutico particular.
Una de las complicaciones más devastadoras de la PA es la necrosis (peri)pancreática infectada (NPI), con una incidencia del 18% y una mortalidad asociada del 15-35%.74, 75 Sin embargo, su presentación suele ser tardía, con una mediana de 13-26 días desde la hospitalización.75-78 Solo en el 7% de los casos fue diagnosticada durante los primeros 7 días.79, 80 Se ha propuesto que la presencia de gas en la zona de necrosis (peri)pancreática, el compromiso extenso (>30%), la bacteriemia previa, valores de hematocrito mayores a 50% y procalcitonina elevada son factores de riesgo para presentar NPI ulterior, aunque no de forma concluyente.75, 77, 81, 82 Dado que la patogenia de la NPI suele ser por traslocación intestinal, los microorganismos más frecuentemente involucrados son enterobacterias (E. coli, K. pneumoniae), seguidas por P. aeruginosa, Enterococcus spp, Staphylococcus spp y cándida, siendo polimicrobiana en hasta el 32% de los casos.77, 83 Estudios observacionales realizados en centros de tercer nivel de atención identificaron que el 35-56% de los microorganismos causantes de la NPI eran multirresistentes, impactando en la elección del tratamiento empírico inicial.84, 85
Frente a la sospecha de NPI en las primeras 72 horas, tras descartar otras causas de persistencia de SIRS o empeoramiento clínico, y considerando su baja frecuencia en esta etapa, se sugiere la toma de hemocultivos y eventual punción con aguja fina guiada por imágenes de la zona de necrosis para tinción de Gram, cultivo y antibiograma, teniendo en cuenta que esta técnica presenta falsos negativos en 20%-29% y falsos positivos en 4%-10%.81 Muestras de múltiples sitios pueden aumentar el rédito.86 Las opciones de tratamiento empírico inicial de la NPI, basadas en la penetración pancreática y la potencial resistencia antimicrobiana, son imipenem o meropenem en monoterapia, piperacilina-tazobactam en monoterapia, o cefepime más metronidazol, a ajustar según aislamiento microbiológico.81, 85
Respecto del uso profiláctico de antimicrobianos en la PA, numerosos metaanálisis de estudios recientes han reportado su falta de eficacia para evitar infecciones extrapancreáticas, NPI y reducir la mortalidad asociada a las mismas.81, 87-89
Recomendaciones
- No se recomienda el uso de profilaxis antibiótica en la PA.
- En caso de sospecha de infección, evaluar causas extrapancreáticas en primera instancia.
- Frente a la sospecha de NPI en esta etapa, intentar documentarla: gas (peri) pancreático y/o cultivo de punción con aguja fina positivo para microorganismo compatible.
- Ante falta de evidencia de infección, suspender los antimicrobianos lo antes posible.
- Involucrar al Servicio de Infectología en la toma de decisiones tras el manejo inicial.
Manejo nutricional en PA en sus primeras 72 horas
La PA es una enfermedad altamente metabólica con activación de una cascada inflamatoria, en la que la terapia nutricional puede modular el estrés oxidativo, mantener la función intestinal, preservar la estructura acinar, disminuir el catabolismo evitando la malnutrición (MN) o agravamiento de esta, y obtener el equilibrio inmuno-inflamatorio.90
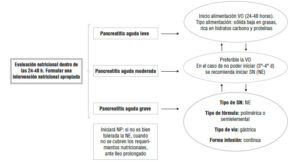
Se recomienda realizar una evaluación nutricional dentro de las 24-48 horas de ingreso a la institución, para determinar la presencia y el grado de MN y permitir una intervención nutricional adecuada (Figura 2).91, 92 Los pacientes con PA deberán clasificarse con un nivel moderado a elevado de riesgo nutricional, por el impacto de la enfermedad en el estado nutricional.90, 93
Figura 2. Manejo nutricional en PA.
Requerimientos calórico-proteicos:8, 94
En PA leve (PAL) = 25-30 kcal/kg/d de energía y 1,2-1,5 g/kg/d de proteínas.
En PA moderada (PAM) – PA grave (PAG) = 35 kcal/kg/d de energía y 1,5-2 g/kg/d de proteínas.*
*(Este límite debe reducirse a 15-20 kcal/de peso actual/día en los casos SIRS o MODS y cuando el paciente está en riesgo de síndrome de realimentación).
1. Nutrición en PAL
• Inicio nutrición oral
Se recomienda iniciar alimentación por vía oral temprana (dentro de las 24-48 horas)48, 88, 93 una vez que disminuya el dolor abdominal y los marcadores inflamatorios comiencen a mejorar, sin necesidad de esperar a que el dolor o los parámetros bioquímicos (amilasa y/o lipasa) se resuelvan completamente, y cuando los pacientes manifiesten tener apetito, ya que es factible y segura.9, 68, 95-97 Aproximadamente, el 20% de los pacientes experimentan una recaída del dolor cuando comienzan con alimentación oral.90, 93 En caso de no poder iniciar la vía oral al 3°- 4° día,48, 88 la vía de elección será la nutrición enteral (NE) en pacientes que requieran soporte nutricional (SN).90
• Composición del plan de alimentación.
Líquidos claros versus dieta sólida con bajo contenido de grasa.
La alimentación oral sólida, comparada con una dieta con líquidos claros, es bien tolerada y nutricionalmente más beneficiosa, ya que disminuye la estadía hospitalaria, se recomienda una alimentación rica en hidratos de carbono y proteínas, con bajo contenido de grasa.90, 92, 93, 98 En cuanto a la consistencia, se puede considerar una dieta blanda, debido a que el aumento en la ingesta de grasa produce saciedad precoz y retraso en el vaciamiento gástrico. En este caso, reduciendo la cantidad total de grasa en cada comida y / o la utilización de fuentes de grasas líquidas podrían mejorar la ingesta oral y promover el vaciamiento gástrico.90 Se considerará iniciar con fibra soluble en aquellos pacientes que experimentan diarrea como resultado de la inflamación pancreática.90
2. Nutrición en PAM
Este subgrupo de pacientes con PA tiene falla orgánica transitoria, que desaparece dentro de las 48 horas. Al igual que con todos los tipos de PA es preferible la vía oral, pero en caso de no poder iniciarla al 3°- 4° día, la NE es la vía de elección en pacientes que requieran SN.
3. Nutrición en PAG
• Cuándo iniciar SN y tipo de SN
La alimentación temprana puede mejorar la MN asociada a la PA y reducir significativamente la tasa de infección.90, 93, 99 Las Guías de Práctica Clínica recomiendan en aquellos pacientes que no toleren la vía oral y que requieran SN emplear NE, tan pronto como sea posible (dentro 24-48 horas).88, 90, 92-94, 98 La NE es la vía de elección.
• Vías de acceso, tipo de fórmula y métodos de administración
Las guías actuales recomiendan administrar la NE a través de la vía gástrica o yeyunal.90, 92, 93 Ambas vías de nutrición son factibles y seguras.48, 88, 90 En cuanto al tipo de fórmula enteral se pueden utilizar tanto las poliméricas como las semielementales.90, 93 No hay evidencia sobre el uso de fórmulas enterales enriquecidas con farmaconutrientes: probióticos,90, 93 prebióticos, simbióticos, arginina,90 glutamina,90 ácidos grasos ω 3,90 no habiéndose apreciado mejoría clínica significativa con el uso de estos inmunonutrientes en los pacientes con PAG. Se necesitan más trabajos randomizados para establecer la eficacia y seguridad de estas fórmulas en pacientes con PA.90 Las fórmulas enterales con fibras mixtas (solubles e insolubles) no se recomiendan en pacientes con riesgo de isquemia intestinal o dismotilidad severa, por lo que probablemente deberían evitarse en las fases iniciales de la PAG.90 Método de administración: se recomienda administrar la fórmula a través de infusión continua sobre la cíclica.92
NP: debe ser utilizada como terapia de segunda línea si la NE no es tolerada, cuando no se logra cubrir los requerimientos nutricionales o ante la presencia de íleo prolongado.48, 92, 93, 100 Tipo de fórmula parenteral: podría considerarse el uso glutamina (que la solución de aminoácidos contenga 0,3-0,57 g/kg/día) por un lapso de 5 a 10 días6, 9 pero no de forma rutinaria en pacientes críticos.96
CPRE: indicaciones en la pancreatitis aguda
La litiasis biliar (LB) es la causa más común de PA.101
La CPRE resulta ser efectiva para resolver la obstrucción biliar, con tasas de éxito superiores al 90%. Sin embargo, es una práctica que conlleva riesgo de eventos adversos, especialmente en pacientes que cursan PA.102
Desde hace varias décadas se discute el rol de la CPRE en pacientes con PA. Múltiples estudios fueron diseñados para evaluar su seguridad y beneficio. Estos presentan diferencias importantes en lo que respecta a criterios de selección de pacientes, severidad de la PA e indicación de la colangiografía.103-106
El trabajo de Oria y colaboradores tuvo como objetivo evaluar si la terapéutica endoscópica precoz era capaz de reducir el score de falla orgánica durante la primera semana y limitar la extensión de las lesiones pancreáticas y peripancreáticas. Los autores concluyeron que, a pesar de la existencia de obstrucción biliar, no hubo beneficios en realizar CPRE precoz en el curso de la enfermedad.107
Un metaanálisis realizado en 2012 concluyó que en casos de PA biliar asociada a colangitis la CPRE precoz disminuyó significativamente la mortalidad, como así también las complicaciones locales y sistémicas. No ocurrió lo mismo cuando se trató de obstrucción biliar sostenida.108
Con la evidencia actual, la realización de CPRE en PA podría resumirse de esta manera:109
• PA leve: no está indicada la CPRE.
• PA con colangitis: indicación de CPRE precoz.
• PA severa: estaría indicada la CPRE ante signos de empeoramiento clínico asociados a obstrucción biliar sostenida.
Es importante destacar que:109
• No se ha demostrado que la realización de la CPRE durante la evolución de una PA provoque exacerbación o empeoramiento del curso de esta.
• Por último, está bien establecido que la desobstrucción de la vía biliar no modifica la evolución de la PA.
Oportunidad de la colecistectomía en la PA biliar
Hasta el 80% de los casos detectados en la Argentina tendrán como etiología la presencia de litiasis biliar.101 La publicación original de Acosta en 1974 tuvo el inmenso valor de establecer la relación entre la migración transpapilar de una litiasis canalicular y la fisiopatología de la PA biliar.110
Por tal motivo, la remoción quirúrgica de la vesícula biliar cobra importancia como el principal gesto terapéutico para evitar la recurrencia de este cuadro.111 Por lo general, con la demostración de la litiasis vesicular es suficiente para atribuir a esta la causa de la pancreatitis. Por ende, salvo que el paciente tenga firmes antecedentes como tabaquismo o alcoholismo severo, o dudas en la presentación clínica, no son necesarios mayores estudios para categorizar a una pancreatitis como de probable origen biliar.
Por tal motivo, la colecistectomía disminuye el riesgo de volver a padecer otro episodio de PA a menos del 10%.112 Ese porcentaje de recurrencia incluye tanto a pacientes con litiasis coledociana residual o recidivada, como a pacientes con otra causa subyacente distinta a la LB.
El mejor momento en la evolución de una PA para realizar la colecistectomía ha sido motivo de controversias en las últimas décadas. En la actualidad, sin embargo, se ha logrado llegar a ciertos consensos desde un punto de vista conceptual.
En los casos de PA severa la colecistectomía debe diferirse hasta la completa resolución del cuadro inflamatorio local y sistémico.113 No tiene sentido operar a un paciente en el curso de una falla orgánica, o ante la presencia de colecciones líquidas o necróticas agudas. Se corre el riesgo de infectar colecciones estériles, y de lidiar con mayores dificultades técnicas por el proceso inflamatorio. En el caso excepcional de coexistir una colecisitis aguda con una pancreatitis severa se puede contemporizar la situación con una colecistostomía percutánea.
Por otra parte, en los casos de PA no severa, se aconseja realizar la colecistectomía laparoscópica en forma precoz.114 Aun así, existen controversias de qué tan precozmente debe realizarse. Hasta las guías publicadas presentan diferencias en este punto. Algunos autores proclaman realizar la colecistectomía entre las 2 a 4 semanas posteriores al alta. Sin embargo, diferir el acto quirurgico puede ser riesgoso ya que, en la espera, pueden ocurrir eventos biliopancreáticos agudos (33,8%) y pancreatitis recurrentes (15%).115
Por tal motivo, la mayoría de los centros presenta como criterio actual realizar la colecistectomía en ausencia de colecciones líquidas o necróticas, luego de resuelto el cuadro clínico, sin presencia de disfunción orgánica y en la misma internación del ataque.113, 116, 117
Algunos autores proclaman incluso la colecistectomía en las primeras 48 h de internación, en casos leves. Sin embargo, este concepto no es universalmente aceptado.118, 119
En cuanto a cuál es la mejor estrategia para lidiar con una eventual litiasis coledociana, la discusión se centra en cuatro alternativas. Una resuelve todo por vía laparoscópica mediante la instrumentación de la vía biliar, y las otras 3 utilizan la CPRE. Estas últimas opciones son:
1. CPRE inicial y colecistectomía laparoscópica posterior.
2. Colecistectomía laparoscópica + colangiografía intraoperatoria + CPRE posoperatoria.
3. Colecistectomía laparoscópica + colangiografía intraoperatoria + instrumentación biliar laparoscópica.
La primera opción corre el riesgo de realizar 70% de CPRE no terapéuticas, ya que al momento de realizarse el lito ya habrá migrado a duodeno. Por tal motivo sería aconsejable certificar previamente la litiasis canalicular mediante ecografía, resonancia o ecoendoscopía.
La segunda opción corre el riesgo de que la CPRE posoperatoria fracase en la extracción del cálculo condenando al paciente a un nuevo procedimiento para lograrlo.
La tercera opción es una estrategia que ha demostrado ser segura en pacientes con PA no severa en nuestro medio.
Por otra parte, la descompresión biliar de urgencia mediante CPRE debería quedar relegada principalmente a pacientes con coexistencia de colangitis aguda y pancreatitis.56, 108
Recomendaciones
- En la PA severa la colecistectomía debe diferirse hasta la resolución del cuadro inflamatorio local y sistémico.
- En las PA no severas, la colecistectomía debe realizarse precozmente para evitar la recurrencia de un ataque, preferentemente en la misma internación, previo al alta. La vía laparoscópica pura o combinada con el uso de CPRE selectiva perioperatoria son las estrategias más utilizadas en nuestro medio.
Conclusiones
La PA es una enfermedad trascendente que afecta a millones de personas en el mundo entero. Este trabajo intenta reducir las variaciones que existen en el enfoque inicial de la PA en nuestro medio, y promover los cuidados de alta calidad para los pacientes que la padecen. Se han descripto diez medidas, cada una de ellas por un especialista en el tema, primordiales durante las primeras 72 horas de la admisión, período en el cual la toma de decisiones puede alterar el curso de la enfermedad y la duración de la hospitalización. Las medidas a adoptar deben caracterizarse por su aplicabilidad y sencillez. Por ello, deseamos que este artículo resulte una herramienta útil en el manejo inicial de la PA. En el horizonte, la llave para mejorar los resultados posiblemente será el desarrollo de terapias que se orienten específicamente a minimizar la respuesta inmunológica causada por la autodigestión pancreática. Mientras tanto, deberíamos evitar el denominado “síndrome de la PA solitaria”, definido como aquella PA abandonada en una sala sin vigilancia posterior. Para ello disponemos de tratamientos protocolizados y multidisciplinarios que aseguran la gestión y seguridad del paciente que ingresa al hospital con una PA.
Para finalizar, adjuntamos una tabla con un resumen y las recomendaciones (Tabla 3).

Referencias
- D Yadav. The epidemiology of pancreatitis and pancreatic cancer. Gastroenterology 2013; 144: 1252-1261.
- De Campos T, Parreira JG, Utiyama E, Rasslan S. A Brazilian survey regarding the management of acute pancreatitis. Rev Col Bras Cir 2008; 35: 304-310.
- Junquera R, Pereyra I. Pancreatitis aguda. Arch Salud Pública 2010; 1: 24-30.
- Andersson B, Andrén-Sandberg A, Nilsson J, Andersson R. Survey of the management of acute pancreatitis in surgical departments in Sweden. Scand J Gastroenterol 2012; 47: 1064-1070.
- Duggan SN, Smyth ND, Sullivan MO, Feehan S, Ridgway PF, Conlon KC. A transatlantic survey of nutrition practice in acute pancreatitis. J Hum Nutr Diet 2012; 25: 388-397.
- Foitzik T, Klar E. (Non-)compliance with guidelines for the management of severe acute pancreatitis among German surgeons. Pancreatology 2007; 7: 80-85.
- Murata A, Matsuda S, Mayumi T, Yokoe M, Kuwabara K, Ichimiya Y, Fujino Y, Kubo T, Fujimori K, Horiguchi H. A descriptive study evaluating the circumstances of medical treatment for acute pancreatitis before publication of the new JPN guidelines based on the Japanese administrative database associated with the diagnosis procedure combination system. J Hepatobiliary Pancreat Sci 2011; 18: 678-683.
- Tenner S, Baillie J, DeWitt J, Vege SS, American College of G. American College of Gastroenterology guideline: management of acute pancreatitis. Am J Gastroenterol 2013; 108: 1400-1415.
- Guidelines WGIAP. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology 2013; 13: e1-e15.
- Agrawal A, Parikh M, Thella K, Jasdanwala S. Acute pancreatitis with normal lipase and amylase: an ED dilemma. Am J Emerg Med 2016; 34: e2254-e2256.
- Kumar P, Ghosh A, Sinha N, Tonk RS. Secondary hypertriglyceridemia causing recurrent acute pancreatitis with normal pancreatic enzymes. Indian J Crit Care Med 2018; 22: 381-383.
- Kitagawa S, Sawai K. Hypertriglyceridemia-Induced Acute Pancreatitis with Normal Pancreatic Enzymes. Am J Med 2018; 131: e299-e300.
- Robitaille D. Large increase in serum lipase in the absence of pancreatitis. Clin Chem 2017; 63: 789-790.
- Cohen J, MacArthur KL, Atsawarungruangkit A, Perillo MC, Martin CR, Berzin TM, Shapiro NI, Sawhney MS, Freedman SD, Sheth SG. Defining the diagnostic value of hyperlipasemia for acute pancreatitis in the critically ill. Pancreatology 2017; 17: 176-181.
- Muniraj T, Dang S, Pitchumoni CS. PANCREATITIS OR NOT? – Elevated lipase and amylase in ICU patients. J Crit Care 2015; 30: 1370-1375.
- Holman GA, Parasher G. Extra-pancreatic pancreatitis: A rare cause of abdominal pain. Dig Dis Sci 2014; 59: 1714-1716.
- Pathmarajah T, Idrees M, Nasim S, Weber DG. Serial lipase for pancreatitis: not enough evidence. ANZ J Surg 2018; 88: E491-E497.
- Reisman A, Cho HJ, Holzer H. Unnecessary repeat enzyme testing in acute pancreatitis a teachable moment. JAMA Intern Med 2018; 178: 702-703.
- Papachristou G, Machicado J, Stevens T, et al. Acute pancreatitis patient registry to examine novel therapies in clinical experience (APPRENTICE): an international, multicenter consortium for the study of acute pancreatitis. Annals of Gastroenterology 2017; 30: 106-113.
- Ocampo C, Kohan G, Leiro F y col. Diagnóstico y tratamiento de la pancreatitis aguda en la Argentina. Acta Gastroenterol Latinoam 2015; 45: 295-302.
- Lowenfels AB, Lankisch PG, Maisonneuve P. What is the risk of biliary pancreatitis in patients with gallstones? Gastroenterology 2000; 119: 879-880.
- Lankisch PG, Lowenfels AB, Maisonneuve P, Oría A. What is the risk of alcoholic pancreatitis in heavy drinkers? Pancreas 2002; 25: 411-412.
- Vila JJ, Borda F, Jiménez FJ. The role of endoscopic ultrasonography in the etiological evaluation of idiopathic acute pancreatitis. Rev Esp Enferm Dig 2008; 100: 90-97.
- Elta GH. Sphincter of Oddi dysfunction and bile duct microlithiasis in acute idiopathic pancreatitis. World J Gastroenterol 2008; 14: 1023-1026.
- Bai HX, Giefer M, Patel M, Orabi AI, Husain SZ. The association of primary hyperparathyroidism with pancreatitis. J Clin Gastroenterol 2012; 46: 656-661.
- Tenner S. Drug-induced acute pancreatitis: Underdiagnosis and overdiagnosis. Dig Dis Sci 2010; 55: 2706-2708.
- Haber CJ, Meltzer SJ, Present DH, Korelitz BI. Nature and course of pancreatitis caused by 6-mercaptopurine in the treatment of inflammatory bowel disease. Gastroenterology 1986; 91: 982-986.
- Sadr-Azodi O, Andrén-Sandberg Å, Orsini N, Wolk A. Cigarette smoking, smoking cessation and acute pancreatitis: A prospective population-based study. Gut 2012; 61: 262-267.
- Lindkvist B, Appelros S, Manjer J, Berglund G, Borgstrom A. A prospective cohort study of smoking in acute pancreatitis. Pancreatology 2008; 8: 63-70.
- Simons-Linares CR, Barkin JA, Jaiswal P. The effect of cannabis consumption on the development and severity of acute pancreatitis. Gastroenterology 2017; 152: S293.
- Sarr MG. 2012 revision of the Atlanta classification of acute pancreatitis. Pol Arch Med Wewnetrznej 2013; 123: 118-124.
- Whitcomb DC. Clinical practice. Acute pancreatitis. N Engl J Med 2006; 354: 2142-2150.
- Dellinger EP, Forsmark CE, Layer P, Lévy P, Maraví-Poma E, Petrov MS, Shimosegawa T, Siriwardena AK, Uomo G, Whitcomb DC, Windsor JA; PancreatitisAcross Nations Clinical Research and Education Alliance (PANCREA). Determinant-based classification of acute pancreatitis severity: An international multidisciplinary consultation. Ann Surg 2012; 256: 875-880.
- Forsmark CE, Swaroop Vege S, Wilcox CM. Acute Pancreatitis. Campion EW, ed. N Engl J Med 2016; 375: 1972-1981.
- Yang CJ, Chen J, Phillips ARJ, Windsor JA, Petrov MS. Predictors of severe and critical acute pancreatitis: A systematic review. Dig Liver Dis 2014; 46: 446-451.
- Petrov MS, Shanbhag S, Chakraborty M, Phillips ARJ, Windsor JA. Organ failure and infection of pancreatic necrosis as determinants of mortality in patients with acute pancreatitis. Gastroenterology 2010; 139: 813-820.
- Marshall JC, Cook DJ, Christou NV, Bernard GR, Sprung CL, Sibbald WJ. Multiple organ dysfunction score: A reliable descriptor of a complex clinical outcome. Crit Care Med 1995; 23: 1638-1652.
- Hamada T, Yasunaga H, Nakai Y, Isayama H, Horiguchi H, Fushimi K, Koike K. Japanese severity score for acute pancreatitis well predicts in-hospital mortality: A nationwide survey of 17,901 cases. J Gastroenterol 2013; 48: 1384-1391.
- Wu BU, Johannes RS, Sun X, Tabak Y, Conwell DL, Banks PA. The early prediction of mortality in acute pancreatitis: A large population-based study. Gut 2008; 57: 1698-1703.
- Jain S, Midha S, Mahapatra SJ, Gupta S, Sharma MK, Nayak B, Jacob TG, Shalimar Garg PK. Interleukin-6 significantly improves predictive value of systemic inflammatory response syndrome for predicting severe acute pancreatitis. Pancreatology 2018.
- Singh VK, Wu BU, Bollen TL, Repas K, Maurer R, Mortele KJ, Banks PA. Early systemic inflammatory response syndrome is associated with severe acute pancreatitis. Clin Gastroenterol Hepatol 2018; 7: 1247-1251.
- Kuo DC, Rider AC, Estrada P, Kim D, Pillow MT. Acute Pancreatitis: What’s the Score? J Emerg Med 2015; 48: 762-770.
- Mounzer R, Langmead CJ, Wu BU, Evans AC, Bishehsari F, Muddana V, Singh VK, Slivka A, Whitcomb DC, Yadav D, Banks PA, Papachristou GI. Comparison of existing clinical scoring systems to predict persistent organ failure in patients with acute pancreatitis. Gastroenterology 2012; 142: 1476-1482.
- Windisch O, Heidegger C-P, Giraud R, Morel P, Buhler L. Thoracic epidural analgesia: a new approach for the treatment of acute pancreatitis? Crit Care 2016; 20: 116.
- Vargas-Schaffer G. Is the WHO analgesic ladder still valid? Twenty-four years of experience. Can Fam Physician 2010; 56: 514-517.
- Mao EQ, Tang YQ, Fei J, Qin S, Wu J, Li L, Min D, Zhang SD. Fluid therapy for severe acute pancreatitis in acute response stage. Chin Med J 2009; 122: 169-173.
- Mao EQ, Fei J, Peng YB, Huang J, Tang YQ, Zhang SD. Rapid hemodilution is associated with increased sepsis and mortality among patients with severe acute pancreatitis. Chinese Med J 2010; 123: 1639-1644.
- Vege SS, DiMagno MJ, Forsmark CE, Martel M, Barkun AN. Initial Medical Treatment of Acute Pancreatitis: American Gastroenterological Association Institute Technical Review. Gastroenterology 2018; 154: 1103-1139.
- Lipinski M, Rydzewska-Rosolowska A, Rydzewski A, Rydzewska G. Fluid resuscitation in acute pancreatitis: Normal saline or lactated Ringer’s solution? World J Gastroenterol 2015; 21: 9367-9372.
- Yokoe M, Takada T, Mayumi T, Yoshida M, Isaji S, Wada K, Itoi T, Sata N, Gabata T, Igarashi H, Kataoka K, Hirota M, Kadoya M, Kitamura N, Kimura Y, Kiriyama S, Shirai K, Hattori T, Takeda K, Takeyama Y, Hirota M, Sekimoto M, Shikata S, Arata S, Hirata K. Japanese guidelines for the management of acute pancreatitis: Japanese Guidelines 2015. J Hepatobiliary Pancreat Sci 2015; 22: 405-432.
- Wu BU, Hwang JQ, Gardner TH, Repas K, Delee R, Yu S, Smith B, Banks PA, Conwell DL. Lactated Ringer’s solution reduces systemic inflammation compared with saline in patients with acute pancreatitis. Clin Gastroenterol Hepatol 2011; 9: 710-717.
- Young P, Bailey M, Beasley R, Henderson S, Mackle D, McArthur C, McGuinness S, Mehrtens J, Myburgh J, Psirides A, Reddy S, Bellomo R; SPLIT Investigators; ANZICS CTG. Effect of a Buffered Crystalloid Solution vs. Saline on Acute Kidney Injury Among Patients in the Intensive Care Unit. JAMA 2015; 314: 1701.
- Shaw AD, Schermer CR, Lobo DN, Munson SH, Khangulov V, Hayashida DK, Kellum JA. Impact of intravenous fluid composition on outcomes in patients with systemic inflammatory response syndrome. Crit Care 2015; 19: 334.
- Raghunathan K, Shaw A, Nathanson B, Stürmer T, Brookhart A, Stefan MS, Setoguchi S, Beadles C, Lindenauer PK. Association between the choice of IV crystalloid and in-hospital mortality among critically Ill adults with sepsis. Crit Care Med 2014; 42: 1585-1591.
- Perel P, Roberts I, Ker K. Colloids versus crystalloids for fluid resuscitation in critically ill patients. Cochrane Database Syst Rev 2013; 2: CD000567.
- Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology 2013; 13: e1-e15.
- Yunos NRAM, Bellomo R, Hegarty FC, Story D, Ho L, Bailey M. Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults. JAMA – J Am Med Assoc 2012; 308: 1566-1572.
- Du XJ, Hu WM, Xia Q, Huang ZW, Chen GY, Jin XD, Xue P, Lu HM, Ke NW, Zhang ZD, Li QS. Hydroxyethyl starch resuscitation reduces the risk of intra-abdominal hypertension in severe acute pancreatitis. Pancreas 2011; 40: 1220-1225.
- Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Åneman A, Madsen KR, Møller MH, Elkjær JM, Poulsen LM, Bendtsen A, Winding R, Steensen M, Berezowicz P, Søe-Jensen P, Bestle M, Strand K, Wiis J, White JO, Thornberg KJ, Quist L, Nielsen J, Andersen LH, Holst LB, Thormar K, Kjældgaard AL, Fabritius ML, Mondrup F, Pott FC, Møller TP, Winkel P, Wetterslev J; 6S Trial Group; Scandinavian Critical Care Trials Group. Hydroxyethyl Starch 130/0.42 vs. Ringer’s Acetate in Severe Sepsis. N Engl J Med 2012; 367: 124-134.
- Buxbaum JL, Quezada M, Da B, Jani N, Lane C, Mwengela D, Kelly T, Jhun P, Dhanireddy K, Laine L. Early aggressive hydration hastens clinical improvement in mild acute pancreatitis. Am J Gastroenterol 2017; 112: 797-803.
- Mole DJ, Hall A, McKeown D, Garden OJ, Parks RW. Detailed fluid resuscitation profiles in patients with severe acute pancreatitis. HPB 2011; 13: 51-58.
- Medicine TF of the AC of CC. Guidelines for intensive care unit admission, discharge, and triage. Task Force of the American College of Critical Care Medicine, Society of Critical Care Medicine. Crit Care Med 1999; 27: 633-638.
- Singla A, Simons J, Li Y, Csikesz NG, Ng SC, Tseng JF, Shah SA. Admission volume determines outcome for patients with acute pancreatitis. Gastroenterology 2009; 137: 1995-2001.
- Thoeni RF. The Revised Atlanta Classification of Acute Pancreatitis: Its importance for the radiologist and its effect on treatment. Radiology 2012; 262: 751-764.
- Foster BR, Jensen KK, Bakis G, Shaaban AM, Coakley FV. Revised Atlanta Classification for Acute Pancreatitis: A Pictorial Essay. Radio Graphics 2016; 36: 675-687.
- Spanier BWM, Nio Y, Van Der Hulst RWM, Tuynman HARE, Dijkgraaf MGW, Bruno MJ. Practice and yield of early CT scan in acute pancreatitis: A dutch observational multicenter study. Pancreatology 2010; 10: 222-228.
- Shyu JY, Sainani NI, Sahni VA, Chick JF, Chauhan NR, Conwell DL, Clancy TE, Banks PA, Silverman SG. Necrotizing Pancreatitis: Diagnosis, Imaging, and Intervention. Radio Graphics 2014; 34: 1218-1239.
- Greenberg JA, Hsu J, Bawazeer M, Marshall J, Friedrich JO, Nathens A, Coburn N, May GR, Pearsall E, McLeod RS. Clinical practice guideline: Management of acute pancreatitis. Can J Surg 2016; 59: 128-140.
- Shah AP, Mourad MM, Bramhall SR. Acute pancreatitis: Current perspectives on diagnosis and management. J Inflamm Res 2018; 11: 77-85.
- Moka P, Goswami P, Kapil A, Xess I. Impact of antibiotic-resistant bacterial and fungal infections in outcome of acute pancreatitis 2018; 47: 489-494.
- da Costa DW, Boerma D, van Santvoort HC, Horvath KD, Werner J, Carter CR, Bollen TL, Gooszen HG, Besselink MG, Bakker OJ. Staged multidisciplinary step-up management for necrotizing pancreatitis. Br J Surg 2014; 101: e65-e79.
- Brown LA, Hore TA, Phillips ARJ, Windsor JA, Petrov MS. A systematic review of the extra-pancreatic infectious complications in acute pancreatitis. Pancreatology 2014; 14: 436-443.
- Pando E, Alberti P, Hidalgo J, Vidal L, Dopazo C, Caralt M, Blanco L, Gómez-Gavara C, Bilbao I, Balsells J, Charco R. The role of extra-pancreatic infections in the prediction of severity and local complications in acute pancreatitis. Pancreatology 2018; 18: 486-493.
- van Dijk SM, Hallensleben NDL, van Santvoort HC, Fockens P, van Goor H, Bruno MJ, Besselink MG; Dutch Pancreatitis Study Group. Acute pancreatitis: recent advances through randomised trials. Gut 2017; 66: 2024-2032.
- Besselink MG, van Santvoort HC, Boermeester MA, Nieuwenhuijs VB, van Goor H, Dejong CH, Schaapherder AF, Gooszen HG; Dutch Acute Pancreatitis Study Group. Timing and impact of infections in acute pancreatitis. Br J Surg 2009; 96: 267-273.
- Dellinger EP, Tellado JM, Soto NE, Ashley SW, Barie PS, Dugernier T, Imrie CW, Johnson CD, Knaebel HP, Laterre PF, Maravi-Poma E, Kissler JJ, Sanchez-Garcia M, Utzolino S. Early antibiotic treatment for severe acute necrotizing pancreatitis: A randomized, double-blind, placebo-controlled study. Ann Surg 2007; 245: 674-683.
- Chen HZ, Ji L, Li L, Wang G, Bai XW, Cheng CD, Sun B. Early prediction of infected pancreatic necrosis secondary to necrotizing pancreatitis. Medicine (Baltimore) 2017; 96: e7487.
- Xue P, Deng LH, Zhang ZD, Yang XN, Wan MH, Song B, Xia Q. Infectious complications in patients with severe acute pancreatitis. Dig Dis Sci 2009; 54: 2748-2753.
- Bourgaux JF, Defez C, Muller L, Vivancos J, Prudhomme M, Navarro F, Pouderoux P, Sotto A. Infectious complications, prognostic factors and assessment of anti-infectious management of 212 consecutive patients with acute pancreatitis. Gastroentérologie Clin Biol 2007; 31: 431-435.
- Petrov MS, Chong V, Windsor JA. Infected pancreatic necrosis : Not necessarily a late event in acute pancreatitis. Word J Gastroenterol 2011; 17: 3173-3176.
- Arvanitakis M, Dumonceau JM, Albert J, Badaoui A, Bali MA, Barthet M, Besselink M, Deviere J, Oliveira Ferreira A, Gyökeres T, Hritz I, Hucl T, Milashka M, Papanikolaou IS, Poley JW, Seewald S, Vanbiervliet G, van Lienden K, van Santvoort H, Voermans R, Delhaye M, van Hooft J. Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guidelines. Endoscopy 2018; 50: 524-546.
- Theodore N, Pappas, Peter A, Banks MD. Is computerized tomographic fine needle aspiration helpful in the management of infected pancreatic necrosis ? PRO : Computerized Tomographic Fine. Am J Gastroenterol 2005; 100: 2371-2374.
- De Waele JJ, Rello J, Anzueto A, Moreno R, Lipman J, Sakr Y, Pickkers P, Leone M, Ferguson A, Oud L, Vincent JL; EPIC II Investigators. Infections and use of antibiotics in patients admitted for severe acute pancreatitis: Data from the EPIC II Study. Surg Infect (Larchmt) 2014; 15: 394-398.
- Lee HS, Lee SK, Park DH, Lee SS, Seo DW, Kim MH, Chong YP. Emergence of multidrug resistant infection in patients with severe acute pancreatitis. Pancreatology 2014; 14: 450-453.
- S u M-S, Lin M-H, Zhao Q-H, Liu Z-W, He L, Jia N. Clinical study of distribution and drug resistance of pathogens in patients with severe acute pancreatitis. Chin Med J (Engl) 2012; 125: 1772-1776.
- Parvin R, Louie T, Pitchumoni CS. Infectious Complications of Acute Pancreatitis. Infect Dis Clin Pract 2013; 21: 94-104.
- Villatoro E, Mulla M, Larvin M. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis. In: Cochrane Database of Systematic Reviews 2010; 5: CD002941.
- Mandalia A, Wamsteker EJ, DiMagno M. American Gastroenterological Association Institute Guideline on Initial Management of Acute Pancreatitis. Gastroenterology 2018; 154: 1096-1101.
- Mourad M, Evans R, Kalidindi V, Navaratnam R, Dvorkin L, Bramhall S. Prophylactic antibiotics in acute pancreatitis: endless debate. Ann R Coll Surg Engl 2017; 99: 107-112.
- McClave SA. Drivers of oxidative stress in acute pancreatitis: the role of nutrition therapy. JPEN J Parenter Enteral Nutr 2012; 36: 24-35.
- Canicoba M, de Baptista GA, Visconti G. Funciones y competencias del nutricionista clínico. Documento de consenso. Revista Cubana de Alimentación y Nutrición 2013; 23: 146-172.
- Mirtallo JM, Forbes A, McClave SA, Jensen GL, Waitzberg DL, Davies AR. International consensus guidelines for nutrition therapy in pancreatitis. JPEN J Parenter Enteral Nutr 2012; 36: 284-291.
- Consenso de práctica clinica de soporte nutricional del paciente adulto críticamente enfermo. Grupo de Trabajo de Abordaje Nutricional en el Paciente Crítico de la Asociación Argentina de Nutrición Enteral y Parenteral (AANEP) Sociedad Argentina de Terapia Intensiva (SATI).
- Li-Long Pan, Jiahong Li, Muhammad Shamoon, Madhav Bhatia, Jia Sun. Recent advances on nutrition in treatment of acute pancreatitis. Front Immunol 2017; 8: 762.
- Meier R, Ockenga J, Pertkiewicz M, Pap A, Milinic N, Macfie J; DGEM (German Society for Nutritional Medicine), Löser C, Keim V; ESPEN (European Society for Parenteral and Enteral Nutrition). ESPEN Guidelines on Enteral Nutrition: Pancreas. Clin Nutr 2006; 25: 275-284.
- McClave SA, Taylor BE, Martindale RG, Warren MM, Johnson DR, Braunschweig C, McCarthy MS, Davanos E, Rice TW, Cresci GA, Gervasio JM, Sacks GS, Roberts PR, Compher C; Society of Critical Care Medicine; American Society for Parenteral and Enteral Nutrition. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr 2016; 40: 159-211.
- Zhao XL, Zhu SF, Xue GJ, Li J, Liu YL, Wan MH, Huang W, Xia Q, Tang WF. Early oral refeeding based on hunger in moderate and severe acute pancreatitis: a prospective controlled, randomized clinical trial. Nutrition 2015; 31: 171-175.
- Tenner S, Baillie J, DeWitt J, Vege SS. American College of Gastroenterology guideline: management of acute pancreatitis. Am J Gastroenterol 2013; 108: 1400-1415.
- Jacobson BC, Vander Vliet MB, Hughes MD, Maurer R, McManus K, Banks PA. A prospective, randomized trial of clear liquids versus low-fat solid diet as the initial meal in mild acute pancreatitis. Clin Gastroenterol Hepatol 2007; 5: 946-951.
- Sun J-K, Mu X-W, Li W-Q, Tong Z-H, Li J, Zheng S-Y. Effects of early enteral nutrition on immune function of severe acute pancreatitis patients. World J Gastroenterol 2013; 19: 917-922.
- Ocampo C, Kohan G, Leiro F, Basso S, Gutiérrez S, Perna L, Serafini V, Lada P, Lanceloti T, García H, Tolino M, Stork G, Zandalazini H, Buonomo L, Mercade J, Ferreres A, Troubul F, Latif J, Klappenbach R, Capitanich P, Rainone P, Sisco P, Zartarian D, Álvarez S, Fraile A. Diagnóstico y tratamiento de la pancreatitis aguda en la Argentina. Resultados de un estudio prospectivo en 23 centros. Acta Gastroenterol Latinoam 2015; 45: 295-302.
- Baron TH. Role of ERCP in complicated pancreatitis. In: ERCP: The Fundamentals: Second Edition 2014: 328-340. doi:10.1002/9781118769409.ch22
- Mark DH, Lefevre F, Flamm CR, Aronson N. Evidence-based assessment of ERCP in the treatment of pancreatitis. Gastrointestinal Endoscopy 2002; 56: S249-S254.
- Neoptolemos JP, London NJ, James D, Carr-Locke DL, Bailey IA, Fossard DP. Controlled trial of urgent endoscopic retrograde cholangiopancreatography and endoscopic sphincterotomy vs. conservative treatment for acute pancreatitis due to gallstones. Lancet 1988; 332: 979-983.
- Fan S-T, Lai E, Mok F, Lo C-M, Zheng S-S, Wong J. Early treatment of acute biliary pancreatitis by endoscopic papillotomy. N Engl J Med 1993; 328: 228-232.
- Fölsch UR, Nitsche R, Lüdtke R, Hilgers RA, Creutzfeldt W. Early ERCP and papillotomy compared with conservative treatment for acute biliary pancreatitis. The German Study Group on Acute Biliary Pancreatitis. N Engl J Med 1997; 336: 237-242.
- Oría A, Cimmino D, Ocampo C, Silva W, Kohan G, Zandalazini H, Szelagowski C, Chiappetta L. Early endoscopic intervention versus early conservative management in patients with acute gallstone pancreatitis and biliopancreatic obstruction: A randomized clinical trial. Ann Surg. 2007; 245 (1): 10-17.
- Tse F, Yuan Y. Early routine endoscopic retrograde cholangiopancreatography strategy versus early conservative management strategy in acute gallstone pancreatitis. Cochrane Database Syst Rev 2012; 5: CD009779.
- Easler JJ, Sherman S. Endoscopic retrograde cholangiopancreatography for the management of common bile duct stones and gallstone pancreatitis. Gastrointest Endosc Clin N Am 2015; 25: 657-675.
- Acosta JM, Ledesma CL. Gallstone migration as a cause of acute pancreatitis. N Engl J Med. 1974; 290 (9): 484-487. doi:10.1056/NEJM197402282900904
- Lund H, Tønnesen H, Tønnesen MH, Olsen O. Long-term recurrence and death rates after acute pancreatitis. Scand J Gastroenterol 2006; 41: 234-238.
- Lankisch PG, Breuer N, Bruns A, Weber-Dany B, Lowenfels AB, Maisonneuve P. Natural history of acute pancreatitis: A long-term population-based study. Am J Gastroenterol 2009; 104: 2797-2805.
- Nealon WH, Bawduniak J, Walser EM, Pitt HA, Behrns KE, Stain SC. Appropriate timing of cholecystectomy in patients who present with moderate to severe gallstone-associated acute pancreatitis with peripancreatic fluid collections. Annals of Surgery 2004: 239: 741-751.
- van Baal MC, Besselink MG, Bakker OJ, van Santvoort HC, Schaapherder AF, Nieuwenhuijs VB, Gooszen HG, van Ramshorst B, Boerma D; Dutch Pancreatitis Study Group. Timing of cholecystectomy after mild biliary pancreatitis: A systematic review. Ann Surg 2012; 255: 860-866.
- Ito K, Ito H, Whang EE. Timing of cholecystectomy for biliary pancreatitis: Do the data support current guidelines? J Gastrointest Surg 2008; 12: 2164-2170.
- Vitale GC. Early management of acute gallstone pancreatitis. Ann Surg. 2007; 245 (1): 18-19. doi:10.1097/01.sla.0000250967.32581.c9
- Yadav D, O’Connell M, Papachristou GI. Natural history following the first attack of acute pancreatitis. Am J Gastroenterol 2012; 107: 1096-1103.
- Aboulian A, Chan T, Yaghoubian A, Kaji AH, Putnam B, Neville A, Stabile BE, de Virgilio C. Early cholecystectomy safely decreases hospital stay in patients with mild gallstone pancreatitis: A randomized prospective study. Ann Surg 2010; 251: 615-619.
- Gurusamy KS, Nagendran M, Davidson BR. Early vs. delayed laparoscopic cholecystectomy for acute gallstone pancreatitis. Cochrane Database Syst Rev 2013; 9: Cd010326.
Correspondencia: Cecilia Curvale
Av. Calchaquí 5401, Florencio Varela. provincia de Buenos Aires, Argentina / Tel.: 11-40878193
Correo electrónico: cecicurvale@hotmail.com
Acta Gastroenterol Latinoam 2019;49(4):307-323
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE