María Mercedes Manresa
Instituto de Gastroenterología Salim.
Salta, Argentina.
Acta Gastroenterol Latinoam 2020;50:47-52
Abreviaturas
VEDA: Videoendoscopía digestiva alta.
EEo: Esofagitis eosinofílica.
Introducción
La disfagia es un síntoma frecuente que se define como la sensación de dificultad en el pasaje del material deglutido desde la boca al estómago. Su prevalencia en la población general se encuentra alrededor del 16%. La identificación temprana de su causa, y la intervención terapéutica correspondiente son fundamentales para prevenir complicaciones como broncoaspiración, desnutrición y pérdida de peso.
En la evaluación inicial de los pacientes con disfagia esofágica, la videoendoscopía digestiva alta (VEDA) es el procedimiento diagnóstico de elección ya que permite la visualización directa del esófago, la toma de muestras para anatomía patológica y la planificación e implementación de técnicas terapéuticas. En los pacientes con disfagia orofaríngea, en cambio, el método de elección es la videofluoroscopía de la deglución. Si dicho estudio es normal debe solicitarse una VEDA ya que un pequeño porcentaje de pacientes con disfagia orofaríngea tienen el origen de su patología a nivel esofágico. En esta revisión nos centraremos en la utilidad de la VEDA en la evaluación diagnóstica del paciente con disfagia esofágica, abordando algunas de sus etiologías más frecuentes.
Al realizar una VEDA podemos encontrar como causa de disfagia orgánica una obstrucción mecánica o un proceso inflamatorio (Tabla 1). Durante el estudio podemos observar también signos sugestivos de un trastorno motor esofágico, como restos de alimentos en esófago y/o resistencia al paso por la unión gastroesofágica.
Tabla 1. Etiología de la disfagia esofágica

Un estudio realizado por Krishnamurthy y col. analizó la prevalencia de diferentes diagnósticos endoscópicos en 30.377 pacientes que se sometieron a una VEDA por presentar disfagia. El hallazgo más frecuente fue estenosis esofágica (41%), seguido por esófago normal (32%), esofagitis erosiva o úlceras esofágicas (22%), impactación esofágica de alimentos (2%) y sospecha de malignidad (1%). Otros autores evaluaron la prevalencia de esofagitis eosinofílica (EEo) en pacientes con disfagia, encontrando un 15-23%.
Los pacientes sin evidencia de obstrucción mecánica ni de esofagitis en la VEDA deben continuar la evaluación diagnóstica con una manometría esofágica de alta resolución. En ausencia de trastornos esofágicos mayores de la motilidad debe descartarse enfermedad por reflujo gastroesofágico antes de llegar al diagnóstico de disfagia funcional.
La sonda de imagen luminal funcional (FLIP) permite medir las propiedades mecánicas del esófago, como distensibilidad y compliance, y evaluar la función motora del mismo durante una VEDA con sedación. Aunque este dispositivo se utiliza actualmente como una herramienta complementaria en el manejo de la disfagia, a medida que se realicen más investigaciones y aumente su accesibilidad, puede convertirse en la prueba inicial para el paciente con disfagia indiferenciada en el momento de la endoscopía índice.
Estenosis esofágica
Ante el hallazgo endoscópico de una estenosis esofágica es importante clasificarla estructuralmente en simple o compleja ya que esto nos va a ayudar a determinar su etiología y a planificar su abordaje terapéutico. Las estenosis simples son cortas (< 2 cm), tienen una luz simétrica y un diámetro igual o mayor a 12 mm que puede atravesarse fácilmente con un endoscopio estándar. Las estenosis complejas son largas (> 2 cm), con luz irregular, tienen un diámetro luminal menor a 12 mm y pueden asociarse con alteraciones anatómicas, como una hernia de hiato grande, divertículos esofágicos o una fístula traqueoesofágica.
Cuando se sospecha malignidad en base a las características endoscópicas de la estenosis o a la clínica del paciente, deben obtenerse muestras de biopsias. En este sentido, las biopsias esofágicas que se realizan en el mismo procedimiento de una dilatación no parecen aumentar el riesgo de perforación.
Adenocarcinomas de la unión gastroesofágica
Los adenocarcinomas de la unión gastroesofágica se definen como tumores que tienen su centro dentro de los 5 cm proximales y distales de la línea Z. La clasificación de Siewert-Stein nos permite diferenciar entre adenocarcinoma de esófago distal (tipo I), de cardias (tipo II) y gástrico (tipo III), según la localización del centro del tumor. Esta distinción es fundamental para definir el tratamiento quirúrgico a realizar, que es diferente en los tres subtipos.
Esofagitis eosinofílica
La disfagia es el síntoma cardinal de los pacientes adultos con EEo. Cuando se realiza una VEDA debe evaluarse la presencia de signos de EEo, e idealmente cuantificarlos utilizando el score de referencia endoscópica. Dicho sistema de clasificación y graduación fue validado en pacientes adultos en un estudio multicéntrico prospectivo, obteniendo buen acuerdo interobservador para cinco signos endoscópicos mayores y un signo menor (Tabla 2). En series de adultos, la sensibilidad de los signos endoscópicos de EEo oscila entre el 50% y el 90% con especificidad mayor al 90%. Si bien no son un criterio necesario para el diagnóstico, aportan evidencia a favor del mismo y permiten dirigir la toma de biopsias.17 Algunos de estos signos se atribuyen al componente inflamatorio de la enfermedad (exudados), mientras que otros se asocian a fibrosis (anillos fijos, estenosis, esófago de calibre estrecho).
Tabla 2. Sistema de clasificación y graduación de signos endoscópicos de EEo

Hirano y col. encontraron un acuerdo interobservador pobre para esófago de calibre estrecho y esófago felino. El esófago de calibre estrecho consta de dos componentes: estrechamiento radial y extensión longitudinal. La sensibilidad de la VEDA para identificar la presencia de esta entidad, según lo determinado por esofagograma, es de 15-21%. Es por esto que, cuando se evalúa la presencia de disfagia en pacientes con EEo, es necesario usar medidas más precisas de diámetro y distensibilidad esofágicas además de la VEDA. El esófago felino consiste en anillos transitorios que duran algunos segundos y que desaparecen cuando el esófago está distendido. Hirano y col. sostienen que se trata de un fenómeno normal del esófago. Se piensa que reflejan el acortamiento esofágico durante las relajaciones transitorias del esfínter esofágico inferior y durante las degluciones. A diferencia del esófago felino, los anillos esofágicos que caracterizan a la EEo son fijos y en ocasiones se hacen más evidentes durante la insuflación del esófago.
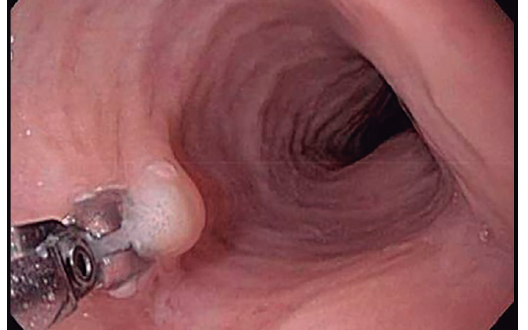
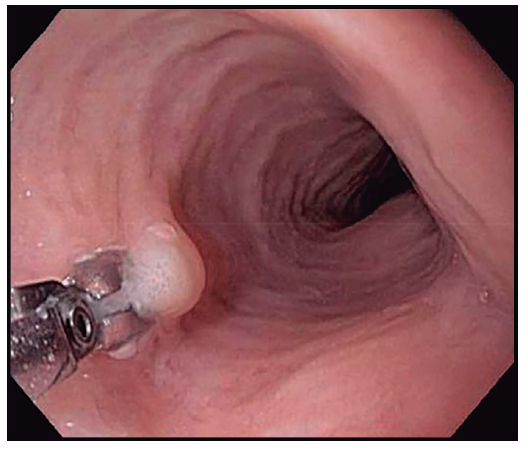
Los cambios inflamatorios de la EEo son parcheados, por lo que pueden no estar presentes en todas las muestras de biopsias. La sensibilidad diagnóstica de la VEDA aumenta con el número de biopsias y se maximiza con al menos seis muestras. Por dicha razón, Lucendo y col. recomiendan tomar por lo menos seis biopsias de dos localizaciones diferentes, típicamente del esófago distal y proximal. Se recomienda dirigir las biopsias esofágicas a las zonas con signos endoscópicos; principalmente exudados y surcos longitudinales, los cuales se asocian con mayor recuento de eosinófilos.Deben obtenerse biopsias de esófago en todos los pacientes con disfagia no explicada, a pesar de una apariencia endoscópica normal, ya que esto puede diagnosticar EEo en aproximadamente uno de cada diez casos. Moawad y col., y posteriormente Dellon y col., observaron que al tomar biopsias esofágicas en pacientes con EEo la mucosa se percibe firme y ofrece resistencia cuando se tracciona la pinza para extraerla. Esto se conoce como signo del tirón o signo de tracción de la biopsia esofágica (Figura 1), el cual podría deberse a la presencia de fibrosis en la lámina propia. Dellon y col. demostraron que dicho signo es muy específico para el diagnóstico de EEo (especificidad 98% – VPP 97%) y encontraron un buen acuerdo interobservador.
Figura 1. Signo del tirón de la biopsia esofágica. Se observa incapacidad para cerrar completamente la pinza de biopsia y levantamiento de la mucosa al traccionar para extraer la muestra
Ante la presencia de síntomas, hallazgos endoscópicos, o alto índice de sospecha de un proceso mucoso a nivel gastroduodenal, deben obtenerse muestras de dichos sectores. En ausencia de lo mencionado, las biopsias gastroduodenales tienen un rendimiento bajo para diagnóstico de trastornos gastrointestinales eosinofílicos.
Es importante tener en cuenta que el diagnóstico de EEo no puede descartarse mediante una VEDA con biopsias normales si esta se realizó mientras el paciente tomaba inhibidores de bomba de protones. Es por esto que algunos expertos proponen que la VEDA del paciente con disfagia se realice previa suspensión de dichos fármacos por dos semanas.
Por último, la VEDA tiene un papel importante en la evaluación de trastornos esofágicos asociados con eosinofilia esofágica secundaria, los cuales incluyen esofagitis infecciosas, enfermedad por reflujo gastroesofágico y acalasia.
Esofagitis por cándida
La candidiasis esofágica es la causa más frecuente de esofagitis infecciosa, seguida por virus herpes simple y citomegalovirus.
Se manifiesta endoscópicamente como placas o exudados blanquecinos que afectan a la mucosa esofágica en forma difusa. Ocasionalmente pueden observarse úlceras esofágicas, en cuyo caso es importante descartar la presencia de una infección coexistente.
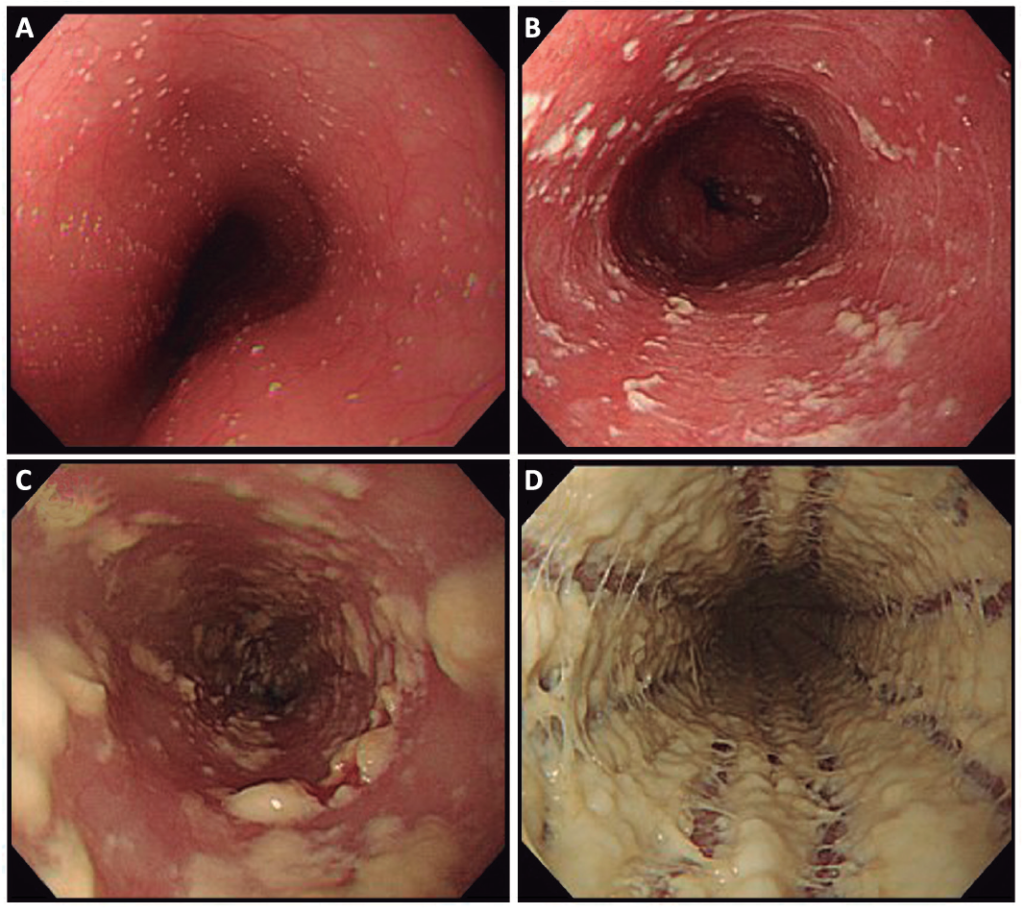
La graduación de la severidad endoscópica de la esofagitis por cándida es útil en la práctica clínica. Se realiza mediante la clasificación de Kodsi que establece cuatro grados con buen acuerdo interobservador (Figura 2). La infección por HIV se asocia de forma independiente a los grados endoscópicos severos (3 y 4) de dicha clasificación. Es por esto que Asayama y col. sugieren solicitar una prueba de HIV a los pacientes con diagnóstico de esofagitis por cándida severa.Los grados severos también se asocian con complicaciones como estenosis, hemorragia y fístula traqueoesofágica.
Figura 2. Severidad endoscópica de la esofagitis por cándida según la clasificación de Kodsi. A) Grado 1: algunas placas blanquecinas elevadas de hasta 2 mm. B) Grado 2: múltiples placas blanquecinas elevadas mayores de 2 mm. C) Grado 3: placas elevadas confluentes, lineales y nodulares. Puede haber úlceras superficiales. D) Grado 4: hallazgos de grado 3 con aumento de la friabilidad de las membranas mucosas y estrechamiento ocasional de la luz
La sensibilidad de la citología por cepillado es significativamente mayor que la de las biopsias. Sin embargo, ambas técnicas son complementarias y aumentan el rendimiento diagnóstico. Las biopsias, a su vez, permiten descartar coinfecciones virales.
La esofagitis por cándida se asocia con otras alteraciones estructurales y funcionales del esófago por lo que es necesario examinar detalladamente la mucosa esofágica y la unión gastroesofágica en busca de factores predisponentes.
Disfagia postcirugía antirreflujo
Ante la presencia de disfagia persistente luego de una cirugía antirreflujo, la VEDA es una herramienta complementaria al esofagograma que nos permite identificar diferentes alteraciones anatómicas que pueden explicar el síntoma del paciente. Para esto es fundamental conocer el aspecto endoscópico de una funduplicatura normal y describir estos hallazgos de forma detallada. En condiciones normales, la unión gastroesofágica se encuentra dentro de la funduplicatura y puede atravesarse sin resistencia con el endoscopio. En la retrovisión, se observan dos pliegues bien marcados, uno anterior y otro posterior, ajustados alrededor del endoscopio en forma simétrica.
A continuación, se detallan las posibles alteraciones anatómicas que se asocian con disfagia posquirúrgica persistente, con su correspondiente descripción endoscópica.
Funduplicatura girada o torcida: los pliegues anterior y posterior son asimétricos, con uno más marcado que el otro.
Ruptura parcial de la funduplicatura: los pliegues se observan poco marcados y no se ajustan al endoscopio.
Funduplicatura intratorácica: se encuentra por encima del nivel del hiato diafragmático, con hernia hiatal recurrente.
Funduplicatura deslizada: está localizada alrededor del estómago en lugar de alrededor del esófago distal.46
Conclusión
La VEDA es una herramienta eficaz en la evaluación diagnóstica y terapéutica del paciente con disfagia. Es fundamental hacer una descripción detallada de los hallazgos endoscópicos, utilizar las clasificaciones disponibles y tomar las muestras de biopsias recomendadas, para tratar de determinar la etiología de la disfagia orgánica mediante una única VEDA. Tener que repetir el procedimiento para llegar al diagnóstico demora el inicio del tratamiento, aumentando los riesgos y los costos.
Bibliografía recomendada
- Eslick GD, Talley NJ. Dysphagia: epidemiology, risk factors and impact on quality of life–a population-based study. Aliment Pharmacol Ther 2008; 27: 971-979.
- Triggs J, Pandolfino J. Recent advances in dysphagia management. F1000Res 2019; 8 (F1000 Faculty Rev): 1527.
- Akaishi T, Nakano T, Machida T, Abe M, Takayama S, Koseki K, Kamei T, Fukudo S, Ishii T. Clinical usefulness of endoscopy, barium fluoroscopy, and chest computed tomography for the correct diagnosis of achalasia. Internal Medicine 2020; 59: 323-328.
- Krishnamurthy C, Hilden K, Peterson KA, Mattek N, Adler DG, Fang JC. Endoscopic findings in patients presenting with dysphagia: analysis of a national endoscopy database. Dysphagia 2012; 27: 101-105.
- Prasad GA, Talley NJ, Romero Y, Arora AS, Kryzer LA, Smyrk TC, Alexander JA. Prevalence and predictive factors of eosinophilic esophagitis in patients presenting with dysphagia: a prospective study. Am J Gastroenterol 2007; 102: 2627-2632.
- Ricker J, McNear S, Cassidy T, Plott E, Arnold H, Kendall B, Franklin K. Routine screening for eosinophilic esophagitis in patients presenting with dysphagia. Therap Adv Gastroenterol 2011; 4: 27-35.
- Aziz Q, Fass R, Gyawali CP, Miwa H, Pandolfino JE, Zerbib F. Esophageal disorders. Gastroenterology 2016; 150: 1368-1379.
- Carlson DA, Lin Z, Kahrilas PJ, Sternbach J, Donnan EN, Friesen L, Listernick Z, Mogni B, Pandolfino JE. The functional lumen imaging probe detects esophageal contractility not observed with manometry in patients with achalasia. Gastroenterology 2015; 149: 1742-1751.
- Kwiatek MA, Kahrilas PJ, Soper NJ, Bulsiewicz WJ, McMahon BP, Gregersen H, Pandolfino JE. Esophagogastric junction distensibility after fundoplication assessed with a novel functional luminal imaging probe. J Gastrointest Surg 2010; 14: 268-276.
- Carlson DA, Lin Z, Rogers MC, Lin CY, Kahrilas PJ, Pandolfino JE. Utilizing functional lumen imaging probe topography to evaluate esophageal contractility during volumetric distention: a pilot study. Neurogastroenterol Motil 2015; 27: 981-989.
- Hirano I, Pandolfino JE, Boeckxstaens GE. Functional lumen imaging probe for the management of esophageal disorders: expert review from the clinical practice updates committee of the AGA Institute. Clin Gastroenterol Hepatol 2017; 15: 325-334.
- ASGE Standards of Practice Committee; Pasha SF, Acosta RD, Chandrasekhara, V, Chathadi KV, Decker GA, Early DS, Evans JA, Fanelli RD, Fisher DA, Foley KQ, Fonkalsrud L, Hwang JH, Jue TL, Khashab MA, Lightdale JR, Muthusamy VR, Sharaf R, Saltzman JR, Shergill AK, Cash B. The role of endoscopy in the evaluation and management of dysphagia. Gastrointest Endosc 2014; 79: 191-201.
- Lew RJ, Kochman ML. A review of endoscopic methods of esophageal dilation. J. Clin Gastroenterol 2002; 35: 117-126.
- Barkin JS, Taub S, Rogers AI. The safety of combined endoscopy, biopsy and dilation in esophageal strictures. Am J Gastroenterol 1981; 76: 23-26.
- Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg 1998; 85: 1457-1459.
- Dellon ES, Liacouras CA, Molina-Infante J, Furuta GT, Spergel JM, Zevit N, Spechler SJ, Attwood SE, Straumann A, Aceves SS, Alexander JA, Atkins D, Arva NC, Blanchard C, Bonis PA, Book WM, Capocelli KE, Chehade M, Cheng E, Collins MH, Davis CM, Dias JA, Di Lorenzo C, Dohil R, Dupont C, Falk GW, Ferreira CT, Fox A, Gonsalves NP, Gupta SK, Katzka DA, Kinoshita Y, Menard-Katcher C, Kodroff E, Metz DC, Miehlke S, Muir AB, Mukkada VA, Murch S, Nurko S, Ohtsuka Y, Orel R, Papadopoulou A, Peterson KA, Philpott H, Putnam PE, Richter JE, Rosen R, Rothenberg ME, Schoepfer A, Scott MM, Shah N, Sheikh J, Souza RF, Strobel MJ, Talley NJ, Vaezi MF, Vandenplas Y, Vieira MC, Walker MM, Wechsler JB, Wershil BK, Wen T, Yang GY, Hirano I, Bredenoord AJ. Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference. Gastroenterology 2018; 115: 1022-1033.
- Hirano I, Moy N, Heckman MG, Thomas CS, Gonsalves N, Achem SR. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013; 62: 489-495.
- Veerappan GR, Perry JL, Duncan TJ, Baker TP, Maydonovitch C, Lake JM, Wong RKH, Osgard EM. Prevalence of eosinophilic esophagitis in an adult population undergoing upper endoscopy: a prospective study. Clin Gastroenterol Hepatol 2009; 7: 420-426.
- Mackenzie SH, Go M, Chadwick B, Thomas K, Fang J, Kuwada S, Lamphier S, Hilden K, Peterson K. Eosinophilic oesophagitis in patients presenting with dysphagia-a prospective analysis. Aliment Pharmacol Ther 2008; 28: 1140-1146.
- Lim JR, Gupta SK, Croffie JM, Pfefferkorn MD, Molleston JP, Corkins MR, Davis MM, Faught PP, Steiner SJ, Fitzgerald JF. White specks in the esophageal mucosa: An endoscopic manifestation of non-reflux eosinophilic esophagitis in children. Gastrointest Endosc 2004; 59: 835-838.
- Straumann A, Spichtin HP, Bucher KA, Heer P, Simon HU. Eosinophilic esophagitis: red on microscopy, white on endoscopy. Digestion 2004; 70: 109-116.
- Cheng E, Souza RF, Spechler SJ. Tissue remodeling in eosinophilic esophagitis. Am J Physiol Gastrointest Liver Physiol 2012; 303: 1175-1187.
- Dellon ES, Kim HP, Sperry SLW, Rybnicek DA, Woosley JT, Shaheen NJ. A phenotypic analysis shows that eosinophilic esophagitis is a progressive fibrostenotic disease. Gastrointest Endosc 2014; 79: 577-585.
- Carlson DA, Hirano I. Narrow-caliber esophagus of eosinophilic esophagitis: difficult to define, resistant to remedy. Gastrointest Endosc 2016; 83: 1149-1150.
- Gentile N, Katzka D, Ravi K, Trenkner S, Enders F, Killian J, Kryzer L, Talley N J, Alexander J. Oesophageal narrowing is common and frequently under-appreciated at endoscopy in patients with oesophageal eosinophilia. Aliment Pharmacol Ther 2014; 40: 1333-1340.
- Samadi F, Levine MS, Rubesin SE, Katzka DA, Laufer I. Feline esophagus and gastroesophageal reflux. AJR Am J Roentgenol 2010; 194: 972-976.
- Shah A, Kagalwalla AF, Gonsalves N, Melin-Aldana H, Li BUK, Hirano I. Histopathologic variability in children with eosinophilic esophagitis. Am J Gastroenterol 2009; 104: 716-721.
- Peery AF, Cao H, Dominik R, Shaheen NJ, Dellon ES. Variable reliability of endoscopic findings with white-light and narrow-band imaging for patients with suspected eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011; 9: 475-480.
- Dellon ES, Speck O, Woodward K, Woosley JT, Shaheen NJ. The patchy nature of esophageal eosinophilia in eosinophilic esophagitis: insights from pathology samples from a clinical trial. Gastroenterology 2012; 142: S-432.
- SaffarI H, Peterson KA, Fang JC Teman C, Gleich GJ, Pease 3rd LF. Patchy eosinophil distributions in an esophagectomy specimen from a patient with eosinophilic esophagitis: Implications for endoscopic biopsy. J Allergy Clin Immunol 2012; 130: 798-800.
- Lucendo AJ, Molina Infante J, Arias A, Von Arnim U, Bredenoord AJ, Bussmann C, Días JA, Bove M, González Cervera J, Larsson H, Miehlke S, Papadopoulou A, Rodríguez Sánchez J, Ravelli A, Ronkainen J, Sanander C, Schoepfer AM, Storr MA, Terreehorst I, Straumann A, Attwood SE. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J 2017; 5: 335-358.
- Nielsen JA, Lager DJ, Lewin M, Rendon G, Roberts CA. The optimal number of biopsy fragments to establish a morphologic diagnosis of eosinophilic esophagitis. Am J Gastroenterol 2014; 109: 515-520.
- Salek J, Clayton F, Vinson L, Saffari H, Pease 3rd LF, Boynton K, Fang J, Cox K, Peterson KA. Endoscopic appearance and location dictate diagnostic yield of biopsies in eosinophilic oesophagitis. Aliment Pharmacol Ther 2015; 41: 1288-1295.
- Moawad FJ, Robinson CL, Veerappan GR, Summers TA, Maydonovitch CL, Wong RK. The tug sign: an endoscopic feature of eosinophilic esophagitis. Am J Gastroenterol 2013; 108: 1938-1939.
- Dellon ES, Gebhart JH, Higgins LL, Hathorn KE, Woosley JT, Shaheen NJ. The esophageal biopsy “pull” sign: a highly specific and treatment-responsive endoscopic finding in eosinophilic esophagitis. Gastrointest Endosc 2016; 83: 92-100.
- Wilcox CM, Karowe MW. Esophageal infections: etiology, diagnosis, and management. Gastroenterologist 1994; 2: 188-206.
- Alsomali MI, Arnold MA, Frankel WL, Graham RP, Hart PA, Lam-Himlin DM, Naini BV, Voltaggio L, Arnold CA. Challenges to “Classic” Esophageal Candidiasis. Looks Are Usually Deceiving. Am J Clin Pathol 2017; 147: 33-42.
- Asayama N, Nagata N, Shimbo T, Nishimura S, Igari T, Akiyama J, Ohmagari N, Hamada Y, Nishijima T, Yazaki H, Teruya K, Oka S, Uemura N. Relationship between clinical factors and severity of esophageal candidiasis according to Kodsi’s classification. Dis Esophagus 2014; 27: 214-219.
- Kodsi BE, Wickremesinghe C, Kozinn PJ, Iswara K, Goldberg PK. Candida esophagitis: a prospective study of 27 cases. Gastroenterology 1976; 71: 715-719.
- Kurnatowska I, Pazurek M, Nowicki M. Case of esophagitis in a posttransplant female patient. Ann Transplant 2007; 12: 39-42.
- Gaissert HA, Breuer CK, Weissburg A, Mermel L. Surgical management of necrotizing Candida esophagitis. Ann Thorac Surg 1999; 67: 231-233.
- Jones JM, Glass NR, Belzer FO. Fatal Candida esophagitis in two diabetics after renal transplantation. Arch Surg 1982; 117: 499-501.
- Kanzaki R, Yano M, Takachi K, Ishiguro S, Motoori M, Kishi K, Miyashiro I, Ishikawa O, Imaoka S. Candida esophagitis complicated by an esophago-airway fistula: report of a case. Surg Today 2009; 39: 972-978.
- Geisinger KR. Endoscopic biopsies and cytologic brushings of the esophagus are diagnostically complementary. Am J Clin Pathol 1995; 103: 295-299.
- Ahuja NK, Clarke JO. Evaluation and management of infectious esophagitis in immunocompromised and immunocompetent individuals. Curr Treat Options Gastroenterol 2016; 14: 28-38.
- Juhasz Arpad, Sundaram A, Hoshino M, Lee TH, Filipi CJ, Mittal SK. Endoscopic assessment of failed fundoplication: a case for standardization. Surg Endosc 2011; 25: 3761-3766.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE