Matías Turchi, Mauricio Ramírez, Federico Llanos, Adolfo Badaloni, Fabio Nachman, Alejandro Nieponice
Unidad de Esófago del Hospital Universitario Fundación Favaloro.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2020;50:38-43
Introducción
La enfermedad por reflujo gastroesofágico (ERGE) es una enfermedad con alta prevalencia en occidente que presenta algunos desafíos para su diagnóstico y tratamiento. Si bien la historia clínica, la anamnesis y la respuesta al tratamiento médico son insuficientes para hacer un diagnóstico concluyente de ERGE, son datos valiosos para determinar la necesidad de un mayor estudio como la videoendoscopía digestiva alta (VEDA). Una VEDA normal no excluye ERGE, pero proporciona evidencia de apoyo para refutarla junto con los datos aportados por los estudios funcionales esofágicos normales (manometría esofágica y pH-impedanciometría). La evidencia concluyente para el diagnóstico de ERGE en la endoscopía incluye la esofagitis erosiva (Tabla 1), el esófago de Barrett (Figura 1) o la estenosis péptica.
Tabla 1. Clasificación de Los Ángeles para esofagitis por reflujo
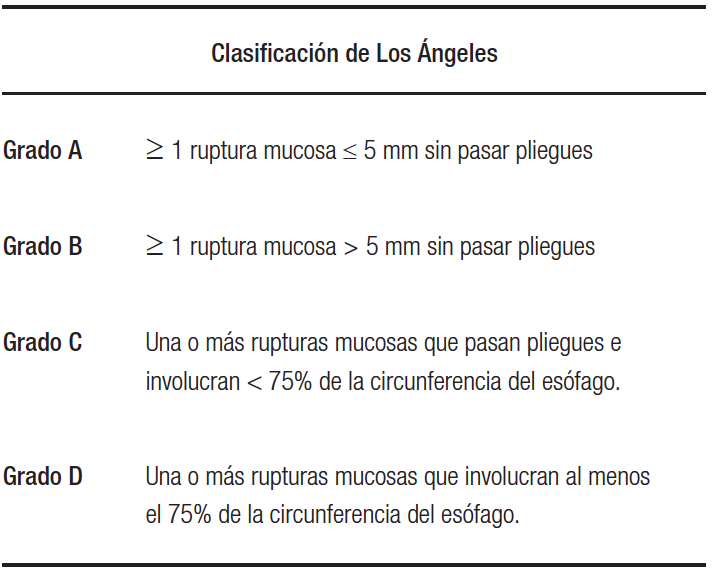
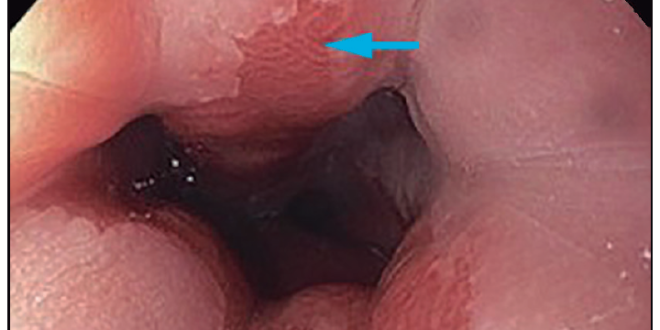
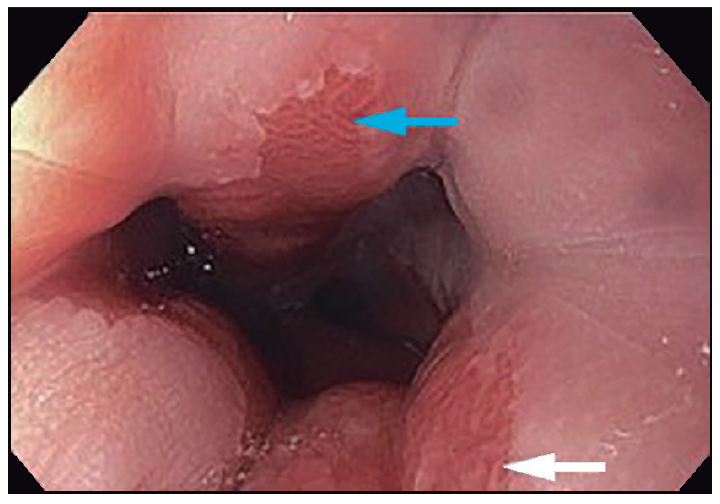
Figura 1. Esófago de Barrett evaluado con luz blanca C2 M4. Flecha azul: lengüeta asalmonada de 1 cm en hora 12. Flecha blanca: lengüeta de mucosa asalmonada de 2 cm en hora 6
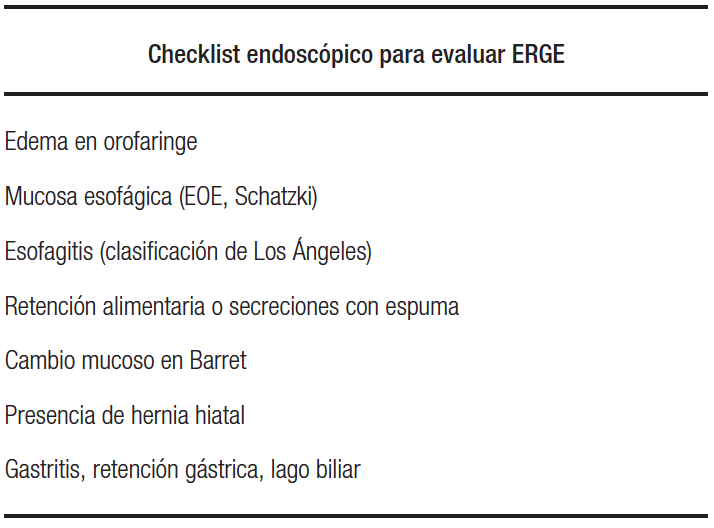
Los signos de ERGE a evaluar durante una VEDA, desde la orofaringe, incluyen: edema en la orofaringe, esofagitis, retención alimentaria o secreciones con espuma, cambio mucoso de aspecto metaplásico, presencia de una hernia hiatal, gastropatía, retención gástrica y lago biliar (Tabla 2). Algunos de estos hallazgos plantean el dilema de cuándo y cómo tomar biopsias de la mucosa esofágica y gástrica. Para ello se han desarrollado nuevas tecnologías que facilitan esta decisión, dirigen la toma de muestras de biopsias y permiten obtener más detalles clínico-patológicos de los hallazgos realizados con métodos convencionales.
Tabla 2. Listado propuesto para evaluar durante una endoscopía la presencia de signos de ERGE de forma ordenada
Esófago de Barrett: ¿cuándo y cómo biopsiar?
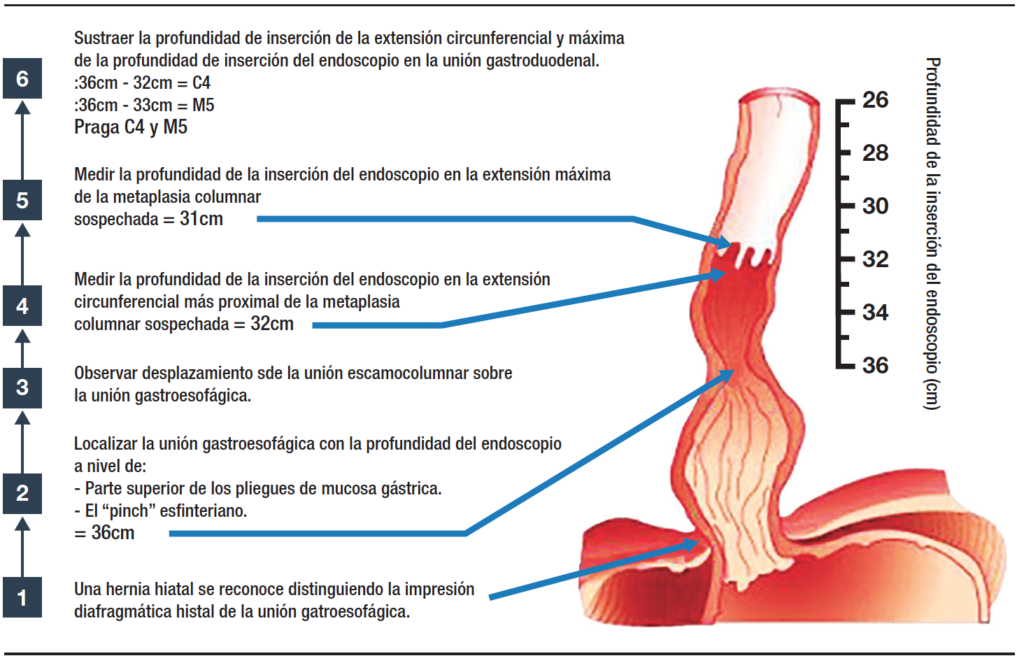
El esófago de Barrett (EB) se define como un cambio histológico del esófago distal, de epitelio escamoso a columnar, cuya histología muestra una metaplasia intestinal con células caliciformes. La mucosa resultante del esófago distal con líneas columnares puede identificarse por su color rosa salmón durante el examen endoscópico. La medición precisa de las longitudes de esófago con revestimiento columnar y su correcta descripción en términos clínicos bien definidos son importantes para una evaluación y una vigilancia de riesgos adecuadas. El sistema de clasificación de criterios de Praga (Figura 2) que mide la extensión circunferencial (C) y máxima (M) para la estandarización endoscópica de las longitudes de EB fue desarrollado y finalmente introducido por el Grupo de Trabajo Internacional para la Clasificación de la Esofagitis (IWGCO) en 2004.
Figura 2. Clasificación de Praga
Para confirmar el diagnóstico de EB se necesitan múltiples biopsias endoscópicas de este epitelio asalmonado. Hay que destacar que las biopsias sobre el cambio mucoso pueden generar confusión y falsos positivos. Recientemente las guías internacionales han considerado que las líneas Z irregulares con menos de 1 cm de variabilidad no deben biopsiarse en individuos sometidos a endoscopía.
Para el seguimiento endoscópico en pacientes con EB se recomiendan biopsias aleatorizadas de cuatro cuadrantes cada 1 o 2 cm para detectar displasia según el protocolo de Seattle. Asimismo, en áreas sospechosas se recomienda además tomar biopsias dirigidas bajo endoscopía de luz blanca. Estas biopsias deben ser procesadas y confirmadas por dos patólogos expertos. Sin embargo, la fiabilidad general y la validez del protocolo de Seattle siguen siendo consideradas subóptimas y presentan un amplio campo para el avance científico.
Por esta razón se han desarrollado y masificado técnicas de imágenes avanzadas tales como cromoendoscopía (índigo carmín, azul de metileno, cristal violeta y ácido acético) y cromoendoscopía virtual (Narrow Band Imaging-NBI®, flexible spectral imaging color enhancement–FICE) que incrementan la tasa de rendimiento diagnóstico de displasia o cáncer en un 34%, buscando prevenir el desarrollo del adenocarcinoma avanzado y el compromiso de ganglios linfáticos.
Publicaciones recientes muestran que la cromoendoscopía virtual (NBI) y la toma de biopsias dirigidas pueden mejorar la eficacia de detección y vigilancia del EB. Las biopsias dirigidas por NBI tienen mayor tasa de detección de displasia y adenocarcinoma temprano de esófago que un examen de luz blanca durante el protocolo de Seattle, y requieren, a su vez, menos biopsias.
WATS3d
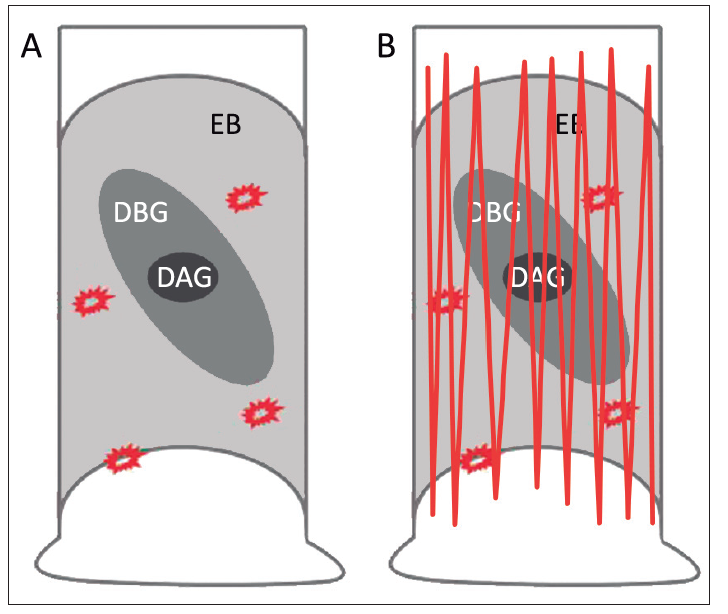
Otro avance en la detección y seguimiento del EB es el muestreo transepitelial de área amplia con análisis de tejido tridimensional computarizado (WATS). Es un método diferente a las biopsias de cuatro cuadrantes del protocolo de Seattle y a las biopsias dirigidas, pero que puede adjuntarse a estos. Consiste en un cepillo abrasivo, que se utiliza para tomar muestras de un área circunferencial grande del esófago para obtener una muestra de tejido de espesor completo del epitelio, incluida la lámina propia. A diferencia de la citología exfoliativa estándar, el cepillo WATS obtiene microbiopsias o fragmentos de tejido completo además de células individuales (Figura 3).
Figura 3. A: Biopsia de mucosa esofágica estándar. B: Biopsia de mucosa con WATS3d.
EB: Esófago de Barrett. DBG: Displasia de bajo grado. DAG: Displasia de alto grado
El análisis de estas biopsias es realizado por un sistema especializado de imágenes por computadora, que utiliza redes específicamente optimizadas para la evaluación de mucosa esofágica. Las capturas de computadora WATS integran todos los cortes juntos para crear una imagen tridimensional sintetizada de la glándula, que se muestra al patólogo, incluida la apariencia in vivo y sin cortes de la superficie glandular no visible en un típico espécimen histológico. El microscopio, asistido por computadora, escanea esta imagen tridimensional sintetizada e identifica y localiza las células caliciformes y la displasia para mostrar al patólogo. Además, las coordenadas exactas de todas las celdas seleccionadas por computadora en el portaobjetos microscópico se muestran en el monitor para que el patólogo pueda localizar y confirmar cualquier anormalidad en la diapositiva. Las imágenes identificadas por la computadora son revisadas por patólogos en conjunto con el microscopio manual y se informan utilizando criterios morfológicos estándar para el diagnóstico de EB y displasia.
Debido al riesgo inherente mencionado de pasar por alto el EB y la displasia epitelial con el protocolo de Seattle aleatorio de cuatro cuadrantes, WATS representa una herramienta potencialmente valiosa para mejorar la detección de la enfermedad, el manejo del paciente y los resultados en el seguimiento.
Inteligencia Artificial
Otro avance que ha llegado para superar el desafío de la detección de la displasia y el cáncer temprano de esófago es la inteligencia artificial. Las estrategias y técnicas endoscópicas, como el NBI y la endomicroscopía láser confocal, están siendo desarrolladas e implementadas en muchos países, resultando en una mayor detección de lesiones tempranas, con la disminución de la mortalidad por cáncer digestivo alto.
Sin embargo, el riesgo de perder una lesión sospechosa de displasia o cáncer temprano en exámenes de endoscopía aún podría ser muy alto en hospitales con bajo volumen de pacientes, o en regiones menos desarrolladas o remotas, e incluso en países donde se realizan muchas endoscopías. La inteligencia artificial ya ha demostrado su potencial para ayudar al hombre en diversos campos médicos. Por ejemplo, la inteligencia artificial puede extrapolar automáticamente estructuras complejas de microimagen (es decir, el alcance de ramas tubulares mucosas y anomalías de intensidad de color) e identificar características cuantitativas a nivel de píxel, que son a menudo indetectables por el ojo humano.
Clínicamente, el uso más importante de la inteligencia artificial endoscópica es asistir en la diferenciación entre lesiones neoplásicas y no neoplásicas. Se han publicado resultados sobre el uso de la inteligencia artificial donde Gastrointestinal Artificial Intelligence Diagnostic System (GRAIDS) logró una alta precisión diagnóstica en la detección de cánceres gastrointestinales superiores, con una sensibilidad similar a la de los endoscopistas expertos, y fue superior a la de endoscopistas no expertos. Este sistema podría ayudar a los hospitales y centros a mejorar su eficacia en la detección de cáncer temprano del tracto digestivo superior.
Aporte de la endoscopía diagnóstica a la cirugía antirreflujo
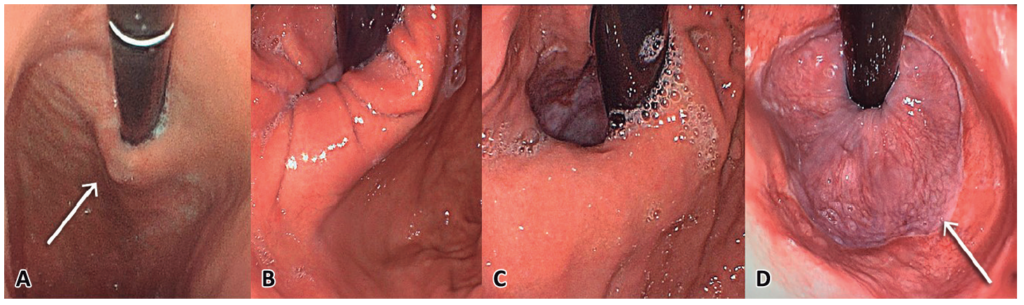
Otro desafío para el endoscopista en el contexto de la ERGE es la evaluación del tracto digestivo alto desde el punto de vista anatómico-quirúrgico. En el diagnóstico, la anatomía del hiato y de la unión gastroesofágica deben ser evaluadas y clasificadas utilizando la clasificación de Hill (Figura 3). En cambio, en la evaluación de un procedimiento antirreflujo, como puede ser una funduplicatura o una cirugía derivativa, esta clasificación para la evaluación del cardias pierde vigencia. Sin embargo, es importante distinguir entre una nueva anatomía normal y una nueva anatomía alterada o patológica cuando aparecen complicaciones postoperatorias (Figura 4).
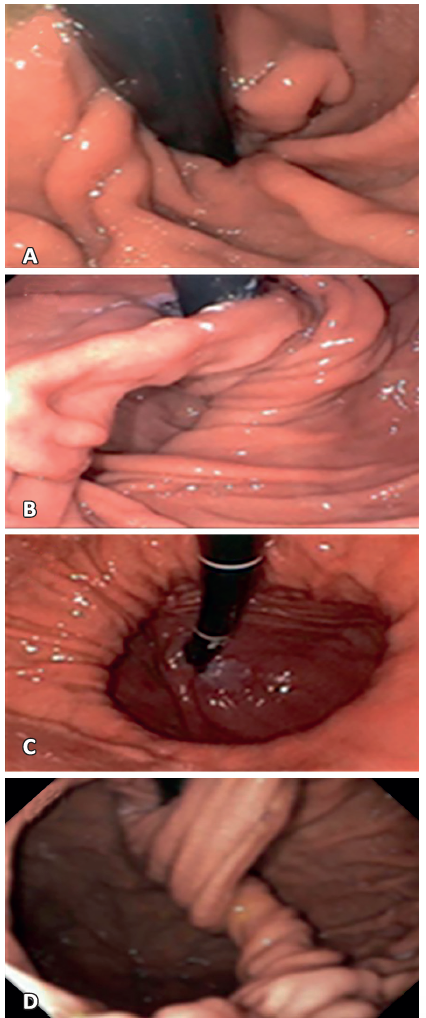
Figura 4. Clasificación endoscópica de Hill. A: Tipo I, presencia de pliegue bien cerrado alrededor del endoscopio con 3-4 cm de extensión hacia la curvatura menor. B: Tipo II, pliegue menor y durante la inspiración se forma un espacio entre el endoscopio y este pliegue. C: Tipo III, casi no existe pliegue y constantemente existe un espacio entre el endoscopio y este, el cual es mayor al diámetro del endoscopio. D: Tipo IV, presencia de hernia hiatal y un espacio importante entre el endoscopio y la impresión hiatal, sin identificar la válvula
Aunque en la actualidad no existe una definición estandarizada, podría pensarse que los pacientes que no responden o aquellos en quienes aparecen síntomas de novo son los que fallaron a la cirugía antirreflujo. Ante la persistencia de los síntomas posterior al procedimiento quirúrgico se debería utilizar el término “falla”. En el caso de que un paciente inicialmente manifieste control de sus síntomas y posteriormente los síntomas reaparezcan, podría emplearse el término “disfunción”. Por otra parte, la presencia de empeoramiento de los síntomas o la aparición de síntomas o situaciones clínicas que no existían antes de la cirugía debe considerarse una “complicación”.Los síntomas que de estas situaciones deriven (disfagia, regurgitación, reflujo recidivado, dolor torácico) deben estudiarse. Es así que la endoscopía junto con el estudio seriado esófago-gástrico tienen un papel fundamental para realizar el diagnóstico y planear la estrategia de abordaje en estos pacientes. Durante la evaluación endoscópica se debe intentar dilucidar el mecanismo de falla, que puede clasificarse de la siguiente manera según sus cuatro formas más frecuentes (Figura 5):
Figura 5. Tipos de falla de funduplicatura. A: Tipo I, hernia con herniación de la funduplicatura. B: Tipo II, sin herniación de la funduplicatura. C: Tipo III, con desplazamiento paraesofágico. D: Tipo IV, defecto en la formación de la plicatura
1. Deslizamiento del estómago por dentro de la funduplicatura (slippage).
2. Herniación para-esofágica del fundus gástrico con plicatura continente y en posición intraabdominal.
3. Migración de la funduplicatura en bloque.
4. Malformación (defecto en la posición o construcción) de la funduplicatura.
Algunos pacientes presentan disfagia posfunduplicatura sin alteraciones visibles en la endoscopía diagnóstica. La obstrucción funcional al tracto de salida de la unión gastroesofágica puede ser secundaria a la estenosis crural ocasionada por una funduplicatura apretada, y puede evidenciarse mediante una manometría esofágica de alta resolución o un tránsito esofágico minutado (Figura 6).
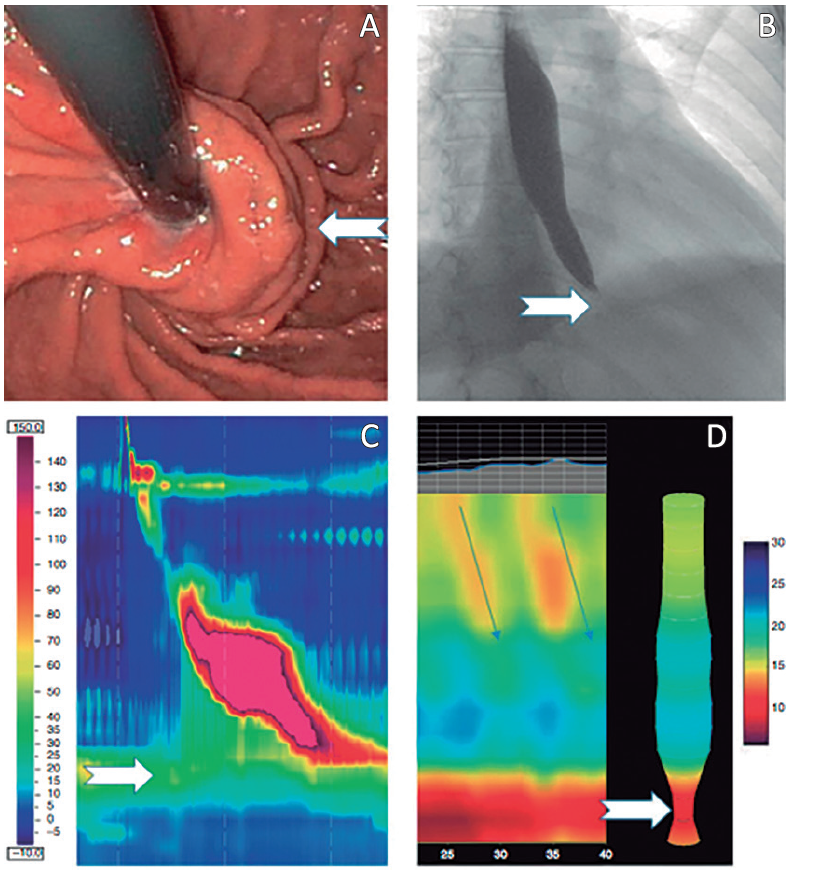
Figura 6. Obstrucción funcional al tracto de salida de la unión esófago gástrica posfunduplicatura de Nissen. A: Visión endoscópica de la funduplicatura normoinserta y continente señalada. B: Esofagograma con afinamiento distal en pico. C: Manometría esofágica de alta resolución que muestra zona de alta presión. D: Estudio de EndoFLIP que muestra la disminución de la distensibilidad a nivel de la UEG
Conclusiones
La endoscopía diagnóstica tiene un rol fundamental en la ERGE, siendo el puntapié de estudio de esta entidad. A partir de su diagnóstico y las complicaciones que de ella derivan, como la esofagitis, el EB, la displasia y el cáncer de esófago, entre otras, existen diversos métodos endoscópicos y avances tecnológicos (cromoendoscopía, cromoendoscopía virtual, WATS, inteligencia artificial) que han llegado para mejorar la detección y facilitar el seguimiento endoscópico de estos pacientes.
Es imprescindible que el endoscopista esté familiarizado con estos métodos, que conozca la terminología, clasificaciones y protocolos (clasificación de Los Ángeles, criterios de Praga, protocolo de Seattle, clasificación de Hill, entre otros) y que tenga vínculo interactivo con los grupos de cirugía de esófago para poder informar los estudios de forma completa y universal.
Bibliografía recomendada
- Gyawali CP, Kahrilas PJ, Savarino E, et al. Modern diagnosis of GERD: the Lyon Consensus. Gut 2018; 67 (7): 1351-1362. doi:10.1136/gutjnl-2017-314722
- Lundell LR, Dent J, Bennett JR, et al. Endoscopic assessment of oesophagitis: clinical and functional correlates and further validation of the Los Angeles classifi cation. Gut 1999; 45: 172-180.
- Wang KK, Sampliner RE. Updated guidelines 2008 for the diagnosis, surveillance and therapy of Barrett’s esophagus. Am J Gastroenterol 2008; 103: 788-797.
- Sharma P, McQuaid K, Dent J, Fennerty MB, Sampliner R, Spechler S, Cameron A, Corley D, Falk G, Goldblum J, et al. A critical review of the diagnosis and management of Barrett’s esophagus: the AGA Chicago Workshop. Gastroenterology 2004; 127: 310-330.
- Choe JW, Kim YC, Joo MK, et al. Application of the Prague C and M criteria for endoscopic description of columnar-lined esophagus in South Korea. World J Gastrointest Endosc 2016; 8 (8): 357-361. doi:10.4253/wjge.v8.i8.357
- Sharma P, Dent J, Armstrong D, Bergman JJ, Gossner L, Hoshihara Y, Jankowski JA, Junghard O, Lundell L, Tytgat GN, et al. The development and validation of an endoscopic grading system for Barrett’s esophagus: the Prague C & M criteria. Gastroenterology 2006; 131: 1392-1399.
- Falk GW. Updated Guidelines for Diagnosing and Managing Barrett Esophagus. Gastroenterol Hepatol (NY) 2016; 12 (7): 449-451.
- Shaheen NJ, Falk GW, Iyer PG, Gerson LB; American College of Gastroenterology. ACG Clinical Guideline: Diagnosis and Management of Barrett’s Esophagus. Am J Gastroenterol 2016; 111: 30-50; quiz 51.
- Vahabzadeh B, Seetharam AB, Cook MB, Wani S, Rastogi A, Bansal A, Early DS, Sharma P. Validation of the Prague C&M criteria for the endoscopic grading of Barrett’s esophagus by gastroenterology trainees: a multicenter study. Gastrointest Endosc 2012; 75: 236-241.
- Qumseya BJ, Wang H, Badie N, Uzomba RN, Parasa S, White DL, et al. Advanced imaging technologies increase detection of dysplasia and neoplasia in patients with Barrett’s esophagus: a metaanalysis and systematic review. Clin Gastroenterol Hepatol 2013; 11: 1562-1570.
- Calderón P, Andresen M, Latorre G, Espino A. ¿Cómo evaluar endoscópicamente un esófago de Barrett?: Criterios de Praga C&M, París y BING. Gastroenterol Latinoam 2016; 27 (3): 181-186.
- Elsheaita A, El-Bially MA, Shamseya MM, et al. Seattle protocol vs. narrow band imaging guided biopsy in screening of Barrett’s esophagus in gastroesophageal reflux disease patients. Medicine (Baltimore) 2020; 99 (8): e19261.
- Sharma P, Hawes RH, Bansal A, et al. Standard endoscopy with random biopsies versus narrow band imaging targeted biopsies in Barrett’s oesophagus: a prospective, international, randomised controlled trial. Gut 2013; 62 (1): 15-21.
- Wolfsen HC, Crook JE, Krishna M, et al. Prospective, controlled tandem endoscopy study of narrow band imaging for dysplasia detection in Barrett’s Esophagus. Gastroenterology 2008; 135 (1): 24-31.
- Smith MS, Ikonomi E, Bhuta R, et al. Wide-area transepithelial sampling with computer-assisted 3-dimensional analysis (WATS) markedly improves detection of esophageal dysplasia and Barrett’s esophagus: analysis from a prospective multicenter community-based study. Dis Esophagus 2019; 32 (3): doy099.
- Johanson JF, Frakes J, Eisen D. Computer-assisted analysis of abrasive transepithelial brush biopsies increases the effectiveness of esophageal screening: a multicenter prospective clinical trial by the EndoCDx Collaborative Group. Dig Dis Sci 2011; 56: 767-772.
- Anandasabapathy S, Sontag S, Graham DY, et al. Computer assisted brush-biopsy analysis for the detection of dysplasia in a high-risk Barrett’s esophagus surveillance population. Dig Dis Sci 2011; 56: 761-766.
- Veitch AM, Uedo N, Yao K, East JE. Optimizing early upper gastrointestinal cancer detection at endoscopy. Nat Rev Gastroenterol Hepatol 2015; 12: 660-667.
- Menon S, Trudgill N. How commonly is upper gastrointestinal cancer missed at endoscopy? A meta-analysis. Endosc Int Open 2014; 2: e46-e50.
- Li X, Zhang S, Zhang Q, et al. Diagnosis of thyroid cancer using deep convolutional neural network models applied to sonographic images: a retrospective, multicohort, diagnostic study. Lancet Oncol 2019; 20: 193-201.
- Trister AD, Buist DSM, Lee CI. Will machine learning tip the balance in breast cancer screening? JAMA Oncol 2017; 3: 1463-1464.
- Luo H, et al. Real-time artificial intelligence for detection of upper gastrointestinal cancer by endoscopy: a multicentre, case-control, diagnostic study. Lancet Oncol 2019; 20 (12):1645-1654.
- Lin L, Chun G. Triadafilopoulos. Evaluation and management of patients with symptoms after anti-reflux surgery. Dis Esoph 2015; 28: 1-10.
- Sobrino-Cossío S, et al. Post-fundoplication symptoms and complications: Diagnostic approach and treatment. Rev de Gastroenterología de México 2017; 82 (3): 234-247.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE