Gloria Fernández-Esparrach, Jordi Gratacós-Ginès
Unidad de endoscopía, Servicio de Gastroenterología, ICMDM, Hospital Clínic, Barcelona. IDIBAPS. CIBEREHD.
Universidad de Barcelona, Cataluña, España.
Acta Gastroenterol Latinoam 2020;50:44-46
Definición de esófago de Barrett
El esófago de Barrett (EB) se define como un cambio en el epitelio del esófago distal de cualquier longitud que puede ser reconocido como mucosa de tipo columnar en la endoscopía y en el que se confirma la presencia de metaplasia intestinal en las biopsias obtenidas del esófago tubular. El diagnóstico de EB requiere, por tanto, un diagnóstico endoscópico y anatomo-patológico.
La prevalencia del EB es del 1,6% en la población general y puede llegar a ser del 20% en pacientes con reflujo gastroesofágico. Si nos referimos a los pacientes a los que se realiza una endoscopía digestiva alta por cualquier indicación, el EB se identifica en un 1% y aumenta a un 12% cuando la indicación es por reflujo.
Sin embargo, la propia definición del EB plantea una serie de problemas prácticos desde el punto de vista clínico como cuál es el límite inferior del esófago, cuál debe ser la extensión mínima de la mucosa de tipo columnar o si es necesaria la confirmación de la existencia de metaplasia intestinal.
¿Cuál es el límite inferior del esófago?
Hay dos referencias anatómicas que pueden utilizarse para definir el final del esófago: el borde superior de los pliegues gástricos y el borde inferior de los vasos en empalizada. El primero es una estructura cambiante con las maniobras de insuflación y aspiración y es especialmente difícil de reconocer cuando hay atrofia de la mucosa gástrica. En el caso de los vasos en empalizada, son difíciles de visualizar cuando hay inflamación y cuando la distensión es insuficiente. Debido a que en los países occidentales la enfermedad por reflujo (que puede ocultar la visibilidad de los vasos en empalizada) es más prevalente que la gastritis crónica, lo más habitual es tomar el borde superior de los pliegues gástricos como referencia para considerar donde acaba el esófago. La existencia de una hernia de hiato puede inducir a errores al considerar como falso EB lo que en realidad son los pliegues gástricos herniados. En estos casos es aconsejable realizar la exploración con poca insuflación para poder identificar correctamente que se trata de pliegues gástricos y que la impronta cardial se encuentra más distal.
¿Cuál es la extensión mínima de la mucosa de tipo columnar?
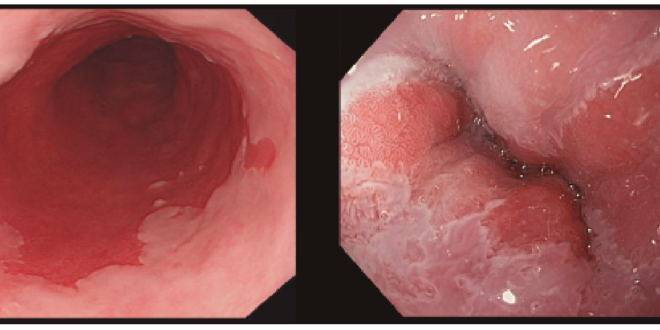
Para considerar que una lengüeta de mucosa de aspecto columnar localizada en el esófago distal es un EB debe tener una longitud mínima de 1 cm. Esto es debido a que para longitudes menores existe una gran variabilidad inter-observador. Cuando la longitud es inferior a 1 cm hablaremos de una línea Z irregular (Figura 1) y, en este caso, no se recomienda realizar biopsias para evitar confusiones.
Figura 1. Izquierda: esófago de Barrett. Derecha: línea Z irregular

¿Es necesario que haya metaplasia intestinal?
Los argumentos en contra de requerir la presencia de metaplasia intestinal es que no siempre se detecta en las biopsias. Sin embargo, sabemos que a nivel del cardias existen diferentes tipos de epitelio columnar (fúndico, cardial e intestinal con células caliciformes) y sólo el intestinal se asocia a una posibilidad de degeneración. Basándose en el primer argumento, en Gran Bretaña no es necesaria la presencia de metaplasia intestinal para el diagnóstico de EB. Contrariamente, otros países como EUA o España sí lo requieren.
Diagnóstico endoscópico
El EB puede tener varios patrones mucosos característicos: tubular, caracterizado por un aspecto alargado de las glándulas; fúndico, en el que las glándulas son redondas; y velloso, con un aspecto alargado pero de mayor tamaño y tortuoso. Sin embargo, a veces, no se identifica ningún patrón mucoso y sólo es visible la vascularización. Al explorar la superficie del EB es muy importante reconocer la presencia de cualquier irregularidad tanto del patrón mucoso como vascular que pueda corresponder a la existencia de displasia o adenocarcinoma. Para ello, el uso de cromoendoscopía virtual como el NBI (imágenes de banda estrecha o Narrow Band Imaging) es de gran ayuda.
La clasificación de Praga ha supuesto un gran avance ya que permite estandarizar la descripción del EB. Esta clasificación tiene en cuenta la existencia de afectación circunferencial (C) y su extensión así como la máxima extensión de las lengüetas (M). A modo de ejemplo, si el cardias se localiza a 35 cm de la arcada dentaria y el EB afecta de forma circunferencial hasta 33 cm pero existe una lengüeta que alcanza los 30 cm, se trata de un C2M5. Un caso similar pero sin la lengüeta sería un C2M2. Además de la clasificación de Praga, en el informe de endoscopía debe describirse el nivel del cardias, la situación del borde superior de los pliegues gástricos, la existencia de hernia de hiato, el número de lengüetas y su situación (teniendo en cuenta que el esófago es como una circunferencia y describiéndolas en el sentido de las agujas del reloj) y la existencia de lesiones visibles.
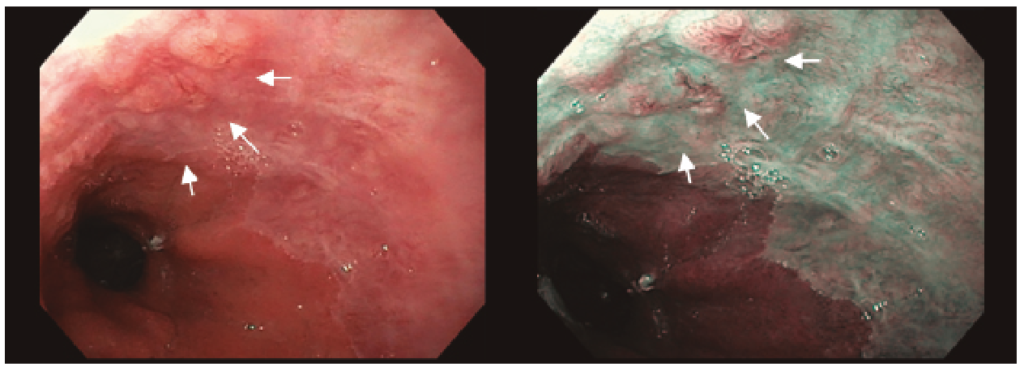
Para la descripción de las lesiones visibles en el EB se utiliza la misma clasificación de París que para los pólipos del colon. Además, debe describirse su localización en función de la distancia a la arcada dentaria y su situación en la circunferencia esofágica. La utilización de endoscopios de alta definición mejora la detección de lesiones pero es recomendable utilizar técnicas de cromoendoscopía virtual o con ácido acético 2% (figura 2). Este último provoca un cambio de coloración inmediato pasando del color asalmonado típico del EB al blanco y es útil para identificar las áreas sugestivas de displasia (que son las zonas que recuperan el color de forma precoz).
Figura 2. Las flechas marcan una lesión visible con luz blanca (izquierda) y con cromoendoscopía virtual (NBI, derecha)
Aunque pueda resultar obvio, si dedicamos más tiempo a la exploración podremos detectar más lesiones, tal y como demuestra el estudio de Gupta y col. en el que se estableció el tiempo óptimo en 1 minuto por cada centímetro.
Protocolo de biopsias
Para el diagnóstico inicial de un EB se recomienda realizar 8 biopsias y ya se ha comentado previamente que no se debe biopsiar una línea Z irregular. Para la vigilancia endoscópica de un EB se recomienda realizar biopsias según lo que establece el protocolo de Seattle: de los 4 cuadrantes y cada 2 cm, preferiblemente en un tubo diferente para cada nivel. Las lesiones visibles deben biopsiarse inicialmente y es muy útil identificar los tubos según su localización. Una opción es la siguiente: si la lesión se encuentra a 36 cm de arcada dentaria y a las 3 horas de la circunferencia esofágica, el tubo se etiquetará como 3603.
Lo que tenemos que esperar del informe de anatomía patológica es que descarte la existencia de displasia (negativo para displasia) o se establezca el grado de displasia en caso de haberla (bajo o alto grado). En el caso de que la muestra no sea suficiente para establecer la existencia de displasia, deberá constar como “indefinido para displasia”. La existencia de esofagitis por reflujo puede inducir al diagnóstico erróneo de displasia por los cambios reactivos. En este caso, deben repetirse las biopsias después del tratamiento para la esofagitis con inhibidores de la bomba de protones. Debido a que el diagnóstico de displasia de bajo grado es especialmente difícil y existe una gran variabilidad inter-observador, se recomienda repetir las biopsias después de 6 meses con optimización del tratamiento antisecretor.
Recomendaciones finales
• Utilizar el mejor endoscopio disponible, idealmente de alta definición.
• Explorar el cardias y el esófago distal en retroversión.
• Realizar una exploración sistemática eliminando previamente los restos de moco con aplicación de un mucolítico y utilizar cromoendoscopía, ya sea virtual o con ácido acético 2%.
• Dedicar más tiempo a la exploración, mirando más y biopsiando menos.
• Recordar que no detectamos lo que vemos sino lo que reconocemos.
Bibliografía recomendada
- Sharma P. Clinical Practice. Barrett’s esophagus. N England J Med 2009; 361: 2548-2556.
- Weusten B, Bisschops R, Coron E, et al. Endoscopic management of Barrett’s esophagus: European Society of Gastrointestinal Endoscopy (ESGE) position statement. Endoscopy 2017; 49: 191-198.
- Sharma P, Dent J, Armstrong D, et al. The development and validation of an endoscopic grading system for Barrett’s esophagus: the Prague C & M criteria. Gastroenterology 2006; 131: 1392-1399.
- Gupta N, Gaddam S, Wani SB, et al. Longer inspection time is associated with increased detection of high-grade dysplasia and esophageal adenocarcinoma in Barrett’s esophagus. Gastrointest Endosc 2012; 76: 531-538.
- Moss A, Bourke MJ, Hourigan LF, et al. Endoscopic resection for Barrett’s high-grade dysplasia and early esophageal adenocarcinoma: an essential staging procedure with long-term therapeutic benefit. Am J Gastroenterol 2010; 105: 1276-1283.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE