Alberto Caminero ID
Instituto de Investigación de enfermedades digestivas Farncombe Family. Universidad de McMaster, Hamilton, Ontario Canadá.
Acta Gastroenterol Latinoam 2021;51(3):259-270
Recibido: 12/07/2021 / Aceptado: 06/09/2021 / Publicado en www.actagastro.org el 27/09/2021 / https://doi.org/10.52787/ntec5426
Resumen
Alrededor de un 25% de la población mundial experimenta reacciones adversas a los alimentos, las cuales son muy diversas tanto a nivel clínico como etiológico. De acuerdo con los procesos fisiopatológicos implicados, estas reacciones pueden clasificarse ampliamente como sensibilidades o intolerancias, según si están o no inmunomediadas. Las sensibilidades alimentarias especialmente presentan un problema clínico, económico y social creciente en todo el mundo. Aunque a ciencia cierta se desconoce la razón del incremento en la prevalencia de sensibilidades bien determinadas como son la enfermedad celíaca o la alergia alimentaria, el papel de los microorganismos tanto en la inducción como en la protección de dichas enfermedades ha sido propuesto. Primero, varios estudios sugieren que la microbiota intestinal, la gran cantidad de microbios que viven en nuestro tracto digestivo, median en la aparición de diferentes reacciones adversas a los alimentos. Estos estudios se basan en cambios observacionales en la composición y función de la microbiota fecal de pacientes celíacos, alérgicos y con intolerancia alimentaria en comparación con controles o sanos. Segundo, agentes microbianos infecciosos se han relacionado con la rotura de la tolerancia oral frente a componentes dietéticos y la aparición de diferentes reacciones adversas a los alimentos. Pero, ¿cómo pueden los microrganismos participar en las sensibilidades e intolerancias alimentarias? Los estudios preclínicos con modelos animales no solo apoyan las observaciones en humanos, además muestran la importancia causal de los microbios en el curso de dichas enfermedades, a la vez que informan de los mecanismos específicos mediante los cuales los microbios participan en las reacciones alimentarias. El objetivo de este estudio es la revisión de la evidencia científica que apoya el papel de los microbios en las principales reacciones adversas a los alimentos descritas, con énfasis en los mecanismos subyacentes mediante los cuales los microorganismos pueden mediar en ellas. El descubrimiento de las principales vías moleculares involucradas en las reacciones patogénicas a los alimentos dietéticos acelerará el desarrollo de nuevos enfoques terapéuticos con el objetivo de prevenir y tratar las sensibilidades y las intolerancias alimentarias.
Palabras claves. Intolerancia alimentaria. Sensibilidad alimentaria. Alergia alimentaria. Permeabilidad intestinal. Microbiota.
Adverse Reactions to Food. What is the Role of Microorganisms?
Summary
It is estimated that around 25% of the population worldwide experience adverse reactions to food, which are very diverse based on both etiology and clinical presentation. According to the pathophysiological processes involved, adverse reactions to foods can be broadly classified as sensitivities or intolerances, depending on whether they are immune-mediated, or not. Specifically, food sensitivities have become a growing clinical, economic, and social problem nowadays. Although the reason for the increased prevalence of well-determined food sensitives such as celiac disease and food allergies is not well understood, the role of microbes in both inducing and protecting from these conditions has been proposed. First, several studies suggest that the gut microbiota, the vast number of microbes that live in our digestive tract, influence the appearance of different adverse reactions to food. These studies are based on observational changes in the composition and function of the fecal microbiota of celiac, allergic and food intolerant patients when compared to controls or healthy participants. Second, infectious microbial agents have been related to the loss of oral tolerance towards dietary components and the occurrence of different adverse reactions to foods. However, how could microbes participate in food sensitivities and intolerances from a mechanistic point of view? Preclinical studies with animal models not only support observations in humans, they also show a causal role of microbes in the occurrence and course of these diseases, while informing the specific underlying mechanisms. The aim of this review is to summarize the scientific evidence that supports the role of microbes in the main adverse reactions to food described, with an emphasis on the underlying mechanisms. The discovery of the main molecular pathways involved in pathogenic reactions to diet foods will accelerate the development of new therapeutic approaches with the aim of preventing and treating food sensitivities and intolerances.
Keywords. Food intolerances. Food sensitivity. Food allergy. Intestinal permeability. Microbiota.
Introducción
Las reacciones alimentarias han incrementado enormemente en los últimos años convirtiéndose en un serio problema sanitario.1, 2 Se estima que una quinta parte de la población mundial experimenta reacciones adversas a diversos componentes de la dieta.3 Dichas reacciones no solo tienen una gran repercusión a nivel clínico, además pueden acarrear una importante carga económica y social perjudicando la calidad de vida de los pacientes.4-8 Además del mayor coste de los alimentos libres de componentes compuestos perjudiciales (antígenos) como el gluten, lactosa, etc, la ubiquidad de estos antígenos tiene un fuerte impacto tanto en la industria como en servicios de restauración y de manufacturación de alimentos; lo cual implica que los pacientes eviten reuniones sociales y sufran una mayor carga psicológica. Así mismo, algunas reacciones alimentarias pueden resultar fatales en algunos casos. Como veremos en esta revisión bibliográfica, las reacciones adversas a los alimentos son muy diversas tanto a nivel clínico como etiológico.3 En muchas de ellas, el incremento en la prevalencia no puede explicarse por la deriva genética, lo que sugiere un papel crítico de factores ambientales aún desconocidos como modificadores de la expresión de la enfermedad.9 Varios factores ambientales han sido propuestos y muchos de ellos se incluyen dentro de los cambios en el estilo de vida producidos en las últimas décadas. Estos cambios se caracterizan por una menor exposición a antígenos ambientales (teoría de la higiene), diferentes patrones de lactancia y variaciones en el tipo de alimentación actual, más occidentalizada, con un mayor consumo de alimentos procesados y potencialmente más “proinflamatorios”.10 Estudios recientes apuntan al papel pivotante de los microorganismos tanto en la generación de respuestas homeostáticas, así como en su participación en la rotura de tolerancia frente a ciertos alimentos.11 En este artículo discutiremos la evidencia científica que sugiere la importancia de los microbios en la aparición de las principales reacciones adversas conocidas, así como los mecanismos mediante los cuales los microrganismos pueden participar en la aparición de dichas respuestas adversas a los alimentos. También discutimos las dianas terapéuticas que pueden ser diseñadas para apuntalar a dichas vías y que podrían desarrollarse para prevenir o tratar mejor las reacciones adversas alimentarias.
Clasificación de las reacciones alimentarias adversas
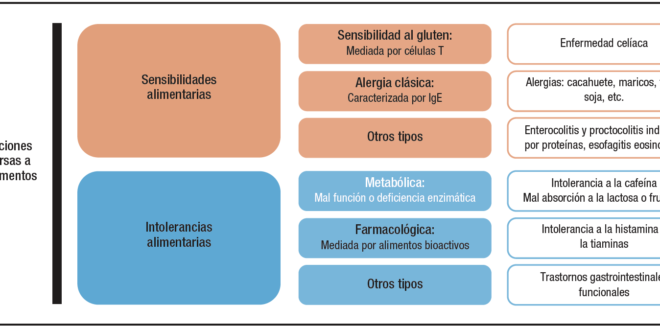
La reacción adversa a los alimentos es cualquier respuesta clínica anormal que puede atribuirse a la ingestión, contacto o inhalación de un alimento, de sus derivados o de uno de sus aditivos, y que a su vez puede ser perfectamente tolerado por la gran mayoría de las personas.12 Las manifestaciones clínicas de dichas reacciones son diversas según la etiología subyacente y los procesos fisiopatológicos implicados. Se trata, por tanto, de un concepto amplio que abarca todo tipo de anomalía, sin dejar constancia de su mecanismo causal. Las reacciones adversas pueden clasificarse de una manera amplia en sensibilidades o intolerancias dependiendo si dependen de una respuesta inmune o una alteración mecánica, respectivamente.3, 13 (Figura 1).
Figura 1. Clasificación de las principales reacciones adversas a los alimentos en humanos: Las reacciones a los alimentos se pueden dividir en intolerancias alimentarias (no inmuno-mediadas) y sensibilidades alimentarias (inmuno-mediadas) de acuerdo con su fisiopatología subyacente.
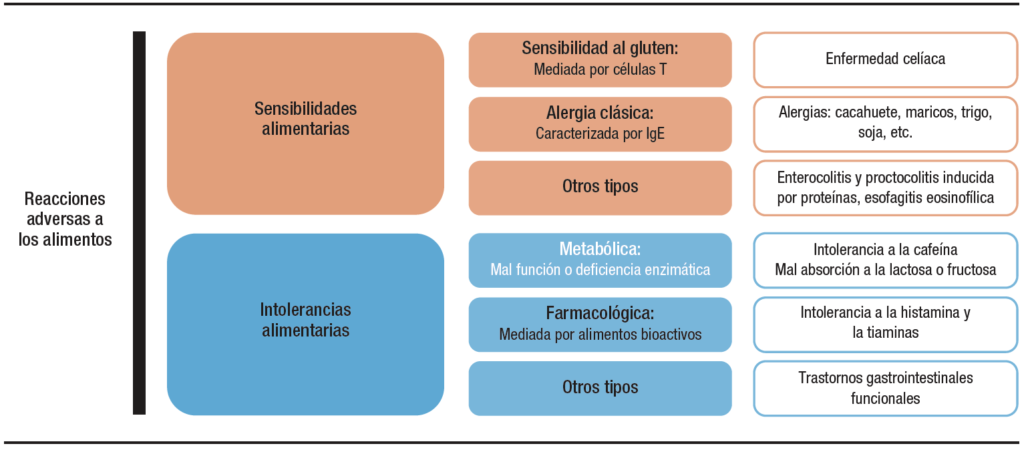
Sensibilidades alimentarias
Las sensibilidades alimentarias son aquellas reacciones adversas con base inmunológica comprobada que presentas algunos pacientes tras la ingestión de un alimento.3 Se produce principalmente en pacientes previamente sensibilizados y se desencadena tras el consumo de pequeñas cantidades de antígenos o alérgenos dietéticos. Estas a su vez pueden clasificarse en base al tipo de respuesta inmune generada tras el consumo del antígeno, siendo la alergia alimentaria y la enfermedad celíaca las sensibilidades más representativas.11 El único tratamiento efectivo para dichas sensibilidades es la eliminación completamente de la dieta de por vida del agente dietético disparador de la respuesta inmune.14
Alergia alimentaria
Las sensibilidades a los alimentos con fisiopatología alérgica clásica se caracterizan por un proceso de “sensibilización” con la consecuente generación de Inmunoglobulina (Ig)- E específica frente al alérgeno alimentario.15 Esto conlleva a una respuesta inmune adaptativa tras la re-exposición al alimento inducida por la unión de la IgE específica del alérgeno al receptor FcεRI presente en células efectoras como los mastocitos y basófilos. Estas células se reticulan y liberan mediadores, como la histamina, que causan síntomas agudos. Una respuesta fuerte al alérgeno podría conducir a la anafilaxia, que se define como una reacción alérgica grave de inicio rápido que afecta a múltiples tejidos y puede causar la muerte.16 Hay muchos tipos de alergias alimentarias siendo las más características las alergias al cacahuete, marisco, soja, leche o trigo, entre otros.15, 17 Aunque la forma clásica de alergias requiere la presencia de IgE sistémica frente al alérgeno, se han descrito otras sensibilidades alimentarias con fisiopatología alérgica que aparentemente no están mediadas por la IgE;3 bien porque no se produce o por que los niveles son bajos para su detección sistémica. Algunos estudios sugieren que existe producción de IgE en la mucosa, pero en niveles circulantes insuficientes para ser detectados.18 En contraste con la alergia alimentaria mediada por IgE bien definida, los enfoques de diagnóstico y los mecanismos inmunitarios subyacentes a estas afecciones no se comprenden bien.13 La alergia alimentaria no mediada por IgE incluye diferentes afecciones médicas, como el síndrome de enterocolitis inducida por proteínas y la proctocolitis inducida por proteínas alimentarias.3 Otro grupo de enfermedades crónicas con fisiopatología alérgica y mecanismos poco comprendidos son la alergia a la proteína de la leche de vaca, la esofagitis eosinofílica y la gastroenteritis. En la esofagitis eosinofílica y la gastroenteritis, la naturaleza del alérgeno alimentario permanece indeterminada.3
La prevalencia de alergias alimentarias ha incrementado enormemente en los países occidentales. Se estima que 250 millones de personas padecen alergia alimentaria en todo el mundo.19 El origen de las alergias, así como su incremento en la prevalencia en las últimas décadas, se desconoce. Se ha sugerido que la menor exposición microbiana (teoría de la higiene) va acompañado con mayores procesos de sensibilización.20 Además, se sabe que determinados factores infecciosos o toxinas microbianas pueden liderar a procesos de sensibilización como aquellos observados en las alergias.21-23
Enfermedad celíaca
La enfermedad celíaca es una enteropatía inflamatoria crónica del intestino delgado con características autoinmunes que aparece en individuos genéticamente susceptibles y es causada por una respuesta inmunitaria inapropiada a las proteínas del gluten.24 La enfermedad celíaca es una de las afecciones crónicas relacionadas con los alimentos más comunes, con una prevalencia mundial del 1,4%.25 A diferencia de las alergias alimentarias, la enfermedad celíaca se caracteriza principalmente por una respuesta celular a las proteínas del gluten presentes en diferentes cereales como el trigo, el centeno y la cebada. Tras la ingesta de estos cereales, se produce una expansión aberrante de células T tipo CD-4 dependientes de gluten en pacientes que específicamente presentan los genes del complejo mayor de histocompatibilidad (HLA, por sus siglas en inglés)-DQ2 o DQ8.26 Esta respuesta inmune adaptativa conlleva la aparición de atrofia vellositaria, hiperplasia de las criptas y linfocitosis intraepitelial en la mucosa del intestino delgado de pacientes celíacos. El daño característico de la mucosa del intestino delgado ha sido la piedra angular en el diagnóstico de la enfermedad, aunque los métodos serológicos, incluida la detección de auto-anticuerpos transglutaminasa tisular 2, se utilizan comúnmente en el estudio diagnóstico.24 Aunque se ha demostrado que la susceptibilidad genética del paciente, junto con la ingesta de gluten dietético, son necesarios para padecer dicha enfermedad, otros factores podrían tener un papel importante debido a que solo un pequeño porcentaje (3%) de las personas genéticamente susceptibles desarrollan la enteropatía.9
Como ocurre con otras sensibilidades alimentarias y enfermedades autoinmunes, la prevalencia de la enfermedad celíaca está aumentando en todo el mundo.2, 9 Debido a que no todas las personas con riesgo genético desarrollan la enfermedad celíaca, y a que el aumento en la prevalencia ha sido demasiado rápido para ser explicado por la deriva genética o a una mayor capacidad diagnóstica, diferentes factores ambientales han sido propuestos como mediadores de la enfermedad.9 Estos incluyen la introducción de gluten en las dietas infantiles (tiempo, cantidad y frecuencia), patrones de lactancia o infecciones intestinales.9, 27, 28 Varios estudios longitudinales y de cohorte han demostrado que diferentes infecciones gastrointestinales aumentan el riesgo de enfermedad celíaca.27, 29 Así mismo se han descrito alteraciones intestinales en la microbiota de los pacientes celíacos.10
Intolerancias alimentarias
Las intolerancias son reacciones alimentarias adversas que implican mecanismos no inmunes.3 Es decir, en la respuesta clínica al antígeno no interviene, o no ha podido demostrarse la intervención de, un mecanismo inmunológico. Sin embargo, existe un componente genético, epigenético o ambiental que ha originado la predisposición a ello. Las intolerancias pueden ser de diversa índole.12 Quizás las más caracterizadas son las intolerancias metabólicas, las cuales ocurren por la falta, deficiencia o mal función de ciertas enzimas o proteínas necesarias para el proceso de digestión o absorción de un alimento. Aquí encontramos reacciones adversas comunes como la intolerancia a la cafeína o la malabsorción a la lactosa o la fructosa.12, 13 La intolerancia a la lactosa sirve como ejemplo gráfico para la definición de estas reacciones adversas. En esta intolerancia existe una incapacidad para degradar el disacárido lactosa debido a una deficiencia primaria o secundaria de β-galactosidasa (lactasa).30 Como consecuencia, la lactosa no digerida llega al colon, donde es fermentada por la microbiota intestinal, lo que provoca la producción de gases (hidrógeno, dióxido de carbono y metano) e hinchazón.11 La intolerancia metabólica suele ocurrir por la presencia de la sustancia que causa el problema de modo independiente de su acción farmacológica sobre algún tejido o receptor. Esto las diferencia del otro subtipo clásico, las intolerancias farmacológicas. Estas reacciones ocurren tras la absorción de grandes cantidades de ciertas sustancias bioactivas que aparecen en determinados alimentos y que no son adecuadamente metabolizadas. En este caso, la reacción adversa es consecuencia de la acción farmacológica directa de la sustancia bioactiva frente a un receptor o tejido del hospedador. Aquí encontramos la intolerancia a la histamina o la tiamina.12 En los tipos de intolerancias aquí mencionados, el papel de los microbios en la generación de reacciones adversas parece nulo, circunstancial o secundario (por ejemplo, el exceso de fermentación en el caso de la lactosa) al efecto originado por el factor dietético o la deficiencia metabólica del hospedador.
En otras entidades clínicas, como los trastornos gastrointestinales funcionales, los componentes específicos de los alimentos y los mecanismos subyacentes responsables de la generación de síntomas siguen sin estar claros.31, 32 Pacientes con trastornos gastrointestinales funcionales frecuentemente reconocen a distintos componentes de la dieta como disparadores del cuadro clínico y diferentes antígenos dietéticos son capaces de inducir procesos proinflamatorios leves a nivel de la mucosa.33, 34 Sin embargo, muchos de estos pacientes no reciben un diagnóstico concluyente incluso después de la provocación alimentaria controlada con placebo.35 Estudios recientes han sugerido que reacciones adversas a los alimentos en algunos pacientes con trastornos funcionales pueden ser desencadenados por ciertos microorganismos.33 De hecho, el mejor ejemplo en gastroenterología de una afección post-infecciosa se relaciona con el síndrome del intestino irritable. En pacientes con intestino irritable post-infeccioso, la disfunción intestinal y el estado inflamatorio de bajo grado característico del trastorno se mantienen mucho después de que desaparecen las infecciones iniciales, y van frecuentemente acompañados de intolerancias alimentarias con origen y mecanismos inciertos.36-38
Microbios y reacciones alimentarias adversas: ¿Cuál es la evidencia científica?
Aunque el papel causal de los microorganismos en la generación de sensibilidades y tolerancias alimentarias en humanos es bastante difícil de estudiar, diversos estudios observacionales y preclínicos sugieren que los microbios pueden desencadenar o proteger frente a dichas condiciones.39 Los humanos coexistimos con una compleja comunidad microbiana, la cual nos aporta múltiples beneficios fisiológicos, en una auténtica relación de mutualismo. Esta relación es especialmente relevante en nuestro intestino y nuestra comunidad compuesta de bacterias, virus y arqueas, constituye lo que se conoce como la “microbiota” o el “microbioma”.40 La microbiota intestinal influye en la fisiología, el metabolismo y en la inmunidad del huésped y, en consecuencia, los mecanismos homeostáticos y de tolerancia.39 Por tanto, la microbiota del individuo es relevante para el “normal” funcionamiento del organismo y su alteración podría favorecer el desarrollo de ciertas reacciones alimentarias adversas.11 Varios grupos han observado una asociación entre la aparición de sensibilidades a los alimentos con prácticas que pueden afectar la composición de la microbiota intestinal, como son los patrones alimenticios en la edad temprana, la toma de antibióticos u otros fármacos o el parto por cesárea.41-43 Además, se han descrito alteraciones en la microbiota intestinal, lo que se conoce como “disbiosis”, tanto en la enfermedad celíaca como en diversos tipos de alergia.44-49 Así mismo, variaciones de grupos bacterianos en la infancia han sido asociados con un mayor riesgo a sufrir alergias a lo largo de la vida. Por otro lado, un estudio reciente también sugirió que una “firma” microbiana específica puede distinguir entre los bebés con y sin alergia alimentaria mediada por IgE. Los autores encontraron una correlación positiva entre Clostridium sensu stricto y la IgE sérica específica del alérgeno.50 Aunque muchos de estos estudios tienden a ser simplistas y con un número o tipo de muestras no ideal, los resultados parecen evidenciar la importancia que pueden tener los microorganismos en las reacciones adversas a los alimentos.9 Si bien es cierto, hoy en día no se ha sido capaz de definir ningún perfil microbiano “patogénico” para ninguna enfermedad específica, ya sea autoinmune, inflamatoria o de sensibilización; así como las características de un microbioma “beneficioso”.9 Cada estudio parece mostrar diferentes variaciones microbianas asociados a enfermedad, algunas contradictorias, lo que resalta la dificultad en la interpretación de este tipo de trabajos. Hay que también tener en cuenta que muchos factores median en la composición y funcionalidad de la microbiota intestinal. La dieta, edad, medicación, raza, entre otros, afectan a la microbiota añadiendo un nivel más de complejidad a la hora de interpretar los datos generados en los estudios de caracterización del microbioma.9 Por tanto, como ocurre en muchas otras patologías, el papel de la microbiota intestinal en la generación de respuestas a los alimentos es asociativo y se basa en diferencias en la composición entre pacientes y sanos.10
El papel de los agentes infecciosos en la generación de reacciones adversas a los alimentos parece más evidente, al menos en ciertas condiciones. Una infección se define como el proceso en el que un microorganismo patógeno invade y se multiplica patogénicamente en un hospedador. Estudios tanto clínicos como epidemiológicos sugieren una asociación entre las infecciones intestinales bacterianas y virales con diversas sensibilidades alimentarias.23, 27, 29, 51-54 Los estudios prospectivos de cohortes de nacimiento dan información muy valiosa a este respecto. Utilizando la enfermedad celíaca como ejemplo, un estudio longitudinal ha proporcionado evidencia de que una mayor frecuencia de infecciones por rotavirus, que generalmente afecta el intestino delgado y conduce a un aumento transitorio de la permeabilidad intestinal, predice un mayor riesgo de enfermedad celíaca en individuos genéticamente predispuestos.29 No es el único estudio que ha mostrado este tipo de observaciones, aunque, curiosamente, el agente infeccioso no siempre es el mismo. De hecho, agentes bacterianos tan diferentes como Campylobacter jejuni o Giardia y virales como Parechovirus, Adenovirus, Influenza o hepatobiliares han sido asociados a la enfermedad celíaca.53, 55-58 Las infecciones también parece que son de relevancia en reacciones adversas dentro del espectro de las intolerancias. El ejemplo mejor caracterizado en gastroenterología de una afección post-infecciosa se relaciona con el síndrome del intestino irritable, en el que tanto el trabajo básico con animales como los estudios clínicos después de una gastroenteritis epidémica demostraron el desarrollo de disfunción intestinal en hasta el 30% de la población que padecía la infección.37, 38 Este tipo de pacientes con frecuencia informan de intolerancias alimentarias, así como un empeoramiento de los síntomas después de la ingestión de componentes dietéticos específicos.36 Recientemente, utilizando modelos animales, se demostró que los agentes infecciosos tanto virales como bacterianos inducen la activación inmune relevante para las sensibilidades e intolerancias.59, 60 Se refuerza así la hipótesis de que las infecciones virales o bacterianas pueden contribuir a la generación de reacciones adversas a los alimentos. Queda por resolver si la protección frente a determinadas infecciones, bien mediante vacunación u otros mecanismos, confiere protección frente a reacciones adversas alimentarias.
A la hora de estudiar mecanismos de causalidad en la generación de reacciones adversas a los alimentos, es necesario llevar a cabo estudios pre-clínicos en el laboratorio. Si bien es cierto que los modelos pre-clínico no siempre recapitulan la complejidad y todas las características observadas en las enfermedades humanas, los estudios en animales han ayudado a proporcionar una visión mecanicista y apoyan la idea de que las respuestas a diferentes antígenos o alérgenos pueden ser moduladas por los microorganismos.11 De hecho, la mayor parte de la evidencia mecanicista surge de este tipo de estudios básicos y demuestran la importancia de las interacciones de microorganismos específicos con el antígeno o alérgeno en sí, así como en la inducción de respuestas pro-inflamatorias o de tolerancia en el huésped por microorganismos.11 Las siguientes secciones amplían estos conceptos.
Mecanismos microbianos mediadores de reacciones adversas: Posibles dianas terapéuticas
Los microbios pueden participar en la susceptibilidad o desencadenamiento de las diferentes reacciones adversas mediante diferentes mecanismos y rutas subyacentes (Figura 2). En esta sección discutiremos las más importantes, así como su posible aprovechamiento terapéutico o de prevención de la enfermedad.
Figura 2. Mecanismos principales mediante los cuales los microbios pueden participar en las reacciones adversas alimentarias. (I) Los alimentos ingeridos en la dieta pueden ser metabolizados por la microbiota intestinal incrementando o reduciendo su inmunogenicidad. (II) Los microbios a su vez son capaces de interactuar con la mucosa intestinal incrementando la permeabilidad intestinal y el paso de los antígenos (III). Por último, los microorganismos también pueden dictar el tipo de respuesta inmune hacia los componentes dietéticos, mediando entre una respuesta inmune tolerogénica (fondo gris) o patogénica (fondo naranja).

Modificación antigénica
La gran mayoría de los antígenos y alérgenos alimentarios capaces de inducir reacciones adversas en humanos son resistentes a las condiciones inhóspitas del tracto digestivo y no son completamente digeridos por nuestras enzimas humanas.61-63 Sin embargo, el papel de la microbiota intestinal en el metabolismo antigénicos se subestima con frecuencia. La microbiota intestinal provee al hospedador de un vasto catálogo de rutas enzimáticas que no se encuentran presentes en nuestro organismo, ayudando a la digestión de componentes dietéticos de difícil asimilación.64 Es decir, los componentes de la dieta no utilizados por nuestro organismo se convierten en sustratos para los microbios intestinales que, en última instancia, dictarán su absorción por nuestro intestino, así como su inmunogenicidad.65 Se ha demostrado que el tracto gastrointestinal humano alberga diversos microbios con la capacidad de digerir diferentes antígenos consumidos en nuestra dieta.66-69 Estos microbios tienen un efecto dual, incrementando o reduciendo su inmunogenicidad en base al tipo de digestión (parcial vs total).70 Hay que tener en cuenta que digestiones parciales, sin la completa eliminación de los antígenos, puede ayudar a la difusión y acceso sistémico de dichos antígenos, facilitando las respuestas inmunes adversas.70 Así mismo, las enzimas producidas por dichos microorganismos pueden inducir respuestas inmunes adversas de relevancia en las sensibilidades alimentarias.59 Por otro lado, eficientes bacterias degradadoras de antígeno localizadas en el tracto digestivo alto puede proporcionar protección frente a reacciones alimentarias adversas.70, 71 Se puede concluir que las personas pueden presentar una mayor o menor capacidad para desarrollar determinadas sensibilidades o intolerancias alimentarias en base a la capacidad metabólica que presenta su microbiota.
La capacidad microbiana para degradar antígenos dietéticos puede ser una estrategia terapéutica para determinadas reacciones adversas a los alimentos.14, 72 Aunque parece complicado su uso en reacciones inmunogénicas rápidas y peligrosas, como las que se observan en las alergias y anafilaxis, el uso de bacterias probioticas metabolizadoras de antígenos, así como sus enzimas purificadas (terapia enzimática oral), ha sido propuesto en sensibilidades como la enfermedad celíaca.73-76 Es difícil que estas terapias puedan sustituir a una dieta libre de gluten. Sin embargo, su uso puede ser de interés como terapia suplementaria o en la industria alimentaria ya que la contaminación cruzada de alimentos es un problema considerable en las sensibilidades alimentarias.14
Incremento de la permeabilidad intestinal
La barrera de la mucosa dicta el paso de alimentos desde la luz hasta la lámina propia a través de diferentes vías, dentro de las que se incluyen las vías transcelulares y paracelulares. El paso excesivo de antígenos dietéticos se ha asociado con reacciones adversas en la lámina propia, así como con procesos de sensibilización alimentaria.77 De hecho, un incremento en la permeabilidad intestinal ha sido reportado en diferentes condiciones alimentarias.77, 78 Muchos patógenos interactúan con la barrera intestinal, lo que subraya la importancia de las interacciones bacteriano-huésped tanto en la salud como en la enfermedad.11 Por ejemplo, distintas toxinas microbianas son capaces de inducir un incremento en la barrera intestinal. De hecho, la toxina colérica de Vibrio cholerae se usa frecuentemente en modelos animales para inducir sensibilidad alimentaria.79 Diferentes microorganismos, tanto virus como bacterianos, tienen la capacidad de inducir un incremento en la permeabilidad intestinal por diferentes mecanismos. Estos efectos pueden resultar de la modificación directa de las proteínas de unión estrecha (tight juctions) que mantienen unidas las células epiteliales, así como la activación de otros receptores de alarma tanto en células epiteliales como en células presentadoras de antígeno.80-82 Dentro de estos receptores, se han sugerido que los receptores de tipo toll (o toll like receptor) o el receptor de hidrocarbos arilo pueden ser de especial relevancia en la respuesta a antígenos dietéticos.83, 84 Además, el epitelio intestinal influye en la tolerancia a antígenos tanto microbianos como alimentarios al condicionar a las células presentadoras de antígeno presentes en las mucosas a inducir un fenotipo tolerogénico o pro-inflamatorio,85, 86 como veremos más adelante. Los patógenos también pueden alterar la capa mucosa intestinal a través de la degradación del moco o inhibiendo las señales comensales normales para la producción de moco.87 Por otro lado, se ha demostrado que bacterias comensales pertenecientes al grupo Clostridia protegen frente a la sensibilización alergénica en modelos preclínicos a través de la regulación de las células linfoides innatas y la permeabilidad intestinal,88 dando un aliento a su posible uso terapéutico.
La fortificación de la barrera intestinal ha sido propuesta en la enfermedad celíaca. El acetato de larazotida, un regulador sintético de uniones estrechas, se ha probado en un estudio de fase 3 con más de 650 pacientes celíacos en dieta libre de gluten con síntomas persistentes.89 Este es el ensayo clínico más avanzado para un fármaco destinado a ser utilizado terapéuticamente en la celiaquía. Además, ciertas formulaciones probióticas como la cepa Lactobacillus rhamnosus GG o probióticos modificados genéticamente expresando el inhibidor de proteasas elafina han mostrado capacidad de restaurar la permeabilidad intestinal en estudios preclínicos.90-92 El uso de este tipo de estas estrategias para otras reacciones adversas a los alimentos, específicamente para aquellas que van asociadas a un proceso de sensibilización, es más difuso.
Rotura de la tolerancia oral: Infecciones
Los microbios a los que están expuestos los humanos tienen la capacidad de dictar el tipo de respuesta inmune de la mucosa. Por un lado, la microbiota intestinal juega un papel muy importante a la hora de mantener un ambiente intestinal tolerogénico u “homeostático” en el hospedador a través de diversos mecanismos entre los que se encuentran el mantenimiento de la integridad epitelial y la educación funcional de las células T reguladoras tolerogénicas.11 En dichas condiciones se previene una respuesta inflamatoria contra antígenos extraños. Muchos de estos efectos están mediados por compuestos microbianos y metabolitos inmunomoduladores que resultan del metabolismo bacteriano de los sustratos de la dieta como son los ácidos grasos de cadena corta (butirato, acetato o propionato) o los metabolitos derivados del triptófano (compuestos indólicos).93-97 Por ejemplo, el butirato, un metabolito que deriva del metabolismo bacteriano de la fibra dietética, tiene la capacidad de inducir células T regulatorias necesarias para el mantenimiento de la tolerancia a los antígenos alimentarios.98 Así mismo, indoles derivados del triptófano reducen procesos de sensibilización al gluten en estudios preclínicos a través del receptor de los hidrocarbos arilo.84
Por otro lado, diferentes factores ambientales, dentro de los que se incluyen a los microorganismos, tienen la capacidad de romper esta respuesta inmune reguladora hacia los antígenos de la dieta y liderar una respuesta inflamatoria. Como resultado se produce una pérdida de tolerancia hacia dicho antígeno.11 Surge la pregunta de cómo las infecciones microbianas pueden afectar las vías de señalización moleculares del huésped que están involucradas en la pérdida de tolerancia oral a los antígenos dietéticos.54 Estudios recientes han mostrado que diversas infecciones víricas activan vías inflamatorias específicas donde tienen lugar las respuestas de las células T a los antígenos de la dieta en modelos animales. Esta activación deroga la respuesta de las células T tolerogénicas induciéndose en su lugar una respuesta patogénica liderada por células T frente al antígeno.60, 99 Así mismo, también se ha demostrado recientemente que determinadas infecciones pueden desencadenar una respuesta inmune local en la mucosa de ratones, caracterizada por la producción de anticuerpos IgE frente al antígeno específicamente en la mucosa del ratón. La posterior exposición a dicho antígeno tras la infección indujo un incremento en el dolor visceral abdominal a través de un mecanismo dependiente de la IgE, los mastocitos y el receptor de histamina H1.33 Esta respuesta podría explicar la generación de determinadas intolerancias alimentarias funcionales poco definidas y serológicamente negativas como las que se observan por ejemplo en el síndrome del intestino irritable.100 Todos estos trabajos preclínicos son de gran relevancia ya que dan una dimensión mecanicista a previos estudios observacionales en los que infecciones víricas de diferente índole se asocian con el diagnóstico de sensibilidades alimentarias y la aparición de intolerancias en enfermedades intestinales funcionales.
Aunque tanto la inducción de tolerancia como la activación de vías homeostáticas mediante mediadores microbianos está lejos de la aplicación clínica, descifrar las vías moleculares regulatorias en los humanos y sus activadores microbianos o metabólicos permitirá la aparición de dianas terapéuticas sensatas en el futuro.101 Estas podrían incluir la activación directa de receptores de naturaleza homeostática como son el receptor de los hidrocarbos arilo o la suplementación con cepas bacterianas probióticas beneficiosas.14, 84 Un estudio reciente ha demostrado que ciertos comensales activan las células T reguladoras nacientes a través de la ruta MyD88 para proteger contra las sensibilidades a los alimentos.102 Sin embargo, la reversión de procesos de sensibilización previamente establecidos parece poco probable con estas prácticas. No obstante, enfoques terapéuticos no-microbianos basados en la inducción de tolerancia al antígeno se están probando en condiciones como la enfermedad celíaca.103 Pese a todas las adversidades a las que se enfrentan, estos estudios son de gran interés ya que permitirían el consumo y asimilación del antígeno por parte del paciente.14 Por último, la protección frente a microbios capaces de inducir procesos de sensibilización, mediante campañas de vacunación, por ejemplo, podría reducir la aparición de sensibilidades o intolerancias alimentarias específicas. La gran limitación con la que se encuentran estas estrategias preventivas radica en que microorganismos de diferente índole pueden ocasionar la aparición de reacciones adversas alimentarias.
Conclusión
El papel de los microbios entéricos en la salud y las enfermedades se está estudiando ampliamente en todo el mundo. Estamos comenzando a comprender la importancia que tienen los microbios en la generación de las diferentes reacciones adversas a los alimentos, que como aquí hemos visto, son muy complejas y heterogéneas. El conocimiento cada vez mayor de las interacciones específicas entre microorganismos, antígenos y hospedadores, así como de las vías moleculares subyacentes, acelerará el desarrollo de nuevas terapias para prevenir y tratar las sensibilidades y las intolerancias alimentarias.
Agradecimientos. Alberto Caminero tiene una posición como Profesor Asistente subvencionada por “Douglas Family chair”.
Propiedad intelectual. Los autores declaran que los datos y figuras presentes en el manuscrito son originales y fueron realizados en sus instituciones pertenecientes.
Aviso de derechos de autor
 © 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
© 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Caminero A. Reacciones adversas a los alimentos: ¿Cuál es el papel de los microorganismos?. Acta Gastroenterol Latinoam. 2021;51(3):259-70. https://doi.org/10.52787/ntec5426
Referencias
- Tang ML, Mullins RJ. Food allergy: is prevalence increasing? Internal medicine journal. 2017;47(3):256-61.
- Rubio-Tapia A, Kyle RA, Kaplan EL, et al. Increased prevalence and mortality in undiagnosed celiac disease. Gastroenterology. 2009;137(1):88-93.
- Turnbull JL, Adams HN, Gorard DA. Review article: the diagnosis and management of food allergy and food intolerances. Alimentary pharmacology & therapeutics. 2015;41(1):3-25.
- Nowak-Wegrzyn A, Hass SL, Donelson SM, et al. The Peanut Allergy Burden Study: Impact on the quality of life of patients and caregivers. The World Allergy Organization journal. 2021;14(2):100512.
- Shah S, Akbari M, Vanga R, et al. Patient perception of treatment burden is high in celiac disease compared with other common conditions. The American journal of gastroenterology. 2014;109(9):1304-11.
- Bacigalupe G, Plocha A. Celiac is a social disease: family challenges and strategies. Families, systems & health: the journal of collaborative family healthcare. 2015;33(1):46-54.
- Silvester JA, Weiten D, Graff LA, Walker JR, Duerksen DR. Living gluten-free: adherence, knowledge, lifestyle adaptations and feelings towards a gluten-free diet. Journal of human nutrition and dietetics : the official journal of the British Dietetic Association. 2016;29(3):374-82.
- Pinto-Sanchez MI, Verdu EF, Gordillo MC, et al. Tax-deductible provisions for gluten-free diet in Canada compared with systems for gluten-free diet coverage available in various countries. Canadian journal of gastroenterology & hepatology. 2015;29(2):104-10.
- Caminero A, Verdu EF. Celiac disease: should we care about microbes? American journal of physiology. Gastrointestinal and liver physiology. 2019;317(2):G161-70.
- Verdu EF, Galipeau HJ, Jabri B. Novel players in coeliac disease pathogenesis: role of the gut microbiota. Nature reviews. Gastroenterology & hepatology. 2015;12(9):497-506.
- Caminero A, Meisel M, Jabri B, Verdu EF. Mechanisms by which gut microorganisms influence food sensitivities. Nature reviews. Gastroenterology & hepatology. 2019;16(1):7-18.
- Ruiz Sanchez JG, Palma Milla S, Pelegrina Cortes B, Lopez Plaza B, Bermejo Lopez LM, Gomez-Candela C. [A global vision of adverse reactions to foods: food allergy and food intolerance]. Nutricion hospitalaria. 2018;35(Spec No4):102-8.
- Sampson HA, Anderson JA. Summary and recommendations: Classification of gastrointestinal manifestations due to immunologic reactions to foods in infants and young children. Journal of pediatric gastroenterology and nutrition. 2000;30 Suppl:S87-94.
- Kivela L, Caminero A, Leffler DA, Pinto-Sanchez MI, Tye-Din JA, Lindfors K. Current and emerging therapies for coeliac disease. Nature reviews. Gastroenterology & hepatology. 2021;18(3):181-95.
- Sicherer SH. Food allergy. Lancet. 2002;360(9334):701-10.
- Cianferoni A, Muraro A. Food-induced anaphylaxis. Immunology and allergy clinics of North America. 2012;32(1):165-95.
- Sicherer SH, Sampson HA. Food allergy: recent advances in pathophysiology and treatment. Annual review of medicine. 2009;60:261-77.
- Morita H, Nomura I, Matsuda A, Saito H, Matsumoto K. Gastrointestinal food allergy in infants. Allergology international : official journal of the Japanese Society of Allergology. 2013;62(3):297-307.
- Pawankar R. Allergic diseases and asthma: a global public health concern and a call to action. The World Allergy Organization journal. 2014;7(1):12.
- Okada H, Kuhn C, Feillet H, Bach JF. The ‘hygiene hypothesis’ for autoimmune and allergic diseases: an update. Clinical and experimental immunology. 2010;160(1):1-9.
- Renz H, Skevaki C. Early life microbial exposures and allergy risks: opportunities for prevention. Nature reviews. Immunology. 2021;21(3):177-91.
- Pascal M, Perez-Gordo M, Caballero T, et al. Microbiome and Allergic Diseases. Frontiers in immunology. 2018;9:1584.
- Custovic A, Murray C, Simpson A. Allergy and infection: understanding their relationship. Allergy. 2005;60 Suppl 79:10-3.
- Ludvigsson JF, Leffler DA, Bai JC, et al. The Oslo definitions for coeliac disease and related terms. Gut. 2013;62(1):43-52.
- Singh P, Arora A, Strand TA, et al. Global Prevalence of Celiac Disease: Systematic Review and Meta-analysis. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2018;16(6):823-36 e822.
- Jabri B, Sollid LM. T Cells in Celiac Disease. Journal of immunology. 2017;198(8):3005-14.
- Kemppainen KM, Lynch KF, Liu E, et al. Factors That Increase Risk of Celiac Disease Autoimmunity After a Gastrointestinal Infection in Early Life. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2017;15(5):694-702 e695.
- Szajewska H, Shamir R, Mearin L, et al. Gluten Introduction and the Risk of Coeliac Disease: A Position Paper by the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. Journal of pediatric gastroenterology and nutrition. 2016;62(3):507-13.
- Stene LC, Honeyman MC, Hoffenberg EJ, et al. Rotavirus infection frequency and risk of celiac disease autoimmunity in early childhood: a longitudinal study. The American journal of gastroenterology. 2006;101(10):2333-40.
- Lomer MC, Parkes GC, Sanderson JD. Review article: lactose intolerance in clinical practice-myths and realities. Alimentary pharmacology & therapeutics. 2008;27(2):93-103.
- Moayyedi P, Simren M, Bercik P. Evidence-based and mechanistic insights into exclusion diets for IBS. Nature reviews. Gastroenterology & hepatology. 2020;17(7):406-13.
- Shepherd SJ, Parker FC, Muir JG, Gibson PR. Dietary triggers of abdominal symptoms in patients with irritable bowel syndrome: randomized placebo-controlled evidence. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2008;6(7):765-71.
- Aguilera-Lizarraga J, Florens MV, Viola MF, et al. Local immune response to food antigens drives meal-induced abdominal pain. Nature. 2021;590(7844):151-6.
- Fritscher-Ravens A, Pflaum T, Mosinger M, et al. Many Patients With Irritable Bowel Syndrome Have Atypical Food Allergies Not Associated With Immunoglobulin E. Gastroenterology. 2019;157(1):109-18 e105.
- Teufel M, Biedermann T, Rapps N, et al. Psychological burden of food allergy. World journal of gastroenterology. 2007;13(25):3456-65.
- Barbara G, Grover M, Bercik P, et al. Rome Foundation Working Team Report on Post-Infection Irritable Bowel Syndrome. Gastroenterology. 2019;156(1):46-58 e47.
- Marshall JK, Thabane M, Garg AX, et al. Incidence and epidemiology of irritable bowel syndrome after a large waterborne outbreak of bacterial dysentery. Gastroenterology. 2006;131(2):445-50; quiz 660.
- Marshall JK, Thabane M, Borgaonkar MR, James C. Postinfectious irritable bowel syndrome after a food-borne outbreak of acute gastroenteritis attributed to a viral pathogen. Clinical gastroenterology and hepatology: the official clinical practice journal of the American Gastroenterological Association. 2007;5(4):457-60.
- Caminero A, Pinto-Sanchez MI. Host immune interactions in chronic inflammatory gastrointestinal conditions. Current opinion in gastroenterology. 2020;36(6):479-84.
- Sommer F, Backhed F. The gut microbiota-masters of host development and physiology. Nature reviews. Microbiology. 2013;11(4):227-38.
- Lebwohl B, Spechler SJ, Wang TC, Green PH, Ludvigsson JF. Use of proton pump inhibitors and subsequent risk of celiac disease. Digestive and liver disease : official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver. 2014;46(1):36-40.
- Lebwohl B, Murray JA, Verdu EF, et al. Gluten Introduction, Breastfeeding, and Celiac Disease: Back to the Drawing Board. The American journal of gastroenterology. 2016;111(1):12-14.
- Zven SE, Susi A, Mitre E, Nylund CM. Association Between Use of Multiple Classes of Antibiotic in Infancy and Allergic Disease in Childhood. JAMA pediatrics. 2020;174(2):199-200.
- Collado MC, Donat E, Ribes-Koninckx C, Calabuig M, Sanz Y. Specific duodenal and faecal bacterial groups associated with paediatric coeliac disease. Journal of clinical pathology. 2009;62(3):264-9.
- Nistal E, Caminero A, Herran AR, et al. Differences of small intestinal bacteria populations in adults and children with/without celiac disease: effect of age, gluten diet, and disease. Inflammatory bowel diseases. 2012;18(4):649-56.
- Nistal E, Caminero A, Vivas S, et al. Differences in faecal bacteria populations and faecal bacteria metabolism in healthy adults and celiac disease patients. Biochimie. 2012;94(8):1724-9.
- Hua X, Goedert JJ, Pu A, Yu G, Shi J. Allergy associations with the adult fecal microbiota: Analysis of the American Gut Project. EBioMedicine. 2016;3:172-9.
- Bunyavanich S, Shen N, Grishin A, et al. Early-life gut microbiome composition and milk allergy resolution. The Journal of allergy and clinical immunology. 2016;138(4):1122-30.
- De Palma G, Nadal I, Medina M, et al. Intestinal dysbiosis and reduced immunoglobulin-coated bacteria associated with coeliac disease in children. BMC microbiology. 2010;10:63.
- Ling Z, Li Z, Liu X, et al. Altered fecal microbiota composition associated with food allergy in infants. Applied and environmental microbiology. 2014;80(8):2546-54.
- Kagnoff MF, Austin RK, Hubert JJ, Bernardin JE, Kasarda DD. Possible role for a human adenovirus in the pathogenesis of celiac disease. The Journal of experimental medicine. 1984;160(5):1544-57.
- Marild K, Kahrs CR, Tapia G, Stene LC, Stordal K. Infections and risk of celiac disease in childhood: a prospective nationwide cohort study. The American journal of gastroenterology. 2015;110(10):1475-84.
- Tapia G, Chuda K, Kahrs CR, et al. Parechovirus Infection in Early Childhood and Association With Subsequent Celiac Disease. The American journal of gastroenterology. 2021;116(4):788-95.
- Verdu EF, Caminero A. How infection can incite sensitivity to food. Science. 2017;356(6333):29-30.
- Verdu EF, Mauro M, Bourgeois J, Armstrong D. Clinical onset of celiac disease after an episode of Campylobacter jejuni enteritis. Canadian journal of gastroenterology = Journal canadien de gastroenterologie. 2007;21(7):453-5.
- Karhus LL, Gunnes N, Stordal K, et al. Influenza and risk of later celiac disease: a cohort study of 2.6 million people. Scandinavian journal of gastroenterology. 2018;53(1):15-23.
- Casella G, Vigano D, Romano Settanni C, et al. Association between celiac disease and chronic hepatitis C. Gastroenterology and hepatology from bed to bench. Summer. 2016;9(3):153-7.
- Carroccio A, Cavataio F, Montalto G, Paparo F, Troncone R, Iacono G. Treatment of giardiasis reverses «active» coeliac disease to «latent» coeliac disease. European journal of gastroenterology & hepatology. 2001;13(9):1101-5.
- Caminero A, McCarville JL, Galipeau HJ, et al. Duodenal bacterial proteolytic activity determines sensitivity to dietary antigen through protease-activated receptor-2. Nature communications. 2019;10(1):1198.
- Bouziat R, Hinterleitner R, Brown JJ, et al. Reovirus infection triggers inflammatory responses to dietary antigens and development of celiac disease. Science. 2017;356(6333):44-50.
- Shan L, Molberg O, Parrot I, et al. Structural basis for gluten intolerance in celiac sprue. Science. 2002;297(5590):2275-9.
- Palladino C, Breiteneder H. Peanut allergens. Molecular immunology. 2018;100:58-70.
- Moreno FJ. Gastrointestinal digestion of food allergens: effect on their allergenicity. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie. 2007;61(1):50-60.
- Koppel N, Maini Rekdal V, Balskus EP. Chemical transformation of xenobiotics by the human gut microbiota. Science. 2017;356(6344).
- Caminero A, Verdu EF. Metabolism of wheat proteins by intestinal microbes: Implications for wheat related disorders. Gastroenterologia y hepatologia. 2019;42(7):449-57.
- Caminero A, Herran AR, Nistal E, et al. Diversity of the cultivable human gut microbiome involved in gluten metabolism: isolation of microorganisms with potential interest for coeliac disease. FEMS microbiology ecology. 2014;88(2):309-19.
- Caminero A, Nistal E, Herran AR, et al. Differences in gluten metabolism among healthy volunteers, coeliac disease patients and first-degree relatives. The British journal of nutrition. 2015;114(8):1157-67.
- Herran AR, Perez-Andres J, Caminero A, et al. Gluten-degrading bacteria are present in the human small intestine of healthy volunteers and celiac patients. Research in microbiology. 2017;168(7):673-84.
- Wei G, Tian N, Siezen R, Schuppan D, Helmerhorst EJ. Identification of food-grade subtilisins as gluten-degrading enzymes to treat celiac disease. American journal of physiology. Gastrointestinal and liver physiology. 2016;311(3):G571-80.
- Caminero A, Galipeau HJ, McCarville JL, et al. Duodenal Bacteria From Patients With Celiac Disease and Healthy Subjects Distinctly Affect Gluten Breakdown and Immunogenicity. Gastroenterology. 2016;151(4):670-83.
- Caminero A, McCarville JL, Zevallos VF, et al. Lactobacilli Degrade Wheat Amylase Trypsin Inhibitors to Reduce Intestinal Dysfunction Induced by Immunogenic Wheat Proteins. Gastroenterology. 2019;156(8):2266-80.
- McCarville JL, Caminero A, Verdu EF. Pharmacological approaches in celiac disease. Current opinion in pharmacology. 2015;25:7-12.
- Murray JA, Kelly CP, Green PHR, et al. No Difference Between Latiglutenase and Placebo in Reducing Villous Atrophy or Improving Symptoms in Patients With Symptomatic Celiac Disease. Gastroenterology. 2017;152(4):787-98 e782.
- Lahdeaho ML, Kaukinen K, Laurila K, et al. Glutenase ALV003 attenuates gluten-induced mucosal injury in patients with celiac disease. Gastroenterology. 2014;146(7):1649-58.
- Pultz IS, Hill M, Vitanza JM, et al. Gluten Degradation, Pharmacokinetics, Safety, and Tolerability of TAK-062, an Engineered Enzyme to Treat Celiac Disease. Gastroenterology. 2021;161(1):81-93 e83.
- Konig J, Holster S, Bruins MJ, Brummer RJ. Randomized clinical trial: Effective gluten degradation by Aspergillus niger-derived enzyme in a complex meal setting. Scientific reports. 2017;7(1):13100.
- Akdis CA. Does the epithelial barrier hypothesis explain the increase in allergy, autoimmunity and other chronic conditions? Nature reviews. Immunology. 2021.
- Sapone A, Lammers KM, Casolaro V, et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC medicine. 2011;9:23.
- Snider DP, Marshall JS, Perdue MH, Liang H. Production of IgE antibody and allergic sensitization of intestinal and peripheral tissues after oral immunization with protein Ag and cholera toxin. Journal of immunology. 1994;153(2):647-57.
- Steck N, Hoffmann M, Sava IG, et al. Enterococcus faecalis metalloprotease compromises epithelial barrier and contributes to intestinal inflammation. Gastroenterology. 2011;141(3):959-71.
- Amieva MR, Vogelmann R, Covacci A, Tompkins LS, Nelson WJ, Falkow S. Disruption of the epithelial apical-junctional complex by Helicobacter pylori CagA. Science. 2003;300(5624):1430-4.
- Wu Z, Nybom P, Magnusson KE. Distinct effects of Vibrio cholerae haemagglutinin/protease on the structure and localization of the tight junction-associated proteins occludin and ZO-1. Cellular microbiology. 2000;2(1):11-7.
- Burgueno JF, Abreu MT. Epithelial Toll-like receptors and their role in gut homeostasis and disease. Nature reviews. Gastroenterology & hepatology. 2020;17(5):263-78.
- Lamas B, Hernandez-Galan L, Galipeau HJ, et al. Aryl hydrocarbon receptor ligand production by the gut microbiota is decreased in celiac disease leading to intestinal inflammation. Science translational medicine. 2020;12(566).
- Esterhazy D, Loschko J, London M, Jove V, Oliveira TY, Mucida D. Classical dendritic cells are required for dietary antigen-mediated induction of peripheral T(reg) cells and tolerance. Nature immunology. 2016;17(5):545-55.
- Wells JM, Rossi O, Meijerink M, van Baarlen P. Epithelial crosstalk at the microbiota-mucosal interface. Proceedings of the National Academy of Sciences of the United States of America. 2011;108 Suppl 1:4607-14.
- Ng KM, Ferreyra JA, Higginbottom SK, et al. Microbiota-liberated host sugars facilitate post-antibiotic expansion of enteric pathogens. Nature. 2013;502(7469):96-9.
- Stefka AT, Feehley T, Tripathi P, et al. Commensal bacteria protect against food allergen sensitization. Proceedings of the National Academy of Sciences of the United States of America. 2014;111(36):13145-50.
- Leffler DA, Kelly CP, Green PH, et al. Larazotide acetate for persistent symptoms of celiac disease despite a gluten-free diet: a randomized controlled trial. Gastroenterology. 2015;148(7):1311-9 e1316.
- Orlando A, Linsalata M, Bianco G, et al. Lactobacillus rhamnosus GG Protects the Epithelial Barrier of Wistar Rats from the Pepsin-Trypsin-Digested Gliadin (PTG)-Induced Enteropathy. Nutrients. 2018;10(11).
- Huibregtse IL, Marietta EV, Rashtak S, et al. Induction of antigen-specific tolerance by oral administration of Lactococcus lactis delivered immunodominant DQ8-restricted gliadin peptide in sensitized nonobese diabetic Abo Dq8 transgenic mice. Journal of immunology. 2009;183(4):2390-6.
- McCarville JL, Dong J, Caminero A, et al. A Commensal Bifidobacterium longum Strain Prevents Gluten-Related Immunopathology in Mice through Expression of a Serine Protease Inhibitor. Applied and environmental microbiology. 2017;83(19).
- Lavelle A, Sokol H. Gut microbiota-derived metabolites as key actors in inflammatory bowel disease. Nature reviews. Gastroenterology & hepatology. 2020;17(4):223-37.
- Arpaia N, Campbell C, Fan X, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature. 2013;504(7480):451-5.
- Furusawa Y, Obata Y, Fukuda S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature. 2013;504(7480):446-50.
- Hadis U, Wahl B, Schulz O, et al. Intestinal tolerance requires gut homing and expansion of FoxP3+ regulatory T cells in the lamina propria. Immunity. 2011;34(2):237-46.
- Bilate AM, Lafaille JJ. Induced CD4+Foxp3+ regulatory T cells in immune tolerance. Annual review of immunology. 2012;30:733-58.
- Tan J, McKenzie C, Vuillermin PJ, et al. Dietary Fiber and Bacterial SCFA Enhance Oral Tolerance and Protect against Food Allergy through Diverse Cellular Pathways. Cell reports. 2016;15(12):2809-24.
- Bouziat R, Biering SB, Kouame E, et al. Murine Norovirus Infection Induces TH1 Inflammatory Responses to Dietary Antigens. Cell host & microbe. 2018;24(5):677-88 e675.
- Rondeau LE, De Palma G, Caminero A. The food, the bug, and the ugly: A recipe for food-induced gut pain. Allergy. 2021.
- McCarville JL, Caminero A, Verdu EF. Novel perspectives on therapeutic modulation of the gut microbiota. Therapeutic advances in gastroenterology. 2016;9(4):580-93.
- Abdel-Gadir A, Stephen-Victor E, Gerber GK, et al. Microbiota therapy acts via a regulatory T cell MyD88/RORgammat pathway to suppress food allergy. Nature medicine. 2019;25(7):1164-74.
- Goel G, King T, Daveson AJ, et al. Epitope-specific immunotherapy targeting CD4-positive T cells in coeliac disease: two randomised, double-blind, placebo-controlled phase 1 studies. The lancet. Gastroenterology & hepatology. 2017;2(7):479-93.
Correspondencia: Alberto Caminero
Correo electrónico: acamine@mcmaster.ca
Acta Gastroenterol Latinoam 2021;51(3):259-270
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE