Jorge Antonio Galdámez Estrada1 ID· Luis Aguilar Paiz2 ID· Gianna Minerva Blanco3 ID
Sandra Chaves Monge4 ID· León de Mezerville Cantillo5 ID· Pablo Navarro Castillo6 ID· Isaac Quintero7 ID· Eliam del Pilar Rivas Polanco8 ID Marco Antonio Sánchez Hernández9 ID· Edder Sandoval10 ID· Jorge Suazo Barahona11 ID Edwin Vicente Pérez12 ID· Mariel Mejía13 ID· Silvia María Portillo14 ID· Luis Enrique Jerez González15 ID· José María Remes Troche16 ID· Max Julio Schmulson Wasserman17 ID
1 Médico Internista Gastroenterólogo. Presidente Asociación Centroamericana y del Caribe de Gastroenterología y Endoscopia Digestiva. Vice-presidente de la Asociación de Gastroenterología y Endoscopia Digestiva de El Salvador.
2 Gastroenterólogo Hospital Centro Médico, Guatemala. Presidente Sociedad Latinoamericana de Neurogastroenterología.
3 Gastroenteróloga, República Dominicana.
4 Asistente de Gastroenterología, Hospital México, CCSS. Coordinadora de Laboratorio de Estudios Funcionales. Hospital México, CCSS. Gastroenteróloga, Hospital Metropolitano y Hospital Clínica Bíblica. Profesora de postgrado Universidad de Costa Rica.
5 Médico Gastroenterólogo, Hepatólogo. San José, Costa Rica.
6 Gastroenterólogo, Clínica Digestiva Navarro, Alajuela Costa Rica. Profesor Escuela de Medicina, Universidad Latina de Costa Rica.
7 Gastroenterólogo, Panamá.
8 Médico gastroenterólogo y especialista en motilidad intestinal en CEDIMAT Centro de Diagnóstico Medicina Avanzada y Telemedicina y Radioclinic, República Dominicana.
9 Jefe Servicio de Gastroenterología, Hospital Escuela Universitario, Tegucigalpa, Honduras.
10 Médico Gastroenterólogo, Gastrosoluciones Centro de Enfermedades Digestivas, Hepáticas Endoscopia Avanzada, Guatemala.
11 Gastroenterólogo y Endoscopista, Director del Centro de Enfermedades Digestivas, Hospital del Valle, San Pedro Sula, Honduras.
12 Gastroenterólogo y Endoscopista, Hospital Salvador B. Gautier, República Dominicana. Vocal capítulo de Endoscopia Digestiva Sociedad Dominicana de Gastroenterología.
Revisores
13 Internista Gastroenteróloga especialista en Endoscopía Digestiva Terapéutica, Neurogastroenterología y Motilidad Gastrointestinal, Hospital Vivian Pellas, Nicaragua.
14 Centro de Enfermedades Digestivas, Hospital del Valle, San Pedro Sula, Honduras.
15 Gastroenterólogo Hospital Centro Médico Guatemala, Profesor Titular de Medicina Interna, Universidad de San Carlos de Guatemala.
16 Laboratorio de Motilidad y Fisiología Digestiva, Instituto de Investigaciones Médico-Biológicas, Universidad Veracruzana, Veracruz, México.
17 Profesor Titular de Medicina, Facultar de Medicina, Universidad Nacional Autónoma de México (UNAM). Laboratorio de Hígado, Páncreas y Motilidad (HIPAM), Unidad de Investigación en Medicina Experimental, Hospital General de México.
Acta Gastroenterol Latinoam 2023;53(2):137-163
Recibido: 06/11/2022 / Aceptado: 21/05/2023 / Publicado online el 30/06/2023 / https://doi.org/10.52787/agl.v53i2.272
Resumen
El síndrome de intestino irritable sigue siendo uno de los trastornos gastrointestinales más comunes observados por los médicos, tanto en la atención primaria como en la secundaria. Se han logrado avances significativos en la comprensión de su compleja fisiopatología, lo que resulta en su reclasificación como un trastorno de la interacción intestino-cerebro, en lugar de un trastorno gastrointestinal funcional. La condición afecta a entre el 5% y el 10% de la población y, en la mayoría de los casos, se caracteriza por tener una evolución con recaídas y remisiones. El diagnóstico se puede hacer sobre la base de la historia clínica con un uso limitado y juicioso de las investigaciones, a menos que se presenten síntomas de alarma, como pérdida de peso o sangrado rectal, o que haya antecedentes familiares de enfermedad inflamatoria intestinal o enfermedad celíaca. Los pilares del tratamiento incluyen la educación del paciente sobre la afección, los cambios en la dieta, la fibra soluble y los medicamentos antiespasmódicos. Otros tratamientos tienden a estar reservados para personas con síntomas refractarios e incluyen neuromoduladores centrales, secretagogos intestinales, medicamentos que actúan sobre los receptores opioides o 5-hidroxitriptamina o serotonina (5-HT), o antibióticos mínimamente absorbidos (todos los cuales se seleccionan de acuerdo con el hábito intestinal predominante), así como terapias psicológicas. Este consenso es el resultado del trabajo en conjunto de representantes de la Asociación Centroamericana y del Caribe de Gastroenterología, desarrollado de forma virtual, con el objetivo de presentar una serie de recomendaciones adaptadas a la realidad de la región y que sirvan de referencia en la práctica clínica.
Palabras claves. Síndrome de intestino irritable, diarrea, estreñimiento, consenso, diagnóstico, tratamiento, Centroamérica.
First Central American and Caribbean Consensus on Irritable Bowel Syndrome
Summary
Irritable bowel syndrome is one of the most common gastrointestinal disorders seen by physicians, both in primary and secondary care. Significant advances have been made in understanding its complex pathophysiology, resulting in its reclassification as a gut-brain interaction disorder, rather than a functional gastrointestinal disorder. The condition affects between 5% and 10% of the population and, in most cases, it is characterized by having a relapsing-remitting course. This diagnosis can be made based on the clinical history with limited and judicious use of investigations, unless symptoms of alarm such as weight loss or rectal bleeding, or a family history of inflammatory bowel disease or celiac disease. The pillars of treatment include patient education about the condition, dietary changes, soluble fiber, and antispasmodic medications. Other treatments tend to be reserved for people with refractory symptoms and include central neuromodulators, intestinal secretagogues, drugs that act on opioid receptors or 5-Hydroxytryptamine or serotonin, (5-HT), or minimally absorbed antibiotics (all of which are selected according to the predominant intestinal habit), as well as psychological therapies. This consensus is the result of the joint work of representatives of the Central American and Caribbean Association of Gastroenterology, developed virtually, with the aim of presenting a series of recommendations adapted to the reality of the region and serving as a reference in clinical practice.
Keywords. Irritable bowel syndrome, diarrhea, constipation, consensus, diagnosis, treatment, Central America.
Abreviaturas
FODMAPs: Alimentos que contienen oligosacáridos, disacáridos, monosacáridos y polioles fermentables.
tTG-IgA: Anticuerpos antitransglutaminasa tisular tipo IgA.
ATC: Antidepresivos tricíclicos.
CdtB: Antitoxina de distensión citoletal β.
CF: Calprotectina fecal.
DGI: Desorden gastrointestinal.
ECA: Estudios clínicos aleatorizados.
EGH: Examen general de heces.
GI: Gastrointestinales.
GMPc: Guanosín monofostafo cíclico.
IRSS: Inhibidores de la recaptación de serotonina.
FIT: Inmunohistoquímica fecal.
NNT: Número necesario para tratar.
PEG: Polietilenglicol.
PCR: Proteína C reactiva.
PT: Prueba tiroidea.
SII: Síndrome de Intestino Irritable.
SII-NC: Síndrome de intestino irritable no clasificable.
SII-PI: Síndrome de intestino irritable posinfección.
SII-D: Síndrome de intestino irritable-Diarrea.
SII-E: Síndrome de intestino irritable-Estreñimiento.
SII-M: Síndrome de intestino irritable-Mixto.
SBIDO: Sobrecrecimiento bacteriano del intestino delgado.
TIIC: Trastornos de la interacción intestino-cerebro.
VES: Velocidad de eritrosedimentación.
Introducción
El síndrome de intestino irritable (SII) es uno de los trastornos de la interacción intestino-cerebro (TIIC) más comunes1 y se caracteriza por dolor abdominal recurrente, de intensidad leve a grave, asociado a alteraciones en los hábitos defecatorios en ausencia de enfermedad orgánica o de anormalidades bioquímicas.
Los síntomas del SII pueden llegar a ser debilitantes y alterar significativamente la calidad de vida de los individuos afectados, con un impacto en la productividad laboral y efectos económicos en los sistemas de salud.
La prevalencia del SII varía sustancialmente entre los países (1,1% – 45,0%), debido a los diferentes criterios diagnósticos utilizados y a la heterogeneidad de los métodos de investigación.2,3
El SII es una enfermedad multifactorial relacionada con alteración de la motilidad intestinal, hipersensibilidad visceral, incremento de la permeabilidad intestinal, fenómenos inmunológicos, disbiosis y alteraciones a nivel del procesamiento del sistema nervioso central, entre otras.4-7
El estándar de oro para el diagnóstico del SII son los criterios de Roma, los cuales fueron desarrollados por la Fundación Roma y cuya versión más reciente, Roma IV, se publicó en 2016.8
El tratamiento del SII es multifactorial y en general los pacientes requieren más de una intervención terapéutica. El manejo puede incluir un estilo de vida saludable, medidas higiénico-dietéticas, terapia farmacológica, apoyo psicológico y el uso de medidas alternativas, según sea el criterio del clínico.
El objetivo de este consenso sobre SII es presentar una serie de recomendaciones adaptadas a la realidad de la región que incorpore la nueva evidencia presentada a nivel internacional para que sea referencia en la práctica clínica, no solo de gastroenterólogos sino también de otros especialistas que atienden pacientes con SII.
Todo esto enfocado en ofrecer una mejor calidad de vida para los pacientes centroamericanos que padecen de SII. En ninguna circunstancia, se recomiendan tratamientos particulares para individuos específicos.
Metodología
Se utilizó la metodología Delphi.9
Buscamos en la literatura médica en español e inglés, utilizando Pubmed y Elsevier (Sciencedirect), con enfoque en las principales revistas de gastroenterología publicadas entre 2017 y mayo 2021, con los términos “síndrome intestino irritable”, combinados con “epidemiología”, “prevalencia”, “incidencia”, “etiología”, “patofisiología”, “diagnóstico”, “investigación”, “gestión”, “terapia” y “tratamiento”, para identificar los artículos pertinentes.
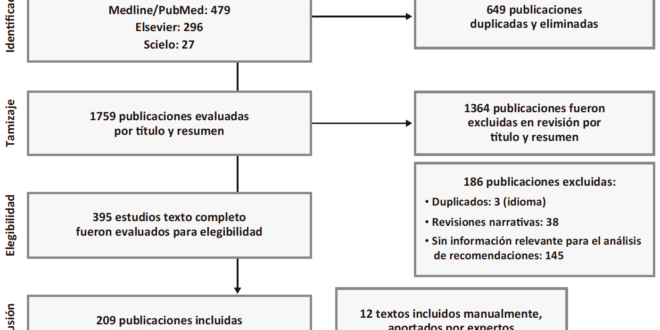
Posteriormente, a solicitud de los expertos, se amplió la búsqueda hasta diciembre 2021 y se revisó también la base de datos Scielo en búsqueda de textos específicos de la región. A solicitud de revisores externos se agregaron manualmente referencias de 2022 aportadas por expertos y revisores para aportar más datos de la región (Figura 1).
Figura 1. Diagrama de flujo de selección de publicaciones
El análisis y revisión de documentos para la selección de artículos se realizó utilizando la plataforma Mendeley y estuvo a cargo de tres coordinadores de grupos de trabajo.
Al finalizar la revisión de la evidencia, cada grupo elaboró una serie de recomendaciones por síntomas; por tal motivo, algunos fármacos se mencionan en distintos apartados, dado que tienen diferentes indicaciones. Estas recomendaciones se enviaron de forma electrónica a todos los participantes para ser votadas. Si el acuerdo era igual o mayor al 75%, se definió que la recomendación podía quedar sin ningún cambio; las recomendaciones que no alcanzaron un acuerdo mayor al 75% fueron revisadas para mejorar su planteamiento. En algunos casos, fue necesario revisar evidencia adicional para generar una nueva recomendación, que fue presentada al grupo en una segunda votación.
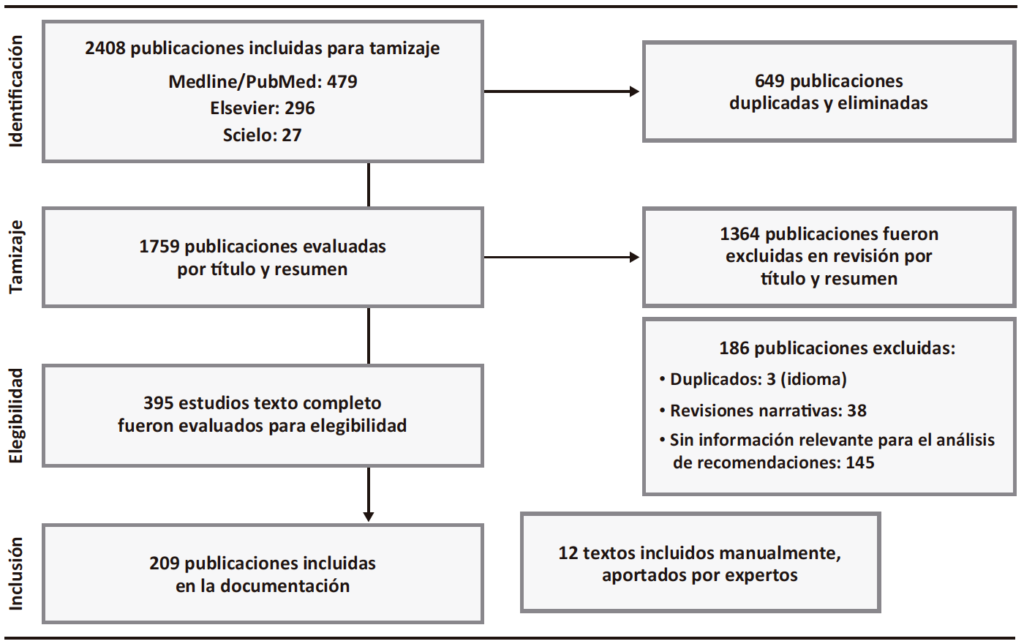
Posterior a la aprobación de la plenaria, los coordinadores establecieron el nivel de evidencia que sustenta cada enunciado. Para esto se utilizó el sistema Grading of Recommendations, Assessment, Development and Evaluation GRADE,10 el cual se resume en la Tabla 1.
Tabla 1. Sistema GRADE: Clasificación de la calidad de evidencia y de la fuerza de las recomendaciones
I. Epidemiología, definiciones y fisiopatología
El Estudio de Epidemiología Global de la Fundación de Roma, un estudio multinacional a gran escala, evaluó la prevalencia de veintidós desórdenes gastrointestinales (DGI) en 33 países de seis continentes, con un total de 73.076 adultos encuestados (vía internet o entrevista personal). La mayor parte del estudio se realizó en el norte de Europa o en el sudeste asiático, y reportó que más del 40% de las personas en los países evaluados tiene al menos un TIIC. Además, reveló que la prevalencia del SII en la población general a nivel mundial es del 4,1% (3,9% – 4,2%).2
Se observó un predominio en el género femenino en ambos métodos de encuesta, con una razón de probabilidades o razón de momios de mujer a hombre de 1,8 (1,7 – 2,0) para encuestados por medio de internet y de 2,0 (1,5 – 2,5) para los países en los que la encuesta se realizó en los hogares.2
Recientemente se efectuó un estudio similar en seis países de la región, que incluyó Costa Rica, Honduras, El Salvador, Guatemala, Nicaragua y Panamá. Se encuestó a 1200 sujetos, 200 por país, 601 hombres y 599 mujeres. Específicamente en el SII, se demostró que el 7,3% (5,8 – 8,7) cumplieron criterios de SII; en mujeres el 9,8% (7,5 – 12,2) y en hombres el 4,7% (3,0 – 6,3). Para las variedades de SII, el predominio de estreñimiento fue de 3,2% (2,2 – 4,2), para el predominio de diarrea fue de 2,3% (1,5 – 3,2), la variedad mixta fue de 0,8% (0,4 – 1,5). Para la región centroamericana, en comparación con el estudio global, la prevalencia de dicho trastorno es de casi el doble (4,1% vs. 7,3%).11
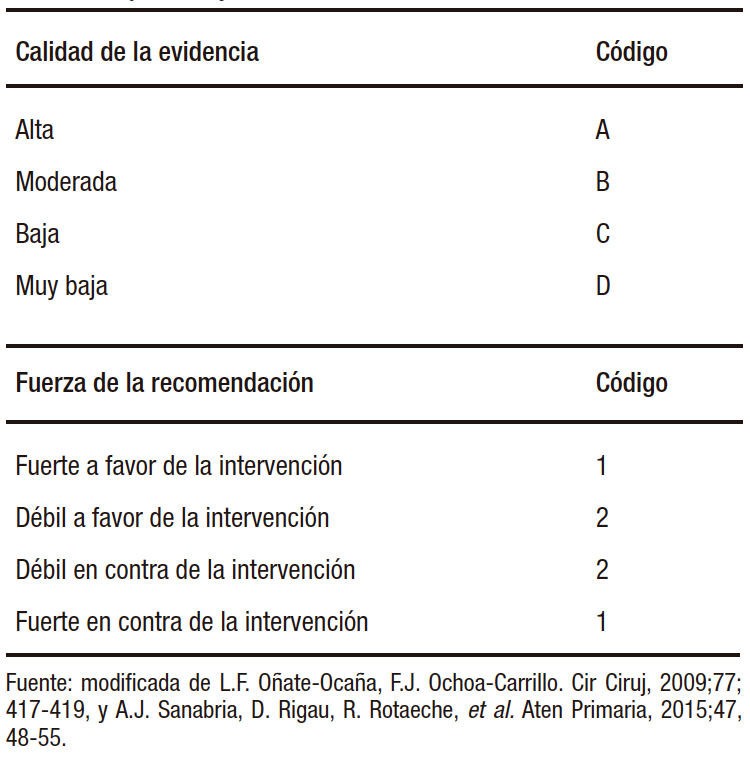
Síndrome de intestino irritable (SII): basado en los Criterios de Roma IV, el SII se define como un trastorno intestinal caracterizado por dolor abdominal recurrente asociado con la defecación o con un cambio del hábito intestinal, ya sea diarrea, estreñimiento o mixto (Figura 2). Los síntomas deben ocurrir al menos seis meses antes del diagnóstico y estar presentes durante los últimos tres meses.12
Figura 2. Criterios diagnósticos Roma IV
 Fuente: elaborado por grupo de trabajo con información obtenida de: Sebastián Domingo JJ. Med Clin (Barc). 2017;148(10):464-468. DOI:10.1016/j.medcli.2016.12.020 Y Drossman DA, Hasler WL. Gastroenterology. 2016;150(6):1257-1261. DOI:10.1053/j.gastro.2016.03.035
Fuente: elaborado por grupo de trabajo con información obtenida de: Sebastián Domingo JJ. Med Clin (Barc). 2017;148(10):464-468. DOI:10.1016/j.medcli.2016.12.020 Y Drossman DA, Hasler WL. Gastroenterology. 2016;150(6):1257-1261. DOI:10.1053/j.gastro.2016.03.035
Figura 3. Escala de forma de heces de Bristol
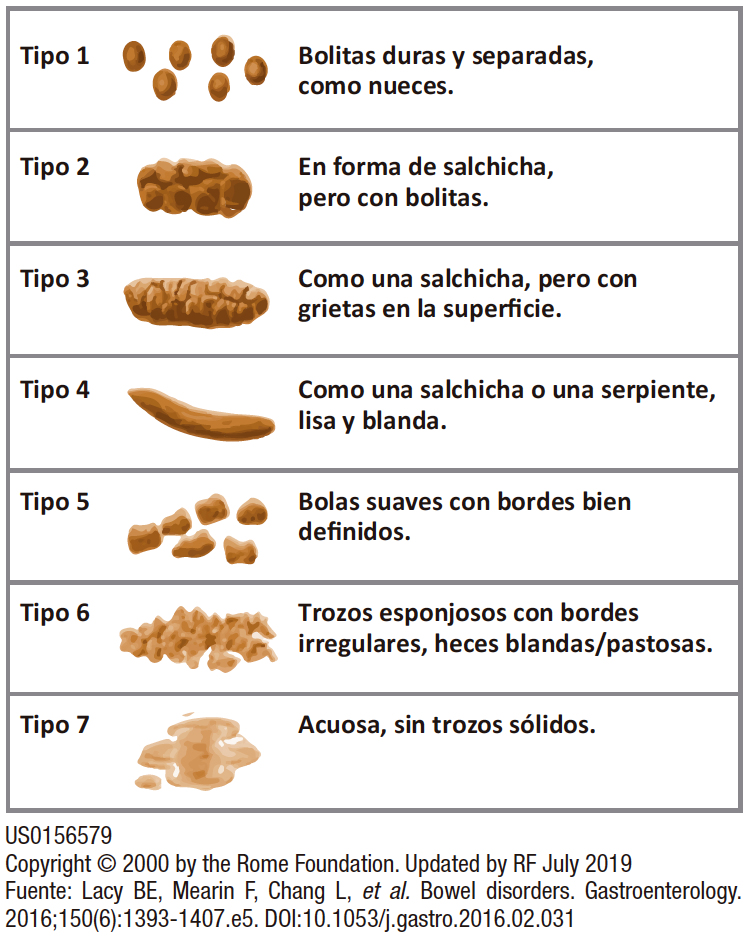
El SII se clasifica en subtipos con base en la consistencia de las evacuaciones de acuerdo con la Escala de Bristol (ver Figura 3) en: estreñimiento (E), diarrea (D), mixto (M) y no clasificable (NC).12
• SII-E: heces son duras/o en pelotitas ≥ 25% de las deposiciones, y sueltas/acuosas < 25% (Tipos 1 y 2).
• SII-D: heces blandas/acuosas ≥ 25% de las deposiciones, y heces duras/grumosas < 25% (Tipos 6 y 7)
• SII-M: heces blandas/acuosas y heces duras/o en pelotitas están presentes en un 25% o más de las deposiciones.
• SII-NC: no cumplen con ninguno de los criterios de las categorías anteriores.
SII posinfección (SII-PI): se desarrolla en aproximadamente el 10% de los pacientes con enteritis infecciosa. Los factores de riesgo identificados incluyen el sexo femenino, la edad más joven, tabaquismo, la angustia psicológica durante o antes de la gastroenteritis infecciosa y la gravedad de la enteritis (incluyendo frecuencia de deposiciones y duración mayor de una semana), dolor abdominal, disentería y el tratamiento con antibióticos.13 Se informa que la prevalencia del SII después de la gastroenteritis infecciosa o la enterocolitis es de 6 a 7 veces mayor que sin un episodio infeccioso previo.14 La proporción de SII-PI entre todos los casos de SII se estima entre el 5% y el 25%.15
La Tabla 2 muestra los criterios diagnósticos para SII-PI sobre la base de los criterios Roma IV.
Tabla 2. Criterios diagnósticos para SII-PI, basado en Roma IV

La fisiopatología del SII es compleja y sigue siendo poco conocida.16 La genética y los cambios epigenéticos, las infecciones, la dieta y las situaciones emocionales negativas desde la infancia pueden predisponer a un individuo a desarrollar SII.13, 17
Entre el 20% y el 60% de los pacientes con SII tienen una percepción visceral incrementada (hipersensibilidad) a varios estímulos fisiológicos (mecánicos o eléctricos).18 La acumulación de diferentes mecanismos (psicológicos, sensoriales y motores) aumenta la gravedad de los síntomas GI y no GI.19-20
El tránsito colónico es anormal solo en el 10% – 20% de los pacientes con SII-E y SII-M y en el 25% – 45% de los pacientes con SII-D.19, 21 Por su parte, los síntomas de dolor abdominal, distensión abdominal y flatulencia se correlacionan pobremente, o nada, con el tránsito colónico;21-22 mientras que la distensión abdominal objetiva (el aumento físico de la circunferencia abdominal, más que la sensación de distensión) se correlaciona con el tránsito intestinal y la consistencia de las heces.22 Los cambios en la motilidad GI pueden estar influenciados por alteraciones en el metabolismo de la serotonina (5-HT),23 con niveles altos reportados en pacientes con SII-D y niveles bajos en SII-E.24
El aumento de la permeabilidad y un incremento de mastocitos en la mucosa, en pacientes con SII-PI y SII-D se correlaciona con la sensibilidad visceral25-26 y la gravedad de los síntomas;27-28 sin embargo, los hallazgos en pacientes con SII-E son inconsistentes.29-30
Los cambios en el microbioma intestinal por gastroenteritis infecciosa, el uso de antibióticos o de inhibidores de la bomba de protones pueden modificar la motilidad GI, la sensibilidad visceral, la permeabilidad intestinal y la consistencia de las heces.31-32 Además, la producción de gases por parte de las bacterias puede inducir respuestas reflejas intestinales a través de la distensión intestinal, lo que conduce a una relajación inadecuada del diafragma, pues empuja el abdomen hacia afuera y provoca una distensión abdominal visible.33 El cambio dietético altera rápidamente el microbioma,34 aunque no está claro si esto explica el beneficio de las terapias dietéticas en algunos pacientes con SII.
En las familias, las influencias genéticas y las vivencias tempranas tienen un papel importante en el desarrollo del SII.35-36 Los estudios de asociación de todo el genoma han proporcionado asociaciones con variantes en el cromosoma 9 (locus9q31·2). En estudios de gemelos, la concordancia de un diagnóstico de SII es más común en gemelos monocigóticos que en gemelos dicigóticos. También se ha observado que tener un padre con SII es un fuerte predictor, lo que sugiere que los factores ambientales, tales como la conducta de enfermedad aprendida, son importantes.37
II. Diagnóstico
1. Pruebas de laboratorio
Es aconsejable realizar a todos los pacientes un hemograma, examen general de heces (EGH), velocidad de eritrosedimentación (VES) y proteína C reactiva (PCR); estos son exámenes accesibles y útiles para descartar organicidad.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: Completamente de acuerdo: 73,33%;
de acuerdo con reservas menores: 26,67%.
La función de las pruebas diagnósticas, como el EGH, es descartar organicidad e identificar infección o inflamación. El EGH es una herramienta útil y accesible para todos los pacientes con SII-D,38 pues permite detectar enfermedades infecciosas (giardia, amebiasis) y datos de enfermedad inflamatoria intestinal (leucocitos, sangre oculta).
Igualmente, el hemograma que incluye conteo de glóbulos blancos se solicita frecuentemente como parte de la evaluación inicial para descartar organicidad (anemia, leucocitosis). Dichos exámenes son de bajo costo y accesibles, aunque los resultados ayudan poco al clínico en cuanto a cambiar su estrategia de abordaje para quienes no presenten datos de alarma en la historia clínica.39
La VES y la PCR son dos pruebas serológicas comúnmente usadas para excluir EII en pacientes con SII-D, aunque son inespecíficas. Un metaanálisis encontró que la VES elevada no discriminaba entre ambas condiciones, mientras que una PCR menor o igual a 0,5 mg/dL reducía la posibilidad de EII en apenas un 1%. Una PCR elevada es más probable en pacientes con enfermedad de Crohn que en pacientes con colitis ulcerativa.40 Esto es de particular utilidad cuando no se cuenta con marcadores fecales a disposición.41
Se recomienda solicitar un examen de la hormona estimulante de la tiroides si hay sospecha clínica de enfermedad tiroidea y no de rutina.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 80%; de acuerdo con reservas menores: 20%.
El porcentaje de pacientes con pruebas tiroideas (PT) alteradas en la población es del 5% y el porcentaje de pacientes con SII y PT alteradas es del 1% aproximadamente.42 La realización de estos estudios depende de la epidemiología local; en general se utilizan para descartar hipotiroidismo en pacientes con SII-E e hipertiroidismo en SII-D.
Se debe descartar la enfermedad celíaca en todos los pacientes con SII-D o SII-M. Además, se debe considerar este diagnóstico en pacientes con SII-E si no hay una adecuada respuesta al tratamiento. La prueba sugerida para tal fin es la serología con anticuerpos antitransglutaminasa tisular tipo IgA(tTG-IgA) pero, si el paciente va a una endoscopía digestiva alta, se debe tomar biopsias del duodeno.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 60%; de acuerdo con reservas menores: 33,33%; completamente en desacuerdo: 6,67%.
La prevalencia de serología anormal para enfermedad celíaca es tres veces mayor en personas con sospecha de SII que en pacientes sin dichos síntomas, independientemente del patrón de las heces.43 Los tTG-IgA tienen una sensibilidad de cerca del 93% para la enfermedad celíaca, con una especificidad de más del 96,5%.44 Cuanto más alto el nivel, es más probable que el resultado sea un verdadero positivo.45 Asimismo, la biopsia del duodeno con atrofia de vellosidades e infiltrado de linfocitos (linfocitosis más de 30 por cada 100 enterocitos),46 asociado con una serología positiva por enfermedad celíaca, confirma este último diagnóstico. Por tanto, se recomienda la toma de múltiples biopsias del duodeno, una o dos muestras del bulbo duodenal y por lo menos cuatro biopsias de la región distal al bulbo duodenal, las cuales deben ser evaluadas por un patólogo experto.47
La deficiencia de IgA es más común en los pacientes con enfermedad celíaca (2% – 3%) que en la población general (1 en 400 a 1 en 800). Por este motivo, se ha recomendado hacer una determinación de los niveles de IgA junto con la determinación de la tTG-IgA y de esa forma eliminar la posibilidad de interpretar como no celíaco a un paciente con deficiencia de IgA. Otra opción es incorporar una prueba de tipo IgG, como la determinación de anticuerpos IgG contra los péptidos deaminados de la gliadina.47 Se discutió la posibilidad de incluir los niveles de IgA totales en la recomendación general; sin embargo, aumenta considerablemente el costo de los estudios. Por tanto, se recomienda dejar a criterio del médico tratante el realizar solo la tTG-IgA o acompañarla de los niveles de IgA, de acuerdo con las condiciones y la clínica de cada paciente. En pacientes con mayor sospecha clínica de enfermedad celíaca en los que la serología de tTG-IgA haya sido negativa, es conveniente solicitar los niveles de IgA o los Anti Gliadina Deaminada IgG y considerar la realización de una biopsia de intestino delgado.
A todo paciente que se someta a una gastroscopía por cualquier indicación y que presente SII-D se le debe tomar biopsia de intestino delgado para descartar enfermedad celíaca.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 66,67%; de acuerdo con reservas menores: 20%; de acuerdo con reservas mayores 6,67%; completamente en desacuerdo: 6,67%.
En ciertas regiones de Centroamérica, como por ejemplo en Costa Rica, donde hay una alta incidencia de cáncer gástrico, son muchas las gastroscopías que se realizan de forma preventiva. Esta es una situación que no ocurre en otras latitudes y es particular de nuestra región. Es por esto que este consenso sugiere tratar de detectar a los pacientes con sospecha de SII (dolor abdominal a repetición, diarreas frecuentes) en el interrogatorio previo a la gastroscopía y en esta población realizar la biopsia del intestino delgado. Desde el punto de vista de costos, una gastroscopía con biopsia es más onerosa que la serología de enfermedad celíaca (además de ser invasiva), pero, si ya el paciente o el sistema de salud incurrieron en el costo de la gastroscopía, el análisis de la biopsia de intestino delgado es más barato que la serología. Por tanto, esta estrategia se considera efectiva, en nuestra región, por el costo de oportunidad.
En pacientes con sospecha de SII-D, es recomendable realizar una calprotectina fecal (CF) para descartar EII. Si esta prueba sale positiva, se debe considerar la realización de una colonoscopía con biopsias de varios segmentos del colon para hacer el diagnóstico diferencial. En pacientes con diarrea persistente, a pesar de tratamiento, se deben considerar otros diagnósticos, como enfermedad celíaca, malabsorción de sales biliares, insuficiencia pancreática exocrina o sprue tropical. Se podría considerar una prueba terapéutica con secuestradores de sales biliares para descartar diarrea secundaria a malabsorción de dichas sales en pacientes con diarrea persistente.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor de realizar la CF.
• GRADE: C2 débil a favor de la prueba terapéutica con secuestradores de sales biliares.
Nivel de acuerdo: completamente de acuerdo: 66,67%; de acuerdo con reservas menores: 26,67%; completamente en desacuerdo: 6,67%.
Puede ser difícil diferenciar entre el SII y la EII solamente sobre la base de síntomas. Previo a los estudios, la posibilidad de EII en el SII es de menos de 0,5% – 1,2%; sin embargo, luego de cinco años, la incidencia es 2,6 – 5 veces mayor que en los controles. Por su parte, la CF es un marcador de inflamación intestinal útil y probablemente superior a las pruebas serológicas VES y PCR para discriminar entre EII y SII.41
La malabsorción de sales biliares es una condición que puede generar diarrea en pacientes con SII-D; de hecho, se considera que aproximadamente el 30% de los pacientes con SII-D cursan con malabsorción de ácidos biliares. Las pruebas para determinar si existe esta condición están disponibles en pocos países, lo que dificulta establecer este diagnóstico. La prueba considerada como el estándar de oro es el de medicina nuclear con ácido tauroselcólico.48 Una prueba terapéutica con secuestradores de sales biliares es el método más usado para diagnosticar esta patología en la mayoría de los países y es una estrategia razonable, dado que los estudios mencionados no están disponibles.41 Algunas veces se necesitan dosis altas de secuestradores para poder mejorar los síntomas (hasta 4 g, seis veces al día)49 y esto, asociado a los problemas de palatabilidad, distensión y dolor abdominal causados por dichas sustancias, puede provocar que algunos pacientes no sean bien diagnosticados.50-51
Pimentel y col. validaron el uso de los anticuerpos anti-CdtB y antivinculina como biomarcadores para discriminar el SII-D de la EII. La particularidad de estos anticuerpos es que estarían positivos en algunos pacientes con SII-D.52-53
Se considera que, hasta el momento, no se cuenta con marcadores que establezcan el diagnóstico de SII, los anticuerpos anti-CdtB y antivinculina no están positivos en todos los pacientes con SII-D y se desconoce su prevalencia en los pacientes con SII. Además, el estudio de Pimentel y colaboradores excluyó a pacientes con patologías relevantes en el diagnóstico diferencial, como colitis microscópica, parasitosis o neoplasias.52, 54
Este es un tema que requiere más estudio y por el momento no se puede recomendar el uso de estos anticuerpos. Además, no están disponibles en Centroamérica.
Hay poca evidencia para solicitar de forma rutinaria pruebas para detectar sobrecrecimiento bacteriano intestinal (SBIDO). En caso de estar disponibles, las pruebas de aliento pueden predecir la respuesta a rifaximina.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 73,33%; de acuerdo con reservas menores: 20%; de acuerdo con reservas mayores: 6,67%.
El SBIDO es definido como la presencia de exceso de bacterias en el intestino delgado, lo cual ocasiona síntomas GI. Estas bacterias son usualmente coliformes, se encuentran típicamente en el colon e incluyen predominantemente aerobios Gram negativos y especies anaeróbicas que fermentan carbohidratos y producen gas.
La prueba de aliento se utiliza para el diagnóstico de síndromes de mala digestión de carbohidratos y SBIDO, y es simple y segura en la evaluación de enfermedades GI.55 Si se considera el SBIDO como una posibilidad en el paciente valorado por SII, se podría hacer una prueba en aliento para SBIDO, que ha demostrado que puede predecir la respuesta a rifaximina,56 o una prueba terapéutica con rifaximina con el mismo objetivo. La elección de usar estas pruebas queda de acuerdo con su disponibilidad y el criterio del clínico.54
2. Imágenes
No se recomienda el enema baritado para descartar organicidad en el SII dado que es un estudio que tiene baja sensibilidad.
Otros estudios radiológicos como el ultrasonido, la tomografía computarizada y la resonancia magnética no están indicados en general en el SII. No obstante, según criterio del clínico podrían ser útiles en algunos pacientes con síntomas específicos.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte en contra de la intervención.
• Nivel de acuerdo: completamente de acuerdo: 73,33%; de acuerdo con reservas menores: 20%; de acuerdo con reservas mayores: 6,67%.
Los estudios de imagen (enema baritado, ultrasonido, tomografía computarizada, resonancia magnética, etc.) son de poca utilidad en pacientes con síntomas de SII en ausencia de datos de alarma o comorbilidades. Los estudios radiológicos no son necesarios en pacientes sin datos de alarma, pero deben considerarse cuando estos existan.
Asimismo, la elección del estudio debe individualizarse y ser determinada por los síntomas predominantes. La realización rutinaria del ultrasonido abdominal en pacientes con SII es innecesaria. Una revisión reciente determinó que hay una sorprendente escasez de información acerca de la utilidad de estudios de imagen en el SII.54
En el caso de SII con manifestaciones de alarma, los estudios radiológicos deben ser dirigidos según la sospecha diagnóstica: en paciente con colonoscopía incompleta podría realizarse colonoscopía virtual; ante sospecha de neoplasia de ovario, ultrasonido pélvico; si se sospecha EII, podría considerarse la enterotomografía o enteroresonancia.57
La colonoscopia tiene justificación de efectuarse en los sujetos con criterios de SII, únicamente si presentan signos de alarma o factores de riesgo. Se puede usar como una alternativa de tamizaje de cáncer de colon en mayores de 50 años. En algunas guías de tamizaje de cáncer de colon publicadas recientemente, el punto de corte se bajó a los 45 años.
• Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 93,33%; de acuerdo con reservas menores: 6,67%.
Las guías internacionales recomiendan un diagnóstico positivo, utilizando los criterios diagnósticos de Roma IV y así minimizar las investigaciones diagnósticas.58 Se debe considerar la realización de colonoscopía en todos los pacientes que elijan esa opción como tamizaje de cáncer de colon de acuerdo con las guías vigentes, así como en los pacientes que presenten datos de alarma: fiebre, anemia, sangre visible o sangre oculta en heces positiva, pérdida de peso no explicada por una dieta, masa palpable abdominal o masa rectal y de presentación nocturna. Igualmente, se consideran factores de riesgo los siguientes: inicio posterior a los 50 años, antecedentes familiares de EII o historia familiar de cáncer colorrectal.41, 59-60
Existen diferencias entre las diversas guías sobre la edad de inicio de tamizaje de cáncer de colon, entre los 45 y los 50 años; lo que es claro es que todos los mayores de 50 años deben ser tamizados. Las dos opciones preferidas de tamizaje para población general son la realización de una colonoscopía cada diez años o la realización de una prueba inmunohistoquímica fecal (FIT) anual. En caso de que la prueba de FIT sea positiva, hay que hacer la colonoscopía.
Otra justificación para realizar una colonoscopía es la posibilidad clínica de colitis microscópica. Esta debe sospecharse en pacientes con síntomas de diarrea persistente; sexo femenino; edad mayor o igual a 50 años; comorbilidad de enfermedad autoinmune; síntomas de diarrea severa o nocturna; duración de la diarrea menor a doce semanas; pérdida de peso; uso de medicamentos que precipitan los síntomas, como antiinflamatorios no esteroidales, inhibidores de bomba de protones, inhibidores del sistema renina angiotensina, estatinas; o uso reciente de antibióticos.41, 58, 61
Es importante tomar biopsias en varios segmentos durante la colonoscopía, aun en presencia de mucosa normal y sin lesiones macroscópicas evidentes.54
La indicación precisa para utilizar la prueba de sangre oculta en heces es identificar sangrado GI, tamizaje de cáncer colorrectal y descartar EII en paciente en estudio por SII. Dicho examen tiene baja sensibilidad y especificidad como parámetro único para descartar EII contra SII.62-63
III. Tratamiento
1. Dieta y medidas generales
Se recomienda seguir una dieta baja en alimentos que contengan oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAPs) en pacientes con SII, teniendo en cuenta que el apego a esta puede ser complicado y que, idealmente, debe ser guiada por un especialista en nutrición clínica.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 86,67%; de acuerdo con reservas menores: 13,33%.
La dieta baja en FODMAPs implica una fase de exclusión de estos alimentos durante 4 – 6 semanas, seguida de una exposición gradual y controlada de cada grupo de FODMAP durante 3 días para determinar la tolerancia individual. Un metaanálisis reciente de doce estudios controlados demostró que esta dieta reduce significativamente la gravedad de los síntomas del SII y mejora la calidad de vida de los pacientes.64 Sin embargo, se necesitan más estudios para evaluar los efectos adversos a largo plazo de esta dieta sobre la nutrición y la microbiota intestinal.65
Un estudio comparativo entre dieta baja en FODMAPs, dieta libre de gluten y dieta balanceada (dieta mediterránea) demostró que las tres redujeron la severidad de los síntomas y mejoraron la calidad de vida en pacientes con SII. Sin embargo, la dieta balanceada fue la preferida por el 86% de los pacientes, demostrando una mejor tolerancia y mejoras significativas en la calidad de vida y el dolor. Por estas razones, una dieta balanceada puede recomendarse en pacientes con SII.66
Una revisión sistemática encontró que la dieta baja en FODMAPs es efectiva en la reducción de los síntomas globales, dolor, distensión abdominal y gravedad de los síntomas en pacientes con SII, con valores de reducción de hasta el 56%.67
No se puede recomendar excluir universalmente el gluten en pacientes con SII, ya que los estudios no aportan evidencia adecuada para esta restricción.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 86,67%; de acuerdo con reservas menores: 13,33%.
En una revisión sistemática y metaanálisis de dos estudios controlados en SII, la dieta libre de gluten mostró una reducción en los síntomas globales en comparación con el control, pero no fue estadísticamente significativa, lo que no proporcionó suficiente evidencia para recomendar una dieta libre de gluten para reducir los síntomas del SII.68 Otros estudios que abordan la relación entre el gluten y el SII tienen problemas metodológicos, como no descartar la enfermedad celíaca, el efecto nocebo y no diferenciar el gluten de otros componentes de la dieta.69
En caso de SII-D asociada al consumo de lactosa, se recomienda confirmar el diagnóstico con una prueba de aire espirado. En caso de dificultad para realizarla, puede recomendarse una prueba terapéutica excluyendo temporalmente la lactosa de la dieta durante 4 – 8 semanas y su posterior reintroducción hasta los niveles que no produzcan síntomas o con uso concomitante de lactasa.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 80%; de acuerdo con reservas menores: 20%.
La restricción de lactosa no es una recomendación dietética en el SII, sino más bien para los pacientes con intolerancia a la lactosa, que se confirma por medio de la prueba de medición de hidrógeno en el aire espirado en el aliento, posterior a la ingesta de lactosa.
Al paciente que se diagnostique con intolerancia a lactosa, se le recomienda el consumo de lácteos deslactosados o el uso de tabletas de lactasa, que deben ser administradas en el momento en que el paciente ingiere el lácteo, dado que su efecto es sobre el alimento ingerido y no sobre el organismo del paciente.
Realizar actividad física 3-5 veces por semana mejora los síntomas globales y la calidad de vida. Hacer yoga también podría ayudar, pero la evidencia es insuficiente en este momento.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 80%; de acuerdo con reservas menores: 13,33%; de acuerdo con reservas mayores: 6,67%.
El ejercicio (20 – 60 min, 3 – 5 veces por semana) mejora la escala de severidad de los síntomas del SII, la calidad de vida asociada y reduce el riesgo de empeoramiento de los síntomas. Los estudios controlados han demostrado que el ejercicio es capaz de prevenir que los síntomas empeoren70 y que la mejoría persiste a largo plazo (hasta 5,2 años).71-72
Una revisión sistemática sugiere que el yoga puede ser un tratamiento seguro y factible para personas con SII. Sin embargo, debido a que los estudios existentes tienen mucho sesgo, no se puede recomendar el uso del yoga como intervención rutinaria para SII. Se necesitan más estudios de alta calidad para medir mejor los resultados clínicos.73
Se recomienda establecer una adecuada relación médico-paciente, ya que está asociada con mejores resultados en el tratamiento global y en la calidad de vida de los pacientes con SII.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 93,33%; de acuerdo con reservas menores: 6,67%.
Se recomienda un enfoque centrado en el paciente con una comunicación efectiva entre el médico y el paciente para el manejo del SII, lo que se ha asociado con mejores resultados globales, mayor satisfacción del paciente y menos visitas médicas. Habilidades como hacer preguntas abiertas, escuchar activamente y mostrar empatía pueden fortalecer la relación médico-paciente y aplicarse en la medicina clínica para mejorar la comunicación en el manejo de enfermedades crónicas.74
Un estudio exploratorio de Hulme y colaboradores encontró que una buena relación médico-paciente se correlaciona positivamente con una mejor calidad de vida y una mayor aceptación de la enfermedad en pacientes con SII. Los resultados sugieren que una relación que fomente el entendimiento mutuo ayuda a los pacientes a comprender sus síntomas y manejar el SII de manera más flexible, lo que mejora su calidad de vida.75 Además, Schmulson y colaboradores demostraron que tranquilizar a los pacientes en la visita médica inicial disminuye significativamente su autopercepción de discapacidad.76
2. Tratamiento de dolor abdominal
Los antiespasmódicos han demostrado ser efectivos ante el dolor abdominal, por lo que son altamente recomendados, solos o combinados con simeticona, de acuerdo con la necesidad del paciente.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 93,33%; de acuerdo con reservas menores: 6,67%.
Los antiespasmódicos son medicamentos que inhiben la contracción del músculo liso al competir con la acetilcolina o bloquear los canales de calcio.77 Estos han demostrado ser superiores al placebo, sobre todo en el dolor y la distensión abdominal (56% versus 38%). También demostraron ser superiores al placebo en el tratamiento del dolor y la distensión abdominal en pacientes con SII, en un metaanálisis de 29 estudios con 2.333 pacientes. Además, mostraron mejoría del dolor abdominal, mejoría global y disminución del puntaje de síntomas globales, con un número necesario para tratar (NNT) de 7, 5 y 3, respectivamente.78
Los relajantes directos del músculo liso, como la mebeverina, la trimebutina y agentes derivados de la papaverina, actúan sobre las miofibrillas del músculo liso del aparato digestivo, reduciendo el tono y peristaltismo y aliviando los espasmos intestinales, sin afectar la motilidad GI. Los efectos secundarios son raros e incluyen cefalea y mareo.77
En un estudio de Connell, la mebeverina endovenosa disminuyó la motilidad del colon sigmoide en pacientes con SII-D y fue superior al placebo en términos de mejoría de los síntomas y bienestar general durante 12 semanas de tratamiento en pacientes con SII.79
Otros estudios no controlados con placebo también han mostrado resultados positivos con la mebeverina de liberación prolongada y simple, con pocos eventos adversos. El bromuro de pinaverio y la mebeverina mostraron mejoras similares en el bienestar global, la frecuencia de defecación y la consistencia de las heces en pacientes con SII-D.79
Dos revisiones sistemáticas encontraron que el tratamiento con trimebutina es más efectivo que el placebo en la mejora del dolor abdominal en pacientes con SII, aunque los resultados estadísticamente significativos difieren entre ambos estudios.78,80
Los antiespasmódicos anticolinérgicos como el butilbromuro de hioscina, la hiosciamina, la dicicloverina, el propinoxato y el bromuro de cimetropio reducen los espasmos intestinales y por lo tanto el dolor abdominal. Sin embargo, pueden tener efectos secundarios como cefalea, mareo y xerostomía.77
El butilbromuro de hioscina es un anticolinérgico antimuscarínico regulado por la Administración de Alimentos y Medicamentos, pero la evidencia en el SII es limitada. Dos metaanálisis citan tres estudios clínicos aleatorizados (ECA) que muestran una mejoría significativa de los síntomas, pero solo uno reportó eficacia en el manejo del dolor abdominal. Se asocia con efectos adversos como sequedad de boca, mareos y visión borrosa, cuya incidencia se relaciona con la dosis. El estreñimiento y la confusión son otros efectos adversos reportados.80-81
El propinoxato es un antiespasmódico con un mecanismo de acción dual: musculotropo y anticolinérgico. Actúa directamente en las células del músculo liso visceral para reducir los espasmos y presenta un bloqueo moderado y no selectivo de las fibras colinérgicas muscarínicas.82
En un estudio doble ciego con placebo en 75 pacientes con SII, el propinoxato oral (10 mg qid por 28 días) mostró una mejoría significativa y progresiva de la intensidad del dolor abdominal, de la frecuencia de las crisis del dolor y de la distensión abdominal en mayor medida que la observada en el grupo tratado con placebo. Los efectos adversos más frecuentes fueron cefalea, náusea y dolor de cabeza, pero ningún paciente tuvo que abandonar el tratamiento.83
El propinoxato se estudió en 400 pacientes con dolor tipo cólico intestinal agudo funcional en un ensayo doble ciego. Se utilizaron tres dosis de propinoxato IV (10 mg, 20 mg y 30 mg) y placebo, cada grupo con 100 pacientes. Todos los grupos de tratamiento fueron más efectivos que el placebo, y las dos dosis mayores fueron más efectivas que la de 10 mg, aunque causaron mayor sequedad de boca como efecto secundario.84
Rzetelna y col. compararon retrospectivamente el pro-pinoxato y la escopolamina en 1.042 pacientes con dolor abdominal de tipo cólico y encontraron que ambos tratamientos resultaron en una mejora estadísticamente significativa en la intensidad del dolor.82
Castillo R. comparó el propinoxato en combinación con el clonixinato de lisina y la hioscina en combinación con paracetamol en 120 pacientes con dolor abdominal de tipo cólico de origen biliar y colónico, encontrando que ambas combinaciones fueron efectivas en el tratamiento del dolor.85
Los canales de calcio son importantes para la fisiología del intestino y en el tratamiento del SII porque regulan procesos intracelulares, como la contracción y la neurotransmisión. Medicamentos como el bromuro de otilonio, el bromuro de pinaverio y el citrato de alverina actúan inhibiendo la acción de la acetilcolina en los receptores muscarínicos o bloqueando los canales de calcio en el músculo liso GI.79
El bromuro de otilonio es un bloqueador de los canales de calcio y de los receptores muscarínicos, lo que sugiere una acción antisecretora en pacientes con SII-D. También bloquea los receptores de taquicinina neuroquinina-2, reduciendo la transmisión aferente sensorial periférica al sistema nervioso central. Estos efectos sugieren que el otilonio puede reducir los dos síntomas principales del SII: espasmos y dolor abdominal.79
En un metaanálisis publicado en 2012, en cuatro ECA que evaluaron bromuro de otilonio contra placebo, se observaron diferencias estadísticamente significativas en favor de la droga en cuanto a la mejoría global de síntomas, con un NNT de 7, y de dolor abdominal, con un NNT de 8. Los efectos adversos del otilonio fueron similares a los del grupo placebo.86
El bromuro de pinaverio es un antiespasmódico eficaz, tanto solo como cuando forma parte de combinaciones con simeticona.81 En un metaanálisis de Cochrane de 2011, se encontró que el bromuro de pinaverio mejora los síntomas del SII y reduce el dolor abdominal. Otro metaanálisis de 2012 encontró que la combinación de pinaverio y simeticona mejora la distensión abdominal, pero no hay beneficios significativos en la mejoría global de los síntomas y el dolor abdominal. El bromuro de pinaverio se considera una droga segura, sin efectos adversos significativos en comparación con el placebo.78, 81
Se recomienda el uso de neuromoduladores en pacientes con predominio de dolor que no responden a los antiespasmódicos convencionales, asociado o no a enfermedad neuropsiquiátrica; los de mayor evidencia son los antidepresivos tricíclicos. En pacientes con SII-E puede empeorar el estreñimiento.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 86,67%; de acuerdo con reservas menores: 13,33%.
El uso de mirtazapina en SII es una recomendación de expertos. Aún faltan estudios que avalen su uso y efectividad.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 73,33%; de acuerdo con reservas menores: 20%; de acuerdo con reservas mayores: 6,67%.
Si los pacientes con SII no responden bien al tratamiento farmacológico convencional y tienen dolor abdominal predominante, deben considerarse terapias con propiedades analgésicas viscerales, como los antidepresivos tricíclicos (ATC) y los inhibidores de la recaptación de serotonina (IRSS).77
Los antidepresivos se utilizan en pacientes con SII debido a su capacidad para modificar la percepción visceral del dolor mediante la modulación central de las vías viscerales aferentes, así como para actuar sobre la comorbilidad psicológica y modificar el tránsito intestinal.77 Varios estudios se han llevado a cabo para evaluar su eficacia en el SII, destacándose la evidencia más sólida con los ATC, siendo imipramina, desipramina y amitriptilina los más utilizados. Por otro lado, los resultados obtenidos con IRSS, como fluoxetina, paroxetina y citalopram, son menos concluyentes.87
Los ATC, gracias a su efecto anticolinérgico, reducen el tiempo de tránsito intestinal, lo que puede ser beneficioso en el SII-D, con un NNT promedio de 4. Sin embargo, deben utilizarse con precaución en pacientes con estreñimiento. Por otro lado, los IRSS tienen efectos proquinéticos y se recomiendan para el SII-E, con un NNT promedio de 5.87
Varios metaanálisis han evaluado la respuesta a los antidepresivos en pacientes con SII, encontrando diferencias estadísticamente significativas a favor del tratamiento en relación con la mejoría global de síntomas y el dolor abdominal. Al analizar los mecanismos de acción de forma individual, la evidencia parece ser más sólida para los ATC.87 Sin embargo, los ATC se asocian a una mayor frecuencia de efectos adversos, como resequedad de mucosas, estreñimiento, somnolencia, hiporexia y palpitaciones, cuando se comparan con placebo, con un número necesario para causar daño de 8,5.88
Para una mejor adherencia al tratamiento y minimizar los efectos secundarios de los ATC, se sugiere iniciar con una dosis baja (10 mg de imipramina o amitriptilina) e ir incrementándola paulatinamente hasta lograr el efecto terapéutico deseado.
La mirtazapina actúa como un potente antagonista de los receptores 5-HT2a-c, 5-HT3 de la serotonina y α-2 adrenérgico a nivel central, lo que favorece una transmisión serotoninérgica más selectiva hacia los receptores 5-HT1, lo que parece ser la clave de la mejoría del estado de ánimo y su papel en el tratamiento del dolor crónico, especialmente el neuropático.89 Por su parte, los receptores 5-HT3 regulan la peristalsis en el tubo digestivo y tienen un efecto sobre la formación de heces y el tiempo de tránsito GI.
En el SII con predominio de diarrea, los receptores 5-HT3 se estimulan excesivamente y el movimiento peristáltico en el tubo digestivo se agrava, de modo que la mirtazapina es eficaz por lo expuesto anteriormente. Además, los receptores 5-HT3 facilitan la transmisión sensorial de dolor abdominal e hipersensibilidad visceral.90
Un estudio con mirtazapina demostró que fue más efectiva que el placebo en disminuir la gravedad de los síntomas del SII. La mirtazapina también tiene propiedades antagonistas del receptor H1 de histamina y 5-HT2a, lo que puede mejorar el sueño, aumentar el apetito y hacer que el sueño sea más reparador.89
Se han informado efectos antidepresivos y terapéuticos de la mirtazapina en el SII con enfermedad mental comórbida.90
3. Tratamiento de SII-Estreñimiento
La fibra mejora el número de evacuaciones en pacientes con SII-E, pero no tiene efecto sobre otros síntomas distintos al estreñimiento.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 73,33%; de acuerdo con reservas menores: 26,67%.
El término suplemento de fibra incluye carbohidratos complejos poco digeribles, los cuales no son hidrolizados ni absorbidos en el intestino delgado, con lo cual se alcanza casi de manera íntegra el colon, donde son fermentados por la microbiota intestinal y se producen ácidos grasos de cadena corta, agua y gases (hidrógeno, metano y carbono). En dependencia de la solubilidad en agua, se subdividen en fibra soluble e insoluble. Un incremento en la ingesta diaria de fibra forma heces más blandas y voluminosas, hecho que aumenta el peristaltismo y facilita la defecación. Se asocia además a cambios en el pH colónico y la microbiota y, potencialmente, tiene efectos sobre la permeabilidad y la inflamación.91-92
Dado que al utilizar fibra puede causar distención, debe introducirse paulatinamente para minimizar esta posibilidad.
Varios estudios y un metaanálisis demostraron que fue la fibra soluble como psyllium (ispaghula) la que tuvo un efecto significativo en el SII, mejorando el estreñimiento y la diarrea. Por otro lado, la fibra insoluble (salvado de trigo) algunas veces aumentó los síntomas. No se encontraron diferencias en la frecuencia de eventos adversos.91-95
Los laxantes osmóticos son útiles en SII-E para el manejo de la constipación, siendo el polietilenglicol (PEG) el de primera elección.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 73,33%; de acuerdo con reservas menores: 20%; completamente en desacuerdo: 6,67%.
En la región centroamericana están disponibles el PEG y la lactulosa, que han demostrado ser superiores al placebo en el manejo de constipación. La lactulosa es un disacárido que puede ser fermentado, lo que puede provocar distensión, dolor abdominal y flatulencia.
Al comparar el PEG con la lactulosa, se encontró que el PEG era superior en número de evacuaciones, consistencia de las heces y necesidad de tratamiento de rescate, sin provocar dolor abdominal.96
Se ha reportado una mejoría estadísticamente significativa en evacuaciones intestinales espontáneas completas, consistencia de las heces y esfuerzo defecatorio en el grupo de PEG. Aunque hubo disminución del índice de gravedad para el malestar abdominal y dolor en el grupo de PEG, esto no fue significativo en relación con el placebo.97-98
En conclusión, los laxantes osmóticos tienen una pobre evidencia para la mejoría de dolor y distensión en SII, pero son útiles para mejorar la frecuencia y consistencia de las evacuaciones. Por lo tanto, pueden ser usados en el manejo de SII-E, principalmente como terapia para el manejo del estreñimiento. Para manejar otros síntomas como distensión y dolor, deben agregarse otras terapias.97
Los laxantes estimulantes que están disponibles en nuestro medio son útiles en el tratamiento del estreñimiento funcional (EF), pero no son eficaces en SII-E.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 53,33%; de acuerdo con reservas menores: 40%; de acuerdo con reservas mayores: 6,67%.
Con respecto al subgrupo antraquinonas, no hay estudios disponibles en SII-E para este tipo de medicamentos, lo cual se infiere de los estudios de EF. En consecuencia, no se recomienda en SII-E.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 93,33%; de acuerdo con reservas menores: 6,67%.
Se denominan laxantes estimulantes a aquellos compuestos que de forma directa provocan un incremento de la peristalsis colónica y favorecen la secreción de agua y electrólitos. Se consideran laxantes estimulantes los difenilmetanos (picosulfato, bisacodilo) y las antraquinonas (cáscara sagrada, hojas de sen).
Existen estudios que demuestran que el bisacodilo y picosulfato de sodio son útiles en el EF para mejorar la cantidad de deposiciones y la calidad de vida.92, 99-100 El dolor abdominal es un efecto secundario frecuente, pero pueden presentarse otros más serios como el síndrome de Steven-Johnson y la enteropatía con pérdida de proteínas.
Este grupo de medicamentos puede ser útil para el estreñimiento ocasional y en períodos cortos. Son medicamentos disponibles en todos nuestros países y, en muchas ocasiones, los pacientes se automedican. Los efectos secundarios establecidos de este grupo de medicamentos son reacciones alérgicas, desequilibrio hidroelectrolítico y melanosis coli. Igualmente, la mayor parte de los pacientes desarrollan tolerancia, de modo que es necesario aumentar la dosis de manera progresiva.101
Los medicamentos secretagogos agonistas del guanilato ciclasa C (linaclotida y plecanatida) son efectivos en el tratamiento de SII-E, pero actualmente no se encuentran disponibles en la región.
• Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 93,33%; de acuerdo con reservas menores: 6,67%.
La linaclotida y la plecanatida son agonistas del guanilato ciclasa C cuyo estímulo produce un aumento del guanosín monofostafo cíclico (GMPc) intracelular en el enterocito, que actúa produciendo un aumento de la secreción de bicarbonato y cloro hacia la luz intestinal; el efecto final es un aumento de la secreción intraluminal con la consiguiente aceleración del tránsito. También se ha observado un efecto analgésico visceral porque reduce la activación de las neuronas nociceptivas.102-104
Tanto la linaclotida como la plecanatida demuestran una eficacia y tolerabilidad similares en el tratamiento de SII-E y EF. No se observaron diferencias en las probabilidades de diarrea entre ambos medicamentos.105 Actualmente, no se encuentran disponibles en los países de la región.
La lubiprostona es efectiva para el tratamiento de SII-E, pues mejora el dolor, la distensión, la frecuencia y la consistencia de deposiciones, pero no está disponible en la región.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 93,33%; de acuerdo con reservas menores: 6,67%.
La lubiprostona es un análogo de la prostaglandina E1 y activa los canales de calcio en el enterocito, produciendo secreción de líquidos hacia la luz intestinal. Aunque la experiencia es mayor en estreñimiento crónico idiopático, tres estudios demostraron su eficacia en SII-E. Los efectos secundarios son de origen GI, entre los cuales predominan las náuseas y la diarrea.106-108
Entre los agonistas de los receptores de serotonina 5-HT4, el tegaserod es el único con evidencia científica favorable en el SII-E, de uso restringido para pacientes menores de 65 años y sin antecedentes cardiovasculares. Actualmente, no se encuentra disponible en la región.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 86,67%; de acuerdo con reservas menores: 13,33%.
La serotonina (5-HT) tiene un papel importante en la secreción, la sensibilidad y la motilidad GI. A su vez, existen diferentes tipos de receptores 5-HT en el intestino. El subtipo 5-HT4, al ser estimulado, favorece la secreción intestinal, aumenta el reflejo peristáltico y aumenta el tránsito colónico. El tegaserod es un agonista parcial de los receptores 5-HT4, el cual logró demostrar una mejoría global de los síntomas en pacientes con SII-E.109-110 Sin embargo, debido a eventos adversos cardiovasculares, su uso fue restringido. Estudios posteriores han mostrado que en realidad tenía un bajo índice de eventos cardiovasculares (0,11 %), aún en pacientes con dos o más factores de riesgo cardiovascular.41
Otros agonistas selectivos de los 5-HT4 han demostrado eficacia en pacientes con EF. Uno de ellos es la prucaloprida, altamente selectiva, que estimula la motilidad intestinal,111-112 pero aún no hay estudios en pacientes con SII-E.
En pacientes con SII-E con estreñimiento refractario, se debe descartar disinergia de piso pélvico. En estos casos, el manejo es con terapia de biorretroalimentación.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 85,71%; de acuerdo con reservas menores: 14,29%.
La disfunción del piso pélvico es un diagnóstico diferencial importante en el SII-E. Dado que esta condición requiere terapia de biorretroalimentación, se recomienda considerar el diagnóstico en pacientes refractarios al manejo inicial.
Es de particular importancia la realización de un tacto rectal asociado a una maniobra de Valsalva para observar un adecuado descenso del piso pélvico y sentir la relajación del esfínter durante el esfuerzo defecatorio. En caso de tacto rectal anormal o estreñimiento refractario, recomendamos la realización de estudios de función ano-rectal (manometría ano-rectal, prueba de expulsión con balón o defecografía).41
4. Tratamiento de SII-Diarrea
La loperamida es una opción disponible y eficaz para tratar la diarrea en pacientes con SII; sin embargo, no ofrece mejoría en los síntomas como dolor y distensión abdominal.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 92,86%; de acuerdo con reservas menores: 7,14%.
La loperamida es un opioide sintético derivado de la piperidina que ralentiza la actividad intestinal sin afectar significativamente el sistema nervioso central. Es un tratamiento de venta libre aprobado para la diarrea aguda, crónica y del viajero, y se utiliza comúnmente en pacientes con SII-D para aliviar los síntomas. Una dosis de 2 a 4 mg hasta cuatro veces al día reduce la actividad intestinal (máximo 16 mg/día), mejora la absorción de líquidos y fortalece el tono del esfínter anal en reposo, lo que alivia la diarrea y la urgencia defecatoria.113
En 2018, el Colegio Americano de Gastroenterología revisó dos ensayos clínicos de 1987 que involucraron a 42 pacientes para evaluar la respuesta de la loperamida en SII-D. Los resultados no mostraron una diferencia estadísticamente significativa entre la loperamida y el placebo en términos de distensión y dolor abdominal, pero sí mejoró la frecuencia y consistencia de las deposiciones. La loperamida está recomendada para controlar la diarrea y no es útil para mejorar otras manifestaciones clínicas del SII-D.95
La rifaximina es una opción de tratamiento para pacientes con SII-D. En caso de una recaída, se puede considerar su uso como una alternativa de retratamiento en aquellos pacientes que hayan respondido positivamente a este medicamento.
• Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 93,33%; completamente en desacuerdo: 6,67%.
La rifaximina tiene una absorción menor al 1%, lo que la hace ideal en el manejo de enfermedades del aparato digestivo, con pocos efectos secundarios y alto perfil de seguridad.114-115 Cabe resaltar que estas propiedades las posee únicamente la rifaximina polimorfo alfa y no las rifaximinas genéricas, como la polimorfo kappa.116 Además, también tiene propiedades de eubiosis,117 lo que en teoría la hace un antibiótico ideal para tratar la disbiosis asociada a la fisiopatología del SII-D, incluidos aquellos que presentan SBIDO.118
En 2011, los estudios multicéntricos, doble ciego, aleatorizados y controlados con placebo TARGET 1 y TARGET 2 mostraron que la rifaximina mejoró la consistencia de las heces y redujo el dolor abdominal significativamente más que el placebo. La combinación de datos de ambos estudios mostró que la rifaximina mejoró la diarrea en un 46,6% del grupo de tratamiento en comparación con el 37,4% del grupo de placebo, con un NNT de 11. La mejoría se mantuvo significativamente mayor en el grupo de tratamiento durante todo el periodo de estudio.119
El ensayo clínico multicéntrico doble ciego, aleatorizado y controlado con placebo TARGET 3 evaluó ciclos de tratamiento repetidos y a largo plazo con rifaximina en pacientes con SII-D. Los pacientes que recibieron retratamiento con rifaximina mostraron una mejoría en los síntomas del SII-D en comparación con el grupo de placebo (38,1% vs. 31,5%), pero no alcanzó significancia estadística (p = 0,3). Solo se observó una diferencia estadísticamente significativa en los pacientes que respondieron al dolor abdominal. Las tasas de efectos adversos fueron bajas y similares entre los grupos.120
Con respecto al perfil de seguridad de rifaximina, es muy favorable con un número necesario para dañar de 8971. La seguridad además fue probada con respecto al desarrollo de resistencia bacteriana. Aun después de tres tratamientos con rifaximina, no se encontró una resistencia estable en el microbioma. Más aún, no hubo una disrupción significativa en el microbioma, y el desarrollo de colitis por C. difficile fue raro.41
El uso de colestiramina podría considerarse, a criterio del clínico, si se sospecha malabsorción de sales biliares. Se necesitan estudios aleatorios controlados para poder recomendar esta terapia en pacientes con SII-D.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 73,33%; de acuerdo con reservas menores: 20%; de acuerdo con reservas mayores: 6,67%.
Se ha reportado que hasta un tercio de los pacientes con SII-D tiene malabsorción idiopática de sales biliares,121 por lo que es factible que el tratamiento con colestiramina (el único disponible en nuestra región) u otros secuestradores de sales biliares (colesevelam y colestipol) mejoren la diarrea de estos pacientes.122
Sin embargo, la evidencia hasta el momento ha sido indirecta y con estudios de baja calidad. Un estudio abierto de doce pacientes mostró que el colesevelam aumenta el secuestro intraluminal de ácidos biliares y mejora la consistencia de las heces, con lo cual se evita la esteatorrea en pacientes con SII-D.123 Un estudio abierto de pacientes con SII, mostró que recibir colestipol durante ocho semanas mejoró en más de un 50% la escala de síntomas, en quince de veintisiete pacientes tratados.124 En pacientes con diarrea crónica e historia de colecistectomía, se ha reportado una respuesta del 79% con colestiramina.125
En nuestra región, de los antagonistas de receptores 5-HT3 se podría utilizar ondansetrón (4 a 12 mg al día) en pacientes con SII-D que no han respondido a otras terapias.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 46,67%; de acuerdo con reservas menores: 46,67%; de acuerdo con reservas mayores: 6,67%.
Estos medicamentos bloquean los receptores de serotonina tipo 3, lo que mejora la diarrea al inhibir la actividad intestinal. Un metaanálisis reciente comparó 21 ensayos clínicos de estos medicamentos y encontró que tienen un riesgo relativo combinado de mejoría del 54% en los síntomas globales del síndrome del intestino irritable en comparación con placebo o mebeverina. No se encontraron diferencias entre los medicamentos alosetrón, ramosetrón y cilansetrón, aunque ninguno de ellos está disponible en la región.126
Un ensayo clínico controlado de 705 mujeres con SII-D severo estudió la eficacia de tres dosis de alosetrón (0,5 o 1 mg al día y 1mg dos veces al día) versus placebo. Se observó que, de manera significativa, más pacientes que recibieron cualquier dosis de alosetrón reportaron una normalización de los patrones intestinales en comparación con placebo. El efecto adverso más común fue el estreñimiento.127 Debido a efectos secundarios severos (como colitis isquémica), el medicamento se retiró del mercado en el año 2000, pero se reintrodujo en 2002, bajo un programa de monitorización, para mujeres con SII-D severo que no responden a tratamiento convencional.
El ondansetrón es una buena opción para tratar la diarrea en pacientes con SII-D. Un estudio clínico de 120 pacientes demostró que el ondansetrón (4 a 12 mg) mejoró significativamente la consistencia de las heces y redujo la urgencia, la gravedad de la urgencia, la frecuencia de defecación y la distensión abdominal, pero no mejoró el dolor. El ondansetrón se utiliza comúnmente para tratar la emesis inducida por quimioterapia y no tiene efectos adversos como colitis isquémica.128 Hay que considerar que su principal efecto secundario es el estreñimiento. Este medicamento es el único disponible en Centroamérica.
La eluxadolina podría ser utilizada en pacientes con SII-D; sin embargo, no se encuentra disponible en nuestra región.
• Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 86,67%; de acuerdo con reservas menores: 6,67%; de acuerdo con reservas mayores: 6,67%.
La eluxadolina es un nuevo agonista mixto de los receptores de opioides micro y kappa, así como antagonista del receptor delta de acción local.129 En el intestino, estos receptores regulan múltiples procesos fundamentales en relación con la motilidad, la secreción, la digestión y la sensación visceral.130
En un ensayo clínico aleatorizado que incluyó a 2.427 pacientes con SII-D, se evaluó el efecto de la eluxadolina en comparación con placebo. El criterio principal de desenlace fue la proporción de pacientes que tuvieron una respuesta compuesta de disminución del dolor abdominal y mejoría en la consistencia de las heces en al menos el 50% de los días desde la semana uno hasta la doce y desde la semana uno hasta la veintiséis. La dosis de 100 mg 2 veces al día fue la que mostró eficacia sostenida durante 6 meses.131
Los eventos adversos más comunes asociados con eluxadolina fueron náuseas, estreñimiento y dolor abdominal.131
Las contraindicaciones para el uso de eluxadolina en pacientes con SII-D incluyen ausencia de vesícula biliar, obstrucción del conducto biliar o disfunción del esfínter de Oddi, alcoholismo, antecedentes de pancreatitis o enfermedades estructurales del páncreas, reacción o hipersensibilidad conocida a la eluxadolina, así como insuficiencia hepática grave o estreñimiento severo.132
Figura 4. Algoritmo de manejo en SII
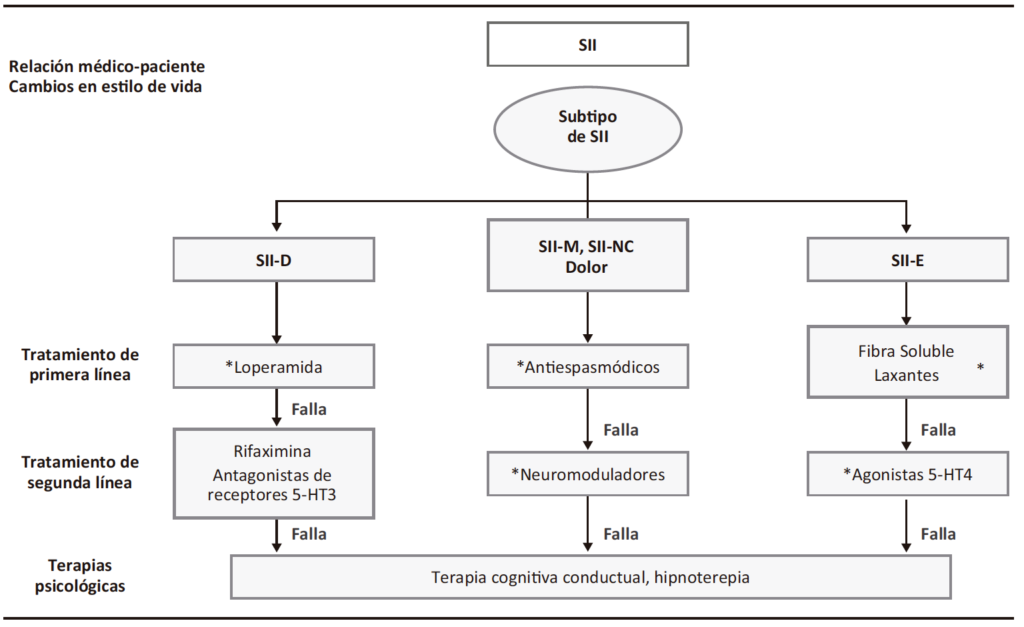
* Revisar eficacia a los 3 meses y descontinuar ante falta de respuesta y pasar a siguiente línea de tratamiento.
Fuente: elaborado por el grupo de trabajo con información obtenida de los artículos: Fakudo S, et al. J Gastroenterol 2021;56:193-217. https://doi.org/10.1007/s00535-020-01746-z y Vasant DH, et al. Gut. 2021;70:1214-1240. DOI:10.1136/gutjnl-2021-324598
6. Otras terapias
La acupuntura se podría utilizar como alternativa de rescate cuando las demás terapias han fallado.
• Nivel de la evidencia y fuerza de la recomendación GRADE: D2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 57,14%; de acuerdo con reservas menores: 28,57%; de acuerdo con reservas mayores: 14,29%.
La acupuntura ha sido estudiada para tratamiento de SII; sin embargo, los estudios existentes son de baja calidad y la imposibilidad de hacer estudios doble ciego hace difícil su análisis. Se recomienda a pacientes que no respondieron satisfactoriamente a los tratamientos convencionales de primera o segunda línea. Es un campo que requiere más investigación.133
La medicina homeopática y las preparaciones herbáceas no pueden ser recomendadas como terapia para pacientes con SII; se necesitan estudios bien diseñados para valorar efectividad y seguridad.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 86,67%; de acuerdo con reservas menores: 13,33%.
Se necesitan estudios de buena calidad para verificar la eficacia y la seguridad de algún tratamiento homeopático clínico individualizado para SII, comparado con placebo o el tratamiento ya conocido.134
Algunas preparaciones herbáceas tienen efectos secundarios y, probablemente, interacciones con medicamentos convencionales. Sin embargo, es posible que existan preparaciones herbáceas (como aloe vera, té de menta, manzanilla, melisa, salvia, semillas de hinojo, anís o alguna combinación de estas) que pudieran tener efectos terapéuticos en pacientes con SII, pero se necesitan más estudios clínicos con adecuada metodología.135
Actualmente el STW-5 es el único producto aprobado para dispepsia y SII,136 pero no está disponible en la región.
El uso de aceite de menta con cubierta entérica es seguro y efectivo para aliviar dolor abdominal y síntomas globales en pacientes con SII. Por tanto, si se encuentra disponible, puede ser utilizado como terapia para dolor abdominal.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 80%; de acuerdo con reservas menores: 13,33%; completamente en desacuerdo: 6,67%.
La Mentha piperita es un producto natural utilizado en el tratamiento del SII debido a su capacidad para relajar el músculo liso, modular la sensibilidad visceral, tener efectos antimicrobianos, antiinflamatorios y moduladores psicosociales.137
En un metaanálisis que evaluó la eficacia del aceite de menta versus placebo en la mejoría global de los síntomas y el dolor abdominal en pacientes con SII, se incluyeron doce ECA realizados en Asia, Europa y Norteamérica. Los resultados mostraron una mejoría significativa en los síntomas globales y el dolor abdominal con el uso de aceite de menta en comparación con el placebo, sin diferencias significativas en los efectos adversos informados, con un NNT de 4 y 3 respectivamente.138 Sin embargo, es importante tener en cuenta que puede provocar efectos adversos como náuseas, vómitos y pirosis, lo que limita su uso en pacientes con reflujo gastroesofágico.
La hipnoterapia realizada por personal calificado puede ser eficaz en el tratamiento de pacientes con SII, sobre todo en aquellos pacientes en quienes las primeras intervenciones no han proporcionado una mejoría deseada.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 53,33%; de acuerdo con reservas menores: 40%; de acuerdo con reservas mayores: 6,67%.
Una revisión sistemática concluyó que la hipnosis produce cambios significativos consistentes y mejora los síntomas principales de SII en la mayoría de los pacientes.Además, influye positivamente en los síntomas no colónicos. El uso de la hipnosis en SII tiene un nivel alto de aceptación debido a que es eficaz y específica.139
En un estudio de 1000 pacientes con SII, Miller y colaboradores encontraron que el 76% alcanzó el objetivo primario de reducción de severidad de síntomas, especialmente las mujeres y los pacientes con ansiedad. El 67% informó una reducción del 30% o más en las escalas de dolor abdominal y menos días con dolor abdominal en el mes. La hipnoterapia enfocada en el intestino resultó efectiva en pacientes con SII refractario, incluyendo a aquellos con trastornos de ansiedad y depresión, y los resultados fueron consistentes independientemente del subtipo de hábito intestinal.140 Asimismo, una revisión sistemática más reciente que incluyó cinco estudios aleatorizados también demostró la efectividad de la hipnoterapia en la mejoría de los síntomas del SII en comparación con los controles.141
La terapia cognitiva conductual y la psicoterapia se proponen como alternativas para SII refractario, aunque los estudios que han demostrado su eficacia tienen sesgo significativo, ya que no pueden ser a doble ciego.
• Nivel de la evidencia y fuerza de la recomendación GRADE: C2 débil a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 53,33%; de acuerdo con reservas menores: 46,67%.
Un metaanálisis evaluó la eficacia de terapias psicológicas en pacientes con SII, incluyendo 41 estudios aleatorizados controlados con más de 4000 pacientes. Las terapias psicológicas se compararon entre sí o contra una intervención control. El objetivo primario fue el riesgo relativo de persistir con síntomas globales de SII o dolor abdominal después de haber completado la terapia durante al menos cuatro semanas.142
La terapia cognitiva conductual de contacto mínimo, la terapia cognitiva conductual directa y la hipnoterapia enfocada en intestino son eficaces con mejorías comparables de hasta un 39%. No hay una terapia psicológica significativamente mejor que otra, pero la heterogeneidad de los estudios limita el análisis. En trece ECA de pacientes con SII refractario, la terapia cognitiva conductual grupal y la hipnoterapia son las intervenciones más efectivas.142 Lo importante, es tener psicoterapeutas entrenados, lo cual es muy poco frecuente en general.
La meditación es una práctica mental que tiene como objetivo aumentar la conciencia y el enfoque en el momento presente, reducir el estrés y mejora el bienestar emocional. Dos metaanálisis y otros estudios han demostrado mejoras en la calidad de vida de los pacientes, incluyendo una mejoría global de síntomas en el tratamientodel SII, pero incluyen pocos pacientes y los resultados no han mostrado significancia estadística, por lo que el grupo de expertos considera que se podría utilizar como coadyuvante a la terapia convencional, sobre todo en personas que tienen asociados trastornos de ansiedad o estrés, siempre y cuando se realice con un profesional especializado.143-145
Aunque es práctica habitual en la región, hay muy poca evidencia que justifique el uso rutinario de enzimas digestivas o simeticona sola en el manejo de SII.
• Nivel de la evidencia y fuerza de la recomendación GRADE: D1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 73,33%; de acuerdo con reservas menores: 26,67%.
Según expertos, el uso de enzimas digestivas para tratar la distensión en el SII no es beneficioso, salvo en casos de insuficiencia pancreática exocrina demostrada. Existen diferentes clases de enzimas, que se agrupan según el proceso químico que utilizan, siendo todas las enzimas digestivas hidrolasas porque descomponen los alimentos con moléculas de agua.
En un pequeño estudio de 2011, se observó que una mezcla de enzimas digestivas que incluye inositol, proteasa, amilasa, amiloglucosidasa, lipasa, celulasa, lactasa y pectinasa, junto con extracto de levadura (Saccharomyces cerevisiae), mejoró significativamente la distensión, la flatulencia y el dolor abdominal en las semanas 3 y 4.146 Sin embargo, no hay estudios de buena calidad científica que avalen estos medicamentos.
7. Probióticos
La evidencia actual muestra que combinaciones, especies o cepas específicas de probióticos son efectivas para los síntomas generales del SII y la calidad de vida. Sin embargo, es difícil derivar una conclusión definitiva debido a la alta heterogeneidad y el riesgo incierto de sesgo de algunos ensayos. Se justifican grandes ensayos bien diseñados y rigurosos.
• Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado.
• Nivel de acuerdo: completamente de acuerdo: 80%; de acuerdo con reservas menores: 20%.
La microbiota intestinal es importante para la homeostasis intestinal y tiene un papel crítico en la modulación de las funciones GI y en el eje intestino-cerebro.147-149 La disbiosis es un mecanismo fisiopatológico subyacente del SII y los probióticos son una opción terapéutica para la modulación del microbioma intestinal.
Los probióticos son microorganismos vivos que brindan beneficios para la salud humana y se consideran una opción terapéutica para tratar diversos síntomas, incluyendo aquellos relacionados con el SII.150 Los probióticos que se han estudiado incluyen muchas cepas de bacilos del ácido láctico, una cepa de Escherichia coli, Clostridium butyricum, Streptococcus salivarius y Saccharomyces boulardii. También se están desarrollando cepas de bacterias modificadas genéticamente para secretar inmunomoduladores y otras que influyan en las citosinas secretadas por las células epiteliales intestinales.151-153
Un metaanálisis de 28 estudios con 3.606 participantes mostró que los probióticos tienen efectos beneficiosos en los síntomas generales del SII y en el dolor abdominal. Los probióticos que contienen multicepas y especies de Bifidobacterium tuvieron el efecto más sólido en la mejoría de los síntomas globales del SII, y los que contienen lactobacilos redujeron significativamente la distensión abdominal y la flatulencia y mejoraron la calidad de vida de los pacientes.154
Hay estudios y metaanálisis que demuestran mejoría en el dolor, la distensión y la calidad de vida de pacientes con SII con el uso de las cepas Lactobacillus plantarum,155 Bifidobacterium infantis 35624,153,156 B. bifidum MIMBb75,157 L. acidophilus DDS-1, B. lactis UABla-12.158
Algunas cepas de Lactobacillus, como L. casei GG, L. plantarum DSM 9843 y L. salivarius UCC4331, no mostraron efectos beneficiosos.159 Esto ilustra un punto clave en los ensayos con probióticos: los hallazgos de una cepa no pueden extrapolarse fácilmente a otra.
Un metaanálisis reciente sugiere que algunos probióticos específicos pueden producir alivio de la distensión subjetiva en algunos pacientes con SII.160-161 Algunos estudios han mostrado que el VSL # 3162 y una combinación de Lactobacillus acidophilus y Bifidobacterium lactis pueden reducir la distensión y la flatulencia en pacientes con SII.163
Otro metaanálisis164 mostró que los probióticos y simbióticos tienen efectos beneficiosos en el EF, mientras que la cepa Saccharomyces cerevisiae CNCM I-3856 ha demostrado mejoras en el dolor abdominal y la distensión en pacientes con SII, pero no en el estreñimiento.165-167
La administración de Lactobacillus plantarum 299v (DSM 9843) durante cuatro semanas ha demostrado mejorar las frecuencias defecatorias y el tenesmo en tres estudios controlados aleatorizados con 314 sujetos.155, 164
Clostridium butyricum administrado tres veces al día durante cuatro semanas mostró una mejora en el hábito intestinal y la calidad de vida en comparación con el grupo placebo.168
Saccharomyces boulardii fue efectivo para diarrea, dolor abdominal y flatulencia.169 La formulación probiótica i3.1 fue superior al placebo en la mejora de la calidad de vida relacionada con el SII en pacientes con diarrea después de seis semanas de tratamiento.170-171
En otro estudio, la combinación de Lactobacilos acidophilus NCFM (L-NCFM) y Bifidobacterium lactis Bi-07 (B-LBi07) demostró una mejoría en los síntomas de distensión, pero no en la consistencia y la frecuencia de las heces en pacientes con SII con distensión y diarrea.163
En Centroamérica existen múltiples probióticos con estudios clínicos que sugieren eficacia en SII-D, SII-E y SII con distensión abdominal, pero la elección debe basarse en la información presentada en este consenso.
Propiedad intelectual. Los autores declaran que los datos, las tablas y las figuras presentes en el manuscrito son veraces. Asimismo, solicitaron autorización y dieron reconocimiento al autor original de las Figuras 2, 3 y 4 y la Tabla 1.
Financiamiento. Este proyecto fue posible gracias al patrocinio educativo sin restricciones de la empresa Abbott. De igual manera, se contó con el apoyo técnico científico de la empresa EDU-Pharma, oficina independiente de educación continua, basada en Costa Rica, para la documentación, redacción, edición y gerencia del proyecto. Se dio forma al presente documento con base en los acuerdos tomados en las reuniones virtuales sincrónicas de los grupos de trabajo. Ningún miembro de la empresa patrocinadora ni de EDU-Pharma tuvieron influencia en las recomendaciones presentadas en este consenso.
Conflicto de interés. Los Dres. Edder Sandoval, Gianna Blanco, Edwin Vicente, Eliam Rivas, Sandra Chaves, declaran no tener ningún conflicto de interés.
Los siguientes doctores declaran haber recibido honorarios por participar en Advisory Boards (AdB), como investigadores (I) o conferencistas (C) para: Dr. Marco Antonio Sánchez Hernández: Astrazeneca (AdB, C), Asofarma (C) y Ferrer (C). Dr. Jorge Suazo Barahona: Procaps (C) y Eurofarma (C). Dr. Luis Aguilar Paiz: Ferrer (AdB, C). Astrazeneca (C), Procaps (C), Lancasco (C). Dr. León De Mezerville Cantillo: Sanofi (AdB, C), Abbvie (AdB), MSD (AdB), Roemmers (C), Abbott (C), Astrazeneca (C), Gutis (C), Abbiotics (C). Dr Pablo Navarro Castillo: Astrazeneca (C), Stein (C), Europharma (C), Chemo (C), Dos Pinos (C), Aspen (C), Abbott (C), Megalabs (C), Roche(C). Procaps (C). Dr. Jorge Antonio Galdámez Estrada: Ferrer (C), Procaps (C), Janssen (C).
Aviso de derechos de autor
© 2023 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Galdamez Estrada J A, Aguilar Paiz L, Minerva Blanco G y col. Primer consenso centroamericano y del Caribe del síndrome de intestino irritable. Acta Gastroenterol Latinoam. 2023;53(2):137-163. https://doi.org/10.52787/agl.v53i2.272
Referencias
- Berry SK, Brenner DM, Cash BD, Chang L, Chey WD, Deutsch JK, et al. Irritable Bowel Syndrome. An Issue of Gastroenterology Clinics of North America. En: Chey WD, Buchman A, editors. Gastroenterology Clinics of North America [Internet]. Elsevier;2021. Pp. 487-713. Disponible en: www.us.elsevierhealth.com/irritable-bowel-syndrome-an-issue-of-gastroenterology-clinics-of-north-america-9780323809283.html
- Sperber AD, Bangdiwala SI, Drossman DA, Ghoshal UC, Simren M, Tack J, et al. Worldwide Prevalence and Burden of Functional Gastrointestinal Disorders. Results of Rome Foundation Global Study. Gastroenterology [Internet]. 2021;160(1):99-114. Disponible en: https://www.sciencedirect.com/science/article/pii/S001650852030487X
- Oka P, Parr H, Barberio B, Black CJ, Savarino E V., Ford AC. Global prevalence of irritable bowel syndrome according to Rome III or IV criteria: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol [Internet]. 2020;5(10):908-17. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S246812532030217X
- Weaver KR, Melkus GDE, Henderson WA. Irritable bowel syndrome: A review. Am J Nurs [Internet]. 2017;117(6):48-55. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5453305/
- Spiller RC. Hidden Dangers of Antibiotic Use: Increased Gut Permeability Mediated by Increased Pancreatic Proteases Reaching the Colon. Cell Mol Gastroenterol Hepatol [Internet]. 2018;6(3):347-348.e1. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30182044/
- Cryan JF, O’Riordan KJ, Cowan CSM, Sandhu K V., Bastiaanssen TFS, Boehme M, et al. The microbiota-gut-brain axis. Physiol Rev [Internet]. 2019;99(4):1877-2013. Disponible en: www.prv.org
- Pittayanon R, Lau JT, Yuan Y, Leontiadis GI, Tse F, Surette M, et al. Gut Microbiota in Patients With Irritable Bowel Syndrome-A Systematic Review. Gastroenterology [Internet]. 2019;157(1):97-108. Disponible en: https://doi.org/10.1053/j.gastro.2019.03.049
- Drossman DA, Hasler WL. Rome IV – Functional GI disorders: Disorders of gut-brain interaction. Gastroenterology [Internet]. 2016;150(6):1257-61. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27147121/
- Fink A, Kosecoff J, Chassin M, Brook RH. Consensus methods: Characteristics and guidelines for use. Am J Public Health [Internet]. 1984;74(9):979-83. Disponible en: https://pubmed.ncbi.nlm.nih.gov/6380323/
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: An emerging consensus on rating quality of evidence and strength of recommendations. BMJ [Internet]. 2008;336(7650):924-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/18436948/
- Aguilar-Paiz L, Quintero-Samudio I, Santana-Vargas D, Suazo-Barahona J, Alfaro-Murillo O, Galdámez J, et al. Tu1340: DISORDERS OF GUT-BRAIN INTERACTION (DGBI) IN CENTRAL AMERICA (CA): A ROME IV INTERNET-BASED EPIDEMIOLOGICAL STUDY. AGA ABSTRACTS. Gastroenterology [Internet]. 2022;162(7):S-923. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0016508522621930
- Sebastián Domingo JJ. Los nuevos criterios Roma (IV) de los trastornos funcionales digestivos en la práctica clínica. Med Clin (Barc) [Internet]. 2017;148(10):464-8. Disponible en: http://dx.doi.org/10.1016/j.medcli.2016.12.020
- Spiller R, Garsed K. Postinfectious Irritable Bowel Syndrome. Gastroenterology. 2009;136(6):1979-88.
- Thabane M, Kottachchi DT, Marshall JK. Systematic review and meta-analysis: The incidence and prognosis of post-infectious irritable bowel syndrome. Aliment Pharmacol Ther. 2007;26(4):535-44.
- Porter CK, Gormley R, Tribble DR, Cash BD, Riddle MS. The incidence and gastrointestinal infectious risk of functional gastrointestinal disorders in a healthy US adult population. Am J Gastroenterol [Internet]. 2011;106(1):130-8. Disponible en: https://journals.lww.com/ajg/Abstract/2011/01000/The_Incidence_and_Gastrointestinal_Infectious_Risk.21.aspx
- Lacy BE, Mearin F, Chang L, Chey WD, Lembo AJ, Simren M, et al. Bowel disorders. Gastroenterology [Internet]. 2016;150(6):1393-1407.e5. Disponible en: http://www.gastrojournal.org/article/S0016508516002225/fulltext
- Chitkara DK, Van Tilburg MAL, Blois-Martin N, Whitehead WE. Early life risk factors that contribute to irritable bowel syndrome in adults: A systematic review [Internet]. Am J Gastroenterol. 2008;103:765-74. Disponible en: https://pubmed.ncbi.nlm.nih.gov/18177446/
- Sanger GJ, Chang L, Bountra C, Houghton LA. Challenges and prospects for pharmacotherapy in functional gastrointestinal disorders. Therap Adv Gastroenterol [Internet]. 2010;3(5):291-305. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21180610/
- Camilleri M, McKinzie S, Busciglio I, Low PA, Sweetser S, Burton D, et al. Prospective Study of Motor, Sensory, Psychologic, and Autonomic Functions in Patients With Irritable Bowel Syndrome. Clin Gastroenterol Hepatol [Internet]. 2008;6(7):772-81. Disponible en: https://pubmed.ncbi.nlm.nih.gov/18456567/
- Simrén M, Törnblom H, Palsson OS, Van Oudenhove L, Whitehead WE, Tack J. Cumulative Effects of Psychologic Distress, Visceral Hypersensitivity, and Abnormal Transit on Patient-reported Outcomes in Irritable Bowel Syndrome. Gastroenterology [Internet]. 2019;157(2):391-402.e2. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31022401/
- Törnblom H, Van Oudenhove L, Sadik R, Abrahamsson H, Tack J, Simrén M. Colonic transit time and IBS symptoms: What’s the link? Am J Gastroenterol [Internet]. 2012;107(5):754-60. Disponible en: https://journals.lww.com/ajg/Fulltext/2012/05000/Colonic_Transit_Time_and_IBS_Symptoms_What_s_the.19.aspx
- Agrawal A, Houghton LA, Reilly B, Morris J, Whorwell PJ. Bloating and distension in irritable bowel syndrome: The role of gastrointestinal transit. Am J Gastroenterol [Internet]. 2009;104(8):1998-2004. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19491831/
- Houghton LA, Atkinson W, Lockhart S, Fell C, Whorwell PJ, Keevil B. Sigmoid-colonic motility in health and irritable bowel syndrome: A role for 5-hydroxytryptamine. Neurogastroenterol Motil [Internet]. 2007;19(9):724-31. Disponible en: https://pubmed.ncbi.nlm.nih.gov/17539895/
- Atkinson W, Lockhart S, Whorwell PJ, Keevil B, Houghton LA. Altered 5-hydroxytryptamine signaling in patients with constipation- and diarrhea-predominant irritable bowel syndrome. Gastroenterology [Internet]. 2006;130(1):34-43. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16401466/
- Spiller RC, Jenkins D, Thornley JP, Hebden JM, Wright T, Skinner M, et al. Increased rectal mucosal enteroendocrine cells, T lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut [Internet]. 2000;47(6):804-11. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11076879/
- Dunlop SP, Hebden J, Campbell E, Naesdal J, Olbe L, Perkins AC, et al. Abnormal intestinal permeability in subgroups of diarrhea-predominant irritable bowel syndromes. Am J Gastroenterol [Internet]. 2006;101(6):1288-94. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16771951/
- Zhou QQ, Zhang B, Nicholas Verne G. Intestinal membrane permeability and hypersensitivity in the irritable bowel syndrome. Pain [Internet]. 2009;146(1-2):41-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19595511/
- Piche T. Tight junctions and IBS – the link between epithelial permeability, low-grade inflammation, and symptom generation? [Internet]. Neurogastroenterol Motil. 2014;26:296-302. Dispo-
nible en: https://pubmed.ncbi.nlm.nih.gov/24548256/ - Piche T, Barbara G, Aubert P, Des Varannes SB, Dainese R, Nano JL, et al. Impaired Intestinal barrier integrity in the colon of patients with irritable bowel syndrome: Involvement of soluble mediators. Gut [Internet]. 2009];58(2):196-201. Disponible en: https://pubmed.ncbi.nlm.nih.gov/18824556/
- Peters SA, Edogawa S, Sundt WJ, Dyer RB, Dalenberg DA, Mazzone A, et al. Constipation-Predominant Irritable Bowel Syndrome Females Have Normal Colonic Barrier and Secretory Function. Am J Gastroenterol [Internet]. 2017;112(6):913-23. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28323272/
- Bhattarai Y, Muniz Pedrogo DA, Kashyap PC. Irritable bowel syndrome: A gut microbiota-related disorder? Am J Physiol – Gastrointest Liver Physiol [Internet]. 2016;312(1):G52-62. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27881403/
- Grover M, Kanazawa M, Palsson OS, Chitkara DK, Gangarosa LM, Drossman DA, et al. Small intestinal bacterial overgrowth in irritable bowel syndrome: Association with colon motility, bowel symptoms, and psychological distress. Neurogastroenterol Motil [Internet]. 2008;20(9):998-1008. Disponible en: https://pubmed.ncbi.nlm.nih.gov/18482250/
- Barba E, Burri E, Accarino A, Cisternas D, Quiroga S, Monclus E, et al. Abdominothoracic mechanisms of functional abdominal distension and correction by biofeedback. Gastroenterology [Internet]. 2015;148(4):732-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25500424/
- David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature [Internet]. 2014;505(7484):559-63. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24336217/
- Koloski NA, Jones M, Weltman M, Kalantar J, Bone C, Gowryshankar A, et al. Identification of early environmental risk factors for irritable bowel syndrome and dyspepsia. Neurogastroenterol Motil [Internet]. 2015;27(9):1317-25. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26202154/
- Ek WE, Reznichenko A, Ripke S, Niesler B, Zucchelli M, Rivera N V, et al. Exploring the genetics of irritable bowel syndrome: A GWA study in the general population and replication in multinational case-control cohorts. Gut [Internet]. 2015;64(11):1774-82. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25248455/
- Levy RL, Jones KR, Whitehead WE, Feld SI, Talley NJ, Corey LA. Irritable bowel syndrome in twins: Heredity and social learning both contribute to etiology. Gastroenterology [Internet]. 2001;121(4):799-804. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11606493/
- Lacy BE, Chey WD, Lembo AJ. New and Emerging Treatment Options for Irritable Bowel Syndrome. Gastroenterol Hepatol (N Y) [Internet]. 2015;11(4 Suppl 2):1-19. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4612133/
- Goldstein RS, Cash BD. Making a Confident Diagnosis of Irritable Bowel Syndrome. Gastroenterol Clin North Am [Internet]. 2021;50(3):547-63. Disponible en: http://www.gastro.theclinics.com/article/S0889855321002752/fulltext
- Menees SB, Powell C, Kurlander J, Goel A, Chey WD. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. Am J Gastroenterol [Internet]. 2015;110(3):444-54. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25732419/
- Lacy BE, Pimentel M, Brenner DM, Chey WD, Keefer LA, Long MD, et al. ACG Clinical Guideline: Management of Irritable Bowel Syndrome. Am J Gastroenterol [Internet]. 2021;116(1):17-44. Disponible en: https://journals.lww.com/ajg/Fulltext/2021/01000/ACG_Clinical_Guideline__Management_
of_Irritable.11.aspx - Carmona-Sánchez R. La detección y tratamiento del hipotiroidismo subclínico en pacientes con síndrome de intestino irritable. ¿Modifica el uso de recursos de salud? Rev Gastroenterol México [Internet]. 2007;72(3):222-6. Disponible en: http://www.revistagastroenterologiamexico.org//es-la-deteccion-tratamiento-del-hipotiroidismo-articulo-X0375090607232321
- Irvine AJ, Chey WD, Ford AC. Screening for Celiac Disease in Irritable Bowel Syndrome: An Updated Systematic Review and Meta-analysis. Am J Gastroenterol [Internet]. 2017;112(1):65-76. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27753436/
- Lewis NR, Scott BB. Meta-analysis: Deamidated gliadin peptide antibody and tissue transglutaminase antibody compared as screening tests for coeliac disease. Aliment Pharmacol Ther [Internet]. 2010;31(1):73-81. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19664074/
- Van Der Windt DAWM, Jellema P, Mulder CJ, Kneepkens CMF, Van Der Horst HE. Diagnostic testing for celiac disease among patients with abdominal symptoms: A systematic review [Internet]. JAMA. 2010;303:1738-46. Disponible en: https://pubmed.ncbi.nlm.nih.gov/20442390/
- Oberhuber G, Granditsch G, Vogelsang H. The histopathology of coeliac disease: Time for a standardized report scheme for pathologists [Internet]. Eur J Gastroenterol Hepatol. 1999:11:1185-94. Disponible en: https://pubmed.ncbi.nlm.nih.gov/10524652/
- Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA. ACG clinical guidelines: Diagnosis and management of celiac disease. Am J Gastroenterol [Internet]. 2013;108(5):656-76. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23609613/
- Slattery SA, Niaz O, Aziz Q, Ford AC, Farmer AD. Systematic review with meta-analysis: The prevalence of bile acid malabsorption in the irritable bowel syndrome with diarrhoea [Internet]. Aliment Pharmacol Ther. 2015;42:3-11. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25913530/
- Barkun A, Love J, Gould M, Pluta H, Hillary Steinhart A. Bile acid malabsorption in chronic diarrhea: Pathophysiology and treatment [Internet]. Can J Gastroenterol. 2013;27:653-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24199211/
- Carrasco-Labra A, Lytvyn L, Falck-Ytter Y, Surawicz CM, Chey WD. AGA Technical Review on the Evaluation of Functional Diarrhea and Diarrhea-Predominant Irritable Bowel Syndrome in Adults (IBS-D). Gastroenterology [Internet]. 2019;157(3):859-80. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31351880/
- Vijayvargiya P, Camilleri M, Shin A, Saenger A. Methods for diagnosis of bile acid malabsorption in clinical practice. Clin Gastroenterol Hepatol. 2013;11(10):1232-9.
- Pimentel M, Morales W, Rezaie A, Marsh E, Lembo A, Mirocha J, et al. Development and validation of a biomarker for diarrhea-predominant irritable bowel syndrome in human subjects. PLoS One [Internet]. 2015;10(5):1-12. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25970536/
- Schmulson M, Balbuena R, Corona de Law C. Experiencia clínica con el uso de los anticuerpos anti-CdtB y anti-vinculina en pacientes con diarrea en México. Rev Gastroenterol Mex [Internet]. 2016;81(4):236-9. Disponible en: http://dx.doi.org/10.1016/j.rgmx.2016.07.001
- Carmona-Sánchez R, Icaza-Chávez ME, Bielsa-Fernández M V, Gómez-Escudero O, Bosques-Padilla F, Coss-Adame E, et al. Consenso mexicano sobre el síndrome de intestino irritable. Revista de Gastroenterologia de Mexico. Elsevier Doyma. 2016;81:149-67.
- Rezaie A, Buresi M, Lembo A, Lin H, McCallum R, Rao S, et al. Hydrogen and Methane-Based Breath Testing in Gastrointestinal Disorders: The North American Consensus. Am J Gastroenterol [Internet]. 2017;112(5):775-84. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28323273/
- Rezaie A, Heimanson Z, McCallum R, Pimentel M. Lactulose breath testing as a predictor of response to rifaximin in patients with irritable bowel syndrome with diarrhea. Am J Gastroenterol [Internet]. 2019;114(12):1886-93. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31688023/
- Kavanagh RG, O’Grady J, Carey BW, O’Connor OJ, Maher MM. Review of the role of abdominal imaging in irritable bowel syndrome. World J Radiol [Internet]. 2018;10(11):143-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6288676/
- Ford AC, Sperber AD, Corsetti M, Camilleri M. Irritable bowel syndrome. Lancet [Internet]. 2020;396(10263):1675-88. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33049223/
- Camilleri M. Diagnosis and Treatment of Irritable Bowel Syndrome: A Review [Internet]. JAMA. 2021;325:865-77. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33651094/
- Alvarado J, Otero W, Jaramillo S. Guía de práctica clínica para el diagnóstico y tratamiento del síndrome de intestino irritable en población adulta. Rev Colomb Gastroenterol [Internet]. 2015;30(1):43-56. Disponible en: https://www.gastrocol.com/wp-content/uploads/2020/04/5-intestino-irritable_FINAL.pdf
- Vasant DH, Paine PA, Black CJ, Houghton LA, Everitt HA, Corsetti M, et al. British Society of Gastroenterology guidelines on the management of irritable bowel syndrome. Gut [Internet]. 2021;70(7):1-27. Disponible en: https://gut.bmj.com/content/70/7/1214
- Narula N, Ulic D, Al-Dabbagh R, Ibrahim A, Mansour M, Balion C, et al. Fecal occult blood testing as a diagnostic test in symptomatic patients is not useful: A retrospective chart review. Can J Gastroenterol Hepatol [Internet]. 2014;28(8):421-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25014182/
- Fu Y, Wang L, Xie C, Zou K, Tu L, Yan W, et al. Comparison of non-invasive biomarkers faecal BAFF, calprotectin and FOBT in discriminating IBS from IBD and evaluation of intestinal inflammation. Sci Rep [Internet]. 2017;7(1):2669. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5453945/
- Casellas F, Burgos R, Marcos A, Santos J, Ciriza-De-Los-Ríos C, García-Manzanares Á, et al. Consensus document on exclusion diets in irritable bowel syndrome (IBS). Rev Esp Enfermedades Dig [Internet]. 2018;110(12):806-22. Disponible en: https://scielo.isciii.es/scielo.phpscript=sci_arttext&pid=S113001082018001200009&lng=es&nrm=iso&tlng=es
- Van Lanen AS, de Bree A, Greyling A. Efficacy of a low-FODMAP diet in adult irritable bowel syndrome: a systematic review and meta-analysis. Eur J Nutr [Internet]. 2021;60(6):3505-22. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33585949/
- Paduano D, Cingolani A, Tanda E, Usai P. Effect of three diets (low-FODMAP, gluten-free and balanced) on irritable bowel syndrome symptoms and health-related quality of life. Nutrients [Internet]. 2019;11(7):1566. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31336747/
- Marsh A, Eslick EM, Eslick GD. Does a diet low in FODMAPs reduce symptoms associated with functional gastrointestinal disorders? A comprehensive systematic review and meta-analysis. Eur J Nutr [Internet]. 2016;55(3):897-906. Disponible en: https://link.springer.com/article/10.1007/s00394-015-0922-1
- Dionne J, Ford AC, Yuan Y, Chey WD, Lacy BE, Saito YA, et al. A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome [Internet]. Am J Gastroenterol. 2018;113:1290-300. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30046155/
- Biesiekierski JR, Peters SL, Newnham ED, Rosella O, Muir JG, Gibson PR. No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology [Internet]. 2013;145(2):320-8.e1. Disponible en: https://europepmc.org/article/med/23648697
- Johannesson E, Simrén M, Strid H, Bajor A, Sadik R. Physical activity improves symptoms in irritable bowel syndrome: A randomized controlled trial. Am J Gastroenterol [Internet]. 2011;106(5):915-22. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21206488/
- Johannesson E, Ringstrom G, Abrahamsson H, Sadik R. Intervention to increase physical activity in irritable bowel syndrome shows long-term positive effects. World J Gastroenterol [Internet]. 2015;21(2):600-8. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25593485/
- Hamaguchi T, Tayama J, Suzuki M, Nakaya N, Takizawa H, Koizumi K, et al. The effects of locomotor activity on gastrointestinal symptoms of irritable bowel syndrome among younger people: An observational study. PLoS One [Internet]. 2020;15(5). Disponible en: https://pubmed.ncbi.nlm.nih.gov/
32470098/ - Schumann D, Anheyer D, Lauche R, Dobos G, Langhorst J, Cramer H. Effect of Yoga in the Therapy of Irritable Bowel Syndrome: A Systematic Review [Internet]. Clin Gastroenterol Hepatol. 2016;14:1720-31. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27112106/
- Di Palma JA, Herrera JL. The role of effective clinician-patient
communication in the management of irritable bowel syndrome and chronic constipation [Internet]. J Clin Gastroenterol. 2012;46:748-51. Disponible en: https://pubmed.ncbi.nlm.nih.gov/22810107/ - Hulme K, Chilcot J, Smith M. Doctor-patient relationship and quality of life in Irritable Bowel Syndrome: an exploratory study of the potential mediating role of illness perceptions and acceptance. Psychol Health Med [Internet]. 2018;23(6):674-84. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29260889/
- Schmulson MJ, Ortiz-Garrido OM, Hinojosa C, Arcila D. A single session of reassurance can acutely improve the self-perception of impairment in patients with IBS. J Psychosom Res [Internet]. 2006;61(4):461-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/17011353/
- Remes-Troche J, Gómez-Escudero O, Rojas b JN, Carmona-Sánchez R, Pérez-Manautae J, López-Colombo A, et al. Tratamiento farmacológico del síndrome de intestino irritable: revisión técnica. Rev Gastroenterol México [Internet]. 2010;75(1):42-66. Disponible en: http://www.revistagastroenterologiamexico.org/es-tratamiento-farmacologico-del-sindrome-intestino-articulo-resumen-X0375090610498417
- Ruepert L, Quartero AO, de Wit NJ, van der Heijden GJ, Rubin G, Muris JW. Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome [Internet]. Cochrane Database Syst Rev. 2011Disponible en: https://pubmed.ncbi.nlm.nih.gov/21833945/
- Costa Barney VA, Ovalle Hernández AF. Rol de los antiespasmódicos en el manejo del síndrome de intestino irritable [Internet]. Revista Colombiana de Gastroenterologia. 2019;34:269-76. Disponible en: https://doi.org/10.22516/25007440.309
- Martínez-Vázquez MA, Vázquez-Elizondo G, González-González JA, Gutiérrez-Udave R, Maldonado-Garza HJ, Bosques-Padilla FJ. Effect of antispasmodic agents, alone or in combination, in the treatment of Irritable Bowel Syndrome: Systematic review and meta-analysis [Internet]. Rev Gastroenterol Mex. 2012;77:82-90. Disponible en: https://pubmed.ncbi.nlm.nih.gov/22672854/
- Bustos-Fernández LM, Hanna-Jairala I. Tratamiento actual del síndrome de intestino irritable. Una nueva visión basada en la experiencia y la evidencia. Acta Gastroenterol Latinoam [Internet].
2019;49(4):381-93. Disponible en: https://actagastro.org/tratamiento-actual-del-sindrome-de-intestino-irritable-una-nueva-vision-basada-en-la-experiencia-y-la-evidencia/ - Rzetelna H, Porto Alegre Rosa CF, Kirzner M, de Medeiros LPJ, Melo C, Ribeiro MG, et al. Clinical Assessment of the Use of Propinox Hydrochloride and Scopolamine Hydrochloride in the Treatment of Abdominal Colic: A Retrospective, Comparative Study. Int J Clin Med [Internet]. 2016;07(07):474-80. Disponible en: https://www.scirp.org/journal/paperinformation.aspx?paperid=68424
- Pulpeiro A, Martí ML, De Los Santos AR, Di Girolamo G. Propinox en síndrome de intestine irritable. Prensa Med Argent [Internet]. 2000;87(3):299-307. Disponible en: https://www.researchgate.net/publication/289908528_Propinox_en_sindrome_de_intestine_irritable
- Di Girolamo G, De los Santos AR, Martí ML, Valdés Quintana E, Godoy MI, Morano MA, et al. Propinox in intestinal colic: Multicenter randomized prospective double-blind study of three doses of propinox vs. placebo in acute intestinal colic pain. Int J Clin Pharmacol Res [Internet]. 2000;20(1-2):31-40. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11146900/
- Castillo R. Propinox mas clonixinato de lisitina por vía oral en dolor cólico abdominal. Prensa méd argent [Internet]. 1997;84(2):126-33. Disponible en: https://pesquisa.bvsalud.org/portal/resource/pt/lil-225960
- Zheng L, Lai Y, Lu W, Li B, Fan H, Yan Z, et al. Pinaverium reduces symptoms of irritable bowel syndrome in a multicenter, randomized, controlled trial. Clin Gastroenterol Hepatol [Internet]. 2015;13(7):1285-1292.e1. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25632806/
- Bustos-Fernández LM, Hanna-Jairala I. Tratamiento actual del síndrome de intestino irritable. Una nueva visión basada en la experiencia y la evidencia. Acta Gastroenterol Latinoam [Internet]. 2019;49(4):381-93. Disponible en: https://www.actagastro.org/numeros-anteriores/2019/Vol-49-N4/Vol49N4-PDF17.pdf
- Ford AC, Lacy BE, Harris LA, Quigley EMM, Moayyedi P. Effect of Antidepressants and Psychological Therapies in Irritable Bowel Syndrome: An Updated Systematic Review and Meta-Analysis. Am J Gastroenterol. 2019;114(1):21-39.
- García Muñoz E, Licona Galicia DG. Usos potenciales de la mirtazapina en cuidados paliativos más allá de su efecto antidepresivo [Internet]. Revista de la Sociedad Espanola del Dolor. 2018;25:37-44. Disponible en: http://scielo.isciii.es/scielo.phpscript=sci_arttext&pid=S113480462018000100037&lng=es&nrm=iso&tlng=es
- Akama F, Mikami K, Watanabe N, Kimoto K, Yamamoto K, Matsumoto H. Efficacy of mirtazapine on irritable bowel syndrome with anxiety and depression: A case study. J Nippon Med Sch [Internet]. 2018;85(6):330-3. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30568059/
- Furnari M, De Bortoli N, Martinucci I, Bodini G, Revelli M, Marabotto E, et al. Optimal management of constipation associated with irritable bowel syndrome [Internet]. Therapeutics and Clinical Risk Management. Dove Press. 2015;11:691-703. Disponible en: https://www.dovepress.com/getfile.phpfileID=24855
- Mearin F, Ciriza C, Mínguez M, Rey E, Mascort JJ, Peña E, et al. Guía de Práctica Clínica: síndrome del intestino irritable con estreñimiento y estreñimiento funcional en adultos. Rev Española Enfermedades Dig [Internet]. 2016;108(6):332-63. Disponible en: https://scielo.isciii.es/scielo.php?pid=S1130-01082016000600007&script=sci_arttext&tlng=es
- Moayyedi P, Quigley EMM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, et al. The effect of fiber supplementation on irritable bowel syndrome: a systematic review and meta-analysis. [Internet]. Am J Gastroenterol. 2014;109:1367-74. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25070054/
- Moayyedi P, Andrews CN, MacQueen G, Korownyk C, Marsiglio M, Graff L, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for the Management of Irritable Bowel Syndrome (IBS). J Can Assoc Gastroenterol [Internet]. 2019;2(1):6-29. Disponible en: https://academic.oup.com/jcag/article/2/1/6/5290372
- Ford AC, Moayyedi P, Chey WD, Harris LA, Lacy BE, Saito YA, et al. American college of gastroenterology monograph on management of irritable bowel syndrome. Am J Gastroenterol [Internet]. 2018;113(S2):1-18. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29950604/
- Lee-Robichaud H, Thomas K, Morgan J, Nelson RL. Lactulose versus Polyethylene Glycol for Chronic Constipation. Cochrane Database Syst Rev [Internet]. 2010;(7). Disponible en: https://pubmed.ncbi.nlm.nih.gov/20614462/
- Chapman RW, Stanghellini V, Geraint M, Halphen M. Randomized clinical trial: Macrogol/PEG 3350 plus electrolytes for treatment of patients with constipation associated with irritable bowel syndrome. Am J Gastroenterol [Internet]. 2013;108(9):1508-15. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23835436/
- Wall GC, Bryant GA, Bottenberg MM, Maki ED, Miesner AR. Irritable bowel syndrome: A concise review of current treatment concepts [Internet]. World J Gastroenterol. 2014;20:8796-806. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25083054/
- Kamm MA, Mueller-Lissner S, Wald A, Richter E, Swallow R, Gessner U. Oral Bisacodyl Is Effective and Well-Tolerated in Patients With Chronic Constipation. Clin Gastroenterol Hepatol [Internet]. 2011;9(7):577-83. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21440672/
- Mueller-Lissner S, Kamm MA, Wald A, Hinkel U, Koehler U, Richter E, et al. Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of sodium picosulfate in patients with chronic constipation. Am J Gastroenterol [Internet]. 2010;105(4):897-903. Disponible en: https://pubmed.ncbi.nlm.nih.gov/20179697/
- Morel Cerda EC, Remes Troche JM. Estreñimiento crónico síndrome de intestino irritable y enfermedad intestinal inflamatoria. En: Valdovinos Díaz MÁ, Coss Adame E, Gómez Escudero O, Yamamoto Furusho JK, editors. Permanyer Mexico [Internet]. México; 2020. Pp. 53-60. Disponible en: https://www.researchgate.net/publication/344371448_Libro_Estrenimiento_cronico_sindrome_de_intestino_irritable_y_enfermedad_inflamatoria_intestinal_Editores_Miguel_A_Valdovinos_Diaz_Enrique_Coss_Adame_Octavio_Gomez_Escudero_Jesus_Kazuo_Yamamoto_Furush
- Chey WD, Lembo AJ, Lavins BJ, Shiff SJ, Kurtz CB, Currie MG, et al. Linaclotide for irritable bowel syndrome with constipation: A 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol [Internet]. 2012;107(11):1702-12. Disponible en: https://pubmed.ncbi.nlm.nih.gov/22986437/
- Rao S, Lembo AJ, Shiff SJ, Lavins BJ, Currie MG, Jia XD, et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol [Internet]. 2012;107(11):1714-24. Disponible en: https://pubmed.ncbi.nlm.nih.gov/22986440/
- Videlock EJ, Cheng V, Cremonini F. Effects of Linaclotide in Patients With Irritable Bowel Syndrome With Constipation or Chronic Constipation: A Meta-analysis [Internet]. Clin Gastroenterol Hepatol. 2013;11:1084-1092.e3. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23644388/
- Shah ED, Kim HM, Schoenfeld P. Efficacy and tolerability of guanylate cyclase-C agonists for irritable bowel syndrome with constipation and chronic idiopathic constipation: A systematic review and meta-analysis [Internet]. Am J Gastroenterol. 2018;113:329-38. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29380823/
- Drossman DA, Chey WD, Johanson JF, Fass R, Scott C, Panas R, et al. Clinical trial: Lubiprostone in patients with constipation-associated irritable bowel syndrome – Results of two randomized, placebo-controlled studies. Aliment Pharmacol Ther [Internet]. 2009;29(3):329-41. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19006537/
- Johanson JF, Morton D, Geenen J, Ueno R. Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of lubiprostone, a locally-acting type-2 chloride channel activator, in patients with chronic constipation. Am J Gastroenterol [Internet]. 2008;103(1):170-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/17916109/
- Johanson JF, Drossman DA, Panas R, Wahle A, Ueno R. Clinical trial: Phase 2 study of lubiprostone for irritable bowel syndrome with constipation. Aliment Pharmacol Ther [Internet]. 2008;27(8):685-96. Disponible en: https://pubmed.ncbi.nlm.nih.gov/18248656/
- Evans B, Clark WK, Moore DJ, Whorwell PJ. Tegaserod for the treatment of irritable bowel syndrome and chronic constipation [Internet]. Cochrane Database Syst Rev. 2007 [citado 3 de agosto de 2021]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/17943807/
- Ford AC, Brandt LJ, Young C, Chey WD, Foxx-Orenstein AE, Moayyedi P. Efficacy of 5-HT 3 antagonists and 5-HT 4 agonists in irritable bowel syndrome: Systematic review and meta-analysis. Am J Gastroenterol [Internet]. 2009;104(7):1831-43. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19471254/
- Ford AC, Moayyedi P, Lacy BE, Lembo AJ, Saito YA, Schiller LR, et al. American college of gastroenterology monograph on the management of irritable bowel syndrome and chronic idiopathic constipation. Am J Gastroenterol [Internet]. 2014;109(Suppl. 1):S2-26. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25091148/
- Shin A, Camilleri M, Kolar G, Erwin P, West CP, Murad MH. Systematic review with meta-analysis: Highly selective 5-HT4 agonists (prucalopride, velusetrag or naronapride) in chronic constipation. Aliment Pharmacol Ther [Internet]. 2014;39(3):239-53. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24308797/
- Cann PA, Read NW, Holdsworth CD, Barends D. Role of loperamide and placebo in management of irritable bowel syndrome (IBS). Dig Dis Sci [Internet]. 1984;29(3):239-47. Disponible en: https://pubmed.ncbi.nlm.nih.gov/6365490/
- Kane JS, Ford AC. Rifaximin for the treatment of diarrhea-predominant irritable bowel syndrome. Expert Rev Gastroenterol Hepatol [Internet]. 2016;10(4):431-42. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26753693/
- Black CJ, Burr NE, Camilleri M, Earnest DL, Quigley EM, Moayyedi P, et al. Efficacy of pharmacological therapies in patients with IBS with diarrhoea or mixed stool pattern: systematic review and network meta-analysis. Gut [Internet]. 2020;69(1):74-82. Disponible en: https://gut.bmj.com/content/69/1/74
- Marzoli GA, Federici M, Mascagni M, Maffei P, Calanni F, Claudio VG. Diferencias farmacocinéticas entre rifaximina alfa y una rifaximina genérica. Med Interna Mex [Internet]. 2019;35(3):370-8. Disponible en: https://www.scielo.org.mx/pdf/mim/v35n3/0186-4866-mim-35-03-370.pdf
- Dupont HL. Review article: The antimicrobial effects of rifaximin on the gut microbiota [Internet]. Aliment Pharmacol Ther. 2016;43:3-10. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26618921/
- Pimentel M, Chow EJ, Lin HC. Eradication of Small Intestinal Bacterial Overgrowth Reduces Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol [Internet]. 2000;95(12):3503-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11151884/
- Pimentel M, Lembo A, Chey WD, Zakko S, Ringel Y, Yu J, et al. Rifaximin Therapy for Patients with Irritable Bowel Syndrome without Constipation. N Engl J Med [Internet]. 2011;364(1):22-32. Disponible en: https://www.nejm.org/doi/full/10.1056/nejmoa1004409
- Lembo A, Pimentel M, Rao SS, Schoenfeld P, Cash B, Weinstock LB, et al. Repeat Treatment With Rifaximin Is Safe and Effective in Patients With Diarrhea-Predominant Irritable Bowel Syndrome. Gastroenterology [Internet]. 2016;151(6):1113-21. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27528177/
- Barkun A, Love J, Gould M, Pluta H, Hillary Steinhart A. Bile acid malabsorption in chronic diarrhea: Pathophysiology and treatment [Internet]. Can J Gastroenterol. 2013;27:653-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24199211/
- Slattery SA, Niaz O, Aziz Q, Ford AC, Farmer AD. Systematic review with meta-analysis: The prevalence of bile acid malabsorption in the irritable bowel syndrome with diarrhoea [Internet].Aliment Pharmacol Ther. 2015;42:3-11. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25913530/
- Camilleri M, Acosta A, Busciglio I, Boldingh A, Dyer RB, Zinsmeister AR, et al. Effect of colesevelam on faecal bile acids and bowel functions in diarrhoea-predominant irritable bowel syndrome. Aliment Pharmacol Ther [Internet]. 2015;41(5):438-48. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25594801/
- Bajor A, Törnblom H, Rudling M, Ung KA, Simrén M. Increased colonic bile acid exposure: A relevant factor for symptoms and treatment in IBS. Gut [Internet]. 2015;64(1):84-92. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24727487/
- Ruiz-Campos L, Gisbert JP, Ysamat M, Arau B, Loras C, Esteve M, et al. Systematic review with meta-analysis: the prevalence of bile acid malabsorption and response to colestyramine in patients with chronic watery diarrhoea and previous cholecystectomy. Aliment Pharmacol Ther [Internet]. 2019;49(3):242-50. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30585336/
- Zheng Y, Yu T, Tang Y, Xiong W, Shen X, Jiang L, et al. Efficacy and safety of 5-hydroxytryptamine 3 receptor antagonists in irritable bowel syndrome: A systematic review and metaanalysis of randomized controlled trials [Internet]. PLoS One. 2017;12:1-21. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28291778/
- Krause R, Ameen V, Gordon SH, West M, Heath AT, Perschy T, et al. A randomized, double-blind, placebo-controlled study to assess efficacy and safety of 0.5 mg and 1 mg alosetron in women with severe diarrhea-predominant IBS. Am J Gastroenterol [Internet]. 2007;102(8):1709-19. Disponible en: https://pubmed.ncbi.nlm.nih.gov/17509028/
- Garsed K, Chernova J, Hastings M, Lam C, Marciani L, Singh G, et al. A randomised trial of ondansetron for the treatment of irritable bowel syndrome with diarrhoea. Gut [Internet]. 2014;63(10):1617-25. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24334242/
- Barshop K, Staller K. Eluxadoline in irritable bowel syndrome with diarrhea: rationale, evidence and place in therapy. Ther Adv Chronic Dis [Internet]. 2017;8(11):153-60. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29090081/
- Holzer P. Opioid receptors in the gastrointestinal tract [Internet]. Regulatory Peptides. Europe PMC Funders. 2009;155:11-7. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3163293/
- Lembo AJ, Lacy BE, Zuckerman MJ, Schey R, Dove LS, Andrae DA, et al. Eluxadoline for Irritable Bowel Syndrome with Diarrhea. N Engl J Med [Internet]. 2016;374(3):242-53. Disponible en: http://www.nejm.org/doi/10.1056/NEJMoa1505180
- US Food and Drug Administration. Viberzi HIGHLIGHTS OF PRESCRIBING INFORMATION [Internet]. US Food and Drug Administration. 2008 [citado 4 de agosto de 2021]. Disponible en: https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/206940s006lbl.pdf
- Wu IXY, Wong CHL, Ho RST, Cheung WKW, Ford AC, Wu JCY, et al. Acupuncture and related therapies for treating irritable bowel syndrome: overview of systematic reviews and network meta-analysis [Internet]. Therap Adv Gastroenterol. 2019;12.Disponible en: https://pubmed.ncbi.nlm.nih.gov/30719074/
- Peckham EJ, Cooper K, Roberts ER, Agrawal A, Brabyn S, Tew G. Homeopathy for treatment of irritable bowel syndrome [Internet]. Cochrane Database Syst Rev. 2019 [citado 1 de agosto de2021]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31483486/
- Bahrami HR, Hamedi S, Salari R, Noras M. Herbal Medicines for the Management of Irritable Bowel Syndrome: A Systematic Review. Electron physician [Internet]. 2016;8(8):2719-25. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27757180/
- Ottillinger B, Storr M, Malfertheiner P, Allescher HD. STW 5 (Iberogast®)-a safe and effective standard in the treatment of functional gastrointestinal disorders. Wiener Medizinische Wochenschrift [Internet]. 2013;163(3-4):65-72. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3580135/
- Chumpitazi BP, Kearns GL, Shulman RJ. Review article: the physiological effects and safety of peppermint oil and its efficacy in irritable bowel syndrome and other functional disorders [Internet]. Aliment Pharmacol Ther. 2018;47:738-52. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29372567/
- Alammar N, Wang L, Saberi B, Nanavati J, Holtmann G, Shinohara RT, et al. The impact of peppermint oil on the irritable bowel syndrome: A meta-analysis of the pooled clinical data 11 Medical and Health Sciences 1103 Clinical Sciences. BMC Complement Altern Med [Internet]. 2019;19(1). Disponible en: https://pubmed.ncbi.nlm.nih.gov/30654773/
- Tan G, Hammond DC, Gurrala J. Hypnosis and irritable bowel syndrome: A review of efficacy and mechanism of action. Am J Clin Hypn [Internet]. 2005;47(3):161-78. Disponible en: https://pubmed.ncbi.nlm.nih.gov/15754863/
- Miller V, Carruthers HR, Morris J, Hasan SS, Archbold S, Whorwell PJ. Hypnotherapy for irritable bowel syndrome: An audit of one thousand adult patients. Aliment Pharmacol Ther [Internet]. 2015;41(9):844-55. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25736234/
- Pajak R, Lackner J, Kamboj SK. A systematic review of minimal-contact psychological treatments for symptom management in Irritable Bowel Syndrome [Internet]. J Psychosom Res. 2013;75:103-12. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23915765/
- Black CJ, Thakur ER, Houghton LA, Quigley EMM, Moayyedi P, Ford AC. Efficacy of psychological therapies for irritable bowel syndrome: Systematic review and network meta-analysis. Gut [Internet]. 2020;69(8):1441-51. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32276950/
- Gaylord SA, Palsson OS, Garland EL, Faurot KR, Coble RS, Mann JD, et al. Mindfulness training reduces the severity of irritable bowel syndrome in women: Results of a randomized controlled trial. Am J Gastroenterol [Internet]. 2011;106(9):1678-88. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21691341/
- Naliboff BD, Smith SR, Serpa JG, Laird KT, Stains J, Connolly LS, et al. Mindfulness-based stress reduction improves irritable bowel syndrome (IBS) symptoms via specific aspects of mindfulness. Neurogastroenterol Motil [Internet]. 2020;32(9):e13828. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32266762/
- Shah K, Ramos-Garcia M, Bhavsar J, Lehrer P. Mind-body treatments of irritable bowel syndrome symptoms: An updated meta-analysis. Behav Res Ther [Internet]. 2020;128:103462. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32229334/
- Ciacci C, Franceschi F, Purchiaroni F, Capone P, Buccelletti F, Iacomini P, et al. Effect of beta-Glucan, Inositol and digestive enzymes in GI symptoms of patients with IBS. Eur Rev Med Pharmacol Sci [Internet]. 2011;15(6):637-43. Disponible en: https://www.europeanreview.org/article/957
- Quigley EMM. Probiotics in Functional Bowel Disorders Getting It Right [Internet]. J Clin Gastroenterol. 2011;45:481-2. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21617544/
- Shanahan F. Probiotics in Perspective [Internet]. Gastroenterology. 2010;139:1808-12. Disponible en: https://pubmed.ncbi.nlm.nih.gov/20965190/
- Jeffery IB, O’Toole PW, Öhman L, Claesson MJ, Deane J, Quigley EMM, et al. An irritable bowel syndrome subtype defined by species-specific alterations in faecal microbiota. Gut [Internet]. 2012;61(7):997-1006. Disponible en: https://pubmed.ncbi.nlm.nih.gov/22180058/
- Tap J, Derrien M, Törnblom H, Brazeilles R, Cools-Portier S, Doré J, et al. Identification of an Intestinal Microbiota Signature Associated With Severity of Irritable Bowel Syndrome. Gastroenterology [Internet]. 2017;152(1):111-123.e8. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27725146/
- Steidler L, Hans W, Schotte L, Neirynck S, Obermeier F, Falk W, et al. Treatment of Murine Colitis by Lactococcus lactis Secreting Interleukin-10. Science (80- ) [Internet]. 2000;289(5483):1352-5. Disponible en: https://pubmed.ncbi.nlm.nih.gov/10958782/
- Mohamadzadeh M, Pfeiler E, Brown J, Zadeh M, Gramarossa M, Managlia E, et al. Regulation of induced colonic inflammation by Lactobacillus acidophilus deficient in lipoteichoic acid. Proc Natl Acad Sci U S A [Internet]. 2011;108(Suppl 1):4623-30. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21282652/
- Whorwell PJ, Altringer L, Morel J, Bond Y, Charbonneau D, O’Mahony L, et al. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome. Am J Gastroenterol [Internet]. 2006;101(7):1581-90. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16863564/
- Li B, Liang L, Deng H, Guo J, Shu H, Zhang L. Efficacy and safety of probiotics in irritable bowel syndrome: A systematic review and meta-analysis. Front Pharmacol. 2020;11:332.
- Ducrotté P. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome. World J Gastroenterol [Internet]. 2012;18(30):4012. Disponible en: http://www.wjgnet.com/1007-9327/full/v18/i30/4012.htm
- Yuan F, Ni H, Asche C V., Kim M, Walayat S, Ren J. Efficacy of Bi-
fidobacterium infantis 35624 in patients with irritable bowel syndro-
me: a meta-analysis. Curr Med Res Opin [Internet]. 2017;33(7):1191-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28166427/ - Andresen V, Gschossmann J, Layer P. Heat-inactivated Bifidobacterium bifidum MIMBb75 (SYN-HI-001) in the treatment of irritable bowel syndrome: a multicentre, randomised, double-blind, placebo-controlled clinical trial. Lancet Gastroenterol Hepatol [Internet]. 2020;5(7):658-66. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32277872/
- Martoni CJ, Srivastava S, Leyer GJ. Lactobacillus acidophilus DDS-1 and bifidobacterium lactis UABla-12 improve abdominal pain severity and symptomology in irritable bowel syndrome: Randomized controlled trial. Nutrients [Internet]. 2020;12(2). Disponible en: https://pubmed.ncbi.nlm.nih.gov/32019158/
- Ford AC, Harris LA, Lacy BE, Quigley EMM, Moayyedi P. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome [Internet]. Aliment Pharmacol Ther. 2018;48:1044-60. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30294792/
- Hungin APS, Mulligan C, Pot B, Whorwell P, Agréus L, Fracasso P, et al. Systematic review: Probiotics in the management of lower gastrointestinal symptoms in clinical practice – An evidence-based international guide [Internet]. Aliment Pharmacol Ther. 2013;38:864-86. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23981066/
- Iovino P, Bucci C, Tremolaterra F, Santonicola A, Chiarioni G. Bloating and functional gastro-intestinal disorders: Where are we and where are we going? [Internet]. World J Gastroenterol. 2014;20:14407-19. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25339827/
- Kim HJ, Vazquez Roque MI, Camilleri M, Stephens D, Burton DD, Baxter K, et al. A randomized controlled trial of a probiotic combination VSL# 3 and placebo in irritable bowel syndrome with bloating. Neurogastroenterol Motil [Internet]. 2005;17(5):687-96. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16185307/
- Ringel-Kulka T, Palsson OS, Maier D, Carroll I, Galanko JA, Leyer G, et al. Probiotic bacteria Lactobacillus acidophilus NCFM and Bifidobacterium lactis Bi-07 versus placebo for the symptoms of bloating in patients with functional bowel disorders: A double-blind study. J Clin Gastroenterol [Internet]. 2011;45(6):518-25. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21436726/
- Ford AC, Quigley EMM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, et al. Efficacy of prebiotics, probiotics, and synbiotics in irritable bowel syndrome and chronic idiopathic constipation: systematic review and meta-analysis. Am J Gastroenterol [Internet]. 2014;109(10):1547-62. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25070051/
- Pineton de Chambrun G, Neut C, Chau A, Cazaubiel M, Pelerin F, Justen P, et al. A randomized clinical trial of Saccharomyces cerevisiae versus placebo in the irritable bowel syndrome. Dig Liver Dis [Internet]. 2015;47(2):119-24. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25488056/
- Spiller R, Pélerin F, Cayzeele Decherf A, Maudet C, Housez B, Cazaubiel M, et al. Randomized double blind placebo-controlled trial of Saccharomyces cerevisiae CNCM I-3856 in irritable bowel syndrome: improvement in abdominal pain and bloating in those with predominant constipation. United Eur Gastroenterol J [Internet]. 2016;4(3):353-62. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4924426/
- Mourey F, Decherf A, Jeanne J-F, Clément-Ziza M, Grisoni M-L, Machuron F, et al. Saccharomyces cerevisiae I-3856 in irritable bowel syndrome with predominant constipation. http://www.wjgnet.com/ [Internet]. 2022;28(22):2509-22. Disponible en: https://www.wjgnet.com/10079327/full/v28/i22/2509.htm
- Sun YY, Li M, Li YY, Li LX, Zhai WZ, Wang P, et al. The effect of Clostridium butyricum on symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome: A randomized, double-blind, placebo-controlled trial. Sci Rep [Internet]. 2018;8(1):1-11. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29445178/
- Akhondi-Meybodi M, Rahimian M, Salmanroghani H, Amirbeigy M, Baghbanian M, Ghelmani S. Study of the Effect of Probiotic Saccharomyces Boulardii on the Treatment of Irritable Bowel Syndrome. J Biol Today’s World [Internet]. 2014;3(7):152-6. Disponible en: http://www.journalbio.com
- Barraza-Ortiz DA, Pérez-López N, Medina-López VM, Minero-Alfaro JI, Zamarripa-Dorsey F, Fernández-Martínez NDC, et al. Combination of a Probiotic and an Antispasmodic Increases Quality of Life and Reduces Symptoms in Patients with Irritable Bowel Syndrome: A Pilot Study. Dig Dis [Internet]. 2021;39(3):294-300. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32810850/
- Lorenzo-Zúñiga V, Llop E, Suárez C, Álvarez B, Abreu L, Espadaler J, et al. I.31, a new combination of probiotics, improves irritable bowel syndrome-related quality of life. World J Gastroenterol [Internet]. 2014;26:8709-16. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25024629/
Correspondencia: Jorge Antonio Galdámez Estrada
Correo electrónico: drgaldamez22@gmail.com
Acta Gastroenterol Latinoam 2023;53(2):137-163
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE