Carmen Aguiar,1 Alejandra Arriola,1 Macarena Vassel,1 Sylvia Jaumandreu,2 María Carmen Rodríguez,3 Carmen Álvarez3
1 Área de Diagnóstico y Tratamiento HPV Rectoanal. MUCAM.
2 Laboratorio de Citopatología. CITOLAB.
3 Laboratorio Carmen Álvarez Santín.
Montevideo, Uruguay.
Acta Gastroenterol Latinoam 2019;49(1):65-68
Recibido: 24/09/2017 / Aprobado: 07/11/2017 / Publicado en www.actagastro.org el 18/03/2019
Resumen
El virus papiloma humano (VPH) es un importante factor de riesgo carcinogénico; es el causante del 90% de los cánceres anales. En los últimos años, el gran avance en el conocimiento sobre la infección del VPH ha impulsado el desarrollo de técnicas para el diagnóstico de las lesiones, provocadas por este virus en el canal anal. La confirmación por biopsia es hasta ahora el método patrón de oro para la confirmación de la enfermedad. Sin embargo, en algunos casos la biopsia negativa no descarta la persistencia de la infección y el consecuente riesgo evolutivo.
Palabras claves. Papilomavirus humano, neoplasia intraepitelial anal, cáncer anal.
Infrequent clinical presentation of anal HPV lesion
Summary
The human papillomavirus (HPV) is an important carcinogenic risk factor, being the cause of 90% of anal cancer. In the last few years, the advance in the knowledge of the HPV infection has boosted the development of techniques for diagnose of the lesions caused by this virus in the anal canal. So far, the confirmation via biopsy is the gold standard for this disease’s confirmation. However, in some cases the negative biopsy does not rule out the persistency of the infection and its consequent evolutionary risk.
Key words. Human papillomavirus, intraepithelial anal neoplasia, anal cancer.
El virus papiloma humano (VPH) es el causante de la enfermedad de transmisión sexual más frecuente del mundo y un importante factor de riesgo carcinogénico, responsable del 90% de los cánceres anales.1
Se han reportado más de 100 genotipos de VPH, de los cuales alrededor de 40 muestran tropismo por la mucosa oral y del tracto anogenital.1
El cáncer anal y el de cérvix uterino, ambos asociados a la infección por VPH, presentan una etiopatogenia e histomorfología similar,2 por lo que los métodos de detección de lesiones precursoras del cáncer anal son similares.3 En el ano a estas lesiones se las denomina neoplasia intraepitelial anal (NIA) y se clasifican de acuerdo con el grado de displasia en NIA 1 de bajo grado y NIA 2 y 3 de alto grado.4 La importancia de su búsqueda sistematizada responde al aumento de la incidencia del cáncer anal, que oscila entre 30 y 100/100.000 habitantes por año en grupos de riesgo.
La citología anal mediante técnica de Papanicolau (PAP) es un buen método de tamizaje para la búsqueda de lesiones precursoras, pero su especificidad no supera el 50%.2 Frente a un resultado anómalo, de acuerdo con la conocida clasificación de Bethesda (LSIL, ASCUS, HSIL, ASC-H) se propone realizar una anoscopía de alta resolución (AAR). Del mismo, las lesiones de cérvix, la tinción con ácido acético al 4% y la magnificación aportan una mejor delimitación de las lesiones en ano y recto bajo para la toma de biopsias dirigidas.2, 5, 6
Se describen como factores de riesgo para la existencia de lesiones precursoras de cáncer anal: la infección por el VIH, la multiplicidad de parejas sexuales, el tabaquismo, el inicio temprano de las relaciones sexuales, el coito anal, la presencia de verrugas en piel anogenital y en el caso de las mujeres la presencia de lesiones VPH en tracto genital inferior.1, 4, 5, 7
En el año 2013 se crea en Médica Uruguaya de Montevideo el Área de Diagnóstico y Tratamiento del VPH Rectoanal. Se confeccionó un protocolo para la búsqueda sistematizada de NIA en el que se describieron los grupos de riesgo: 1) hombres que tienen sexo con hombres (HsexH) VIH positivo, 2) HsexH, 3) mujeres con lesiones VPH en el tracto genital inferior y 4) hombres o mujeres con verrugas anogenitales condilomatosas.8
Se valoró el rendimiento de la citopatología, PAP, frente al análisis histológico de muestras obtenidas mediante AAR como método patrón de oro. Se demostró una sensibilidad del PAP del 92% y una especificidad del 46%. Fue la primera búsqueda sistematizada de lesiones precursoras de cáncer anal en nuestro medio.8 Dado el excelente rendimiento, se adoptó al PAP como método de tamizaje de la NIA, realizándose AAR con biopsia solo en los casos de PAP positivos. En el momento actual estamos valorando el rendimiento del test de Genotipificación Biomolecular que permitirá determinar la infección por genotipos virales con capacidad para el desarrollo de cáncer, HPV de alto riesgo.8, 9
En el contexto de dicha investigación hemos observado que, en algunas oportunidades, la presencia de lesiones intraepiteliales displásicas en el PAP no siempre se corresponde con lesión evidente ni en la imagen magnificada 100x ni en el análisis histológico de muestras randomizadas. Si bien es un hallazgo infrecuente, hay estudios que describen la presencia de displasia en pacientes con mucosa aparentemente normal.10
Se presenta y discute el caso de una paciente que debutó con lesiones anales por VPH, LSIL en PAP y NIA1 en la histología. Luego del tratamiento se observó un aumento del grado de displasia en PAP, HSIL, sin lesiones evidentes en AAR y en el análisis histológico. Un año después consultó por lesiones bucales de tipo HPV, sin lesiones evidentes en canal anal. Se realizó test de genotipificación molecular, test VPH, en muestras de canal anal que informó genotipo 68, de alto riesgo oncogénico.
Caso clínico
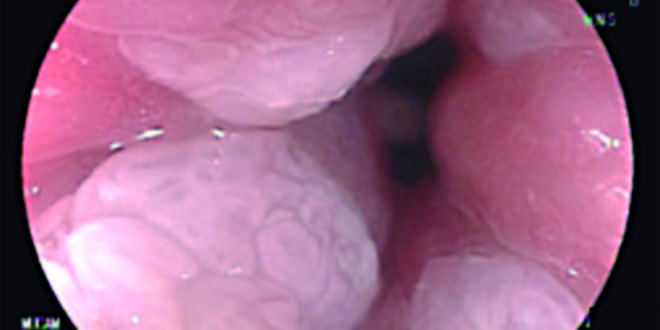
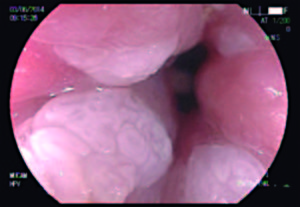
Mujer de 32 años tabaquista, con antecedente de múltiples parejas sexuales. Sin patología ginecológica a destacar, con test de VIH y VDRL negativos. Enviada por condilomas perianales al Área de Diagnóstico y Tratamiento HPV Rectoanal. Se realizó PAP intra anal que informó lesión intraepitelial escamosa de bajo grado, LSIL. Siguiendo el protocolo se realizó AAR, observando en área de transición ano rectal lesión elevada que se biopsió (Figura 1). El análisis histológico informó neoplasia intraepitelial de bajo grado, NIA 1. Se inició tratamiento de lesiones internas con topicaciones semanales de ácido tricloroacético (TCA). Las verrugas de piel fueron tratadas en dermatología.
Figura 1. Imagen de 1er AAR con acetotinción y magnificación 100x. Se observa lesión elevada de aspecto VPH.
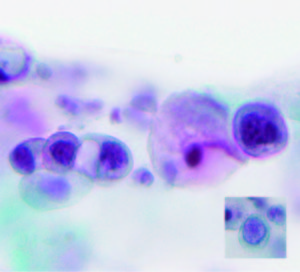
A los 6 meses se realizó una revisión. No se observaron lesiones en piel perianal ni lesiones internas en la anoscopía convencional. Se tomaron muestras para PAP intra anal y el análisis citológico informó lesión intraepitelial de alto grado, HSIL (Figura 2). Sin lesiones evidentes para la AAR, se tomaron muestras con biopsias randomizadas en área de transición anorrectal. El análisis histológico informó mucosa normal.
Figura 2. Lesión Intraepitelial Anal de Alto Grado (HSIL). Extendido con reguero de células pavimentosas inmaduras, con alta relación núcleo citoplasmática, núcleos hipercromáticos marcada irregularidad de la cromatina y de la membrana nuclear. Detalle de células aisladas en el ángulo inferior de la imagen.
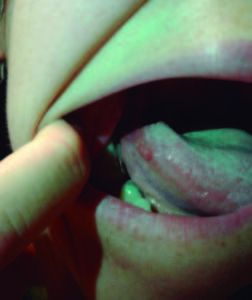
La paciente interrumpió los controles y concurrió un año después con dolor en la cavidad oral, adenomegalias submaxilares dolorosas y lesiones exofíticas verrucosas en el borde y en la base de la lengua (Figura 3), mucosa yugal y amígdalas. El análisis citológico con técnica de PAP de estas lesiones informó atipías de células escamosas de resultado incierto, ASCUS. Se solicitó nuevamente VIH y VDRL con resultados negativos. El PAP ginecológico, ecografía pélvica y transvaginal fueron normales.
Figura 3. Lesión exofítica verrucosa en borde de lengua.
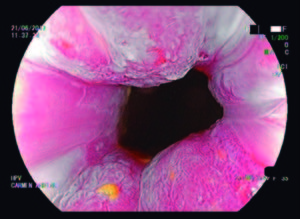
No se observaron lesiones en la piel perianal. Se repitió AAR sin observarse lesiones (Figura 4) y el análisis histológico de las biopsias randomizadas fue negativo. Se tomaron muestras de mucosa anal para test HPV que informaron serotipo 68 de alto riesgo para cáncer anal.
En la evolución presentó disminución espontánea en número y tamaño de las lesiones bucales. Continuó con controles pautados en la institución de salud Médica Uruguaya de Montevideo en el Área de Diagnóstico y Tratamiento del VPH Rectoanal con muy buena adherencia.
Figura 4. Imagen de AAR cromoendoscopía laser LCI, magnificada 100 x. Se observa el área de transición sin lesiones.
Discusión
La infección por VPH puede producir lesiones externas en piel anal, internas en la mucosa del canal y en áreas de metaplasia escamosa del recto bajo.
Las lesiones internas deben ser buscadas siempre que existan lesiones externas o aún en su ausencia, en grupos de riesgo. Tienen morfologías diversas, desde lesiones muy similares a las externas, verrugas, hasta mínimas irregularidades mucosas como el patrón en mosaico que presentó nuestra paciente en la primer AAR. Existe la posibilidad, aunque poco frecuente, de la presencia de displasia en ausencia de lesiones visibles.12 Surawicz y col. han propuesto distintas hipótesis para explicar este hallazgo: tamaño pequeño de las lesiones o que las atipías celulares ocurran en la profundidad de las glándulas. En nuestro caso utilizamos endoscopía de alta resolución con tinción y magnificación 100x, lo que aleja la posibilidad del subdiagnóstico de lesiones pequeñas. La lesión dejó de ser evidente también para la histología, pero es posible que las muestras puedan haber sido realizadas en mucosa sana. La infección VPH persistente en el canal anal de esta paciente fue comprobada por el test de Genotipificación Biomolecular que evidenció un genotipo 68, con alto riesgo para desarrollo de cáncer.
Según la clasificación de la Agencia Internacional de Investigación sobre el Cáncer, los genotipos VPH de alto riesgo oncogénico son: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68. En los casos de infección persistente por motivos no totalmente conocidos, pero probablemente vinculados a una alteración en la inmunidad local,9 un virus de alto riesgo puede integrarse al genoma de la célula epitelial del huésped. Estos genotipos presentan en su cápside las proteínas E6 y E7 que al sobreexpresarse inhiben los genes guardianes del genoma que codifican las proteínas P53 y PRb, inductoras de apoptosis. Es aún escaso el conocimiento del potencial oncogénico en canal anal de los genotipos 26, 53, 66, 67, 70, 73 y 82.11, 12
Conclusión
Es necesario profundizar el conocimiento sobre la prevención del cáncer anal en grupos de riesgo donde la tasa de incidencia de esta enfermedad aumenta considerablemente con respecto a la población general. Se impone el uso de técnicas de tamizaje como el PAP anal o los Test VPH previo a la indicación de AAR. Se propone hacer una búsqueda sistematizada de las lesiones precursoras de cáncer anal en pacientes que pertenecen a grupos de riesgo. Una vez realizado el diagnóstico deberá realizarse el tratamiento de estas lesiones. Estará indicado el seguimiento postratamiento en los casos con lesiones displásicas o infección persistente por genotipos oncogénicos en las técnicas de tamizaje.
Sostén financiero. Para la realización de esta investigación no se recibió ningún apoyo en forma de subvenciones, equipo, fármacos u otros.
Referencias
- Daling JR, Madeleine M, Johnson L. Human Papillomavirus, smoking and sexual practices in the etiology of anal cáncer. Cancer 2004; 101: 270-280.
- Panther L, Wagner K, Proper J, Fugelso D, Chatis P, Weeden W, Nasser I, Doweiko J, Dezube B. High resolution anoscopy findings for men who have sex with men: in accuracy of anal cytology as a predictor of histologic high grade intraepithelial neoplasia and the impact of HIV serostatus. CID 2004; 38:1490-1492.
- Dunne EF, Nielson C, Stone K, Markowitz L, Giuliano A. Prevalence of HPV infection among men: A systematic review of the literature. J Infect Dis 2006; 194: 1044-1057.
- Moscicki A, Darragh T, Berry JM, Roberts J, Khan M, Boardman L, Chiao E, Einstein M, Goldstone S, Jay N, Likes W, Stier E, Welton M, Wiley D, Palefsky J. Screening for anal cancer in women. Low Genit Tract Dis 2015; 19: 27-42.
- Park I, Palefsky JM. Evaluation and management of anal intraepithelial neoplasia in HIV-Negative and HIV-Positive men who have sex with men. Curr Infect Dis Rep 2010; 12: 126-133.
- Palefsky J, Rubin M. The epidemilogy of anal human papillomavirus and related neoplasia. Obstet Gynecol Clin North Am 2009; 36: 187-200.
- Berry JM, Chrobak D, Jay N, Palefsky J. Who is ready to screen for anal squamous intraepithelial lesions and why should they perform High-Resolution Anoscopy? Sex Transm Dis 2014; 41: 254-256.
- Aguiar C, Jaumandreu S, Alvarez C, Rodríguez M, Ortega C. Lesiones rectoanales internas por VPH, diagnóstico mediante PAP anal y Anoscopía de Alta Resolución con biopsias, 1era serie en Uruguay. Rev Med Urug 2015; 31: 96-101.
- Leiding J, Holland S. Warts and All: HPV in primary immunodeficiencies. J Allergy Clin Immunol 2012; 130: 1030-1048.
- Goldstone S, Moshier E. Detection of oncogenic human papillomavirus impacts anal screenings guidelines in men who have sex with men. Dis Colon Rectum 2010; 53: 1135-1142.
- Berry JM, Palefsky J, Jay N, Cheng SC, Darragh T, Ching-Hong PV. Performance characteristics of anal cytology and human papillomavirus testing in patients with high resolution anoscopy guided biopsy of high grade anal intraepithelial neoplasia. Dis Colon Rectum 2009; 53: 239-247.
- Surawicz CM, Critchlow C, Sayer J, Hurt C, Hawes S, Kirby P. High grade anal dysplasia in visually normal mucosa in homosexual men: seven cases. Am J Gastroenterol 1995; 90: 1776-1778.
- Bouvard V, Baan R, Straif K, Grosse Y, Secretan B, El Ghissassi F, Benbrahim-Tallaa L, Guha N, Freeman C, Galichet L, Cogliano V. A review of human carcinogens part B: biological agents. Lancet Oncol 2009; 10: 321-322.
- Schiffman M, Clifford G, Buonaguro FM. Classification of weakly carcinogenic human papillomavirus types: addressing the limits of epidemiology at the borderline. Infect Agent Cancer 2009; 4: 8.
Correspondencia: Carmen Aguiar
José Félix Zubillaga 1119 bis. Montevideo, Uruguay
Tel.: 598 99131695
Correo electrónico: carycarus@yahoo.com
Acta Gastroenterol Latinoam 2019;49(1): 65-68
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE