Bruno Bazzano ID· Yessica Pontet ID· Alejandra Arriola ID· Virginia López ID
Hospital de Clínicas, Montevideo, Uruguay.
Acta Gastroenterol Latinoam 2024;54(1):84-91
Recibido: 13/08/2023 / Aceptado: 25/02/2024 / Publicado online el 25/03/2024 /
https://doi.org/10.52787/agl.v54i1.341
Resumen
La tuberculosis intestinal es una patología poco frecuente. Aunque presenta una baja incidencia, esta se encuentra en ascenso por el aumento del número de casos de infección por VIH, la resistencia a los fármacos antituberculosos y los cambios migratorios. Es una enfermedad de difícil diagnóstico dada su heterogeneidad clínica. Puede simular otras enfermedades intestinales, lo que puede conducir a un retraso en su detección y en el inicio de tratamiento. Es por este motivo que el diagnóstico suele realizarse en etapas avanzadas o graves.
Se presenta el caso de una mujer de 53 años inmunocompetente que consultó por fiebre, repercusión general, síntomas respiratorios y diarrea de 3 meses de evolución. La videocolonoscopía evidenció lesiones en ciego con biopsias que confirmaron Mycobacterium tuberculosis, presente también en muestras respiratorias. Pese al tratamiento anti tuberculosis instaurado, la paciente presentó perforación intestinal con mala evolución y posterior fallecimiento.
Palabras claves. Tuberculosis intestinal, inmunocompetente.
Intestinal Tuberculosis in an Immunocompetent Patient: A Case Report
Summary
Intestinal tuberculosis is an infrequent pathology. Although it has a low incidence, it is on the rise due to the increase in the number of cases of HIV infection, resistance to anti-tuberculosis drugs, and migratory changes. Sometimes diagnosis is difficult for physicians given its clinical heterogeneity. It can mimic other intestinal diseases, and therefore its detection and start of treatment are often late. For this reason, the diagnosis is usually made in advanced or severe stages. We present the case of a 53-year-old immunocompetent woman with fever, general repercussions, respiratory symptoms and diarrhea of 3 months’ evolution. Video colonoscopy showed lesions in the cecum with biopsies confirming Mycobacterium tuberculosis, also present in respiratory samples. Despite initiating anti-tuberculosis treatment, the patient presented intestinal perforation with poor evolution and death.
Keywords. Intestinal tuberculosis, immunocompetence.
Abreviaturas
CHLAEP: Comisión Honoraria de Lucha Antituberculosa y Enfermedades Prevalentes.
COVID 19: Enfermedad por virus SARS-CoV-2.
HB: Hemoglobina.
IGRA: Pruebas serológicas de detección de interferón gamma, por sus siglas en inglés.
LBA: Lavado bronquio-alveolar.
OMS: Organización Mundial de la Salud.
PPD: Prueba cutánea de derivado proteico purificado, por sus siglas en inglés.
PCR: Reacción en cadena de la polimerasa, por sus siglas en inglés.
TBC: Tuberculosis.
VCC: Videocolonoscopía.
VGC: Videogastroscopía.
VIH: Virus de la Inmunodeficiencia Humana.
Introducción
Se considera que un tercio de la población mundial está infectada por M. tuberculosis y que entre el 5% y el 10% desarrollarán la enfermedad.
En 2021, según reporta la OMS, 10,6 millones de personas enfermaron a nivel mundial y 1,6 millones murieron por tuberculosis (TBC).1 Más de 85% de los nuevos casos ocurrieron en países con ingresos medianos y bajos. La pandemia de COVID-19 ha tenido un impacto significativo en el diagnóstico y tratamiento de la TBC, lo que podría llevar a un aumento de la enfermedad en el futuro, con una reversión en el descenso observado en incidencia y mortalidad en las últimas décadas. El número estimado de muertes por TBC aumentó entre 2019 y 2021, revirtiendo los años de disminución entre 2005 y 2019.1
En Uruguay se observa un ascenso progresivo del número de casos notificados a partir de 2006, lo que constituye una reversión en la situación epidemiológica nacional. En 2021 se alcanzaron 951 casos (nuevos y recaídas), correspondientes a una tasa de incidencia de 26,8/100.000 habitantes, lo que ubica al país en el grupo de prevalencia media-alta (25-49/100.000).2
Los principales grupos de riesgo reportados en Uruguay para TBC son: contactos con pacientes con TBC, personas que viven con VIH y personas privadas de libertad.2
Entre los pacientes inmunocomprometidos, los que tienen VIH/SIDA tienen el mayor riesgo de desarrollar TBC, con mayor mortalidad, aunque su incidencia está en descenso en los últimos años.1 Según la OMS, el 6,7% de los casos de TBC a nivel mundial en el año 2021 ocurrieron en personas con VIH/SIDA.1 En Uruguay, el reporte de CHLAEP de 2021 fue de 12,1%, lo que corresponde a 821 casos.2 En 2021, se estimaron 1,4 millones de muertes entre personas con VIH negativo a nivel mundial1 y 187.000 muertes entre personas con VIH positivo.1 En Uruguay se reportaron 25 muertes en 2021 en pacientes VIH y un total de 107 casos.2
Las formas extrapulmonares representan el 15%-30% de los casos de TBC en la literatura.1 Desde la década del 80, han aumentado su incidencia en mayor proporción que la forma pulmonar.3 En Uruguay, en 2021 alcanzaron el 11%,2 aunque esta frecuencia de presentación se incrementa notablemente en individuos infectados por el VIH, receptores de trasplantes de órganos sólidos y/o pacientes con terapia inmunosupresora.4 Se presume que la base de la alta frecuencia de TBC extrapulmonar entre pacientes con infección por VIH es la falla de la respuesta inmune para contener M. tuberculosis, lo que facilita la diseminación hematógena y la subsiguiente afectación de uno o múltiples sitios no pulmonares.4
La forma abdominal puede involucrar cualquiera de sus órganos. La localización intestinal es la más frecuente y, si bien puede ocurrir en cualquier topografía, el sector ileocecal suele ser el más afectado. La afectación aislada colónica y de intestino delgado le siguen en frecuencia, mientras que el esófago y el estómago raramente están comprometidos.5
La enteritis tuberculosa se produce por la ingesta de alimentos o esputo contaminados, por diseminación hematógena de una tuberculosis pulmonar activa, o por afectación directa de otros órganos contiguos.5 Las micobacterias poseen una cápsula grasa resistente a la digestión que interfiere con la liberación temprana en el tracto gastrointestinal, lo que explica la rareza de las lesiones gastrointestinales proximales.5 La predilección del bacilo por el íleon se debe a que es una región de lumen estrecho y estasis relativa, lo que permite la digestión de la cápsula con un alto nivel de absorción y abundante tejido linfático. El microorganismo penetra en la mucosa alojándose posteriormente en la submucosa, coloniza las placas de Peyer e inicia una reacción inflamatoria con edema de serosa y submucosa, infiltración celular e hiperplasia linfática.1-5
Sus signos y síntomas no son específicos y pueden confundirse principalmente con enfermedad de Crohn, cáncer de colon o abdomen agudo. Es por este motivo que siempre debe considerarse la TBC como diagnóstico diferencial, principalmente en regiones endémicas para dicha infección o en pacientes de riesgo. Sin embargo, la inmunocompentencia del individuo no la descarta.6
Caso clínico
Se presenta el caso de una mujer de 53 años, procedente del medio rural. De sus antecedentes personales, se destacaba TBC pulmonar a los 10 años, para la cual recibió tratamiento (la paciente desconocía la duración y los antibióticos utilizados).
Fue derivada por diarrea crónica de 3 meses de evolución, dolor abdominal cólico difuso, fiebre de 38º C, sudoración nocturna y síndrome de repercusión general con adelgazamiento de 30 kg, anorexia y vómitos. En la esfera respiratoria, refería tos seca y disnea de esfuerzo clase funcional III de inicio insidioso.
De la paraclínica, se destacaba la presencia de anemia con hemoglobina de 8,7 mg/dl; la función renal y el ionograma eran normales. En lo nutricional, presentaba repercusión proteico calórica con hipoalbuminemia moderada-severa (albúmina 2,40 g/dl). El hepatograma era normal y los reactantes de fase aguda estaban elevados (proteína C reactiva > 150 mg/l y velocidad de eritrosedimentación de 70 mm).
De la pesquisa infecciosa, presentaba VIH, coprocultivo, coproparasitarios seriados y hemocultivos negativos, y las toxinas A y B para Clostridioides difficile también negativas. La dosificación de inmunoglobulina A estaba en rango y el anticuerpo transglutaminasa era negativo.
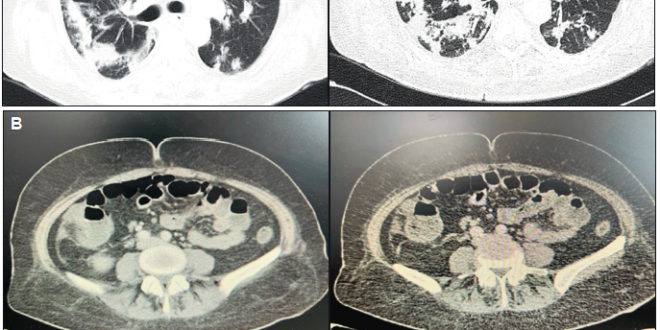
La radiografía de tórax evidenció un infiltrado pulmonar difuso, sin focos de consolidación. En la evolución agregó expectoración mucopurulenta, por lo que se inició piperacilina tazobactam por 2 semanas, sin respuesta clínica favorable. Ante la persistencia del síndrome febril prolongado con repercusión general, se solicitó TC de tórax, abdomen y pelvis, que evidenció a nivel torácico elementos sugestivos de infección parenquimatosa pulmonar (Figura 1A), destacándose a nivel abdominal un engrosamiento parietal del ciego con algunas adenomegalias (Figura 1B).
Figura 1. Tomografía de tórax y abdomen
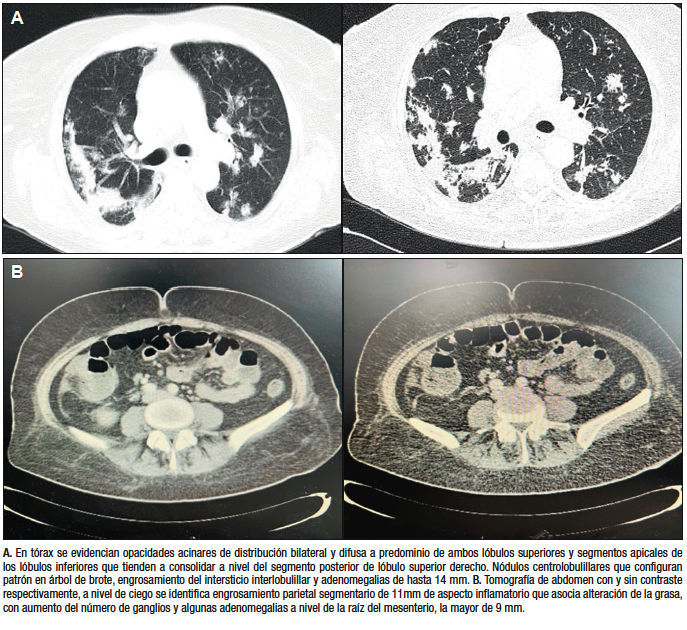
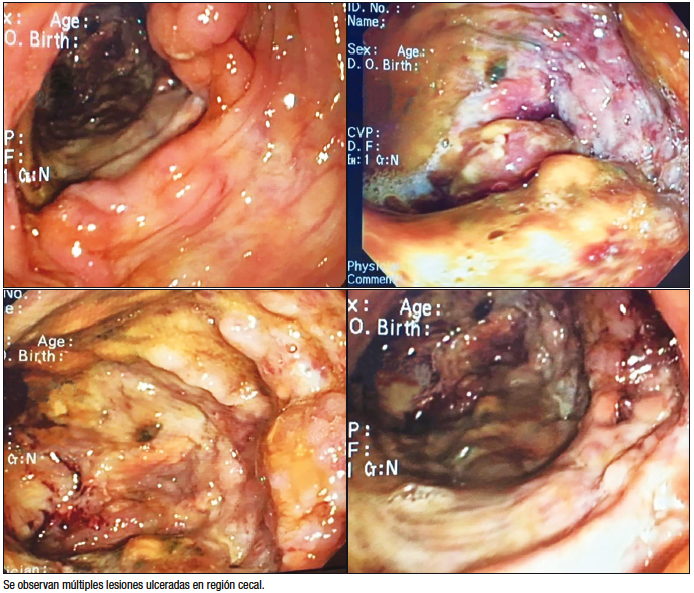
Se realizó fibrobroncoscopía con lavado broncoalveolar (LBA), estudio bacteriológico sin desarrollo y baciloscopías negativas. La VCC fue total, con regular preparación y se observaron en ciego úlceras profundas, cubiertas de fibrina con bordes elevados y con compromiso total del ciego. La válvula ileocecal se encontraba con mucosa edematosa y friable, por lo que no se exploró íleon. A nivel de colon ascendente, se observó una úlcera aislada de 15 mm con fondo recubierto de fibrina y bordes elevados (Figura 2). Se tomaron biopsias en formol y suero fisiológico para estudio histológico y baciloscopía, cultivo e inmunofenotipo.
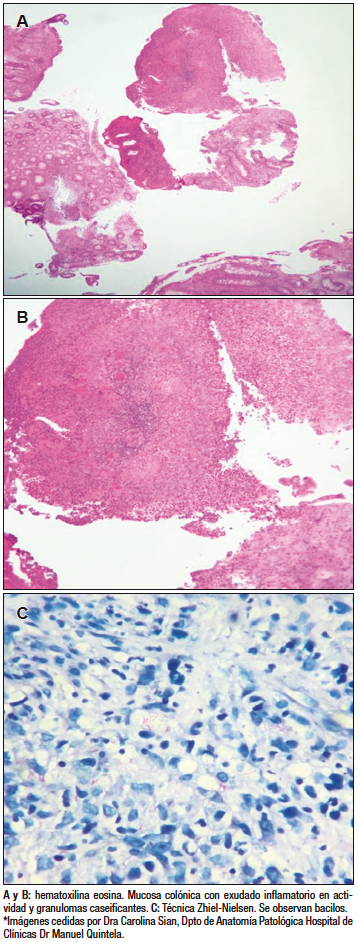
Valorada en equipo multidisciplinario, y con planteo de micobacteriosis, se decidió iniciar tratamiento empírico con pirazinamida, isoniazida, etambutol y rifampicina. La anatomía patológica informó la presencia de una colitis inespecífica con proceso granulomatoso, en actividad, ulcerada (Figuras 3A y 3B) y, con la técnica de Zhiel-Nielsen (Figura 3C), se observaron bacilos ácido-alcohol resistentes compatibles con Mycobacterium tuberculosis.
Figura 3. Anatomía patológica de biopsias colónicas
Se realizó un segundo LBA que fue positivo para Mycobacterium tuberculosis complex.
En la evolución agregó epigastralgia intensa y vómitos, con mala tolerancia al tratamiento anti-TBC por lo que se rotó la vía de administración a intravenosa. La VGC evidenció esofagitis erosiva grado C de la clasificación de Los Ángeles.
Posteriormente, presentó peoría del dolor abdominal, vómito fecaloideo de gran volumen asociado con un deterioro del estado general, con detención del tránsito digestivo para materias y gases y abolición de los ruidos hidroaéreos. Se realizó una radiografía de abdomen que mostró la imagen en pila de monedas. La exploración quirúrgica confirmó en última asa ileal una perforación secundaria a proceso inflamatorio subagudo. Se resecó la última asa ileal y ciego, con ileostomía a la Brooke en flanco derecho. Se confeccionó vacuum. Ingresó a centro de tratamiento intensivo, con deterioro progresivo, shock séptico y posterior fallecimiento.
Discusión
La presentación clínica y los hallazgos al examen físico de la TBC, ya sea pulmonar o extrapulmonar, no son específicos, por lo que clásicamente se ha conocido a la TBC como “la gran simuladora”. Los estados inmunitarios influyen en el desarrollo de la enfermedad y en su presentación clínica.4 La ausencia de elementos sugestivos de inmunocompromiso lleva a diagnósticos tardíos, como sucedió en el caso presentado. Se ha descrito que el diagnóstico de TBC intestinal se retrasa en al menos el 40% de los pacientes, postergando el inicio del tratamiento e incrementando la morbilidad y mortalidad.7 Gran parte de las infecciones por TBC en situaciones de inmunocompromiso se presentan en pacientes con VIH.1-4 Sin embargo, la mayoría de los casos ocurren en pacientes sin inmunosupresión asociada, como en el caso presentado. Se identifican factores de riesgo como diabetes mellitus, consumo de alcohol, tabaquismo, edad avanzada, contacto previo con M. tuberculosis, desnutrición y situación socioeconómica deficitaria.8 Se ha propuesto que pertenecer a zonas endémicas de alta prevalencia de la enfermedad también constituye un factor de riesgo.9 Esto se explica porque puede ocurrir una reactivación luego de la infección a edad temprana, con el posterior desarrollo de la enfermedad en la vida adulta.10 En el caso clínico presentado existe el antecedente de infección por TBC en la infancia. Aunque se desconocía la duración del tratamiento, los antibióticos utilizados y los controles posteriores, se podría catalogar a la infección actual como una recaída. Si bien no se puede descartar una reinfección, aleja este planteo la ausencia de inmunocompromiso y la presencia de factores de riesgo asociados. El compromiso intestinal, en este caso, es secundario a la TBC pulmonar activa confirmada en las imágenes.
En cuanto a la presentación clínica, el dolor abdominal es el síntoma más frecuente y se describe en entre el 70% y 100% de los casos.5 Es de tipo cólico e intermitente, como relataba la paciente y probablemente haya sido consecuencia de una obstrucción intestinal. Frecuentemente, se localiza en la fosa ilíaca derecha o la región periumbilical.5 El compromiso intestinal, en este caso, es secundario a la TBC pulmonar activa confirmada en las imágenes. La paciente presentaba diarrea, que es una forma de presentación habitual pero inespecífica. La anorexia y la pérdida de peso ocurren en la mayoría de las TBC intestinales, mientras que las náuseas, los vómitos y la fiebre ocurren en hasta 40%.8-11 La anemia es un hallazgo muy frecuente en pacientes con TBC, alcanzando una prevalencia del 62%.12 Se describe tanto como un factor de riesgo para el desarrollo de TBC, así como una consecuencia de esta. En la paciente podría explicarse por inflamación, malabsorción y ferropenia por hemorragia digestiva a través de las lesiones intestinales.5-12
En la endoscopía se pueden observar diferentes tipos de lesiones, que se clasifican como mucosas (infección activa) o cicatrizales (infección crónica o pasada). Dentro de las lesiones mucosas, se pueden encontrar úlceras de disposición transversal o circunferencial con o sin mucosa nodular, erosiones colónicas, pequeñas úlceras aftoides u erosiones en general limitadas al íleon.13
Las lesiones cicatrizales pueden evidenciarse como: válvula ileocecal con aspecto entreabierto o en boca de pez, deformidades pseudodiverticulares y áreas de mucosa atrófica con cicatrices fibrosas que pueden llevar a zonas de “estenosis en servilletero”.11-13 Los hallazgos endoscópicos que presentaba la paciente, con úlceras profundas a nivel de ciego, son compatibles con afectación intestinal mucosa y actividad en curso.
Los hallazgos endoscópicos no son patognomónicos y pueden asemejarse a muchas otras etiologías. Uno de los diferenciales más desafiantes es la enfermedad de Crohn.
Ambas pueden manifestarse de forma clínicamente similar, con los síntomas que presentaba la paciente: dolor abdominal de tipo cólico, diarrea crónica, anemia y repercusión general, por lo que fue uno de los principales diferenciales considerados. En la TBC intestinal, a nivel endoscópico las ulceraciones tienden a extenderse de manera transversal o circunferencial,13 como se evidenció en la paciente en la que se encontró una afección total y circunferencial del ciego. Las ulceraciones en Crohn, por su parte, son de aspecto longitudinal, parcheadas, con mucosa sana entre ellas,13 pero esto también se describe dentro de los hallazgos endoscópicos posibles en la TBC intestinal. Por lo tanto, la realización de la VCC con ileoscopía y obtención de biopsias es mandatoria para el diagnóstico en caso de sospecha.11-13
Se aconseja obtener al menos seis muestras dirigidas a lesiones visibles o de mucosa sana y deben de ser enviadas en formol para estudio histológico y en suero fisiológico para microbiológico y técnicas moleculares de PCR. En general, las biopsias presentan una baja sensibilidad para el diagnóstico de TBC, debido a que muchas veces son muestras superficiales, y los hallazgos típicos, como granulomas caseificantes, conglomerados de histiocitos y células gigantes de Langerhans, están localizados en la submucosa. Es por este motivo que se recomienda la realización de múltiples biopsias, en lo posible profundas para aumentar el rendimiento diagnóstico.14 La sensibilidad del estudio histológico es de alrededor del 68%, con una especificidad del 77,1%.15
En el caso clínico discutido se realizó baciloscopía, que sigue siendo la técnica más utilizada para el diagnóstico de TBC, por su sencillez de realización, bajo costo y rapidez en la obtención de resultados. Su especificidad es del 100% y la sensibilidad diagnóstica de 17,3% – 31%;15 y el método clásico de tinción en muestras histológicas es el de Ziehl-Neelsen, que identifica bacterias ácido alcohol resistentes como M. tuberculosis. Los hallazgos en las muestras analizadas de la paciente mediante Ziehl-Neelsen confirmaron la presencia de M. tuberculosis y, además, se informaron granulomas caseificantes con hematoxilina-eosina lo que permitió confirmar el diagnóstico de TBC intestinal.
El cultivo de M. tuberculosis es el gold standard para TBC intestinal, con una especificidad del 100% pero una muy baja sensibilidad, cercana al 10%.15
Otro método diagnóstico es el basado en técnicas moleculares por PCR. Se basa en la amplificación del genoma de M. tuberculosis y puede realizarse directo sobre la muestra biológica o sobre cultivos. En el caso clínico presentado, se realizó GeneXpert® MTB/RIF, una técnica automatizada de PCR en tiempo real que permite obtener resultados en 2 horas y, además, determinar la sensibilidad a isoniazida y rifampicina.15 Se analizaron muestras de LBA, que resultaron positivas para M. tuberculosis complex. La sensibilidad para muestras de biopsia de tejidos con GeneXpert es cercana al 80%-90%, y la especificidad es de 90%-100%;15 en muestras de materia fecal alcanzan una sensibilidad diagnóstica del 39,1% y una especificidad del 85,7%.15 Los análisis por PCR de biopsias de mucosa tomados por colonoscopía detectan el gen IS6110 presente únicamente en M. tuberculosis, con una especificidad del 95% y una sensibilidad del 30%, con un alto porcentaje de falsos negativos. La técnica de PCR-Múltiplex, capaz de detectar varias secuencias simultáneamente, obtiene mejores resultados, y alcanza una sensibilidad de aproximadamente el 80% y una especificidad cercana al 100%.15 La complicación más frecuente (hasta un 44%) es la obstrucción intestinal; le siguen la perforación, las fístulas y la hemorragia.16 La paciente, además de la hemorragia digestiva, presentó una obstrucción de tipo completa, la cual se topografió a nivel de intestino delgado al evidenciarse en la radiología de abdomen la imagen en pila de monedas. Se localiza frecuentemente a nivel de la válvula ileocecal, como presentaba la paciente,17 debido al tamaño de la luz del intestino delgado y el gran componente linfático, con inflamación, cicatrización y fibrosis a ese nivel. La laparotomía realizada no solo confirmó la estenosis en esta topografía, sino que certificó la perforación intestinal vinculada al proceso ulcerado infeccioso. La perforación es la segunda complicación más frecuente y alcanza una mortalidad aproximada del 30%.16 La cirugía también es un recurso complementario al tratamiento farmacológico en caso de complicaciones como hemorragia severa, obstrucción, formación de abscesos y fístulas grandes o refractarias. Existe evidencia no es concluyente sobre el beneficio y la seguridad de la dilatación endoscópica con balón aplicada específicamente a las estenosis de la válvula ileocecal y el colon por afectación de la TBC.5 Tanto la cirugía como las intervenciones endoscópicas deben adaptarse al sitio específico de la infección y al tipo de lesión involucrada.5
El tratamiento de la TBC intestinal es discutido; la mayoría de los expertos recomiendan una terapia similar a la utilizada para la TBC pulmonar activa. Esta consiste en la combinación de drogas con efecto bactericida y esterilizantes, en forma prolongada (no menor a 6 meses), continua y supervisada.9 Sin embargo, los datos sobre la duración del tratamiento siguen siendo controvertidos.5 Aunque algunos datos retrospectivos han sugerido que la terapia de corta duración (6 meses) es suficiente, muchos de los resultados son extrapolados de otros sitios de afectación extrapulmonar y no directamente de estudios que involucran casos de tuberculosis intestinal.5
En un estudio prospectivo aleatorizado con 197 pacientes con TBC abdominal, no se encontraron diferencias en cuanto a la respuesta clínica entre los 6 y 9 meses de tratamiento (91,5% vs. 90,8%).19 Los fármacos recomendados de primera línea son los utilizados en este caso: isoniazida, rifampicina, etambutol, pirazinamida.9 Los efectos adversos más frecuentemente reportados son náuseas, vómitos y hepatotoxicidad.9 El uso de medicamentos inyectables para TBC, en caso de afectación gastrointestinal grave, podría ser una opción a considerar, pero falta evidencia concluyente en este sentido.20
La hipoalbuminemia aumenta la morbimortalidad posquirúrgica al afectar negativamente la cicatrización de las heridas, aumentar el riesgo de infecciones y retrasar la recuperación. Además, puede explicar niveles séricos subterapéuticos de fármacos antituberculosos,18 que, sumado a la intolerancia digestiva alta que presentaba la paciente, contribuyeron al deterioro progresivo y posterior fallecimiento.
Conclusión
Se discutió el caso de una mujer de 53 años inmunocompetente con una TBC pulmonar e intestinal y complicaciones como desnutrición, oclusión y perforación intestinal. La relevancia de revisar este caso radica en que el diagnóstico debe sospecharse incluso en inmunocompetentes, y más si el paciente presentó el antecedente de la infección en el pasado. El mimetismo con otras enfermedades intestinales puede retrasar el diagnóstico, por lo que el debut con complicaciones es frecuente y el inicio del tratamiento no siempre puede evitar una mala evolución.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Bazzano B, Pontet Y, Arriola A y col. Tuberculosis intestinal en paciente inmunocompetente: reporte de un caso. Acta Gastroenterol Latinoam.2024;54(1):84-91. https://doi.org/10.52787/agl.v54i1.341
Referencias
- WHO. Global tuberculosis report 2022. Ginebra: World Health organization; 2022. Disponible en: https://www.who.int/teams/global-tuberculosis-programme/tb-reports/global-tuberculosis-report-2022
- chlaep.org.uy. [internet]. Datos nacionales, situación de tuberculosis en Uruguay 2021, sitio web disponible en: https://chlaep.org.uy/programa-nacional-de-control-de-tuberculosis/estadisticas/
- Miranda L, Lanz C, Nozar F. Tuberculosis abdominal. Rev. Méd. Urug. [Internet]. [citado 10 de mayo de 2021]. 2012;28(3):199-04. Disponible en: https://revista.rmu.org.uy/index.php/rmu/article/view/340
- Machuca I, Vidal E, de la Torre-Cisneros J. Tuberculosis en pacientes inmunodeprimidos. Enferm Infecc Microbiol Clin. 2018;36(6):366-74.
- Choi EH, Coyle WJ. Gastrointestinal Tuberculosis. Microbiol Spectr. 2016;4(6).
- Horvath KD, Whelan RL. Intestinal tuberculosis: return of an old disease. Am J Gastroenterol.1998;93(5):692-6.
- Muneef MA, Memish Z, Mahmoud SA, et al. Tuberculosis in the belly: a review of forty-six cases involving the gastrointestinal tract and peritoneum. Scand J Gastroenterol. 2001;36(5):528-32.
- Wu DC, Averbukh LD, Wu GY. Diagnostic and Therapeutic Strategies for Peritoneal Tuberculosis: A Review. J Clin Transl Hepatol. 2019;7(2):140-8.
- CHLAEP. Guía nacional para el manejo de la tuberculosis. Montevideo: CHLAEP, tercera edición, noviembre de 2016. Disponible en: https://chlaep.org.uy/wp-content/uploads/2018/08/guia-nacional-para-el-manejo.pdf
- Jehangir W, Khan R, Gil C, Baruiz-Creel M, Bandel G, Middleton JR, Sen P. Abdominal Tuberculosis: An Immigrant’s Disease in the United States. N Am J Med Sci. 2015;7(6):247-52.
- Bhansali SK. Abdominal tuberculosis. Experiences with 300 cases. Am J Gastroenterol. 1977;67(4):324-37. PMID: 879148.
- Barzegari S, Afshari M, Movahednia M, et al. Prevalence of anemia among patients with tuberculosis: A systematic review and meta-analysis. Indian J Tuberc. 2019;66(2):299-307.
- Sato S, Yao K, Yao T, Schlemper RJ, Matsui T, et al. Colonoscopy in the diagnosis of intestinal tuberculosis in asymptomatic patients. Gastrointest Endosc. 2004;59(3):362-8.
- Kirsch R, Pentecost M, Hall Pde M, Epstein DP, Watermeyer G, Friederich PW. Role of colonoscopic biopsy in distinguishing between Crohn’s disease and intestinal tuberculosis. J Clin Pathol. 2006;59(8):840-4.
- Maulahela H, Simadibrata M, Nelwan EJ, et al. Recent advances in the diagnosis of intestinal tuberculosis. BMC Gastroenterol. 2022;22(1):89.
- Sefr R, Rotterová P, Konecný J. Perforation peritonitis in primary intestinal tuberculosis. Dig Surg. 2001;18(6):475-9.
- Nguyen VH. Intestinal obstruction due to tuberculosis. Asian J Surg. 2002; 25(2):145-8.
- Bernhard J S, Bhatia G, Knauer C M. Gastrointestinal tuberculosis: an eighteen-patient experience and review. J Clin Gastroenterol.2000;30:397-402.
- Govind M, Uday G, Balakrishnan R, et al. Intermittent Directly Observed Therapy for Abdominal Tuberculosis: A Multicenter Randomized Controlled Trial Comparing 6 Months Versus 9 Months of Therapy. Clinical Infectious Diseases. 2015;61(5):750-7.
- Goldani L Z, Spessatto C O, Nunes DL, et al. Management of Severe Gastrointestinal Tuberculosis with Injectable Antituberculous Drugs. Trop Med Health.2015;43(3):191-4.
Correspondencia: Bruno Bazzano
Correo electrónico: brunob3b@gmail.com
Acta Gastroenterol Latinoam 2024;54(1):84-91
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE