Hui Jer Hwang,1 Ignacio Málaga,1 Cecilia Curvale,1 Sandra Basso,2 Analía Gubitosi,2 Martín Guidi,1 Julio De María,1 Raúl Matanó1
1 Servicio de Gastroenterología y Endoscopía. Hospital de Alta Complejidad El Cruce “Dr. Néstor Kirchner”. Florencio Varela, provincia de Buenos Aires, Argentina.
2 Sección de Patología Pancreática. Hospital de Gastroenterología “Dr. Carlos Bonorino Udaondo”. Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2019;49(3):192-202
Recibido: 31/07/2018 / Aprobado: 08/10/2018 / Publicado en www.actagastro.org el 17/09/2019
Resumen
En la Argentina el cáncer de páncreas es la cuarta causa de muerte por neoplasia maligna. Debido a que en estadios tempranos es potencialmente curable, existe gran interés en su pesquisa. El Consorcio Internacional de Pesquisa del Cáncer de Páncreas recomienda la detección temprana cuando el riesgo es 5 veces mayor al de la población general o el riesgo acumulado es > 5 %. Los métodos de diagnóstico recomendados son la ultrasonografía endoscópica y la resonancia magnética nuclear anualmente. Se inició un estudio prospectivo, multicéntrico y observacional durante 2017 en el que se incluyeron en forma consecutiva sujetos con factores de riesgo aumentado para cáncer de páncreas. Se realizó: historia clínica detallada, USE con o sin punción aspirativa con aguja fina, RMN de abdomen y colangiopancreatografía por resonancia. Se obtuvieron los siguientes resultados en 39 pacientes. En el grupo de pancreatitis crónica la USE diagnosticó pancreatitis crónica sugestiva en 5 pacientes (23,8 %); pancreatitis crónica calcificante en 15 (61,9 %), en 2 de estos 15 pacientes se efectuó PAAF guiada por USE por masa cefálica pancreática con resultado negativo para cáncer o neoplasia maligna; un paciente con tumor mucinoso papilar intraductal y otro con un quiste de característica indeterminada. En el grupo de cáncer pancreático familiar se diagnosticó a un paciente con quiste de páncreas indeterminado. En conclusión, en el primer año de este programa de pesquisa, se identificó una lesión premaligna y se descartó cáncer en dos pacientes con masa pancreática asociada a pancreatitis crónica. La continuidad del programa de pesquisa es esencial en los pacientes de alto riesgo.
Palabras claves. Cáncer de páncreas, pesquisa, ecoendoscopía, resonancia magnética nuclear.
Screening of premalignant lesions and early pancreatic cancer in a high-risk population
Summary
In Argentina, pancreatic cancer is the fourth cause of death due to malignancy. Because in early stage it is potentially curable, there is great interest in their research. The International Pancreatic Cancer Research Consortium recommends early detection when the risk is 5 times higher than the general population or the cumulative risk is > 5%. The methods recommended for the diagnosis are Endosonography endoscopic ultrasound (EUS) and nuclear magnetic image magnetic resonance imaging annually. A prospective, multicenter and observational study was carried out during 2017 in which subjects with increased risk factors for pancreatic cancer were included consecutively. We performed a detailed clinical record, EUS with or without fine needle aspiration (FNA) and magnetic resonance cholangiopancreatography. The following results were obtained in 39 patients. In the chronic pancreatitis group, EUS diagnosed suggestive chronic pancreatitis in 5 patients (23.8%); calcifying chronic pancreatitis in 15 (61.9%), 2 of these with cephalic pancreatic mass, therefore FNA was performed with negative result for malignant neoplasia; one patient with intraductal papillary mucinous neoplasm and another with a cyst of indeterminate characteristic. In the group of familial pancreatic cancer, a patient with an indeterminate pancreatic cyst was diagnosed. In conclusion, in the first year of this screening program a premalignant lesion was diagnosed, and neoplasia was ruled out in two patients with pancreatic mass associated with chronic pancreatitis. The continuity of the research program is essential in high-risk patients.
Key words. Pancreatic cancer, screening, Eco-endoscopy, nuclear magnetic resonance.
Abreviaturas
CP-RMN: colangiopancreatografía por resonancia.
PAAF: punción aspirativa con aguja fina.
PanIN: neoplasia intraepitelial pancreática.
RMN: resonancia magnética nuclear.
TC: tomografía computada.
TMPI: tumor mucinoso papilar intraductal.
USE: ultrasonografía endoscópica.
El adenocarcinoma de páncreas es uno de los tumores malignos más letales. La tasa de mortalidad no se ha modificado en las últimas décadas, con una sobrevida a los 5 años del 6%.1 Aun cuando la lesión es pequeña (< 2 cm) y resecable, la sobrevida a los 5 años es del 39,2 %.2 En la Argentina es la cuarta causa de muerte por neoplasia maligna después del cáncer de pulmón, colon-recto y mama.3
Debido a que el cáncer de páncreas (CP) detectado en estadio temprano (T1: < 2 cm) es potencialmente curable, existe gran interés en la pesquisa. Sin embargo, su incidencia en la población general es baja (8 casos/105 habitantes en hombres y 5 casos/105 habitantes en mujeres, ajustados por edad en la Argentina)3 por lo que no se recomienda pesquisa en la población general. En la última década, el mayor conocimiento sobre las lesiones premalignas y los avances tecnológicos para detectar lesiones tempranas ha generado gran interés en la búsqueda de este tumor en individuos con riesgo aumentado. Tanto en los Estados Unidos como en países europeos iniciaron programas de detección temprana hace ya una década.4-11
Los pacientes de alto riesgo presentan historia familiar y factores genéticos predisponentes. El Consorcio Internacional de Pesquisa del Cáncer de Páncreas (International Cancer of the Pancreas Screening Consortium Summit -CAPS-) recomienda la detección temprana cuando el riesgo es 5 veces mayor a la población general o el riesgo acumulado de por vida es > 5%.4
En la Tabla 1 se presentan los factores de riesgo hereditarios con el riesgo relativo (RR) estimado y el riesgo acumulado de por vida para desarrollar CP. La principal herramienta usada para cuantificar el riesgo en esta neoplasia maligna es el interrogatorio sobre el antecedente familiar de CP.12-17
La presencia de mutaciones en las células germinales de los genes: BRCA2, PALB2, p16, STK11, ATM, PRSS1 y genes relacionados con el síndrome de Lynch están asociados con un incremento significativo del riesgo de CP.18-26
La pancreatitis crónica de diversas etiologías también es un factor de riesgo para el CP con un RR de entre 2,3 y 18,5.27, 28, 41
Los programas de prevención de CP en poblaciones de alto riesgo reportaron una prevalencia de neoplasias de entre 5 y 23%.5-12 El tumor mucinoso papilar intraductal tipo 2 (TMPI) fue la patología más frecuentemente hallada, seguida por masas sólidas (neoplasia intraepitelial pancreática de bajo y alto grado (PanIN) y el adenocarcinoma ductal pancreático temprano).4, 29
Los métodos de diagnóstico por imágenes utilizados para la búsqueda fueron la ultrasonografía endoscópica (USE), la resonancia magnética nuclear (RMN) y la colangiopancreatografía por resonancia (CP-RMN) con o sin infusión de secretina. Estos métodos tuvieron mayor precisión y sensibilidad que la tomografía computada (TC) multicorte y la ecografía abdominal.31, 40
Tabla 1. Factores de riesgo hereditario, riesgo relativo estimado y riesgo acumulado de por vida para desarrollar cáncer de páncreas (CP).

Es controvertido el rol de la punción aspirativa con aguja fina (PAAF) guiada por USE debido a la baja sensibilidad de la citología en lesiones quísticas y sólidas pequeñas.32 Sin embargo, no existe actualmente ningún otro método que la supere.
La decisión de resección pancreática ante el hallazgo de una lesión preneoplásica o tumor maligno debe ser realizada de manera multidisciplinaria.
El objetivo de nuestro estudio fue realizar un programa de pesquisa de CP en la población de alto riesgo. Presentamos los hallazgos del primer año de experiencia.
Material y métodos
Estudio prospectivo, multicéntrico y observacional en el que se incluyó en forma consecutiva a sujetos con factores de riesgo aumentado para CP. Las instituciones participantes fueron: el Servicio de Gastroenterología y Endoscopía del Hospital de Alta Complejidad El Cruce “Dr. Néstor Kirchner” y la Sección de Patología Pancreática del Hospital de Gastroenterología “Dr. Carlos Bonorino Udaondo”. Se enrolaron pacientes desde el 1 de enero hasta el 31 de diciembre de 2017.
Criterios de inclusión: 1) antecedente familiar de CP en 2 o más familiares con al menos uno de ellos de primer grado con CP familiar; 2) un familiar de primer grado < 50 años con CP; 3) síndrome de Peutz Jeghers (SPJ); 4) síndrome de Lynch y uno o más familiares con CP; 5) pancreatitis hereditaria; 6) pancreatitis crónica de cualquier etiología.
Se excluyó a los sujetos con antecedente de CP o cirugía pancreática previa.
A los pacientes enrolados se les realizó: historia clínica detallada, confección del familigrama con antecedentes familiares de CP y de otros tipos de tumores, USE con sedación y PAAF (de lesiones quísticas o sólidas), RMN de abdomen y CP-RMN.
La USE se efectuó en el Hospital El Cruce con sedación. Se utilizó un ecoendoscopio lineal (EG-530 UT, procesador SU 7000, Fujinon, Japón) y las punciones se efectuaron con aguja fina de 22 gauge con técnica estándar.
No existe consenso con respecto a la edad en la que debería iniciarse la pesquisa en cada uno de los grupos de riesgo. Nosotros decidimos, en base a la bibliografía, iniciar la búsqueda 10 años antes de la edad del familiar más joven con CP o a partir de los 40 años (lo que suceda en primera instancia), excepto pacientes con SPJ que deben chequearse a partir de los 25 años.
La descripción endosonográfica de la pancreatitis crónica se basó en los criterios de Rosemont y se clasificó como: pancreatitis crónica consistente, sugestiva, indeterminada y normal.39
El estudio fue aprobado por los Comités de Investigación y Ética de las instituciones participantes.
Análisis estadístico
Los datos se registraron en una Tabla 2 de Excel y para el procesamiento se utilizó el programa SPSS versión 20.0. Los resultados se presentaron como porcentaje, media, mediana, intervalo de confianza 95%, desvío estándar o rango según corresponda.
Tabla 2. Datos demográficos, factores de riesgo y marcador tumoral.
Resultados
Datos demográficos
En total fueron enrolados 39 pacientes. La mediana de edad fue de 52,4 años (rango: 18-83), 20 (51,3%) fueron de sexo masculino. Los factores de riesgo por los que ingresaron a la pesquisa fueron: 21 pacientes (53,8%) por pancreatitis crónica, 17 (43,6 %) por antecedente familiar de CP y 1 (2,6%) por SPJ.
En el grupo de pacientes con CP familiar, 10 (58,8%) sujetos tenían antecedente de un familiar de primer grado que se diagnosticó antes de los 50 años y 10 (58,8%) tenían 2 o más familiares de primer y/o segundo grado comprometidos.
En el grupo de pacientes con pancreatitis crónica, 7 manifestaron síntomas de dolor abdominal, 4 pérdidas de peso, 3 diarrea crónica, 1 síndrome coledociano, 1 anemia y 7 sujetos tenían antecedentes de episodios de pancreatitis recurrente.
Respecto de los hábitos tóxicos 10 (47,6%) pacientes manifestaron ingesta crónica de bebidas alcohólicas y 12 (57,1%) tabaquismo activo o previo.
Respecto de los pacientes con antecedente de CP familiar, la mayoría (12 pacientes) eran asintomáticos, 5 tenían dolor abdominal recurrente con diagnóstico clínico de dispepsia funcional y/o síndrome de intestino irritable y 1 paciente con antecedente de pancreatitis recurrente.
En este grupo, 2 pacientes manifestaron ingesta crónica de bebidas alcohólicas y 7 tabaquismo activo o previo.
La paciente con SPJ era asintomática y no tenía antecedente familiar de CP.
Hallazgos de la USE y RMN
A todos los pacientes se les realizó USE y en 24 de 39 sujetos se realizó RMN abdominal con CP-RMN.
En el grupo de pancreatitis crónica, la USE encontró signos sugestivos de inflamación crónica (principalmente bandas y áreas hiperecogénicas sin calcificación, dilatación del conducto pancreático principal y sus ramas, engrosamiento de la pared del conducto) en 5 pacientes (23,8%) y pancreatitis crónica calcificante en 15 (61,9%).
Dos pacientes de este último grupo tenían una masa cefálica de 3 y 3,5 cm de diámetro por lo que se realizaron PAAF con resultados citológicos negativos para neoplasia maligna en ambos casos y se consideraron como masa inflamatoria asociada a pancreatitis crónica.
Durante el seguimiento de 6 meses en estos 2 pacientes, no hubo empeoramiento en sus condiciones clínicas como tampoco cambios en las imágenes. Un paciente tenía atrofia total del páncreas.
En otro caso de pancreatitis crónica calcificante se detectó un quiste unilocular de páncreas con pared fina de 4 cm de diámetro, ubicado en la cabeza del órgano y comunicado con el conducto de Wirsung; se realizó PAAF obteniendo un líquido de característica mucinoso y filante con citología compatible con TMPI tipo 2.
La CP-RMN confirmó el hallazgo y se derivó a cirugía para realizar duodenopancreatectomía cefálica. En otro paciente se detectó un quiste pequeño de 5 mm de característica indeterminada.
En relación con los hallazgos de la RMN en este mismo grupo, 11 pacientes tenían signos de pancreatitis crónica (dilatación del conducto pancreático y de sus ramas, presencia de litiasis intraductal, parénquima heterogéneo, atrofia y calcificaciones), 2 sujetos evidenciaron masa cefálica pancreática con pancreatitis crónica, coincidiendo con los hallazgos de la USE descripta previamente cuyas punciones fueron negativas para neoplasia maligna, y 1 con TMPI tipo 2, de 4 cm de diámetro, que también coincidió con el hallazgo de la USE.
En un caso la RMN fue normal.
En el grupo de CP familiar, la USE visualizó esteatosis pancreática en 2 pacientes, pancreatitis crónica sugestiva en otros 2 y quiste de páncreas de 5 mm de característica indeterminada (que se confirmó en la RMN) en 1.
En 12 sujetos la USE resultó normal. La RMN fue normal en 8 casos.
La Tabla 3 muestra la correlación entre los hallazgos de la USE y la RMN de cada subgrupo de pacientes.
En la Tabla 4 se describen los hallazgos de la PAAF.
En 25 sujetos se estudió el marcador tumoral sérico CA 19-9.
En 2/25 los valores fueron 2-3 veces superiores al valor límite superior normal (37 U/ml), ambos casos con diagnóstico de pancreatitis crónica.
La paciente con SPJ tuvo resultados normales tanto en la USE como en la RMN.
En las Figuras 1 a 4 se visualizan ejemplos de los hallazgos de CP-RMN y USE.
Tabla 3. Hallazgos de USE y RMN en los tres grupos de riesgo.

Tabla 4. Hallazgos de la PAAF guiado por USE.

Figura 1. CP-RMN de una paciente con pancreatitis crónica: dilatación del conducto pancreático principal y de sus ramas laterales.
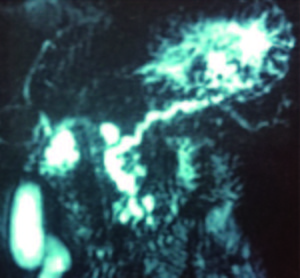
Figura 2. Signo ultrasonográfico de pancreatitis crónica calcificante: dilatación del conducto pancreático principal (5 mm en el cuerpo) y litiasis en su interior (3 mm). CP: conducto pancreático. #1 y 2: litos intraductales.

Figura 3. Signo ultrasonográfico de pancreatitis crónica: parénquima heterogéneo con bandas hiperecogénicas confluentes con aspecto de panal de abeja.

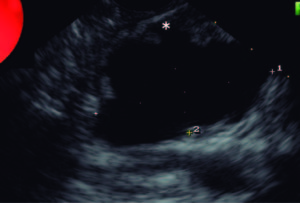
Figura 4. Quiste de cabeza pancreática de 4 cm de diámetro comunicado con el conducto de Wirsung (TMPI tipo 2). PAAF positiva para células epiteliales neoplásicas mucinosas. *Rama del conducto de Wirsung que se comunica con el quiste.
Discusión
El objetivo de la pesquisa del CP es el diagnóstico precoz de los tumores malignos o los potencialmente malignos. El TMPI es la patología preneoplásica más frecuentemente hallada seguido por PanIN.4, 31, 41
La incidencia del CP en la población general es relativamente baja por lo que no sería costo/efectivo realizar pesquisa de forma generalizada. Se debería concentrar los recursos en pacientes con riesgo elevado, que incluye patologías hereditarias y procesos inflamatorios crónicos que incrementan la oncogénesis del páncreas.
En nuestro trabajo incluimos a pacientes con pancreatitis crónica, cuyo riesgo de desarrollar cáncer de páncreas es variable, estimándose un RR de entre 2,3 y 18,5.27, 28, 41
Se ha demostrado que el diagnóstico de CP en estos pacientes es más difícil debido a limitaciones de la USE, con disminución de la precisión diagnóstica debido a diversos motivos, como la presencia de calcificaciones con sombra acústica posterior, la heterogeneidad del parénquima o masa inflamatoria que pueden “ocultar” lesiones tumorales pequeñas.
Se recomienda la punción de la masa o zona sospechosa con aguja fina guiada por USE. Con el advenimiento de nuevas tecnologías como la elastografía por USE podría diferenciarse una masa inflamatoria de una masa neoplásica.38
En relación con el hallazgo de lesiones sólidas, nosotros diagnosticamos 2 pacientes con masa en la cabeza pancreática visualizada tanto en la USE como en la RMN.
En ambos se realizaron PAAF que descartaron lesión neoplásica, y durante el seguimiento por 6 meses presentaron una evolución benigna. En un paciente con pancreatitis crónica calcificante se detectó una imagen quística unilocular de 4 cm en la cabeza pancreática.
Los diagnósticos diferenciales ante este hallazgo son pseudoquiste (secundario a obstrucción y ruptura de los ductos con formación de colecciones pancreáticas y/o peripancreáticas) o tumor quístico.
En esta situación, la PAAF fue esencial para distinguir ambas entidades que tienen diferentes pronóstico y conducta terapéutica. Nosotros realizamos punción bajo guía ecoendoscópica y confirmamos en la citología el diagnóstico de TMPI, por lo que se indicó tratamiento quirúrgico.
En nuestra población estudiada, ningún paciente rechazó la indicación de USE como tampoco hubo complicaciones relacionadas con el procedimiento.
También es de gran valor la utilización de la RMN como estudio complementario. La RMN con C-RMN es muy sensible en la detección de tumor quístico pancreático, lesión sólida, estenosis o dilatación del conducto pancreático y sus ramas, y además es útil para diferenciar entre cambios ductales de la pancreatitis crónica y la neoplasia mucinosa papilar intraductal de conducto principal o mixta.
En el grupo de pacientes con CP familiar, no detectamos lesiones neoplásicas o preneoplásicas, solo 2 pacientes con pancreatitis crónica sugestiva y un paciente con una lesión quística pequeña de característica indeterminada. En los casos con riesgo de CP familiar, la probabilidad de desarrollar neoplasia pancreática va incrementándose en relación con el mayor número de familiares afectados, familiares de primer grado y/o menores de 50 años con cáncer de páncreas.
En nuestra cohorte 2 pacientes tenían tres familiares de primer y/o segundo grado con CP, 8 casos con dos familiares comprometidos y 7 con un familiar de primer grado diagnosticado antes de los 50 años.
El SPJ es una patología producida por una mutación genética que predispone a un riesgo muy elevado de CP (Tabla 1) y también en otros órganos, por lo que se requiere realizar pesquisa en forma temprana. En nuestro estudio, la única paciente que tuvimos presentó resultados normales en ambos métodos (USE y RMN).
En relación con las limitaciones de nuestro trabajo, existieron dificultades para acceder a la realización de la RMN, y por tanto hubo una menor cantidad de pacientes con este estudio realizado.
Acorde a las recomendaciones de CAPS, 4 la pesquisa con USE y RMN anual es muy costosa para nuestro sistema de salud. Una opción a considerar es realizar USE y RMN en forma alternada cada año, estrategia posible si los resultados de la pesquisa fueran normales. Esta propuesta requiere validación y consenso.
Para que la pesquisa sea efectiva es importante que los pacientes cumplan los intervalos sugeridos para la realización de los estudios. Además, se necesita concientización y una amplia difusión de los programas de búsqueda tanto en los profesionales de la salud como en la población.
En conclusión, nuestro primer año de pesquisa de cáncer de páncreas con USE y RMN no detectó ninguna lesión neoplásica maligna. Identificamos una lesión premaligna (TMPI) y se descartó neoplasia en dos pacientes con masa pancreática asociada a pancreatitis crónica.
La continuidad en el programa de búsqueda es esencial para los pacientes de alto riesgo.
Conflicto de intereses. Los autores declaran no tener ningún conflicto de intereses.
Sostén financiero. Este proyecto de investigación cuenta con el apoyo económico de la Sociedad Argentina de Gastroenterología, a través de la Beca para Investigación en Gastroenterología 2016.
References
- Rahib L, Smith B, Aizenberg R, Rosenzweig A, Fleshman J, Matrisian L. Projecting Cancer Incidence and Deaths to 2030: The Unexpected Burden of Thyroid, Liver and Pancreas Cancers in the United States. Cancer Res 2014; 74: 2913-2921.
- van Roessel S, Kasumova GG, Verheij J, Najarian RM, Maggino L, de Pastena M, Malleo G, Marchegiani G, Salvia R, Ng SC, de Geus SW, Lof S, Giovinazzo F, van Dam JL, Kent TS, Busch OR, van Eijck CH, Koerkamp BG, Abu Hilal M, Bassi C, Tseng JF, Besselink MG. International Validation of the Eighth Edition of the American Joint Committee on Cancer (AJCC) TNM Staging System in Patients With Resected Pancreatic Cancer. JAMA Surg 2018; 153: e183617.
- Análisis de la situación del cáncer en Argentina. Publicado por el Instituto Nacional del Cáncer y el Ministerio de Salud de la Nación, 2014. Disponible en: http://www.msal.gov.ar/inc/index. php/acerca-del-cancer/estadisticas.
- Canto MI, Harinck F, Hruban RH, Offerhaus GJ, Poley JW, Kamel I, Nio Y, Schulick RS, Bassi C, Kluijt I, Levy MJ, Chak A, Fockens P, Goggins M, Bruno M; International Cancer of Pancreas Screening (CAPS) Consortium. International Cancer of the Pancreas Screening (CAPS) Consortium summit on the management of patients with increased risk for familial pancreatic cancer. Gut 2013; 62: 339-347.
- Al-Sukhni W, Borgida A, Rothenmund H, Holter S, Semotiuk K, Grant R, Wilson S, Moore M, Narod S, Jhaveri K, Haider MA, Gallinger S. Screening for Pancreatic Cancer in a High-Risk Cohort: An Eight-Year Experience. J Gastrointest Surg 2011; 16: 771-783.
- Canto MI, Goggins M, Hruban RH, Petersen GM, Giardiello FM, Yeo C, Fishman EK, Brune K, Axilbund J, Griffin C, Ali S, Richman J, Jagannath S, Kantsevoy SV, Kalloo AN. Screening for early pancreatic neoplasia in high-risk individuals: a prospective controlled study. Clin Gastroenterol Hepatol 2006; 4: 766-781.
- Canto MI, Goggins M, Yeo CJ, Griffin C, Axilbund JE, Brune K, Ali SZ, Jagannath S, Petersen GM, Fishman EK, Piantadosi S, Giardiello FM, Hruban RH. Screening for pancreatic neoplasia in high-risk individuals. Clin Gastro Hepatol 2004; 2: 606-621.
- Langer P, Kann PH, Fendrich V, Habbe N, Schneider M, Sina M, Slater EP, Heverhagen JT, Gress TM, Rothmund M, Bartsch DK. Five years of prospective screening of high-risk individuals from families with familial pancreatic cancer. Gut 2009; 58: 1410-1418.
- Ludwig E, Olson SH, Bayuga S, Simon J, Schattner MA, Gerdes H, Allen PJ, Jarnagin WR, Kurtz RC. Feasibility and yield of screening in relatives from familial pancreatic cancer families. Am J Gastroenterol 2011; 106: 946-954.
- Poley JW, Kluijt I, Gouma DJ, Harinck F, Wagner A, Aalfs C, van Eijck CH, Cats A, Kuipers EJ, Nio Y, Fockens P, Bruno MJ. The yield of first-time endoscopic ultrasonography in screening individuals at a high risk of developing pancreatic cancer. Am J Gastroenterol 2009; 104: 2175-2181.
- Verna EC, Hwang C, Stevens PD, Rotterdam H, Stavropoulos SN, Sy CD, Prince MA, Chung WK, Fine RL, Chabot JA, Frucht H. Pancreatic Cancer Screening in a Prospective Cohort of High-Risk Patients: A Comprehensive Strategy of Imaging and Genetics. Clin Cancer Res 2010; 16: 5028-5037.
- Klein AP, Brune KA, Petersen GM, Goggins M, Tersmette AC, Offerhaus GJ, Griffin C, Cameron JL, Yeo CJ, Kern S, Hruban RH. Prospective risk of pancreatic cancer in familial pancreatic cancer kindreds. Cancer Res 2004; 64: 2634-2638.
- Grover S, Syngal S. Hereditary Pancreatic Cancer. Gastroenterology 2010; 139: 1076-1080.
- Brune KA, Lau B, Palmisano E, Canto M, Goggins MG, Hruban RH, Klein AP. Importance of age of onset in pancreatic cancer kindreds. J Natl Cancer Inst 2010; 102: 119-126.
- Hruban RH, Canto MI, Goggins M, Schulick R, Klein AP. Update on familial pancreatic cancer. Adv Surg 2010; 44: 293-311.
- Giardiello FM, Brensinger JD, Tersmette AC, Goodman SN, Petersen GM, Booker SV, Cruz-Correa M, Offerhaus JA. Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology 2000; 119: 1447-1453.
- van Lier MG, Wagner A, Mathus-Vliegen EM, Kuipers EJ, Steyerberg EW, van Leerdam ME. High cancer risk in Peutz-Jeghers syndrome: a systematic review and surveillance recommendations. Am J Gastroenterol 2010; 105: 1258-1264.
- Couch FJ, Johnson MR, Rabe KG, Brune K, de Andrade M, Goggins M, Rothenmund H, Gallinger S, Klein A, Petersen GM, Hruban RH. The prevalence of BRCA2 mutations in familial pancreatic cancer. Cancer Epidemiol Biomarkers Prev 2007; 16: 342-346.
- Hahn SA, Greenhalf B, Ellis I, Sina-Frey M, Rieder H, Korte B, Gerdes B, Kress R, Ziegler A, Raeburn JA, Campra D, Grützmann R, Rehder H, Rothmund M, Schmiegel W, Neoptolemos JP, Bartsch DK. BRCA2 germline mutations in familial pancreatic carcinoma. J Natl Cancer Inst 2003; 95: 214-221.
- Murphy KM, Brune KA, Griffin C, Sollenberger JE, Petersen GM, Bansal R, Hruban RH, Kern SE. Evaluation of candidate genes MAP2K4, MADH4, ACVR1B and BRCA2 in familial pancreatic cancer: deleterious BRCA2 mutations in 17%. Cancer Res 2002; 62: 3789-3793.
- van Asperen CJ, Brohet RM, Meijers-Heijboer EJ, Hoogerbrugge N, Verhoef S, Vasen HF, Ausems MG, Menko FH, Gómez García EB, Klijn JG, Hogervorst FB, van Houwelingen JC, van’t Veer LJ, Rookus MA, van Leeuwen FE; Netherlands Collaborative Group on Hereditary Breast Cancer (HEBON). Cancer risks in BRCA2 families: estimates for sites other than breast and ovary. J Med Genet 2005; 42: 711-719.
- Lynch HT, Fusaro RM, Lynch JF, Brand R. Pancreatic cancer and the FAMMM syndrome. Fam Cancer 2008; 7: 103-112.
- De Snoo FA, Bishop DT, Bergman W, van Leeuwen I, van der Drift C, van Nieuwpoort FA, Out-Luiting CJ, Vasen HF, ter Huurne JA, Frants RR, Willemze R, Breuning MH, Gruis NA. Increased risk of cancer other than melanoma in CDKN2A founder mutation (p16-Leiden)-positive melanoma families. Clin Cancer Res 2008; 14: 7151-7157.
- Kastrinos F, Mukherjee B, Tayob N, Wang F, Sparr J, Raymond VM, Bandipalliam P, Stoffel EM, Gruber SB, Syngal S. Risk of pancreatic cancer in families with Lynch syndrome. JAMA 2009; 302: 1790-1795.
- Lowenfels AB, Maisonneuve P, DiMagno EP, Elitsur Y, Gates LK Jr, Perrault J, Whitcomb DC. Hereditary pancreatitis and the risk of pancreatic cancer. International Hereditary Pancreatitis Study Group. J Natl Cancer Inst 1997; 89: 442-446.
- Vitone LJ, Greenhalf W, Howes NR, Neoptolemos JP. Hereditary pancreatitis and secondary screening for early pancreatic cancer. Rocz Akad Med Bialymst 2005; 50: 73-84.
- Bansal P, Sonnenberg A. Pancreatitis is a risk factor for pancreatic cancer. Gastroenterology 1995; 109: 247-251.
- Talamini G, Falconi M, Bassi C, Sartori N, Salvia R, Caldiron E, Frulloni L, Di Francesco V, Vaona B, Bovo P, Vantini I, Pederzoli P, Cavallini G. Incidence of cancer in the course of chronic pancreatitis. Am J Gastroenterol 1999; 94: 1253-1260.
- Brentnall TA, Bronner MP, Byrd DR, Haggitt RC, Kimmey MB. Early diagnosis and treatment of pancreatic dysplasia in patients with a family history of pancreatic cancer. Ann Intern Med 1999; 131: 247-255.
- Kimmey MB, Bronner MP, Byrd DR, Brentnall TA. Screening and surveillance for hereditary pancreatic cancer. Gastrointest Endosc 2002; 56: S82-S86.
- Canto MI, Hruban RH, Fishman EK, Kamel IR, Schulick R, Zhang Z, Topazian M, Takahashi N, Fletcher J, Petersen G, Klein AP, Axilbund J, Griffin C, Syngal S, Saltzman JR, Mortele KJ, Lee J, Tamm E, Vikram R, Bhosale P, Margolis D, Farrell J, Goggins M; American Cancer of the Pancreas Screening (CAPS) Consortium. Frequent Detection of Pancreatic Lesions in Asymptomatic High-Risk Individuals. Gastroenterology 2012; 142: 796-804.
- Tanaka M, Fernández-del Castillo C, Adsay V, Chari S, Falconi M, Jang JY, Kimura W, Levy P, Pitman MB, Schmidt CM, Shimizu M, Wolfgang CL, Yamaguchi K, Yamao K; International Association of Pancreatology. International consensus guidelines 2012 for the management of IPMN and MCN of the páncreas. Pancreatology 2012; 12: 183-197.
- “World Health Organization Classification of Tumors”. Pathology & Genetics. Tumors of the digestive system 2000: 74.
- American Society of Clinical Oncology Policy Statement Update: Genetic Testing for Cancer Susceptibility. J Clin Oncol 2003; 21: 2397-2406.
- Giardiello FM, Brensinger JD, Petersen GM. AGA technical review on hereditary colorectal cancer and genetic testing. Gastroenterology 2001; 21: 198-213.
- Howes N, Lerch MM, Greenhalf W, Stocken DD, Ellis I, Simon P, Truninger K, Ammann R, Cavallini G, Charnley RM, Uomo G, Delhaye M, Spicak J, Drumm B, Jansen J, Mountford R, Whitcomb DC, Neoptolemos JP; European Registry of Hereditary Pancreatitis and Pancreatic Cancer (EUROPAC). Clinical and genetic characteristics of hereditary pancreatitis in Europe. Clin Gastroenterol Hepatol 2004; 2: 252-261.
- Singer MV, Gyr K, Sarles H. Report of the Second International Symposium on the Classification of Pancreatitis in Marseille, France, March 28-30, 1984. Gastroenterology 1985; 89: 683- 685.
- Iglesias-García J, Domínguez-Muñoz E, Castiñeira-Alvariño M, Luaces-Regueira M, Lariño-Noia J. Quantitative elastography associated with endoscopic ultrasound for the diagnosis of chronic pancreatitis. Endoscopy 2013; 45: 781-788.
- Catalano MF, Sahai A, Levy M, Romagnuolo J, Wiersema M, Brugge W, Freeman M, Yamao K, Canto M, Hernández LV. EUS-based criteria for the diagnosis of chronic pancreatitis: the Rosemont classification. Gastrointest Endosc 2009; 69: 1251- 1261.
- McAllister F, Montiel MF, Uberoi GS, Uberoi AS, Maitra A, Bhutani MS. Current Status and Future Directions for Screening Patients at High Risk for Pancreatic Cancer. Gastroenterol Hepatol (NY) 2017; 13: 268-275.
- Wang W, Liao Z, Li G, Li Z-S, Chen J, Zhan X-B, Wang L-W, Liu F, Hu L-H, Guo Y, Zou D-W, Jin Z-D. Incidence of Pancreatic Cancer in Chinese Patients with Chronic Pancreatitis. Pancreatology 2011; 11: 16-23.
Correspondencia: Hui Jer Hwang
Avenida Calchaquí 5401. Florencio Varela, provincia de Buenos Aires, Argentina
Tel.: 011-1560519039
Correo electrónico: hwanghuijer@yahoo.com.ar
Acta Gastroenterol Latinoam 2019;49(3): 192-202
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE





