Gloria Fernández-Esparrach, Rodrigo Garcés-Durán
Unidad de Endoscopía, Servicio de Gastroenterología, ICMDM, Hospital Clínic, Barcelona. IDIBAPS. CIBEREHD.
Universidad de Barcelona, Cataluña, España.
Acta Gastroenterol Latinoam 2020;50:58-61
Introducción
La carcinogénesis gástrica se asocia a la infección por Helicobacter pylori y se produce a través de lesiones histológicas precursoras de cáncer gástrico (CG), según lo que conocemos como cascada de Correa: gastritis atrófica, metaplasia intestinal (MI) y displasia. Los pacientes con estas lesiones podrían ser candidatos a medidas dirigidas a reducir el riesgo de CG. Entre ellas se destacan la erradicación de Helicobacter pylori, la vigilancia mediante endoscopía digestiva alta y la resección de las lesiones con alto riesgo de malignización. En esta revisión vamos a centrarnos en la MI: cómo mejorar su diagnóstico y establecer su extensión. El seguimiento de la MI sigue siendo muy controvertido y las guías de las diferentes sociedades recomiendan estrategias diferentes, por lo que no vamos a entrar en esta discusión que merecería todo un capítulo a parte.
La MI se define como la sustitución del epitelio glandular y foveolar de la mucosa gástrica por epitelio de morfología intestinal. La clasificación más difundida en la práctica diaria es la que diferencia dos tipos de MI: 1) MI completa (MIC) en la que la mucosa gástrica adquiere el fenotipo propio de la mucosa del intestino delgado; y 2) MI incompleta (MII) en la que la mucosa gástrica tendría un aspecto parecido al colon.
¿Cuál es el riesgo real de CG en un paciente con MI?
En una revisión sistemática, se identificaron y analizaron seis estudios de incidencia de CG en pacientes con gastritis crónica atrófica (GCA) (n = 19749), siete estudios en MI (n = 18800) y dos estudios en GCA + MI con diagnóstico basado en histología. Los resultados observaron una incidencia de CG en GCA de 0,53-15,24 x 1000 personas/año con mayor incidencia en Asia, y una incidencia de CG en MI de 0,38-17,08 x 1000 personas/año con mayor incidencia en los Estados Unidos. Sin embargo, se observaron poca calidad y mucha heterogeneidad en estos estudios. Si comparamos estas cifras con las reportadas en el esófago de Barrett, el riesgo de degeneración a cáncer del esófago de Barrett sin displasia es de 5,98 x 1000 personas/año, y cuando presenta displasia de bajo grado es de 16,98 x 1000 personas/año.
Según el tipo de MI, se observó mayor incidencia de CG en caso de MII: 5,76 x 1000 personas/año con MII, 2,76 x 1000 personas/año con MIC y 3,09 x 1000 personas/año globalmente en caso de MI. En un estudio de seguimiento de doce meses a 639 pacientes se observó un mayor riesgo asociado de CG sobre todo en caso de MII: x 2,50 (MIC), x 6,42 (MII), x 4,17 (MI), siendo el riesgo 2,57 superior en la MII vs. la MIC.
¿Cómo mejorar el diagnóstico? Técnica endoscópica y otrosa
Para mejorar el diagnóstico endoscópico de la MI existen 3 claves: 1) Conocimiento: no solo del aspecto que tiene la mucosa normal y la patológica sino también del riesgo individual que tiene cada paciente en función de sus antecedentes (estratificación del riesgo); 2) tener una buena técnica de exploración endoscópica y 3) la experiencia médica del endoscopista.ptina.
Conocimiento
Existen una serie de factores de riesgo para el desarrollo de CG y, por tanto, para la presentación de lesiones preneoplásicas como la MI:
• Geográficos: áreas como el este de Asia, Europa del este y Rusia, y América Latina (área andina) tienen una mayor prevalencia de CG.
• Étnicos: aparte de los asiáticos, los americanos africanos, asiáticos y latinos tienen mayor riesgo.
• Otros: edad avanzada, sexo masculino, historia familiar de CG, infección por Helicobacter pylori, ingesta elevada de sal, tabaco y la GCA y la MI se asocian a un mayor riesgo de CG.
Por lo tanto, ante un paciente que proceda de alguna de estas regiones o tenga algunos de los factores mencionados, se debe estar más alerta porque presenta mayor riesgo de MI.
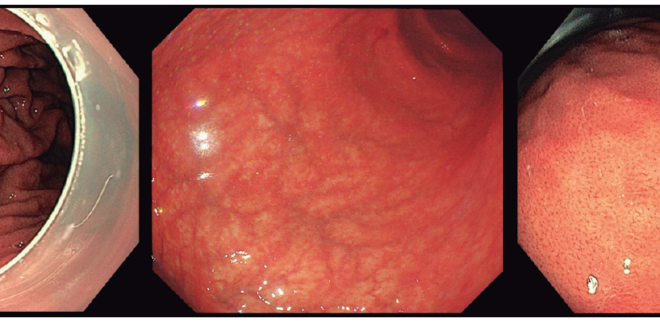
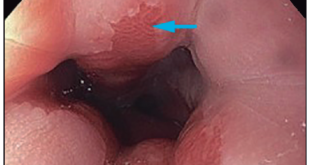
También es importante tener en cuenta la distribución de las lesiones premalignas incipientes en la mucosa gástrica, ya que la localización del CG varía en función de algunas características como el tamaño o el tipo. Así, los casos de cáncer gástrico diminuto y pequeño se hallan predominantemente en el antro mientras que los casos de cáncer indiferenciado se hallan predominantemente en la curvatura mayor del cuerpo gástrico.En cuanto al conocimiento del aspecto de una mucosa normal (Figura 1), su reconocimiento nos permitirá reducir el tiempo endoscópico y evitar la utilización de técnicas complementarias para el diagnóstico de lesiones premalignas. La presencia de RAC (del inglés: regular arrangement of collecting venules), a nivel de la curvatura gástrica menor (Figura 2), permite el diagnóstico endoscópico de mucosa normal Helicobacter pylori negativo con una sensibilidad y valor predictivo negativos de 100%.
Figura 1. De izquierda a derecha puede verse una imagen de mucosa normal con pliegues conservados, una mucosa atrófica sin pliegues mucosos y con patrón vascular realzado en la submucosa y, finalmente, una imagen de patrón RAC característico

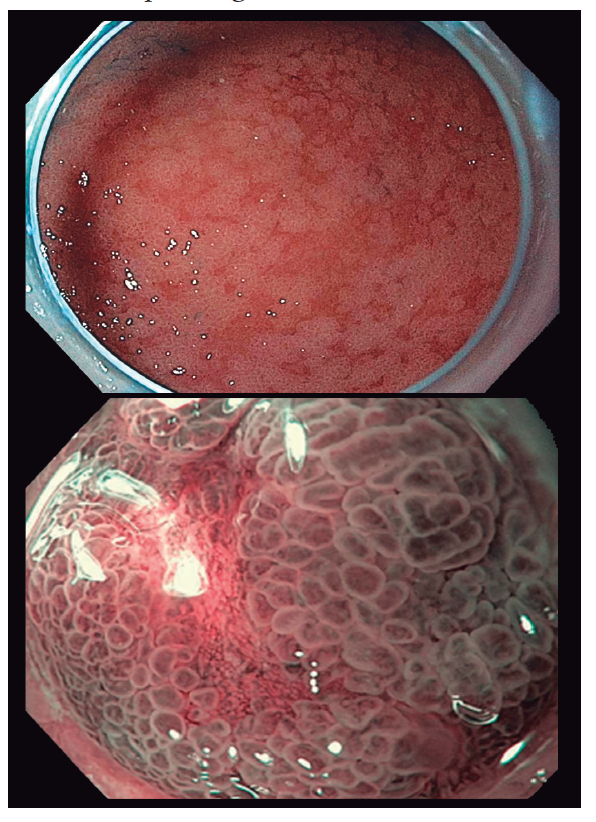
Figura 2. Imágenes características de MI: presencia de áreas más pálidas en el antro que, a mayor aumento, presentan un aspecto más alargado y tubular del patrón glandular
La identificación de signos endoscópicos de atrofia de la mucosa gástrica (transparencia de vasos submucosos a nivel del fundus gástrico y disminución de pliegues en la curvatura mayor) y de metaplasia intestinal permite identificar a los pacientes que requerirán técnicas endoscópicas avanzadas para la detección de lesiones. La utilización de cromoendoscopía mediante NBI (del inglés: narrow band imaging) o de luz blanca (LCI o BLI) permitirá la identificación de áreas sospechosas de metaplasia intestinal gástrica y orientar las biopsias.
Técnica endoscópica
Una sedación adecuada permite una mejor tolerancia en el paciente. La administración de una preparación con mucolíticos y antiespumantes (250 ml de agua estéril, 400 mg de N-acetilcisteina y 20 mg simeticona) y el uso de agentes anticolinérgicos permiten una mejor visualización de la mucosa. Es importante evitar las áreas ciegas; para ello es necesario una pared gástrica bien distendida, la limpieza del moco y burbujas con bomba de agua y antiespumante, y el mapeo visual de todo el estómago. La utilización de técnicas de endoscopía avanzada (NBI y otras técnicas de cromoendoscopía) permite la detección de pequeñas lesiones premalignas, sobre todo en aquellos pacientes con factores de riesgo. La duración de la exploración debe ser de al menos ocho minutos. Dedicar al menos este tiempo permite una mayor detección de lesiones de riesgo (x 2,5) y mayor detección de CG y displasia (x 3,42). Los tipos de endoscopio también permiten optimizar la técnica, ya que la asociación de la imagen de alta definición y cromoendoscopía mejora el diagnóstico de lesiones premalignas gástricas y tumores gástricos superficiales respecto de la luz blanca.
Valoración de la extensión
La extensión de la MI tiene un impacto sobre el riesgo de desarrollar CG. En el estudio de Vannella con 300 pacientes con GCA se realizaron seis biopsias de antro y cuerpo en el seguimiento anual mediante gastroscopía. Durante el seguimiento se identificaron quince casos de cáncer gástrico en catorce pacientes y los factores de riesgo observados en la curva de regresión Cox fueron los siguientes: la edad mayor a 50 años (HR 8,8), la presencia de pangastritis atrófica (HR 4,5) y la presencia de MI severa en el cuerpo (HR 4,0). La intensidad de MI y su extensión se valorará mediante cromoendoscopía y la realización de biopsias.
Existe una clasificación endoscópica para la extensión de MI con NBI que puntúa su presencia o ausencia en cinco áreas diferentes de la mucosa. El sistema de puntuación obtenido, EGGIM, puntúa entre 0 (normal sin áreas de MI) y 10 (extensa MI en todas las áreas de la mucosa gástrica). Con esta clasificación se obtiene una exactitud diagnóstica del 94% (mientras que con luz blanca es del 83%). El beneficio del EGGIM es mayor en los estadios OLGIM III/IV. La clasificación endoscópica EGGIM se ha validado muy recientemente y el punto de corte óptimo para detectar las lesiones OLGIM III/IV es un EGGIM > 4.
¿Cómo biopsiar?
El estudio histológico de las muestras obtenidas mediante biopsia endoscópica es el patrón oro del diagnóstico de la MI. La MI tiene una distribución topográfica que tenemos que tener en cuenta a la hora de tomar biopsias. Existen cuatro tipos principales de distribución de la MI: focal, antral, de Magenstrasse y difuso. Los tipos Magenstrasse y difuso presentan mayor riesgo de desarrollo de CG.
Un mayor número de biopsias permite el aumento de la eficacia diagnóstica de atrofia, MI y displasia. Por este motivo el protocolo de Sydney recomienda la realización de cinco biopsias gástricas: dos a nivel del antro (una en curvatura mayor y otra en curvatura menor), una de la incisura y dos del cuerpo (una en curvatura menor y otra en curvatura mayor). La utilidad de añadir una biopsia de la incisura es un tema controvertido. Aunque esta localización ha sido considerada un área de aparición temprana de atrofia o MI, con mayor prevalencia de lesiones premalignas y más fiable para el diagnóstico de atrofia y MI que el antro o el cuerpo, otros estudios concluyen que las biopsias de la incisura añaden poca información a las obtenidas del cuerpo y antro. En el estudio de Rugge con 504 pacientes Helicobacter pylori positivos se observó que un 46% de ellos se hubiese perdido sin biopsia de la incisura.Y en otro estudio con 272 pacientes consecutivos se observó en 152 de ellos mucosa normal en incisura, un 14% con Helicobacter pylori positivo, un 24% con MI y un 13% con atrofia. Aunque la biopsia rutinaria de la incisura aporta poca información clínica adicional, si se utiliza el sistema de estadificación histopatológica OLGIM es necesario realizar una biopsia de la incisura.
La evidencia actual sugiere que las biopsias guiadas por cromoendoscopía, convencional o virtual, combinadas con el mapeo aleatorio son el método ideal para detectar la MI. En el estudio de Buxbaum se observó una mayor detección de MI en los pacientes en los que se realizaron biopsias guiadas por NBI o mapeo respecto del grupo de pacientes HD-WL. También se observó que la combinación de NBI y mapeo permite una detección de metaplasia intestinal hasta del 100% con respecto a las otras combinaciones NBI + HD-WL (70,6%) y mapeo + HD-WL (82,4%). Las guías europeas recomiendan por lo tanto la utilización de cromoendoscopía virtual, con o sin magnificación, para la detección de lesiones gástricas premalignas y la realización de biopsias guiadas en el estadiaje de GCA, MI y tumores superficiales.
Bibliografía recomendada
- Spence AD, Cardwell CR, McMenamin ÚC, et al. Adenocarcinoma risk in gastric atrophy and intestinal metaplasia: A systematic review. BMC Gastroenterol 2017; 17: 157.
- González CA, Sanz-Anquela JM, Companioni O, et al. Incomplete type of intestinal metaplasia has the highest risk to progress to gastric cancer: Results of the Spanish follow-up multicenter study. J Gastroenterol Hepatol 2016; 31: 953-988.
- Garcés-durán R, García-rodríguez A, Córdova H, et al. Association between a regular arrangement of collecting venules and absence of Helicobacter pylori infection in a European population. Gastrointest Endosc 2019; 90: 461-466.
- Teh JL, Tan JR, Lau LJF, et al. Longer examination time improves detection of gastric cancer during diagnostic upper gastrointestinal endoscopy. Clin Gastroenterol Hepatol 2015; 13: 480-487.
- Vannella L, Lahner E, Osborn J, Annibale B. Systematic review: Gastric cancer incidence in pernicious anaemia. Aliment Pharmacol Ther 2013; 37: 375-382.
- Pimentel-Nunes P, Libanio D, Lage J, et al. A multicenter prospective study of the real-time use of narrow-band imaging in the diagnosis of premalignant gastric conditions and lesions. Endoscopy 2016; 48: 723-730.
- Price AB. The Sydney System: histological division. J Gastroenterol Hepatol [Internet]. 2019; 6 (3): 209-222. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/1912431
- Rugge M, Cassaro M, Pennelli G, et al. Atrophic gastritis: Pathology and endoscopy in the reversibility assessment. Gut 2003; 52: 1387-1388.
- Eriksson NK, Färkkilä MA, Voutilainen ME, et al. The clinical value of taking routine biopsies from the incisura angularis during gastroscopy. Endoscopy 2005; 37: 532-536.
- Buxbaum JL, Hormozdi D, Dinis-Ribeiro M, et al. Narrow-band imaging versus white light versus mapping biopsy for gastric intestinal metaplasia: a prospective blinded trial. In: Gastrointestinal Endoscopy 2017; 86: 857-865.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE