Miriam Galich
Médica Patóloga. Jefa de Patología del Centro Integral de Gastroenterología.
Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2020;50:55-57
Introducción
El esófago normal presenta una mucosa constituida por epitelio pavimentoso que consta de quince capas celulares. La capa basal representa el 15% del espesor epitelial.
Las biopsias endoscópicas en la gran mayoría de los casos solo constan de mucosa.
Las dos patologías esofágicas más relevantes son: esofagitis por reflujo y esófago de Barrett.
Esofagitis por reflujo
Se define como el contenido que refluye al esófago y que genera síntomas molestos y/o complicaciones esofágicas o extraesofágicas (Consenso Montreal 2006).
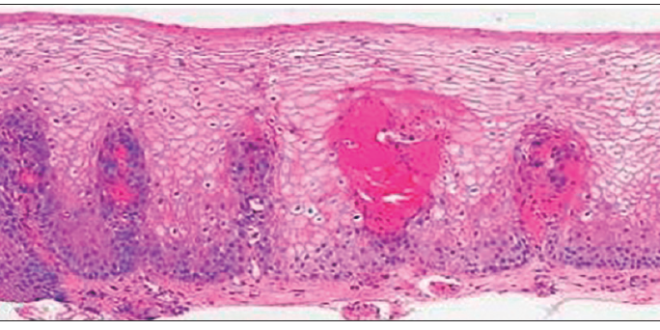
Los marcadores histológicos de esofagitis por reflujo son: dilatación de espacios intercelulares, presencia de células balonizadas con núcleos picnóticos en el epitelio escamoso, vasos sanguíneos superficializados, dilatados y congestivos intrapapilares, elongación de las papilas que supere 2/3 del espesor epitelial, hiperplasia de la capa basal superior al 20% del espesor epitelial, acantosis que se define como incremento del número de capas celulares, más de 15 o más de 0,4 mm y presencia de uno hasta siete eosinófilos por corte histológico con ubicación peripapilar, lo que marca la diferencia con la esofagitis eosinofílica que presenta más de veinte y microabscesos superficiales de eosinófilos (Figura 1).
Figura 1. Esofagitis por reflujo 4X H&E. Hallazgos histológicos: Acantosis, hiperplasia de la basal, superficialización de las papilas, vasos papilares dilatados y congestivos

Esófago de Barrett
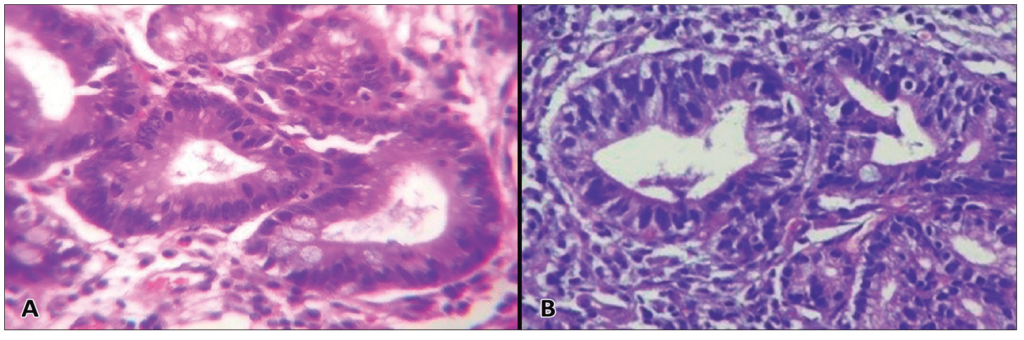
El esófago de Barrett, de acuerdo con los criterios del American College of Gastroenterology, consiste en metaplasia intestinal con células caliciformes en el examen histológico (Figura 2).
Figura 2. A: Epitelio híbrido HE 10X. Epitelio Escamoso en la base y Columnar a nivel superficial. B: Epitelio de Barrett HE 4X. Presencia de criptas irregulares revestidas por epitelio de tipo columnar especializado con células caliciformes. C: Barrett, Alcian Blue a pH 2,5 20X. Células Caliciformes teñidas de Azul, positivas con Alcian Blue a pH 2,5 (productoras de sialomucinas, baja probabilidad de progresión a displasia y adenocarcinoma)

Dicha metaplasia debe medir 1 cm por lo menos y ser visible endoscópicamente para el diagnóstico de Barrett.El esófago de Barrett se origina en un epitelio cilíndrico multiestratificado, un epitelio híbrido (escamoso-columnar), biológicamente activo y fenotípicamente similar al Barrett.
Riesgo de progresión en esófago de Barrett
De los pacientes que tienen Barrett solo un pequeño porcentaje progresa a adenocarcinoma.
La detección de displasia (neoplasia intraepitelial) es por el momento el único marcador de incremento del riesgo de progresión a cáncer.
El diagnóstico de displasia tiene limitaciones debidas a la variabilidad interobservador y el error de muestreo (pocas muestras).
La variabilidad interobservador es mucho más elevada cuando el diagnóstico lo hacen patólogos generales, no expertos en patología gastrointestinal.
Protocolo de Seattle
Muestreo de biopsias de cuatro cuadrantes utilizando el protocolo de Seattle, cada 2 cm en pacientes sin displasia y cada 1 cm en pacientes con displasia previa.
Esta técnica es aplicable tanto para esófago de Barrett de segmento corto (< 3 cm) como de segmento largo (≥ 3 cm).
Aun siguiendo este protocolo, solo es posible tomar muestras del 6% del área del Barrett.
Histológicamente, el esófago Barrett se clasifica en: Barrett sin displasia, indefinido para displasia, displasia de bajo grado, displasia de alto grado, carcinoma intramucoso y adenocarcinoma invasivo.
Para la displasia de cualquier grado, las biopsias deben ser revisadas por dos patólogos, al menos uno de los cuales debe ser un patólogo gastrointestinal especializado, debido a la variabilidad interobservador en la interpretación.
La variabilidad interobservador puede reducirse con el apoyo de técnicas complementarias, por ejemplocitometría de flujo para evaluar aneuploidía.
Los resultados más fidedignos se dan con material en fresco, pero puede hacerse sobre tacos en parafina, con resultados variables.
Otra metodología de estudio es el FISH (hibridización in situ con fluorescencia) sobre material obtenido por citología esofágica.
Gene signature (Firma Genética) es un estudio mediante microarray de 90 genes, de los cuales c-MYC sería el más importante factor de transcripción, regulando 29 del total de estos 90 genes. La desregulación de c-MYC está involucrada en la carcinogénesis de Barrett y podría ser muy útil en los casos de “indefinido para displasia”, pero esto aún no está probado completamente.
Displasia asociada a Barrett
La capacidad de progresión neoplásica de un Barrett es un proceso multifactorial que incluye: aberraciones cromosómicas, eventos genéticos y epigenéticos y factores ambientales.
La neoplasia intraepitelial o displasia se define como un epitelio neoplásico confinado a la membrana basal y se caracteriza por una alteración arquitectural y por anomalías citológicas.
Se clasifican en: displasia (neoplasia intraepitelial) de bajo y alto grado (esta es sinónimo de carcinoma in situ).
Se denomina carcinoma intramucoso cuando las células rompen la membrana basal e infiltran la lámina propia (Figura 3 ).
Figura 3. A: Displasia de bajo grado, HE 10X. Glándulas con tendencia a la fusión y presencia de pseudoestratificación nuclear limitada al tercio inferior del epitelio. Los núcleos son hipercromáticos, algunos con nucléolos pequeños. Coexisten aísladas figuras mitóticas limitadas al sector descripto y algunas células caliciformes. B: Displasia de alto grado, HE 10X. Glándulas en general fusionadas con atipía citológica que llega al polo apical de las células con presencia de figuras mitóticas y ausencia de células caliciformes
El riesgo de progresión a adenocarcinoma en displasia de bajo grado es del 3-15% y en displasia de alto grado es del 16-61%.
Uno de los marcadores inmunohistoquímicos de proliferación celular es el Ki-67, un antígeno nuclear presente activamente en todas las fases del ciclo celular que se encuentra incrementado en las displasias, marca en toda la cripta en tanto que en procesos reactivos, se observa inmunotinción predominante en la base de la cripta.
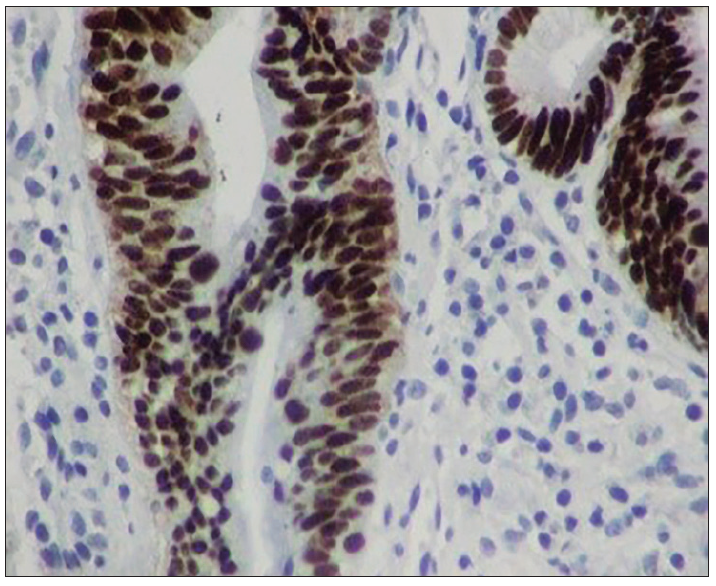
En tanto la p53 es la más frecuentemente mutada. Se llama el guardián del genoma. Su función principal es proteger a la célula cuando hay un daño, sobreexpresándose; lo primero que hace es detener el ciclo celular en G1-S, permitiendo que las enzimas de reparación puedan actuar. Si las enzimas de reparación actúan bien y reparan el daño, se levanta la barrera y las células pueden continuar su ciclo (Figura 4 ).
Figura 4. Técnicas inmunohistoquímicas p53 positiva en displasia de alto grado. La inmunomarcación es nuclear y se evidencia en toda la glándula (tinción marrón)
Conclusiones
El diagnóstico de esófago de Barrett con displasia asociada sigue siendo un punto controversial ya que está sujeto a la variabilidad interobservador, variabilidad que disminuye con el conocimiento, entrenamiento y experiencia en patología gastrointestinal y con la utilización de métodos más objetivos tales como citometría de flujo para medir aneuploidía o la Firma Genética (Gene Signature) para determinar mediante microarrays los genes involucrados en el desarrollo de displasia y adenocarcinoma en un Barrett.
Si bien el valor de la p53 aún no ha sido avalado para apoyar el diagnóstico de displasias, su determinación mediante técnicas inmunohistoquímicas podría ayudar a aumentar el nivel de acuerdo entre patólogos, al categorizar indefinidos vs. displasias.
Bibliografía recomendada
- Kahrilas PJ, Bredenoord AJ, Fox M, et al. The Chicago classification of esophageal motility disorders, v3.0. Neurogastroenterol Motil 2015; 27 (2): 160-174.
- Wilkinson JM, Halland M. Esophageal Motility Disorders. Am Fam Physician 2020; 102 (5): 291-296.
- Agrawal A, Hila A, Tutuian R, Mainie I, Castell DO. Clinical relevance of the nutcracker esophagus: suggested revision of criteria for diagnosis. J Clin Gastroenterol 2006; 40 (6): 504-509.
- Pandolfino JE, Fox M, Bredenoord A, Kahrilas PJ. High-resolution manometry in clinical practice: utilizing pressure topography to classify oesophageal motility abnormalities. Neurogastroenterol Motil 2009; 21 (8): 796-806.
- Roman S, Pandolfino JE, Chen J, Boris L, Luger D, Kahrilas PJ. Phenotypes and clinical context of hypercontractility in high-resolution esophageal pressure topography (EPT). Am J Gastroenterol 2012; 107 (1): 37.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE