Mónica P. Marino ID
Sección Hepatología.
Hospital C. Bonorino Udaondo. Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2023;53(1):28-37
Recibido: 09/03/2023 / Aceptado: 28/03/2023 / Publicado online el 30/03/2023 / https://doi.org/10.52787/agl.v53i1.309
Resumen
La hepatitis autoinmune es una patología poco frecuente que se caracteriza por presentar alteraciones bioquímicas e histológicas. Se conocen 2 subtipos: el tipo I afecta a niños y adultos y el tipo II afecta casi exclusivamente a los niños. Hasta el momento no existen criterios diagnósticos específicos y es considerada como una patología de exclusión, aunque existen ciertas alteraciones en el laboratorio y la histología relacionadas con esta entidad. Puede cursar en forma asintomática o sintomática y el tratamiento de elección es la inmunosupresión. El uso de métodos no invasivos como la elastografía puede ser útil en el monitoreo del seguimiento, tanto para evaluar el tratamiento como para prevenir complicaciones. En su evolución puede presentar fibrosis hepática avanzada, cirrosis, requerimiento de trasplante hepático o muerte por insuficiencia hepática. El objetivo de esta revisión es presentar las últimas publicaciones relacionadas a la hepatitis autoinmune.
Palabras claves. Hepatitis autoinmune, hepatitis de interfase, emperipolesis.
Autoimmune Hepatitis: Up-to-Date Concepts
Summary
Autoimmune hepatitis is a rare pathology characterized by biochemical and histological alterations. Two subtypes are known: type I affects children and adults, and type II affects almost exclusively children. So far there are no specific diagnostic criteria and it is considered a pathology of exclusion, although there are certain laboratory and histological alterations related to this entity. It can be asymptomatic or symptomatic, and the treatment of choice is immunosuppression. The use of non-invasive methods such as elastography can be useful in follow-up surveillance, both to evaluate treatment and to prevent complications. In its evolution it can present advanced hepatic fibrosis, cirrhosis, requirement of liver transplantation and death due to hepatic insuffieciency. The aim of this review is to present the latest evidence related to autoimmune hepatitis.
Keywords. Autoimmune hepatitis, interphase hepatitis, emperipolesis.
Abreviaturas
HAI: Hepatitis autoinmune.
IHA: Insuficiencia hepática aguda.
HAI I: Hepatitis autoinmune tipo I.
HAI II: Hepatitis autoinmune tipo II.
ANA: Anticuerpos antinucleares.
ASMA: Anticuerpos anti-músculo liso.
LKM1: Anticuerpos anti-microsomales tipo 1.
LC1: Anticuerpo anti-citosol hepático tipo 1.
sn HAI: Hepatitis autoinmune seronegativa.
TH: Trasplante hepático.
HLA: Antígenos leucocitarios humanos.
AST: Aspartato aminotransferasa.
ALT: Alanina aminotransferasa.
pANCA: Anticuerpo anticitoplasma de neutrófilo.
anti-ASGPR: Anticuerpo anti-rreceptor de asialoglicoproteína.
LC1: Anticuerpo citosólico antihepático 1.
SLA/LP: Antígeno/anticuerpo hígado-páncreas.
LKM-3: Anticuerpo microsomal-anti-hígado-riñón 3.
UGT: Anti-UDP-glucuronosiltransferasa.
CEP: Colangitis esclerosante primaria.
NAFLD: Hígado graso no alcohólico.
TE: Elastografía transitoria.
HTP: Hipertensión portal.
LSM: Liver stiffness measure.
CAP: Atenuación controlada.
AZA: Azatioprina.
TPMT: Tiopurina metil trasferasa.
MMF: Micofenolato mofetil.
CsA: Ciclosporina.
TAC: Tacrolimus.
ULN: Límite superior normal (Por upper limit of normal).
Introducción
La HAI es una enfermedad hepática rara con múltiples formas de presentación. Se caracteriza por la presencia de autoanticuerpos, hipergammaglobulinemia y anomalías en la biopsia hepática. No tiene características patognomónicas, la patogénesis es en parte desconocida, y permanece como un diagnóstico de exclusión.
Los pacientes pueden ser asintomáticos, estar crónicamente enfermos o presentar IHA.
Se conocen 2 entidades: la HAI I y la HAI II. La HAI I es mucho más común y afecta tanto a niños como a adultos, mientras que la HAI II es principalmente una enfermedad pediátrica. La HAI I se caracteriza por presentar ANA y/o ASMA positivos, mientras que HAI II se caracteriza por tener LKM1 y/o anti-hígado-riñón positivos y LC1. Además, hasta el 20% de los casos de HAI son negativos para los autoanticuerpos ANA, ASMA y LKM1, a pesar de la presencia de otros rasgos característicos de la HAI seronegativa (sn HAI).1-3
La progresión a fibrosis hepática avanzada, cirrosis, muerte por insuficiencia hepática o trasplante hepático (TH) son resultados posibles. El tratamiento con agentes inmunosupresores ha salvado vidas, pero los regímenes de tratamiento pueden estar, a largo plazo, asociados con efectos secundarios graves y de eficacia variable.4
El objetivo de esta revisión es presentar las últimas publicaciones relacionadas con la hepatitis autoinmune.
Epidemiología y diagnóstico
La HAI afecta a todas las edades y razas, con picos de edad entre los 10 y los 30 años y entre los 40 y los 60 años; se subdivide en HAI I y HAI II. El predominio femenino ocurre en adultos (71%-95% mujeres) y niños (60%-76% niñas).
Al igual que con otras enfermedades autoinmunes, las asociaciones genéticas primarias en la HAI involucran loci del complejo mayor de histocompatibilidad. Las asociaciones de HLA se agrupan dentro del haplotipo ancestral 8.1 conservado, que define los alelos portados por la mayoría de los caucásicos y resulta del desequilibrio de ligamiento dentro de los loci HLAde clase I, II y III: HLA-A1, Cw7, B8, TNFAB*a2b3, TNFN*S, C2*C, Bf*s, C4A*Q0, C4B*1, DRB1*03:01, DRB1*04:01, DRB1*13:01, DRB3*01:01, DQA1*05:01, DQB1*02:01.4
El diagnóstico de HAI se basa en anomalías histológicas (hepatitis de interfase), hallazgos clínicos y de laboratorio característicos (niveles elevados de AST y ALT séricas y aumento de la concentración sérica de IgG) y la presencia de uno o más autoanticuerpos característicos.4
Revisión de laboratorio
El método de referencia para evaluar los autoanticuerpos relacionados con el hígado sigue siendo la inmunofluorescencia indirecta en tejido triple de roedores, es decir, hígado, riñón y estómago.
La dilución de suero inicial convencional es 1:10. En adultos, el punto de corte de positividad es de 1:40, mientras que en niños y adolescentes se consideran positivos títulos de 1:20 para ANA y ASMA y de 1:10 para anti-LKM1 y anti-LC1, ya que los autoanticuerpos son raros en sujetos sanos a edades tempranas.5
Los autoanticuerpos típicos utilizados para el diagnóstico serológico de la HAI son el ANA, el ASMA, anti-actina y el LKM-1. Los anticuerpos atípicos que pueden ser de utilidad diagnóstica en los casos de HAI con anticuerpos típicos negativos, y son pANCA, ASGPR, LC1, anticuerpo anti-hepático soluble, SLA/LP, LKM-3 y UGT.6
Históricamente, el ANA es el primer autoanticuerpo asociado a HAI.
El ANA, junto con el ASMA, definen la HAI I, siendo positivo en aproximadamente dos tercios de los pacientes, y asociado con el ASMA en la mitad de los casos.
Una variedad de enfermedades autoinmunes sistémicas y específicas de órganos extra-hepáticos también se asocian típicamente con la positividad de ANA, como el lupus eritematoso, la tiroiditis de Hashimoto, la esclerosis sistémica o la enfermedad celíaca, que pueden coexistir con la HAI. Además, los ANA pueden ser positivos incluso en individuos sanos, y la frecuencia y los títulos aumentan con la edad.5
Los ANA también pueden presentarse como un hallazgo serológico aislado en la colangitis esclerosante primaria (CEP; 29%), la hepatitis C crónica (26%), la hepatitis B crónica (32%), la enfermedad del hígado graso no alcohólico (NAFLD; 34%) y el alcoholismo crónico. Por otro lado, el ASMA puede encontrarse como un hallazgo serológico aislado en CEP (6%), hepatitis C crónica (6%) y enfermedad hepática crónica asociada con el alcohol (4%). El ANA y el ASMA son concurrentes en <10% de las enfermedades hepáticas fuera de la HAI, y la precisión diagnóstica de la HAI mejora del ~58% al 74% si se detectan dos autoanticuerpos en la presentación.4
El anti-LKM1 es el sello serológico de HAI II, que es mucho más raro en HAI I, representando el 20-30% de los casos pediátricos y hasta el 10% de los casos de HAI en adultos. Los ANA, ASMA y AMA están ausentes en pacientes con HAI II. El anti-LC1, junto con el anti-LKM1, define la HAI II. En alrededor de dos tercios de los casos, los dos autoanticuerpos coexisten, pero en algunos pacientes, el anti-LC1 es el único marcador serológico, por lo que es esencial investigarlo.
El cANCA es raro en HAI I y en HAI II, y el pANCA está prácticamente ausente.
Si bien los autoanticuerpos son una herramienta esencial en el rompecabezas diagnóstico de la HAI, no son diagnósticos por sí solos. Por lo tanto es obligatorio tener un conocimiento esencial de sus metodologías de prueba y significado clínico para usarlos correctamente en la práctica clínica.
Figura 1. Autoanticuerpos Asociados a las Hepatitis Autoinmunes Tipo I y Tipo II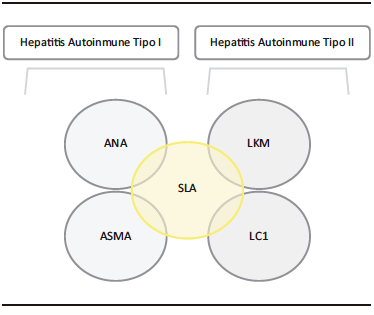
Hepatitis Autoinmune Seronegativa
La sn HAI es rara, ya que en más del 95% de los casos hay presencia de ANA y/o ASMA, siempre que los autoanticuerpos se analicen de acuerdo con los puntos de corte recomendados.5
Las presentaciones agudas y graves ocurren en menos del 7% de los casos. Sin embargo, las presentaciones agudas también pueden presentarse de manera encubierta, con niveles normales de gammaglobulina sérica, puntajes de diagnóstico internacional bajos previos al tratamiento, pero con histopatología que demuestra necrosis centro-lobulillar en la zona 3 compatible con sn HAI.6
Figura 2. Algoritmo Diagnóstico para las Hepatitis Autoinmunes Seronegativas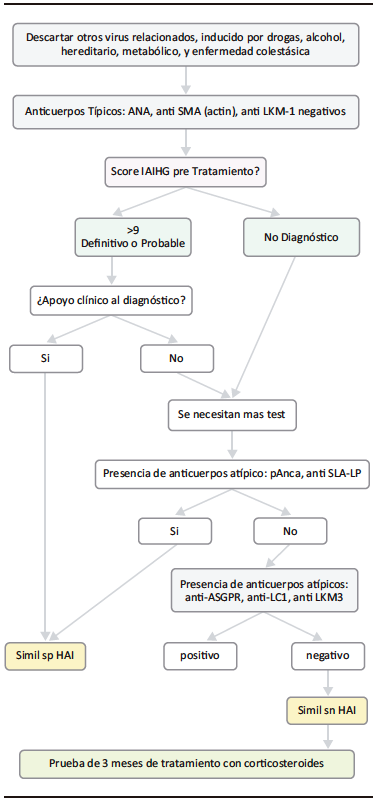
Las presentaciones crónicas varían ampliamente en hasta un (1% a 34% de los casos). Por otra parte, la sn HAI se ha asociado con otras enfermedades autoinmunes cuyas manifestaciones también pueden estar presentes.
Otros marcadores séricos no invasivos
Efe y col. informaron que los niveles séricos de vitamina D estaban asociados con la fibrosis hepática y hepatitis de interfase en la HAI y los no respondedores a terapias inmunosupresoras tenían niveles basales de vitamina D en suero significativamente más bajos en comparación con los que respondieron.
Un estudio reciente mostró que los pacientes con HAI y deficiencia severa de vitamina D (< 25 nmol/L) tenían más probabilidad de no responder al tratamiento y mayor mortalidad relacionada con el hígado.
También se ha investigado la ferritina como un biomarcador predictivo de la respuesta al tratamiento en pacientes con HAI. Tauberty col., informaron que un nivel de ferritina inicial > 2,09 × ULN y niveles de inmunoglobulina más bajos (< 1,89 × ULN) se asociaron con una remisión bioquímica completa.7
Histología de la HAI
La histología hepática representa un componente central del puntaje utilizado para el diagnóstico, por lo que la biopsia hepática se considera obligatoria en el estudio de la HAI en la mayoría de las guías publicadas por sociedades científicas internacionales. No existe un biomarcador diagnóstico para la HAI y la histopatología es clave en la designación del diagnóstico de HAI como definitivo, probable o improbable. Sin embargo, los criterios histológicos para hacer un diagnóstico de HAI se basan en gran medida en estudios antiguos y no han sido validados prospectivamente ni acordados por consenso internacional. 8
Se han descrito varios rasgos histológicos como característicos de la HAI, pero ninguno es patognomónico. Los sistemas de puntuación propuestos por el International AIH Group (IAIHG) para establecer el diagnóstico de HAI incorporan las rosetas hepatocelulares (pequeño grupo de hepatocitos dispuestos alrededor de una luz central también pequeña) y la emperipolesis (la presencia de un linfocito intacto dentro del citoplasma de un hepatocito) como rasgos típicos que apoyan el diagnóstico de HAI.
En la publicación del IAIHG de 1999, la presencia de rosetas hepatocelulares era una característica histológica que contribuía a la puntuación diagnóstica de probabilidad de HAI. El sistema de puntuación simplificado del IAIHG de 2008 categoriza la histología hepática como típica de la HAI cuando se interrelacionan hepatitis, rosetas y emperipolesis.
Sin embargo, estudios más recientes han sugerido que ambas características reflejan más bien una lesión y regeneración de las células hepáticas en el contexto de un daño celular grave, y carecen de especificidad diagnóstica para la HAI.8
La hepatitis de interfase es el sello histológico de la HAI, acompañada de infiltración de células plasmáticas en el 66% (definidos como focos de ≥ 5 células plasmáticas) y hepatitis lobulillar en el 47% de los casos. También se encuentra necrosis centrolobulillar en el 29% de los casos; esto ocurre con una frecuencia similar en pacientes con y sin cirrosis. La emperipolesis está presente en un 65% de los pacientes con HAI; y las rosetas hepatocelulares lo están en un 33% de los casos.4
La emperipolesis y la formación de rosetas son predictores histológicos superiores de HAI. Además, la colangitis linfocítica de moderada a grave no excluye el diagnóstico de HAI.9-10
La cirrosis está presente en 28%-33% de los adultos en el momento de la presentación, especialmente en los ancianos, así como en el 38% de los niños. La cirrosis se desarrolla en el 40% de los adultos con necrosis multilobulillar o necrosis en puente.4
Las características histológicas de la NAFLD están presentes en el 17% al 30% de los pacientes adultos con HAI, y esa concurrencia podría influir en la respuesta al tratamiento.4
Clínica de la HAI
La HAI puede presentarse de forma asintomática en 25% a 34% de los casos. Los síntomas suelen manifestarse como fatiga, malestar general, artralgias o amenorrea. La fatigabilidad fácil es la queja principal en el 85% de los pacientes; puede haber ictericia. La presencia de prurito o hiperpigmentación es inconsistente con el diagnóstico, y la pérdida de peso sugiere una complicación grave (malignidad).
La HAI se presenta con un inicio agudo (duración < 30 días) en 25% a 75% de los pacientes. La HAI asociada con la encefalopatía hepática ocurre en 3% a 6% de los pacientes norteamericanos y europeos.
Tabla 1. Características de HAI Tipo I y Tipo II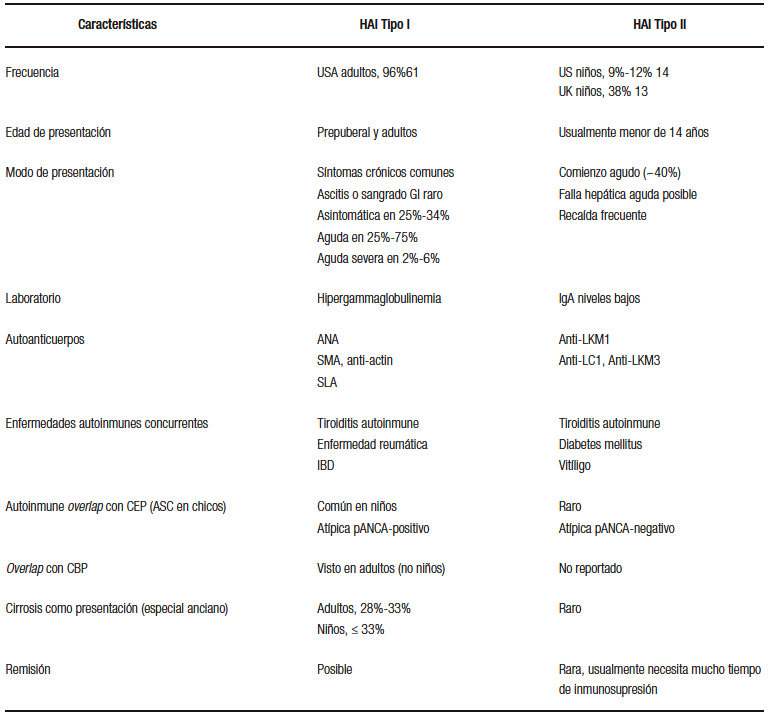
El uso de la elastografía (Fibroscan) en HAI
Los biomarcadores radiográficos para la HAI son limitados, pero existe alguna evidencia en torno a la TE. La TE es una herramienta establecida para evaluar la fibrosis hepática de manera no invasiva en varias enfermedades hepáticas, pero los datos en el caso de las HAI son limitados. Un estudio de Hartly y col. reveló que la TE tenía una gran utilidad para detectar la fibrosis grave después de 6 meses de terapia inmunosupresora.7, 11
Este estudio actual validó por primera vez la técnica en una gran cohorte de pacientes con HAI, demostrando que es una herramienta confiable para detectar fibrosis hepática en la HAI tratada. Para el seguimiento de la progresión de la enfermedad en pacientes bajo tratamiento, la validación de la rigidez hepática como marcador no invasivo de fibrosis hepática mejorará en gran medida la atención al paciente con HAI.11
En la historia natural de la HTP en pacientes con cirrosis, un evento importante es el desarrollo de várices esofágicas con el riesgo subsiguiente de sangrado por várices. El Sexto Consenso de Baveno sobre Hipertensión Portal (Baveno VI) recomendaba el uso de herramientas no invasivas para descartar la presencia de varices con alto riesgo de sangrado (varices que necesitan tratamiento [VNT]). Según Baveno VI, los pacientes con enfermedad hepática crónica avanzada compensada con un recuento de plaquetas normal (> 150.000) y un LSM < 20 kPa no necesitan vigilancia endoscópica porque el riesgo previsto de tener VNT es inferior al 5% (definido como umbral de riesgo “seguro” por el consenso de Baveno VI). La implementación de esta recomendación en la práctica clínica podría ahorrar entre un 20 % y un 40 % de las endoscopias de vigilancia. Los criterios ampliados de Baveno VI (plaquetas > 110.000 y LSM < 25 kPa) también demostraron ser seguros, ahorrando un mayor número de endoscopias que los criterios originales.5
Durante las últimas décadas se descubrió que varios marcadores no invasivos tienen una alta precisión para detectar la fibrosis hepática y la progresión de la enfermedad.
Otro método de imágenes en tiempo real basado en ultrasonido con ventajas para evaluar la enfermedad hepática es el 2D-SWE, mediante el uso de la técnica de imágenes de corte supersónico.12
Al analizar una gran cohorte de pacientes con cirrosis relacionada con HAI, se encontró que una proporción significativa de pacientes con cirrosis (incluidos aquellos con evidencia histológica de cirrosis al momento del diagnóstico de HAI) tenían LSM bajo. De hecho, estas cifras estaban por debajo de los puntos de corte recomendados para el diagnóstico de cirrosis en general (14 kPa), y específicamente para el diagnóstico de cirrosis relacionada con HAI (12,5 kPa y 16 kPa).13 Más importante aún, hasta el 52% de los pacientes con evidencia de HTP (descompensación de enfermedad hepática, várices esofágicas o gástricas, o presencia de colaterales) tenían un LSM por debajo de esos límites. No obstante, las herramientas no invasivas (Baveno VI, criterios ampliados de Baveno VI y modelo continuo ANTICIPATE-PBC) para clasificar a los pacientes para endoscopia son útiles en pacientes con cirrosis relacionada con HAI.13
Por lo tanto, las recomendaciones de las Guías de práctica clínica de la EASL sobre pruebas no invasivas determinan que, la medición de LSM por TE puede usarse en pacientes con HAI tratada para monitorear el curso de la enfermedad, junto con transaminasas e IgG, y para estadificar la fibrosis hepática después de al menos 6 meses de terapia inmunosupresora, evaluando de ese modo la gravedad y el pronóstico de la enfermedad hepática.14
Además, dada la mayor posibilidad de esteatosis hepática en pacientes con HAI por la administración a largo plazo de fármacos inmunosupresores como los glucocorticoides, los métodos no invasivos puede ser particularmenteadecuados para monitorear los cambios histológicos hepáticos pre y posterapéuticos.
En un estudio que evalúa el parámetro de CAP en la esteatosis hepática en pacientes con enfermedades hepáticas autoinmunes, se confirmó que el CAP se correlacionó bien con la esteatosis hepática en la histología. Se establecieron valores de corte con alta precisión diagnóstica para cada grado de esteatosis en pacientes con enfermedad hepática de etiología mixta, que resultaron similares a los propuestos previamente en los datos de los pacientes individuales. El rendimiento del CAP para el diagnóstico del grado de esteatosis hepática en pacientes con HAI se mantuvo estable, lo que respalda que puede usarse como un método de diagnóstico no invasivo y confiable para monitorear la esteatosis y el curso de la enfermedad autoinmune.8
La resonancia nuclear magnética para la evaluación de la fibrosis hepática tiene una sensibilidad de 90%, una especificidad de 100%, un valor predictivo positivo de 100% y un valor predictivo negativo de 90%.
Tratamiento
Primera Línea de Tratamiento
Prednisona o Prednisolona con y sin Azatioprina
Para el tratamiento se utiliza prednisona sola, 40-60 mg al día en adultos y 1-2 mg/kg al día en niños (dosis máxima 40-60 mg al día), o una dosis menor de prednisona, 20-40 mg al día, en combinación con AZA (adultos dosificación: 50 a 150 mg al día; o en Europa, 1 a 2 mg/kg al día; niños, 1 a 2 mg/kg al día); se administra con un antiácido durante la fase de inducción.
En algunos centros la AZA se inicia al mismo tiempo que los glucocorticoides, mientras que la mayoría de los centros recomiendan esperar 2 semanas antes de comenzar AZA para confirmar la respuesta a los esteroides, evaluar el estado de TPMT y evaluar la respuesta al tratamiento excluyendo la rara posibilidad de hepatitis inducida por AZA.4, 15
La dosis de prednisona o prednisolona se reduce gradualmente a 20 mg diarios o a una dosis suficiente para lograr la remisión bioquímica mientras se controlan las pruebas de laboratorio cada 2 semanas. A partir de entonces, se recomienda una disminución gradual (2,5 a 5 mg cada 2 a 4 semanas) para lograr una dosis más baja de 5 a 10 mg diarios que mantenga la remisión de laboratorio.
Se puede utilizar monoterapia con corticoides solo cuando el paciente tiene contraindicación para recibir AZA, o cuando el tiempo de tratamiento esperado sea menor de 6 meses.
En el contexto de la intolerancia a la AZA, el MMF es una terapia alternativa aceptable para mantener la remisión.
La dosis inicial típica de AZA es de 50 a 100 mg al día en adultos y de 1 a 2 mg/kg al día en niños. La aparición de leucopenia o trombocitopenia justifica la reducción de la dosis o la suspensión del fármaco. La AZA debe interrumpirse si la citopenia no se recupera en 1 o 2 semanas. La mayoría de los casos de citopenia en pacientes tratados con AZA en la HAI se asocian con cirrosis.
La eficacia y seguridad de la budesonida (que tiene un efecto de primer paso hepático del 90%) en combinación con AZA fue demostrada en un ensayo aleatorio de HAI recién diagnosticada que se centró en la remisión de laboratorio después de 6 meses. Los pacientes que recibieron budesonida (3 mg tres veces al día, reducidos a dos veces al día después de la remisión) combinados con AZA según el peso (1 a 2 mg/kg al día) lograron la remisión de laboratorio después de 6 meses más frecuentemente (60% versus 39%) y con menos efectos secundarios específicos (SSSE; 28% versus 53%) en comparación con prednisona (40 mg diarios reducidos a 10 mg diarios) combinado con AZA basado en el peso. Un beneficio potencial a largo plazo de la terapia con budesonida es la preservación de la densidad mineral ósea.16
Se realizó una revisión sistemática y un metanálisis para investigar si el tratamiento de primera línea con prednisona o prednisolona sola o en combinación con AZA fue superior a la budesonida en combinación con AZA en pacientes con HAI recién diagnosticada. Los objetivos fueron evaluar la frecuencia de la remisión, el intervalo hasta la remisión, la frecuencia y el tipo de efectos secundarios asociados con la medicación y la frecuencia de muerte o TH.4, 15
El metanálisis reveló que la remisión bioquímica era más probable con el uso de budesonida y AZA en comparación con prednisona y AZA (OR: 2,19; intervalo de confianza [IC] del 95%: 1,30 a 3,67) (grado de evidencia alto), pero el análisis se basó en un único ensayo clínico aleatorizado.
Por lo tanto, las guías de la AASLD recomiendan:
– Para los niños y adultos que presentan HAI y no tienen cirrosis o HAI grave aguda, utilizar budesonida y AZA o prednisona/prednisolona y AZA como tratamiento de primera línea.
– Para niños y adultos con HAI que tienen cirrosis o presentan HAI grave aguda, se sugiere que no se utilice budesonida (recomendación condicional, certeza muy baja).
Alternativas al tratamiento de primera línea
El MMF se utiliza en pacientes intolerantes a AZA como tratamiento de primera línea en combinación con prednisolona.
Por otro lado, la ciclosporina (CsA) ha inducido la remisión bioquímica en niños con HAI con buenos resultados durante el seguimiento a largo plazo. Los niveles mínimos de CsA generalmente se mantienen más altos inicialmente (es decir, 150 a 200 ng/mL) y luego disminuyen gradualmente a 50 a 70 ng/ml después de 1 año, siempre que la enfermedad esté en remisión.
El tacrolimus (TAC) redujo los niveles séricos de AST y ALT en un 70% y un 80% respectivamente después de 3 meses, pero esta promesa inicial no se ha observado en otros estudios. En este momento, no hay datos suficientes para recomendar los inhibidores de la calcineurina como agentes de primera línea.4,16
Segunda Línea de tratamiento
Se puede utilizar el MMF en pacientes con HAI que no toleran la AZA o tienen una respuesta incompleta o fracaso del tratamiento con glucocorticoides/AZA.
La efectividad de MMF como terapia de segunda línea también ha sido respaldada por un estudio reciente que indica la inducción de la remisión bioquímica en el 60% de los casos.4
Inhibidores de calcineurina
Hay múltiples estudios sobre el uso de TAC en el contexto del fracaso del tratamiento. Se ha administrado en combinación con prednisona, budesonida, AZA o MMF, con niveles séricos mínimos que oscilan entre 1 y 10 ng/mL. Dos estudios de un solo centro informaron la normalización de las aminotransferasas séricas en respuesta a TAC en el 91%-92% de los casos de adultos, y un tercer estudio de un solo centro mostró la normalización del nivel sérico de ALT o IgG en el 79%.4
En niños o adultos con HAI que presentan fracaso del tratamiento, respuesta incompleta o intolerancia a los fármacos de primera línea, la AASLD sugiere el uso de MMF o TAC para lograr y mantener la remisión bioquímica (recomendación condicional, certeza baja).
Sobre la base de una mayor facilidad de uso y perfil de efectos secundarios, la AASLD sugiere un ensayo de MMF sobre TAC como agente inicial de segunda línea en pacientes con HAI (recomendación condicional, certeza muy baja).4, 22
Anticuerpos contra TNF-α
Se sabe que los anticuerpos monoclonales contra el TNF-α (infliximab) causan daño hepático e incluso pueden causar lesiones similares a la HAI inducidas por fármacos. Los anticuerpos anti-TNF también pueden tener un papel terapéutico en la HAI.4
Anticuerpos Anti CD20
El rituximab es un anticuerpo monoclonal dirigido contra el receptor CD20 de superficie de las células B. La evidencia que favorece el uso de anticuerpos que agotan las células B es limitada y no justifica su uso como tratamiento de segunda línea.4, 18
Tioguaninas
La tioguanina (TGN) se metaboliza directamente a 6-TGN, que es el metabolito activo de AZA. Los metabolitos de 6-TGN son responsables del efecto inmunosupresor terapéutico de AZA, pero también pueden causar mielosupresión, especialmente en presencia de deficiencia de TPMT. Los metabolitos metilados asociados con la conversión de AZA a 6-TGN se han asociado con intolerancia a AZA, y la producción de estos metabolitos metilados puede reducirse mediante el tratamiento con tioguanina.4, 17-18
Trasplante hepático en la HAI
La HAI es la indicación de TH en el 2%-3% de los receptores en Europay aproximadamente en el 5% de los receptores en Estados Unidos.
La sobrevida ha sido similar en pacientes pediátricos y adultos hasta los 50 años. La infección fue la causa más frecuente de muerte dentro de los 30 a 180 días posteriores al TH, especialmente durante el período postoperatorio temprano para pacientes > 50 años.
Respecto al uso a largo plazo de corticosteroides después de TH sigue habiendo controversias. La literatura sugiere que en algunos pacientes puede realizarse el retiro seguro delos corticosteroides.1
Respuesta al tratamiento
Respuesta Bioquímica Completa.
Se define como la normalización de la actividad de transaminasas séricas y nivel de IgG por debajo del límite superior normal (ULN), que debe lograrse, a más tardar, 6 meses después de iniciado del tratamiento.1
Respuesta insuficiente
La definición de «respuesta insuficiente» es la imposibilidad de lograr una respuesta bioquímica completa, utilizando una combinación de actividad de transaminasas e IgG.
El consenso con respecto a las definiciones de respuesta bioquímica completa y respuesta insuficiente indica que cualquier respuesta que no sea la normalización de transaminasas e IgG debe clasificarse como respuesta insuficiente.1
Falta de respuesta
Se define como una reducción < 50% del nivelde las transaminasas séricas después de 4 semanas de tratamiento. En el contexto de esta definición, las transaminasas séricas aún deben estar por encima del ULN para ser consideradas como falta de respuesta, ya que las transaminasas por debajo del ULN indican una posible respuesta bioquímica completa.1
Remisión
La remisión incluye la normalización de las transaminasas séricas y de los niveles de IgG por debajo del ULN. Esto debería lograrse a más tardar 6 meses después del inicio del tratamiento.
HAI post vacunación para COVID-19
Algunos informes recientes han sugerido que la vacunación contra el COVID-19 puede conducir al desarrollo de enfermedades autoinmunes. Se especula que la vacuna puede alterar la autotolerancia y desencadenar respuestas autoinmunes a través de la reactividad cruzada con las células del huésped. Por lo tanto, los proveedores de atención médica deben permanecer atentos durante la vacunación masiva contra el COVID-19.19-20
Los posibles mecanismos que pueden ocurrir detrás de escena incluyen el mimetismo molecular, los adyuvantes, la propagación de epítopos, la activación de espectadores, el cromosoma X y el hepatotropismo de SARS-CoV-2.
De todos modos, la evidencia de que las vacunas contra el COVID-19 inducen HAI se limitó a informes de casos, series de casos y cartas al editor. La fiabilidad de los informes de casos no permite confirmar si la relación entre la HAI y las vacunas es casual o causal.21
HAI y embarazo
La tasa general de complicaciones maternas durante el embarazo o dentro de los 12 meses posteriores al parto es del 38%.
Las pacientes con HAI que están embarazadas o que planean quedar embarazadas dentro del próximo año deben continuar con el tratamiento para reducir el riesgo de exacerbación y descompensación hepática. Los brotes son 3 veces más comunes después del parto.
Las dosis de mantenimiento de glucocorticoides y/o AZA deben continuarse durante todo el embarazo.
El MMF está contraindicado durante el embarazo y se debe informarse a las mujeres sobre sus efectos adversos antes de iniciar el tratamiento.
Las mujeres con cirrosis que están embarazadas o planean quedar embarazadas dentro del próximo año deben someterse a una prueba de detección de várices mediante endoscopia antes de la concepción o durante el segundo trimestre de gestación y tratarse con ligaduras con bandas.
Las mujeres con HAI deben ser monitoreadas cuidadosamente durante los primeros 6 meses posteriores al parto para la detección temprana de un brote.4, 22
Conclusión
La HAI es una patología poco frecuente que en su evolución puede presentar complicaciones severas, incluyendo el trasplante hepático y la muerte.
A pesar del aporte de nuevas evidencias continúa siendo una patología de exclusión, dada la ausencia de biomarcadores específicos, si bien ciertas alteraciones del laboratorio y patrones histopatológicos determinados apuntan a un diagnóstico más probable.
Se dispone de tecnología no invasiva para el monitoreo de la enfermedad, tanto en la evaluación del tratamiento inmunosupresor, como en la prevención de aparición de complicaciones.
Propiedad intelectual. La autora declara que los datos, las figuras y las tablas presentes en el manuscrito son originales y se realizaron en su institución perteneciente.
Financiamiento. La autora declara que no hubo fuentes de financiación externas.
Conflicto de interés. La autora declara no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2023 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Marino P M. Novedades en hepatitis autoinmune. Acta Gastroenterol Latinoam. 2023;53(1):28-37. https://doi.org/10.52787/agl.v53i1.309
Referencias
- Pape S, et al Sistematicrewiew of response criteria and endpoints in autoimmune hepatitis by the International Autoimmune Hepatitis Group, J. Hepatol. 2022,76,841-849.
- Wang G, Tanaka A, Zhao H, Jia J, Ma X, Harada K, Wang FS, Wei L, Wang Q, Sun Y, Hong Y, Rao H, Efe C, Lau G, Payawal D, Gani R, Lindor K, Jafri W, Omata M, Sarin SK. The Asian Pacific Association for the Study of the Liver clinical practice guidance: the diagnosis and management of patients with autoimmune hepatitis. Hepatol Int. 2021 Apr;15(2):223-257. DOI: 10.1007/s12072-021-10170-1. Epub 2021 May 4. PMID: 33942203; PMCID: PMC8144150.
- Terziroli Beretta-Piccoli, B., Mieli-Vergani, G. &Vergani, D. Autoimmune Hepatitis: Serum Autoantibodies in Clinical Practice. ClinicRevAllergImmunol 63, 124-137 (2022). https://doi.org/10.1007/s12016-021-08888-9
- Mack, C.L., Adams, D., Assis, D.N., Kerkar, N., Manns, M.P., Mayo, M.J., Vierling, J.M., Alsawas, M., Murad, M.H. and Czaja, A.J. (2020), Diagnosis and Management of Autoimmune Hepatitis in Adults and Children: 2019 Practice Guidance and Guidelines From the American Association for the Study of Liver Diseases. Hepatology, 72:671-722. https://doi.org/10.1002/hep.31065
- Mieli-Vergani G, Vergani D, Czaja AJ, Manns MP, Krawitt EL, Vierling JM, Lohse AW, Montano-Loza AJ. Autoimmune hepatitis. Nat Rev Dis Primers. 2018 Apr 12;4:18017. DOI: 10.1038/nrdp.2018.17. PMID: 29644994.
- Bhumi SA, Wu GY. Seronegative Autoimmune Hepatitis. J Clin Transl Hepatol. 2023 Apr 28;11(2):459-465. DOI: 10.14218/JCTH.2022.00235. Epub 2022 Sep 26. PMID: 36643052; PMCID: PMC9817061.
- Harrington, C, Krishnan, S, Mack, CL, Cravedi, P, Assis, DN, Levitsky, J. Noninvasive biomarkers for the diagnosis and management of autoimmune hepatitis. Hepatology. 2022;76: 1862-1879. https://doi.org/10.1002/hep.32591
- Ni XX, Lian M, Wu HM, Li XY, Sheng L, Bao H, Miao Q, Xiao X, Guo CJ, Li H, Ma X, Hua J. Evaluation of controlled attenuation parameter in assessing hepatic steatosis in patients with autoimmune liver diseases. World J Gastroenterol. 2021 Jan 7;27(1):80-91. DOI: 10.3748/wjg.v27.i1.80. PMID: 33505152; PMCID: PMC7789069.
- Gurung A, Assis DN, McCarty TR, Mitchell KA, Boyer JL, Jain D. Histologic features of autoimmune hepatitis: a critical appraisal. Hum Pathol. 2018;82:51-60. DOI: 10.1016/j.humpath.2018.07.014
- Lohse AW, Sebode M, Bhathal PS, Clouston AD, Dienes HP, Jain D, Gouw ASH, Guindi M, Kakar S, Kleiner DE, Krech T, Lackner C, Longerich T, Saxena R, Terracciano L, Washington K, Weidemann S, Hübscher SG, Tiniakos D. Consensus recommendations for histological criteria of autoimmune hepatitis from the International AIH Pathology Group: Results of a workshop on AIH histology hosted by the European Reference Network on Hepatological Diseases and the European Society of Pathology: Results of a workshop on AIH histology hosted by the European Reference Network on Hepatological Diseases and the European Society of Pathology. Liver Int. 2022 May;42(5):1058-1069. DOI: 10.1111/liv.15217. Epub 2022 Mar 12. PMID: 35230735.
- Hartl J, Ehlken H, Sebode M, Peiseler M, Krech T, Zenouzi R, von Felden J, Weiler-Normann C, Schramm C, Lohse AW. Usefulness of biochemical remission and transient elastography in monitoring disease course in autoimmune hepatitis. J Hepatol. 2018 Apr;68(4):754-763. DOI: 10.1016/j.jhep.2017.11.020. Epub 2017 Nov 24. PMID: 29180000.
- Hartl J, Denzer U, Ehlken H, Zenouzi R, Peiseler M, Sebode M, Hübener S, Pannicke N, Weiler-Normann C, Quaas A, Lohse AW, Schramm C. Transient elastography in autoimmune hepatitis: Timing determines the impact of inflammation and fibrosis. J Hepatol. 2016 Oct;65(4):769-775. DOI: 10.1016/j.jhep.2016.05.023. Epub 2016 May 26. PMID: 27238753.
- Yan YL, Xing X, Wang Y, Wang XZ, Wang Z, Yang L. Clinical utility of two-dimensional shear-wave elastography in monitoring disease course in autoimmune hepatitis-primary biliary cholangitis overlap syndrome. World J Gastroenterol. 2022 May 14;28(18):2021-2033. DOI: 10.3748/wjg.v28.i18.2021. PMID: 35664960; PMCID: PMC9150059.
- Efe, C, Kulkarni, AV, Terziroli Beretta-Piccoli, B, Magro, B, Stättermayer, A, Cengiz, M, et al. Liver injury after SARS-CoV-2 vaccination: features of immune-mediated hepatitis, role of corticosteroid therapy and outcome. Hepatology.2022;76:1576-1586. https://doi.org/10.1002/hep.32572
- Purnak T, Efe C, Kav T, Wahlin S, Ozaslan E. Treatment response and outcome with two different prednisolone regimens in autoimmune hepatitis. Dig Dis Sci 2017;62(10):2900-2907.
- Pape S, Gevers TJG, Belias M, Mustafajev IF, Vrolijk JM, van Hoek B, et al. Predniso(lo)ne dosage and chance of remission in patients with autoimmune hepatitis. Clin GastroenterolHepatol 2019;17(10):2068-2075.e2
- Beretta-Piccoli BT, Mieli-Vergani G, Vergani D. Autoimmune hepatitis: Standard treatment and systematic review of alternative treatments. World J Gastroenterol 2017;23(33):6030-6048
- Newman WG, Payne K, Tricker K, Roberts SA, Fargher E, Pushpakom S, et al. A pragmatic randomized controlled trial of thiopurine methyltransferase genotyping prior to aza- thioprine treatment: the TARGET study. Pharmacogenomics 2011;12(6):815-826.
- Rodríguez Y, Rojas M, Beltrán S, Polo F, Camacho-Domínguez L, Morales SD, Gershwin ME, Anaya JM. Autoimmune and autoinflammatory conditions after COVID-19 vaccination. New case reports and updated literature review. J Autoimmun. 2022 Oct;132:102898. DOI: 10.1016/j.jaut.2022.102898. Epub 2022 Aug 24. PMID: 36041291; PMCID: PMC9399140.
- European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu; Clinical Practice Guideline Panel; Chair; EASL Governing Board representative; Panel members. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis – 2021 update. J Hepatol. 2021 Sep;75(3):659-689. DOI: 10.1016/j.jhep.2021.05.025. Epub 2021 Jun 21. PMID: 34166721.
- Front. Immunol., 25 November 2022Sec. Autoimmune and Autoinflammatory Disorders: Autoimmune Disorders Volume 13 – 2022. https://doi.org/10.3389/fimmu.2022.1035073
- Schramm C, Herkel J, Beuers U et al. (2006) Pregnancy in autoimmune hepatitis: outcome and risk factors. Am J Gastroenterol 101:556-560. https://doi.org/10.1111/j.1572-0241.2006.00479.x
Correspondencia: Mónica P. Marino
Correo electrónico: monicap_marino@yahoo.com.ar
Acta Gastroenterol Latinoam 2023;53(1):28-37
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE