María Cristina Arregui1 ID· Andrea Besga1 ID· Teresita González1 ID· Cecilia Zubiri1 ID· Verónica Garrido1 ID· Julieta Hernández1 ID· María Victoria Fasano1, 2 ID
1Hospital de Niños “Sor María Ludovica” de La Plata.
2IDIP – Instituto de Desarrollo e Investigaciones Pediátricas “Prof. Dr. Fernando E. Viteri».
Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2021;51(3):292-299
Recibido: 07/06/2021 / Aceptado: 07/09/2021 / Publicado en www.actagastro.org el 27/09/2021 / https://doi.org/10.52787/hsps8298
Resumen
Introducción. La enfermedad hepática grasa no alcohólica es la primera causa de enfermedad hepática crónica en niños con prevalencia e incidencia en aumento. Evoluciona con depósito de grasa a nivel hepático y genera impacto negativo en la salud y la calidad de vida de los pacientes. Objetivo. Determinar la presencia de variables asociadas de enfermedad hepática grasa no alcohólica en la población pediátrica estudiada. Métodos. Estudio observacional, de corte transversal, en el que se incluyeron pacientes desde 18 meses a 16 años con sobrepeso u obesidad atendidos en los servicios de Gastroenterología y Nutrición de un hospital pediátrico de tercer nivel, desde septiembre 2009 a febrero 2019. Se incluyeron dos grupos: 1) “Con hígado graso”: pacientes con aumento de la ecogenicidad hepática, y 2) “Sin hígado graso”: pacientes con estudio ecográfico normal. Se compararon ambos grupos analizando variables antropométricas, bioquímicas, antecedentes perinatales y personales. Resultados. Se incluyeron a 371 pacientes con sobrepeso u obesidad, evidenciando que el antecedente de prematurez y bajo peso al nacimiento resultaron factores asociados a hígado graso. Los recién nacidos pretérmino tienen 14 veces más chances de hígado graso que recién nacidos de término [OR 14,08 IC 95% (2,31- 577,54)]; mientras que pacientes con bajo peso nacimiento (< 2500 g) tienen el triple de chances de tener hígado graso [OR 3,38 IC 95% (1,01; 17,77)]. La lactancia materna exclusiva hasta el sexto mes redujo las chances de hígado graso [OR 0,29 IC 95% (0,15-0,53)]. El examen físico mostró que la acantosis nigricans en cuello y axilas, y el aumento de la circunferencia abdominal fueron más prevalentes en el grupo de Hígado Graso (p < 0,05).
Así como, las variables bioquímicas alteradas de aspartato aminotransferasa y alanino aminotransferasa, insulina (p < 0,05) y triglicéridos (p = 0,0004). Conclusión. La búsqueda de variables asociadas a hígado graso resulta de vital importancia en el diagnóstico temprano y oportuno de esta entidad. El antecedente de prematurez y bajo peso representa un factor de riesgo, mientras que la lactancia materna exclusiva hasta el sexto mes resultaría ser un factor protector del desarrollo de hígado graso. En el examen físico, la acantosis nigricans y el aumento de la circunferencia abdominal fueron más frecuentes en el grupo con hígado graso. En cuanto a las variables bioquímicas, la alteración de transaminasas, insulina y triglicéridos fueron mayores en el grupo con hígado graso, en forma significativa.
Palabras claves. Enfermedad hepática grasa no alcohólica, población pediátrica, lactancia materna exclusiva, sobrepeso, obesidad.
Fatty Liver in Paediatrics: Associated Factors
Summary
Introduction. Nonalcoholic fatty liver disease is the leading cause of chronic liver disease in children with an increasing prevalence and incidence, that evolves with fat deposition in the liver and generates a negative impact on the health and quality of life of patients. Objective. To determine the presence of variables associated with non-alcoholic fatty liver disease in the pediatric population studied. Methods. Observational, cross-sectional study, in which overweight or obese patients aged from 18 months to 16 years were included, treated in the Gastroenterology and Nutrition services of a tertiary pediatric hospital, from September 2009 to February 2019. Two groups were included: 1) «With Fatty Liver»: patients with increased liver echogenicity and 2) «Without fatty liver»: patients with normal ultrasound study. Both groups were compared analyzing anthropometric, biochemical, perinatal and personal history variables. Results. 371 overweight or obese patients were included, showing that a history of prematurity and low birth weight were factors associated with fatty liver. Preterm newborns have 14 times more chances of fatty liver than term newborns [OR 14.08 95% CI (2.31- 577.54)]; while patients with low birth weight (< 2500 g) have three times the chances of having fatty liver [OR 3.38 95% CI (1.01; 17.77)]. Exclusive breastfeeding up to the sixth month reduced the chances of fatty liver [OR 0.29 95% CI (0.15-0.53)]. Physical examination showed that acanthosis nigricans in the neck and armpits, and increased abdominal circumference were more prevalent in the Fatty Liver group (p < 0.05) as well as, the altered biochemical variables of aspartate aminotransferase and alanine aminotransferase, insulin (p < 0.05) and triglycerides (p = 0.0004). Conclusion: The search for variables associated with fatty liver is of vital importance in the early and timely diagnosis of this entity. The history of prematurity and low weight represent a risk factor, while exclusive breastfeeding up to the sixth month would prove to be a protective factor for the development of fatty liver. On physical examination, acanthosis nigricans and increased abdominal circumference were more common in the fatty liver group. Regarding the biochemical variables, the alteration of transaminases, insulin and triglycerides were significantly greater in the group with fatty liver.
Keywords. Non-alcoholic Fatty Liver Disease, Paediatric Population, Exclusive Breastfeeding, Overweight, Obesity.
Abreviaturas
EHGNA: Enfermedad hepática grasa no alcohólica.
EHNA: Esteatohepatitis no alcohólica.
ESPGHAN: European Society for Paediatric Gastroenterology Hepatology and Nutrition.
HG: Hígado graso.
IMC: Índice de masa corporal.
TSH: Hormona estimulante de tiroides.
T4L: Tiroxina.
TGO: Aspartato aminotransferasa.
TGP: Alanino aminotransferasa.
IQR: Intervalo intercuartílico.
PN: Peso al nacer.
LME: Lactancia materna exclusiva.
EG: Edad gestacional.
LV: Leche de vaca.
RNPT: Recién nacido pretérmino.
GGT: Gamma glutamil transpeptidasa.
FAL: Fosfatasa alcalina.
Introducción
La enfermedad hepática grasa no alcohólica (EHGNA) es la primera causa de enfermedad hepática crónica en niños en países desarrollados, con prevalencia e incidencia en aumento.1 Abarca un amplio espectro, que incluye desde la esteatosis simple a esteatohepatitis no alcohólica (EHNA), pudiendo llegar a la cirrosis y provocando un impacto importante en la salud y el deterioro en la calidad de vida.2 Representa la primera causa de enfermedad hepática crónica en niños en los países desarrollados, y su elevada prevalencia se debe a la estrecha relación con la obesidad infantil y la diabetes mellitus, patología con categoría de epidemia. En comparación con décadas pasadas, la prevalencia de la EHGNA, principalmente en el mundo occidental, se incrementó hacia el año 2015 de 2,8% a 46% y está asociada con obesidad y diabetes a nivel mundial.3 La gravedad de la enfermedad es tal que actualmente representa en adultos la segunda causa de trasplante hepático en los Estados Unidos y se proyecta que constituya el principal motivo de trasplante en la próxima década.
El diagnóstico de EHGNA requiere: a) evidencia de esteatosis hepática histológica o en imágenes, y b) ausencia de otras causas preexistentes (consumo de alcohol, medicación esteatogénica o enfermedades hereditarias).4, 5
Es sabido que las dietas hipercalóricas, el consumo de alimentos industrializados, las comidas rápidas, el sedentarismo, el uso y abuso de pantallas y las familias disfuncionales, sumados a factores socio-económicos y culturales favorecen el desarrollo de la enfermedad que, de no diagnosticarse y tratarse tempranamente, evolucionará generando complicaciones tanto hepáticas como sistémicas a corto y largo plazo.6, 7 Resulta preocupante el hecho de que la edad de inicio es cada vez más temprana, debido al importante aumento de sobrepeso y obesidad, siendo esta condición y la insulino-resistencia el mayor riesgo para desarrollarla.8
Las investigaciones sobre esta patología en la edad pediátrica van en aumento, con el objetivo de identificar factores de riesgo, diferentes formas de presentación y sus consecuencias. Es un importante desafío en la actualidad la implementación de estrategias de prevención de obesidad y esteatosis hepática, como también lo es un diagnóstico temprano, sabiendo además que es una entidad cada vez más frecuente pero escasamente diagnosticada y tratada.9 Por todo ello el objetivo de este trabajo fue determinar la presencia de variables asociadas a la presencia de esteatosis hepática en la población pediátrica estudiada, utilizando métodos accesibles en la consulta general como lo son el interrogatorio, el análisis de sangre y la ultrasonografía.
Métodos
Estudio observacional, de corte transversal, en el que se incluyó a pacientes desde 18 meses a 16 años con sobrepeso (Z IMC > 1) u obesidad (Z IMC > 2) que concurrieron a los servicios de Gastroenterología y Nutrición de un hospital pediátrico de tercer nivel, desde septiembre 2009 a febrero 2019. Se incluyó a pacientes con no menos de tres consultas, siendo el intervalo entre ellas variable dependiendo de la posibilidad de acceso hospitalario. Se incluyó a aquellos con diagnóstico antropométrico de sobrepeso u obesidad asociado a estudio ecográfico normal o con hígado graso. Se excluyó a aquellos con otra patología hepática crónica, con otra enfermedad sistémica y con historias clínicas incompletas (ausencia de datos filiatorios o de las variables a evaluar). Se dividió a los pacientes en dos grupos: Grupo 1: “Con Hígado Graso (HG)”: ecografía con aumento de la ecogenicidad hepática, y Grupo 2: “Sin HG”: ecografía hepática normal.
Se revisaron las historias clínicas teniendo en cuenta antecedentes perinatales como edad gestacional (EG) al momento del nacimiento, peso al nacer (PN) y alimentación durante los primeros seis meses de vida (LME) o leche de vaca (LV), como así también la presencia de enfermedades e internaciones durante su infancia. Se consultó respecto de la realización de actividad física.
Se registraron las mediciones antropométricas, peso y talla, utilizando el programa Anthro Who Plus. Se determinó el IMC (índice de masa corporal) y el score Z de la variable IMC para realizar luego análisis estadístico. En el examen físico se pesquisó la presencia de acantosis nigricans, hipertensión arterial, hepatomegalia y diámetro de circunferencia abdominal. Se interrogó sobre la presencia de apneas como antecedente personal.
Se utilizó ultrasonografía hepática por constituir el examen complementario más utilizado, por su nula invasividad y fácil accesibilidad. Fue realizada por los mismos profesionales del servicio de Imágenes del hospital. Tiene una sensibilidad y especificidad de 60 y 94% respectivamente, en pacientes con más de 25-30% de los hepatocitos afectados. Su sensibilidad se muestra subóptima en pacientes con menor cuantía de esteatosis. La visualización de grasa mediante imágenes resulta suficiente para evaluar la presencia de esteatosis hepática en la práctica clínica.10
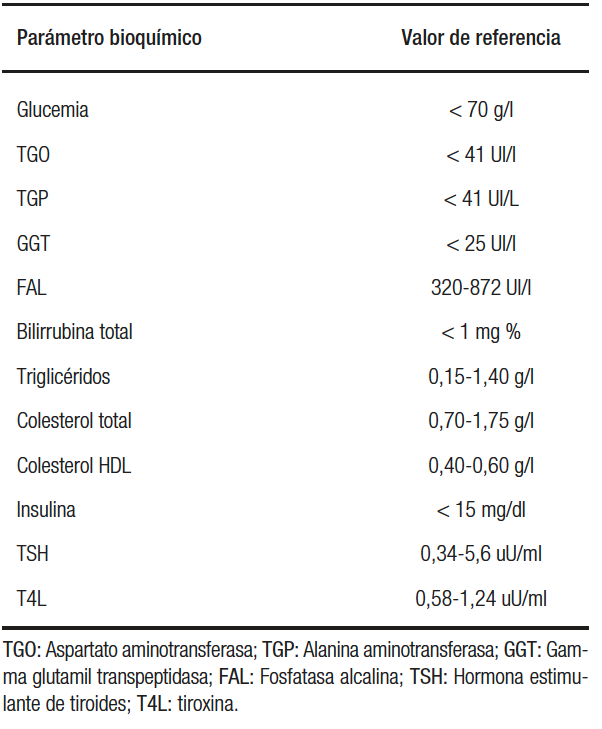
En caso de hipertransaminasemia para diagnóstico diferencial, se consultó sobre el consumo de alcohol, medicación esteatogénica y enfermedades hepáticas crónicas. Respecto de variables bioquímicas, se revisó hemograma, hepatograma, urea y creatinina, glucemia, insulina, perfil lipídico, TSH (hormona estimulante de tiroides) y T4L (tiroxina), y se realizó dosaje de ceruloplasmina, alfa-1 antitripsina, metabolismo del hierro, anticuerpos para diagnóstico de celiaquía, y perfil de autoinmunidad, según la clínica del paciente. En caso de duda diagnóstica, se realizó interconsulta con el servicio de Enfermedades Metabólicas del hospital. Los valores de referencia de laboratorio de las variables analizadas de nuestro hospital se muestran en la Tabla 1.
Tabla 1. Valores de referencia de laboratorio
Para el análisis estadístico de los datos se utilizó el paquete estadístico R versión 3.6.1.
Las variables cualitativas se informaron como frecuencias y porcentajes. La normalidad de las variables cuantitativas se analizó mediante el test de Kolmogorov-Smirnov. Las variables con distribución normal se informaron como media ± desvío, mientras que aquellos datos no paramétricos se informaron como mediana (IQR: intervalo intercuartílico). Para estudiar la asociación entre las variables cualitativas se utilizaron el test de Chi-cuadrado o el test exacto de Fisher, y se calculó el OR mediante regresión logística. Luego se utilizó un modelo lineal generalizado multivariable para ajustar los OR.
Para comparar las variables cuantitativas entre los pacientes con y sin HG, se usaron los tests de Student o Mann- Whitney, según correspondiera. En todos los casos se consideró significativo un valor de p < 0,05.
Resultados
Se analizó a un total de 371 pacientes con sobrepeso y obesidad, 280 con HG ecográfico y 91 con ecografía hepática normal. El Grupo 1 inicialmente incluía a 368 pacientes pero, secundario a historias clínicas incompletas, incumplimiento de las consultas o diagnóstico de otras patologías, se excluyó a 88 pacientes. Dentro de las patologías diagnosticadas, 6 tuvieron antecedente de nutrición parenteral, 4 pacientes fueron celíacos, 2 tuvieron hepatitis autoinmune, 1 fibrosis quística, 1 abetalipoproteinemia, y 1 glucogenosis.
En las Tablas 2 y 3, se muestran las características clínicas y bioquímicas de ambos grupos analizados y los hallazgos estadísticamente significativos.
Tabla 2. Variables sociodemográficas y antecedentes
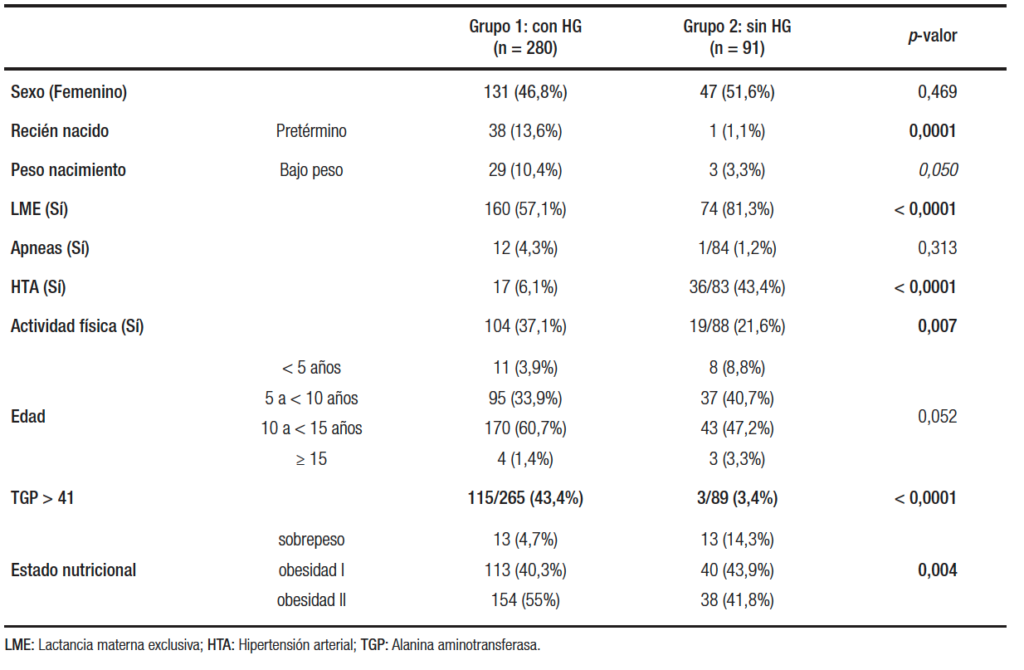
Tabla 3. Variables bioquímicas y biométricas

Considerando la muestra, el 60,7% de los pacientes pertenecían a una franja etaria entre 10 y 14,9 años. Con respecto a su estado nutricional, el 55% tenían obesidad grado II, y 40,3 % obesidad grado I, basándose dicha clasificación en el Z-IMC donde el 50% presentaron un Z Score IMC > 3,09 y en el 75 % > 2,56.
Vinculada a los antecedentes perinatales, se observó una diferencia significativa comparando ambos grupos en relación con la edad gestacional. El 13,6 % del Grupo 1 fueron pretérmino (edad gestacional al nacer < 37 semanas) en comparación con el 1,1 % del Grupo 2 (p = 0,003).
El bajo peso al nacer (menor a 2500 g) fue más frecuente en el Grupo 1 (10,4 %) respecto del Grupo 2 (3,3 %), [OR 3,38 IC 95 % (1,01; 17,77)]. En relación con la alimentación, el 57,1% del Grupo 1 se alimentó con LME hasta los 6 meses de edad, en comparación con el 81,3 % en el Grupo 2 [OR para LME 0,29 IC 95 % (0,15- 0,53)].
En lo concerniente al examen físico, el grupo con HG presentó mayor prevalencia de acantosis nigricans en cuello y/o axilas, y una mayor circunferencia abdominal (p < 0,05).
En lo que se refiere a valores de laboratorio, el grupo con HG mostró un valor medio de transaminasas dentro de parámetros normales. Se hallaron diferencias significativas entre grupos al comparar valores medios de aspartato aminotransferasa (TGO) y alanino aminotransferasa (TGP), insulinemia y triglicéridos (p < 0,05).
Considerando un valor de TGP > 41, se observó una diferencia estadísticamente significativa en el Grupo 1 (43,4% vs. 3,4% del Grupo 2, p < 0,000) (Tabla 3).
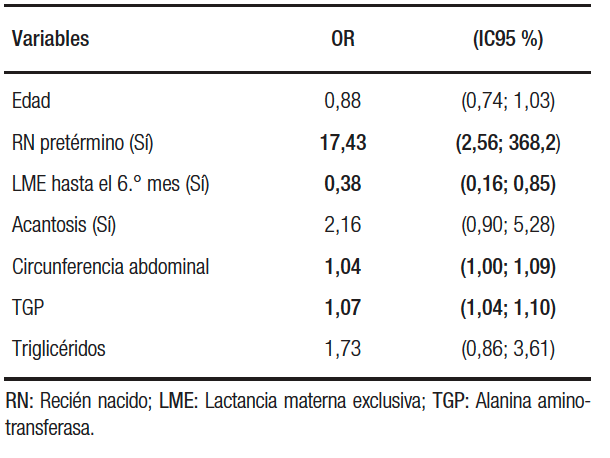
Finalmente, se realizó un análisis ajustado a través de un modelo de regresión logística multivariado donde se incorporaron todas las variables que resultaron significativas en el análisis bivariable, y luego se utilizó el método de selección por pasos hacia atrás para ajustar el modelo final. El modelo final, y los OR (IC 95 %) respectivos, se muestran en la Tabla 4. Se puede observar que las variables que resultaron significativas aún ajustadas por las otras fueron: recién nacido pretérmino (RNPT), la circunferencia abdominal y la TGP (riesgo aumentado) y LME hasta el 6° mes (riesgo disminuido).
Respecto de la circunferencia abdominal y la TGP, por cada 1 cm que aumenta la circunferencia abdominal las chances de tener HG aumentan un 4%, y por cada UI/L que aumenta la TGP, las chances de HG aumentan un 7%.
Tabla 4. Modelo de regresión logística multivariable para HG
Discusión
La búsqueda de factores asociados, protectores o de riesgo en patologías como el HG es una de las áreas de mayor énfasis en investigación de los últimos tiempos. La necesidad de adelantarse a los efectos que producen los hábitos modificables representa una carrera contra el tiempo, dado el impacto que los mismos generan a futuro, considerando que cada vez son más los niños con patologías consideradas de adulto y que presentan hallazgos clínicos de cronicidad y de daño a órgano blanco, con variables bioquímicas alteradas.11
De aquí que el tamizaje resulte necesario y aconsejable en pediatría, y deba sumarse a la búsqueda de sus posibles asociaciones con otras enfermedades metabólicas, proponiendo mediante la anamnesis detallada, examen físico, ecografía abdominal y estudios de laboratorio la detección de HG y síndrome metabólico como los principales pilares para la toma de conocimiento temprana de la patología. Estas prácticas resultan cruciales para un diagnóstico y tratamiento precoz.12
Dentro del proceso diagnóstico, mucha bibliografía propone la realización de biopsia hepática con la intención de confirmar histológicamente el diagnóstico de EHGNA. Se estima que entre 15 y 39% de los pacientes sometidos a biopsia hepática padecen esta enfermedad.11 La biopsia hepática continúa siendo el examen estándar para el adecuado diagnóstico y estadificación del paciente con HGNA, por su valor diagnóstico y pronóstico. Mediante la evaluación del grado de esteatosis, actividad inflamatoria, daño parenquimatoso y presencia de remodelación tisular/fibrosis, el estudio histopatológico ayuda a distinguir sujetos con HGNA no progresivo de aquellos con esteatohepatitis no alcohólica (EHNA) y potencial de progresar a formas de daño hepático más avanzado como la cirrosis.18 Adicionalmente, la biopsia puede orientar acerca de causas específicas de HGNA/EHNA que pueden requerir tratamiento dirigido, como trastornos hormonales, genéticos, exposición a sustancias tóxicas y reacciones adversas a medicamentos, entre otras. Es decir, la biopsia permite establecer la magnitud de la fibrosis hepática, haciendo posible la estadificación del HGNA. No obstante, considerando que la biopsia hepática resulta un procedimiento invasivo y no accesible fácilmente comparativamente con una ultrasonografía, la misma no se realiza de rutina en todos los pacientes pediátricos. De acuerdo con la ESPGHAN, a todos los niños obesos mayores de 3 años se les debería realizar ultrasonido abdominal y función hepática como herramienta válida para identificar infiltración grasa del hígado, estableciendo que el ultrasonido ha mostrado ser, en pacientes obesos, una herramienta idónea para discernir a quiénes corresponde realizar biopsia hepática como paso previo a la confirmación del diagnóstico. De todas maneras, la circunferencia abdominal, masa grasa y grasa visceral tienen una significativa correlación para detectar EHGNA, y sumadas a parámetros bioquímicos la aproximación diagnóstica es alta. Conforme haya mayor accesibilidad a elastografía, dicho procedimiento permitirá ser más exacto al momento de realizar una valoración cuali y cuantitativa del depósito graso sin necesidad de recurrir a biopsia hepática, al menos para diagnóstico inicial (descartadas otras patologías que cursen con esteatosis hepática).
Vinculada a los antecedentes personales, la LME y su duración resultan de importancia alzándose como factor protector y quedando esto reflejado en el análisis realizado y en el cálculo de OR de nuestros grupos de estudio, donde los niños que tuvieron LME hasta el sexto mes de vida tuvieron 71% menos chances de tener HG que aquellos que suspendieron la LME antes del 6° mes. Esto coincide con la bibliografía consultada,13 estando demostrado que una mayor duración de la lactancia y el retraso del inicio de fórmula complementaria se asocia con una reducción en la prevalencia de HGNA. También se ha observado que la lactancia prolongada reduce la gravedad de esteatosis evidenciada ecográficamente, y se postula que su duración mayor a 4 meses induce un perfil metabólico más favorable caracterizado por IMC bajo y menor grasa subcutánea y resistencia insulínica, entre otros.14
La EG es un factor importante a tener en cuenta, dado que en los RNPT se observó que tienen 13 veces más chances de tener HG. Esto coincide con lo publicado en el año 2015 por Breji y cols., quienes demostraron que en RNPT el aumento acelerado de peso después de la edad a término se asocia con un mayor riesgo de desarrollar HGNA en adultos jóvenes,15 pero una crítica a esta relación podría ser que conocer la velocidad de ganancia de peso sería un factor a considerar en el análisis, y el mismo no fue tenido en cuenta en nuestros pacientes.
Situación similar ocurre con el peso al nacer, observando que los nacidos con peso < 2500 g tienen el triple de chances de tener HG que aquellos nacidos con peso > 2500 g.
Vinculada al examen físico, resulta fundamental la medición de la circunferencia abdominal y la búsqueda de acantosis nigricans. Respecto de la primera, conforme aumenta el valor de la circunferencia abdominal en 1 cm, las chances de padecer HG se elevan un 4%; mientras que la segunda es un claro indicador de insulino-resistencia, y de ahí su relación con síndrome metabólico e HG.
En lo que concierne a los parámetros bioquímicos analizados y a tener cuenta, han sido las transaminasas las más estudiadas. El test de tamizaje recomendado es la TGP, por ser de bajo costo y disponible en forma universal. Para el diagnóstico de HGNA, el valor de 2 veces el normal de la TGP en niños con sobrepeso y obesos de 10 años o más tiene una sensibilidad del 88% y una especificidad del 26%.16 En nuestro estudio, no solo se observó que existe una diferencia estadísticamente significativa entre aquellos pacientes que tienen hipertransaminasemia vinculada a la presencia de HG, sino que la misma fue mayor para TGP respecto de TGO, lo que coincide con los reportes de la literatura donde la primera enzima es más específica de patología hepática.17-19
Es sabido que el HGNA a menudo permanece asintomático hasta que haya ocurrido un daño significativo al hígado y/u otros sistemas; que el desarrollo de comorbilidades, que incluyen resistencia a la insulina y diabetes mellitus tipo II son un marcador pronóstico de las asociaciones y riesgos que esta patología presenta, cuya presencia debe ser investigada a partir muchas veces de un único dato positivo en el examen físico o bioquímico del individuo.20, 21 Esto destaca la importancia de buscar esta patología en los niños teniendo en cuenta los factores de riesgo, con el fin de lograr un diagnóstico temprano que nos permita prevenir mayores complicaciones.
Si bien se analizaron múltiples variables en el trabajo, estas pueden incluso resultar escasas para el concepto de multicausalidad de obesidad y sobrepeso y de su extrapolación a hígado graso y síndrome metabólico. Existen factores socio-demográficos no modificables, y otros modificables, de la población estudiada, que exceden el alcance de esta investigación y que bien pueden influir en el desarrollo de la patología estudiada y de ahí en sus conclusiones.
Conclusión
Dentro de los antecedentes personales, la prematurez y el bajo peso representan un factor de riesgo para HG, mientras que el haber sido alimentado con LME hasta el sexto mes resultaría ser un factor protector. La acantosis nigricans en cuello y axilas, y el aumento de la circunferencia abdominal fueron más prevalentes en el grupo de HG, así como también la alteración en los niveles de TGP, insulina y triglicéridos.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos y las tablas que figuran en el manuscrito son originales y fueron realizados en sus instituciones pertenecientes.
Aviso de derechos de autor
 © 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
© 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Arregui MC, Besga A, González T y col. Factores asociados al hígado graso en una población pediátrica. Serie de casos. Acta Gastroenterol Latinoam. 2021;51(3):292-9. https://doi.org/10.52787/hsps8298
Referencias
- Pajuelo J, Cuadros M, Campos M, Sánchez J. Prevalencia de sobrepeso y obesidad en niños menores de cinco años en el Perú 2007-2010. Rev Perú Med Exp Salud Pública. 2011;28:222-7.
- Moran JR, Ghishan FK, Halter SA, Greene HL. Steatohepatitis in obese children: a cause of chronic liver dysfunction. Am J Gastroenterol. 1983;78:374-7.
- Pacífico L, Nobili V, Anania C, Verdecchia P, Chiesa C. Pediatric nonalcoholic fatty liver disease,metabolic syndrome and cardiovascular risk. World J. Gastroenterol. 2011;17:3082-91.
- Schwimmer JB, Pardee PE, Lavine JE, Blumkin AK, Cook S. Cardiovascular risk factors and the metabolic syndrome in pediatric nonalcoholic fatty liver disease. Circulation. 2008;118:277-83.
- Schwimmer JB, Zepeda A, Newton KP, et al. Longitudinal assessment of high blood pressure in children with nonalcoholic fatty liver disease. PLoS One. 2014;9(11):e112569.
- Sahoo K, Sahoo B, Choudhury AK, Sofi NY, Kumar R, Bhadoria AS. Childhood obesity: causes and consequences. J Family Med Prim Care. 2015; 4:187-92.
- Newton KP, Hou J, Crimmins NA, et al. Prevalence of prediabetes and type 2 diabetes in children with nonalcoholic fatty liver disease. JAMA Pediatr. 2016;170(10):e161971.
- Wiegand S, Keller KM, Röbl M, L’Allemand D, Reinehr T, Widhalm K, Holl RW. APV-Study Group and the German Competence Network Adipositas. Obese boys at increased risk for nonalcoholic liver disease: evaluation of 16.390 overweight or obese children and adolescents. Int J Obes (Lond). 2010;34:1468-74.
- Santos L, Hernández G, Puerta A, Enfermedad hepática por infiltración grasa no alcohólica. La nueva pandemia del milenio Revista Colombiana de Gastroenterologia. 2010;25:380-98.
- Shannon A, Alkhouri N, Carter-Kent C, Monti L, et al. Ultrasonographic quantitative estimation of hepatic steatosis in children with NAFLD. J Pediatr Gastroenterol Nutr. 2011;53:190-5.
- Mann J, Goonetilleke R, McKierman P. Paediatric non alcoholic fatty liver disease: a practical overview for non-specialists. Arch Dis Child. 2015;100:673-7.
- Feldstein A, Charatcharoenwitthaya P, Treeprasertsuk S, Benson J, et al. The natural history of nonalcoholic fatty liver disease in children: a follow–up study for up to 20 years. Gut. 2009;58(11):1538-44.
- Alavian SM, Mohammad-Alizadeh AH, Esna-Ashari F, Ardalan G, Hajarizadeh B. Non-alcoholic fatty liver disease prevalence among school-aged children and adolescents in Iran and its aso¬ciation with biochemical and anthropometric measures. LiverInt 2009;29:159-63.
- Rajindrajith S. Non-alcoholic fatty liver disease and its associations among adolescents in an urban, Sri Lankan community. BMC Gastroenterol. 2017;17(1):135.
- Breij LM, Kerkhof GF. Risk for Nonalcoholic Fatty Liver Disease in Young Adults Born Preterm. Res Paediatr. 2015;84(3):199-205.
- Méndez N, Gutiérrez Y, Chávez N, et al. Hígado graso no alcohólico y esteatohepatitis no alcohólica. Conceptos actuales. RevGastroenterol México. 2010;75:143S-148S.
- Herrera GA, Nassif HA, Arus SE, Cand HC, León N. Hígado graso. Enfoque diagnóstico y terapéutico. Revista Cubana Med [Internet]. 2007;46(1):3-5. [citado el 25 de junio de 2011].
- Pratt DS, Kaplan MM. Primary care: Evaluation of abnormal liver-enzyme results in asymptomatic patients. N Engl J Med. 2000;342(17):1266-71.
- Vos MB, et al. NASPGHAN Clinical Practice Guideline for the Diagnosis and Treatment of Nonalcoholic Fatty Liver Disease in Children: Recommendations from the Expert Committee on NAFLD (ECON) and the North American Society of Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). Journal of pediatric gastroenterology and nutrition. 2017;64(2):319-34.
- Younossi ZM, Diehl AM, Ong JP. Nonalcoholic fatty liver disease: An agenda for clinical research. Hepatology. 2002;35(4):746-52.
- American Gastroenterological Association. American Gastroenterological Association medical position statement: nonalcoholic fatty liver disease. Gastroenterology. 2002;123(5):1702-4.
Correspondencia: María Cristina Arregui
Correo electrónico: chris04_363@hotmail.com
Acta Gastroenterol Latinoam 2021;51(3):292-299
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE