Gloria Fernández-Esparrach, Henry Córdova
Unidad de endoscopia, Servicio de Gastroenterología, ICMDM, Hospital Clínic, Barcelona. IDIBAPS. CIBEREHD.
Universidad de Barcelona, Cataluña, España.
Acta Gastroenterol Latinoam 2020;50:21-24
Introducción
La Videoendoscopía digestiva alta (VEDA) se utiliza ampliamente en el diagnóstico y tratamiento de lesiones esofágicas, gástricas y del duodeno y es considerada un procedimiento seguro y bien tolerado. Entre las múltiples indicaciones aceptadas se incluyen: disfagia, hemorragia gastrointestinal, úlcera péptica, enfermedad por reflujo refractaria al tratamiento, estudio de anemia y enfermedad celiaca. Durante la exploración pueden realizarse biopsias diagnósticas, así como tratamientos para extirpar lesiones, obtener la hemostasia y la dilatación, o la colocación de prótesis en estenosis.
La calidad de la atención de la salud puede medirse comparando el trabajo de un individuo o de un grupo con un patrón de referencia. El parámetro que se utiliza para la comparación se denomina indicador de calidad. A diferencia de la colonoscopia de cribado, la VEDA de calidad presenta muchos interrogantes por resolver. Así, por ejemplo, no tenemos escalas de limpieza ni sabemos qué grado de visualización de la mucosa es recomendable; no se ha establecido la duración recomendable de la exploración; no existen datos sobre la tasa de detección de lesiones recomendable, además de que el tipo de posibles lesiones es mucho más variado que en la colonoscopia; la obtención de biopsias es a menudo poco fiable por ser poco representativa del área a valorar. La escasa evidencia existente al respecto, hace que la VEDA de calidad sea todo un reto.
Un estudio endoscópico de alta calidad garantiza al paciente un procedimiento seguro y con grandes posibilidades de éxito en cuanto a confirmar o descartar diagnósticos correctos y clínicamente relevantes. El establecimiento de indicadores de calidad y el cumplimiento de los estándares implica conocer el nivel de la calidad de los procedimientos que se realizan con el objetivo de identificar áreas de mejora. Si se aumenta el nivel de calidad, las ventajas para el paciente aumentarán, puesto que el número de procedimientos que se realicen con una indicación apropiada será mayor y, por lo tanto, disminuirá la morbimortalidad asociada. La consecuencia final de este proceso de mejora de la calidad sería contener los costos y ofrecer un mejor servicio de manera global.
Veda de calidad
En los últimos años, las diferentes sociedades científicas en el área de la Endoscopía han hecho un esfuerzo por abordar el tema de la calidad de la VEDA. En 2006, la American Society for Gastrointestinal Endoscopy (ASGE) y el American College of Gastroenterology (ACG) publicaron la primera versión de indicadores de calidad en la VEDA, que ha sido actualizada recientemente en 2015, integrando nuevos indicadores de calidad de proceso divididos en 3 periodos: previo al procedimiento, intra procedimiento y después del procedimiento. En esta revisión haremos un resumen de las recomendaciones de la ASGE/ACG así como de las de la Sociedad Europea de Endoscopía Gastrointestinal (ESGE) y la Unión Europea de Gastroenterología (UEG) publicadas en 2016 y que sólo se centran en el procedimiento. Como indicadores pre-procedimiento, sólo mencionaremos la necesidad de que el paciente esté en ayunas, siendo la recomendación de mínimo 6 horas para sólidos y mínimo de 2 horas para líquidos. Existen estudios que demuestran que el correcto ayuno de líquidos mejora el confort durante la exploración y permite una mejor visualización de la mucosa.
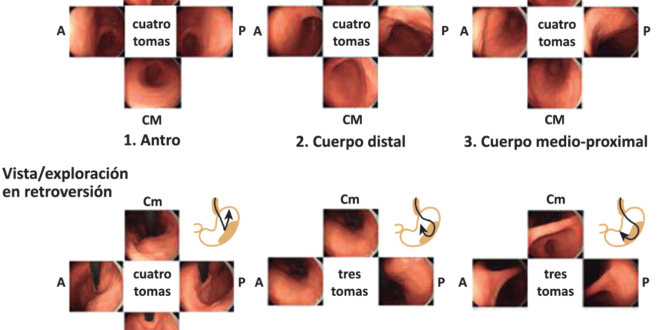
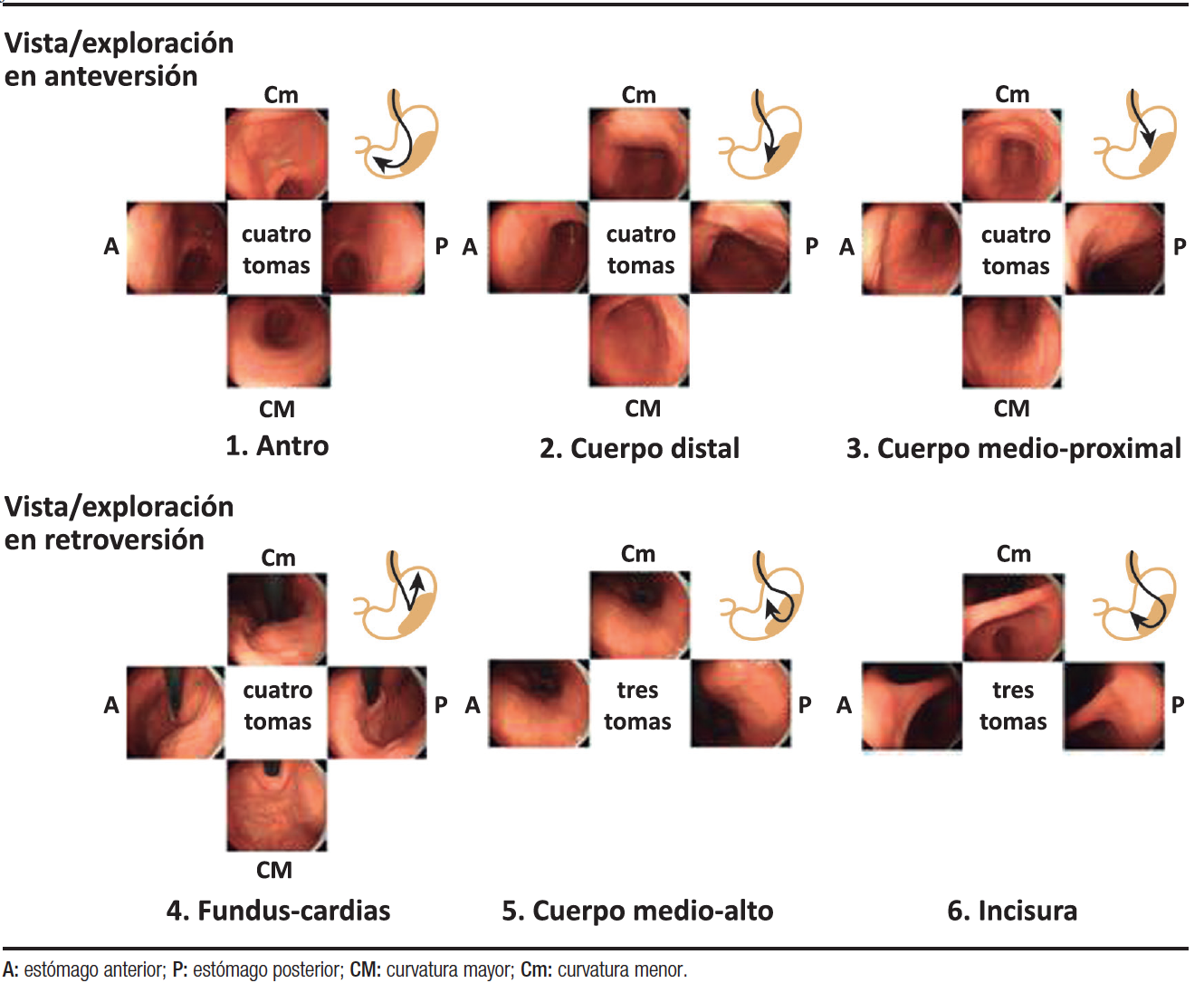
La definición de un procedimiento completo incluye la inspección del esófago, estómago y duodeno. En el caso de que no se haya realizado una VEDA en los 3 años previos, la duración de la exploración (desde la intubación hasta la extubación) debe ser de mínimo 7 minutos. Teh et al., demostraron que los endoscopistas lentos detectaban más lesiones premalignas gástricas (OR 2,5) y también más cáncer y lesiones con displasia (OR 3,42). Es recomendable incluir la visualización de la papila como criterio de exploración completa (de forma extrapolable a la intubación del ciego en la colonoscopia), ya que se asocia a una tasa más alta de detección de lesiones, probablemente porque refleja que se trata de una exploración más minuciosa. La realización de una VEDA completa incluye la fotodocumentación adecuada (de las áreas de referencia y de las lesiones). Cuando la indicación es por reflujo gastroesofágico y esófago de Barrett (EB), deberían realizarse fotografías de la impronta diafragmática y el borde superior de los pliegues gástricos. Una VEDA de calidad debería incluir al menos 10 fotografías: esófago proximal, esófago distal, impronta diafragmática/línea Z, fundus y cardias en retroversión, cuerpo en visión frontal, cuerpo retroversión, incisura, antro, bulbo y segunda porción duodenal. En las endoscopías para seguimiento de pacientes con lesiones pre-neoplásicas gástricas se recomienda el protocolo de cribado sistemático (más conocido como SSS) que consiste en la obtención de 22 fotografías (Figura 1).
Figura 1. Protocolo sistemático de exploración (SSS): consiste en la toma de 22 fotografías, tanto en anteversión (4 del antro, 4 de cuerpo distal y 4 de cuerpo medio-proximal) como en retroversión (3 de incisura, 3 de cuerpo medio-alto y 4 de fundus-cardias
En cuanto a la identificación de patología, cuando la indicación es para seguimiento de metaplasia intestinal, el tiempo de exploración en estómago deber ser mínimo de 5 minutos para poder realizar un mapeo de toda la mucosa. Cuando se realiza la revisión de un EB, dedicar más tiempo aumenta la tasa de detección de lesiones visibles. En el estudio de Gupta et al. la tasa de detección fue del 30% cuando se dedicaron ≤ 2 minutos y 85% cuando se dedicaron 7 minutos o más y la tasa de detección de lesiones con displasia o cáncer fue de 15% y 69%, respectivamente, por lo que el tiempo de inspección debería ser de 1 min/cm. En ambos casos, la inspección óptima incluye el uso de endoscopios de alta definición, sedación del paciente, insuflación óptima para una correcta distensión de los pliegues (especialmente en el estómago) y lavados para eliminar restos de moco y espuma. Ya hemos comentado en la introducción que no disponemos de escalas validadas para valorar el grado de limpieza pero se recomienda describir la presencia de restos alimentarios, sangre o burbujas que impidan la valoración de una parte de la mucosa.
Todos los expertos coinciden en que debe utilizarse una terminología estandarizada y validada para describir los hallazgos patológicos (por ejemplo, clasificación de Paris para pólipos y lesiones neoplásicas precoces o clasificación de los Ángeles para la esofagitis por reflujo). El EB merece una atención especial por la gran variabilidad que existe en la forma de presentación y las dificultades para estandarizar la forma de describirlo. La clasificación de Praga tiene en cuenta tanto la extensión circunferencial como la máxima longitud y es la más utilizada en el momento actual. También es muy importante realizar una toma de biopsias lo más exhaustiva y representativa posible por lo que se recomienda seguir el protocolo de Seattle consistente en obtener biopsias de los cuatro cuadrantes y cada 2 cm. Ninguna de las dos guías menciona la posibilidad de utilizar colorantes para mejorar el diagnóstico óptico de lesiones precoces tanto en el seguimiento de la metaplasia intestinal gástrica como del EB. Sólo se menciona la recomendación del uso de lugol en pacientes con riesgo de cáncer esofágico. El protocolo de biopsias de Sydney es el que se utiliza en el estómago y permite el diagnóstico, extensión y seguimiento de la metaplasia intestinal además del diagnóstico de la infección por Helicobacter pylori. Consiste en obtener dos biopsias de antro, una de incisura y dos del cuerpo. Una inspección óptima incluye: lavados, sedación, endoscopios de alta definición.
Otro aspecto muy importante de la calidad es el registro de las complicaciones, tanto intra como post-procedimiento. Sin embargo, estas últimas requieren de registros prospectivos y se necesita personal dedicado para contactar con los pacientes días después de la realización de la VEDA.
El consenso asiático sobre estándares de calidad en la VEDA utiliza la misma definición de VEDA de calidad pero introduce una nueva variable que es la estratificación del riesgo de padecer cáncer gástrico antes de empezar la exploración ya que todos los pacientes no son iguales. Además, en el momento de la exploración, la identificación de algunos signos como atrofia de pliegues gástricos a nivel del cuerpo proximal o la ausencia de un patrón de vénulas colectoras deben ponernos en alerta ya que, en el contexto de una gastritis atrófica o la infección por Helicobacter pylori, el riesgo de cáncer gástrico y lesiones preneoplásicas es mayor y la exploración debe ser más exhaustiva y minuciosa. En Asia también se recomienda utilizar siempre un mucolítico y un antiespumante antes de la endoscopía para que la visibilidad sea mejor, además de utilizar endoscopios con magnificación. Sin embargo, en los países Occidentales la magnificación no está ampliamente disponible.
Indicadores para medir la veda de calidad
A continuación vamos a enumerar los indicadores propuestos por la ASGE y la ESGE.
Indicadores Pre-procedimiento
• Indicación adecuada para la VEDA. Una indicación adecuada se asocia a una tasa significativamente más elevada de hallazgos clínicamente relevantes.
• Obtención del consentimiento informado.
• Administración de antibióticos profilácticos en pacientes con cirrosis y hemorragia digestiva alta y previos a la colocación de la gastrostomía percutánea endoscópica.
• Administración de inhibidores de la bomba de protones (IBP) en pacientes con úlcera sangrante.
• Administración de drogas vasoactivas en pacientes con sospecha de sangrado por varices esofágicas.
• Endoscopía realizada por médicos entrenados.
Indicadores Intra-procedimiento
• Examinación completa del esófago, estómago y duodeno incluyendo retroflexión en estómago. Y además debe estar documentado en el informe.
• Realizar biopsias de la úlcera gástrica en pacientes sin sangrado activo.
• En EB utilizar la clasificación de Praga.
• Realizar biopsias en casos de sospecha de EB. Toma de biopsias según el protocolo de Seattle después de la inspección exhaustiva.
• Describir las lesiones según la clasificación de Paris.
• Descripción y localización de la lesión causante de la hemorragia digestiva.
• Descripción de los estigmas en la úlcera péptica: sangrado activo y vaso visible
• Tratamiento endoscópico del sangrado activo o del vaso visible no sangrante de las úlceras. Documentar si se logró la hemostasia. Realizar dos modalidades de tratamiento endoscópico en la úlcera péptica con sangrado activo o vaso visible no sangrante.
• Ligadura como tratamiento de elección de las varices esofágicas.
• Cuatro biopsias intestinales en pacientes con sospecha de enfermedad celíaca.
Indicadores Post-procedimiento
• Recomendar el uso de IBP en pacientes a quienes se realiza dilatación por estenosis pépticas esofágicas.
• Utilizar IBP/antagonistas H2 en pacientes con úlcera gástrica y duodenal.
• Detección de Helicobacter pylori en pacientes con úlcera gástrica o duodenal.
• Endoscopía de “second look” en caso de resangrado de una úlcera péptica tratada endoscópicamente.
• Contactar a los pacientes para documentar la aparición de complicaciones después de la VEDA.
Un grupo de investigadores del hospital Clínic de Barcelona realizó un estudio cuyo objetivo fue analizar el cumplimiento de los criterios de calidad en la VEDA y evaluar la mejora tras la realización de un programa de formación. Para ello estudiaron dos cohortes: una retrospectiva (grupo control) y otra prospectiva (grupo intervención), antes y después de un programa de formación. El programa de formación consistió en una sesión informativa, la mejora del programa de elaboración de informes con la inclusión de algunos campos obligatorios y la distribución de un dosier con todos los protocolos de biopsias y clasificaciones. Utilizando los indicadores propuestos por la ASGE, tras el programa de formación se observó una mejoría significativa en los siguientes indicadores: indicación documentada, exploraciones completas documentadas, actuación correcta, toma adecuada de biopsias según protocolos, fotodocumentación de lesiones descritas, fotodocumentación por segmentos y valoración global correcta. La conclusión del estudio fue que un programa de formación muy sencillo mejora los indicadores de calidad de la VEDA, alcanzando la mayoría los estándares recomendados por la ASGE.
Sin embargo, esta mejora de los indicadores de calidad no se mantiene en el tiempo. Los mismos investigadores evaluaron el cumplimiento a largo plazo (3 años). Para ello diseñaron un estudio comparativo de 2 cohortes: VEDA posteriores a un programa de formación realizado en 2016 y VEDA en 2019. Los resultados mostraron una disminución significativa en prácticamente todos los indicadores de calidad que, además no alcanzaron los estándares recomendados: retroversión gástrica, protocolo de biopsias de Seattle, descripción de la lesión en la hemorragia, el protocolo en EC que recomendamos son 4 de duodeno distal y 2 de bulbo, fotodocumentación de la lesión. Por ello, es necesario hacer programas de formación continuados para mantener la calidad de la VEDA por encima de los estándares recomendados.
Experiencia y conocimientos del endoscopista
Es muy importante saber diferenciar el aspecto normal de la mucosa y sus alteraciones. Por ejemplo, el endoscopista tiene que saber cuándo sospechar la presencia de atrofia gástrica, reconocer la metaplasia intestinal, reconocer que pacientes tienen riesgo de tener Helicobacter pylori positivo (cuando hay alteraciones inflamatorias o existen cambios en el patrón regular de las vénulas colectoras entre otros), identificar pequeños cambios en la irregularidad de la superficie o cambios en el color (mucosa pálida o eritematosa). También es crucial saber utilizar toda la tecnología que tenemos al alcance, por ejemplo cromoendoscopía virtual o índigo carmín, ya que nos ayuda a detectar lesiones precoces y pre-neoplásicas.
Bibliografía recomendada
- Park WG, Shaheen NJ, Cohen J, Pike IM, Adler DG, et al. Quality indicators for EGD. Gastrointest Endosc. 2015; 81 (1): 17-30.
- Bisschops R, Areia M, Coron E, et al. Performance measures for upper gastrointestinal endoscopy: A European Society of Gastrointestinal Endoscopy quality improvement initiative. United European Gastroenterol J 2016; 4: 629-656.
- Teh JL, Tan JR, Lau LJ, Saxena N, Salim A, et al. Longer examination time improves detection of gastric cancer during diagnostic upper gastrointestinal endoscopy. Clin Gastroenterol Hepatol 2015; 13 (3): 480-487.
- Gupta N, Gaddam S, Wani SB, et al. Longer inspection time is associated with increased detection of high-grade dysplasia and esophageal adenocarcinoma in Barrett’s esophagus. Gastrointest Endosc 2012; 76: 531-538.
- Chiu PWY, Uedo N, Singh R, et al. An Asian consensus on standards of diagnostic upper endoscopy for neoplasia. Gut 2019; 68 (2): 186-197.
- Córdova H, Sánchez-Montes C, Delgado-Guillena PG, et al. Quality indicators for esophagogastroduodenoscopy: A comparative study of outcomes after an improvement programme in a tertiary hospital. Gastroenterol Hepatol 2017; 40: 587-594.
- Alcaraz-Serrat JA, Córdova H, Moreira L, et al. Evaluation of long-term adherence to oesophagogastroduodenoscopy quality indicators. Gastroenterol Hepatol 2020 Jul 13;S0210-5705(20)30218-1.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE