Herbert Burgos
Especialista en Gastroenterologia. Licenciatura en Medicina y Cirugía en la Universidad de Costa Rica. Miembro de la Asociación Americana de Endoscopia Gastrointestinal. Fellow de la Asociación Americana de Endoscopia Gastrointestinal. Director del Centro Entrenamiento de la Organización Mundial de Gastroenterología WGO-San José Training Center.
San José, Costa Rica.
Acta Gastroenterol Latinoam 2020;50:25-31
Introducción
La creciente práctica de la endoscopía ha generado un impulso significativo en el desarrollo de la Gastroenterología, su aplicación tanto diagnóstica como terapéutica ha permitido mejorar la atención de los pacientes y sus dolencias digestivas.
Sin embargo, el proceso para llevar a cabo esta técnica ha generado múltiples variantes de aplicabilidad y metodologías de procesos. Esto tiene un impacto variable en el curso habitual de realización del estudio y con ello difiere la calidad, así como los resultados de los exámenes.
Por esto, es esencial establecer los estándares mínimos de calidad que permitan una práctica de la colonoscopía en forma segura, efectiva y reproducible. Todos los endoscopistas que realicen colonoscopías deben medir la calidad de sus exámenes.
El desarrollo de nuevas tecnologías en endoscopía a partir de la incorporación de la videoendoscopía representa ahora un nuevo reto y obliga a actualizar los estándares para obtener resultados óptimos.
El proceso de evaluación en la videocolonoscopía se ha dirigido a la mejora en la tasa de detección de adenomas, el cual requiere una mejora en los indicadores de calidad, a través de medidas concretas.
Medidas de calidad en una videocolonoscopía
Los indicadores más importantes están señalados en la Tabla 1, el peso que tienen en la mejora de la calidad es variable y su implementación en forma independiente o conjunta siempre mejorarán los índices de detección de lesiones, pero estos indicadores requieren que el proceso de la endoscopia cumpla con los protocolos correctos en la realización del estudio.
Tabla 1. Indicadores de calidad en colonoscopía

Recientemente, el grupo de Calidad en Endoscopía del Colegio Americano de Gastroenterología y de la Asociación Americana de Endoscopía Gastrointestinal (ACG/ASGE según sus siglas en inglés) establecieron una serie de medidas para mejorar la calidad en endoscopía, las cuales se señalan en la Tabla 2. También la Sociedad Europea de Endoscopía Gastrointestinal ha hecho una revisión cuyos puntos más relevantes se encuentran resumidos en la Tabla 3.
Tabla 2. Medidas de calidad en colonoscopía

Tabla 3. Medidas de calidad para colonoscopía de la Sociedad Europea de Endoscopía Gastrointestinal

A continuación, trataremos en forma específica su evaluación.
A. Indicaciones de la colonoscopía
El desarrollo de la técnica endoscópica ha permitido generar múltiples indicaciones para la colonoscopía que se extienden desde su uso diagnóstico al terapéutico. Las indicaciones habituales se encuentran en la Tabla 4. El objetivo es minimizar las indicaciones inapropiadas. Cuando la indicación no es la habitual, esto debe ser documentado. Es necesario evitar un estudio cuando no es necesario ya que más allá de generar costos, los beneficios son usualmente bajos, exponiendo al paciente al riesgo del procedimiento.
Tabla 4. Indicaciones para colonoscopía

En el tamizaje de pacientes la definición de inicio de éste es variable según las incidencias de neoplasia colorrectal en la población de estudio. En general, 50 años es el punto usual de inicio, pero debemos considerar los antecedentes de cáncer colorrectal en familiares de primer grado. La existencia de neoplasia en etapas tempranas debe establecer una estrategia de detección 10 años antes de la edad del familiar.
Además, la evaluación debe incluir la historia familiar previa de poliposis familiar adenomatosa o neoplasias como cáncer de endometrio, pelvis renal u ovarios, que podrían implicar mayor riesgo de carcinogénesis. Una vez estratificado el riesgo se debe proceder a realizar el estudio acorde con la evaluación. Otro aspecto importante es que los intervalos sean los recomendados en caso de post polipectomía y postresección cáncer de colon o de 10 años luego de la colonoscopía de tamizaje en población de riesgo promedio.
B. Preparación para el estudio
El estándar de preparación actual es la utilización de dosis divididas, sin embargo, se ha documentado que hasta un 20% de los estudios siguen utilizando monodosis de preparación.
Una mala preparación genera procedimientos más prolongados, con disminución de la tasa de intubación cecal, que reduce significativamente la detección de adenomas y genera procedimientos repetidos y disminuye el cumplimiento paciente-proveedor.
El uso de dosis divididas puede ser realizada con diferentes combinaciones de productos como preparaciones isosmóticas de alto (4 litros) o bajo volumen (2 litros) o bien productos de bajo volumen hiperosmótico.
La parte inicial se toma en la tarde o noche previa y la segunda dosis 4 a 6 horas antes de la colonoscopía, haciendo la última ingesta hasta 2 horas antes del procedimiento.
De acuerdo a las guías de la Asociación Americana de Anestesiología, el paciente puede ingerir líquidos claros hasta 2 horas antes del procedimiento, pero debemos tener presente que los estudios que avalan estas recomendaciones no incluyeron pacientes con gastroparesia, acalasia, disfunciones del sistema nervioso central, pacientes con patología cardíaca, pulmonar, inmunológica. En estas poblaciones donde mínimas aspiraciones pueden ser devastadoras es prudente considerar intervalos más prolongados de ayuno.
Esta metodología es superior a la ingesta de la dosis total en una sola toma generando una limpieza satisfactoria de colon (OR 3,70; 95% CI, 2,79-4,91; p < 0,01) con menor probabilidad de discontinuar la preparación (OR 0,53; 95% CI, 0,28-0,98; p = 0,04), mayor aceptación a repetirla (OR 1,76; 95% CI,1,06-2,91; p = 0,03) y reducción de las náuseas (OR 0,55; 95% CI, 0,38- 0,79; p < 0,01) según lo demostró el estudio de Kilgore TW, et al.
El beneficio final demostrado fue duplicar la tasa de detección de adenomas en forma global, así como en lesiones menores de 9 mm. La calidad de la preparación debe estar documentada en el reporte endoscópico. Se recomienda utilizar las escalas de preparación de Boston o de Ottawa. Para la escala de Boston se considera una adecuada preparación cuando el score es ≥ 6.
Es necesario considerar si el paciente tiene factores que induzcan a tener una mala preparación, como el uso de antidepresivos tricíclicos, narcóticos, ingesta de múltiples medicamentos, cirugía previa colorrectal, lesiones de espina dorsal, enfermedad de Parkinson o un índice de masa corporal (IMC) elevado.
La suspensión de antitrombóticos es también un elemento variable y debe estar dirigido a proteger primariamente al paciente de eventos tromboembólicos. El riesgo de sangrado se debe optimizar según el tipo de medicamento. Actualmente, existen múltiples guías que nos permiten establecer el riesgo, la necesidad de suspensión y la utilización de terapia puente peri-endoscópica para mejorar su manejo.
Se debe considerar la profilaxis antimicrobiana en la combinación de estudios bajos con ecoendoscopía y toma de biopsias con aguja fina; así como en pacientes que se encuentren en diálisis peritoneal, en pacientes con cirrosis y sangrado digestivo; y ante condiciones cardíacas con alto riesgo de endocarditis bacteriana (válvulas cardíacas protésicas o bioprotésicas, antecedentes de endocarditis, cardiopatías congénitas, etc.).
C. Tasa de detección de adenomas
Es la frecuencia con que se detectan adenomas en pacientes asintomáticos, mayores de 50 años, de riesgo promedio para cáncer colorrectal cuya indicación de colonoscopia fue tamizaje.
Los mínimos actuales aceptables son 30% en hombres y 20% en mujeres, sin embargo, recientes publicaciones establecen valores mayores a 50% como objetivo de detección. La tasa de detección de adenomas es considerada como el marcador individual más importante de calidad de la colonoscopia.
Es interesante destacar que el estándar mínimo para pacientes con SOMF (FIT positivo) se desconoce, aunque se considera que debería ser más alto.
Además debemos mencionar que la tasa de detección de adenomas (ADR según sus siglas en inglés) fue establecida para adenomas convencionales y no aplica para las lesiones serratas que no deben ser consideradas para el ADR.
Ante limitaciones para obtener la histopatología de los pólipos, se puede utilizar la tasa de detección de pólipos (PDR según sus siglas en inglés) que en muchos estudios tiene una buena correlación con el ADR. El estándar mínimo se estima en un 40%, lo cual correspondería a un 25% de la tasa detección de adenomas.
D. Tiempo de retirada
Este tiempo se mide desde la llegada a ciego hasta su retiro a través del ano. No debe ser menor a 6 minutos en colonoscopías que no requieran biopsia o resección de lesiones y se asocia a la tasa de detección de adenomas. Hay que optimizar el tiempo realizando una distensión adecuada, lavado y limpieza de restos y vigilar detrás de los pliegues, procurando establecer una inspección de todos los segmentos. Con ello se reduce sustancialmente la aparición de carcinoma de intervalo colónico.
Como consejos para mejorar el retiro hay que evitar la formación de bucles aumentando el control de ángulos de la colonoscopia, hay que tener cuidado en ángulos cortos, menos aire siempre es útil. El patrón de retiro en helicoide mejora el diagnóstico.
E. Tasa de estudio completo
Es esencial que la colonoscopía sea completa hasta el ciego, no es admisible omitir la exploración de alguno de los segmentos del colon. En el pasado era común la práctica de rectosigmoidoscopías como un método de estudio de tamizaje, bajo la premisa de que la mayoría de las lesiones se encontraban en la porción rectosigmoidea. La evidencia ha demostrado que esto no es así, ya que el patrón de aparición de las lesiones premalignas actualmente es mayor a nivel proximal que distal; esto fue señalado por Mehrotra A, et al., que demostró en un grupo de 104.619 colonoscopias que la detección de adenomas proximales fue mayor a la de los adenomas distales (24,9% vs. 12,7% respectivamente).
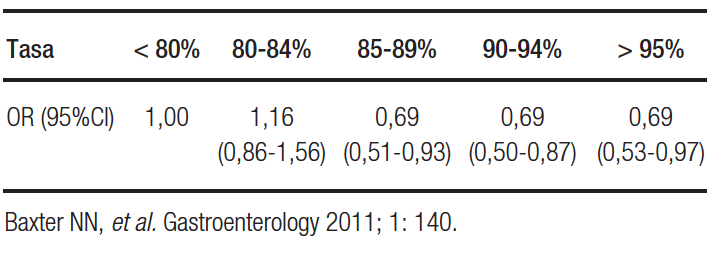
La falla en no completar el estudio está relacionada con aumento en el carcinoma de intervalo, como lo demostró Baxter NN, et al. y se resume en la Tabla 5.
Tabla 5. Tasa de estudio completo estudio y cáncer de intervalo
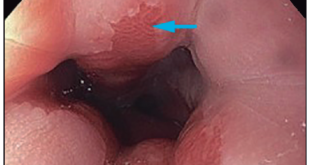
Por tanto, es esencial la exploración y documentación de todos los segmentos colorrectales, además de la evaluación de la válvula ileocecal y la intubación cecal.
Es recomendable que la tasa de Intubación Cecal sea mayor del 95% en la colonoscopía de tamizaje, y del 90% en todas las indicaciones. La mayoría de las fallas están relacionadas con mala preparación, formación de bucles, cirugía previa, obstrucción, colitis severa, bajo IMC, intolerancia del paciente y diverticulosis grave. Esto puede mejorarse con cambios de posición, presión abdominal, intercambio de agua y el uso de capuchón. Los procedimientos donde no se puede intubar el fondo cecal debido a la mala preparación colónica o colitis severa no deben ser considerados para determinar la tasa.
G. Técnicas para aumentar la detección de adenomas
Se han implementado diferentes elementos y técnicas para mejorar la detección de adenomas; entre ellas tenemos:
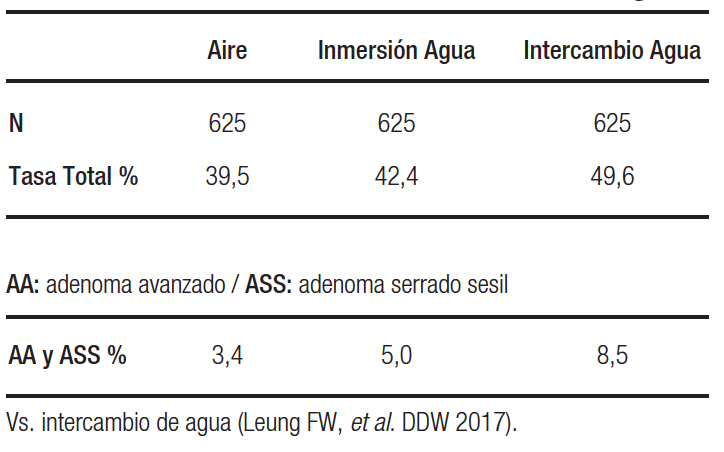
1. Técnica de inmersión e intercambio de agua: ambas técnicas han demostrado que aumentan la tasa de detección de adenomas en forma significativa como lo muestra la Tabla 6.
Tabla 6. Tasa de detección de adenomas: inmersión de agua
2. Uso de capuchones (CAPS): existen múltiples dispositivos en esta modalidad, en general todos han demostrado el aumento en la tasa de intubación cecal y la detección de adenomas, siendo mejores los resultados en colon derecho y principalmente para lesiones planas y en las lesiones sésiles aserradas. Recientemente Desai M, et al. realizó un meta-análisis que demuestra que el uso del capuchón (en 2546 eventos) favoreció la evaluación de los adenomas proximales de colon (OD 1,49 / 1,08-2,05).
3. Posición dinámica del paciente al retiro: la ganancia en tasa de detección de adenomas aumenta hasta un 9,8%, principalmente para lesiones localizadas en transverso, flexura esplénica, descendente y sigmoides.
4. Retroflexión cecal: Es una medida que depende del tipo de endoscopio y las condiciones singulares de posición, la mayoría de las guías de calidad no lo mencionan como un método efectivo.
5. Uso de imagen de endoscopía avanzada: el impacto de estas tecnologías se encuentra en evaluación, debido a la variabilidad de técnicas de estudio es difetícil establecer resultados comparativos, sin embargo, la utilización de cromoendoscopia ha mejorado el diagnóstico de las lesiones adenomatosas, así como la caracterización de estas, aumentando hasta un 8% más detección de adenomas.
Tal vez el aporte más importante es que cuando se compara la mejora en detección entre expertos y no expertos, el uso de estas técnicas tiende a mejorar sustancialmente la detección entre los no expertos.
La incorporación de la cromoendoscopía de contraste y vital ha demostrado en diferentes meta-análisis una mejora significativa en comparación con la luz blanca, por lo cual su incorporación a la evaluación puede incrementar el diagnóstico de lesiones hasta un 15%.
En resumen, los elementos que mejoran la calidad en colonoscopia son múltiples e incluyen los aspectos de pre-procedimiento, intraprocedimiento y postprocedimiento. Los indicadores de calidad más importantes son 1. La tasa de detección de adenomas, 2. Tasa de intubación cecal con documentación fotográfica y 3. Seguir las recomendaciones de los intervalos de colonoscopia de tamizaje y de vigilancia post polipectomía.
El análisis de las oportunidades de mejora en la tasa de detección de adenomas, por lo tanto, deben ser contextuales, y en la mayoría de los casos en diferentes puntos del proceso. Su comprensión y aplicación siempre tendrá un efecto aditivo en la detección de lesiones tempranas con el efecto directo sobre la mejora de morbilidad y mortalidad de nuestros pacientes.
Bibliografía recomendada
- Rex, D. K., Schoenfeld, P. S., Cohen, J., Pike, I. M., Adler, D. G., Fennerty, M. B., Lieb, J. G., 2nd, Park, W. G., Rizk, M. K., Sawhney, M. S., Shaheen, N. J., Wani, S., & Weinberg, D. S. (2015). Quality indicators for colonoscopy. Gastrointestinal endoscopy, 81(1), 31–53. https://doi.org/10.1016/j.gie.2014.07.058
- Rex DK, Petrini JL, Baron TH, Chak A, Cohen J, Deal SE, Hoffman B, Jacobson BC, Mergener K, Petersen BT, Safdi MA, Faigel DO, Pike IM; ASGE/ACG Taskforce on Quality in Endoscopy. Quality indicators for colonoscopy. Am J Gastroenterol. 2006 Apr;101(4):873-85. doi: 10.1111/j.1572-0241.2006.00673.x. PMID: 16635231.
- Kaminski, M. F., Thomas-Gibson, S., Bugajski, M., Bretthauer, M., Rees, C. J., Dekker, E., Hoff, G., Jover, R., Suchanek, S., Ferlitsch, M., Anderson, J., Roesch, T., Hultcranz, R., Racz, I., Kuipers, E. J., Garborg, K., East, J. E., Rupinski, M., Seip, B., Bennett, C., … Rutter, M. D. (2017). Performance measures for lower gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy, 49(4), 378–397. https://doi.org/10.1055/s-0043-103411
- Raju, G. S., Vadyala, V., Slack, R., Krishna, S. G., Ross, W. A., Lynch, P. M., Bresalier, R. S., Hawk, E., & Stroehlein, J. R. (2013). Adenoma detection in patients undergoing a comprehensive colonoscopy screening. Cancer medicine, 2(3), 391–402. https://doi.org/10.1002/cam4.73
- Rex, D. K., Boland, C. R., Dominitz, J. A., Giardiello, F. M., Johnson, D. A., Kaltenbach, T., Levin, T. R., Lieberman, D., & Robertson, D. J. (2017). Colorectal cancer screening: Recommendations for physicians and patients from the U.S. Multi-Society Task Force on Colorectal Cancer. Gastrointestinal endoscopy, 86(1), 18–33. https://doi.org/10.1016/j.gie.2017.04.003
- Kahi, C. J., Anderson, J. C., & Rex, D. K. (2013). Screening and surveillance for colorectal cancer: state of the art. Gastrointestinal endoscopy, 77(3), 335–350. https://doi.org/10.1016/j.gie.2013.01.002
- Wexner, S. D., Beck, D. E., Baron, T. H., Fanelli, R. D., Hyman, N., Shen, B., Wasco, K. E., American Society of Colon and Rectal Surgeons, American Society for Gastrointestinal Endoscopy, & Society of American Gastrointestinal and Endoscopic Surgeons (2006). A consensus document on bowel preparation before colonoscopy: prepared by a task force from the American Society of Colon and Rectal Surgeons (ASCRS), the American Society for Gastrointestinal Endoscopy (ASGE), and the Society of American Gastrointestinal and Endoscopic Surgeons (SAGES). Gastrointestinal endoscopy, 63(7), 894–909. https://doi.org/10.1016/j.gie.2006.03.918
- Johnson, D. A., Barkun, A. N., Cohen, L. B., Dominitz, J. A., Kaltenbach, T., Martel, M., Robertson, D. J., Boland, C. R., Giardello, F. M., Lieberman, D. A., Levin, T. R., & Rex, D. K. (2014). Optimizing adequacy of bowel cleansing for colonoscopy: recommendations from the U.S. multi-society task force on colorectal cancer. Gastrointestinal endoscopy, 80(4), 543–562. https://doi.org/10.1016/j.gie.2014.08.002
- Kim, H. N., & Raju, G. S. (2010). Bowel preparation and colonoscopy technique to detect non-polypoid colorectal neoplasms. Gastrointestinal endoscopy clinics of North America, 20(3), 437–448. https://doi.org/10.1016/j.giec.2010.03.005
- Sacks, N. C., Sharma, A., Cyr, P. L., Bertiger, G., Dahdal, D. N., & Brogadir, S. P. (2018). Real-world comparison of the effectiveness and safety of different bowel preparation agents. Clinical and experimental gastroenterology, 11, 289–299. https://doi.org/10.2147/CEG.S171861
- Kilgore, T. W., Abdinoor, A. A., Szary, N. M., Schowengerdt, S. W., Yust, J. B., Choudhary, A., Matteson, M. L., Puli, S. R., Marshall, J. B., & Bechtold, M. L. (2011). Bowel preparation with split-dose polyethylene glycol before colonoscopy: a meta-analysis of randomized controlled trials. Gastrointestinal endoscopy, 73(6), 1240–1245. https://doi.org/10.1016/j.gie.2011.02.007
- ASGE Standards of Practice Committee, Saltzman, J. R., Cash, B. D., Pasha, S. F., Early, D. S., Muthusamy, V. R., Khashab, M. A., Chathadi, K. V., Fanelli, R. D., Chandrasekhara, V., Lightdale, J. R., Fonkalsrud, L., Shergill, A. K., Hwang, J. H., Decker, G. A., Jue, T. L., Sharaf, R., Fisher, D. A., Evans, J. A., Foley, K., … Acosta, R. D. (2015). Bowel preparation before colonoscopy. Gastrointestinal endoscopy, 81(4), 781–794. https://doi.org/10.1016/j.gie.2014.09.048
- Cohen L. B. (2008). Clinical trial: a dose-response study of fospropofol disodium for moderate sedation during colonoscopy. Alimentary pharmacology & therapeutics, 27(7), 597–608. https://doi.org/10.1111/j.1365-2036.2008.03598.x
- Hassan, C., East, J., Radaelli, F., Spada, C., Benamouzig, R., Bisschops, R., Bretthauer, M., Dekker, E., Dinis-Ribeiro, M., Ferlitsch, M., Fuccio, L., Awadie, H., Gralnek, I., Jover, R., Kaminski, M. F., Pellisé, M., Triantafyllou, K., Vanella, G., Mangas-Sanjuan, C., Frazzoni, L., … Dumonceau, J. M. (2019). Bowel preparation for colonoscopy: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – Update 2019. Endoscopy, 51(8), 775–794. https://doi.org/10.1055/a-0959-0505
- ASGE Standards of Practice Committee, Acosta, R. D., Abraham, N. S., Chandrasekhara, V., Chathadi, K. V., Early, D. S., Eloubeidi, M. A., Evans, J. A., Faulx, A. L., Fisher, D. A., Fonkalsrud, L., Hwang, J. H., Khashab, M. A., Lightdale, J. R., Muthusamy, V. R., Pasha, S. F., Saltzman, J. R., Shaukat, A., Shergill, A. K., Wang, A., … DeWitt, J. M. (2016). The management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointestinal endoscopy, 83(1), 3–16. https://doi.org/10.1016/j.gie.2015.09.035
- Chan, F., Goh, K. L., Reddy, N., Fujimoto, K., Ho, K. Y., Hokimoto, S., Jeong, Y. H., Kitazono, T., Lee, H. S., Mahachai, V., Tsoi, K., Wu, M. S., Yan, B. P., & Sugano, K. (2018). Management of patients on antithrombotic agents undergoing emergency and elective endoscopy: joint Asian Pacific Association of Gastroenterology (APAGE) and Asian Pacific Society for Digestive Endoscopy (APSDE) practice guidelines. Gut, 67(3), 405–417. https://doi.org/10.1136/gutjnl-2017-315131
- ASGE Standards of Practice Committee, Khashab, M. A., Chithadi, K. V., Acosta, R. D., Bruining, D. H., Chandrasekhara, V., Eloubeidi, M. A., Fanelli, R. D., Faulx, A. L., Fonkalsrud, L., Lightdale, J. R., Muthusamy, V. R., Pasha, S. F., Saltzman, J. R., Shaukat, A., Wang, A., & Cash, B. D. (2015). Antibiotic prophylaxis for GI endoscopy. Gastrointestinal endoscopy, 81(1), 81–89. https://doi.org/10.1016/j.gie.2014.08.008
- Hilsden, R. J., Rose, S. M., Dube, C., Rostom, A., Bridges, R., McGregor, S. E., Brenner, D. R., & Heitman, S. J. (2019). Defining and Applying Locally Relevant Benchmarks for the Adenoma Detection Rate. The American journal of gastroenterology, 114(8), 1315–1321. https://doi.org/10.14309/ajg.0000000000000120
- Dong, Z., Sun, H., Li, B., Zhang, Q., Sun, K., Wang, Z., Qian, X., Wang, J., Zhan, T., Jiang, Y., Chen, Y., & Xu, S. (2020). Comprehensive evaluation of the learning curve to achieve satisfactory adenoma detection rate. Journal of gastroenterology and hepatology, 10.1111/jgh.15314. Advance online publication. https://doi.org/10.1111/jgh.15314
- May, F. P., & Shaukat, A. (2020). State of the Science on Quality Indicators for Colonoscopy and How to Achieve Them. The American journal of gastroenterology, 115(8), 1183–1190. https://doi.org/10.14309/ajg.0000000000000622
- Kaltenbach, T., Anderson, J. C., Burke, C. A., Dominitz, J. A., Gupta, S., Lieberman, D., Robertson, D. J., Shaukat, A., Syngal, S., & Rex, D. K. (2020). Endoscopic Removal of Colorectal Lesions-Recommendations by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology, 158(4), 1095–1129. https://doi.org/10.1053/j.gastro.2019.12.018
- Shaukat, A., Rector, T. S., Church, T. R., Lederle, F. A., Kim, A. S., Rank, J. M., & Allen, J. I. (2015). Longer Withdrawal Time Is Associated With a Reduced Incidence of Interval Cancer After Screening Colonoscopy. Gastroenterology, 149(4), 952–957. https://doi.org/10.1053/j.gastro.2015.06.044
- Mehrotra, A., Morris, M., Gourevitch, R. A., Carrell, D. S., Leffler, D. A., Rose, S., Greer, J. B., Crockett, S. D., Baer, A., & Schoen, R. E. (2018). Physician characteristics associated with higher adenoma detection rate. Gastrointestinal endoscopy, 87(3), 778–786.e5. https://doi.org/10.1016/j.gie.2017.08.023
- Baxter, N. N., Sutradhar, R., Forbes, S. S., Paszat, L. F., Saskin, R., & Rabeneck, L. (2011). Analysis of administrative data finds endoscopist quality measures associated with postcolonoscopy colorectal cancer. Gastroenterology, 140(1), 65–72. https://doi.org/10.1053/j.gastro.2010.09.006
- Rex D. K. (2006). Quality in colonoscopy: cecal intubation first, then what?. The American journal of gastroenterology, 101(4), 732–734. https://doi.org/10.1111/j.1572-0241.2006.00483.x
- Shah, H. A., Paszat, L. F., Saskin, R., Stukel, T. A., & Rabeneck, L. (2007). Factors associated with incomplete colonoscopy: a population-based study. Gastroenterology, 132(7), 2297–2303. https://doi.org/10.1053/j.gastro.2007.03.032
- Kahi, C. J., Boland, C. R., Dominitz, J. A., Giardiello, F. M., Johnson, D. A., Kaltenbach, T., Lieberman, D., Levin, T. R., Robertson, D. J., & Rex, D. K. (2016). Colonoscopy surveillance after colorectal cancer resection: recommendations of the US multi-society task force on colorectal cancer. Gastrointestinal endoscopy, 83(3), 489–98.e10. https://doi.org/10.1016/j.gie.2016.01.020
- Tseng, C. W., & Hsieh, Y. H. (2020). Use of water immersion instead of water exchange underlay the unfavourable outcomes in the water-assisted sigmoidoscopy (WAS) study. Gut, gutjnl-2020-323362. Advance online publication. https://doi.org/10.1136/gutjnl-2020-323362
- Cheng, C. L., Kuo, Y. L., Hsieh, Y. H., Tang, J. H., & Leung, F. W. (2019). Water exchange colonoscopy decreased adenoma miss rates compared with literature data and local data with CO2 insufflation: an observational study. BMC gastroenterology, 19(1), 143. https://doi.org/10.1186/s12876-019-1065-2
- Leung, J. W., Yen, A. W., Jia, H., Opada, C., Melnik, A., Atkins, J., Feller, C., Wilson, M. D., & Leung, F. W. (2019). A prospective RCT comparing combined chromoendoscopy with water exchange (CWE) vs water exchange (WE) vs air insufflation (AI) in adenoma detection in screening colonoscopy. United European gastroenterology journal, 7(4), 477–487. https://doi.org/10.1177/2050640619832196
- Desai, M., Sanchez-Yague, A., Choudhary, A., Pervez, A., Gupta, N., Vennalaganti, P., Vennelaganti, S., Fugazza, A., Repici, A., Hassan, C., & Sharma, P. (2017). Impact of cap-assisted colonoscopy on detection of proximal colon adenomas: systematic review and meta-analysis. Gastrointestinal endoscopy, 86(2), 274–281.e3. https://doi.org/10.1016/j.gie.2017.03.1524
- Köksal, A. Ş., Kalkan, I. H., Torun, S., Taşkıran, I., Öztaş, E., Kayaçetin, E., & Şaşmaz, N. (2013). A simple method to improve adenoma detection rate during colonoscopy: altering patient position. Canadian journal of gastroenterology = Journal canadien de gastroenterologie, 27(9), 509–512. https://doi.org/10.1155/2013/276043
- Desai, M., Bilal, M., Hamade, N., Gorrepati, V. S., Thoguluva Chandrasekar, V., Jegadeesan, R., Gupta, N., Bhandari, P., Repici, A., Hassan, C., & Sharma, P. (2019). Increasing adenoma detection rates in the right side of the colon comparing retroflexion with a second forward view: a systematic review. Gastrointestinal endoscopy, 89(3), 453–459.e3. https://doi.org/10.1016/j.gie.2018.09.006
- Ball, A. J., Johal, S. S., & Riley, S. A. (2015). Position change during colonoscope withdrawal increases polyp and adenoma detection in the right but not in the left side of the colon: results of a randomized controlled trial. Gastrointestinal endoscopy, 82(3), 488–494. https://doi.org/10.1016/j.gie.2015.01.035
- Bisschops, R., East, J. E., Hassan, C., Hazewinkel, Y., Kamiński, M. F., Neumann, H., Pellisé, M., Antonelli, G., Bustamante Balen, M., Coron, E., Cortas, G., Iacucci, M., Yuichi, M., Longcroft-Wheaton, G., Mouzyka, S., Pilonis, N., Puig, I., van Hooft, J. E., & Dekker, E. (2019). Advanced imaging for detection and differentiation of colorectal neoplasia: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – Update 2019. Endoscopy, 51(12), 1155–1179. https://doi.org/10.1055/a-1031-7657
- Aziz, M., Desai, M., Hassan, S., Fatima, R., Dasari, C. S., Chandrasekar, V. T., Jegadeesan, R., Duvvuri, A., Patel, H., Rai, T., Sathyamurthy, A., Kohli, D. R., Vennalaganti, P., Nawras, A., Wallace, M., & Sharma, P. (2019). Improving serrated adenoma detection rate in the colon by electronic chromoendoscopy and distal attachment: systematic review and meta-analysis. Gastrointestinal endoscopy, 90(5), 721–731.e1. https://doi.org/10.1016/j.gie.2019.06.041
- Yoshida, N., Hisabe, T., Ikematsu, H., Ishihara, H., Terasawa, M., Inaba, A., Sato, D., Cho, H., Ego, M., Tanaka, Y., Yasuda, R., Inoue, K., Murakami, T., Inada, Y., Itoh, Y., & Saito, Y. (2020). Comparison Between Linked Color Imaging and Blue Laser Imaging for Improving the Visibility of Flat Colorectal Polyps: A Multicenter Pilot Study. Digestive diseases and sciences, 65(7), 2054–2062. https://doi.org/10.1007/s10620-019-05930-x
- Shinozaki, S., Kobayashi, Y., Hayashi, Y., Sakamoto, H., Sunada, K., Lefor, A. K., & Yamamoto, H. (2019). Colon polyp detection using linked color imaging compared to white light imaging: Systematic review and meta-analysis. Digestive endoscopy : official journal of the Japan Gastroenterological Endoscopy Society, 10.1111/den.13613. Advance online publication. https://doi.org/10.1111/den.13613
- Leung, J. W., Yen, A. W., Jia, H., Opada, C., Melnik, A., Atkins, J., Feller, C., Wilson, M. D., & Leung, F. W. (2019). A prospective RCT comparing combined chromoendoscopy with water exchange (CWE) vs water exchange (WE) vs air insufflation (AI) in adenoma detection in screening colonoscopy. United European gastroenterology journal, 7(4), 477–487. https://doi.org/10.1177/2050640619832196
- Matsuda, T., Ono, A., Sekiguchi, M., Fujii, T., & Saito, Y. (2017). Advances in image enhancement in colonoscopy for detection of adenomas. Nature reviews. Gastroenterology & hepatology, 14(5), 305–314. https://doi.org/10.1038/nrgastro.2017.18
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE