Roberto Parodi,1, 2 Juan Ibarzabal,2 Rodrigo Román,1 Marcelo Alasino,3 Martín Varela,4 Susana Díaz5
1 GR, Gastroenterología Rosario.
2 Primera Cátedra de Clínica Médica y Terapéutica, Facultad de Ciencias Médicas, Universidad Nacional de Rosario.
3 Servicio de Cirugía, Grupo Gamma Rosario.
4 Biopat, Laboratorio de Anatomía Patológica.
5 Centro de diagnóstico patológico, Gammalab. Rosario, Provincia de Santa Fe, Argentina.
Acta Gastroenterol Latinoam 2019;49(3):229-240
Recibido: 14/01/2017 / Aprobado: 16/01/2019 / Publicado en www.actagastro.org el 17/09/2019
Resumen
Se presenta el caso de un paciente varón de 44 años, sin antecedentes patológicos, que consultó por cuadro de meses de evolución caracterizado por astenia, decaimiento, hiporexia no selectiva, asociado a artralgias intermitentes, con hallazgo de sangre oculta en materia fecal y anemia microcítica e hipocrómica y sin otra alteración analítica. En la tomografía computada se detectan adenomegalias intestinales con infiltrado inflamatorio inespecífico en la biopsia. Luego de dos endoscopías digestivas se observa una infiltración macrofágica con gránulos PAS positivos en la mucosa duodenal, y se aborda el diagnóstico de enfermedad de Whipple (EW). La EW es una afección sistémica producida por una bacteria intracelular Gram-positiva llamada Tropheryma whipplei de contagio oral-digestivo. Posee una incidencia anual de 1-6 casos por 10.000.000 de personas. Es más frecuente en varones adolescentes y adultos jóvenes. Cursa con lesiones intestinales asociadas a pérdida de peso, gastroenteritis, dolor abdominal, artritis y síntomas neurológicos, y también como endocarditis con hemocultivos negativos y/o compromiso neurológico aislado. Se asocia al HLA B27 y una disregulación inmunológica explicaría la diseminación bacteriana. La analítica es inespecífica, la endoscopía puede demostrar una mucosa friable asociada a linfangiectasia. La tinción de PAS y la PCR representan las pruebas principales para el diagnóstico. El objetivo del tratamiento es prevenir las complicaciones y erradicar la infección. Se recomienda un esquema con doxiciclina e hidroxicloroquina dada la menor tasa de recurrencia y se adiciona una sulfa en presencia de compromiso neurológico. En caso de recaída se debe continuar el tratamiento por tiempo indefinido. El test de PCR parecería ser el indicado para el monitoreo del tratamiento.
Palabras claves. Enfermedad de Whipple, malaabsorción, adenopatías mesentéricas.
Whipple’s disease. Case report and literture review
Summary
We present the case of a 44-year-old male patient with no medical history, who consulted for months of evolution characterized by asthenia, decay, non-selective hyporexia, associated with intermittent arthralgias, with fecal occult blood finding and hypochromic microcytic anemia and without any other analytical alteration. On computed tomography, intestinal lymphadenopathies with nonspecific inflammatory infiltrate were detected in biopsy. After two endoscopic exams, a macrophage infiltration with PAS positive granules was observed in the duodenal mucosa, addressing the diagnosis of Whipple’s disease. It represents a systemic condition produced by a Gram-positive intracellular bacterium called Tropheryma whipplei of oral-digestive infection. It has an annual incidence of 1-6 cases per 10.000.000 people. It is more frequent in adolescent males and young adults. It presents with intestinal lesions associated with weight loss, gastroenteritis, abdominal pain, arthritis and neurological symptoms, as well as endocarditis with negative blood cultures and / or isolated neurological involvement. It is associated with HLA B27 and an immune deregulation would explain the bacterial spread. The analytical is nonspecific and the endoscopy can demonstrate a friable mucosa associated with lymphangiectasias. PAS staining and PCR represent the main tests for diagnosis. The goal of treatment is to prevent complications and eradicate the infection. A scheme with doxycycline and hydroxychloroquine is recommended given the lower recurrence rate, a sulfa is added in the presence of neurological compromise. In case of relapse, treatment must continue indefinitely. The PCR test would seem to be the one for monitoring the treatments.
Key words. Whipple’s disease, malabsorption, mesenteric lymphadenopathies.
Abreviaturas
VIH: Virus de la inmunodeficiencia humana.
VHB: Virus hepatitis B.
VHC: Virus hepatitis C.
TC: Tomografía computada.
PET-TC: Tomografía por emisión de positrones.
SUV: Standardized uptake value.
PAS: Ácido peryódico de Schiff.
EW: Enfermedad de Whipple.
TW: Tropheryma whipplei.
ARN: Ácido ribonucleico.
PCR: Reacción en cadena de la polimerasa.
ADN: Ácido desoxiribonucleico.
TGF-1: Factor transformador de crecimiento tipo 1.
IL: Interleuquina.
INF-γ: Interferón gamma.
Th-1: Células T helper tipo 1.
Th-2: Células T helper tipo 2.
MAI: Mycobacterium avium intracelullar.
IRIS: Síndrome de reconstitución inmunológica.
Caso clínico
Se presenta el caso de un paciente varón de 44 años sin antecedentes patológicos de jerarquía. Consulta por un cuadro de dos meses de evolución, de inicio insidioso y curso progresivo, caracterizado por pérdida de peso de 20 kg, hiporexia no selectiva, astenia y adinamia. Además presenta artralgias de intensidad leve de grandes articulaciones de carácter migratriz, con mejoría espontánea. Refiere solo dos episodios de diarrea sin moco, pus ni sangre, autolimitados a lo largo de la evolución del cuadro. No presenta fiebre, cambios en el hábito evacuatorio ni síntomas urinarios o respiratorios.
En la analítica general se observa anemia microcítica, hipocrómica, de tipo ferropénica, leve leucocitosis con neutrofilia, sin eosinofilia, y velocidad de eritrosedimentación globular acelerada. Serologías negativas para sífilis, virus de la inmunodeficiencia humana (VIH), virus hepatitis B (VHB), virus hepatitis C (VHC) y para enfermedad celíaca. Presentó en forma intermitente resultados positivos de muestras de sangre oculta en materia fecal (prueba de bencidina) (Tabla 1). En la radiología directa de abdomen de pie y en la ecografía abdomino-renal no se hallaron alteraciones.
Se realiza una videoendoscopía digestiva alta: a nivel del bulbo duodenal y en la segunda porción se observa disminución de pliegues mucosos. Se toma biopsia de la mucosa duodenal (tres) que no evidenció alteraciones significativas. En la endoscopía baja se progresa hasta ciego con mucosa de características normales, se visualizan hemorroides internas congestivas.
Tabla 1. Valores de analítica.
Se realiza una tomografía computada (TC), observándose la presencia de múltiples imágenes redondeadas compatibles con adenopatías de entre 15 y 25 mm de diámetro, contiguas, en el mesenterio y en menor medida en el retroperitoneo; se destacan por presentar densidad heterogénea con sectores hipodensos y otros con densidad similar a la de partes blandas.
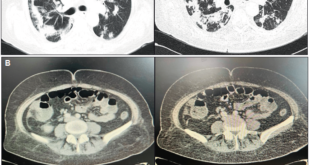
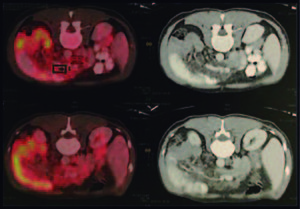
Con base en dichos hallazgos se procede a la realización de una tomografía por emisión de positrones (PET- TC) que evidencia una marcada alteración de la densidad de la grasa intraabdominal asociada a numerosas formaciones ganglionares, algunas de ellas con escasa actividad metabólica con SUV (standardized uptake value) de 3,5 a 6,5 (Figura 1).
Figura 1. Estudio PET-CT. Se observa marcada alteración de la grasa intraabdominal asociada a numerosas formaciones ganglionares rondando un SUV máximo de 3,5-6,5.
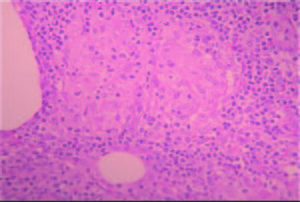
Ulteriormente se decide la exploración quirúrgica por laparotomía, en la cual no se observan lesiones intestinales en la macroscopía y se visualizan múltiples adenomegalias en el mesenterio, predominantemente en el área yeyunal. Se realiza una biopsia y el examen anátomo-patológico descarta por microscopía e inmunohistoquímica una enfermedad linfoproliferativa primaria, y evidencia una expresión linfocitaria policlonal, con presencia de plasmocitos reactivos, compatible con cuadro reactivo/ inflamatorio, de carácter inespecífico (Figura 2).
Figura 2. Biopsia ganglionar. Infiltrado linfoplasmocitario de aspecto inespecífico.
En este contexto, se repite la serología para VIH que resulta negativa, se realiza el dosaje sérico de inmunoglobulinas que se encuentran en rango normal y un proteinograma por electroforesis que presentó un moderado aumento de las alfa-2 globulinas. Se solicitan marcadores tumorales: antígeno carcinoembrionario, alfa feto-proteína, subunidad β de gonadotrofina coriónica humana que resultaron dentro de parámetros normales.
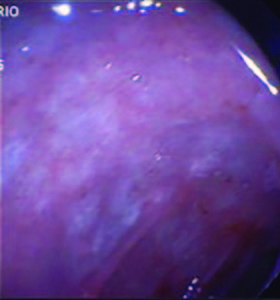
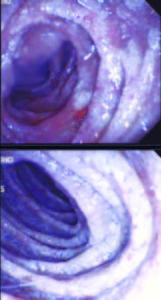
Debido a los hallazgos no concluyentes se decide repetir la videoendoscopía digestiva alta. En esta ocasión se informa que tras progresarse hasta la cuarta porción del duodeno se observan pliegues engrosados, mucosa eritematosa y friable, recubierta por placas blanco-amarillentas, tomándose múltiples biopsias (cinco) (Figuras 3 y 4).
Figura 3. Endoscopía duodenal. Mucosa eritematosa y friable.
Figura 4. Endoscopía duodenal. Mucosa recubierta por placas blanco-amarillentas.
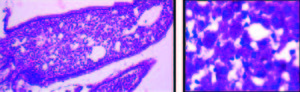
En el examen anatomopatológico se visualiza una infiltración macrofágica con gránulos PAS (ácido peryódico de Schiff) positivos, abordándose de esta forma el diagnóstico de enfermedad de Whipple (EW) (Figura 5).
Figura 5. Biopsia duodenal. Infiltración macrofágica con gránulos PAS (ácido peryódico de Schiff) positivos.
Realizó tratamiento con ceftriaxona (2 g/día) parenteral por dos semanas, y luego trimetoprima/sulfametoxazol (160/800 mg dos veces/día) vía oral durante 18 meses. Presentó mejoría paulatina de la sintomatología, recuperación progresiva de peso (30 kg) y normalización de los parámetros de laboratorio. Permanece asintomático y en buen estado general con laboratorios normales luego de un año y medio de seguimiento después de finalizado el tratamiento.
Discusión
La EW representa una afección sistémica producida por una bacteria Gram positiva, el Tropheryma whipplei (TW). El nombre proviene del griego, trophe: alimento y eryma: barrera, por la malaabsorción de nutrientes que puede generar. Esta entidad fue descrita en 1907 por George Hoyt Whipple como una enfermedad sistémica y crónica asociada a lipodistrofia intestinal. Recién en 1952 se postuló que la etiología podría deberse a una bacteria, dada la mejoría clínica luego de la instauración de tratamiento antibiótico. En 1960 los hallazgos en la microscopía electrónica sumaron evidencia a dicha hipótesis y en 1990 se amplificó su ácido ribonucleico (ARN) por técnicas de reacción en cadena de la polimerasa (PCR). Se logró su cultivo en 1997.1-4
Es una patología rara, la mayoría de los casos se han reportado en Norte América y en Europa Occidental. Se estima una incidencia mundial anual de 1 a 6 casos cada 10.000.000 de personas.2 Es más frecuente en pacientes de sexo masculino, principalmente en adolescentes y en mayores de 40 años. Se cree que con el advenimiento del test de PCR para el diagnóstico la incidencia será mayor.2-4
Con respecto a la presentación clínica, esta entidad puede cursar con lesiones histológicas gastrointestinales asociadas a diversas manifestaciones clínicas (clásica), o como endocarditis con hemocultivos negativos y/o compromiso neurológico aislado.3, 5
Los síntomas de la EW clásica son completamente inespecíficos: pérdida de peso (79-99%), gastroenteritis (63-85%), dolor abdominal (23-60%), artritis (20-83%) y síntomas neurológicos (6-63%). Pueden establecerse tres fases sintomatológicas. Al principio los pacientes padecen fiebre, artritis y artralgias. En la fase media aparece diarrea, dolor abdominal, pérdida de peso y linfadenopatías. Al final cualquier órgano puede afectarse, generalmente los ojos, el corazón y el sistema nervioso central.5
Con respecto al compromiso gastrointestinal, si bien el duodeno, el yeyuno y el íleon son mayormente afectados, el hígado, el esófago y el estómago también pueden comprometerse. El dolor abdominal asociado a diarrea y/o esteatorrea son los síntomas clásicos, generalmente asociados a linfadenopatías abdominales. En un 20 a 30% de los pacientes se comprueba sangre oculta en materia fecal producto del daño de la mucosa digestiva. Puede existir hepatoesplenomegalia y en ocasiones hepatitis. Como consecuencia del síndrome malaabsortivo se producen deficiencias nutricionales que pueden progresar a un síndrome de wasting (pérdida de peso, fatiga, debilidad, atrofia muscular con pérdida de apetito).2-5 El caso comunicado presentaba determinación de sangre oculta en materia fecal positiva y anemia carencial, en ausencia de diarrea y dolor abdominal.
La afección articular se presenta como artralgia migratoria intermitente, artritis, o ambas sin deformidad. Generalmente el compromiso es poliarticular, aunque puede ser oligoarticular de grandes articulaciones, o con menor frecuencia, puede presentarse como poliartritis seronegativa crónica y destructiva. Principalmente son afectadas las rodillas, muñecas y tobillos y con menos frecuencia los hombros, codos y cadera. Cursa con reactantes de fase aguda elevados y anemia. En raras ocasiones, se presenta como espondiloartropatía u osteoartropatía hipertrófica. Puede acompañarse de mialgias y calambres musculares.6, 7 El caso reportado presentaba artralgias de tipo migratriz de resolución espontánea sin secuelas articulares, asociadas a anemia y pérdida de peso.
Dado la presencia frecuente de lesiones cerebrales en autopsias, se cree que la afección neurológica se produce en la mayoría de los pacientes. Puede aparecer como compromiso aislado, asociado a la enfermedad gastrointestinal, o como recaída neurológica en la enfermedad previamente tratada. Cursa con confusión o coma en contexto de meningoencefalitis o convulsiones, delirio, hipersomnia, síntomas de primer motoneurona, signos extrapiramidales, ataxia cerebelosa, oftalmoplejía supranuclear y movimientos anormales como mioclonías, miorritmia oculomasticatoria, movimientos coreiformes. En un 71% aparecen alteraciones en la esfera cognitiva que pueden evolucionar a la demencia. Los síntomas psiquiátricos de depresión y las alteraciones de la personalidad son muy comunes.8-10
El compromiso ocular, excluyendo la mencionada oftalmoplejía, ocurre en un 11% de los pacientes con enfermedad clásica como uveítis anterior o posterior, crónica y bilateral.11, 12 El pronóstico de los pacientes con compromiso en sistema nervioso central es malo, 25% fallecen dentro de los cuatro años o quedan con secuelas graves. El diagnóstico se efectúa mediante la detección del ADN de TW en el líquido cefalorraquídeo por medio de PCR.1-4 En la actualidad se recomienda el estudio del líquido cefalorraquídeo en todos los pacientes, incluso los que cursan sin sintomatología neurológica.3
En el 17 al 55% de los pacientes existe compromiso cardíaco, la pericarditis es muy frecuente, no así la miocarditis, que puede ser la primera manifestación en forma de insuficiencia cardíaca o muerte súbita.13 El cuadro de endocarditis cursa con hemocultivos negativos, ausencia de fiebre, vegetaciones y destrucción valvular, siendo dificultoso el diagnóstico.14, 15 Se ha confirmado dicha afección a través de la PCR del material valvular obtenido quirúrgicamente.14
La enfermedad pulmonar asociada es muy frecuente (30 a 40%) y se manifiesta como derrame pleural, infiltración pulmonar o adenopatías mediastínicas granulomatosas.16 Si bien se cree que el compromiso se debe a microaspiraciones, se piensa que la traslocación bacteriana a través del sistema circulatorio o directamente desde el medioambiente pueden ser vías de contagio.1-3
En el caso que motiva la presentación, no se ha detectado signo-sintomatología de compromiso neuro-oftalmológico, cardíaco ni pulmonar.
El compromiso ganglionar es frecuente, se estima en un 9% aproximadamente, sobre todo a nivel abdominal en forma de granulomas epitelioides no caseificados y con células gigantes.5, 17 Dicho compromiso fue clave para arribar al diagnóstico en el caso presentado.
Otras presentaciones
A nivel cutáneo es habitual la presencia de melanodermia. El compromiso renal generalmente es tardío, y tanto el epidídimo como los testículos son también órganos diana.1-3 Si bien no se conoce la frecuencia, puede presentarse en forma de patologías agudas como gastroenteritis, neumonía o bacteriemia.2, 16, 18 Se han descrito casos también de EW con artritis aislada, espondilodiscitis y uveítis sin evidencia de enfermedad digestiva por medio de PCR de líquido o tejido sinovial, punción biopsia de disco intervertebral o de humor acuoso.1-3
Microbiología
El TW es una bacteria intracelular ubicua.19 Taxonómicamente se encuentra relacionada al grupo de los actinomyces y de las micobacterias. Según los análisis de PCR existen 72 genotipos identificados. La pared bacteriana posee mucopolisacáridos que se colorean con la con la coloración de PAS. El principal nicho ecológico es el intestino humano.4 El porcentaje de bacterias en materia fecal es significativamente mayor en pacientes sintomáticos que en portadores, es decir que existe una relación entre la carga bacteriana y el desarrollo de enfermedad. La transmisión es oral-oral o fecal-oral.3, 19
Se piensa además que la bacteria posee la capacidad de formación de esporas, lo cual explicaría la capacidad de supervivencia en el ambiente.20 Algunos estudios agregan una forma de transmisión respiratoria, dada la presencia del organismo en muestras de lavado bronquioloalveolar.16 Se encuentra en estudio la importancia de reservorios no humanos de la bacteria como animales domésticos.2
Portadores asintomáticos
Se cree que la bacteria se adquiere en la infancia y los familiares de pacientes con enfermedad presentan mayor tasa de portación dada la forma de contagio y por compartir el medioambiente.2 Se ha detectado la presencia del TW en muestras de saliva, heces, sangre y en biopsia duodenal, aunque se desconoce su valor patológico.21
Fisiopatología
Si bien esta entidad tiene mayor predominio en hombres y está frecuentemente asociada al antígeno HLA B27, no se ha demostrado asociación a un factor genético específico. Dado que la exposición al TW es muy importante, los pacientes que desarrollan la enfermedad tendrían factores predisponentes del huésped, del patógeno y del ambiente, no definidos claramente.22, 23
La mayoría de los pacientes tienen entre 48 y 54 años al momento del diagnóstico. Se cree que este hecho se produce dado el retraso entre el inicio de los síntomas y el diagnóstico. Los pacientes que presentan los alelos HLA DRB1*13 o DQB1*06 poseen menor expresión del factor transformador de crecimiento tipo 1 (TGF-1) y son productores de mayor interleuquina 4 (IL-4), que disminuye (down regulation) la síntesis de interleuquina 12 (IL-12) e interferón gamma (INF-γ) fundamentales en la patogenia.22, 24, 25
Desde la mucosa intestinal, por vía linfática, la bacteria se propaga al sistema circulatorio. En la EW existiría una disfunción macrofágica. Si bien las baterías son fagocitadas, sus antígenos no son degradados, lo cual se asocia a la producción disminuida de IL-12. Además la presentación de antígenos es inadecuada (menor expresión de CD11b). En este orden, disminuye la producción de INF-γ por las células T y existe menor activación de los macrófagos deficientes. En consecuencia, se genera una respuesta inmunológica ineficaz de las células T Helper tipo 1 (Th-1), favoreciendo el desarrollo de una respuesta de células T Helper tipo 2 (Th-2).26, 27
Por inducción de secreción de interleuquina 16 (IL- 16) se movilizan más macrófagos y células dendríticas al sitio de infección. La replicación intracelular se asocia a apoptosis de las células del huésped, lo que facilita la diseminación bacteriana.25, 26
A pesar de la respuesta Th-2 los títulos de anticuerpos IgG e IgM no son altos en comparación con los portado res. Este hecho se justificaría por la variación antigénica del patógeno y por sus mecanismos de evasión de la respuesta inmune. En enfermos los títulos de IgA son más altos que en portadores.27
Con base en lo enunciado, es característica la infiltración masiva de los tejidos infectados por macrófagos. Luego del tratamiento la bacteria desaparece, pero los macrófagos persisten. En sujetos sanos el TW se multiplica en los macrófagos, pero no en los monocitos; en los pacientes enfermos el patógeno lo realiza en los dos tipos de células, lo que favorece su propagación.23
Cabe destacar que existe una potenciada actividad de células reguladoras en el intestino y en la sangre, que resulta en un aumento de TGF e IL-10, aumentando de esta manera el ambiente de inmunosupresión, y se genera una disminución de la producción de IL-12 y de INF con las consecuencias descritas.28
Diagnóstico
Los hallazgos analíticos son completamente inespecíficos, puede cursar con niveles elevados de reactantes de fase aguda, anemia, leucocitosis, trombocitosis y signos bioquímicos de malaabsorción. Menos frecuentemente puede existir trombocitopenia y eosinofilia.1-4 El caso comunicado presentó anemia microcítica, hipocrómica, leucocitosis neutrofílica y velocidad de eritrosedimentación globular elevada.
En el estudio endoscópico del tubo digestivo puede visualizarse en la región posbulbar del duodeno y a nivel del yeyuno una mucosa pálida y despulida alternando con zonas erosionadas, eritematosas o friables. Puede presentar además linfangiectasia, que torna la mucosa de color amarillo pálido.29, 30 En la segunda endoscopía se visualizó una mucosa eritematosa y friable, recubierta por placas blanco-amarillenta.
Los estudios por imágenes (ecografía, tomografía axial computada, resonancia magnética nuclear) son útiles para descartar otras entidades. La presencia de adenomegalias intestinales en la tomografía con escasa actividad metabólica en el PET-TC orientó hacia un cuadro infeccioso y alejó la patología neoplásica y linfoproliferativa, en el caso comunicado.
En las biopsias intestinales es muy frecuente la aparición de una mucosa atrófica con dilatación de vasos linfáticos. Existe además acumulación de ácidos grasos en la lámina propia y en los nódulos linfáticos, a lo cual hace referencia su primera descripción fisiopatológica como “lipodistrofia intestinal”. El examen de elección para la detección del TW es la tinción de PAS de las muestras de biopsias de los tejidos afectados. Debe tenerse presente que las lesiones pueden ser focales y separadas, por lo que deben realizarse distintas muestras de tejido. También debe recordarse que dichas inclusiones no son específicas de TW, se observan en infecciones por Mycobacterium avium intracelullar (MAI), el cual es Ziehl-Neelsen positivo. También patógenos como Rhodococcus equi, Corynebacterium, Bacillus cereus e Histoplasma pueden en circunstancias presentar una tinción similar.22, 29, 30 La infiltración macrofágica con gránulos PAS positivos en la biopsia intestinal permitió abordar el diagnóstico en el caso presentado.
Los gránulos PAS positivos pueden encontrarse además en el líquido cefalorraquídeo, tejido cerebral, válvulas cardíacas, médula ósea, nódulos linfáticos, piel, hígado, músculo, pulmón y ojos.22 Cabe destacar que en distintos tejidos pueden encontrarse granulomas no caseificados compuestos por células epiteloides, que en un 40% pueden ser PAS negativos.1, 2 La biopsia ganglionar del caso presentado evidenció la presencia de un infiltrado inflamatorio PAS negativo de carácter inespecífico.
Con mayor sensibilidad y especificidad existe una tinción inmunohistoquímica de anticuerpos frente a TW, que permite detectar al organismo en diversos sitios. Además, puede emplearse en muestras fijadas y puede utilizarse el suero del propio paciente y realizar una tinción autoinmunoquímica. No es un método disponible en nuestro medio.31, 32
Con la técnica de hibridación fluorescente in situ (FISH), que consiste en el marcaje de cromosomas con una molécula fluorescente, se puede confirmar la presencia del patógeno en tejidos extraintestinales y biopsias PAS positivas. Como esta prueba detecta el ribosoma del TW, el mismo desaparece rápidamente en las bacterias muertas, por lo que no debería emplearse en pacientes bajo tratamiento.2, 33 No constituye una técnica ampliamente difundida en la actualidad.
Con respecto a la serología para el TW, debe recordarse que el 70% de los pacientes sanos pueden ser portadores de anticuerpos IgG, siendo más específica la detección de anticuerpos IgM.
El problema de este método recae en que los portadores presentan además mayor título de IgM en comparación con los enfermos, lo que otorga resultados contradictorios y confusos.34 Se encuentra en evaluación una nueva metodología por Western-Blot que diferenciaría los anticuerpos de los pacientes con enfermedad de los portadores asintomáticos.35
Con menor disponibilidad aún, la microscopía electrónica puede diagnosticar la presencia de la bacteria en muestras de biopsia.36 El cultivo del patógeno requiere de semanas y solo es posible realizarlo en centros especializados.2
En la actualidad, el método diagnóstico que se propone es el análisis de la PCR para TW. Este test convencional detecta las secuencias genómicas 16S ARNr de la bacteria.31 Las técnicas más nuevas de PCR cuantitativa a tiempo real (qPCR) detectan regiones intergenéticas específicas 16S-23S, secuencias genéticas repetidas o el gen rpoB con mayor sensibilidad y especificidad.37, 38 El mayor riesgo de la prueba es la contaminación, que puede ocurrir en distintos pasos del análisis de PCR, incluídos el proceso de recolección de muestras, aislamiento del DNA y durante la amplificación. Deben obtenerse varias muestras digestivas (compromiso parcheado). Debe solicitarse esta prueba solamente en pacientes con clínica compatible dada la alta prevalencia de portadores, como fue descrito. Algunos autores proponen el test como screening en muestras de saliva y materia fecal, con resultados contradictorios.2, 21, 31
En conclusión, para el diagnóstico de esta entidad se utiliza la tinción de PAS y la PCR, preferentemente sobre la inmunohistoquímica. La mayoría de las fuentes recomiendan como primer paso el examen histológico del intestino delgado (al menos cinco biopsias de duodeno y/o yeyuno) y realizar posteriormente el análisis de PCR o inmunohistoquímico para la confirmación. En los casos en que la biopsia no sea característica y los test sean negativos, ante la sospecha diagnóstica puede acudirse a los otros métodos descritos.3, 4 Dado que en nuestro medio el test de PCR y el resto de los métodos no se encuentran disponibles con facilidad, el diagnóstico se basó en los hallazgos endoscópicos y anatomopatológicos de la biopsia de intestino delgado en el contexto de un cuadro clínico compatible.
Diagnósticos diferenciales
En los casos de que los síntomas articulares predominen, deben descartarse otras causas de enfermedad reumática. Se sospecha EW cuando la enfermedad articular no mejora o incluso empeora con la terapia biológica.39 La infección por el VIH puede presentarse con cualquiera de los síntomas descritos, incluso puede cursar con el cuadro de enteropatía y síndrome de wasting. En la presentación como endocarditis deben descartarse en primera instancia los patógenos más frecuentes. La presencia de granulomas sistémicos puede remedar a la sarcoidosis.17 En cuanto al compromiso abdominal deben estudiarse otras causas de síndrome malaabsortivo, como la enfermedad celíaca, y otras infecciones, como el compromiso por MAI. En pacientes con enfermedad vascular debe considerarse el diagnostico de angina abdominal.
Tratamiento
Los objetivos del tratamiento son reducir la morbilidad, prevenir complicaciones y erradicar la infección. La mortalidad es cercana al 100% en caso de que la entidad no sea adecuadamente tratada. Cuando el tratamiento se realiza por al menos un año, el pronóstico generalmente es bueno y la remisión ocurre en el 70% de los pacientes. Los síntomas como diarrea, dolor articular y fiebre suelen desaparecer rápidamente una vez instaurado el tratamiento. Los pacientes que presentan compromiso ocular, cardíaco y del sistema nervioso central tienden a recaer y la mortalidad es mayor.40
El tratamiento clásico inicial se realiza con ceftriaxona (2 g/día), meropenem (3 g/día) o penicilina (12 millones de unidades/día) por catorce días y posteriormente se continúa por un año con terapia de mantenimiento con trimetoprima/sulfametoxazol (160/800 mg/dos veces por día). Se eligen fármacos que sean capaces de atravesar la barrera hematoencefálica.41-44
Como en otras patologías, puede producirse un síndrome de reconstitución inmunológica que puede plantear el diagnóstico diferencial con recaída de la enfermedad. Dicho síndrome representa una complicación seria en un 10% de los pacientes con EW clásica. Su fisiopatología se explicaría por el efecto inmunosupresor de los linfocitos T CD4 que genera el patógeno; luego del tratamiento, dichas células parten desde la sangre periférica hacia los tejidos afectados, generando los síntomas.44 La primera línea de tratamiento son los corticoides. En caso de que el proceso inflamatorio continúe luego de 24 horas, debe adicionarse otra terapia inmunosupresora, como la talidomida.45, 46
Los últimos reportes sugieren que las tetraciclinas poseen una alta tasa de recurrencia, estimada en un 28%. Mediante cultivos celulares se ha comprobado que tanto la doxiciclina como el sulfametoxazol son activos in vitro pero la trimetoprima no. Según el análisis genómico, la bacteria carece de la secuencia de codificación para la enzima dihidrofolato reductasa, sitio de acción de este último fármaco. Además, en cultivos celulares se demostró que las cefalosporinas y las fluorquinolonas no son activas. Agentes que disminuyen el pH intravacuolar, como la doxiciclina y la hidroxicloroquina, disminuyen la viabilidad bacteriana y son activos in vitro, sin embargo, falta evidencia suficiente que establezca la efectividad in vivo, es decir si la actividad se mantiene con regularidad en los pacientes.40, 47
De esta manera, en la actualidad se recomienda el esquema anual de doxiciclina (200 mg/día) e hidroxicloroquina (600 mg/día) con el propósito de erradicar los microorganismos intracelulares en pacientes con EW sin compromiso neurológico, en cuyo caso deben adicionarse dosis elevadas de sulfametoxazol o sulfadiazina.3, 47, 48
En pacientes con recurrencia neurológica, se ha propuesto el uso de interferón, con buena respuesta. Algunos autores recomiendan adicionar este inmunomodulador a la terapia antimicrobiana en cualquier forma de infección, para potenciar el efecto antibiótico y evitar recaídas y resistencia.49
En el caso de infecciones crónicas localizadas se sugiere el tratamiento con doxiciclina e hidroxicloroquina por un período de 12 a 18 meses. Debe tenerse presente que la duración óptima del tratamiento en general sigue siendo materia de debate.48 El paciente recibió el esquema de tratamiento clásico con adecuada tolerancia, mejoría sintomatológica, y sin evidencia de recurrencia a la fecha.
Recaída
Se piensa que existe una predisposición genética a sufrir una recaída. La misma se estima en un 30%. Puede ocurrir años después luego de completado un esquema antibiótico, por lo que se recomienda el monitoreo de por vida.
Clásicamente, cuando se demostraba la presencia de recaída se recomendaba iniciar nuevamente el esquema terapéutico con un betalactámico por cuatro semanas, seguido de la terapia con cotrimoxazol por uno a dos años. La evidencia a la fecha sostiene que debería emplearse un esquema antibiótico diferente al previo, dada la sospecha de resistencia. Se aconseja el esquema con doxiciclina e hidroxicloroquina, continuando la primera droga por tiempo indeterminado para evitar una nueva recaída. Resulta importante destacar que las tasas de generación de resistencia antibiótica con la terapéutica prolongada no se encuentran establecidas y la posibilidad de aparición de efectos adversos es mayor.47, 48
Monitoreo del tratamiento
No existe a la fecha un método universalmente reconocido para monitorear el tratamiento, por lo que es difícil evaluar la efectividad de la terapia.
La reevaluación endoscópica a los 6, 12, 24 y 36 meses del diagnóstico y luego cada tres años puede ser una alternativa. Sin embargo, debe tenerse presente que los macrófagos pueden persistir en la lámina propia por años luego del tratamiento exitoso, por lo que la biopsia puede no ser representativa.2, 5 Otros autores sugieren que el tratamiento debería ser monitoreado con el test de PCR, dado que representa el método más sensible y específico, en contraste con los hallazgos histológicos.50
Consideraciones finales
La EW es una entidad sistémica con un gran espectro de manifestaciones clínicas. Representa un desafío diagnóstico en el cual la sospecha clínica es crucial para iniciar su búsqueda. Con el desarrollo de nuevas técnicas moleculares para su detección probablemente las cifras de incidencia anual aumenten. En la actualidad se continúa investigando la patogenia de este microorganismo intracelular como también la mejor forma de erradicarlo. Se necesitan más estudios acerca del estado de portación y de su transmisión.
Conflicto de intereses. Los autores declaran no tener ningún conflicto de intereses.
Sostén financiero. No se recibió apoyo financiero para la realización de este manuscrito.
References
- Fenollar F, Puéchal X, Raoult D. Whipple’s Disease. New England Journal of Medicine 2007; 356: 55-66.
- Dolmans RA, Boel CH, Lacle MM, Kusters JG. Clinical manifestations, treatment, and diagnosis of Tropheryma Whipplei infections. Clinical Microbiology Reviews 2017; 30: 529-555.
- Marth T, Moos V, Müller C, Biagi F, Schneider T. Tropheryma whipplei infection and Whipple’s disease. Lancet Infectious Disease 2016; 16: 12-21.
- Obst W, Von Arnim U, Malfertheiner P. Whipple’s Disease. Viszeralmedizin 2014; 30: 167-172.
- Lagier JC, Lepidi H, Raoult D, Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center. Medicine (Baltimore) 2010; 89: 337-345.
- Puchal X. Whipple’s disease and arthritis. Curr Opin Rheumatol 2001; 13: 74-79.
- Glaser C, Rieg S, Wiech T, Scholz C, Endres D, Stich O, Hasselblatt P, Geißdörfer W, Bogdan C, Serr A, Häcker G, Voll RE, Thiel J, Venhoff N. Whipple’s disease mimicking rheumatoid arthritis can cause misdiagnosis and treatment failure. Orphanet J Rare Dis 2017; 12: 99.
- Feurle G, Volk B, Waldherr R. Cerebral Whipple’s disease with negative jejunal histology. N Eng J Med 1979; 300: 907-908.
- Alba D, Molina F, Vázquez JJ. Neurologic manifestations of Whipple’s disease. An Med Interna 1995; 12: 508-512.
- Compain C, Sacre K, Puchal X, Klein I, Vital-Durand D, Houeto JL, De Broucker T, Raoult D, Papo T. Central nervous system involvement in Whipple’s disease: clinical study of 18 patients and long-term follow-up. Medicine (Baltimore) 2013; 92: 324-330.
- Drancourt M, Raoult D, Lepidi H, Fénollar F, Birg ML, Bodaghi B, Hoang PL, Lelièvre JD. Culture of Tropheryma whippelii from the vitreous fluid of a patient presenting with unilateral uveitis. Ann Intern Med 2003; 139: 1046-1047.
- Rickman L, Freeman W, Green R, Feldman S, Sullivan J, Russack V, Relman D. Brief Report: Uveitis caused by Tropheryma whippelii (Whipple’s Bacillus). N Eng J Med 1995; 332: 363-366.
- McAllister HA, Fenoglio JJ. Cardiac involvement in Whipple’s disease. Circulation 1975; 52: 152-156.
- Escher R, Roth S, Droz S, Egli K, Altwegg M, Täuber MG. Endocarditis due to Tropheryma whipplei: rapid detection, limited genetic diversity, and long-term clinical outcome in a local experience. Clin Microbiol Infect 2010; 16: 1213-1222.
- Geissendorfer W, Moos V, Moter A, Loddenkemper Ch, Jansen A, Tandler R, Morguet AJ, Fenollar F, Raoult D, Bogdan Ch, Schneider T. High frequency of Tropheryma whipplei in culture-negative endocarditis. J Clin Microbiol 2012; 50: 216-222.
- Bousbia S, Papazian L, Auffray JP, Fenollar F, Martin C, Li W, Chiche L, La Scola B, Raoult D. Tropheryma whipplei in patients with pneumonia. Emerg Infect Dis 2010; 16: 258-263.
- Cho C, Lincscheer WG, Hirschkorn MA, Ashutosh K. Sarcoidlike granulomas as an early manifestation of Whipple’s disease. Gastroenterology 1984; 87: 941-947.
- Raoult D, Fenollar F, Rolain JM, Minodier P, Bosdure E, Li W, Garnier JM, Richet H. Tropheryma whipplei in children with gastroenteritis. Emerg Infect Dis 2010; 16: 776-782.
- Schöniger-Hekele M, Petermann D, Weber B, Müller C. Tropheryma whipplei in the environment: survey of sewage plant influxes and sewage plant workers. Appl Environ Microbiol 2007; 73: 2033-2035.
- Raoult D, Ogata H, Audic S, Robert C, Suhre K, Drancourt M, Claverie JM. Tropheryma whipplei Twist: a human pathogenic Actinobacteria with a reduced genome. Genome Res 2003; 13: 1800-1809.
- Fenollar F, Laouira S, Lepidi H, Rolain JM, Raoult D. Value of Tropheryma whipplei quantitative polymerase chain reaction assay for the diagnosis of Whipple’s disease: usefulness of saliva and stool specimens for firstline screening. Clinical Infectious Diseases 2008; 47: 659-667.
- Misbah S, Mapstone N. Whipple’s disease revisited. J Clin Pathol 2000; 53: 750-755.
- Schneider T, Moos V, Loddenkemper C, Marth T, Fenollar F, Raoult D. Whipple’s disease: new aspects of pathogenesis and treatment. The Lancet Infectious Diseases 2008; 8: 179-190.
- Martinetti M, Biagi F, Badulli C, Feurle GE, Müller C, Moos V, Schneider T, Marth T, Marchese A, Trotta L, Sachetto S, Pasi A, De Silvestri A, Salvaneschi L, Corazza GR. The HLA alleles DRB1*13 and DQB1*06 are associated to Whipple’s disease. Gastroenterology 2009; 136: 2289-2294.
- Martin F, Vilseck J, Dobbins W, Buckley C, Tyor M. Immunological alteration in patients with treated Whipple’s disease. Gastroenterology 1972; 63: 6-18.
- Moos V, Schmidt C, Geelhaar A, Kunkel D, Allers K, Schinnerling K, Loddenkemper C, Fenollar F, Moter A, Raoult D, Ignatius R, Schneider T. Impaired immune functions of monocytes and macrophages in Whipple’s disease. Gastroenterology 2010; 138: 210-220.
- Marth T, Kleen N, Stallmach A, Ring S, Aziz S, Schmidt C, Strober W, Zeitz M, Schneider T. Dysregulated peripheral and mucosal Th1/Th2 response in Whipple’s disease. Gastroenterology 2002; 123: 1468-1477.
- Schinnerling K, Moos V, Geelhaar A, Allers K, Loddenkemper C, Friebel J, Conrad K, Kühl AA, Erben U, Schneider T. Regulatory T cells in patients with Whipple’s disease. J Immunol 2011; 187: 4061-4067.
- Günther U, Moos V, Offenmüller G, Oelkers G, Heise W, Moter A, Loddenkemper C, Schneider T. Gastrointestinal diagnosis of classical Whipple disease: clinical, endoscopic, and histopathologic features in 191 patients. Medicine (Baltimore) 2015; 94: e714.
- Mönkemüller K, Fry LC, Von Arnim U, Neumann H, Evert M, Malfertheiner P. Whipple’s disease: an endoscopic and histologic study. Digestion 2008; 77: 161-165.
- Fenollar F, Raoult D. Molecular techniques in Whipple’s disease. Expert Rev Mol Diagn 2001; 1: 299-309.
- Baisden BL, Lepidi H, Raoult D et al. Diagnosis of Whipple’s disease by immunohistochemical analysis: a sensitive and specific method for the detection of Tropheryma whipplei (the Whipple bacillus) in paraffin-embedded tissue. Am J Clin Pathol 2002; 118: 742-748.
- Mallmann C, Siemoneit S, Schmiedel D, Petrich A, Gescher DM, Halle E, Musci M, Hetzer R, Gobel UB, Moter A. Fluorescence in situ hybridization to improve the diagnosis of endocarditis: a pilot study. Clin Microbiol Infect 2010; 16: 767-773.
- Bonhomme CJ, Renesto P, Nandi S, Lynn AM, Raoult D. Serological microarray for a paradoxical diagnostic of Whipple’s disease. Eur J Clin Microbiol Infect Dis 2008; 27: 959-968.
- Fenollar F, Amphoux B, Raoult D. A paradoxical Tropheryma whipplei western blot differentiates patients with Whipple’s disease from asymptomatic carriers. Clin Infect Dis 2009; 49: 717-723.
- Yardley JH, Hendrix TR. Combined electron and light microscopy in Whipple’s disease. Demonstration of “bacillary bodies” in the intestine. Bull Johns Hopkins Hospital 1961; 109: 80-98.
- Fenollar F, Fournier P, Robert C, Raoult D. Use of genome selected repeated sequences increases the sensitivity of PCR detection of Tropheryma whipplei. J Clin Microbiol 2004; 42: 401-403.
- Moter A, Schmiedel D, Petrich A, Wiessner A, Kikhney J, Schneider T, Moos V, Göbel U, Reischl U. Validation of an rpoB gene PCR assay for detection of Tropheryma whipplei: 10 Years’ experience in a national reference laboratory. J Clin Microbiol 2013; 51: 3858-3861.
- Marth T. Systematic review: Whipple’s disease (Tropheryma whipplei infection) and its unmasking by tumour necrosis factor inhibitors. Aliment Pharmacol Ther 2015; 41: 709-724.
- Cannon W. Whipple’s disease, genomics, and drug therapy. Lancet 2003; 361: 1916-1931.
- Feurle G, Marth T. An evaluation of antimicrobial treatment for Whipple’s Disease. Tetracycline versus trimethoprim-sulfamethoxazole. Dig Dis Sci 1994; 39: 1642-1648.
- Feurle GE, Moos V, Blaker H, Loddenkemper C, Moter A, Stroux A, Marth T, Schneider T. Intravenous ceftriaxone, followed by 12 or three months of oral treatment with trimethoprim-sulfamethoxazole in Whipple’s disease. J Infect 2013; 66: 263-270.
- Feurle GE, Junga NS, Marth T. Efficacy of ceftriaxone or meropenem as initial therapies in Whipple’s disease. Gastroenterology 2010; 138: 478-486.
- Moos V, Feurle GE, Schinnerling K, Geelhaar A, Friebel J, Allers K, Moter A, Kikhney J, Loddenkemper C, Kuhl AA, Erben U, Fenollar F, Raoult D, Schneider T. Immunopathology of immune reconstitution inflammatory syndrome in Whipple’s disease. J Immunol 2013; 190: 2354-2361.
- Lagier JC, Fenollar F, Lepidi H, Liozon E, Raoult D. Successful treatment of immune reconstitution inflammatory syndrome in Whipple’s disease using thalidomide. J Infect 2010; 60: 79-82.
- Le Blay P, Rakotonirainy H, Lagier JC, Raoult D, Puechal X, Pers YM. A severe Whipple’s disease with an immune reconstitution inflammatory syndrome: an additional case of thalidomide efficiency. Joint Bone Spine 2014; 81: 260-262.
- Lagier JC, Fenollar F, Lepidi H, Giorgi R, Million M, Raoult D. Treatment of classic Whipple’s disease: from in vitro results to clinical outcome. J Antimicrob Chemother 2014; 69: 219-227.
- Lagier JC, Fenollar F, Raoult D. Whipple’s disease and Tropheryma whipplei infections in internal medicine. When to think about it? How to treat? Rev Med Interme 2014; 35: 801-807.
- Schneider T, Stallmach A, Von Herbay A, Marth T, Strober W, Zeitz M. Treatment of refractory Whipple’s disease with interferón- γ. Ann Intern Med 1998; 129: 875-877.
- Audoly G, Fenollar F, Lagier JC, Lepidi H, Raoult D. Deglycosylation of Tropheryma whipplei biofilm and discrepancies between diagnostic results during Whipple’s disease progression. Scientific Reports 2016; 6: 23883.
Correspondencia: Roberto Leandro Parodi
Santa Fe 1831, 3° piso (C.P.: 2000). Rosario, Provincia de Santa Fe, Argentina
Tel./fax: 0341 5271109
Correo electrónico: rlparodi@fibertel.com.ar
Acta Gastroenterol Latinoam 2019;49(3): 229-240
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE