Adriana Fernández ID· Rosana Vagni ID· Verónica Garrido ID· Gisela Merlo ID· Natalia Delgado ID· Analía Cabrera ID· Romina Vega ID· Alejandro Viqueiras ID· Ana Cabral ID· Humberto Fain ID· Corina Dlugoszewski ID· Horacio F González ID
Grupo RIANA (Red Interdisciplinaria de Atención Nutricional Ambulatoria), Argentina.
Acta Gastroenterol Latinoam 2022;52(2):251-257
Recibido: 14/03/2022 / Aceptado: 22/05/2022 / Publicado online el 27/06/2022 / https://doi.org/10.52787/agl.v52i2.187
Resumen
Introducción. Se ha descrito que la falla intestinal crónica secundaria a síndrome de intestino corto resulta en un impacto sobre el crecimiento de los niños. Objetivo. Comparar el crecimiento de niños con falla intestinal crónica secundaria a síndrome de intestino corto neonatal entre los recién nacidos de edad gestacional ≥ 36 semanas y 6 días grupo 1 y < 36 semanas grupo 2, evaluados a los dos años de vida y durante la niñez. Métodos. Estudio longitudinal, retrospectivo, analítico, de niños con síndrome de intestino corto neonatal y falla intestinal crónica. Se observó el crecimiento, z score peso/edad, z score Talla/Edad y z score de índice de masa corporal/edad (Organización Mundial de la Salud) a los 2 años de edad; a posteriori, analizamos el inicio y el final de un período de un año entre los 2-9 años de edad de los mismos pacientes. Resultados. Grupo 1: 13 pacientes, grupo 2: 8 pacientes. Se encontró un mayor impacto en z-score de talla/edad en el grupo 2 a los 2 años (p = 0,008). Durante el período analizado luego de los 2 años, se observó que el z-score de peso/edad y el z-score de indice de masa corporal/edad se mantuvieron estables, mientras que el z-score de talla/edad empeoró en ambos grupos. Conclusión. Los niños con < 36 semanas de edad gestacional tuvieron un mayor impacto en el crecimiento longitudinal a los 2 años y ambos grupos estudiados tuvieron un impacto negativo en el crecimiento en talla luego de los 2 años.
Palabras claves. Síndrome de intestino corto, falla intestinal, crecimiento, Nutrición Parenteral Domiciliaria, prematuridad.
Growth of Children with Neonatal Short Bowel Syndrome: Its Relationship to Gestational Age
Summary
Introduction. It has been described that children with chronic intestinal failure secondary to short bowel syndrome have an impact on growth. Objective. To compare the growth of children with chronic intestinal failure secondary to neonatal short bowel syndrome between newborns of gestational age ≥ 36 weeks and 6 days Group 1 and < 36 weeks Group 2, evaluated at two years of age and during childhood. Methods. Longitudinal, retrospective, analytical study of children with neonatal short bowel syndrome and chronic intestinal failure. Growth, weight/age z-score, height/age z-score and body mass index/age z-score (World Health Organization) were determined at 2 years of age; a posteriori, we analyzed the beginning and end of a period of one year between 2-9 years of age of the same patients. Results. Group 1: 13 patients, Group 2: 8 patients. A greater impact on height/age z-score was found in Group 2 at 2 years (p < 0.008). During the analyzed period after 2 years, it was observed that the weight/age z-score and the body mass index z-score/age remained stable, while the height/age z-score worsened in both groups. Conclusion. Children with < 36-weeks of gestational age had a greater impact on longitudinal growth at 2 years and both groups studied had a negative impact on height growth after 2 years.
Keywords. Short bowel syndrome, intestinal failure, growth, home parenteral nutrition, prematurity.
Abreviaturas
FIC: Falla intestinal crónica.
SIC: Síndrome de intestino corto.
NP: Nutrición parenteral.
AVC: Accesos vasculares centrales.
EG: Edad gestacional.
Z T/E: z-score de talla/edad.
Z P/E: z-score de peso/edad.
Z IMC/Edad: Índice de masa corporal/edad.
OMS: Organización Mundial de la Salud.
NPD: Nutrición parenteral domiciliaria.
Introducción
La falla intestinal (FI) secundaria a síndrome de intestino corto (SIC) en pediatría es una entidad poco frecuente, pero de muy alta morbimortalidad.1
Los casos más graves de SIC cursan con falla intestinal crónica, una condición clínica caracterizada por una grave malaabsorción de fluidos, electrolitos, macro y micronutrientes. Por lo tanto, estos pacientes serán dependientes de la nutrición parenteral (NP) en forma prolongada o permanente2 y deberán contar con la atención de un equipo de rehabilitación intestinal experto en la patología.3,4
La causa más frecuente de falla intestinal en pediatría es el síndrome de intestino corto de origen neonatal, secundario a malformaciones digestivas congénitas, vólvulo o enteritis necrotizante.5, 6 La incidencia es mayor en recién nacidos pretérminos que en recién nacidos de término.7, 8
El crecimiento en estos niños es afectado por diferentes causas, sobre todo en las primeras etapas de la vida: alteraciones hidroelectrolíticas, aportes inadecuados, complicaciones asociadas a la enfermedad de base, cirugías reiteradas y causas relacionadas con complicaciones de la nutrición parenteral prolongada: hepatopatía asociada a la FI,9, 10 complicaciones asociadas a los accesos venosos centrales (AVC),11 osteopatía, alteraciones renales.12, 13 Se suman a estas complicaciones mencionadas las comorbilidades asociadas a la prematurez.14, 15
El objetivo del estudio es comparar el crecimiento de niños con SIC neonatal y FI nacidos con edad gestacional (EG) ≥ de 36 semanas y 6 días, con niños con EG < de 36 semanas a los dos años de vida y al inicio y al final de un período de un año posterior a los dos años de edad.
Materiales y métodos
Estudio longitudinal, retrospectivo, analítico, sobre la base de datos de niños con SIC neonatal y FI crónica, dependientes de NP domiciliaria (NPD). Se registraron z score peso/edad (z P/E), z score talla/edad (z T/E) y z score IMC/edad (z IMC/E) a los 2 años de edad y, a posteriori, analizamos el inicio y el final de un período de un año entre los 2-9 años de edad de los mismos pacientes. Los datos fueron comparados con las curvas de crecimiento de la Organización Mundial de la Salud (OMS). Los pacientes fueron analizados en dos grupos: G1 ≥ 36 semanas y 6 días de EG y G2 < 36 y 5 días semanas de EG.
El análisis estadístico se realizó con el software R versión 4.0.3. Se estudió la normalidad de las variables mediante el test de Shapiro-Wilk. Los datos no paramétricos se informaron como mediana (IQR: rango intercuartílico). Para comparar las variables entre los niños del G1 y G2, se usó el test de Mann-Whitney, según correspondiera. Para el cambio en las variables antropométricas luego de un año de tratamiento, se utilizó el test de Wilcoxon de rangos signados. En todos los casos, se consideró significativo un p – valor < 0,05.
Consideraciones éticas
Por la característica retrospectiva del estudio, no se requirió la aprobación de la junta de revisión institucional o del Comité de Ética.
Para proteger la identidad del registro de los participantes, los datos personales fueron disociados e incorporados a otra base de datos con un código.
Resultados
Fueron analizados 21 niños, 50% masculinos; G1, 13 pacientes, G2, 8 pacientes. Todos recibieron ≥ 60% de las calorías no proteicas en NP sobre la ecuación de gasto energético de Schofield durante todo el período observado.
El índice de infecciones asociadas a los AVC fue de 1,6/1000 días de NP y ningún paciente presentó hepatopatía asociada a la FI durante el año observado luego del segundo año de vida.
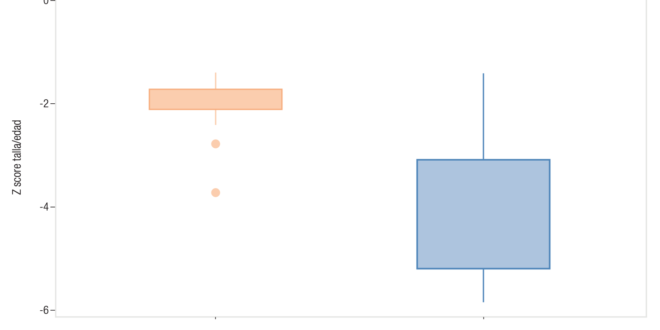
En la Tabla 1 se observan las diferencias entre los dos grupos estudiados en EG, peso de nacimiento y talla/edad a los dos años de vida (véase la diferencia de zT/E a los dos años en el Gráfico 1).
Tabla 1. Comparación de edad gestacional, peso de nacimiento, talla/edad y z score de talla/edad a los dos años entre el grupo 1 y grupo 2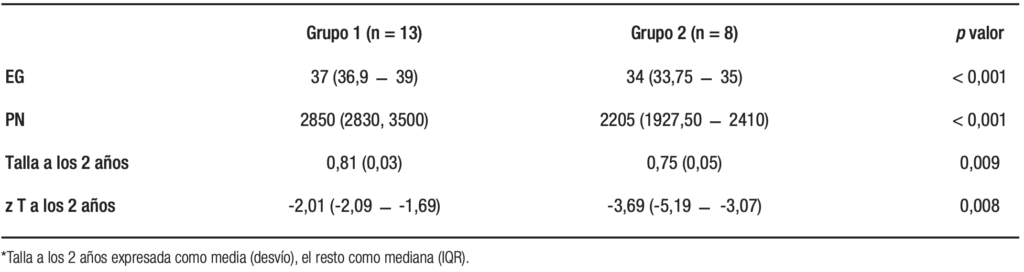
Gráfico 1. Diferencias de Z score de talla/edad entre los grupos 1 y 2 a los dos años de vida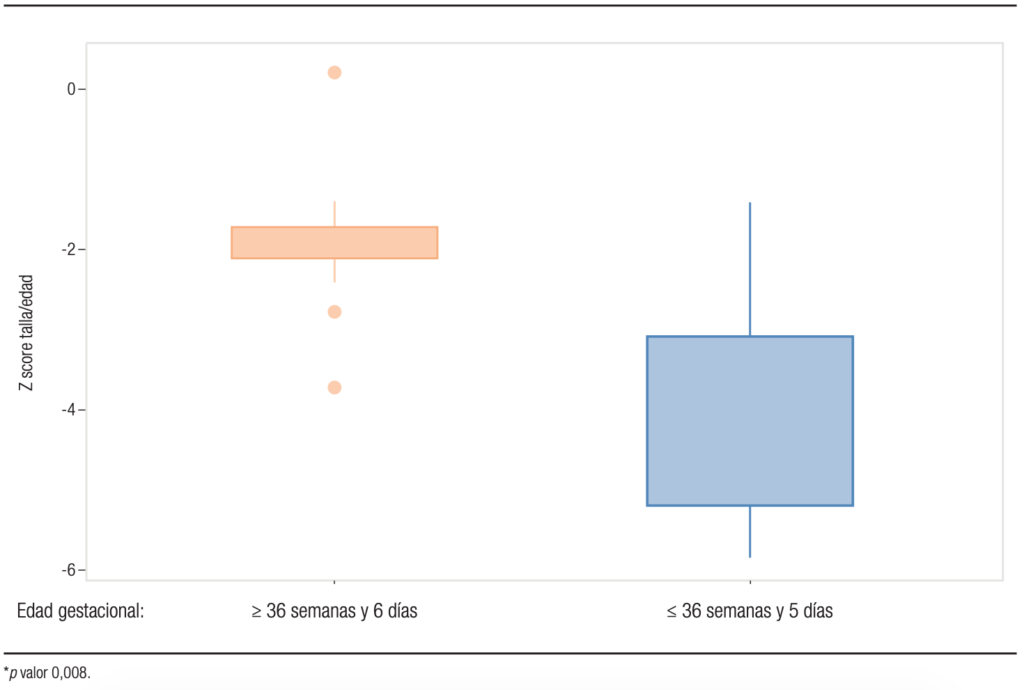
En la segunda parte del análisis se observó el crecimiento de los mismos niños en ambos grupos al inicio y al final de un período de un año entre los 2 y 9 años de edad. La edad mediana del G1 fue de 4,5 años (2,5 – 5) y el G2 4,75 (3 – 6,88), (p = 0,255).
En la Tabla 2 se observan las diferencias de los indicadores del estado nutricional entre el inicio y final del año estudiado en ambos grupos; el z score de P/E e IMC/E no presentan cambios significativos (Gráfico 2 y 3) pero el z score de talla/edad empeora para ambos grupos (véase Gráfico 4).
Tabla 2. Diferencias en z score de talla/edad, peso/edad e IMC al inicio y al final del año entre los 2 y 9 años de edad, observado para el grupo 1 y el grupo 2, y entre ambos grupos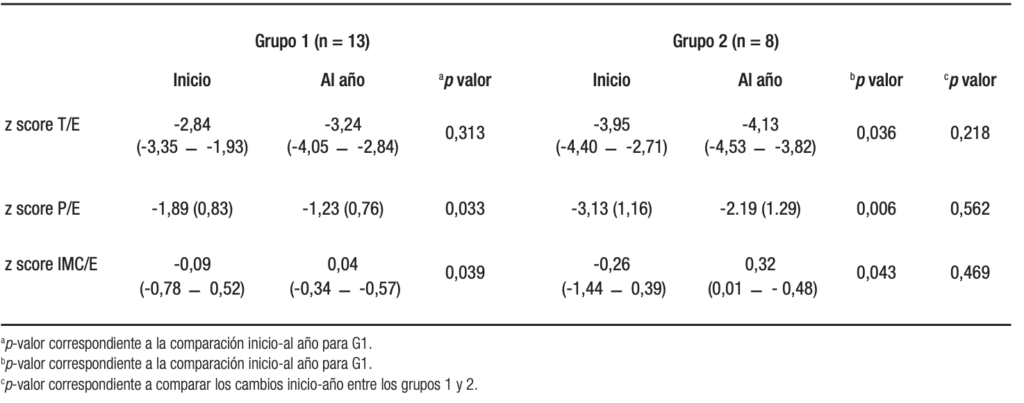
Gráfico 2. Diferencias de z score de peso/edad al inicio y al final del período entre los 2 y 9 años, observado entre el grupo 1 y el grupo 2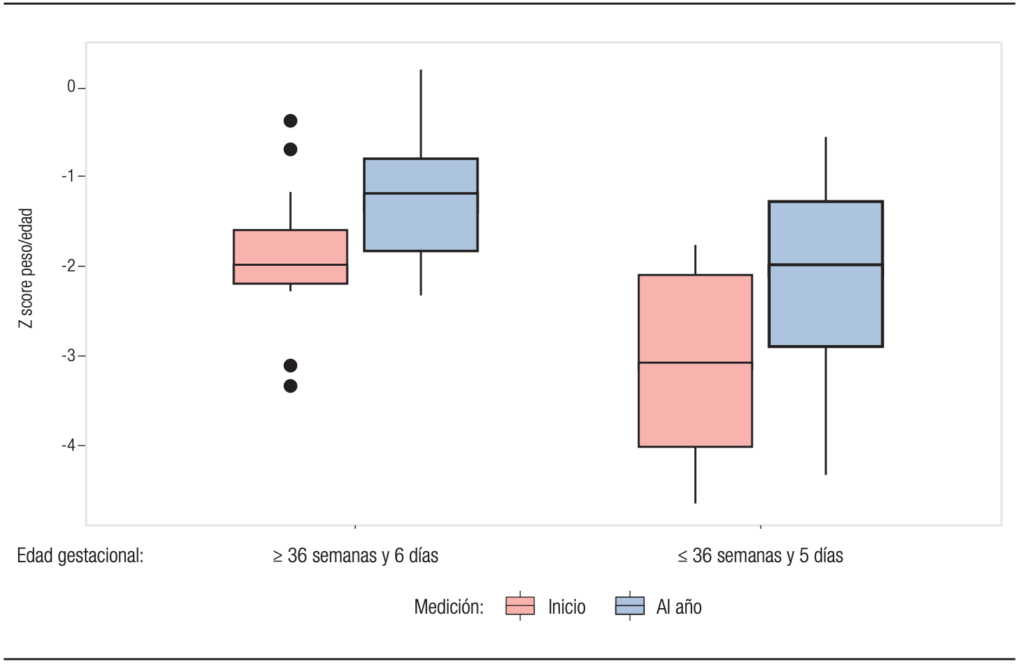
Gráfico 3. Diferencias de z score de IMC/edad al inicio y al final del período observado entre el grupo 1 y el grupo 2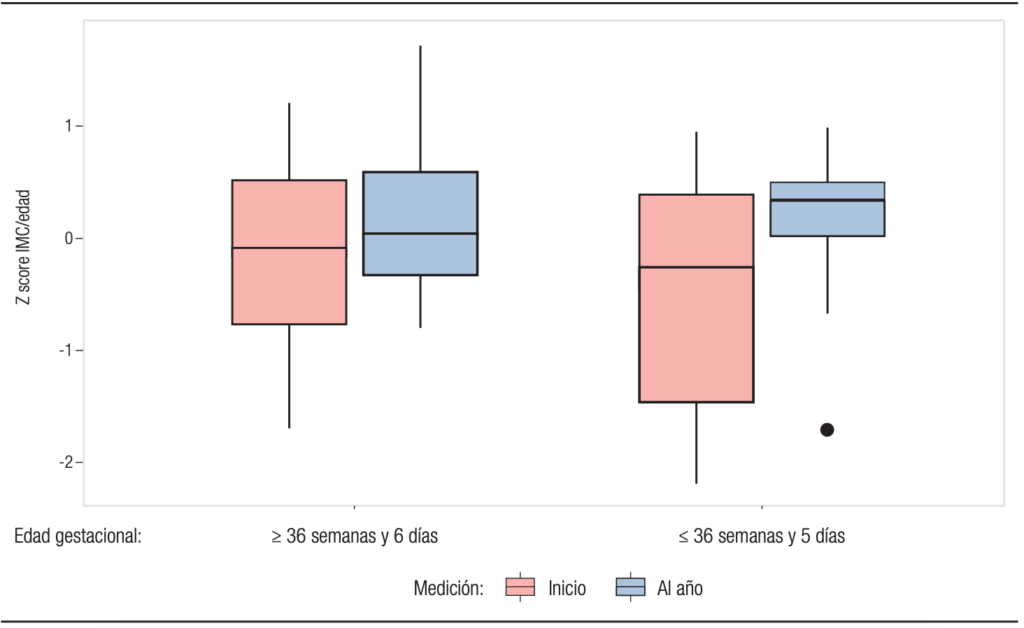
Gráfico 4. Diferencias de z score de talla/edad al inicio y al final del período observado el grupo 1 y grupo 2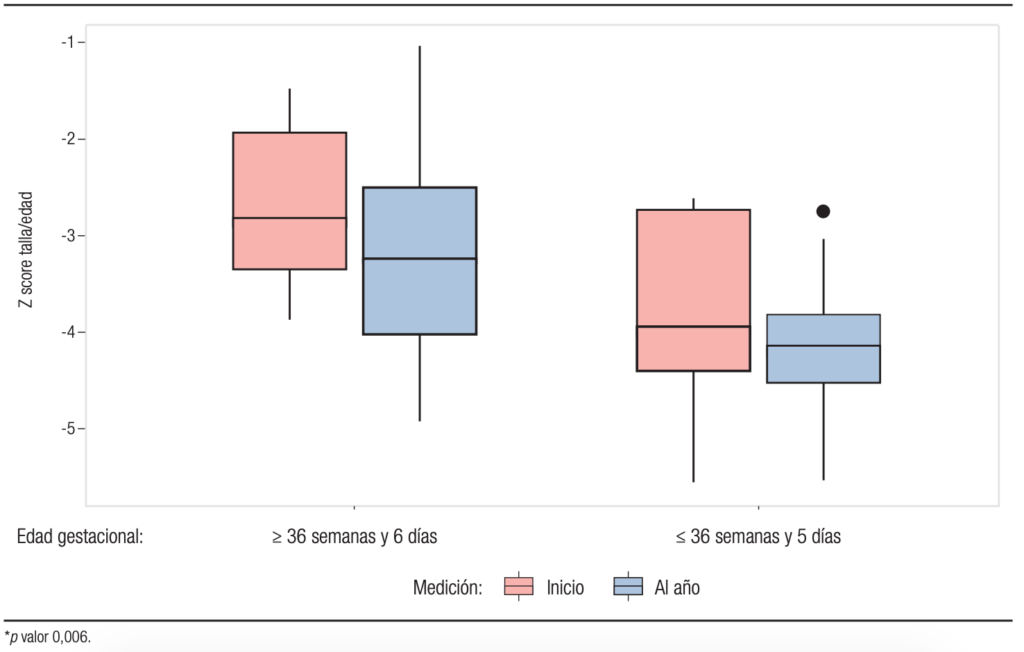
Discusión
En este trabajo se observa un mayor impacto en el crecimiento longitudinal en los niños nacidos con EG < 36 semanas (G2). Durante la niñez, ambos se mantienen sin cambios significativos en peso/edad e IMC/Edad, pero empeoran en zT/E, con mayor impacto en los del G2.
Lograr un crecimiento adecuado es un objetivo principal en el tratamiento de la FI secundaria a SIC en pediatría,16 pero pocos trabajos lo mencionan entre sus resultados. En una revisión sistemática sobre 70 trabajos acerca de niños con FI dependientes de NP prolongada, Nagelkerke y col. observó que solo 23 incluían el crecimiento como un resultado.17
Fue observado un impacto negativo en el crecimiento en aquellos niños que dependen de la NP prolongada desde etapas tempranas,18 pero, actualmente, existen escasas recomendaciones sobre los aportes nutricionales en NP para niños con retraso de crecimiento en talla.19, 20
Hill y col. analizaron a 45 pacientes que recibían nutrición parenteral domiciliaria (NPD), entre 5 y 17 años, con FI, y observaron que el 50% presentaba baja talla y un tercio, baja densidad ósea.21
Pichler J y col. analizaron el crecimiento y la composición corporal de 34 niños con FI crónica, y encontraron un déficit de crecimiento, de peso y de masa magra en todos ellos.22
En nuestro medio, Dalieri M y col., sobre 27 pacientes con FI secundaria a SIC neonatal, informaron que el 27% presentó una talla inferior a z score de <-2 a los 2 años de vida, sin discriminar a los pretérminos.23
Entre las debilidades de nuestro trabajo, debemos remarcar que se trata de un estudio retrospectivo en una base de datos obtenidos de pacientes externados en nutrición parenteral domiciliaria. Por lo tanto, no pudimos precisar información sobre algunos antecedentes perinatales y complicaciones de la etapa neonatal.
Sin embargo, creemos que, a pesar de que el n muestral es limitado, se trata de una patología de baja incidencia poblacional sobre la cual no son frecuentes los reportes en nuestro medio, y hallamos que la fortaleza es el seguimiento a largo plazo de pacientes complejos con NPD prolongada por un equipo interdisciplinario de expertos.
Conclusión
Los RNPT con EG < de 36 semanas presentaron un impacto mayor en la talla que los de >36 semanas y 6 días, tanto a los dos años como en etapa posterior, mientras que el IMC/E se mantuvo sin cambios significativos. Esta observación no es, en general, puntualizada en otros estudios de SIC y creemos que debiera diferenciarse por tratarse de una población de mayor riesgo.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos, las tablas y los gráficos presentes en el manuscrito son originales y fueron realizados en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Fernández A, Vagni R, Garrido V y col. Crecimiento de niños con síndrome de intestino corto neonatal: relación con la edad gestacional. Acta Gastroenterol Latinoam. 2022; 52(2):251-257. https://doi.org/10.52787/agl.v52i2.187
Referencias
- Fernández A, Desantadina V, Balacco M, Busoni V, Cabral A, Cosentino S, Dalieri M, Dlugozewski C, Fabeiro M, Fain H, Hassan AS, Martínez MI, Martínez S, Saure C, Sosa P, Strasnoy I, Rumbo C, Vagni R. Guía clínica para el manejo de la falla intestinal secundaria a síndrome de intestino corto en pediatría. Arch Argent Pediatr. 2021t;119(5): e441-e472.
- D’Antiga L, Goulet O. Intestinal failure in children: the European view. J Pediatr Gastroenterol Nutr. 2013;56:118-26.
- Chandra R, Kesavan A. Current treatment paradigms in pediatric short bowel syndrome. Clin Journal Gastroenterol. 2018;11:103-12.
- Merritt RJ, Cohran V, Raphael BP, et al. Intestinal Rehabilitation Programs in the Management of Pediatric Intestinal Failure and Short Bowel Syndrome. J Pediatr Gastroenterol Nutr. 2017;65(5):588-96.
- Mutanen A, Wales PW. Etiology and prognosis of pediatric short bowel syndrome. Semin Pediatr Surg. 2018;27(4):209-17.
- Mezoff EA, Cole CR, Cohran VC. Etiology and Medical Management of Pediatric Intestinal Failure. Gastroenterol Clin North Am. 2019;48(4):483-98.
- Wales PW, de Silva N, Kim J, Lecce L, et al. Neonatal short bowel syndrome: population-based estimates of incidence and mortality rates. J Pediatr Surg. 2004;39(5):690-5.
- Batra A, Keys SC, Johnson MJ, et al. Epidemiology, management and outcome of ultrashort bowel syndrome in infancy. Arch Dis Child Fetal Neonatal Ed. 2017;102(6):F551-6.
- Lacaille F, Gupte G, Colomb V, et al. Intestinal Failure–Associated Liver Disease: A Position Paper of the ESPGHAN Working Group of Intestinal Failure and Intestinal Transplantation. JPGN. 2015;60(2):272-83.
- Norsa L, Nicastro E, Di Giorgio A, Lacaille F, D’Antiga L. Prevention and Treatment of Intestinal Failure-Associated Liver Disease in Children. Nutrients. 2018;10(6):664.
- Kolaček S, Puntis JWL, Hojsak I; ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN Guidelines on Pediatric Parenteral Nutrition: Venous Access. Clin Nutr. 2018;37(6 Pt B):2379-91.
- Hartman C, Shamir R, Simchowitz V, et al.; ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN Guidelines on Pediatric Parenteral Nutrition: Complications. Clin Nutr. 2018;37(6 Pt B):2418-29.
- Fullerton BS, Hong CR, Jaksic T. Long-term outcomes of pediatric intestinal failure. Semin Pediatr Surg. 2017;26(5):328-35.
- Olieman JF, Penning C, Spoel M, et al. Long-term impact of infantile short bowel syndrome on nutritional status and growth. Br J Nutr. 2012;107(10):1489-97.
- Duggan CP, Jaksic T. Pediatric Intestinal Failure. N Engl J Med. 2017;377(7):666-75.
- Oliveira C, de Silva NT, Stanojevic S, et al. Change of Outcomes in Pediatric Intestinal Failure: Use of Time-Series Analysis to Assess the Evolution of an Intestinal Rehabilitation Program. J Am Coll Surg. 2016;222(6):1180-1188.e3.
- Nagelkerke SCJ, Mager DJ, Benninga MA, et al. Reporting on outcome measures in pediatric chronic intestinal failure: A systematic review. Clin Nutr. 2020;39(7):1992-2000.
- Morton DL, Hawthorne KM, Moore CE. Growth of Infants with Intestinal Failure or Feeding Intolerance Does Not Follow Standard Growth Curves. J Nutr Metab. 2017;2017.
- Batra A, Beattie RM. Infants on Parenteral Nutrition: Getting the Calories Right. JPEN. 2018;42(2):268-9.
- Abi Nader E, Lambe C, Talbotec C, et al. A New Concept to Achieve Optimal Weight Gain in Malnourished Infants on Total Parenteral Nutrition. JPEN J Parenter Enteral Nutr. 2018;42(1):78-86.
- Pichler J, Chomtho S, Fewtrell M, et al. Growth and bone health in pediatric intestinal failure patients receiving long-term parenteral nutrition. Am J Clin Nutr. 2013;97(6):1260-9.
- Pichler J, Chomtho S, Fewtrell M, et al. Body composition in paediatric intestinal failure patients receiving long-term parenteral nutrition. Arch Dis Child. 2014;99:147-53.
- Dalieri M, Fabeiro M, Prozzi M, et al. Growth assessment of children with neonatal short bowel syndrome. Nutr Hosp. 2007;22(4):455-60.
Correspondencia: Adriana Fernández
Correo electrónico: adrianafernandezlp@gmail.com
Acta Gastroenterol Latinoam 2022;52(2):251-257
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE