Florencia Benitez ID· Yéssica Pontet ID
Clínica de Gastroenterología, UdelaR.
Montevideo, Uruguay.
Acta Gastroenterol Latinoam 2022;52(3):395-401
Recibido: 30/07/2022 / Aceptado: 23/09/2022 / Publicado online el 29/09/2022 / https://doi.org/10.52787/agl.v52i3.231
Resumen
La amiloidosis comprende un grupo heterogéneo de enfermedades infiltrativas caracterizadas por el depósito extracelular de fibrillas proteicas insolubles. El tubo digestivo puede afectarse en cualquier sector de forma directa o por infiltración del sistema nervioso autónomo. Los sectores más frecuentemente involucrados son el colon descendente y el sigmoides. El diagnóstico es histológico mediante tinción con Rojo Congo.
La colitis isquémica es la patología isquémica más frecuente del tracto gastrointestinal. La mayoría de las veces es transitoria y reversible, siendo el colon izquierdo el sector involucrado con más frecuencia. Las manifestaciones clínicas son inespecíficas y dependen tanto del grado de isquemia como de los sitios afectados. La videocolonoscopía es considerada el patrón oro para el diagnóstico. La distribución topográfica de las lesiones suele ser territorial, segmentaria y parcheada, según los vasos ocluidos. La ausencia de hallazgos patognómicos para el diagnóstico de colitis isquémica hace difícil su determinación en el contexto de comorbilidades como la amiloidosis, ya que esta enfermedad puede tener la misma presentación clínica y endoscópica. La isquemia no sólo constituye uno de sus mecanismos fisiopatológicos de lesión intestinal, sino que también puede ser consecuencia de una afectación sistémica independiente de la infiltración colónica. Se describe y discute el caso de un paciente de 60 años con amiloidosis asociada a cadenas ligeras y debut de colitis, que se presenta con sangrado digestivo bajo y dolor abdominal. Debido al diagnóstico en diferido de amiloidosis colónica y sus características similares a la colitis isquémica, discernir entre ambos resultó un desafío diagnóstico.
Palabras claves. Colitis, amiloidosis, isquemia, hemorragia digestiva.
Ischemic Colitis and Amyloidosis: a Diagnostic Challenge
Summary
Amyloidosis comprises a heterogeneous group of infiltrative diseases characterized by the extracellular deposition of insoluble protein fibrils. Any sector of the digestive tract can be affected directly or by infiltration of the autonomic nervous system. Descending and sigmoid colon are the most frequently involved sectors. Diagnosis is histological by Congo red staining. Ischemic colitis is the most frequent ischemic pathology of the gastrointestinal tract. Usually it is transient and reversible, with the left colon being habitually involved. Clinical manifestations are nonspecific and depend on the degree of ischemia and the affected sites. The gold standard for diagnosis is video colonoscopy. The topographic distribution of the lesions is usually territorial, segmental and patchy, depending on the occluded vasculature. The absence of pathognomonic findings for the diagnosis of ischemic colitis makes its determination difficult in the context of comorbidities such as amyloidosis. This disease can have the same clinical and endoscopic presentation. Ischemia not only constitutes one of the mechanisms of intestinal injury, but can also be a consequence of systemic involvement independently of colonic infiltration. The case of a 60-year-old patient with light chain-associated amyloidosis and colitis onset, who presented lower gastrointestinal bleeding and abdominal pain, is described and discussed. Due to the delayed diagnosis of colonic amyloidosis and the similarity with ischemic colitis, distinguishing between the two was a diagnostic challenge.
Keywords. Colitis, amiloidosis, ischemia, digestive hemorrhage.
Abreviaturas
AAL: Amiloidosis asociada a cadenas ligeras.
CI: Colitis isquémica.
HDB: Hemorragia digestiva baja.
VCC: Videocolonoscopia.
Hb: Hemoglobina.
FEVI: Fracción de eyección ventricular izquierda.
H&E: Hematoxilina y eosina.
PMN: Polimorfonucleares.
Introducción
El término amiloidosis corresponde a un grupo heterogéneo de enfermedades infiltrativas caracterizadas por el depósito extracelular de fibrillas proteicas insolubles, lo que determina alteraciones en la estructura y función de los tejidos involucrados.1-3 El tubo digestivo puede afectarse en cualquier sector de forma directa o por infiltración del sistema nervioso autónomo.4, 5 Los sectores más frecuentemente involucrados son el colon descendente y el sigmoides.5 La afectación colónica puede ser inespecífica y suele ser subdiagnosticada.1, 5, 6 Los pacientes en general permanecen asintomáticos hasta el desarrollo de complicaciones como obstrucción, estenosis, perforación o hemorragia.1, 3 El sangrado de origen intestinal ocurre en 4 a 36% de los pacientes y se vincula a erosiones o úlceras. Puede estar favorecido por desórdenes de la coagulación que se describen en la amiloidosis asociada a cadenas ligeras (AAL) o estar causado por infiltración tisular directa. El sangrado también puede vincularse a alteraciones de la vasoconstricción, así como a isquemia intestinal localizada como consecuencia de la infiltración de las paredes de los vasos sanguíneos.1, 2 Desde el punto de vista endoscópico, el colon afectado presenta hallazgos poco específicos.3 La amiloidosis AL forma típicamente protrusiones polipoides.5, 6 El primer paso para avanzar en el diagnóstico es confirmar, mediante el examen histológico, la presencia de depósitos de amiloide, además de valorar el tipo de fibrilla.7 La tinción considerada patrón oro para confirmar el depósito es la de Rojo Congo, con la cual el amiloide presenta un aspecto rojo característico bajo luz normal y birrefringencia verde manzana bajo luz polarizada.2, 6
La colitis isquémica (CI) es la patología isquémica más frecuente del tracto gastrointestinal (75% de los casos).8, 9 Su incidencia en la población general se ha estimado en 16 casos cada 100.000 individuos y el diagnóstico es más frecuente en mayores de 65 años.10 Otros factores de riesgo además de la edad son: hipertensión arterial, hiperlipidemia, enfermedad coronaria y diabetes.11 En la mayoría de los casos ocurre una reducción rápida y transitoria del flujo sanguíneo intestinal de causa no oclusiva, que determina un aporte de sangre insuficiente e hipoxia tisular. En más de la mitad de los casos la enfermedad es transitoria y reversible, siendo el colon izquierdo el sector más frecuentemente involucrado (hasta 75% de los casos).8-9, 11-12 Las manifestaciones clínicas son inespecíficas y dependen del grado de isquemia y los sitios afectados. El dolor abdominal es el síntoma predominante. La hemorragia digestiva baja (HDB) ocurre típicamente luego de 12 a 24 horas de iniciado el dolor.8, 10 Otros síntomas frecuentes son diarrea, distensión abdominal, náuseas y vómitos.10 La tomografía computada es el método de imagen más utilizado.9 Los hallazgos más frecuentes incluyen engrosamiento de la pared, edema, dilatación y, en menor medida, imágenes en “huellas dactilares” como resultado de hemorragia subepitelial.9, 10 La videocolonoscopía (VCC) es considerada el patrón oro para el diagnóstico. La distribución topográfica de las lesiones suele ser territorial, segmentaria y parcheada, según los vasos ocluidos.8 Los hallazgos más frecuentes son: mucosa edematosa y frágil, eritema segmentario, hemorragias petequiales, signo de úlcera longitudinal, atrofia y granularidad de la mucosa. Las principales características histológicas encontradas son: criptas distorsionadas, nódulos hemorrágicos, edema de la mucosa y submucosa, macrófagos con hemosiderina, hiperplasia del tejido de granulación, células fantasma, necrosis y trombos intravasculares.8, 10
En el contexto de comorbilidades como la amiloidosis, la ausencia de hallazgos patognómicos para la colitis isquémica dificulta su diagnóstico. Esta enfermedad puede tener la misma presentación clínica y endoscópica. La isquemia no sólo constituye uno de sus mecanismos fisiopatológicos de lesión intestinal, sino que también puede ser consecuencia de su afectación sistémica, independientemente de la infiltración colónica. Por lo tanto, ambas entidades pueden superponerse, dificultando la diferenciación diagnóstica.
Se describe y discute el caso de un paciente de 60 años con amiloidosis asociada a cadenas ligeras y que debuta con colitis, manifestada por un sangrado digestivo bajo y dolor abdominal.
Caso clínico
Se presenta el caso de un hombre de 60 años sin antecedentes médico-quirúrgicos conocidos y sin controles previos de salud. Fue hospitalizado debido a una insuficiencia cardíaca global descompensada de etiología incierta, con flutter auricular por el que requirió anticoagulación con heparina de bajo peso molecular.
De la evaluación etiológica de su cardiopatía se destacó la presencia de características sugestivas de amiloidosis en la resonancia magnética cardíaca: ventrículo izquierdo con grosor parietal aumentado, dilatación biatrial, derrame pericárdico moderado y depósito focal de gadolinio.13 Se efectuaron biopsias de grasa subcutánea abdominal y por xerostomía de glándulas salivales menores, que mostraron depósitos de amiloide. Se realizó diagnóstico de AAL sin elementos definitorios de mieloma múltiple y se inició quimioterapia con ciclofosfamida, bortezomib y dexametasona.
A las 8 horas de iniciada la anticoagulación el paciente presentó un episodio de hemorragia digestiva baja, autolimitada, sin repercusión hemodinámica, que cesó en 24 horas y no se reiteró. También presentó dolor en epigastrio e hipocondrio izquierdo de inicio abrupto, de moderada intensidad, sin irradiaciones ni relación con las ingestas o las deposiciones. El dolor se reproducía al examen físico, sin elementos de irritación peritoneal. No presentó otros sangrados, clínica infecciosa o digestiva ni repercusión general. En los parámetros bioquímicos de laboratorio, se destacó la repercusión hematimétrica, dada por una anemia microcrocítica leve (Hb 10.1 g/dl), leucocitosis de 16400 10^3/uL a predominio de neutrófilos, plaquetas de 197000 10^3/uL, INR 1.7 y tiempo de protrombina de 72%. La amilasemia, velocidad de eritrosedimentación y proteína C reactiva eran normales. La función renal se encontraba conservada y el hepatograma no presentaba alteraciones a destacar. Frente a este episodio se suspendió la anticoagulación y la administración de los antiinflamatorios no esteroideos. Los exámenes de coprocultivo, coproparasitológicos y detección de Clostridium tuvieron resultados negativos.
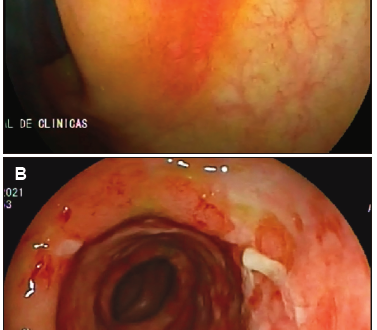
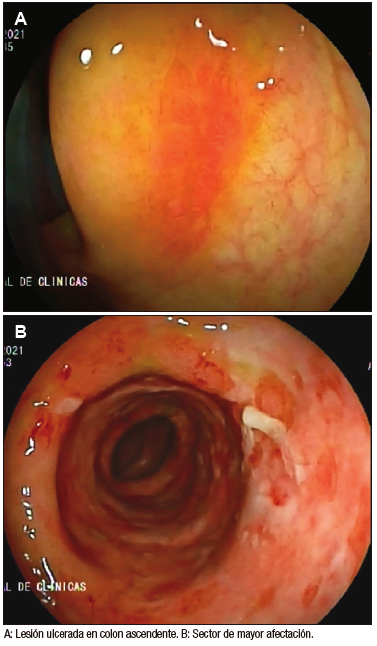
Se realizó una tomografía de abdomen que mostró, a nivel del ángulo esplénico y parte del colon transverso, engrosamiento parietal difuso (8 mm) de segmento largo con aspecto edematoso. El mismo presentó calibre y realce parietal habitual y alteración de la densidad de la grasa e ingurgitación de vasos mesentéricos adyacentes. Una semana posterior al sangrado se realizó VCC total con ileoscopía. Este estudio mostró en el colon ascendente proximal una lesión plana y eritematosa con centro deprimido, de bordes elevados, informada como úlcera en vías de cicatrización con mucosa circundante sana (Figura 1-a). Desde los 35 a los 60 cm del margen anal se destacó la ausencia de patrón vascular, edema, eritema y úlceras superficiales extensas cubiertas de fibrina. Presentó mayor afectación desde los 50 a los 60 cm, sector que se correlacionó con el ángulo esplénico (Figura 1-b). El resto de la mucosa presentó el aspecto habitual.
Figura 1. Videocolonoscopía realizada al debut
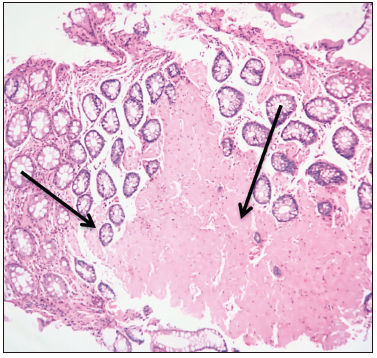
La anatomía patológica reveló, a nivel de la úlcera del colon ascendente, epitelio superficial esfacelado, criptas con leve distorsión arquitectural y disminución de la mucosecreción con exudado linfoplasmocitario. A nivel de la muscularis mucosae se informaron depósitos de material eosinófilo amorfo (Figura 2). En los sectores de mayor afectación se destacó la presencia de ulceración tapizada por exudado fibrino-hemorrágico con polimorfonucleares. Por debajo presentó tejido de granulación con exudado linfoplasmocitario y polimorfonucleares. También se destacó la presencia de material eosinófilo amorfo en el sector más profundo. En las muestras de mucosa rectal se presentó abundante material eosinófilo amorfo que disecaba las fibras de la muscularis mucosae y se extendía a la lámina propia. Las células intersticiales mostraban aspecto histiocitario. Con la técnica de tinción Rojo Congo el depósito descripto fue congófilo, pero no mostró dicroísmo verde con la luz polarizada.
Figura 2. Depósito de amiloide en mucosa (Hematoxilina y eosina 10X)
Ante el planteo de colitis isquémica en contexto de AAL se inició tratamiento con mesalazina. Dos meses después se realizó VCC de control. Desde el sector transverso medio hasta el ciego se observó una afectación circunferencial y continua, dada por pérdida del patrón vascular, edema, eritema, erosiones y úlceras superficiales cubiertas por fibrina, con friabilidad. La mucosa de colon descendente y sigmoides presentó un patrón vascular preservado, a excepción de escasas áreas con parches eritematosos. En la mucosa del recto no se observaron lesiones. Del informe de anatomía patológica se destacó, en los sectores de mayor afectación, la presencia de áreas erosivas en el epitelio superficial y leve criptitis, sin abscesos crípticos. La lámina propia se encontró ocupada y distendida por abundantes depósitos de material eosinófilo amorfo, que también se encontró en la submucosa. A ese nivel presentó exudado inflamatorio disperso, linfoplasmocitario y polimorfonucleares junto con eosinófilos. En la mucosa rectal se realizó estudio con Rojo Congo. El material descripto en la lámina propia fue congófilo, identificándose focos con dicroísmo verde con la luz polarizada.
Presentó buena evolución desde el punto de vista digestivo, no reiteró sangrados ni dolor abdominal por lo que se decidió continuar con el tratamiento sistémico de la enfermedad y realizar controles clínicos, endoscópicos e histológicos.
Discusión
Se discute el caso de un paciente con diagnóstico reciente de AAL y debut de colitis. Dado que el diagnóstico de afectación intestinal de la enfermedad fue realizado en diferido, la diferenciación con colitis isquémica fue uno de los principales problemas diagnósticos al inicio.
La AAL es la forma más frecuente de la enfermedad, con una incidencia estimada de 10 a 12 casos por millón.1 Al igual que en el paciente presentado, la edad media al diagnóstico de 60 años y es más frecuente en varones.1, 4 Por su parte, la CI predomina en mujeres, es más frecuente en mayores de 65 años y aumenta su incidencia con la edad, que se considera uno de los principales factores de riesgo. Adicionalmente el paciente presentó insuficiencia cardíaca por infiltración de amiloide, sin otros factores de riesgo descriptos para la enfermedad.10, 11
El tipo de amiloidosis que presentó se asocia a discrasia clonal sanguínea, generalmente sutil, de células plasmáticas o linfoides B.3 Hasta el 15% de los pacientes presentan mieloma múltiple asociado, por lo que es importante investigarlo en todos los casos diagnosticados.5 En el caso expuesto, el paciente fue valorado exhaustivamente por hematología y no presentó elementos definitorios para MM a pesar de tener una discrasia sanguínea subyacente.
El paciente presentó en primera instancia compromiso cardíaco y esto coincide con lo reportado internacionalmente: el corazón y los riñones suelen ser los órganos más afectados, seguidos del sistema nervioso autónomo, hígado y tracto gastrointestinal.1 El compromiso cardíaco ocurre hasta en la mitad de todos los casos.3 Es el principal factor determinante de la supervivencia y confiere mal pronóstico, con una mediana de sobrevida de 4 a 6 meses luego de la aparición de la insuficiencia cardíaca congestiva.3, 14 Al igual que en el paciente presentado, se manifiesta como una miocardiopatía restrictiva, con FEVI conservada.3 Se ha descripto que cuando aparecen síntomas el daño tisular suele ser irreversible.14
Esta forma de amiloidosis es la que afecta en mayor medida el tracto digestivo, frecuentemente en el contexto de enfermedad sistémica.6, 7 Sin embargo, no está establecida la valoración intestinal de forma sistematizada ante la ausencia de síntomas. Esto determina que en pacientes con afectación gastrointestinal, pero asintomáticos en lo digestivo, se subestime un compromiso que tiene importancia pronóstica. En un estudio retrospectivo llevado a cabo por Lim y cols., que incluyó 24 pacientes con amiloidosis gastrointestinal, se observó que presentaron mayor cantidad de órganos involucrados y enfermedad más avanzada que aquellos sin afectación digestiva.15
El paciente presentó, en el contexto del debut de la amiloidosis cardíaca y el inicio de la anticoagulación, una colitis que se manifestó como dolor abdominal y HDB. El problema diagnóstico radicó en diferenciar si se trataba de colitis por infiltración intestinal de amiloide, colitis isquémica como mecanismo fisiopatológico de la amiloidosis o colitis isquémica vinculada a otras causas.
La hemorragia digestiva en contexto de amiloidosis puede ocurrir por infiltración difusa de amiloide en la pared intestinal y la formación posterior de erosiones o úlceras.2 En estos pacientes, como factor de riesgo adicional para el sangrado se describe una mayor prevalencia de alteraciones de la coagulación, como la deficiencia del factor X. Esta deficiencia no constituye una condición necesaria y no se investigó en este paciente.3 Dado que no se logró comprobar amiloide en las biopsias intestinales iniciales, la colitis secundaria a amiloidosis no fue planteada en primera instancia en este caso como mecanismo de daño predominante.
No existen criterios diagnósticos establecidos para el diagnóstico de colitis isquémica, sino que es una construcción que incluye la exclusión de otras causas de colitis.11 En el caso expuesto se descartaron causas infecciosas subyacentes, enfermedad inflamatoria intestinal y malignidad.
Dado que se conocía que el paciente era portador de amiloidosis con afectación cardíaca y de glándulas salivales, una hipótesis fue que presentara CI secundaria a compromiso intestinal de su enfermedad sistémica. Está descripto que la amiloidosis es una causa de isquemia oclusiva por enfermedad de pequeños vasos, vinculada a la infiltración de los vasos sanguíneos submucosos con fragilidad vascular secundaria.2-3, 8 Este diagnóstico inicialmente también fue desestimado al no comprobarse la presencia de amiloide en la VCC índice.
Como última hipótesis se planteó que la isquemia estuviera vinculada a su enfermedad cardiovascular per se, aunque no existieron episodios de hipotensión y el inicio de la anticoagulación aleja el planteo de una causa tromboembólica de la isquemia.
El paciente presentó dolor abdominal y HDB luego del inicio de la anticoagulación. El dolor abdominal no es frecuente en pacientes con amiloidosis colónica. Los síntomas más habituales se vinculan a desórdenes de la motilidad (constipación o diarrea).2 La HDB es un síntoma que ocurre hasta en el 36% de los afectados. Con frecuencia es autolimitada pero recurre si no se realiza el tratamiento de la enfermedad de base.1
Los síntomas del paciente fueron más compatibles con los descriptos para la CI, que típicamente se manifiesta con dolor abdominal de tipo cólico e inicio agudo, que aumenta luego de la ingesta y se acompaña de urgencia defecatoria.8, 10 El dolor se localiza sobre el sector de colon afectado y es seguido de HDB autolimitada, sin repercusión hemodinámica, en las 12 a 24 horas posteriores.8, 10, 12
Pese a que el paciente presentó los síntomas descriptos, los mismos no se manifestaron en la secuencia cronológica característica dado que comenzaron de forma conjunta; tampoco se presentó la urgencia defecatoria.
Los estudios por imágenes son de ayuda diagnóstica en ambas patologías y los hallazgos descriptos en la tomografía de abdomen son inespecíficos. El paciente presentó engrosamiento parietal difuso de aspecto edematoso a nivel del colon transverso y el ángulo esplénico, compatible con las dos entidades. Presentó también alteración de la densidad grasa descripta en la literatura para CI. No presentó otros hallazgos descriptos en la amiloidosis intestinal, como son el estrechamiento luminal y la pérdida de haustras.1 Tampoco se observaron imágenes en huellas dactilares que, pese a estar descriptas en la CI, son infrecuentes.9
La VCC es otra herramienta diagnóstica de gran relevancia para ambas patologías.3, 8 Los hallazgos endoscópicos en el paciente fueron inespecíficos y las características encontradas eran compatibles con ambas entidades. Los hallazgos sugestivos de amiloidosis fueron la pérdida del patrón vascular, úlceras superficiales y profundas, eritema y edema de la mucosa. Se destaca que no se evidenció el aspecto típico de protuberancias polipoides, como se describe frecuentemente en la AAL.16
La VCC se considera el patrón oro para el diagnóstico de CI.10 Los hallazgos endoscópicos, así como los signos histológicos patognomónicos típicos, se observan en general en las primeras 48 horas.17 En el paciente presentado, la VCC se realizó siete días después del inicio de los síntomas, lo que pudo haber disminuido su rendimiento diagnóstico. Pese a esto, los hallazgos de una mucosa edematosa con fragilidad y eritema segmentario alimentaban la sospecha. No se observaron otros elementos descriptos como petequias, pseudomembranas y el signo endoscópico de «banda única», muy específico y caracterizado por una úlcera lineal solitaria que se extiende longitudinalmente a lo largo de la pared antimesentérica.8
Respecto a la distribución topográfica de las lesiones, la afectación sectorial y parcheada del colon se observa en ambas entidades. En la amiloidosis predomina en colon descendente y sigmoides, sectores en los que el paciente presentó mayor preservación.5 En lo que respecta al planteo de CI, se destaca que en la VCC inicial se observó mayor afectación a nivel de ángulo esplénico, lo que fue concordante con la topografía del dolor abdominal. Teniendo en cuenta que en esta enfermedad la distribución topográfica de las lesiones se relaciona con los vasos sanguíneos ocluidos, la presencia de una úlcera aislada en el sector ascendente proximal no concuerda. Tampoco fue concordante el cambio topográfico de las lesiones en la VCC de control, donde la mayor afectación se observó en colon derecho.8
El estudio histológico de los tejidos implicados es un pilar fundamental para el diagnóstico de ambas patologías. El amiloide se observa en forma de depósitos de material amorfo y eosinófilo en las tinciones con H&E con el típico dicroísmo verde manzana en la luz polarizada bajo Rojo Congo.2, 6 Las biopsias con mayor rendimiento diagnóstico son de origen renal, hepático, de grasa subcutánea, médula ósea y del tracto gastrointestinal.7 Un estudio retrospectivo llevado a cabo por Freudenthaler y cols. incluyó 542 pacientes con amiloidosis gastrointestinal y observó una frecuencia de depósitos de amiloide en las biopsias de 38% en colon, 23% en estómago, 17% en recto, 16% en duodeno y 6% en yeyuno e íleon.18 El sitio de depósito de amiloide varía según el tipo de amiloidosis. En la AAL se deposita principalmente en las capas muscular de la mucosa, submucosa y muscular propia en forma de masa.1, 16 En el paciente discutido se destacó la presencia de depósitos de material eosinófilo amorfo tanto en la mucosa (lámina propia y muscular de la mucosa) como en la submucosa. No se presentó dicroísmo verde en las primeras muestras pero si en las segundas. En este sentido, es importante tener en cuenta que la sensibilidad de las biopsias de recto para el diagnóstico de amiloidosis es 75 a 94%.3 Las causas de falsos negativos con la tinción de Rojo Congo incluyen una cantidad escasa de tejido examinado, la tinción o el uso del polarizador inadecuados, así como la baja intensidad de la luz. Por esto, si la sospecha de la enfermedad es alta se considera pertinente tomar nuevas muestras de tejido para ser examinadas.19 En el caso del paciente presentado, la tinción inicial negativa para Rojo Congo determinó el retraso diagnóstico y amplió la búsqueda de diagnósticos diferenciales como CI vinculada a otras causas. Cabe destacar que ninguno de los hallazgos era sugestivo de enfermedad inflamatoria intestinal por lo que no se avanzó en este sentido.
Las muestras histopatológicas obtenidas por VCC rara vez son diagnósticas de CI. Las características patognomónicas se observan con poca frecuencia.18 El paciente discutido presentó distorsión arquitectural de las criptas, así como elementos sugestivos de la fase reparadora de la lesión isquémica, como son el tejido de granulación con exudado linfoplasmocitario, PMN e histiocitos.8, 20
En lo que respecta al tratamiento, previo a la confirmación histológica de amiloidosis intestinal se inició la administración de mesalazina. Si bien no es un tratamiento descripto en la literatura para ninguna de las entidades, existen reportes de casos de colitis crónica con buena respuesta a la mesalazina, vinculada a la inhibición de radicales de oxígeno y de la síntesis de leucotrieno B4.21 En el caso del paciente, pese a que no reiteró los síntomas, tampoco se objetivó mejoría en la VCC de control. Dado que mediante el estudio histológico en diferido se realizó diagnóstico de amiloidosis colónica, se decidió continuar el tratamiento de la misma, valorando en la evolución la respuesta clínica, endoscópica e histológica. El objetivo en la AAL es suprimir la síntesis de cadenas livianas de inmunoglobinas mediante el tratamiento de la discrasia sanguínea subyacente con quimioterapia.6 Como en el caso de este paciente, se administran regímenes combinados con fármacos inhibidores del proteosoma: ciclofosfamida y dexametasona. Las tasas de respuesta completa con este esquema son mayores al 60%.7 Pese a esto la AAL se considera una enfermedad con mal pronóstico, donde únicamente su identificación temprana y el tratamiento agresivo pueden conducir a la remisión completa y la respuesta de los órganos involucrados.22
Conclusión
Los diagnósticos de amiloidosis colónica y colitis isquémica presentan características clínicas y endoscópicas similares que hacen difícil su diferenciación. Es importante tener en cuenta que ambos se pueden intrincar dado que la colitis isquémica puede ser secundaria a la infiltración de amiloide en los vasos sanguíneos de la pared intestinal o secundaria a la afectación cardíaca de la enfermedad.
Se presentó el caso de un paciente con amiloidosis AL cardiaca y colónica. La alta sospecha hizo que se llegara al diagnóstico de esta última en un segundo intento endoscópico. El tratamiento para esta variante se basa en la quimioterapia; el pronóstico es malo. A pesar de la alta sensibilidad de las biopsias de colon para el diagnóstico, es importante tener en cuenta la posibilidad de falsos negativos, por lo que entender la naturaleza de la enfermedad y priorizar el contexto es clave para llegar al diagnóstico.
Agradecimientos. Los autores agradecen al Departamento de anatomía patológica del Hospital de Clínicas por la imagen brindada.
Consentimiento para la publicación. Se obtuvo el consentimiento informado por escrito del paciente o su padre, tutor o familiar, para la publicación de los datos y/o imágenes clínicas en beneficio de la ciencia. La copia del formulario de consentimiento se encuentra disponible para los editores de esta revista.
Propiedad intelectual. Los autores declaran que los datos, las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Benitez F, Pontet Y. Colitis isquémica y amiloidosis: un desafío diagnóstico. Acta Gastroenterol Latinoam. 2022;52(3):395-401. https://doi.org/10.52787/agl.v52i3.231
Referencias
- Talar-Wojnarowska R, Jamiroziak K. Intestinal amyloidosis: Clinical manifestations and diagnostic challenge. Adv. Clin. Exp. Med. 2021;30(5):563-70.
- Ellen C. Ebert. Manifestaciones digestivas y hepáticas de las enfermedades sistémicas. En: M. Feldman, S. Friedman, J. Brandt. Sleisenger y Fordtran. Enfermedades digestivas y hepáticas. Fisiopatología, diagnóstico y tratamiento. 10a ed. Barcelona: Elsevier; 2018.p.579-616.
- Sattianayagam PT, Hawkins PN, Guillmore JD. Systemic amyloidosis and the gastrointestinal tract, Nat. Rev. Gastroenterol. Hepatol. 2009;6:608-17.
- Lado Lado FL, Ferreiro Regueiro MJ, Cabana González B, et al. Amiloidosis. Med. Integral. 2000;36(4):137-41.
- Maza I, Vlodavsky E, Eliakim RA. Rectal bleeding as a presenting symptom of AL amyloidosis and multiple myeloma. World J Gastrointest Endosc. 2010;2(1):44-6.
- Ebert EC, Nagar M. Gastrointestinal manifestations of amyloidosis, Am J Gastroenterol. 2008;103:776-87.
- Syed U, Ching Companioni R, Alkhawam H, Walfish A. Amyloidosis of the gastrointestinal tract and the liver: clinical context, diagnosis and management. Eur. J. 2016;28:1109-21.
- Doulberis M, Panagopoulos P, Scherz S, Dellaporta E, Kouklakis G. Update on ischemic colitis: from etiopathology to treatment including patients of intensive care unit. Scand. J. Gastroenterol. 2016;51(8):893-902.
- Tadros M, Majumder S, Birk WJ. A review of ischemic colitis: is our clinical recognition and management adequate? Expert. Rev. Gastroenterol. Hepatol. 2013;7(7):605-13.
- Xu Y, Xiong L, Li Y, Jiang X, Xiong Z. Diagnostic methods and drug therapies in patients with ischemic colitis. Int. J. Colorectal Dis. 2020;36:47-56.
- Nikolic AL, Keck JO. Ischaemic colitis: uncertainty in diagnosis, pathophysiology and management. ANZ J. Surg. 2017;88(4):278-83.
- Theodoropoulou A, Koutroubakis IE. Ischemic colitis: clinical practice in diagnosis and treatment. World J. Gastroenterol. 2008;14(48):7302-8.
- García J, Rodríguez C. Amiloidosis cardiaca: estudio de caso y revisión bibliográfica. Rev. costarric. salud pública. 2019;28 (1):74-82.
- Palladini G, Milani P, Merlini G. Management of AL amyloidosis in 2020. ASH. 2020;136(23):2620-27.
- Lim Y, Lee H, Jung S, Gwag HB, Kim DH, Kim SJ, et al. Clinical features and outcomes of systemic amyloidosis with gastrointestinal involvement: a single-center experience. Korean J Intern Med. 2015;30(4):496-505.
- Iida T, Yamano H, Nakase H. Systemic amyloidosis with gastrointestinal involvement: Diagnosis from endoscopic and histological views. J. Gastroenterol. Hepatol. 2017;33:583-90.
- Montoro M, Brandt L.J, Santolaria S, Gomollon F, Sánchez Puértolas B, Vera J, et al. Clinical patterns and outcomes of ischaemic colitis: Results of the Working Group for the Study of Ischaemic Colitis in Spain (CIE study). Scand. 2011;46(2):236-46.
- Freudenthaler S, Hegenbart U, Schönland S, Behrens HM, Krüger S, Röcken C. Amyloid in biopsies of the gastrointestinal tract-a retrospective observational study on 542 patients. Virchows Arch. 2016;468:569-77.
- Yakupova E, Bobyleva L, Vikhlyantsev I, Bobylev AG. Congo Red and amyloids: history and relationship. Biosci Rep. 2019;39(1):1-4.
- Mitsudo S, Brandt, L. J. Pathology of Intestinal Ischemia. Surg. Clin. North Am. 1992;72(1):43-63.
- Sano S, Nishimori I, Miyao M, Kawamura K, Fukui Y, Taniki T, et al. Successful Use of Mesalamine in the Treatment of Chronic Segmental Lesion in a Case of Ischemic Colitis. J. Gastroenterol. Hepatol. 2003;18(7):882-3.
- Rysava R. AL amyloidosis: advances in diagnostics and treatment. Nephrol Dial Transplant. 2019;34(9):1460-6.
Correspondencia: Florencia Benitez
Correo electrónico: florencia.benitez.sturla@gmail.com
Acta Gastroenterol Latinoam 2022;52(3):395-401
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE