María Marta Piskorz,1 Juan I Olmos,2 Jorge A Olmos3
1Médica de planta del sector de Neurogastroenterología del Hospital de Clínicas “José de San Martín”, Universidad de Buenos Aires.
2Servicio de Gastroenterología del Hospital de Clínicas «José de San Martín», Universidad de Buenos Aires.
3Jefe del sector de Neurogastroenterología del Hospital de Clínicas “José de San Martín”, Universidad de Buenos Aires.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2020;50:57-68
Resumen
La acalasia es un trastorno primario del esófago, de etiología desconocida, caracterizado por la degeneración del plexo mientérico, lo cual resulta en una alteración de la relajación de la unión gastroesofágica, junto con una pérdida de la peristalsis del cuerpo del esófago. El advenimiento de la manometría esofágica de alta resolución tuvo un fuerte impacto en la mejoría del rédito diagnóstico en la acalasia. La manometría esofágica de alta resolución ha permitido además definir subtipos con diferentes respuestas al tratamiento. La mayoría de los pacientes serán tratados bajo las siguientes modalidades: inyección de toxina botulínica, dilatación neumática, miotomía de Heller y POEM. En esta revisión narrativa se discuten en profundidad las evidencias a favor y en contra de cada una de las modalidades terapéuticas.
Palabras claves. Acalasia, inyección de toxina botulínica, dilatación neumática, miotomía de Heller, POEM.
Achalasia: Current Evidence Based Recommendations
Summary
Achalasia is a primary disorder of the esophagus of unknown etiology, characterized by degeneration of the myenteric plexus, that results in impaired relaxation of the gastroesophageal junction, together with a loss of peristalsis of the body of the esophagus. The advent of high resolution esophageal manometry had a strong impact on the improvement of diagnostic yield in achalasia. High-resolution esophageal manometry has also made it possible to define subtypes with different responses to treatment. Most patients will be treated with botulinum toxin injection, pneumatic dilation, Heller’s myotomy, and POEM. In this narrative review we will deep discuss the evidence for and against each therapeutic alternative.
Key words. Achalasia, botulinum toxin injection, pneumatic dilation, Heller myotomy, POEM.
Abreviaturas
UGE: Unión gastroesofágica.
HRM: Manometría esofágica de alta resolución.
EEI: Esfínter esofágico inferior.
BTX: Inyección de toxina botulínica.
POEM: Miotomía peroral endoscópica.
ERGE: Enfermedad por reflujo gastroesofágico.
IRP: Presión de relajación integrada.
Introducción
La acalasia es un trastorno primario del esófago, de etiología desconocida, caracterizado por la degeneración del plexo mientérico, lo cual resulta en una alteración de la relajación de la unión gastroesofágica (UGE), junto con una pérdida de la peristalsis del cuerpo del esófago.1
La acalasia ocurre tanto en hombres como en mujeres. Tradicionalmente se consideraba una enfermedad rara, con una incidencia reportada que variaba de 0,3 a 1,63 cada 100.000 personas por año.2 Sin embargo, la estimación de la incidencia se ha realizado a través de estudios retrospectivos de bases de datos hospitalarias, con diagnósticos basados en técnicas antiguas, como la manometría convencional o el esofagograma baritado.3 Los estudios más recientes realizados en bases de datos de laboratorios que incorporan a la manometría de alta resolución sugieren una incidencia más elevada de 2,92 cada 100.000 personas/año en Chicago2 y 2,3 a 2,8 cada 100.000 personas/año en Australia.4
Fisiopatología
La acalasia fue descrita por primera vez por Sir Thomas Willis, en 1674, y su denominacion deriva del griego όχι χαλ´αρωση que significa “sin relajación”. El hallazgo central en la acalasia es la pérdida selectiva de neuronas inhibitorias en el esófago, lo que lleva a una contracción tónica.5 Esto provoca una contractura del esfínter esofágico inferior (EEI), el cual no se relaja durante la deglución; por otro lado, se observa ausencia de peristalsis.5 Cuando está presente por un período de tiempo prolongado, la obstrucción distal continua del esófago provoca una dilatación progresiva.6, 7
El mecanismo exacto por el que existe una pérdida de neuronas inhibitorias del esófago en la acalasia ha sido objeto de muchos estudios. Las teorías iniciales hipotetizaron que esta pérdida de neuronas tendría que ver con una degeneración del plexo mientérico.8 Sin embargo, esta teoría fue cuestionada en la década del noventa’ cuando se demostró la infiltración inflamatoria en las biopsias de pacientes con estadios precoces de acalasia.9 Estudios posteriores mostraron un predominio de células T, lo que llevó a la teoría de que la pérdida de neuronas era el resultado directo de una activación de la respuesta inmune.10-12 Sobre la base de esto, se sugirió que podría existir una etiología infecciosa o autoinmune. La teoría actual es que existiría una infección viral previa que actuaría como gatillante de la respuesta inmunomediada en pacientes genéticamente predispuestos, que resultaría en la pérdida selectiva de neuronas inhibitorias, con la consecuente acalasia.7
Diagnóstico
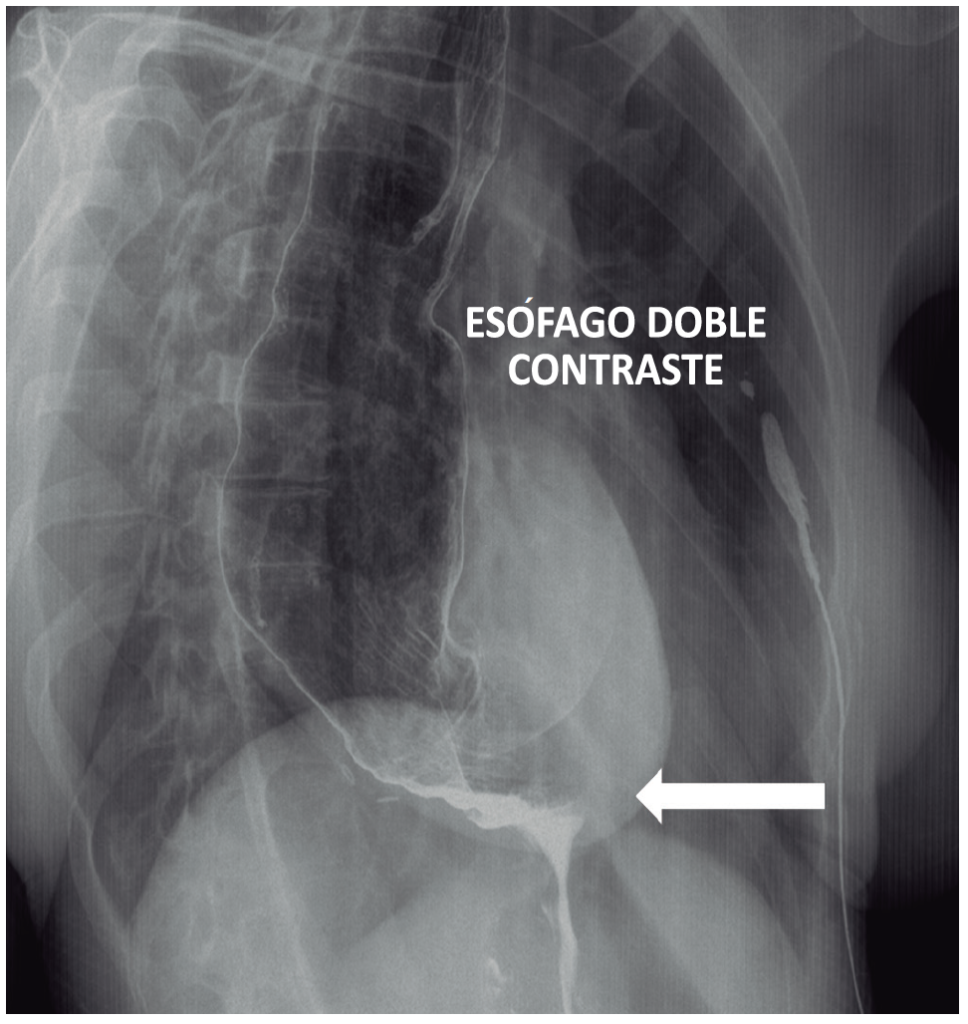
El 90% de los pacientes presentan disfagia esofágica para sólidos y líquidos como síntoma principal, sin alteración de la fase orofaríngea. Además, el 75% presenta regurgitación, el 60% pérdida de peso, el 50% dolor de pecho y el 40% pirosis.13 En pacientes con síntomas sugestivos de acalasia, la endoscopía digestiva alta es mandatoria, con el objeto de excluir pseudoacalasia u otras formas de obstrucción mecánica de la unión gastroesofágica.1 Aunque en la endoscopía puede observarse dilatación del esófago, retención de comida y secreciones y una unión gastroesofágica que se traspasa con resalto, estos hallazgos no son diagnósticos de acalasia. Además, la endoscopía puede ser normal en estadios precoces de la enfermedad. El esófagograma baritado puede ser de mucha utilidad, especialmente cuando se observa la imagen típica en “pico de pájaro” o “canalito” a nivel de la unión gastroesofágica (Figura 1 y Video), pero, al igual que la endoscopía, puede ser absolutamente normal si el esófago no está dilatado.3 Una modificación del esofagograma baritado denominado tránsito esofágico minutado agrega valor al diagnóstico, ya que su resultado está asociado con el pronóstico luego del tratamiento y además es capaz de predecir la recurrencia de los síntomas (Figura 2).14
Figura 1. Tránsito esofágico. Se observa la imagen típica de “pico de pajaro” o “ canalito” a nivel de la unión esofagogástrica (gentileza del Dr. Mariano Loureiro del Centro Rossi)
Video. Tránsito esofágico. Se observa de forma dinámica el paso del contraste baritado a través del esófago y el vaciamiento del mismo
Visualizar video en: https://youtu.be/WWRGO9YzsR0
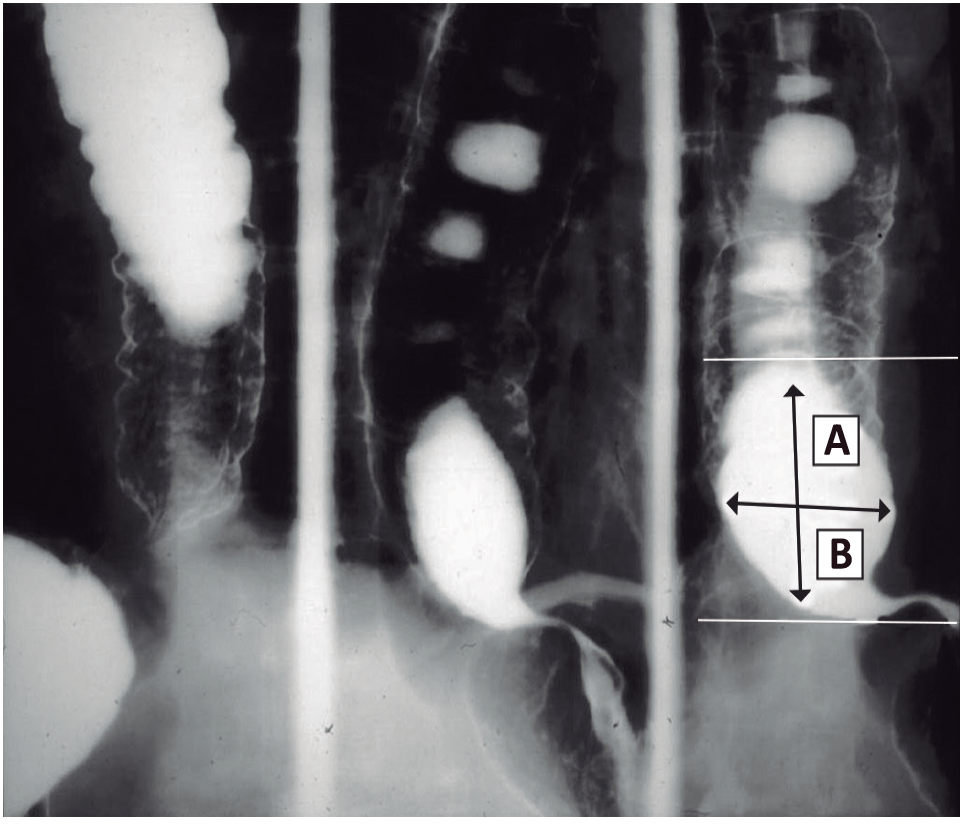
Figura 2. Tránsito esofágico minutado. El paciente ingiere 200cc de bario y se mide la altura de la columna (A) al minuto, a los dos minutos y a los cinco minutos, y el ancho (B).(gentileza del Dr. Mariano Loureiro del Centro Rossi)
El advenimiento de la manometría esofágica de alta resolución (HRM) tuvo un fuerte impacto en la mejoría del rédito diagnóstico en la acalasia. En comparación con la manometría convencional (sensibilidad 52%), la presión de relajación integrada (IRP) tiene una sensibilidad del 98% y una especificidad del 96% para diagnosticar acalasia.15
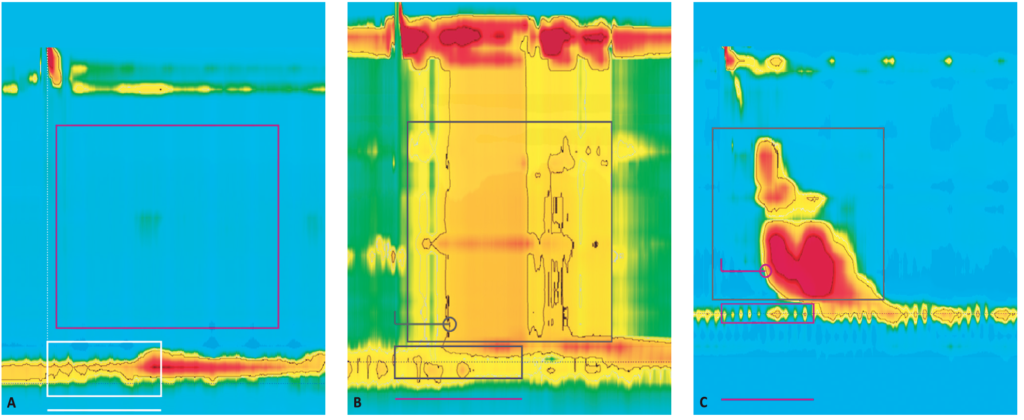
Los criterios diagnósticos de acalasia en la manometría esofágica de alta resolución son la relajación incompleta de la unión gastroesofágica y la ausencia de peristalsis organizada. Han sido definidos tres subtipos de acalasia en base a los hallazgos de la manometría esofágica de alta resolución: tipo I o clásica con baja presión intraesofágica; tipo II con panpresurización esofágica, y tipo III con contracciones espásticas de gran amplitud (Figura 3).16 Existen muchos estudios que han demostrado que el resultado del tratamiento depende del subtipo de acalasia, y esta información sirve para guiar la elección del tratamiento.17-19
Figura 3. Subtipos de acalasia en manometría esofágica de altaresolución. A) Tipo I; B) Tipo II; C) Tipo III. (Gentileza del Sector de Neurogastroenterología del Hospital de Clínicas «José de San Martín»)
El EndoFLIP (Crospon, Galway, Irlanda) es una nueva tecnología que permite evaluar las propiedades mecánicas del esófago y de la unión gastroesofágica, utilizando mediciones de planimetría por impedanciometría en un área luminal transversal, durante los cambios de presión producidos por una distensión volumétrica controlada.20 Los estudios en los que se utilizó el EndoFLIP mostraron que la distensibilidad de la unión gastroesofágica está reducida en los pacientes con acalasia,21 y que el fracaso terapéutico en el control de los síntomas luego del tratamiento está asociado con una baja distensibilidad persistente.22 Además, en un estudio reciente se observó que la acalasia en el subgrupo de pacientes en los que se observa una relajación normal en la manometría esofágica de alta resolución podría ser diagnosticada a través del EndoFLIP.23
Además de los tres subtipos de acalasia, la Clasificación de Chicago v3.0 reconoce a la obstrucción del flujo de salida de la UGE como otra entidad (Figura 4). En esta entidad, el IRP es mayor que el límite superior normal, pero hay una peristalsis fragmentada, o incluso normal, de tal manera que no se cumplen los criterios diagnósticos de acalasia.24 Desde su descripción inicial, se informó que era un grupo heterogéneo.25 Las etiologías potenciales incluyen acalasia precoz o incompleta, rigidez de la pared esofágica por una enfermedad infiltrativa o cáncer, esofagitis eosinofílica, obstrucción vascular extrínseca, hernia de hiato por deslizamiento o paraesofágica, obesidad abdominal, efecto de opiáceo, o simplemente una medición falsa positiva.26 Por lo tanto esta entidad requiere una evaluaciónclínica adicional (por ejemplo, ecoendoscopia, FLIP, tomografía computarizada, etc.) y un enfoque cauteloso en el tratamiento.27
Figura 4. Obstrucción de la unión gastroesofágica. Se observa peristalsis conservada y falta de relajación de la unión gastroesofágica. (Gentileza del Sector de Neurogastroenterología del Hospital de Clínicas «José de San Martín»)
Tratamiento de la acalasia
Aunque un 5% de los pacientes con acalasia pueden llegar a necesitar una esofagectomía en los estadios finales de la enfermedad,13 la mayoría serán tratados bajo las siguientes modalidades: inyección de toxina botulínica, dilatación neumática, miotomía de Heller y POEM. Es importante destacar que no hay uniformidad de criterios en los diferentes estudios en cuanto a la definición de éxito terapéutico, y que no todos los estudios utilizaron scores estandarizados para determinarlo. Además, muchos estudios no muestran mediciones objetivas del éxito terapéutico, como cambios en la presión del esfínter esofágico inferior (EEI) o en el vaciamiento en el tránsito esofágico minutado, y en el caso de que las muestren, la definición de éxito puede variar también. Finalmente, también varía entre los estudios la definición de reflujo gastroesofágico (ERGE), que es uno de los eventos adversos más importantes asociados al tratamiento de la acalasia. En este caso, pueden haberse incluido síntomas, presencia de esofagitis erosiva en la endoscopía o monitoreo de pH alterado.3 El score de Eckardt permite la valoración estandarizada de la respuesta clínica al tratamiento.28 Este score se basa en la suma de cuatro síntomas (disfagia, regurgitación, dolor de pecho y pérdida de peso), que se gradúan de acuerdo a la severidad. El éxito terapéutico sobre la base de este score se define con un puntaje de 3.28 Aunque este score puede tener algunas limitaciones, es el más ampliamente utilizado para valorar los resultados clínicos en la acalasia y para proveer una medición estandarizada del éxito terapéutico.3
Inyección de toxina botulínica
La inyección endoscópica de toxina botulínica (BTX) reduce la presión del EEI a través de la inhibición de la acetilcolinesterasa de las terminaciones nerviosas.29 Sin embargo, su respuesta terapéutica no perdura en el tiempo y las subsecuentes sesiones producen un efecto más débil y de menor duración.30 A pesar de su extenso uso, la inyección de BTX no está estandarizada en términos de: formulación de la droga, dosis, frecuencia de inyección y técnica (sitio de inyección). En la práctica, usualmente se inyectan 100U. Se considera un procedimiento seguro en líneas generales. Los eventos adversos serios, como la mediastinitis o las reacciones alérgicas, son extremadamente raros.1 La principal limitación es la duración del efecto de la toxina botulínica, que es de entre cuatro y seis meses, por lo que requiere retratamiento periódico. En la actualidad es un tratamiento que está reservado para los gerontes o los pacientes de muy alto riesgo para otras intervenciones.
Un metaanálisis que incluyó nueve estudios reportó respuesta sintomática de 79% al mes, 70% a los 3 meses, 53% a los 6 meses y 41% al año.31
Una revisión sistemática y metaanálisis de 22 estudios no controlados reportó un éxito clínico definido por un score de Eckardt de 3 en 730 pacientes, del 77% (IC 95% 72-81%; I2 = 35%; p = 0,04), con un tiempo de seguimiento de 1 a 6 meses.3 Por otro lado se observó una disminución estadísticamente significativa en la presión promedio del EEI de 38,23 mmHg (rango 34-40-42,06) luego de la inyección de toxina botulínica (p < 0,01).3
No fueron descritos eventos adversos serios. La ERGE luego del tratamiento no fue documentada, y el dolor de pecho fue reportado en un 11% de los pacientes (IC95% 7-15%).3
El antecedente de que un paciente haya sido sometido a inyección de BTX es importante a la hora de planificar POEM, ya que puede prolongar el procedimiento debido a la presencia de fibrosis secundaria a la inyección, aunque no se asoció con aumento de complicaciones o disminución en la efectividad de POEM.32
Dilatación neumática
La dilatación neumática consiste en lograr la disrupción de las fibras musculares del EEI a través de la dilatación intraluminal con un balón presurizado, y es comúnmente realizado bajo guía fluoroscópica. Existen tres tamaños de balón disponibles para la dilatación neumática (30, 35 y 40 mm de diámetro). En el abordaje convencional se comienza con un balón de 30 mm, progresando a balones de mayor diámetro en el caso de no alcanzar la respuesta esperada.
Se realizan dilataciones subsecuentes con intervalos de dos a cuatro semanas, sobre la base de los síntomas del paciente, correlacionando los mismos con mediciones de presión del EEI o con la mejoría en el vaciamiento esofágico.
La tasa de éxito de la dilatación neumática presenta una enorme variación en la literatura, principalmente debido a la gran cantidad de protocolos utilizados, los diseños de los estudios, la duración del seguimiento y el diámetro del balón utilizado.33
Los pacientes que tuvieron seguimiento de 37 meses presentaron mejoría sintomática con una relación lineal al aumento del diámetro del balón utilizado, con los siguientes resultados: 74% (30 mm), 86% (35 mm) y 90% (40 mm).34
En centros con experiencia se realizan redilataciones “a demanda” como tratamiento efectivo y de rutina.33
En una revisión sistemática y metaanálisis realizado recientemente, sobre 52 estudios no controlados que reportaron resultados en 4166 pacientes con acalasia tratados con dilatación neumática, se observó un éxito clínico (definido por un score de Eckardt de 3) en el 83% (IC 95% 79-85%; I2 = 82%; p < 0,01), en un tiempo de seguimiento de tres a seis meses.3 Se observó además una disminución estadísticamente significativa en la presión promedio del EEI de 34,47 mmHg (rango 32,82-36,13) antes del procedimiento a 20,80 mmHg (rango 12,11-29,49) luego de la dilatación neumática (p < 0,01). Los eventos adversos más frecuentemente reportados luego de la dilatación neumática fueron la perforación esofágica (2,8%; IC 95% 2,3-3,5) y sangrado que requirió algún tipo de intervención (2%; IC 95% 1-4). Luego de un tiempo de seguimiento promedio de seis meses, la tasa de ERGE sintomático fue del 9% (IC 95% 5-16).3
Generalmente, balones de dilatación de mayor diámetro mejoran la eficacia clínica y la función esofágica, pero están asociados a una mayor tasa de perforación.35
La complicación más grave es la perforación esofágica con una tasa de 2% (0-16%) en manos experimentadas, de las cuales el 50% requiere resolución quirúrgica. Generalmente se producen en la primera dilatación, siendo la dificultad de mantener el balón en posición el principal factor de riesgo. Existen otros predictores de perforación, como realizar el tratamiento en población geronte y cuando la primera dilatación se realiza con un balón mayor a 30 mm.33
Existen trabajos que demostraron que las mujeres con acalasia tipo II presentaron las mejores respuestas terapéuticas, mientras que hombres jóvenes, pacientes con acalasia espástica o con megaesófago tuvieron las peores respuestas.36
Están disponibles actualmente técnicas novedosas como el EsoFLIP®, que permite un monitoreo dinámico con medición de diámetro, presión intrabalón y área transversal de la luz del esófago mientras se realiza la dilatación hidráulica. Se publicó recientemente un estudio de factibilidad con medición de resultados a corto plazo luego de tratamiento único con EsoFLIP. Se estudiaron 28 pacientes con acalasia no tratada y los resultados mostraron disminución significativa de score de Eckardt (7 basal a 2 postratamiento; p > 0,001) como así también una reducción significativa de la altura de la columna de bario luego de cinco minutos (4,5 a 1,7 cm; p = 0,0087). No se reportaron perforaciones ni sangrado significativo.37 Se trata de una técnica nueva y prometedora, ya que en teoría permitiría una dilatación individualizada a cada paciente, dependiendo de la elasticidad y diámetro que presente el esófago al momento de realizar el tratamiento, lo que podría disminuir el número de complicaciones. Hacen falta trabajos a largo plazo que demuestren su utilidad y comportamiento en el tiempo.
Miotomía de Heller laparoscópica
Con esta técnica se logra la disrupción de las fibras musculares del EEI a través de una incisión. En los últimos años, hubo una evolución de la cirugía abierta (toracoscopia y laparotomía) a la laparoscopia mínimamente invasiva con funduplicatura parcial.3 Un reciente metaanálisis que incluyó a 5834 pacientes de 53 estudios (5 aleatorizados y controlados y 48 de cohorte prospectiva o retrospectiva) analizó los resultados de la miotomía de Heller laparoscópica.38 Sin embargo, en este metaanálisis el éxito clínico no estuvo basado estrictamente en el score de Eckardt, sino en la mejoría de la disfagia, la cual fue tratada como una variable dicotómica. En promedio, se observó una mejoría de la disfagia del 87,7% (IC 95% 87-88) luego de la miotomía de Heller laparoscópica, con un tiempo de seguimiento promedio de 40 meses. Sobre la base de un modelo de regresión lineal, la probabilidad de mejoría de la disfagia fue del 91% a los 12 meses y 90% a los 24 meses. No se incluyeron en este metaanálisis mediciones objetivas, como hallazgos manométricos y esófagograma. Los síntomas de ERGE fueron reportados por un 17,5% de los pacientes (IC 95% 16-19) luego de la miotomía de Heller laparoscópica, mientras que se observaron signos endoscópicos de ERGE en el 11,5% (IC 95% 9-15) y por monitoreo de pH en el 11,1% (IC 95% 10-13).38
Miotomía peroral endoscópica (POEM)
Se trata de una técnica endoquirúrgica desarrollada por el médico japonés Dr. Inoue en el año 2009, que surge como un tratamiento alternativo a la miotomía de Heller laparoscópica.
En el año 2010 se publicó el primer estudio sobre POEM y se reportó que los 17 pacientes incluidos habían presentado éxito terapéutico, con una disminución significativa de la presión del EEI.39 A partir de ahí, se han publicado múltiples estudios prospectivos y retrospectivos evaluando la eficacia en el corto, mediano y largo término así como la seguridad del POEM.40-54
Un metaanálisis reportó los resultados clínicos del POEM.55 Se incluyeron 36 estudios que evaluaron a 2373 pacientes (52% mujeres, edad media 45 años). La indicación del POEM fue acalasia en el 98% de los pacientes. La longitud media de la miotomía fue de 12 ± 0,48 cm y el tiempo medio del procedimiento fue de 88 ± 5,4 minutos. El éxito clínico medido por un score de Eckardt de 3 fue alcanzado en un 98% (IC 95% 97-100%) de los pacientes luego del procedimiento. Hubo, sin embargo, mucha heterogeneidad en los resultados (I2 = 68%; p = 0,001).55 En promedio, el score de Eckardt disminuyó de 6,9 ± 0,15 preoperatorio a 0,77 ± 0,10, 1 ± 0,10 y 1 ± 0,8 a los 1, 6 y 12 meses luego del tratamiento, respectivamente.55 Además, hubo una disminución significativa en la presión promedio del EEI, la presión de relajación integrada (IRP) y el promedio de altura de la columna de bario en el tránsito esofágico minutado luego del procedimiento.55
El centro del Dr. Inoue ha realizado más de mil POEM demostrando > 90% con score de Eckardt < 3 a los dos meses de seguimiento y una disminución de la presión del EEI que persistió por tres años.56
Se ha demostrado que la realización de POEM tiene igual efectividad tanto en la población pediátrica, como en la población adulta y geronte.57, 58
Los eventos adversos perioperatorios reportados en el estudio incluyeron injuria mucosa (4,8%; IC 95% 2-8,5), perforación esofágica (0,2%; IC 95% 0-1,1), sangrado que requirió de alguna intervención (0,2%; IC 95% 0-1,4), enfisema subcutáneo (7,5%; IC 95% 3,5-12), neumotórax (1,2%; IC 95% 0,1-4,3), neumomediastino (1,1%; IC 95% 0,1-4,7%), neumoperitoneo (6,8%; IC 95% 1,9-14) y derrame pleural (1,2%; IC 95% 0-8,3). Sin embargo, los eventos adversos graves asociados al POEM fueron raros, y la mayoría intraprocedimiento, pudiéndose tratar endoscópicamente sin dejar secuelas.55 Luego de un seguimiento de ocho meses luego del procedimiento, se observó que las tasas de ERGE sintomático, esofagitis endoscópica y exposición ácida anormal en el monitoreo de pH fueron respectivamente de 8,5% (IC 95% 4,9-13), 13% (IC 95% 5-23) y 47% (IC 95% 21-74).55
Recientemente, se realizó un consenso internacional multicéntrico para definir el estado actual del ERGE post-POEM, evaluando los últimos diez años de experiencia con esta técnica. De acuerdo con los resultados del consenso, se confirmó que la mayoría de los pacientes con ERGE post-POEM responden a tratamiento con IBP y la necesidad de funduplicatura para ERGE refractario es rara. El IBP sigue siendo la base del tratamiento de ERGE post-POEM con un alto grado de eficacia.59
Teitelbaum y col. estudiaron los resultados del POEM a los cinco años del procedimiento.49 Fueron incluidos veintitrés pacientes, con una mediana de seguimiento de 65 meses. El score de Eckardt mejoró significativamente respecto al basal (1,7 vs. 6,4; p = 0,001). Un éxito terapéutico a largo plazo definido por un score de Eckardt de 3 fue alcanzado en 19 pacientes (83%), y ninguno necesitó retratamiento por síntomas persistentes o recurrentes.49
Se ha reportado recientemente un trabajo que evalúa el POEM a nivel mundial luego de una década de experiencia, el cual tuvo como objetivo comparar los resultados de los países occidentales con los latinoamericanos. Se incluyeron 840 pacientes, alcanzando un éxito clínico en el 95% de ellos y evidenciando una reducción significativa de score de Eckardt de 8,2 unidades (p < 0,0001) y de la presión del EEI de 24 mmHg (p < 0,0001). Del total de pacientes, 107 casos (13%) fueron realizados en Latinoamérica, no habiendo diferencia significativa en reducción del score de Eckardt entre los grupos occidentales y latinoamericanos. Por lo tanto, el POEM es un procedimiento efectivo y seguro para el tratamiento de la acalasia no solo en occidente, sino también en Latinoamérica.60
A pesar de que los resultados son muy alentadores, el POEM es un procedimiento endoscópico complejo que requiere habilidades endoscópicas avanzadas, conocimiento de la anatomía quirúrgica y experiencia en resección endoscópica submucosa, así como en resolución de complicaciones como sangrado y perforación.61 La inexperiencia del operador podría ser el factor principal en las complicaciones por POEM, en especial la injuria mucosa. El procedimiento requiere además una curva de aprendizaje. La extrapolación de los datos publicados sugiere un mínimo de veinte casos para alcanzar competencia, cuarenta para lograr eficiencia y sesenta para dominar la técnica.62, 63
Comparación entre los diferentes tratamientos para la acalasia
Dilatación neumática vs. toxina botulínica
Existen varios estudios aleatorizados que han comparado la dilatación neumática con la inyección de toxina botulínica intraesfinteriana.64-71 Además, existe una revisión sistemática y metaanálisis que compara la eficacia y seguridad de estas dos modalidades terapéuticas.72 Siete estudios aleatorizados, que incluyeron 178 pacientes, fueron incluidos. No se observó una diferencia estadísticamente significativa entre la dilatación neumática y la inyección de toxina botulínica en cuanto a éxito terapéutico a las cuatro semanas de la intervención (riesgo relativo (RR) de remisión, 1,11; IC 95% 0,97-1,27). Tampoco hubo una diferencia significativa en la presión promedio del EEI entre los dos grupos. Tres estudios midieron resultados a los seis meses, y cuatro estudios a los doce. A los seis meses el éxito clínico fue alcanzado en el 80,7% de los pacientes a los que se les realizó dilatación vs. 51,8% a los que se les inyectó toxina botulínica (RR 1,57; IC 95% 1,19-2,08; p = 0,0015). A los doce meses, el éxito clínico fue del 73,3% vs. 37,5% (RR 1,88; IC 95% 1,35-2,61; p = 0,0002). No se observaron eventos adversos en la rama toxina botulínica (de 151 procedimientos), mientras que se observaron tres perforaciones (en 188 dilataciones en la rama dilatación neumática). Estos datos demuestran que la dilatación neumática es más efectiva en el largo plazo (más de seis meses) comparado con la inyección de toxina botulínica en pacientes con acalasia.72
Dilatación neumática vs. miotomía de Heller laparoscópica
Existen tres metaanálisis recientes que compararon la eficacia clínica y la efectividad entre la dilatación neumática y la miotomía de Heller laparoscópica.73-75 Sobre la base de la herramienta para la evaluación de la calidad de los metaanálisis AMSTAR-2, el metaanálisis realizado por Cheng y col. resultó ser el de mejor calidad.3 Este metaanálisis incluyó siete estudios aleatorizados que compararon el resultado de la dilatación neumática con la miotomía de Heller laparoscópica en pacientes con acalasia, de los cuales cinco fueron incluidos en el análisis final (498 participantes). El éxito clínico fue significativamente mayor con la miotomía de Heller laparoscópica a los tres meses y un año (corto plazo), con RR de 1,16 (IC 95% 1,01-1,35; p = 0,04) y 1,14 (IC 95% 1,02-1,27; p = 0,02), respectivamente.73 Sin embargo, el éxito terapéutico no fue estadísticamente diferente entre los dos grupos a los dos y cinco años de seguimiento, con RR de 1,05 (IC 95% 0,91-1,22; p = 0,49) y 1,17 (IC 95% 0,84-1,64; p = 0,34), respectivamente. Por otro lado, la tasa de injuria mucosa inadvertida que requirió una ulterior intervención luego de la miotomía de Heller laparoscópica fue significativamente menor que las dilataciones que requirieron ulterior intervención por una perforación esofágica (RR 0,25; IC 95% 0,08-0,81; p = 0,02). Por último, la tasa de ERGE, la presión del EEI y los scores de calidad de vida no mostraron diferencias entre las dos intervenciones.
Estos datos sugieren que cualquiera de las dos modalidades terapéuticas pueden ser propuestas como tratamiento inicial en pacientes con acalasia.3
POEM vs. miotomía de Heller laparoscópica
No existen estudios aleatorizados que comparen los resultados del POEM vs. la miotomía de Heller laparoscópica. Existen algunos estudios retrospectivos que comparan estas dos modalidades terapéuticas, y hay dos metaanálisis recientes.38, 76 El metaanálisis de Awaiz fue calificado de alta calidad sobre la base del AMSTAR-2. Incluyó siete estudios con un total de 483 pacientes (miotomía de Heller 250, POEM 233). El tiempo del procedimiento fue mayor para la miotomía de Heller, pero la diferencia no fue estadísticamente significativa. No hubo diferencias en la tasa de eventos adversos en general (OR 1,25; IC 95% 0,56-2,77; p = 0,59), ERGE (OR 1,27; IC 95% 0,70-2,30; p = 0,44), la duración de la estadía hospitalaria (diferencia de medias 0,30; IC 95% 0,24-0,85; p = 0,28) y el dolor postoperatorio.76
Los datos disponibles en la actualidad sugieren que tanto la miotomía de Heller laparoscópica como el POEM son alternativas aceptables como tratamiento de primera línea en el manejo de pacientes con acalasia.
POEM vs. dilatación neumática
Un metaanálisis identificó cinco estudios que comparaban directamente estas modalidades.3 Luego de excluir un estudio que evaluaba solo pacientes pediátricos77 y otro que tenía un tiempo de seguimiento de solo dos meses,78 se realizó un metaanálisis sobre tres estudios que reportaban el score de Eckardt luego del tratamiento. Dos eran estudios de cohorte retrospectivos,79, 80 y uno un estudio aleatorizado y controlado.81 En total incluyeron 114 pacientes tratados con POEM y 92 con dilatación neumática. El éxito terapéutico definido como un Eckardt de 3, luego de doce meses del tratamiento, se alcanzó en el 93% de los pacientes tratados con POEM (IC 95% 87-97%; I2 = 0%; p = 0,67) y en el 72% de los pacientes tratados con dilatación neumática (IC 95% 64-80%; I2 = 54%; p = 0,11), con un RR de 1,28 a favor del POEM de 1,28 (IC 95% 1,14-1,45; p = 0,01).3 Hubo una tendencia a más ERGE luego del POEM comparado con la dilatación neumática (23% vs. 9%). En los dos estudios que reportaron a la ERGE sobre la base de los hallazgos endoscópicos, la esofagitis erosiva fue más frecuente luego del POEM comparado con la dilatación neumática (9-48% vs. 0-13%). No hubo eventos adversos severos luego del POEM. Hubo una perforación que fue resuelta endoscópicamente, luego de una dilatación neumática.
En cuanto a los resultados a dos años del POEM vs. la dilatación neumática, hubo un mayor éxito terapéutico con el POEM (58 de 63 pacientes; 92%) que con la dilatación neumática (34 de 63 pacientes; 54%) (diferencia absoluta 38% [IC 95% 22-52%]; p = 0,001; RR 1,71 [IC 95% 1,34-2,17]). Se observó más esofagitis erosiva en los pacientes que fueron tratados con POEM que en los que recibieron dilatación neumática (diferencia absoluta 34%; IC 95% 12-49%; p = 0,002).
Resultados del tratamiento sobre la base de los subtipos de acalasia
En las descripciones iniciales de los tres subtipos de acalasia, se hacía mención a que existían distintas respuestas al tratamiento en estos diferentes subtipos, y que era mejor en la acalasia tipo II y peor en la tipo III.16 Esto fue posteriormente corroborado en estudios subsecuentes, con una tasa de éxito que va del 90% al 100% para la tipo II, del 63% al 90% en la tipo I y del 33% al 70% en la tipo III.17-19 Estos hallazgos fueron ulteriormente confirmados en un metaanálisis de nueve estudios que incluyó a 298 pacientes tratados con dilatación neumática y 429 pacientes que fueron tratados con miotomía de Heller laparoscópica.82 Se observó que los mejores resultados los tuvieron los pacientes con acalasia tipo II y los peores los pacientes con acalasia tipo III. Existe poca información en cuanto a la respuesta al POEM en la acalasia tipo III. Un estudio no controlado de 32 pacientes con acalasia tipo III tratados con POEM reportó una tasa de éxito (Eckardt de 3) del 90,6% luego de una mediana de seguimiento de 24 meses.83 A pesar de que la evidencia es limitada, el POEM ha sido recomendado recientemente como el tratamiento de elección en la acalasia tipo III.27, 84
En resumen, en comparación con el tipo I, se ha propuesto que el tipo II tiene una mejor respuesta a cualquier forma de tratamiento (toxina botulínica, dilatación neumática, miotomía peroral o miotomía de Heller laparoscópica), mientras que el tipo III tiene la peor respuesta a todos los tratamientos.7, 17-19, 85, 86 Por otro lado, un estudio con análisis retrospectivo evidenció que los pacientes sometidos a miotomía laparoscópica de Heller tuvieron respuesta similar entre los pacientes con acalasia tipo I y tipo II, mientras que aquellos con acalasia tipo III no tuvieron respuesta favorable.87
Un metaanálisis que incluyó veinte estudios analizó el resultado clínico después de los diferentes tratamientos en los subtipos manométricos. Se observó que las tasas de éxito para miotomía de Heller en la acalasia tipo I, II y III fueron del 81%, 92% y 71%, respectivamente. Por otro lado, los de miotomía peroral fueron del 95%, 97% y 93% respectivamente.88
Por otro lado, las guías británicas de la sociedad de gastroenterología refieren que por el momento no hay suficiente información para recomendar tratamientos específicos sobre la base del subtipo, especialmente entre el tipo I o el tipo II. Por lo tanto, las decisiones terapéuticas deben basarse en la disponibilidad, la experiencia local y la elección del paciente.89
Cuando se compararon los estudios agrupados que analizaron acalasia tipo I vs. tipo II, se halló que todas las opciones terapéuticas tuvieron mejor respuesta en la acalasia tipo II respecto de la I.16-19, 44, 80, 86, 87, 90-98
La comparación entre acalasia tipo I vs. III no arrojó diferencias significativas en respuesta al tratamiento con toxina botulínica.16, 90, 91 En cambio, en el resto de los tratamientos presentaron significativamente mejor respuesta los demás tratamientos en la acalasia tipo I respecto de la III, salvo con el POEM donde se observó mejor respuesta en la acalasia tipo III.16-19, 44, 80, 86, 87, 90-98
Por último, para la comparación de acalasia tipo II vs. III se halló que las cuatro opciones terapéuticas tuvieron significativamente mejores resultados para la acalasia tipo II que para la tipo III.16-19, 44, 80, 86, 87, 90-98
Conclusión
A pesar de que la acalasia sigue siendo un trastorno motor del esófago cuya etiología es desconocida, en los últimos años hubo avances en su diagnóstico y tratamiento. La manometría esofágica de alta resolución ha permitido definir subtipos con diferentes respuestas al tratamiento. Esto significa que la acalasia no es un desorden uniforme y que los diferentes subtipos deberían tenerse en consideración a la hora de tomar decisiones terapéuticas. Por otro lado, aunque las modalidades terapéuticas clásicas siguen vigentes, el POEM está ganando un lugar privilegiado, a pesar de que es un procedimiento endoscópico complejo que requiere habilidades endoscópicas avanzadas.
En un futuro nuevas modalidades diagnósticas, como el EndoFLIP, permitirán seguramente un diagnóstico precoz durante la endoscopia índice y con mayor confort para el paciente.
Referencias
- Vaezi MF, Pandolfino JE, Vela MF. ACG clinical guideline: diagnosis and management of achalasia. Am J Gastroenterol 2013; 108 (8): 1238-1249; quiz 1250.
- Samo S, Carlson DA, Gregory DL, Gawel SH. Incidence and prevalence of achalasia in Central Chicago, 2004-2014, since the widespread use of high-resolution manometry. Clinical [Internet] 2017. Disponible en: https://www.sciencedirect.com/science/article/pii/S1542356516306103
- Khashab MA, Vela MF, Thosani N, Agrawal D, Buxbaum JL, Abbas Fehmi SM, et al. ASGE guideline on the management of achalasia. Gastrointest Endosc 2020; 91 (2): 213-227.e6.
- Duffield JA, Hamer PW, Heddle R, Holloway RH, Myers JC, Thompson SK. Incidence of Achalasia in South Australia Based on Esophageal Manometry Findings. Clin Gastroenterol Hepatol 2017; 15 (3): 360-365.
- Lottrup C, Khan A, Rangan V, Clarke JO. Esophageal physiology-an overview of esophageal disorders from a pathophysiological point of view. Ann NY Acad Sci 2020; 31: 1.
- Pandolfino JE, Gawron AJ. Achalasia: a systematic review. JAMA 2015; 313 (18): 1841-1852.
- Boeckxstaens GE, Zaninotto G, Richter JE. Achalasia. Lancet 2014; 383 (9911): 83-93.
- Cassella RR, Brown AL Jr, Sayre GP, Ellis FH Jr. Achalasia of the esophagus: pathologic and etiologic considerations. Ann Surg 1964; 160: 474-487.
- Goldblum JR, Whyte RI, Orringer MB, Appelman HD. Achalasia. A morphologic study of 42 resected specimens. Am J Surg Pathol 1994; 18 (4): 327-337.
- Pandolfino JE, Kim H, Ghosh SK, Clarke JO, Zhang Q, Kahrilas PJ. High-resolution manometry of the EGJ: an analysis of crural diaphragm function in GERD. Am J Gastroenterol 2007; 102 (5): 1056-1063.
- Raymond L, Lach B, Shamji FM. Inflammatory aetiology of primary oesophageal achalasia: an immunohistochemical and ultrastructural study of Auerbach’s plexus. Histopathology 1999; 35 (5): 445-453.
- Clark SB, Rice TW, Tubbs RR, Richter JE, Goldblum JR. The nature of the myenteric infiltrate in achalasia: an immunohistochemical analysis. Am J Surg Pathol 2000; 24 (8): 1153-1158.
- Vela MF, Richter JE, Wachsberger D, Connor J, Rice TW. Complexities of managing achalasia at a tertiary referral center: use of pneumatic dilatation, Heller myotomy, and botulinum toxin injection. Am J Gastroenterol 2004; 99 (6): 1029-1036.
- Rohof WO, Lei A, Boeckxstaens GE. Esophageal stasis on a timed barium esophagogram predicts recurrent symptoms in patients with long-standing achalasia. Am J Gastroenterol 2013; 108 (1): 49-55.
- Ghosh SK, Pandolfino JE, Rice J, Clarke JO, Kwiatek M, Kahrilas PJ. Impaired deglutitive EGJ relaxation in clinical esophageal manometry: a quantitative analysis of 400 patients and 75 controls. Am J Physiol Gastrointest Liver Physiol 2007; 293 (4): G878-G885.
- Pandolfino JE, Kwiatek MA, Nealis T, Bulsiewicz W, Post J, Kahrilas PJ. Achalasia: a new clinically relevant classification by high-resolution manometry. Gastroenterology 2008; 135 (5): 1526-1533.
- Salvador R, Costantini M, Zaninotto G, Morbin T, Rizzetto C, Zanatta L, et al. The Preoperative Manometric Pattern Predicts the Outcome of Surgical Treatment for Esophageal Achalasia [Internet]. Journal of Gastrointestinal Surgery 2010; 14: 1635-1645. Disponible en: http://dx.doi.org/10.1007/s11605-010-1318-4
- Pratap N, Kalapala R, Darisetty S, Joshi N, Ramchandani M, Banerjee R, et al. Achalasia cardia subtyping by high-resolution manometry predicts the therapeutic outcome of pneumatic balloon dilatation. J Neurogastroenterol Motil 2011; 17 (1): 48-53.
- Rohof WO, Salvador R, Annese V, Bruley des Varannes S, Chaussade S, Costantini M, et al. Outcomes of treatment for achalasia depend on manometric subtype. Gastroenterology 2013; 144 (4): 718-725; quiz e13-e14.
- Carlson DA. Functional lumen imaging probe: The FLIP side of esophageal disease. Curr Opin Gastroenterol 2016; 32 (4): 310-318.
- Pandolfino JE, de Ruigh A, Nicodème F, Xiao Y, Boris L, Kahrilas PJ. Distensibility of the esophagogastric junction assessed with the functional lumen imaging probe (FLIPTM) in achalasia patients. Neurogastroenterol Motil 2013; 25 (6): 496-501.
- Rohof WO, Hirsch DP, Kessing BF, Boeckxstaens GE. Efficacy of treatment for patients with achalasia depends on the distensibility of the esophagogastric junction. Gastroenterology 2012; 143 (2): 328-335.
- Ponds FA, Bredenoord AJ, Kessing BF, Smout AJPM. Esophagogastric junction distensibility identifies achalasia subgroup with manometrically normal esophagogastric junction relaxation. Neurogastroenterol Motil [Internet] 2017; 29 (1). Disponible en: http://dx.doi.org/10.1111/nmo.12908
- Kahrilas PJ, Bredenoord AJ, Carlson DA, Pandolfino JE. Advances in Management of Esophageal Motility Disorders. Clin Gastroenterol Hepatol 2018; 16 (11): 1692-1700.
- Scherer JR, Kwiatek MA, Soper NJ, Pandolfino JE, Kahrilas PJ. Functional esophagogastric junction obstruction with intact peristalsis: a heterogeneous syndrome sometimes akin to achalasia. J Gastrointest Surg 2009; 13 (12): 2219-2225.
- Ratuapli SK, Crowell MD, DiBaise JK, Vela MF, Ramirez FC, Burdick GE, et al. Opioid-Induced Esophageal Dysfunction (OIED) in Patients on Chronic Opioids. Am J Gastroenterol 2015; 110 (7): 979-984.
- Kahrilas PJ, on behalf of the International Working Group for Disorders of Gastrointestinal Motility and Function, Bredenoord AJ, Fox M, Prakash Gyawali C, Roman S, et al. Advances in the management of oesophageal motility disorders in the era of high-resolution manometry: a focus on achalasia syndromes [Internet]. Nature Reviews Gastroenterology & Hepatology 2017; 14: 677-688. Disponible en: http://dx.doi.org/10.1038/nrgastro.2017.132
- Eckardt VF, Aignherr C, Bernhard G. Predictors of outcome in patients with achalasia treated by pneumatic dilation. Gastroenterology 1992;103 (6): 1732-1738.
- Hoogerwerf WA, Pasricha PJ. Pharmacologic Therapy in Treating Achalasia [Internet]. Gastrointestinal Endoscopy Clinics of North America 2001; 11: 311-323. Disponible en: http://dx.doi.org/10.1016/s1052-5157(18)30073-4
- Cappell MS, Stavropoulos SN, Friedel D. Updated Systematic Review of Achalasia, with a Focus on POEM Therapy. Dig Dis Sci 2020; 65 (1): 38-65.
- Campos GM, Vittinghoff E, Rabl C, Takata M, Gadenstätter M, Lin F, et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg 2009; 249 (1): 45-57.
- Orenstein SB, Raigani S, Wu YV, Pauli EM, Phillips MS, Ponsky JL, et al. Peroral endoscopic myotomy (POEM) leads to similar results in patients with and without prior endoscopic or surgical therapy. Surg Endosc 2015; 29 (5): 1064-1070.
- Boeckxstaens GE. Achalasia: From Bench to Peroral Endoscopic Myotomy. Dig Dis 2016; 34 (5): 476-482.
- Richter JE. Update on the management of achalasia: balloons, surgery and drugs. Expert Rev Gastroenterol Hepatol 2008; 2 (3): 435-445.
- Mikaeli J, Bishehsari F, Montazeri G, Yaghoobi M, Malekzadeh R. Pneumatic balloon dilatation in achalasia: a prospective comparison of safety and efficacy with different balloon diameters. Aliment Pharmacol Ther 2004; 20 (4): 431-436.
- Farhoomand K, Richter JE, Achkar E, Connor JT, Vaezi MF. A new predictor of outcome of pneumatic dilation in achalasia [Internet]. Gastroenterology 2003; 124: A234-A235. Disponible en: http://dx.doi.org/10.1016/s0016-5085(03)81177-0
- Schnurre L, Murray FR, Schindler V, Runggaldier D, Fischbach L, Bordier V, et al. Short-term outcome after singular hydraulic EsoFLIP dilation in patients with achalasia: A feasibility study [Internet]. Neurogastroenterology & Motility 2020: 32. Disponible en: http://dx.doi.org/10.1111/nmo.13864
- Schlottmann F, Luckett DJ, Fine J, Shaheen NJ, Patti MG. Laparoscopic Heller Myotomy Versus Peroral Endoscopic Myotomy (POEM) for Achalasia [Internet]. Annals of Surgery 2018; 267: 451-460. Disponible en: http://dx.doi.org/10.1097/sla.0000000000002311
- Inoue H, Minami H, Kobayashi Y, Sato Y, Kaga M, Suzuki M, et al. Peroral endoscopic myotomy (POEM) for esophageal achalasia. Endoscopy 2010; 42 (4): 265-271.
- Bhayani NH, Kurian AA, Dunst CM, Sharata AM, Rieder E, Swanstrom LL. A comparative study on comprehensive, objective outcomes of laparoscopic Heller myotomy with per-oral endoscopic myotomy (POEM) for achalasia. Ann Surg 2014; 259 (6): 1098-1103.
- Costamagna G, Marchese M, Familiari P, Tringali A, Inoue H, Perri V. Peroral endoscopic myotomy (POEM) for oesophageal achalasia: preliminary results in humans. Dig Liver Dis 2012; 44 (10): 827-832.
- Hungness ES, Teitelbaum EN, Santos BF, Arafat FO, Pandolfino JE, Kahrilas PJ, et al. Comparison of perioperative outcomes between peroral esophageal myotomy (POEM) and laparoscopic Heller myotomy. J Gastrointest Surg 2013; 17 (2): 228-235.
- Khashab MA, Kumbhari V, Azola A, Zein ME, Messallam AA, Abdelgelil A, et al. Intraoperative determination of the adequacy of myotomy length during peroral endoscopic myotomy (POEM): the double-endoscope transillumination for extent confirmation technique (DETECT). Endoscopy 2015; 47 (10): 925-928.
- Kumbhari V, Tieu AH, Onimaru M, El Zein MH, Teitelbaum EN, Ujiki MB, et al. Peroral endoscopic myotomy (POEM) vs laparoscopic Heller myotomy (LHM) for the treatment of Type III achalasia in 75 patients: a multicenter comparative study. Endosc Int Open 2015; 3 (3): E195-E201.
- Rieder E, Swanström LL, Perretta S, Lenglinger J, Riegler M, Dunst CM. Intraoperative assessment of esophagogastric junction distensibility during per oral endoscopic myotomy (POEM) for esophageal motility disorders. Surg Endosc 2013; 27 (2): 400-405.
- Sharata A, Kurian AA, Dunst CM, Bhayani NH, Reavis KM, Swanström LL. Peroral endoscopic myotomy (POEM) is safe and effective in the setting of prior endoscopic intervention. J Gastrointest Surg 2013; 17 (7): 1188-1192.
- Sharata AM, Dunst CM, Pescarus R, Shlomovitz E, Wille AJT, Reavis KM, et al. Peroral endoscopic myotomy (POEM) for esophageal primary motility disorders: analysis of 100 consecutive patients. J Gastrointest Surg 2015; 19 (1): 161-170; discussion 170.
- Swanstrom LL, Kurian A, Dunst CM, Sharata A, Bhayani N, Rieder E. Long-term outcomes of an endoscopic myotomy for achalasia: the POEM procedure. Ann Surg 2012; 256 (4): 659-667.
- Teitelbaum EN, Dunst CM, Reavis KM, Sharata AM, Ward MA, DeMeester SR, et al. Clinical outcomes five years after POEM for treatment of primary esophageal motility disorders. Surg Endosc 2018; 32 (1): 421-427.
- Teitelbaum EN, Soper NJ, Pandolfino JE, Kahrilas PJ, Hirano I, Boris L, et al. Esophagogastric junction distensibility measurements during Heller myotomy and POEM for achalasia predict postoperative symptomatic outcomes. Surg Endosc 2015; 29 (3): 522-528.
- Khashab MA, Messallam AA, Onimaru M, Teitelbaum EN, Ujiki MB, Gitelis ME, et al. International multicenter experience with peroral endoscopic myotomy for the treatment of spastic esophageal disorders refractory to medical therapy (with video). Gastrointest Endosc 2015; 81 (5): 1170-1177.
- Khashab MA, Messallam AA, Saxena P, Kumbhari V, Ricourt E, Aguila G, et al. Jet injection of dyed saline facilitates efficient peroral endoscopic myotomy. Endoscopy 2014; 46 (4): 298-301.
- Ngamruengphong S, Inoue H, Ujiki MB, Patel LY, Bapaye A, Desai PN, et al. Efficacy and Safety of Peroral Endoscopic Myotomy for Treatment of Achalasia After Failed Heller Myotomy. Clin Gastroenterol Hepatol 2017; 15 (10): 1531-1537.e3.
- Kumbhari V, Familiari P, Bjerregaard NC, Pioche M, Jones E, Ko WJ, et al. Gastroesophageal reflux after peroral endoscopic myotomy: a multicenter case–control study. Endoscopy 2017; 49: 634-642. Disponible en: https://www.researchgate.net/profile/Edward_Jones3/publication/316690860_Gastroesophageal_reflux_after_peroral_endoscopic_myotomy_a_multicenter_casecontrol_study/links/5c45dd34458515a4c73662e6/Gastroesophageal-reflux-after-peroral-endoscopic-myotomy-a-multicenter-case-control-study.pdf
- Akintoye E, Kumar N, Obaitan I, Alayo QA, Thompson CC. Peroral endoscopic myotomy: a meta-analysis. Endoscopy 2016; 48 (12): 1059-1068.
- Inoue H, Sato H, Ikeda H, Onimaru M, Sato C, Minami H, et al. Per-Oral Endoscopic Myotomy: A Series of 500 Patients. J Am Coll Surg 2015; 221 (2): 256-264.
- Li C, Tan Y, Wang X, Liu D. Peroral endoscopic myotomy for treatment of achalasia in children and adolescents. J Pediatr Surg 2015; 50 (1): 201-205.
- Li C-J, Tan Y-Y, Wang X-H, Liu D-L. Peroral endoscopic myotomy for achalasia in patients aged ≥ 65 years. World J Gastroenterol 2015; 21 (30): 9175-9181.
- Inoue H, Shiwaku H, Kobayashi Y, Chiu PWY, Hawes RH, Neuhaus H, et al. Statement for gastroesophageal reflux disease after peroral endoscopic myotomy from an international multicenter experience. Esophagus 2020; 17 (1): 3-10.
- Kahaleh M, Tyberg A, Robles-Medranda C, Lukashok HP, Olmos JI, Oleas R, et al. Peroral endoscopic myotomy around the world: a decade of experience. In: Gastrointestinal Endoscopy [Internet]. MOSBY-ELSEVIER; 2019. Disponible en: https://observatorio.fm.usp.br/handle/OPI/32943
- Haito-Chavez Y, Inoue H, Beard KW, Draganov PV, Ujiki M, Rahden BHA, et al. Comprehensive Analysis of Adverse Events Associated With Per Oral Endoscopic Myotomy in 1826 Patients: An International Multicenter Study [Internet]. American Journal of Gastroenterology 2017; 112: 1267-1276. Disponible en: http://dx.doi.org/10.1038/ajg.2017.139
- Kurian AA, Dunst CM, Sharata A, Bhayani NH, Reavis KM, Swanström LL. Peroral endoscopic esophageal myotomy: defining the learning curve. Gastrointest Endosc 2013; 77 (5): 719-725.
- Patel KS, Calixte R, Modayil RJ, Friedel D, Brathwaite CE, Stavropoulos SN. The light at the end of the tunnel: a single-operator learning curve analysis for per oral endoscopic myotomy. Gastrointest Endosc 2015; 81 (5): 1181-1187.
- Zaninotto G, Costantini M, Rizzetto C, Zanatta L, Guirroli E, Portale G, et al. Four hundred laparoscopic myotomies for esophageal achalasia: a single centre experience. Ann Surg 2008; 248 (6): 986-993.
- Bansal R, Nostrant TT, Scheiman JM, Koshy S, Barnett JL, Elta GH, et al. Intrasphincteric botulinum toxin versus pneumatic balloon dilation for treatment of primary achalasia. J Clin Gastroenterol 2003; 36 (3): 209-214.
- Annese V, Basciani M, Perri F, Lombardi G, Frusciante V, Simone P, et al. Controlled trial of botulinum toxin injection versus placebo and pneumatic dilation in achalasia. Gastroenterology 1996; 111 (6): 1418-1424.
- Ghoshal UC, Chaudhuri S, Pal BB, Dhar K, Ray G, Banerjee PK. Randomized controlled trial of intrasphincteric botulinum toxin A injection versus balloon dilatation in treatment of achalasia cardia. Dis Esophagus 2001; 14 (3-4): 227-231.
- Mikaeli J, Fazel A, Montazeri G, Yaghoobi M, Malekzadeh R. Randomized controlled trial comparing botulinum toxin injection to pneumatic dilatation for the treatment of achalasia. Aliment Pharmacol Ther 2001; 15 (9): 1389-1396.
- Muehldorfer SM, Schneider TH, Hochberger J, Martus P, Hahn EG, Ell C. Esophageal achalasia: intrasphincteric injection of botulinum toxin A versus balloon dilation. Endoscopy 1999; 31 (7): 517-521.
- Vaezi MF, Richter JE, Wilcox CM, Schroeder PL, Birgisson S, Slaughter RL, et al. Botulinum toxin versus pneumatic dilatation in the treatment of achalasia: a randomised trial. Gut 1999; 44 (2): 231-239.
- Zhu Q, Liu J, Yang C. Clinical study on combined therapy of botulinum toxin injection and small balloon dilation in patients with esophageal achalasia. Dig Surg 2009; 26 (6): 493-498.
- Leyden JE, Moss AC, MacMathuna P. Endoscopic pneumatic dilation versus botulinum toxin injection in the management of primary achalasia. Cochrane Database Syst Rev 2014; (12): CD005046.
- Cheng J-W, Li Y, Xing W-Q, Lv H-W, Wang H-R. Laparoscopic Heller myotomy is not superior to pneumatic dilation in the management of primary achalasia: Conclusions of a systematic review and meta-analysis of randomized controlled trials. Medicine [Internet] 2017; 96 (7). Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/pmc5319488/
- Illés A, Farkas N, Hegyi P, Garami A, Szabó I, Solymár M, et al. Is Heller myotomy better than balloon dilation? A meta-analysis. J Gastrointestin Liver Dis 2017; 26 (2): 121-127.
- Baniya R, Upadhaya S, Khan J, Subedi S, Mohammed TS, Ganatra B, et al. Laparoscopic esophageal myotomy versus pneumatic dilation in the treatment of idiopathic achalasia: a meta-analysis of randomized controlled trials [Internet]. Clinical and Experimental Gastroenterology 2017; 10: 241-248. Disponible en: http://dx.doi.org/10.2147/ceg.s130449
- Awaiz A, Yunus RM, Khan S, Memon B, Memon MA. Systematic Review and Meta-Analysis of Perioperative Outcomes of Peroral Endoscopic Myotomy (POEM) and Laparoscopic Heller Myotomy (LHM) for Achalasia [Internet]. Surgical Laparoscopy, Endoscopy & Percutaneous Techniques 2017; 27: 123-131. Disponible en: http://dx.doi.org/10.1097/sle.0000000000000402
- Tan Y, Zhu H, Li C, Chu Y, Huo J, Liu D. Comparison of peroral endoscopic myotomy and endoscopic balloon dilation for primary treatment of pediatric achalasia. J Pediatr Surg 2016; 51 (10): 1613-1618.
- Sanaka MR, Hayat U, Thota PN, Jegadeesan R, Ray M, Gabbard SL, et al. Efficacy of peroral endoscopic myotomy vs. other achalasia treatments in improving esophageal function. World J Gastroenterol 2016; 22 (20): 4918-4925.
- Wang X, Tan Y, Lv L, Zhu H, Chu Y, Li C, et al. Peroral endoscopic myotomy versus pneumatic dilation for achalasia in patients aged = 65 years [Internet]. Revista Española de Enfermedades Digestivas 2016; 108. Disponible en: http://dx.doi.org/10.17235/reed.2016.4488/2016
- Meng F, Li P, Wang Y, Ji M, Wu Y, Yu L, et al. Peroral endoscopic myotomy compared with pneumatic dilation for newly diagnosed achalasia [Internet]. Surgical Endoscopy 2017; 31: 4665-4672. Disponible en: http://dx.doi.org/10.1007/s00464-017-5530-0
- Ponds FA, Fockens P, Lei A, Neuhaus H, Beyna T, Kandler J, et al. Effect of Peroral Endoscopic Myotomy vs Pneumatic Dilation on Symptom Severity and Treatment Outcomes Among Treatment-Naive Patients With Achalasia [Internet]. JAMA 2019; 322: 134. Disponible en: http://dx.doi.org/10.1001/jama.2019.8859
- Ou YH, Nie XM, Li LF, Wei ZJ, Jiang B. High-resolution manometric subtypes as a predictive factor for the treatment of achalasia: A meta-analysis and systematic review. J Dig Dis 2016; 17 (4): 222-235.
- Zhang W, Linghu E-Q. Peroral Endoscopic Myotomy for Type III Achalasia of Chicago Classification: Outcomes with a Minimum Follow-Up of 24 Months [Internet]. Journal of Gastrointestinal Surgery 2017; 21: 785-791. Disponible en: http://dx.doi.org/10.1007/s11605-017-3398-x
- Kahrilas PJ, Katzka D, Richter JE. Clinical Practice Update: The Use of Per-Oral Endoscopic Myotomy in Achalasia: Expert Review and Best Practice Advice From the AGA Institute [Internet]. Gastroenterology 2017; 153: 1205-1211. Disponible en: http://dx.doi.org/10.1053/j.gastro.2017.10.001
- Boeckxstaens G, Zaninotto G. Achalasia and esophago-gastric junction outflow obstruction: focus on the subtypes. Neurogastroenterology & [Internet] 2012. Disponible en: https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1365-2982.2011.01833.x
- Moonen A, Annese V, Belmans A, Bredenoord AJ, Bruley des Varannes S, Costantini M, et al. Long-term results of the European achalasia trial: a multicentre randomised controlled trial comparing pneumatic dilation versus laparoscopic Heller myotomy. Gut 2016; 65 (5): 732-739.
- Hamer PW, Holloway RH, Heddle R, Devitt PG, Kiroff G, Burgstad C, et al. Evaluation of outcome after cardiomyotomy for achalasia using the Chicago classification [Internet]. British Journal of Surgery 2016; 103: 1847-1854. Disponible en: http://dx.doi.org/10.1002/bjs.10285
- Andolfi C, Fisichella PM. Meta-analysis of clinical outcome after treatment for achalasia based on manometric subtypes. Br J Surg 2019; 106 (4): 332-341.
- Trudgill NJ, Sifrim D, Sweis R, Fullard M, Basu K, McCord M, et al. British Society of Gastroenterology guidelines for oesophageal manometry and oesophageal reflux monitoring. Gut 2019; 68 (10): 1731-1750.
- Lee H, Chung H, Lee TH, Hong KS, Youn YH, Park JH, et al. Therapeutic Outcome of Achalasia Based on High-Resolution Manometry: A Korean Multicenter Study. Am J Ther 2019; 26 (4): e452-e461.
- Min M, Peng LH, Yang YS, Hou XH, Guo RB, Wang WF, et al. Characteristics of achalasia subtypes in untreated Chinese patients: a high-resolution manometry study. J Dig Dis 2012; 13 (10): 504-509.
- Hosaka H, Kusano M, Kawada A, Kuribayashi S, Shimoyama Y, Moki F, et al. Mo1900 The Long Term Outcome After the Treatment of Different Subtypes of Achalasia Using High Resolution Manometry [Internet]. Gastroenterology 2014; 146: S-686. Disponible en: http://dx.doi.org/10.1016/s0016-5085
(14)62490-2 - Müller M, Keck C, Eckardt AJ, Werling S, Wehrmann T, König J, et al. Outcomes of pneumatic dilation in achalasia: Extended follow-up of more than 25 years with a focus on manometric subtypes [Internet]. Journal of Gastroenterology and Hepatology 2018; 33: 1067-1074. Disponible en: http://dx.doi.org/10.1111/jgh.14044
- Yamashita H, Ashida K, Fukuchi T, Nagatani Y, Koga H, Senda K, et al. Predictive factors associated with the success of pneumatic dilatation in Japanese patients with primary achalasia: a study using high-resolution manometry. Digestion 2013; 87 (1): 23-28.
- Crespin OM, Tatum RP, Xiao K, Martin AV, Khandelwal S, Pellegrini CA, et al. The relationship between manometric subtype and outcomes of surgical treatment for patients with achalasia. Surg Endosc 2017; 31 (12): 5066-5075.
- Kumbhari V, Tieu AH, El Zein MH, Ngamruengphong S, Abdelgelil A, Besharati S, et al. Tu1513 PerOral Endoscopic Myotomy (POEM) Achieves Similar Clinical Response but Incurs Lesser Charges Compared to Heller Myotomy (HM) for the Treatment of Achalasia [Internet]. Gastrointestinal Endoscopy 2015; 81: AB492. Disponible en: http://dx.doi.org/10.1016/j.gie.2015.03.964
- Kim WH, Cho JY, Ko WJ, Hong SP, Hahm KB, Cho J-H, et al. Comparison of the Outcomes of Peroral Endoscopic Myotomy for Achalasia According to Manometric Subtype. Gut Liver 2017; 11 (5): 642-647.
- Kim GH, Jung KW, Jung H-Y, Kim M-J, Na HK, Ahn JY, et al. Superior clinical outcomes of peroral endoscopic myotomy compared with balloon dilation in all achalasia subtypes. J Gastroenterol Hepatol 2019; 34 (4): 659-665.
Correspondencia: Jorge A Olmos
Av. Callao 875 piso 2do. Ciudad Autónoma de Buenos Aires, Argentina
Tel.: 5950-8794
Correo electrónico: jorge.a.olmos@gmail.com
Acta Gastroenterol Latinoam – Vol 50 – Sup N° 3 (AMTME – Noviembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE