Mariela Dulbecco ID· Mauricio Guzmán ID
Unidad de Neurogastroenterología, Servicio de Gastroenterología, Hospital Interzonal General de Agudos General José de San Martín, Universidad Nacional de La Plata, Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2022;52(2):153-165
Recibido: 04/05/2022 / Aceptado: 06/06/2022 / Publicado online el 27/06/2022 / https://doi.org/10.52787/agl.v52i2.207
Resumen
La enfermedad por reflujo gastroesofágico constituye uno de los motivos de consulta más frecuentes en la práctica gastroenterológica. Su diagnóstico es un desafío ya que los síntomas típicos suelen tener una baja sensibilidad y especificidad. No menos desafiante es su abordaje terapéutico, ya que requiere de un enfoque integral que debe tener en cuenta la presentación sintomática (síntomas típicos esofágicos o síntomas extraesofágicos), los hallazgos estructurales endoscópicos y las características motoras y funcionales. La correcta identificación de los fenotipos de la enfermedad por reflujo gastroesofágico es crucial para direccionar en cada caso el mejor tratamiento. En esta revisión, se propone otorgar al lector las mejores opciones terapéuticas según cada fenotipo y de acuerdo con las mejores evidencias disponibles en la actualidad.
Palabras claves. Enfermedad por reflujo gastroesofágico, fenotipos, enfermedad por reflujo no erosiva, esófago de Barrett.
Therapeutic Approach to Gastroesophageal Reflux Disease
Summary
Gastroesophageal reflux disease is one of the most frequent reasons for consultation in gastroenterological practice. Its diagnosis is a challenge since typical symptoms usually have a low sensitivity and specificity. No less challenging is its therapeutic approach, since it requires a comprehensive approach that must take into account the symptomatic presentation (typical esophageal symptoms or extra esophageal symptoms), endoscopic structural findings, and motor and functional characteristics. The correct identification of the phenotypes of gastroesophageal reflux disease is crucial to guide the best treatment in each case. In this review, it is proposed to provide the reader with the best therapeutic options according to each phenotype and in accordance with the best evidence currently available.
Keywords. Gastroesophageal reflux disease, phenotypes, non-erosive reflux disease, Barrett’s esophagus.
Abreviaturas
ERGE: Enfermedad por reflujo gastroesofágico.
EE: Enfermedad por reflujo gastroesofágico erosiva.
EB: Esófago de Barrett.
EEI: Esfínter esofágico inferior.
UEG: Unión esófago-gástrica.
IBP: Inhibidor de bomba de protones.
BACP: Bloqueadores de ácidos competitivos de potasio.
ERNE: Enfermedad por reflujo no erosiva.
LA: Los Ángeles.
ACE: Adenocarcinoma de esófago.
AAS: Ácido acetil salicílico.
AINES: Antiinflamatorios no esteroideos.
RH: Reflujo hipersensitivo.
PF: Pirosis funcional.
Introducción
El abordaje de la enfermedad por reflujo gastroesofágico (ERGE) requiere un enfoque integral que debe tener en cuenta la presentación sintomática (síndrome sintomático esofágico típico o síntomas atípicos, extraesofágicos), los hallazgos estructurales endoscópicos y las características motoras y funcionales.1 El objetivo del tratamiento de la ERGE consiste en el alivio sintomático, la curación del daño mucoso y la prevención de las complicaciones.2
Las decisiones terapéuticas diferirán según los fenotipos, definidos por las características anatómicas (presencia o no de hernia de hiato, complicaciones como esofagitis erosiva, estenosis, Barrett) y las alteraciones motoras y funcionales acompañantes (motilidad esofágica inefectiva, ausencia de reserva peristáltica).1 Esto permite caracterizar a la ERGE en tres fenotipos: la enfermedad por reflujo gastroesofágico no erosiva (ERNE), la enfermedad por reflujo gastroesofágico erosiva (EE) y el esófago de Barrett (EB). Esta clasificación fisiopatológica se basa en la historia natural de la enfermedad, en la cual la mayoría de los pacientes con ERGE mantienen su fenotipo a lo largo del tiempo.3
El principal desafío en el abordaje terapéutico de la ERGE es identificar a aquellos pacientes que se van a beneficiar de cada uno de los diferentes tratamientos disponibles, que incluyen tanto el manejo médico como los tratamientos invasivos (cirugía). Estos últimos beneficiarán a los pacientes con ERGE bien definida con alteraciones estructurales, mientras que aquellos pacientes con trastornos funcionales que simulen la ERGE (confundidores del reflujo) o que se superpongan con esta se beneficiarán con neuromoduladores.4
Manejo médico
El objetivo del tratamiento de la ERGE consiste en el alivio sintomático, la curación del daño mucoso y la prevención de las complicaciones.2
El manejo medico incluye las modificaciones en el estilo de vida y la terapia farmacológica, principalmente con medicaciones que reducen la secreción acida gástrica.1
Modificaciones en el estilo de vida
Las recomendaciones con respecto a los cambios en el estilo de vida podrían resumirse en tres estrategias generales:2
1. Evitar los alimentos que puedan precipitar los síntomas (chocolate, menta, alcohol, comidas con alto contenido en grasas).
2. Evitar los alimentos que puedan provocar pirosis por una acción directa irritante (café, cítricos, gaseosas y comidas picantes).
3. Adoptar conductas terapéuticas, tanto posturales (elevación de la cabecera de la cama, elegir dormir sobre el lado lateral izquierdo) como también relacionadas con el cambio de hábitos (descenso de peso, cesación tabáquica, evitar comer acostado, esperar 2-3 horas para acostarse después de las comidas).2
Es importante remarcar que la evidencia que apoya estas recomendaciones suele ser limitada y variable, basada en estudios pequeños y no controlados, como únicas intervenciones terapéuticas. Todo esto hace que la interpretación y las recomendaciones definitivas sean difíciles.1 Es razonable, por lo tanto, personalizar estas recomendaciones, sugiriendo evitar o utilizar con moderación los alimentos o actividades específicas que cada paciente identifique como desencadenantes de los síntomas.5
Con respecto a los alimentos, existen múltiples estudios que determinan los efectos de estos sobre la presión del esfínter esofágico inferior (EEI). El café, los cítricos y las comidas picantes no parecen tener efectos en la presión del EEI, pero sí podrían desencadenar los síntomas como irritantes directos. Por otro lado, el consumo de alcohol, el tabaquismo, el chocolate, la menta y los alimentos altos en grasas sí reducen la presión del EEI en los estudios de laboratorio.6-7
Existen mejores evidencias acerca del valor de los cambios posturales en el manejo de los síntomas nocturnos y el control de la exposición ácida nocturna. La elevación de la cabecera de la cama y dormir sobre el lado lateral izquierdo disminuyen el tiempo de exposición ácida y mejoran el tiempo de aclaramiento ácido.7 Esta maniobra postural se basa en que, al recostarse sobre el lado lateral derecho, la unión esófago-gástrica (UEG) se posiciona en un lugar dependiente del contenido gástrico, favoreciendo así el reflujo.1
El corto tiempo de espera entre la ingesta de los alimentos y la adquisición de la posición horizontal se asocia también a un aumento de los síntomas de reflujo y una mayor necesidad de medicación; por esto, se recomienda esperar al menos tres horas para recostarse después de comer.8
Con respecto al sobrepeso, existen numerosos estudios que han demostrado una correlación directa entre la obesidad y la ERGE, demostrando la eficacia que tiene la disminución de peso como intervención terapéutica en el manejo de sus síntomas. Un estudio documentó un 40% de reducción en los síntomas en quienes redujeron su índice de masa corporal en 3,5 kg/m2 o más, en comparación con los controles.10
Terapia de supresión ácida
• Inhibidores de la bomba de protones
Los inhibidores de la bomba de protones (IBP) inhiben la secreción de ácido gástrico al inactivar de manera selectiva, no competitiva e irreversible, las moléculas H+– K+ ATPasa de las células parietales. Los efectos no son inmediatos porque el IBP necesita concentrarse en los canalículos secretores ácidos de dichas células antes de inhibir la bomba de protones. La producción de ácido se suprime hasta que se regeneran nuevas bombas.4 Vale la pena resaltar que los IBP no actúan sobre los mecanismos fisiopatológicos de la ERGE ni tampoco reducen el número de eventos de reflujo; en cambio, alteran el pH del reflujo a débilmente ácido o alcalino.11
Los IBP son la medicación más prescrita y el tratamiento médico de primera línea de la ERGE. Esto se debe a que son consistentemente superiores a los anti H2 en el alivio de los síntomas típicos, la curación mucosa y el mantenimiento de esta. Estos datos surgen de un metaanálisis de Cochrane, que incluyó 134 estudios con un total de 35.978 pacientes, en el que se evidenció la superioridad de los IBP frente a todas las otras terapias farmacológicas. La tasa de persistencia de la esofagitis a las 4 semanas fue del 31,5% en los pacientes con IBP en comparación con el 61,5% de los pacientes que recibieron anti H2 (RR de persistencia a las 4 semanas 0,50, IC 95% 0,45 a 0,56) y un número necesario a tratar (NNT) de 3 (IC 95% 3 a 4). También se demostró la superioridad de los IBP frente a los anti H2 para la mejoría de los síntomas, con una persistencia de síntomas del 35% para los IBP y del 58% para los anti H2 (RR de persistencia de los síntomas a las 4 semanas 0,57, IC 95% 0,48 a 0,68) con un NNT de 4 (95% CI 3 a 5).12
• Tipos de IBP
Existen en la actualidad diferentes IBP disponibles.
Todos los IBP (salvo el dexlansoprazol) deben ser administrados 30-60 minutos antes de las comidas para asegurar su máxima eficacia.
Las moléculas de H+– K+ ATPasa se sintetizan dentro del retículo endoplásmico de las células parietales y se almacenan en las vesículas del aparato de Golgi hasta que son llevadas a la superficie apical de las células, en respuesta a la estimulación funcional. Los IBP solo bloquean las moléculas que están presentes en la superficie, mientras que las moléculas inactivas dentro de la célula pueden escapar de la inhibición; por ende, el máximo efecto antisecretor se logra con la estimulación que genera la llegada del alimento al estómago sobre las células parietales y el consecuente estímulo del receptor de gastrina. Es por este motivo que se debe indicar a los pacientes que, pasados los 30-60 minutos de la toma del IBP, consuman algún alimento.13
El dexlansoprazol, en cambio, es un IBP de liberación dual, que presenta una primera absorción en duodeno y, posteriormente, en el resto del intestino delgado, siendo su eficacia independiente del tiempo en relación con las ingestas de comida, lo que permite su administración con los alimentos. Otro de los beneficios de esta tecnología innovadora de absorción es la prolongación del tiempo de concentración plasmática del fármaco en comparación con el resto de los IBP.14 En dos estudios controlados aleatorizados que incluyeron a 4.092 pacientes, en los que se evaluó la seguridad y la eficacia para el alivio de la EE, se demostró que, en dosis de 60 mg y 90 mg, fue superior al lansoprazol 30 mg en la curación mucosa en las esofagitis moderadas a severas a las 8 semanas (86% versus 79% y 90% versus 85% respectivamente, p < 0,05). De esta manera, se concluyó que 90 mg de dexlansoprazol fueron significativamente superiores a 30 mg de lansoprazol para la cicatrización de la esofagitis moderada y severa, con una ganancia terapéutica del 8%. Esta ganancia terapéutica sugiere que un 25-30% de los pacientes que no curan su esofagitis con lansoprazol después de las 8 semanas de tratamiento podrían curarse con dexlansoprazol 90 mg (NNT de 13).15
Cabe mencionar tambien el beneficio clínico modesto, pero significativo, del esomeprazol en el tratamiento de la esofagitis erosiva. Esto quedó demostrado en un metaanálisis realizado por Spiegel y col., en el que se evidenció un riesgo relativo del 5% en la probabilidad de curación mucosa, con disminución del riesgo absoluto en un 4% y un NNT de 25 a 8 semanas.16
Desde el punto de vista clínico, todos los IBP pueden considerarse equivalentes ya que difieren poco en sus tasas de control sintomático y de curación del daño mucoso.12 No obstante, los expertos resaltan los beneficios, mencionados anteriormente, del dexlansoprazol y el esomeprazol para ser considerados como fármacos de primera elección.
Si bien, como mencionamos previamente, hay pocas diferencias entre los distintos IBP, la estrategia de rotar de un IBP a otro en pacientes con respuesta terapéutica insuficiente es válida y surge de la variabilidad individual en el control del pH gástrico entre los diferentes IBP.17 Algunos estudios sugieren que las diferencias genéticas en el metabolismo del CYP2C19 afectan la respuesta al IBP. Por lo tanto, si se considerara la estrategia de rotar el IBP, sería una buena elección cambiar por uno que no dependa de este metabolismo (rabeprazol, por ejemplo).18
• Modos de uso y discontinuación de los IBP
Los IBP pueden ser utilizados de forma intermitente (“tratamiento a demanda”) o como tratamiento a largo plazo (“tratamiento de mantenimiento” o “tratamiento continuo”).
El tratamiento de forma intermitente o a demanda consiste en tomar el IBP cuando aparecen los síntomas y suspenderlos cuando estos mejoran.
El tratamiento de mantenimiento o continuo consiste en la toma ininterrumpida del IBP, teniendo siempre como objetivo utilizar la dosis mínima efectiva para lograr la supresión ácida que controle los síntomas o mantenga la curación mucosa.
Estas modalidades terapéuticas, así como sus indicaciones y eficacia, las abordaremos más adelante dentro del enfoque según los fenotipos de la ERGE.
El modo de discontinuación del IBP (cuando estuviese indicado) es un área de controversia. Se ha planteado que la suspensión de este podría generar un potencial “rebote”, con una hipersecreción ácida, lo que resultaría en un recrudecimiento de los síntomas de reflujo.19 Se considera la hipersecreción ácida de rebote como un fenómeno fisiológico, que resulta del incremento del pH gástrico, con el consecuente aumento de la gastrina que promueve la proliferación de las células parietales y las enterocromafines, aumentando así la capacidad del estómago de producir ácido. Esto llevó a plantear estrategias de discontinuación, pudiéndose optar por la suspensión abrupta o la suspensión paulatina. Cualquiera de estas opciones puede ser considerada. Un estudio que las comparó no encontró diferencias significativas en los días libres de síntomas y la probabilidad de continuar libre de IBP a los 6 meses.20 En cualquier caso, se debe advertir a los pacientes de esta posibilidad de reaparición de los síntomas y de su manejo con medicación alternativa (véase el manejo por fenotipos).
• Efectos adversos
El uso a largo plazo de los IBP se ha relacionado con múltiples y diversos efectos adversos, incluyendo una reducción en la absorción de micronutrientes (vitamina B12, magnesio), infecciones gastrointestinales y pulmonares, osteoporosis, riesgo de fracturas, enfermedad cardíaca, enfermedad renal y demencia.21
Estos se presumen como consecuencia de la supresión crónica del ácido gástrico y surgen de múltiples estudios observacionales, en los que la mayoría de las asociaciones pueden ser susceptibles a sesgos y factores confundidores, siendo poco probable que representen relaciones de causa y efecto, y dando como resultado una calidad de la evidencia baja o muy baja para todos los efectos adversos reportados.22
Si bien aún faltan estudios prospectivos bien diseñados que evalúen la asociación causal entre el uso del IBP y los efectos adversos, vale la pena mencionar un estudio reciente, controlado, de 17.598 pacientes. Estos eran pacientes con enfermedad coronaria, anticoagulados o en tratamiento con AAS, y que fueron aleatorizados a recibir IBP o placebo. Este estudio no encontró diferencias significativas en ninguno de los efectos adversos mencionados, a excepción de las infecciones entéricas, con un aumento modesto del riesgo (1,4% en IBP contra el 1,0% en placebo; OR 1,33; IC 95%; 1,01-1,75).23
Por ende, cuando los IBP se indican adecuadamente, los beneficios superan los potenciales riesgos. Cuando los IBP se prescriben de manera inapropiada o innecesaria, los riesgos modestos se vuelven importantes, porque no hay un potencial beneficio.21
• Anti histamínicos H2
Los anti H2 bloquean la secreción de ácido al competir por los receptores de histamina en las células parietales gástricas.4 Como mencionamos anteriormente, son menos efectivos que los IBP en la curación mucosa y su mantenimiento, así como en la remisión de los síntomas.12
Algunos estudios demostraron un mejor control del pH intragástrico durante la noche.24
• Tipos de anti H2
Ya es bien conocido el retiro del mercado de la ranitidina por una disposición de la ANMAT en el 2020, por detectarse una impureza denominada N-nitrosodimetilamina (NDMA) que podría tratarse de un probable carcinógeno humano.25 Existen, sin embargo, otras formulaciones disponibles y seguras, como la famotidina, la cimetidina y la nizatidina.11
• Modos de uso
Su uso a largo plazo se encuentra limitado por la taquifilaxia rápida que generan (dentro de los 7 días), por lo cual la indicación como tratamiento continuo debe desaconsejarse.24
Podrían considerarse como alternativa, menos efectiva que los IBP, en el tratamiento a demanda de la ERGE, por el rápido alivio de los síntomas que generan.11
También pueden utilizarse en la discontinuación de los IBP, una vez alcanzada la remisión de los síntomas.26
• Bloqueadores de ácido competitivos de potasio
Estos fármacos suprimen la secreción de ácido gástrico al inhibir mediante una unión covalente iónica reversible a la región K+ de las moléculas H+, K+ ATPasa de las células parietales.11
A diferencia de los IBP, los bloqueadores de ácidos competitivos de potasio (BACP) tienen un rápido comienzo de acción, una vida media prolongada y un profundo efecto inhibitorio; desde el primer día de administración se alcanza una rápida supresión ácida y se llega a niveles de pH intragástricos más altos.11
A pesar de estas ventajas teóricas sobre los IBP, la evidencia no ha demostrado datos concluyentes en cuanto a la superioridad en el control sintomático y la curación mucosa con estos nuevos fármacos.27 En un metaanálisis reciente que incluyó 6 estudios asiáticos, se demostró una eficacia similar entre el vonoprazan y los IBP en el tratamiento de la ERGE con un RR de 1,06 (95% CI: 0,99-1,13; p = 0,09) y un perfil de seguridad similar entre los fármacos; pero, en el análisis de subgrupos, en pacientes con esofagitis severa (C o D), el vonoprazan mostró un beneficio marginal en la curación mucosa con respecto a los IBP.28
• Tipos de BACP
Vanoprazan y tegoprazan son las formulaciones desarrolladas, pero aún no se encuentran disponibles de forma global, estando solo aprobados en algunos países de Asia, como Japón y Corea del Sur.11 Las guías de recomendación japonesas posicionan a estos fármacos como de primera línea ante las esofagitis severas.29
• Antiácidos
Son compuestos a base de aluminio, calcio o magnesio. Neutralizan el ácido gástrico, sin reducir su secreción.4
No proporcionan un alivio prolongado de los síntomas ni curación mucosa ni previenen las complicaciones de la ERGE.4
Son relativamente seguros, pero las formulaciones que contienen magnesio pueden generar diarrea y las que contienen aluminio, constipación.11
Su uso es a demanda y su principal ventaja es el rápido alivio de los síntomas. No puede recomendarse uno sobre otro debido a la falta de información acerca de este punto.4
Alginatos
Son polímeros de polisacáridos naturales, que precipitan formando un gel viscoso al entrar en contacto con el ácido gástrico. Actúan creando una barrera física contra el reflujo del contenido gástrico.4 Proveen un rápido alivio, con inicio de acción en menos de 5 minutos y una duración aproximada de 90 minutos.30
Son particularmente útiles para neutralizar el acid pocket. Este consiste en una capa de ácido sobrenadante en el estómago proximal, cercana a la UEG, que se genera en el período posprandial. El gel de alginato actúa desplazando este acid pocket y formando una barrera farmacológica hacia distal, evitando su ingreso al esófago.31
Cuando se usan en combinación con un antiácido, los alginatos son mejores para el control de la pirosis y el tiempo de exposición ácida que los antiácidos solos.32
Su principal uso es la utilización en forma permanente, en combinación con los IBP, para el manejo del reflujo ácido y no ácido asociado a síntomas esofágicos y principalmente extraesofágicos.11
En una revisión reciente de la literatura sobre el tratamiento de síntomas atípicos (reflujo faringo-laríngeo), se avaló su uso como terapia adjunta a los IBP o como alternativa a estos.33
Proquinéticos
Los proquinéticos son agentes que aumentan la presión del EEI y el vaciamiento gástrico. Entre ellos, se destacan la metoclopramida, domperidona, cinitapride e itopride. La evidencia para su uso en los pacientes con ERGE es limitada. En un metaanálisis del 2014 de 12 estudios aleatorizados y controlados se encontró solo una modesta mejoría sintomática al agregar proquinéticos al tratamiento con IBP, sin mejoría en la curación mucosa, pero con un aumento significativo en los efectos adversos.34
En un estudio reciente de 21 voluntarios sanos se evaluó el prucalopride, un agonista 5HT4 utilizado para el tratamiento de la constipación, que demostró una mejoría en el vaciamiento gástrico y en el tiempo de exposición ácida. Aún faltan estudios para valorar su utilidad clínica en el manejo de la ERGE.35
Hasta el día de hoy, no existe evidencia suficiente para recomendarlos para el tratamiento de la ERGE, y por sus efectos adversos a largo plazo son desaconsejados.1
Baclofeno
Es un agonista GABAb que actúa disminuyendo las relajaciones transitorias del EEI que dan lugar a los eventos de reflujo. Disminuye el número de eventos de reflujo posprandial (ácidos y no ácidos) y los reflujos nocturnos.25-26 Sus efectos en el sistema nervioso central constituyen su principal limitante, dado que puede generar somnolencia, confusión, debilidad o temblores.38
Podría considerarse, en casos altamente seleccionados, una prueba de baclofeno en dosis de 5 a 20 mg 3 veces al día en pacientes con documentación objetiva de reflujo sintomático a pesar de la terapia óptima con IBP. Esto se consideraría en casos excepcionales, dado los efectos tóxicos de la droga.39
Sucralfato
Es un agente protector de la mucosa, formado por hidróxido de aluminio y sulfato de sucrosa, que se une a la mucosa digestiva. Es pobremente absorbido y no tiene toxicidad sistémica. La evidencia de su eficacia en el manejo de la ERGE es limitada. Algunos estudios han evidenciado mejoría versus placebo, pero no se han comparado con los IBP, que son claramente las drogas de elección.40
Su uso se encuentra muy limitado en la actualidad, dado el arsenal terapéutico disponible actualmente.1
Manejo quirúrgico
Funduplicatura
La funduplicatura se considera el gold estándar entre los procedimientos antirreflujo, por su eficacia en modificar los parámetros fisiopatológicos de la ERGE. Este procedimiento crea una barrera al reflujo del contenido gástrico (ácido o no ácido) y, así, se convierte en un tratamiento efectivo para el control del reflujo.1
Los pacientes con síntomas típicos de ERGE y buena respuesta a IBP o los que tienen pH-metría patológica con correlación sintomática positiva son los que mejor responden al tratamiento quirúrgico.41
La funduplicatura laparoscópica se inició en 1991, siendo actualmente el método de elección y desplazando el abordaje por cirugía abierta.1
• Seguridad y efectos adversos
Es un procedimiento seguro, cuando es realizado en centros de experiencia. La mortalidad postoperatoria reportada es baja, menor al 1%.42
Los efectos adversos más frecuentes son los relacionados con la acumulación de gas, disfagia postoperatoria y diarrea.42 Los síntomas relacionados al gas se dan en hasta un 85% de los pacientes y se deben a la incapacidad de relajar la UEG en respuesta a la distensión gástrica, lo que resulta en distensión abdominal, saciedad precoz, dolor abdominal, flatulencias e imposibilidad de eructar y vomitar. Usualmente mejoran dentro del año de la cirugía.42
La aparición de disfagia postoperatoria es esperable en las primeras 2 a 6 semanas postcirugía, sobre todo para sólidos, y tiene resolución espontánea dentro de los 2 a 3 meses. Sin embargo, un porcentaje de entre 3-24% de los pacientes persiste con disfagia y requiere evaluación y tratamiento.42 En la actualidad, y con la disponibilidad de la manometría esofágica de alta resolución, puede predecirse la aparición de la disfagia posfunduplicatura ante la ausencia de reserva peristáltica, evidenciada con el desafío de los múltiples tragos rápidos.43
La aparición de estos efectos no deseados derivó en el interés de definir el tipo de funduplicatura más conveniente, comparando la funduplicatura completa de 360º (Nissen) con la funduplicatura parcial (Toupet o Dor). Las funduplicaturas parciales se plantean como una alternativa ante un compromiso de la motilidad esofágica, ya que estas tienen similar eficacia en resolver los síntomas, pero resultan en menor desarrollo de disfagia postoperatoria, problemas con la producción de gas y la habilidad de eructar o vomitar. Sin embargo, las funduplicaturas parciales también podrían tener una mayor tasa de recurrencia de ERGE.44
• Eficacia a largo plazo
La duración de la cirugía antirreflujo en términos de control de los síntomas ha sido un tema de particular interés, debido a la importancia de definir el control de los síntomas a largo plazo y, así, soslayar riesgos y beneficios de la cirugía por sobre el tratamiento médico.
En un estudio de seguimiento a 10 años, en el que se evaluó al 84% de 247 pacientes con ERGE que habían sido inicialmente aleatorizados a recibir tratamiento médico o cirugía, se observó que el 92% de los pacientes tratados medicamente continuaban recibiendo medicación antirreflujo, y un porcentaje tan alto como el 62% de los que habían recibido tratamiento quirúrgico habían reiniciado la misma. Este estudio concluye que la cirugía no debe ser pensada como una estrategia para abandonar de forma definitiva el uso de medicación.45
Una revisión sistemática y metaanálisis de 7 ensayos clínicos controlados y aleatorizados se enfocó en la respuesta sintomática y encuestas de satisfacción. Se concluyó que la pirosis y la regurgitación fueron menos frecuentes en los pacientes con funduplicatura que en los pacientes con IBP y que, aunque una considerable proporción de los pacientes tuvo que recurrir a medicación postcirugía, estos se mostraban más satisfechos con su tratamiento en el corto y mediano plazo, y la mayoría manifestó que volvería a elegirla.46
Otra revisión del 2015 de Cochrane, que evaluó 4 estudios, con 1.160 pacientes, concluyó que aún es incierto y que faltan estudios para evaluar los riesgos y los beneficios de la cirugía en comparación con el tratamiento a largo plazo de los IBP.47
Si bien la indicación debe ser personalizada según cada caso clínico, en la última guía americana de manejo de ERGE se recomienda la cirugía antirreflujo como opción en pacientes con evidencia objetiva de ERGE: aquellos con ERGE erosiva de alto grado (LA grado C o D), grandes hernias hiatales y /o persistencia de síntomas de ERGE.1
Sistema de control de reflujo magnético laparoscópico
El sistema de control de reflujo magnético laparoscópico (LINX) consiste en una serie de magnetos interconectados por cables de titanio que forman una pulsera expandible, que se coloca mediante laparoscopía alrededor del esófago distal, reforzando el EEI para prevenir los eventos de reflujo. El paso del bolo alimenticio a través de la UEG se logra debido a que la fuerza de los magnetos disminuye a medida que la distancia entre estos aumenta. La habilidad de eructar o vomitar se conserva ya que el aumento de la presión abdominal en estas situaciones típicamente sobrepasa la presión de apertura de los dispositivos. Este sistema se desarrolló como una alternativa menos invasiva y más fácilmente reversible que la funduplicatura.48
En términos de eficacia, la inserción del dispositivo se asocia a una mejoría de los síntomas de reflujo, especialmente los relacionados con el volumen, como la regurgitación, y a una disminución del tiempo de exposición ácida.48
En un estudio reciente aleatorizado se estableció la superioridad del dispositivo en el control de la regurgitación respecto de aumentar la dosis de IBP a dos veces por día.49 Si bien no existen estudios controlados aleatorizados que comparen este dispositivo con la funduplicatura, estudios observacionales y revisiones sistemáticas evidenciaron que el esfínter laparoscópico tiene tiempos más cortos tanto operatorios como de estadía hospitalaria, menos efectos adversos relacionados con el gas y mayor capacidad conservada de vomitar y eructar. No habría diferencias significativas en el control de los síntomas, el uso de IBP postoperatorio y complicaciones mayores.1
La inserción del dispositivo es segura. En una revisión sobre 1042 dispositivos implantados en 82 centros, se reportó un 0,1% de complicaciones intra/perioperatorias, 1,3% de readmisiones hospitalarias, 5,6% de dilataciones endoscópicas y 3,4% de cirugía para remoción, ninguna de emergencia, todas por disfagia. No se evidenciaron migraciones ni mal funcionamiento. La erosión, que era un efecto temido, se reportó en un solo paciente (0,1%). Debe remarcarse que los pacientes con estos dispositivos tienen contraindicada la realización de resonancias.50
En cuanto a las indicaciones, esta técnica se encuentra limitada a pacientes que no presenten hernias hiatales grandes y puede considerarse como una alternativa a la funduplicatura en pacientes con regurgitación que fallaron al tratamiento médico.1 En la actualidad, en los países desarrollados que disponen del método y tienen experiencia, ha reemplazado a la funduplicatura, en un subgrupo de pacientes.
Abordaje terapéutico según los fenotipos
Existen tres fenotipos en la ERGE: la enfermedad por reflujo gastroesofágico no erosiva (ERNE), la EE y el EB. Esta clasificación se basa en que la mayoría de los pacientes con ERGE mantienen su fenotipo a lo largo del tiempo.51 Este modelo surge en contraposición al paradigma de la ERGE como un espectro continuo en el cual la variante no erosiva podría progresar en el tiempo a las complicaciones.51
Los datos longitudinales respaldan el concepto de fenotipos, ya que demuestran que la progresión de una enfermedad no erosiva a esofagitis de alto grado o esófago de Barret es muy poco frecuente.51 Esto se basa en que los determinantes fisiopatológicos de cada fenotipo son diferentes. Está bien establecido que los factores que determinan la lesión mucosa difieren de los factores que determinan los síntomas; por ende, no sería razonable que las estrategias de tratamiento fueran las mismas para todos los pacientes con ERGE.3 Asimismo, los pacientes con fenotipo de EE severa o EB presentan claros predisponentes (sexo masculino, raza blanca, obesos, antecedentes familiares) en contraposición con el fenotipo no erosivo, en el que no se identifica predilección ni de género ni de raza.3
La hipersensibilidad esofágica es otro determinante fisiopatológico de los fenotipos de la ERGE. Su influencia en estos varía ampliamente, siendo más significativa en la ERNE y categórica en los trastornos funcionales esofágicos (reflujo hipersensitivo y pirosis funcional).52
Los trastornos funcionales esofágicos, definidos por Roma IV, pueden superponerse con la ERGE; es por este motivo que abordaremos también su tratamiento.
Conocer la fisiopatología de la ERGE y, así, los fenotipos es fundamental para abordar de forma correcta a los pacientes.
Manejo del paciente con EE
La esofagitis se define endoscópicamente mediante la clasificación de Los Ángeles (LA), según el grado de lesión mucosa.
• EE severa (LA grados C y D)
Las esofagitis severas están determinadas fisiopatológicamente por la incompetencia grosera de la UEG. Esta puede ser definida por un EEI hipotensivo y/o la presencia de una hernia de hiato, y se caracteriza por un predominio de reflujo supino y un mal aclaramiento del ácido. Esto genera una exposición ácida del esófago distal muy prolongada.3
Estos determinantes fisiopatológicos suelen ser fijos o irreversibles, lo que condiciona al paciente a un tratamiento con terapia antisecretora a largo plazo o a cirugía antirreflujo.
El objetivo terapéutico en las esofagitis severas es la curación mucosa, el mantenimiento de esta y el control de los síntomas.
El tratamiento médico indicado en las EE de alto grado son los IBP en forma continua para mantener la curación mucosa, ya que el 100% de los pacientes con esofagitis grado C recaen a los 6 meses de suspender la medicación e, incluso, puede darse tan rápido como a las 2 semanas.53
Una vez instaurado el tratamiento con IBP, está indicado a las 8 semanas la realización de una nueva endoscopía para certificar la curación mucosa y descartar un EB subyacente, ya que la presencia de inflamación esofágica severa podría enmascararlo.1
Posteriormente, se indica la dosis mínima efectiva, es decir, la dosis mínima que controla los síntomas y mantiene la curación mucosa.1
• EE leve (LA grados A y B)
Los pacientes con grados leves de esofagitis presentan un compromiso menos severo de la UEG.3 Los determinantes fisiopatológicos de la EE de bajo grado se superponen con los de la ERNE.
El hallazgo de una esofagitis grado A ha sido desestimado en el consenso de Lyon como evidencia concluyente de ERGE; es considerada inespecífica y puede encontrarse en sujetos asintomáticos.54 Asimismo, la esofagitis grado A tiene una baja probabilidad de progresión a grados más severos y tiene posibilidad de regresión espontánea. Esto quedó evidenciado en un estudio prospectivo a 5 años, en el cual un tercio de los pacientes con esofagitis LA A tuvo una resolución de esta sin tomar IBP, y otro porcentaje (38%) persistió con la esofagitis LA A sin progresión.55
Si bien la esofagitis grado B se considera una evidencia adecuada para iniciar el tratamiento con IBP, los problemas de variabilidad interobservador llevaron a que los expertos en el consenso de Lyon consideren que la evidencia tampoco es concluyente para el diagnóstico definitivo de ERGE.54 Sin embargo, en la actualidad, hay cada vez más aceptación entre los expertos respecto de que la esofagitis grado B sea considerada suficiente para un diagnóstico definitivo de ERGE.1
En una revisión reciente de la historia natural, se evidenció una progresión de los grados leves a severos de esofagitis entre un 1 y un 22%.51
Es por este motivo que, en las esofagitis leves, a diferencia de las severas, el objetivo terapéutico es el control de los síntomas, por lo cual podría ser posible reducir o incluso eliminar el tratamiento médico.1
Manejo del paciente con EB
El esófago de Barrett es un cambio metaplásico del esófago distal en el que el epitelio escamoso normal es reemplazado por epitelio cilíndrico especializado con células caliciformes, en pacientes con una apariencia endoscópica de mucosa asalmonada mayor a 1 cm. Es el único precursor conocido del adenocarcinoma de esófago (ACE).56
El EB es casi siempre diagnosticado en la primera endoscopía y es poco frecuente que se desarrolle en pacientes con ERNE o EE.51 Es por este motivo que se recomienda solo una endoscopía de detección de EB en los pacientes con síntomas de ERGE.56
Algunos determinantes fisiopatológicos del EB se comparten con la EE severa, como la presencia de hernia de hiato, el EEI hipotensivo, la motilidad esofágica inefectiva y la obesidad central. Se asocia a una exposición crónica severa ácida y también biliar.57 También se identifican factores predisponentes, como los síntomas crónicos de reflujo (síntomas semanales por más de 5 años), el sexo masculino, la edad mayor de 50 años, el tabaquismo, la raza blanca, la ya mencionada obesidad central y la historia familiar de EB o ACE.56
El objetivo del tratamiento en el EB es la supresión ácida continua con IBP para cumplir la función de prevenir la progresión a displasia y ACE.
En un metaanálisis de estudios observacionales, que incluyó a 2.813 pacientes con EB, se evidenció una reducción del 71% del riesgo de desarrollar displasia de alto grado y adenocarcinoma de esófago con el uso de IBP, apoyando su rol como tratamiento quimiopreventivo.58
En lo que respecta a la dosis de IBP (simple versus doble), no existe un claro beneficio en aumentar la dosis del IBP con respecto a la oncogénesis, por lo que en la última guía de recomendación de manejo de EB solo se recomienda considerar dosis más altas en los pacientes que lo requieran para el control de sus síntomas.56
La evidencia tampoco es concluyente con el uso quimiopreventivo del ácido acetil salicílico (AAS). El AAS y los antiinflamatorios no esteroideos (AINES) inhiben varias vías de la oncogénesis, incluyendo la del ACE, especialmente la vía de la ciclooxigenasa, que es un mediador clave en la regulación positiva de la cascada inflamatoria de diversos factores oncogénicos. En el estudio prospectivo de quimioprevención AspECT, que se realizó en 84 centros del Reino Unido y 1 centro de Canadá, y en el que se aleatorizó a 2.557 pacientes con EB a recibir dosis bajas y dosis altas de IBP con o sin AAS, evaluaron la progresión a displasia, ACE o muerte a los 8 a 9 años. Este estudio demostró que las dosis altas fueron superiores a las dosis bajas, no encontrándose diferencias significativas a favor del uso del AAS.59 A pesar de estos datos, la última guía de recomendación americana no pudo hacer ninguna recomendación a favor o en contra del uso de AAS como quimioprevención en el EB, por falta de evidencia.56
La cirugía antirreflujo en el EB no debe considerarse como un tratamiento antineoplásico. La evidencia disponible no ha demostrado ser más efectiva en disminuir el riesgo de displasia o ACE que el tratamiento médico, sumado a los riesgos inherentes a la cirugía.56
Manejo del paciente con ERNE
Como mencionamos anteriormente, los determinantes fisiopatológicos de la ERNE se superponen con los de la enfermedad erosiva leve. Existe un aumento de la sensibilidad esofágica y una exposición al reflujo ácido con predominio de la exposición de pie. A diferencia del fenotipo erosivo, estos pacientes no tienen una predilección según raza o género ni asociación con sobrepeso.3
El aumento de la sensibilidad esofágica está definido por alteraciones en la integridad estructural de la mucosa (que facilitarían la exposición de los nervios subepiteliales sensoriales al reflujo) y la activación de las vías neuronales que median el dolor (con un aumento de la percepción dolorosa a través de mecanismos periféricos y centrales).3
El objetivo del tratamiento en la ERNE es el control sintomático, siendo los IBP a demanda el tratamiento de elección. Esta estrategia consiste en tomar el IBP cuando aparecen los síntomas y suspenderlos al mejorar.
Un estudio que incluyó a 774 pacientes comparó el tratamiento a demanda, el tratamiento continuo o el placebo en los pacientes con ERNE. En este estudio, el tratamiento a demanda fue igual de efectivo en el control de los síntomas (medido como días libres de síntomas) que el tratamiento continuo.60
En el proceso de discontinuar los IBP, debe advertirse a los pacientes que pueden desarrollar síntomas transitorios por la hipersecreción ácida de rebote. Durante este período pueden indicarse opciones farmacológicas de menor potencia, como los antiácidos o anti H2 para controlar los síntomas.61
Abordaje terapéutico de los trastornos funcionales esofágicos
Si bien el reflujo hipersensitivo y la pirosis funcional no son parte del espectro de la ERGE, estos se presentan sintomáticamente con pirosis, pudiendo actuar como confundidores en el abordaje inicial de los pacientes o superponerse al reflujo gastroesofágico ya establecido. Los determinantes fisiopatológicos de estas entidades son la hipersensibilidad visceral y la hipervigilancia, en un contexto de exposición ácida fisiológica y función motora esofágica normal o limítrofe. Los tratamientos enfocados en las alteraciones motoras sutiles o en la exposición ácida suelen ser insuficientes y poco efectivos. En contraste, las estrategias de modulación de las respuestas periféricas o las percepciones centrales suelen ser más exitosas.52
Manejo del paciente con reflujo hipersensitivo (RH)
El RH se define sobre la base de los criterios diagnósticos de Roma IV:
1. Síntomas retroesternales que incluyen pirosis o dolor.
2. Endoscopía normal y ausencia de esofagitis eosinofílica.
3. Ausencia de trastornos motores.
4. Evidencia de que los síntomas son desencadenados por eventos de reflujo a pesar del tiempo de exposición ácida normal por pH-metría (asociación sintomática positiva, tiempo de exposición ácida normal).52
En este caso los determinantes fisiopatológicos son la hipersensibilidad esofágica, con un aumento de la sensibilización tanto central como periférica. Está relacionado con umbrales de estimulación más bajos, ya que se han identificado un aumento de los receptores al ácido y alteraciones en la percepción del dolor.3-4
El abordaje terapéutico consiste en una combinación de IBP y neuromoduladores (véase pirosis funcional).
Manejo del paciente con pirosis funcional (PF)
La pirosis funcional es definida por Roma IV sobre la base de los siguientes criterios:
1. Ardor retroesternal o dolor.
2. Sin alivio con el tratamiento adecuado con IBP.
3. Ausencia de evidencia de ERGE o esofagitis eosinofílica como la causa de los síntomas.
4. Ausencia de evidencia de trastornos motores esofágicos.52
Estos pacientes evidencian, en el monitoreo ambulatorio con pH-metría sin IBP, una exposición ácida fisiológica sin asociación sintomática con reflujo (índice sintomático y SAP negativos). También puede existir una superposición de PF con ERGE. Esta puede darse en el contexto de pacientes con ERGE ya demostrado, los cuales persisten con síntomas a pesar del tratamiento con IBP y que, al realizarles un monitoreo ambulatorio de reflujo, en este caso con IBP, se evidencian las características descritas.62
Los determinantes fisiopatológicos de esta se basan principalmente en la hipersensibilidad esofágica, con mayor percepción del dolor a través de mecanismos periféricos y centrales. Los trastornos de ansiedad y el estrés se encuentran asociados ya que pueden aumentar las respuestas centrales a estímulos esofágicos.3
La historia natural de los pacientes con pirosis funcional ha sido menos estudiada. Un estudio de 40 pacientes evidenció que el 66% persistían sintomáticos a los 22 meses, lo que apoya la cronicidad de esta entidad.62
En estos pacientes, el tratamiento con IBP no es efectivo y los tratamientos más invasivos como la cirugía antirreflujo deben evitarse.
El objetivo terapéutico incluye la resolución de los síntomas, la prevención de la recurrencia y la mejoría de la calidad de vida.63-64
Se han estudiado diferentes neuromoduladores para el tratamiento de la pirosis funcional, muchos basados en la experiencia sobre otros trastornos funcionales como el dolor torácico no cardiogénico.63
Podemos mencionar los antidepresivos tricíclicos, siempre bajo la pauta de iniciar con la dosis más baja posible e ir aumentando lentamente. Las dosis objetivo de la amitriptilina son de 10-25 mg/día y usualmente se indican de noche. Dentro de los inhibidores selectivos de la recaptación de serotonina, se ha estudiado la fluoxetina en dosis de 20 mg/día, encontrándose un efecto beneficioso. La melatonina presenta un efecto modulador del dolor en dosis de 6 mg/día, y puede ser de utilidad en pacientes con trastornos del sueño asociados.63
Dentro de las terapias alternativas, se encuentran la acupuntura y la hipnoterapia. La primera evidenció, en un estudio de 30 pacientes con pirosis refractaria a IBP, ser más efectiva en la mejoría de los síntomas que duplicar la dosis de IBP.65 La hipnoterapia, en cambio, fue evaluada en la PF, demostrándose, en un pequeño estudio de 9 pacientes, una disminución significativa de los síntomas y de la hipervigilancia esofágica (ansiedad visceral) así como una mejoría de la calidad de vida.66
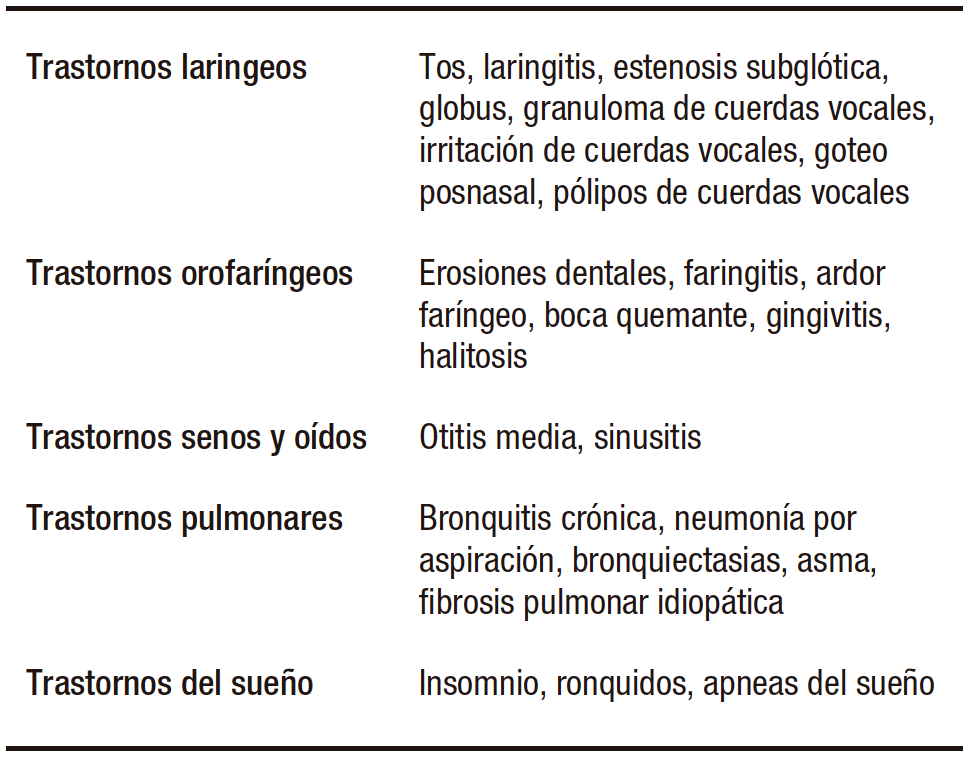
Manejo del paciente con ERGE extraesofágico
Múltiples síntomas y entidades han sido atribuidos a la ERGE, siendo denominados síntomas extraesofágicos o ERGE atípico. Estos son un desafío para los médicos ya que suelen ser síntomas inespecíficos que se superponen y atribuyen a múltiples otros trastornos. A continuación, se describen algunos:11
Si bien el consenso de Montreal reconoció que existe una relación establecida entre la ERGE y el asma, la tos crónica, la laringitis y las erosiones dentales, no se ha podido establecer una causalidad y los considera como de origen multifactorial, en donde la ERGE suele ser un cofactor, más que la causa.67 Por este motivo, se recomienda que estos pacientes siempre sean evaluados por los respectivos especialistas, ya sea otorrinolaringólogos, alergistas, neumonólogos, fonoaudiólogos, antes de atribuirle los síntomas al reflujo.1
La documentación del reflujo mediante endoscopía o monitoreo (pH-metría, pH-impedanciometría) tampoco establece causalidad entre la ERGE y los síntomas extraesofágicos. Los métodos más utilizados para determinar asociación sintomática (índice sintomático y asociación probabilística) se encuentran bien validados para la asociación de los síntomas típicos y el reflujo, pero son limitados para los síntomas extraesofágicos.
El abordaje terapéutico inicial está entonces determinado por la presencia o no de síntomas típicos (pirosis y regurgitación) concomitantes:1
• Síntomas extraesofágicos sin síntomas típicos acompañantes: no se inicia IBP. Están indicadas las pruebas que evalúan la presencia de reflujo (endoscopía, pH-metría, pH-impedanciometría) antes de indicar un tratamiento.
• Síntomas extraesofágicos con síntomas típicos acompañantes: se indica una prueba terapéutica con IBP, dosis doble por 8 a 12 semanas. Si no hay respuesta del síntoma atípico, deben suspenderse los IBP e iniciarse las pruebas que evalúen la presencia o no de reflujo.
Como mencionamos anteriormente, el agregado de alginatos, en forma permanente, ante la falta de respuesta a los IBP, seria de utilidad para el manejo del reflujo asociado a síntomas extraesofágicos.11
Por lo anterior expuesto, se entiende que el abordaje terapéutico de la ERGE extraesofágica es complejo, ya que se encuentran múltiples incertidumbres: primero, por la etiología multifactorial de los síntomas atípicos, segundo, el monitoreo de reflujo es más útil cuando es negativo (descarta la ERGE) y, por último, si bien la cirugía antirreflujo es efectiva en limitar los eventos de reflujo, no existe evidencia de calidad que avale su eficacia en el manejo de los síntomas atípicos.68
Conclusiones
El abordaje de la enfermedad por reflujo gastroesofágica (ERGE) requiere de una correcta identificación de los fenotipos descritos, siendo estos determinados por la presentación sintomática (síntomas típicos esofágicos o síntomas extraesofágicos), los hallazgos estructurales endoscópicos y las características motoras y funcionales. El objetivo del tratamiento de la ERGE consiste en el alivio de los síntomas, la curación del daño mucoso y la prevención de las complicaciones. El principal desafío en la actualidad consiste en identificar qué pacientes van a beneficiarse de cada uno de los diferentes tratamientos disponibles, el tratamiento médico o los tratamientos invasivos (cirugía).
Propiedad intelectual. Los autores declaran que los datos y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Dulbecco M, Guzmán M. Abordaje terapéutico de la enfermedad por reflujo gastroesofágico. Acta Gastroenterol Latinoam. 2022;52(2):153-165.
https://doi.org/10.52787/agl.v52i2.207
Referencias
- Katz PO, Dunbar KB, Schnoll-Sussman FH, Greer KB, Yadlapati R, Spechler SJ. ACG Clinical Guideline for the Diagnosis and Management of Gastroesophageal Reflux Disease. American Journal of Gastroenterology. 2022;117(1):27-56.
- Katzka DA, Kahrilas PJ. Advances in the diagnosis and management of gastroesophageal reflux disease. BMJ. 2020 Nov 23;371:m3786. doi: 10.1136/bmj.m3786. PMID: 33229333
- Katzka DA, Pandolfino JE, Kahrilas PJ. Phenotypes of Gastroesophageal Reflux Disease: Where Rome, Lyon, and Montreal Meet. Vol. 18, Clinical Gastroenterology and Hepatology. W.B. Saunders. 2020. Pp. 767-76.
- Gyawali CP, Fass R. Management of Gastroesophageal Reflux Disease. Gastroenterology. 2018;154(2):302-18.
- Olmos JA, Piskorz MM, Vela MF. REVISIÓN Gastroesophageal Reflux Disease Review (GERD) Revisión sobre enfermedad por reflujo gastroesofágico (ERGE) [Internet]: Acta Gastroenterol Latinoam 2016;46: 160-172. Disponible en: www.actagastro.org
- Newberry C, Lynch K. The role of diet in the development and management of gastroesophageal reflux disease: Why we feel the burn. Vol. 11, Journal of Thoracic Disease. AME Publishing Company; 2019. Pp. S1594-601.
- El-Serag HB, Satia JA, Rabeneck L. Dietary intake and the risk of gastro-oesophageal reflux disease: A cross sectional study in volunteers. Gut. 2005;54(1):11-7.
- Schuitenmaker JM, van Dijk M, Oude Nijhuis RAB, Smout AJPM, Bredenoord AJ. Associations Between Sleep Position and Nocturnal Gastroesophageal Reflux: A Study Using Concurrent Monitoring of Sleep Position and Esophageal pH and Impedance. American Journal of Gastroenterology. 2022;117(2):346-51.
- Ness-Jensen E, Hveem K, El-Serag H, Lagergren J. Lifestyle Intervention in Gastroesophageal Reflux Disease. Clinical Gastroenterology and Hepatology. 2016;14(2):175-182.e3.
- Ness-Jensen E, Lindam A, Lagergren J, Hveem K. Weight loss and reduction in gastroesophageal reflux. a prospective population-based cohort study: The HUNT study. American Journal of Gastroenterology. 2013;108(3):376-82.
- Fass R, Boeckxstaens GE, El-Serag H, Rosen R, Sifrim D, Vaezi MF. Gastro-oesophageal reflux disease. Vol. 7, Nature Reviews Disease Primers. Nature Research; 2021.
- Khan M, Santana J, Donnellan C, Preston C, Moayyedi P. Medical treatments in the short term management of reflux oesophagitis. Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2007.
- Hatlebakk JG, Katz PO, Camacho-Lobato L, Castell DO. Proton pump inhibitors: better acid suppression when taken before a meal than without a meal. Aliment Pharmacol Ther. 2000 Oct;14(10):1267-72. doi: 10.1046/j.1365-2036.2000.00829.x. PMID: 11012470.
- Sharma P, Shaheen NJ, Perez MC, Pilmer BL, Lee M, Atkinson SN, et al. Clinical trials: Healing of erosive oesophagitis with dexlansoprazole MR, a proton pump inhibitor with a novel dual delayed-release formulation – Results from two randomized controlled studies. Alimentary Pharmacology and Therapeutics. 2009;29(7):731-41.
- Fass R, Frazier R. The role of dexlansoprazole modified-release in the management of gastroesophageal reflux disease. Vol. 10, Therapeutic Advances in Gastroenterology. SAGE Publications Ltd; 2017. Pp. 243-51.
- Gralnek IM, Dulai GS, Fennerty MB, Spiegel BMR. Esomeprazole Versus Other Proton Pump Inhibitors in Erosive Esophagitis: A Meta-Analysis of Randomized Clinical Trials. Clinical Gastroenterology and Hepatology. 2006;4(12):1452-8.
- Fass R, Sontag SJ, Traxler B, Sostek M. Treatment of Patients With Persistent Heartburn Symptoms: A Double-Blind, Randomized Trial. 2006.
- Hillman L, Yadlapati R, Thuluvath AJ, Berendsen MA, Pandolfino JE. A review of medical therapy for proton pump inhibitor nonresponsive gastroesophageal reflux disease. Vol. 30, Diseases of the Esophagus. Oxford University Press; 2017. Pp. 1-15.
- Targownik LE, Fisher DA, Saini SD. AGA Clinical Practice Update on De-Prescribing of Proton Pump Inhibitors: Expert Review. Gastroenterology [Internet]. 2022 Feb. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S001650852104083X
- Björnsson E, Abrahamsson H, Simrén M, Mattsson N, Jensen C, Agerforz P, et al. Discontinuation of proton pump inhibitors in patients on long-term therapy: A double-blind, placebo-controlled trial. Alimentary Pharmacology and Therapeutics. 2006;24(6):945-54.
- Freedberg DE, Kim LS, Yang YX. The Risks and Benefits of Long-term Use of Proton Pump Inhibitors: Expert Review and Best Practice Advice From the American Gastroenterological Association. Vol. 152, Gastroenterology. W.B. Saunders; 2017. Pp. 706-15.
- Ma C, Shaheen AA, Congly SE, Andrews CN, Moayyedi P, Forbes N. Interpreting Reported Risks Associated With Use of Proton Pump Inhibitors: Residual Confounding in a 10-Year Analysis of National Ambulatory Data. Gastroenterology. 2020;158(3):780-2.e3.
- Moayyedi P, Eikelboom JW, Bosch J, Connolly SJ, Dyal L, Shestakovska O, et al. Safety of Proton Pump Inhibitors Based on a Large, Multi-Year, Randomized Trial of Patients Receiving Rivaroxaban or Aspirin. Gastroenterology. 2019;157(3):682-691.e2.
- Fackler WK, Ours TM, Vaezi MF, Richter JE. Long-term effect of H2RA therapy on nocturnal gastric acid breakthrough. Gastroenterology. 2002;122(3):625-32.
- Suspensión preventiva y retiro del mercado de todos los medicamentos que contengan RANITIDINA [Internet]. argentina.gob.ar. 2020 [citado 4 mayo 2022]. Disponible en: https://www.argentina.gob.ar/noticias/suspension-preventiva-y-retiro-del-mercado-de-todos-los-medicamentos-que-contengan
- Kim J, Blackett JW, Jodorkovsky D. Strategies for Effective Discontinuation of Proton Pump Inhibitors. Vol. 20, Current Gastroenterology Reports. Current Medicine Group LLC 1; 2018.
- Ashida K, Sakurai Y, Hori T, Kudou K, Nishimura A, Hiramatsu N, et al. Randomised clinical trial: Vonoprazan, a novel potassium-competitive acid blocker, vs. lansoprazole for the healing of erosive oesophagitis. Alimentary Pharmacology and Therapeutics. 2016;43(2):240-51.
- Cheng Y, Liu J, Tan X, Dai Y, Xie C, Li X, et al. Direct Comparison of the Efficacy and Safety of Vonoprazan Versus Proton-Pump Inhibitors for Gastroesophageal Reflux Disease: A Systematic Review and Meta-Analysis. Vol. 66, Digestive Diseases and Sciences. Springer; 2021. Pp. 19-28.
- Iwakiri K, Fujiwara Y, Manabe N, Ihara E, Kuribayashi S, Akiyama J, et al. Evidence-based clinical practice guidelines for gastroesophageal reflux disease 2021. Vol. 57, Journal of Gastroenterology. Springer Japan; 2022. Pp. 267-85.
- Tytgat GN, Simoneau G. Clinical and laboratory studies of the antacid and raft-forming properties of Rennie alginate suspension. Alimentary Pharmacology and Therapeutics. 2006;23(6):759-65.
- Kwiatek MA, Roman S, Fareeduddin A, Pandolfino JE, Kahrilas PJ. An alginate-antacid formulation (Gaviscon Double Action Liquid) can eliminate or displace the postprandial “acid pocket” in symptomatic GERD patients. Alimentary Pharmacology and Therapeutics. 2011;34(1):59-66.
- Leiman DA, Riff BP, Morgan S, Metz DC, Falk GW, French B, Umscheid CA, Lewis JD. Alginate therapy is effective treatment for GERD symptoms: a systematic review and meta-analysis. Dis Esophagus. 2017 May 1;30(5):1-9. doi: 10.1093/dote/dow020. PMID: 28375448; PMCID: PMC6036656.
- Huestis MJ, Keefe KR, Kahn CI, Tracy LF, Levi JR. Alternatives to Acid Suppression Treatment for Laryngopharyngeal Reflux. Vol. 129, Annals of Otology, Rhinology and Laryngology. SAGE Publications Inc.; 2020. Pp. 1030-9.
- Ren LH, Chen WX, Qian LJ, Li S, Gu M, Shi RH. Addition of prokinetics to PPI therapy in gastroesophageal reflux disease: A meta-analysis. World Journal of Gastroenterology. 2014;20(9):2412-9.
- Kessing BF, Smout AJPM, Bennink RJ, Kraaijpoel N, Oors JM, Bredenoord AJ. Prucalopride decreases esophageal acid exposure and accelerates gastric emptying in healthy subjects. Neurogastroenterology and Motility. 2014;26(8):1079-86.
- Vela MF, Tutuian R, Katz PO, Castell DO. Baclofen decreases acid and non-acid post-prandial gastro-oesophageal reflux measured by combined multichannel intraluminal impedance and pH. Alimentary Pharmacology and Therapeutics. 2003;17(2):243-51.
- Grossi L, Spezzaferro M, Sacco LF, Marzio L. Effect of baclofen on oesophageal motility and transient lower oesophageal sphincter relaxations in GORD patients: A 48-h manometric study. Neurogastroenterology and Motility. 2008;20(7):760-6.
- Armstrong D, Sifrim D. New Pharmacologic Approaches in Gastroesophageal Reflux Disease. Vol. 39, Gastroenterology Clinics of North America. 2010. Pp. 393-418.
- Koek GH, Sifrim D, Lerut T, Janssens J, Tack J. Effect of the GABA B agonist baclofen in patients with symptoms and duodeno-gastro-oesophageal reflux refractory to proton pump inhibitors [Internet]. Disponible en: www.gutjnl.com
- Simon B, Ravelli GP, Goffin H. Sucralfate gel versus placebo in patients with non-erosive gastro-oesophageal reflux disease. Vol. 10, Aliment Pharmacol Ther. 1996.
- Campos GMR, Peters JH, Demeester TR. Multivariate Analysis of Factors Predicting Outcome After Laparoscopic Nissen Fundoplication.
- Richter JE. Gastroesophageal Reflux Disease Treatment: Side Effects and Complications of Fundoplication. Clinical Gastroenterology and Hepatology. 2013;11(5):465-71.
- Shaker A, Stoikes N, Drapekin J, Kushnir V, Brunt LM, Gyawali CP. Multiple rapid swallow responses during esophageal high-resolution manometry reflect esophageal body peristaltic reserve. American Journal of Gastroenterology. 2013;108(11):1706-12.
- Du X, Wu JM, Hu ZW, Wang F, Wang ZG, Zhang C, et al. Laparoscopic Nissen (total) versus anterior 180° fundoplication for gastro-esophageal reflux disease. Vol. 96, Medicine (United States). Lippincott Williams and Wilkins; 2017.
- Spechler SJ, Lee E, Ahnen D, Goyal RK, Hirano I, Ramirez F, et al. Long-term Outcome of Medical and Surgical Therapies for Gastroesophageal Reflux Disease Follow-up of a Randomized Controlled Trial [Internet]. Disponible en: http://jama.jamanetwork.com/
- Rickenbacher N, Kötter T, Kochen MM, Scherer M, Blozik E. Fundoplication versus medical management of gastroesophageal reflux disease: Systematic review and meta-analysis. Surgical Endoscopy. 2014;28(1):143-55.
- Garg SK, Gurusamy KS. Laparoscopic fundoplication surgery versus medical management for gastro-oesophageal reflux disease (GORD) in adults. Vol. 2015, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2015.
- Vaezi MF, Shaheen NJ, Muthusamy VR. State of Evidence in Minimally Invasive Management of Gastroesophageal Reflux: Findings of a Scoping Review. Gastroenterology. 2020;159(4):1504-25.
- Bell R, Lipham J, Louie B, Williams V, Luketich J, Hill M, et al. Laparoscopic magnetic sphincter augmentation versus double-dose proton pump inhibitors for management of moderate-to-severe regurgitation in GERD: a randomized controlled trial [Internet]. Disponible en: www.giejournal.org
- Lipham JC, Taiganides PA, Louie BE, Ganz RA, Demeester TR. Safety analysis of first 1000 patients treated with magnetic sphincter augmentation for gastroesophageal reflux disease. Diseases of the Esophagus. 2015;28(4):305-11.
- Shah A, Shibli F, Kitayama Y, Fass R. The Natural Course of Gastroesophageal Reflux Disease: A Critical Appraisal of the Literature. Vol. 55, Journal of Clinical Gastroenterology. Lippincott Williams and Wilkins; 2021. Pp. 12-20.
- Aziz Q, Fass R, Gyawali CP, Miwa H, Pandolfino JE, Zerbib F. Esophageal disorders. Gastroenterology. 2016 May 1;150(6):1368-79.
- Savarino V, Marabotto E, Zentilin P, Furnari M, Bodini G, de Maria C, et al. Pathophysiology, diagnosis, and pharmacological treatment of gastro-esophageal reflux disease. Vol. 13, Expert Review of Clinical Pharmacology. Taylor and Francis Ltd; 2020. Pp. 437-49.
- Prakash Gyawali C, Kahrilas PJ, Savarino E, Zerbib F, Mion F, Smout AJPM, et al. Modern diagnosis of GERD: The Lyon Consensus. Vol. 67, Gut. BMJ Publishing Group; 2018. Pp. 1351-62.
- Ronkainen J, Talley NJ, Storskrubb T, Johansson SE, Lind T, Vieth M, et al. Erosive esophagitis is a risk factor for barrett’s esophagus: A community-based endoscopic follow-Up study. American Journal of Gastroenterology. 2011;106(11):1946-52.
- Shaheen NJ, Falk GW, Iyer PG, Souza RF, Yadlapati RH, Sauer BG, et al. Diagnosis and Management of Barrett’s Esophagus: An Updated ACG Guideline. American Journal of Gastroenterology [Internet]. 2022;117(4):559-87. Disponible en: https://journals.lww.com/10.14309/ajg.0000000000001680
- Katzka DA, Pandolfino JE, Kahrilas PJ. Phenotypes of Gastroesophageal Reflux Disease: Where Rome, Lyon, and Montreal Meet. Vol. 18, Clinical Gastroenterology and Hepatology. W.B. Saunders; 2020. Pp. 767-76.
- Singh S, Garg SK, Singh PP, Iyer PG, El-Serag HB. Acid-suppressive medications and risk of oesophageal adenocarcinoma in patients with barrett’s oesophagus: A systematic review and meta- Analysis. Vol. 63, Gut. BMJ Publishing Group; 2014. Pp. 1229-37.
- Jankowski JAZ, de Caestecker J, Love SB, Reilly G, Watson P, Sanders S, et al. Esomeprazole and aspirin in Barrett’s oesophagus (AspECT): a randomised factorial trial. The Lancet. 20184;392(10145):400-8.
- Pace F, Tonini M, Pallotta S, Molteni P, Porro GB. Systematic review: Maintenance treatment of gastro-oesophageal reflux disease with proton pump inhibitors taken “on-demand.” Vol. 26, Alimentary Pharmacology and Therapeutics. 2007. Pp. 195-204.
- Targownik LE, Fisher DA, Saini SD. AGA Clinical Practice Update on De-Prescribing of Proton Pump Inhibitors: Expert Review. Gastroenterology. 2022;162(4):1334-42.
- Surdea Blaga T, Dumitrascu D, Galmiche JP, Bruley Des Varannes S. Functional heartburn: Clinical characteristics and outcome. European Journal of Gastroenterology and Hepatology. 2013;25(3):282-90.
- Fass R, Zerbib F, Gyawali CP. AGA Clinical Practice Update on Functional Heartburn: Expert Review. Gastroenterology. 2020;158(8):2286-93.
- Patel D, Fass R, Vaezi M. Untangling Nonerosive Reflux Disease From Functional Heartburn. Vol. 19, Clinical Gastroenterology and Hepatology. W.B. Saunders; 2021. Pp. 1314-26.
- Dickman R, Schiff E, Holland A, Wright C, Sarela SR, Han B, et al. Clinical trial: Acupuncture vs. doubling the proton pump inhibitor dose in refractory heartburn. Alimentary Pharmacology and Therapeutics. 2007;26(10):1333-44.
- Riehl ME, Pandolfino JE, Palsson OS, Keefer L. Feasibility and acceptability of esophageal-directed hypnotherapy for functional heartburn. Diseases of the Esophagus. 2016;29(5):490-6.
- Vakil N, van Zanten S v, Kahrilas P, Dent J, Jones R, Bianchi LK, et al. The Montreal definition and classification of gastroesophageal reflux disease: A global evidence-based consensus. Vol. 101, American Journal of Gastroenterology. 2006.
- Katzka DA, Kahrilas PJ. Advances in the diagnosis and management of gastroesophageal reflux disease. The BMJ. 2020;371.
Correspondencia: Mauricio Guzmán
Correo electrónico: mauricioguzman76@hotmail.com
Acta Gastroenterol Latinoam 2022;52(2):153-165
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE