María Mercedes Manresa1 ID· Paula Cecilia Carboné2 ID· Guillermina Diez3 ID
1 Sección Neurogastroenterología, Instituto de Gastroenterología Salim, Salta, Argentina.
2 Sección Neurogastroenterología, Instituto de Diagnóstico Médico Oroño, Rosario, Argentina.
3 Servicio de Endoscopía, Clínica Pasteur, Neuquén, Argentina.
Acta Gastroenterol Latinoam 2022;52(4):424-438
Recibido: 18/11/2022 / Aceptado: 13/12/2022 / Publicado online el 21/12/2022 / https://doi.org/10.52787/agl.v52i4.276
Resumen
El dolor torácico no cardiogénico se define como la presencia de dolor retroesternal recurrente en el que la etiología cardiovascular ha sido descartada de manera objetiva. Se estima que su prevalencia global en la comunidad es del 13%. Nuestro enfoque en esta revisión se centrará en las causas esofágicas de dolor retroesternal, las cuales ocupan el primer lugar dentro de las causas no cardíacas. Las herramientas diagnósticas disponibles en la actualidad para evaluar los trastornos esofágicos relacionados con dolor torácico no cardiogénico incluyen: ensayos terapéuticos con inhibidores de bomba de protones, videoendoscopía digestiva alta, monitoreo ambulatorio de reflujo y manometría esofágica de alta resolución. El tratamiento debe estar dirigido al mecanismo fisiopatológico subyacente responsable de los síntomas. Las opciones terapéuticas incluyen fármacos (inhibidores de bomba de protones y neuromoduladores), tratamiento endoscópico, cirugía y terapias psicológicas.
Palabras claves. Dolor torácico no cardiogénico, enfermedad por reflujo gastroesofágico, trastornos funcionales esofágicos, dolor torácico funcional, hipersensibilidad al reflujo, trastornos motores esofágicos.
Approach to the Patient with Non-cardiogenic Chest Pain of Esophageal Origin
Summary
Non-cardiac chest pain is defined as the presence of recurrent retrosternal pain in which cardiovascular etiology has been objectively ruled out. Its overall prevalence in the community is estimated to be 13%. In this review we will focus on esophageal causes of chest pain, which rank first among non-cardiac causes. Currently available diagnostic tools to evaluate chest pain related to esophageal disorders include: therapeutic trials with proton pump inhibitors, upper gastrointestinal videoendoscopy, ambulatory reflux monitoring and high-resolution esophageal manometry. Treatment should be directed at the underlying pathophysiological mechanism responsible for the symptoms. Therapeutic options include drugs (proton pump inhibitors and neuromodulators), endoscopic treatment, surgery, and psychological therapies.
Keywords. Non-cardiac chest pain, gastroesophageal reflux disease, functional esophageal disorders, functional chest pain, reflux hypersensitivity, esophageal motor disorders.
Abreviaturas
DTNC: Dolor torácico no cardiogénico.
DTE: Dolor torácico de origen esofágico.
ERGE: Enfermedad por reflujo gastroesofágico.
DTF: Dolor torácico funcional.
HR: Hipersensibilidad al reflujo.
TME: Trastornos motores esofágicos.
EED: Espasmo esofágico distal.
EJGOO: Sigla en inglés de obstrucción del flujo de salida de la unión esófago gástrica.
EEo: Esofagitis eosinofílica.
SECs: Sigla en inglés de contracciones esofágicas sostenidas.
HRM: Sigla en inglés de manometría de alta resolución.
IBP: Inhibidores de bomba de protones.
VEDA: Video endoscopía digestiva alta.
TEA: Tiempo de exposición ácida.
IS: Índice sintomático.
SAP: Sigla en inglés de probabilidad de asociación sintomática.
MII-pH: Sigla en inglés de impedancia intraluminal multicanal con pH-metría.
ECA: Ensayo controlado aleatorizado.
POEM: Sigla en inglés de miotomía peroral endoscópica.
ATC: Antidepresivos tricíclicos.
ISRS: Inhibidores selectivos de la recaptación de serotonina.
TCC: Terapia cognitivo conductual.
Introducción
El dolor torácico no cardiogénico (DTNC) se define como la presencia de dolor retroesternal recurrente en el que la etiología cardiovascular ha sido descartada de manera objetiva por un cardiólogo.1 Antes de considerar su abordaje diagnóstico y terapéutico, debemos asegurarnos de que se hayan realizado los exámenes cardiovasculares adecuados según los factores de riesgo de cada paciente (ver la Figura 1 de la revisión sobre enfermedad coronaria y dolor torácico crónico). Una vez descartada la etiología cardiovascular es fundamental que el paciente continúe con una evaluación exhaustiva con el fin de realizar un diagnóstico que permita indicar un tratamiento específico para el control del síntoma. Esto evita que el paciente continúe buscando ayuda en guardias de emergencias y consultando a múltiples especialistas por episodios recurrentes de dolor torácico, lo que provoca el consecuente deterioro de su calidad de vida.
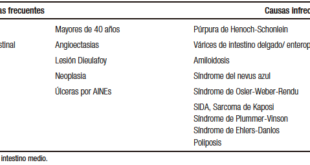
El DTNC puede ser desencadenado por causas gastrointestinales o que no están relacionadas con el tracto digestivo, como las musculoesqueléticas, pleuropulmonares, reumatológicas, psicológicas, entre otras (Tabla 1).2, 3 Dentro de las causas no cardíacas de dolor retroesternal, las esofágicas ocupan el primer lugar (80,5%)4 seguidas por las musculoesqueléticas (25,7%).5
Tabla 1. Causas de dolor torácico no cardiogénico

El dolor torácico de origen esofágico (DTE) puede ser de carácter opresivo o quemante; con irradiación a la espalda, al cuello, los brazos y las mandíbulas. Su manifestación clínica puede ser equivalente al dolor producido por isquemia miocárdica, por lo que es necesario realizar exámenes complementarios para poder diferenciarlos.2
Nuestro enfoque en esta revisión se centrará en las causas esofágicas del DTNC.
Epidemiología
El DTNC es un problema clínico frecuente. Aunque no se traduce en un aumento de la mortalidad, se asocia a una mayor utilización de los servicios médicos y a una peor calidad de vida.6 Se estima que su prevalencia global en la comunidad es del 13% (IC 95%: 9-16%), sin diferencia entre mujeres y hombres.7 En Argentina, un estudio poblacional encontró una prevalencia de DTNC anual de 23,5% y semanal de 5,2%8 que disminuye con el incremento en la edad.9
Las personas con DTNC tienen mayores puntuaciones de ansiedad (5,5 vs. 4,1; p < 0,001) y de depresión (4,4 vs. 3,8; p = 0,007) en comparación con los controles sanos.5 La prevalencia de depresión y de ansiedad, moderadas a severas, en los pacientes con DTNC es de 34% y 30% respectivamente. Los pacientes con estos trastornos presentan episodios de dolor más severos y más frecuentes que los pacientes sin comorbilidades psicológicas.10
Etiología
La causa más frecuente de DTNC de origen esofágico es la enfermedad por reflujo gastroesofágico (ERGE).2, 11-12
Le siguen en frecuencia los trastornos funcionales esofágicos, como el dolor torácico funcional (DTF) o la hipersensibilidad al reflujo (HR) definidos mediante los criterios de ROMA IV.13 A diferencia de lo que se piensa habitualmente, los trastornos motores esofágicos (TME) representan la causa del dolor torácico en una minoría de pacientes.2 Se han relacionado con DTNC los TME espásticos (acalasia tipo III, espasmo esofágico distal -EED- y esófago hipercontráctil) y la obstrucción del flujo de salida de la unión esófago gástrica (EJGOO). Fass y col. estimaron que del 50 al 60% de los pacientes con DTNC tienen ERGE, del 32 al 35% DTF y del 15 al 18% TME.14 Es importante tener en cuenta que las causas mencionadas de DTE pueden coexistir.
La esofagitis eosinofílica (EEo) se manifiesta con síntomas crónicos de disfunción esofágica que pueden incluir al dolor retroesternal.15 En un estudio retrospectivo realizado en los Estados Unidos encontraron que el 12% (IC 95%: 7-17%) de 171 pacientes con DTNC tenían ≥ 15 eosinófilos por campo de gran aumento en las biopsias esofágicas.16
Las neoplasias esofágicas rara vez se presentan con dolor torácico sin otro síntoma acompañante. En un estudio de pacientes con carcinoma de esófago, menos del 1% tenía dolor torácico como único síntoma.17
Fisiopatología
La inervación sensorial del esófago está dada por fibras vagales y nervios espinales. Los últimos hacen escala en el asta dorsal de la médula espinal donde convergen con las fibras provenientes del corazón. Esto explica que el dolor de origen esofágico sea indistinguible clínicamente del dolor por isquemia miocárdica.18
Se han propuesto varias hipótesis para explicar la fisiopatología del DTE, incluidas la estimulación de quimiorreceptores locales por reflujo ácido y no ácido, y la activación de mecanorreceptores por contracciones de gran amplitud o por distensión.19
Inicialmente se asumió que el espasmo esofágico primario o secundario a reflujo ácido era la causa del dolor en un grupo de pacientes. Sin embargo, se observó que la contracción del músculo circular, registrada por manometría esofágica, rara vez se correlaciona con episodios espontáneos de dolor torácico.20 A su vez, no se ha demostrado que la resolución de las alteraciones manométricas se correlacione con una mejoría del dolor.21 Esto ha llevado a la hipótesis de que alteraciones en la señalización neuronal aferente podrían ser la base de la fisiopatología del dolor torácico en pacientes con TME.22
Los pacientes con DTNC tienen umbrales más bajos de dolor visceral que los controles sanos, evaluados mediante distensión esofágica gradual con balón.23-25 Rao y col. utilizaron planimetría por impedancia para investigar la reactividad muscular y las propiedades viscoelásticas del esófago en pacientes con dolor torácico de origen desconocido En comparación con los controles sanos, encontraron que los sujetos con dolor torácico presentaron una menor distensibilidad esofágica, umbrales nociceptivos más bajos y aumento de la frecuencia, la amplitud y la duración de las contracciones esofágicas reactivas en respuesta a la insuflación gradual de un balón.26
El grupo de Mittal utilizó la medición del espesor del músculo liso esofágico mediante ultrasonido intraluminal de alta frecuencia en combinación con manometría esofágica, como un marcador de la contracción de la capa muscular longitudinal. Encontró asociación temporal entre episodios de dolor torácico y contracciones esofágicas sostenidas (SECs) de dicha capa muscular.27 Posteriormente, el mismo grupo evidenció asociación temporal entre las SECs y eventos de pirosis. La duración de las SECs asociadas con los eventos de pirosis (44,9 +- 29,6 s) fue significativamente menor que la duración de las SECs (68,0 +- 38,9 s) observadas durante los episodios de dolor torácico (p = 0,02).28 Esta diferencia de duración podría reflejar el intervalo de tiempo necesario para la activación de mecanorreceptores esofágicos o para la inducción de isquemia muscular, dos mecanismos que pueden desempeñar un papel en la fisiopatología del DTE.19,29 Es posible que la hiperreactividad esofágica detectada a través de planimetría por impedancia26 y las SECs detectadas por ultrasonografía intraluminal representen una actividad motora esofágica similar.26-27 Por el contrario, McIntosh y Paterson no encontraron diferencias significativas en la magnitud del acortamiento esofágico medido por manometría de alta resolución (HRM) entre pacientes con DTNC y controles sanos. Tampoco pudieron demostrar una correlación entre el inicio de los episodios de dolor torácico y el acortamiento esofágico.30
Los eosinófilos liberan múltiples gránulos tóxicos, como la proteína básica mayor, que producen inflamación crónica, dismotilidad esofágica y fibrosis. No está claro por qué algunos pacientes con EEo tienen disfagia mientras que otros presentan dolor torácico. Se postula que puede haber una degranulación variable o selectiva de sustancias que inducen mayor irritación de terminales nerviosas y contracción del músculo liso, lo que provoca dolor torácico, o mayor fibrosis y remodelación, lo que genera disfagia.16
Los mecanismos fisiopatológicos del DTF son todavía más complejos e involucran una combinación de hipersensibilidad esofágica, sensibilización central y periférica, procesamiento central alterado de estímulos esofágicos, alteraciones en las propiedades mecano-físicas del esófago, disregulación autonómica y comorbilidades psicológicas.31
Diagnóstico
El abordaje diagnóstico práctico del paciente con DTNC debe estar dirigido a la identificación del mecanismo causal subyacente. En virtud de la amplia diferencia de morbimortalidad de la enfermedad arterial coronaria respecto de las causas esofágicas de dolor torácico, sumado a que no es posible distinguir en base a la semiología del dolor la causa del mismo, se recomienda como enfoque diagnóstico inicial la evaluación cardiológica de todo paciente que presente dolor torácico por primera vez.32-34
Como se mencionó previamente, teniendo en cuenta que el origen esofágico representa la causa más probable de DTNC, resulta lógico que el abordaje diagnóstico siguiente esté destinado a identificar patologías esofágicas tales como ERGE, TME, EEo y trastornos esofágicos funcionales.
Las herramientas diagnósticas disponibles en la actualidad para evaluar trastornos esofágicos relacionados con DTNC incluyen: ensayos terapéuticos con inhibidores de bomba de protones (IBP), videoendoscopía digestiva alta (VEDA), monitoreo ambulatorio de reflujo y HRM.
Ensayo terapéutico con inhibidores de bomba de protones
El ensayo terapéutico con IBP está indicado como primer paso en el algoritmo diagnóstico del DTNC de probable origen esofágico a fin de detectar la ERGE como mecanismo causal previo a una evaluación diagnóstica formal.35 Existen dos abordajes.33 Por un lado, la terapia empírica con IBP durante 8 a 12 semanas, la cual es utilizada usualmente en el tratamiento convencional de la ERGE.36-37 Por el otro, puede realizarse una prueba terapéutica corta con IBP (en inglés PPI test) la cual se define como un curso corto (generalmente 7 a 14 días) de dosis altas de IBP.38 Las dosis diarias utilizadas para esta prueba terapéutica en los ensayos clínicos fueron: 40 a 80 mg de omeprazol, 30 a 90 mg de lansoprazol, 40 mg de rabeprazol y 40 mg de esomeprazol.12, 39-50 La prueba corta con IBP ha demostrado una sensibilidad del 69% al 95% y una especificidad del 67% al 86%, por lo cual se considera una intervención simple, altamente sensible y costo efectiva para diagnosticar DTNC relacionado con ERGE.33 Su beneficio terapéutico fue evaluado en diferentes metanálisis y revisiones sistemáticas.51-54 Cremonini y col. demostraron una tasa de riesgo de persistir con dolor después de la terapia con IBP de 0,54 (IC 95%: 0,41-0,71) con un número necesario a tratar (NNT) de 3 (IC 95%: 2-4). La sensibilidad, especificidad y OR para la prueba con IBP vs. pHmetría de 24 horas y VEDA fueron 80%, 74% y 13,83 (IC 95%: 5,48-34,91) respectivamente.51 Ghoneim y col. evaluaron la precisión diagnóstica de la prueba corta con IBP en DTNC y encontraron una sensibilidad y especificidad del 79% (IC 95%: 69-86%).54
La prueba terapéutica corta con IBP se recomienda como abordaje inicial en todo paciente con DTNC sin síntomas de alarma.
Video endoscopía digestiva alta
La VEDA se considera el primer procedimiento diagnóstico a realizar en pacientes con DTNC en presencia de síntomas o signos de alarma (disfagia, sangrado, vómitos, pérdida de peso o anemia) y es el abordaje a seguir en pacientes que no evidenciaron respuesta favorable a un ensayo terapéutico con IBP.55 Resulta el procedimiento diagnóstico de elección para descartar patología orgánica, evaluar los fenotipos de ERGE (erosiva, no erosiva, estenosis péptica y esófago de Barrett), identificar EEo y otras lesiones mucosas de origen infeccioso, medicamentoso o neoplásico.32, 56-58
En el DTNC, la VEDA tiene una tasa de rendimiento diagnóstico variable, con una baja sensibilidad. Los hallazgos mucosos relacionados con ERGE se pueden encontrar en un 10% a un 42% de los pacientes con DTNC.59-65 Dickman y col. evaluaron a un total de 3688 pacientes que se realizaron VEDA por DTNC y 32981 pacientes por síntomas típicos de ERGE. Se encontró una VEDA normal en el 44,1% de los pacientes con DTNC vs. el 38,8% de los pacientes con síntomas típicos de ERGE (p < 0,0001). En el grupo de DTNC el 28,6% tuvo hernia hiatal, el 19.4% ERGE erosiva, el 4,4% esófago de Barrett y el 3,6% estenosis péptica. Estos hallazgos fueron significativamente más frecuentes en el grupo con síntomas típicos de ERGE comparado con el grupo con DTNC (44,8%, 27,8% y 9,1% respectivamente; p < 0.0001).64
De acuerdo a la última guía de ERGE del Colegio Americano de Gastroenterología (ACG), se establece diagnóstico de ERGE en pacientes con esofagitis erosiva grado B, C y D de la clasificación de Los Ángeles y esófago de Barrett ≥ 3 cm.66 La esofagitis erosiva grado A de Los Ángeles no es suficiente para un diagnóstico definitivo de ERGE ya que es un hallazgo inespecífico, con escaso acuerdo interobservador, que se encuentra en el 5% al 7,5% de los controles asintomáticos.67
La toma de biopsias esofágicas debe llevarse a cabo ante la presencia de lesión orgánica, la sospecha endoscópica de esófago de Barrett y aún en ausencia de lesiones con el objetivo de descartar EEo. Se debe tener en cuenta que hasta el 7% de las endoscopías de pacientes con EEo muestran mucosa esofágica de aspecto normal.68 Para maximizar el rendimiento diagnóstico de la VEDA, ésta debe llevarse a cabo idealmente luego de la suspensión de los IBP durante 2 a 4 semanas, tanto para evaluar la presencia de esofagitis erosiva como para descartar EEo por biopsias.69-70
Monitoreo ambulatorio de reflujo
Los pacientes con DTNC que no muestran respuesta favorable a las pruebas con IBP, en quienes la VEDA no evidencia esofagitis erosiva grado B, C o D de Los Ángeles o esófago de Barrett ≥ 3 cm son candidatos para estudios de monitoreo ambulatorio de reflujo.55, 66 Esta conducta a seguir se basa en el hecho de que, como se mencionó anteriormente, la ERGE representa la causa más frecuente de DTE.
El monitoreo ambulatorio de reflujo permite determinar el tiempo de exposición ácida (TEA) esofágica y la correlación de síntomas con episodios de reflujo a través de parámetros como el índice sintomático (IS) y la probabilidad de asociación sintomática (SAP) los cuales resultan de utilidad para discriminar entre ERGE, HR o DTF.67
Se dispone de 3 métodos para el monitoreo ambulatorio de reflujo: pH-metría, impedancia intraluminal multicanal con pH-metría (MII-pH) y cápsula inalámbrica (Bravo). Los 2 primeros se realizan mediante un catéter transnasal y tienen 24 horas de duración. La cápsula inalámbrica se coloca por vía endoscópica y permite un monitoreo prolongado de pH de 48 a 96 horas.7 -72
La pH-metría de 24 horas ha evidenciado una sensibilidad del 79% al 96% y una especificidad del 85% al 100%.4, 73-80
Extender el monitoreo de pH a 2 días con un sistema inalámbrico aumenta la detección de ERGE en una proporción clínicamente significativa de pacientes con DTNC. Prakash y col. demostraron que un registro de 48 horas tuvo una ganancia del 10% para detectar un TEA anormal, un 7,3% de aumento en el número de pacientes que tuvieron dolor torácico durante el estudio y un 21% de incremento en el número de pacientes con SAP positivo.81 La presencia de la cápsula en el esófago provocó dolor torácico, odinofagia o disfagia en el 9% de los pacientes, aunque en menos del 2% los síntomas fueron lo suficientemente intensos como para indicar su extracción endoscópica.82
En referencia a la MII-pH pocos estudios demostraron el valor adicional de esta técnica sobre las otras modalidades en pacientes con DTNC. Como ventajas se pueden mencionar la posibilidad de discriminar los episodios de reflujo en base a sus características químicas (ácido, débilmente ácido y alcalino) y físicas (líquido, gaseoso o mixto), de evaluar la extensión proximal y el tiempo de aclaramiento del reflujo y de medir parámetros como la impedancia basal nocturna relacionado este último con la integridad de la mucosa esofágica. Un estudio con MII-pH determinó que los episodios de reflujo asociados a dolor torácico alcanzaron con mayor frecuencia el esófago proximal, presentaron un mayor tiempo de eliminación del volumen, fueron más frecuentemente ácidos con un nadir de pH más bajo en comparación con los episodios de reflujo que no fueron seguidos por dolor torácico. Un mayor volumen de reflujo ácido durante un período de tiempo más prolongado parece ser un factor determinante para percibir un episodio de reflujo como dolor torácico.83 Ribolsi y col. observaron que la presencia de gas en el episodio de reflujo y la mayor duración del mismo parecen estar asociadas al DTNC.84 Un estudio demostró que la impedancia basal nocturna en el esófago distal de pacientes con DTNC relacionado con ERGE fue significativamente menor que en los pacientes con DTNC no relacionado con ERGE.85
Manometría esofágica de alta resolución
La HRM de esófago representa en la actualidad el método de elección para el diagnóstico de TME, los cuales habitualmente se manifiestan con dolor torácico o disfagia. Se debe tener en cuenta que, en pacientes en quienes se realizará monitoreo ambulatorio de reflujo con catéter, se debe solicitar una manometría esofágica previa para guiar el correcto posicionamiento del mismo.72
Estudios realizados con manometría esofágica convencional en pacientes con DTNC han reportado resultados variables, pero coincidieron en su mayoría con el hallazgo de una función esofágica normal en hasta el 70% de los casos.86-88 Deckel y col. demostraron que el 70% de los pacientes con DTNC remitidos para realizar una manometría esofágica tuvo un estudio normal. La alteración motora más frecuente fue el esfínter esofágico inferior hipotensivo (61%). El esófago en cascanueces (nutcracker) y otros trastornos motores inespecíficos se observaron en sólo el 10% de los pacientes.87 Un estudio realizado en Brasil reportó la presencia de una manometría anormal en el 63% de los pacientes con DTNC; el esfínter esofágico inferior hipotensivo y los trastornos motores inespecíficos fueron los más frecuentes.89
El advenimiento de la HRM ha permitido un mejor entendimiento y un avance sustancial en la evaluación de la función motora del esófago. La última actualización de la clasificación de los TME, Chicago versión 4.0, incorporó una modificación de los criterios diagnósticos previos. Estableció la incorporación, a los criterios manométricos, de la presencia de síntomas compatibles (disfagia y dolor torácico) y de estudios complementarios de soporte (FLIP -catéter de imagen luminal funcional- y esofagograma minutado) para determinar un diagnóstico concluyente, clínicamente relevante de EED, esófago hipercontráctil y EJGOO.90
En los últimos años es creciente el número de estudios sobre HRM en DTNC. Akinsiku y col. compararon pacientes con DTNC estudiados mediante HRM o manometría convencional. En el grupo de HRM hallaron motilidad esofágica normal en el 46,6% de los pacientes; la anormalidad motora más frecuente fue la motilidad esofágica inefectiva (25,3%). Otros TME encontrados incluyen: acalasia (7,33%), EJGOO (4%), contractilidad ausente (4%), esófago Jackhammer (3,33%) y EED (2,67%).88 En un estudio retrospectivo se evaluaron 177 pacientes con DTNC mediante HRM. Se diagnosticaron TME en el 31% de los pacientes (motilidad esofágica inefectiva en el 14,1%; esófago Jackhammer en el 6,8%; EED en el 5,1% y acalasia en el 2,3%).91
Esofagograma con bario
El esofagograma con bario tiene una baja sensibilidad y especificidad en ERGE, por lo que no está recomendado para su diagnóstico.66, 92 Se debe considerar para una valoración estructural y funcional del esófago en los pacientes con dolor torácico que refieren disfagia o con alta sospecha de TME. En pacientes con acalasia esta prueba puede evidenciar dilatación esofágica y afinamiento distal en «pico de pájaro». Se puede sospechar EED ante la presencia de una imagen de esófago en forma de «sacacorchos».93-94
Como se mencionó previamente, la nueva Clasificación de Chicago versión 4.0 incorporó estudios complementarios de soporte a los criterios manométricos. Uno de ellos es el esofagograma con bario minutado, el cual se recomienda en pacientes con diagnóstico no concluyente de acalasia y para confirmar una EJGOO.90, 95
Pruebas sensoriales
La hipersensibilidad esofágica desempeña un papel importante en el DTNC.96 La demostración de umbrales bajos de percepción del dolor a estímulos químicos, mecánicos o eléctricos sugiere hipersensibilidad esofágica. Las pruebas de sensorialidad presentan baja sensibilidad, son invasivas, tienen disponibilidad limitada y actualmente sólo se utilizan con fines de investigación. Se han estudiado pruebas de estimulación química como la de Bernstein (perfusión esofágica de ácido clorhídrico),97-98 pruebas de estimulación mecánica (distensión esofágica con balón y planimetría por impedancia)99-100 así como pruebas de estimulación eléctrica, térmica y multimodal.101
Evaluación psiquiátrica y psicológica
Como se resaltó previamente, es frecuente la asociación del DTNC con trastornos psiquiátricos, principalmente el trastorno de ansiedad generalizada y el trastorno de pánico.102-103 Algunos estudios han demostrado que las comorbilidades psiquiátricas pueden coexistir con otras causas de DTNC como ERGE y TME.104-105 En virtud de ello, en pacientes con exámenes diagnósticos normales o con alta sospecha de un trastorno psiquiátrico de base se recomienda un abordaje multidisciplinario con la participación de especialistas en psiquiatría o psicología.
Criterios diagnósticos para trastornos funcionales esofágicos
Si el paciente no responde favorablemente a un ensayo terapéutico con IBP, presenta una VEDA con biopsias esofágicas normales, se descarta ERGE y TME; es probable que presente un trastorno funcional esofágico. Los trastornos funcionales esofágicos que pueden manifestarse con dolor torácico son el DTF y la HR. Los índices de asociación sintomática (IS y SAP) evaluados durante los estudios de monitoreo ambulatorio de reflujo permitirán establecer el diagnóstico diferencial entre ambos.67
Criterios diagnósticos para dolor torácico funcional:13
Los criterios mencionados a continuación tienen que estar presentes durante los últimos 3 meses, con el inicio del síntoma al menos 6 meses antes del diagnóstico, con una frecuencia de al menos una vez por semana. Deben incluir todos los siguientes:
• Dolor o molestia torácica retroesternal (luego de descartar las causas cardíacas).
• Ausencia de síntomas esofágicos asociados, como pirosis y disfagia.
• Ausencia de evidencia de que la ERGE o la EEo son la causa del síntoma.
• Ausencia de TME mayores.
Criterios diagnósticos para hipersensibilidad al reflujo:13
Los criterios mencionados a continuación tienen que estar presentes durante los últimos 3 meses, con el inicio del síntoma al menos 6 meses antes del diagnóstico, con una frecuencia de al menos dos veces por semana. Deben incluir todos los siguientes:
• Síntomas retroesternales que incluyan pirosis y dolor torácico.
• VEDA normal y ausencia de evidencia de que la EEo es la causa de los síntomas.
• Ausencia de TME mayores.
• Evidencia de que los síntomas están desencadenados por eventos de reflujo a pesar de una exposición ácida esofágica normal.
Tratamiento
El tratamiento de los pacientes con DTNC debe estar dirigido al mecanismo fisiopatológico subyacente responsable de los síntomas.106 Las opciones terapéuticas incluyen fármacos, tratamiento endoscópico, cirugía y terapias psicológicas.
DTNC relacionado con ERGE
Las modalidades terapéuticas para el DTNC relacionado con ERGE incluyen fármacos, tratamiento endoscópico y funduplicatura quirúrgica.
En su última actualización sobre evaluación y manejo de ERGE, la Asociación Americana de Gastroenterología (AGA) propone tratar a los pacientes con pirosis, regurgitación o DTNC sin síntomas de alarma con dosis simples de IBP durante 4 a 8 semanas. Si la respuesta es inadecuada, la dosis puede aumentarse a dos veces al día o cambiarse por agentes supresores de ácido más eficaces, entre ellos, IBP con menor metabolización a través de la vía CYP2C19 (rabeprazol y esomeprazol), IBP con formulación de liberación prolongada (dexlansoprazol) y bloqueantes de ácido competitivos de potasio (P-CABs).107-108 Cuando se logra una respuesta adecuada y sostenida, el IBP debe reducirse a la dosis eficaz más baja.55
Los IBP que se evaluaron en ensayos controlados aleatorizados (ECA) con placebo son: omeprazol, rabeprazol, lansoprazol y esomeprazol.12,35,37,47,49,109-110,50 En una revisión sistemática y un metanálisis se observó que el tratamiento con IBP en pacientes con DTNC relacionado con ERGE fue más eficaz que el placebo (OR 11,7; IC 95%: 5,5-25,0)111 Kadir y col. evaluaron, en un ensayo aleatorizado, la eficacia y la seguridad de una terapia guiada según etiología vs. una terapia empírica en pacientes con DTNC. En el grupo de terapia guiada, los pacientes con ERGE fueron tratados con dexlansoprazol 30 mg/día y los pacientes con HR o DTF recibieron teofilina 250 mg/día. En el grupo empírico se administró dexlansoprazol 60 mg/día. El estudio demostró que la terapia guiada fue más eficaz que la terapia empírica en reducir las puntuaciones de dolor torácico global en la octava semana (p = 0.005).112
El tratamiento de la ERGE puede abordarse también mediante terapias endoscópicas (radiofrecuencia no ablativa y funduplicatura transoral sin incisión) y quirúrgicas (funduplicatura) aunque existe escasa evidencia sobre el papel de las mismas en los pacientes con DTNC.
DTNC relacionado con trastornos motores esofágicos
En pacientes con dolor torácico como síntoma predominante, con sospecha de hipersensibilidad visceral superpuesta, la neuromodulación puede ser más eficaz que el tratamiento específico sobre la dismotilidad esofágica.
En pacientes con DTNC asociado a TME espásticos (acalasia tipo III, EED y esófago hipercontráctil) se han utilizado relajantes del músculo liso como nitratos, bloqueantes de canales de calcio (nifedipina y diltiazem) e inhibidores de la 5-fosfodiesterasa (sildenafil). La mayoría de los estudios realizados incluyen muestras pequeñas y muy pocos son ECA bien diseñados. La eficacia de estos fármacos es limitada y se utilizan muy poco en la práctica clínica debido a sus efectos adversos (cefalea, mareos, hipotensión).21,113–115 Pueden indicarse en pacientes que no son candidatos a otros tratamientos o como terapia puente mientras se decide una terapia definitiva.1
Los TME espásticos pueden abordarse mediante tratamientos endoscópicos como inyección de toxina botulínica A en el del cuerpo esofágico, dilatación esofágica y miotomía peroral endoscópica (POEM) o quirúrgicos como miotomía de Heller. La evidencia actual sobre estas terapias es escasa pero creciente en los últimos años.
En relación a la inyección endoscópica de toxina botulínica A, estudios abiertos sugieren una mejoría significativa del dolor torácico en pacientes con TME. La recaída de los síntomas se puede tratar de manera eficaz con la aplicación posterior de más inyecciones.116, 117 Storr y col. evaluaron a 9 pacientes con dolor torácico y espasmo esofágico difuso diagnosticado mediante manometría convencional. Inyectaron 10 ml de toxina botulínica (10 UI/ml) en fracciones de 1 ml. Comenzaron a la altura del EEI y se extendieron proximalmente por la la pared posterior del esófago (hora 3 del campo endoscópico) a intervalos de 1 a 1,5 cm. La puntuación de dolor torácico de los pacientes disminuyó de un valor basal de 3 a 1 al mes del tratamiento y a 0 a los 6 meses del mismo (p < 0,01).116 Miller y col. evaluaron a 29 pacientes con TME espásticos no relacionados con acalasia. Demostraron que la inyección de toxina botulínica a la altura de la unión esófago gástrica logró una reducción significativa en la puntuació de dolor torácico (3,7 vs. 0,78; p < 0,0001) con una duración media del efecto de 7,3 ± 4,1 meses.117 En un ensayo prospectivo aleatorizado doble ciego realizado en 22 pacientes con EED y esófago nutcracker se realizaron inyecciones de toxina botulínica o solución fisiológica en 4 cuadrantes, a 2 y 7 cm por encima de la unión esófago gástrica. Se demostró mejoría de la disfagia sin efecto significativo sobre las puntuaciones de dolor torácico (1,9 ± 0,4 vs 1,0 ± 0,4; p = 0.43).118
Existe poca evidencia con respecto a la dilatación esofágica en el manejo del DTNC relacionado con TME espásticos.119-120
El tratamiento con POEM ha demostrado buenos resultados en pacientes con EED, esófago hipercontráctil y acalasia tipo III. En una serie prospectiva de 100 pacientes con TME tratados con POEM en un centro médico; el 91,5% de los pacientes que se presentaron con dolor torácico informaron la resolución del síntoma luego del tratamiento.121 Debido a la capacidad de esta técnica de extender la miotomía de forma proximal sobre el esófago, se considera la primera línea de tratamiento en pacientes con acalasia tipo III con tasas de respuesta superiores en comparación con la miotomía de Heller (93% vs. 71%).122 Un metanálisis de 8 estudios observacionales con un total de 179 pacientes (116 con acalasia tipo III, 37 con esófago Jackhammer, 18 con EED y 8 con esfínter esofágico inferior hipertensivo) demostró una tasa de respuesta global del tratamiento con POEM del 87%, con una tasa de respuesta promedio en acalasia tipo III, EED y esófago Jackhammer de 92%, 88% y 72% respectivamente.123 Un estudio retrospectivo multicéntrico evaluó pacientes con EED (17) y esófago Jackhammer (18) que fueron tratados con POEM. El estudio evidenció una mejoría del dolor torácico en el 87% de los pacientes.124 Albers y col. llevaron a cabo un estudio prospectivo para evaluar la eficacia de POEM en DTNC en 14 pacientes con TME espásticos (7 con acalasia tipo III, 6 con esófago hipercontráctil y 1 con EED). El 86% de los pacientes mostraron una mejoría sintomática después del tratamiento.125 Si bien el tratamiento con POEM representa una opción terapéutica prometedora, son necesarios ECA con seguimiento a largo plazo para determinar su verdadero papel en el tratamiento del DTNC relacionado con TME espásticos.
La miotomía de Heller puede representar un tratamiento quirúrgico eficaz en algunos pacientes con DTNC relacionado con TME espásticos. Leconte y col. realizaron una miotomía quirúrgica extendida en 20 pacientes con EED y evidenciaron una mejoría de la disfagia y del dolor torácico en el 100% y en el 90% de los pacientes respectivamente, durante un seguimiento de 50 meses.126
En cuanto al manejo de la EJGOO clínicamente significativa, la dilatación endoscópica estándar puede generar mejoría sintomática con una tasa de respuesta del 69,6%; mientras que la inyección de toxina botulínica A en el esfínter esofágico inferior demostró una tasa de respuesta del 63,6%.127 En una cohorte de 33 pacientes con EJGOO la dilatación neumática tuvo una tasa de respuesta del 66,7% con un seguimiento de hasta 1,7 años.128 El tratamiento con POEM se evaluó en series de casos con muy pocos pacientes en las que se observó una resolución sintomática del 82% al 93%, con una media de seguimiento de 195 días.124,129 Como abordaje terapéutico inicial de la EJGOO se recomiendan la inyección de toxina botulínica o la dilatación endoscópica.130
DTNC relacionado con hipersensibilidad esofágica
Las modalidades terapéuticas disponibles para pacientes con hipersensibilidad esofágica son: fármacos (principalmente neuromoduladores), terapias psicológicas y medicina alternativa.131 Dichas opciones deben tenerse en cuenta en pacientes con DTF o HR al igual que en aquellos con superposición de hipersensibilidad esofágica con ERGE o con TME.
Los neuromoduladores son la base del tratamiento de los pacientes con hipersensibilidad visceral. Se trata de fármacos, en su mayoría antidepresivos, que actúan sobre las vías sensitivas periféricas o centrales modificando el umbral sensitivo. Su uso se debe adaptar a cada paciente, es conveniente explicar el mecanismo de acción y los potenciales efectos adversos para favorecer la adherencia al tratamiento e inducir la respuesta deseada. Se debe comenzar con dosis bajas que se irán aumentando gradualmente hasta obtener una respuesta clínica. Su efecto máximo se alcanza a las 8 a 12 semanas.1
Los neuromoduladores más estudiados en DTF son los antidepresivos tricíclicos (ATC), los inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y noradrenalina.
Antidepresivos tricíclicos:
El efecto analgésico de los ATC probablemente se deba a la inhibición combinada de la recaptación de serotonina y noradrenalina.132 La imipramina se evaluó en 2 ECA doble ciego en pacientes con DTNC. El primero de estos estudios comparó 50 mg/día de imipramina con 0,1 mg/día de clonidina o placebo. Sólo la imipramina demostró una reducción significativa en la frecuencia del dolor en comparación con el placebo. Tanto la imipramina como la clonidina mostraron una reducción significativa en la intensidad del dolor en comparación con el placebo.133 El segundo estudio comparó 50 mg/día de imipramina con placebo en forma cruzada. Los autores demostraron que el número total de episodios de dolor torácico fue significativamente menor en el grupo de imipramina en comparación con el grupo de placebo (p = 0,01).134
En los TFE los ATC se administran a la hora de acostarse, en dosis que no modifican el estado de ánimo y que pueden aumentarse gradualmente hasta obtener el efecto deseado.135-136 Si el paciente presenta efectos adversos, se puede comenzar con una dosis más baja del mismo ATC o cambiar por otro fármaco del mismo grupo.131
Los efectos adversos se presentan en el 30% al 100% de los pacientes;137 incluyen mareos, somnolencia, retención urinaria, boca seca, estreñimiento, visión borrosa, rubor, hipotensión ortostática, disfunción sexual, arritmias y aumento de peso.135-136 Deben prescribirse con precaución en varones de edad avanzada, especialmente si presentan hipertrofia prostática benigna o enfermedad cardiovascular, y deben evitarse en pacientes con bloqueo de rama cardíaca o intervalo QT prolongado.132
Inhibidores selectivos de la recaptación de serotonina:
Los ISRS bloquean selectivamente el transportador presináptico de la serotonina y aumentan su neurotransmisión.132
Un metanálisis de todos los ECA que compararon ISRS frente a placebo en pacientes con DTNC demostró que los ISRS no fueron mejores que el placebo en cuanto a la mejoría del dolor torácico.138
La paroxetina se evaluó en 2 ECA doble ciego que no demostraron una mejoría significativa en el dolor torácico. En el primer estudio, los pacientes con DTNC que recibieron paroxetina en una dosis media de 30 mg/día durante 8 semanas tuvieron una mejoría significativa en la percepción clínica global pero no en la puntuación específica de la percepción del dolor torácico en comparación con los que recibieron placebo.132,139 En el segundo estudio, 69 pacientes con DTNC fueron asignados al azar a 16 semanas de tratamiento ambulatorio con terapia cognitivo conductual (TCC), paroxetina o placebo. La comparación entre paroxetina y placebo se realizó de forma doble ciego y no evidenció una diferencia estadísticamente significativa en la reducción del dolor torácico. La TCC fue significativamente mejor en comparación con la paroxetina y con el placebo para reducir el dolor.140
La sertralina fue evaluada en 2 ECA doble ciego en pacientes con DTNC. En el primero se administró en dosis de 50 a 200 mg/día según la respuesta clínica y evidenció una disminución significativa de las puntuaciones de dolor torácico en comparación con el placebo (p < 0.02).141 El segundo estudio comparó placebo con tres tratamientos activos: TCC más sertralina, TCC más placebo y sertralina sola. Todos los tratamientos activos dieron como resultado mayores reducciones en la intensidad del dolor en comparación con el placebo (p ≤ 0,001) con efectos similares entre ellos (p > 0,50). Estos hallazgos sugieren que la TCC y la sertralina, ya sean solas o combinadas, pueden reducir de manera sostenida la intensidad del dolor.142
Los efectos adversos de los ISRS incluyen: náuseas, vómitos, anorexia, diarrea, disminución de la libido, retraso de la eyaculación, somnolencia, insomnio, fatiga, cefalea e hiperhidrosis.136
Inhibidores de la recaptación de serotonina y noradrenalina:
Este grupo de fármacos tiene un efecto de bloqueo variable sobre la recaptación de serotonina y noradrenalina, lo que refuerza la neurotransmisión de estas sustancias.132 Debido a la falta de efecto antimuscarínico tiene menos efectos adversos indeseables.143
La venlafaxina se evaluó en un ECA que comparó en forma cruzada 75 mg/día de este fármaco a la hora de acostarse con placebo en pacientes con DTF. Se observó una mejoría del dolor en el 52% de los pacientes que recibieron venlafaxina en comparación con el 4% de los que recibieron placebo (OR 26, IC 95%: 5,7-118,8; p < 0,001). Los efectos adversos más frecuentes fueron trastornos del sueño.144
Otros fármacos:
El citalopram ha demostrado eficacia en el tratamiento de la hipersensibilidad esofágica en un ECA.145 Se ha demostrado que este fármaco tiene diversos efectos sobre la fisiología esofágica con aumento de las presiones en la unión esofagogástrica, reducción de las relajaciones transitorias del EEI y de los eventos de reflujo. También se ha asociado con presiones elevadas del esfínter esofágico superior y sensación de globus, por lo que debe usarse con precaución en pacientes con globus asociado.146
La teofilina, un antagonista de la adenosina que relaja el músculo liso y tiene propiedades analgésicas viscerales, fue evaluada en dos estudios del grupo de Rao. Los autores demostraron que este fármaco aumentó los umbrales de percepción del dolor en pacientes sometidos a distensión esofágica con balón.147-148 A su vez, evidenciaron que disminuyó de forma significativa el número de episodios de dolor torácico (p = 0,025), su duración (p = 0,002) y su intensidad (p = 0,031) en comparación con el placebo, administrada en dosis de 200 mg dos veces al día durante 4 semanas. Como efectos adversos se observaron insomnio, náuseas, palpitaciones y temblores.147 Aunque los resultados sugieren un potencial uso de este fármaco en el DTNC, su rango terapéutico es estrecho lo que limita su uso en la práctica clínica.
El dronabinol es un agonista sintético de los receptores de cannabinoides CB1 y CB2 que ha demostrado un efecto antinociceptivo visceral.149 Un estudio piloto controlado, con placebo, doble ciego, incluyó a 19 pacientes con DTF que recibieron dronabinol (5 mg, dos veces al día) o placebo durante 4 semanas. El fármaco aumentó de forma significativa los umbrales de dolor en diferentes secuencias de insuflación del balón (3,0 vs. 1,0; p = 0,03) y redujo de forma significativa la intensidad del dolor torácico en comparación con el placebo (0,18 vs. 0,01; p = 0,04), sin efectos adversos significativos.149-150 Se necesitan más estudios con mayor número de pacientes para corroborar estos hallazgos.
Terapias psicológicas:
Se han utilizado TCC, hipnoterapia, ejercicios de relajación y terapias basadas en mindfulness para el tratamiento de varios trastornos funcionales digestivos. Estas terapias pueden ser consideradas complementarias en el tratamiento de pacientes con trastornos funcionales esofágicos. Son especialmente útiles en pacientes con una respuesta inadecuada a los tratamientos médicos estándar.151
Una revisión de Cochrane de Kisely y col. de 17 ECA concluyó que las terapias psicológicas, especialmente la TCC y la hipnoterapia, pueden ser eficaces en el tratamiento del DTNC. Sin embargo, el análisis fue limitado debido al pequeño número de pacientes incluidos y a la heterogeneidad en los estudios.152
En la TCC los pacientes examinan sus creencias sobre los síntomas y realizan un proceso de modificación de las mismas, lo que favorece el desarrollo de mejores estrategias para el manejo de los síntomas. Un ECA comparó la TCC en un grupo de pacientes con DTNC y en un grupo control. Después de 3 meses de intervención, el grupo con TCC presentó una reducción significativa del número de días y de la gravedad del dolor en comparación con el grupo control.153
La hipnoterapia parece modular los patrones de activación cerebral asociados al procesamiento del dolor.154 En trastornos funcionales digestivos el objetivo es inducir un estado de relajación profunda con el fin de guiar a los pacientes en el ejercicio de algún control sobre su función digestiva.155 En un ECA realizado en pacientes con DTNC, la hipnoterapia demostró una reducción en las puntuaciones globales de dolor en el 80% de los pacientes en comparación con un 23% de respuesta en el grupo control (p = 0,008).156-157
Conclusión
El dolor retroesternal se puede considerar de origen no cardíaco sólo si la etiología cardiovascular ha sido descartada objetivamente por un cardiólogo, con los exámenes complementarios adecuados, según el riesgo de cada paciente. Dentro de las causas no cardíacas de dolor retroesternal, las esofágicas ocupan el primer lugar. Es fundamental realizar una evaluación diagnóstica exhaustiva de los pacientes con dolor torácico no cardiogénico con el fin de detectar una etiología específica. Esto permitirá realizar el reaseguro de los pacientes y brindar un tratamiento específico para alcanzar un mejor control del síntoma y mejorar su calidad de vida. Las comorbilidades psicológicas pueden alterar la percepción sensorial y contribuir a la severidad de los síntomas por lo que deben tenerse en cuenta en el abordaje diagnóstico y terapéutico.
Propiedad intelectual. Los autores declaran que los datos presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Manresa M M, Carboné P C y Diez G. Abordaje del paciente con dolor torácico no cardiogénico de origen esofágico. Acta Gastroenterol Latinoam. 2022;52(4):424-438. https://doi.org/10.52787/agl.v52i4.276
Referencias
- Gómez-Escudero O, Coss-Adame E, Amieva-Balmori M, et al. Consenso mexicano sobre dolor torácico no cardiaco. Revista de Gastroenterología de México 2019;84:372-397.
- Fass R, Achem SR. Noncardiac chest pain: epidemiology, natural course and pathogenesis. J Neurogastroenterol Motil 2011;17:110-123.
- Committee Members W, Gulati M, Levy PD. AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR guideline for the evaluation and diagnosis of chest pain: a report of the American College of Cardiology/American Heart… Journal of the American, https://www.jacc.org/doi/abs/10.1016/j.jacc.2021.07.053 (2021)
- Manterola C, Barroso MS, Losada H, et al. Prevalence of esophageal disorders in patients with recurrent chest pain. Dis Esophagus 2004;17:285-291.
- Wong WM, Lam KF, Cheng C, et al. Population based study of noncardiac chest pain in southern Chinese: prevalence, psychosocial factors and health care utilization. World J Gastroenterol 2004;10:707-712.
- Eslick GD, Coulshed DS, Talley NJ. Review article: the burden of illness of non-cardiac chest pain. Aliment Pharmacol Ther 2002;16:1217-1223.
- Ford AC, Suares NC, Talley NJ. Meta-analysis: the epidemiology of noncardiac chest pain in the community. Aliment Pharmacol Ther 2011;34:172-180.
- Chiocca JC, Olmos JA, Salis GB, et al. Prevalence, clinical spectrum and atypical symptoms of gastro-oesophageal reflux in Argentina: a nationwide population-based study. Aliment Pharmacol Ther 2005;22:331-342.
- Eslick GD, Jones MP, Talley NJ. Non-cardiac chest pain: prevalence, risk factors, impact and consulting-a population-based study. Aliment Pharmacol Ther 2003;17:1115-1124.
- Al-Ani M, Winchester DE. Prevalence and Overlap of Noncardiac Conditions in the Evaluation of Low-risk Acute Chest Pain Patients. Crit Pathw Cardiol 2015;14:97-102.
- Fass R, Fennerty MB, Johnson C, et al. Correlation of ambulatory 24-hour esophageal pH monitoring results with symptom improvement in patients with noncardiac chest pain (NCCP) due to gastroesophageal reflux disease (GERD). Gastroenterology 1998;114:A751.
- Dickman R, Emmons S, Cui H, et al. The effect of a therapeutic trial of high-dose rabeprazole on symptom response of patients with non-cardiac chest pain: a randomized, double-blind, placebo-controlled, crossover trial. Alimentary Pharmacology and Therapeutics 2005;22:547-555.
- Aziz Q, Fass R, Prakash Gyawali C, et al. Esophageal Disorders. Gastroenterology 2016;150:1368-1379.
- Fass R, Dickman R. Non-cardiac chest pain: an update. Neurogastroenterology and Motility 2006;18:408-417.
- Dellon ES, Liacouras CA, Molina-Infante J, et al. Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference. Gastroenterology 2018;155:1022-1033.e10.
- Achem SR, Almansa C, Krishna M, et al. Oesophageal eosinophilic infiltration in patients with noncardiac chest pain. Aliment Pharmacol Ther 2011;33:1194-1201.
- Gibbs JF, Rajput A, Chadha KS, et al. The changing profile of esophageal cancer presentation and its implication for diagnosis. J Natl Med Assoc 2007;99:620-626.
- Sengupta JN. Esophageal sensory physiology. GI Motility online. Epub ahead of print 16 May 2006. DOI: 10.1038/gimo16
- Richter JE, Bradley LA, Castell DO. Esophageal chest pain: current controversies in pathogenesis, diagnosis, and therapy. Ann Intern Med 1989;110:66-78.
- Paterson WG, Abdollah H, Beck IT, et al. Ambulatory esophageal manometry, pH-metry, and Holter ECG monitoring in patients with atypical chest pain. Dig Dis Sci 1993;38:795-802.
- Richter JE, Dalton CB, Bradley LA, et al. Oral nifedipine in the treatment of noncardiac chest pain in patients with the nutcracker esophagus. Gastroenterology 1987;93:21-28.
- Cannon RO 3rd, Benjamin SB. Chest pain as a consequence of abnormal visceral nociception. Dig Dis Sci 1993;38:193-196.
- Barish CF, Castell DO, Richter JE. Graded esophageal balloon distention. Dig Dis Sci 1986;31:1292-1298.
- Richter JE, Barish CF, Castell DO. Abnormal sensory perception in patients with esophageal chest pain. Gastroenterology 1986;91:845-852.
- Deschner WK, Maher KA, Cattau EL Jr, et al. Intraesophageal balloon distention versus drug provocation in the evaluation of noncardiac chest pain. Am J Gastroenterol 1990;85:938-943.
- Rao SS, Gregersen H, Hayek B, et al. Unexplained chest pain: the hypersensitive, hyperreactive, and poorly compliant esophagus. Annals of internal medicine 1996;124:950-958.
- Balaban DH, Yamamoto Y, Liu J, et al. Sustained esophageal contraction: a marker of esophageal chest pain identified by intraluminal ultrasonography. Gastroenterology 1999;116:29-37.
- Pehlivanov N, Liu J, Mittal RK. Sustained esophageal contraction: a motor correlate of heartburn symptom. Am J Physiol Gastrointest Liver Physiol 2001;281:G743-51.
- Mackenzie J, Land D, Belch J, et al. OESOPHAGEAL ISCHAEMIA IN MOTILITY DISORDERS ASSOCIATED WITH CHEST PAIN. Lancet 1988;332:592-595.
- McIntosh K, Paterson WG. Sustained esophageal longitudinal smooth muscle contraction may not be a cause of noncardiac chest pain. Neurogastroenterol Motil 2018;30:e13428.
- Yamasaki T, Fass R. Noncardiac chest pain: diagnosis and management. Curr Opin Gastroenterol 2017;33:293-300.
- Eslick GD, Coulshed DS, Talley NJ. Diagnosis and treatment of noncardiac chest pain. Nat Clin Pract Gastroenterol Hepatol 2005; 2:463-472.
- Fass R, Achem SR. Noncardiac chest pain: diagnostic evaluation. Dis Esophagus 2012;25:89-101.
- Fenster PE. Evaluation of chest pain: a cardiology perspective for gastroenterologists. Gastroenterol Clin North Am 2004;33:35-40.
- Pandak WM, Arezo S, Everett S, et al. Short course of omeprazole: a better first diagnostic approach to noncardiac chest pain than endoscopy, manometry, or 24-hour esophageal pH monitoring. J Clin Gastroenterol 2002;35:307-314.
- Achem SR, Kolts BE, Wears R, et al. Chest pain associated with nutcracker esophagus: a preliminary study of the role of gastroesophageal reflux. Am J Gastroenterol 1993;88:187-192.
- Achem SR, Kolts BE, MacMath T, et al. Effects of omeprazole versus placebo in treatment of noncardiac chest pain and gastroesophageal reflux. Dig Dis Sci 1997;42:2138-2145.
- Gasiorowska A, Fass R. The proton pump inhibitor (PPI) test in GERD: does it still have a role? J Clin Gastroenterol 2008;42: 867-874.
- Schindlbeck NE, Klauser AG, Voderholzer WA, et al. Empiric therapy for gastroesophageal reflux disease. Arch Intern Med 1995;155:1808-1812.
- Fass R, Fennerty MB, Ofman JJ, et al. The clinical and economic value of a short course of omeprazole in patients with noncardiac chest pain. Gastroenterology 1998;115:42-49.
- Johnsson F, Weywadt L, Solhaug J-H, et al. One-week omeprazole treatment in the diagnosis of gastro-oesophageal reflux disease. Scand J Gastroenterol 1998;33:15-20.
- Fass R, Ofman JJ, Gralnek IM, et al. Clinical and economic assessment of the omeprazole test in patients with symptoms suggestive of gastroesophageal reflux disease. Arch Intern Med 1999;159:2161-2168.
- Bate CM, Riley SA, Chapman RW, et al. Evaluation of omeprazole as a cost-effective diagnostic test for gastro-oesophageal reflux disease. Aliment Pharmacol Ther 1999;13:59-66.
- Fass R, Ofman JJ, Sampliner RE, et al. The omeprazole test is as sensitive as 24-h oesophageal pH monitoring in diagnosing gastro-oesophageal reflux disease in symptomatic patients with erosive oesophagitis. Aliment Pharmacol Ther 2000;14:389-396.
- Fass R. Empirical trials in treatment of gastroesophageal reflux disease. Dig Dis 2000;18:20-26.
- Juul-Hansen P, Rydning A, Jacobsen CD, et al. High-dose proton-pump inhibitors as a diagnostic test of gastro-oesophageal reflux disease in endoscopic-negative patients. Scand J Gastroenterol 2001;36:806-810.
- Xia HHX, Lai KC, Lam SK, et al. Symptomatic response to lansoprazole predicts abnormal acid reflux in endoscopy-negative patients with non-cardiac chest pain. Aliment Pharmacol Ther 2003;17:369-377.
- Husser D, Bollmann A, Kühne C, et al. Evaluation of noncardiac chest pain: diagnostic approach, coping strategies and quality of life. Eur J Pain 2006;10:51-55.
- Kim JH, Sinn DH, Son HJ, et al. Comparison of one-week and two-week empirical trial with a high-dose rabeprazole in non-cardiac chest pain patients. Journal of Gastroenterology and Hepatology 2009;24:1504-1509.
- Flook NW, Moayyedi P, Dent J, et al. Acid-Suppressive Therapy With Esomeprazole for Relief of Unexplained Chest Pain in Primary Care: A Randomized, Double-Blind, Placebo-Controlled Trial. American Journal of Gastroenterology 2013;108:56-64.
- Cremonini F, Wise J, Moayyedi P, et al. Diagnostic and Therapeutic Use of Proton Pump Inhibitors in Non-Cardiac Chest Pain: A Metaanalysis. The American Journal of Gastroenterology 2005;100:1226-1232.
- Wang WH, Huang JQ, Zheng GF, et al. Is Proton Pump Inhibitor Testing an Effective Approach to Diagnose Gastroesophageal Reflux Disease in Patients With Noncardiac Chest Pain? Archives of Internal Medicine 2005;165:1222.
- Wertli MM, Ruchti KB, Steurer J, et al. Diagnostic indicators of non-cardiovascular chest pain: a systematic review and meta-analysis. BMC Medicine; 11. Epub ahead of print 2013. DOI: 10.1186/1741-7015-11-239
- Ghoneim S, El Hage Chehade N, Wang J, et al. S412 Diagnostic Accuracy of the Proton Pump Inhibitor Test in Patients With Gastroesophageal Reflux Disease and Non-Cardiac Chest Pain: A Systematic Review and Meta-Analysis. American Journal of Gastroenterology 2021;116:S182-S183.
- Yadlapati R, Prakash Gyawali C, Pandolfino JE, et al. AGA Clinical Practice Update on the Personalized Approach to the Evaluation and Management of GERD: Expert Review. Clinical Gastroenterology and Hepatology 2022;20:984-994.e1.
- Vela MF. Diagnostic Work-Up of GERD. Gastrointestinal Endoscopy Clinics of North America 2014;24:655-666.
- Sharma VK. Role of endoscopy in GERD. Gastroenterol Clin North Am 2014;43:39-46.
- ASGE Standards of Practice Committee, Muthusamy VR, Lightdale JR, et al. The role of endoscopy in the management of GERD. Gastrointest Endosc 2015;81:1305-1310.
- Hsia PC, Maher KA, Lewis JH, et al. Utility of upper endoscopy in the evaluation of noncardiac chest pain. Gastrointest Endosc 1991;37:22-26.
- Frøbert O, Funch-Jensen P, Jacobsen NO, et al. Upper endoscopy in patients with angina and normal coronary angiograms. Endoscopy 1995;27:365-370.
- García-Compeán D, González M, Galindo G, et al. Prevalence of gastroesophageal reflux disease in patients with extraesophageal symptoms referred from otolaryngology, allergy, and cardiology practices: a … Digestive, https://www.karger.com/Article/Abstract/51392 (2000).
- Wong W-M, Lai KC, Lau CP, et al. Upper gastrointestinal evaluation of Chinese patients with non-cardiac chest pain. Aliment Pharmacol Ther 2002;16:465-471.
- Battaglia E, Bassotti G, Buonafede G, et al. Noncardiac chest pain of esophageal origin in patients with and without coronary artery disease. Hepatogastroenterology 2005;52:792-795.
- Dickman R, Mattek N, Holub J, et al. Prevalence of upper gastrointestinal tract findings in patients with noncardiac chest pain versus those with gastroesophageal reflux disease (GERD)-related symptoms: results from a national endoscopic database. Am J Gastroenterol 2007;102:1173-1179.
- Williams JF, Sontag SJ, Schnell T, et al. Non-cardiac chest pain: the long-term natural history and comparison with gastroesophageal reflux disease. Am J Gastroenterol 2009;104:2145-2152.
- Katz PO, Dunbar KB, Schnoll-Sussman FH, et al. ACG Clinical Guideline for the Diagnosis and Management of Gastroesophageal Reflux Disease. Am J Gastroenterol 2022;117:27-56.
- Gyawali CP, Kahrilas PJ, Savarino E, et al. Modern diagnosis of GERD: the Lyon Consensus. Gut 2018;67:1351-1362.
- Kim HP, Vance RB, Shaheen NJ, et al. The prevalence and diagnostic utility of endoscopic features of eosinophilic esophagitis: a meta-analysis. Clin Gastroenterol Hepatol 2012;10:988-96.e5.
- Dunbar KB, Agoston AT, Odze RD, et al. Association of Acute Gastroesophageal Reflux Disease With Esophageal Histologic Changes. JAMA 2016;315:2104-2112.
- Odiase E, Schwartz A, Souza RF, et al. New Eosinophilic Esophagitis Concepts Call for Change in Proton Pump Inhibitor Management Before Diagnostic Endoscopy. Gastroenterology 2018;154:1217-1221.e3.
- Pandolfino JE, Kahrilas PJ. Prolonged pH monitoring: Bravo capsule. Gastrointest Endosc Clin N Am 2005;15:307-318.
- Roman S, Gyawali CP, Savarino E, et al. Ambulatory reflux monitoring for diagnosis of gastro-esophageal reflux disease: Update of the Porto consensus and recommendations from an international consensus group. Neurogastroenterol Motil 2017;29:e13067.
- Lacima G, Grande L, Pera M, et al. Utility of ambulatory 24-hour esophageal pH and motility monitoring in noncardiac chest pain: report of 90 patients and review of the literature. Dig Dis Sci 2003;48:952-961.
- Streets CG, DeMeester TR. Ambulatory 24-hour esophageal pH monitoring: why, when, and what to do. J Clin Gastroenterol 2003;37:14-22.
- Demeester TR, O’sullivan GC, Bermudez G, et al. Esophageal Function in Patients with Angina-Type Chest Pain and Normal Coronary Angiograms. Annals of Surgery 1982;196:488-498.
- de Caestecker JS, Blackwell JN, Brown J, et al. The oesophagus as a cause of recurrent chest pain: which patients should be investigated and which tests should be used? Lancet 1985;2:1143-1146.
- Janssens J, Vantrappen G, Ghillebert G. 24-hour recording of esophageal pressure and pH in patients with noncardiac chest pain. Gastroenterology 1986;90:1978-1984.
- Schofield PM, Bennett DH, Whorwell PJ, et al. Exertional gastro-oesophageal reflux: a mechanism for symptoms in patients with angina pectoris and normal coronary angiograms. Br Med J 1987;294:1459-1461.
- Hewson EG, Dalton CB, Richter JE. Comparison of esophageal manometry, provocative testing, and ambulatory monitoring in patients with unexplained chest pain. Dig Dis Sci 1990;35:302-309.
- Hewson EG, Sinclair JW, Dalton CB, et al. Twenty-four-hour esophageal pH monitoring: the most useful test for evaluating noncardiac chest pain. Am J Med 1991;90:576-583.
- Prakash C, Clouse RE. Wireless pH monitoring in patients with non-cardiac chest pain. Am J Gastroenterol 2006;101:446-452.
- Prakash C, Jonnalagadda S, Azar R, et al. Endoscopic removal of the wireless pH monitoring capsule in patients with severe discomfort. Gastrointest Endosc 2006;64:828-832.
- Herregods TVK, Bredenoord AJ, Oors JM, et al. Determinants of the Association between Non-Cardiac Chest Pain and Reflux. Am J Gastroenterol 2017;112:1671-1677.
- Ribolsi M, Balestrieri P, Biasutto D, et al. Role of Mixed Reflux and Hypomotility with Delayed Reflux Clearance in Patients with Non-cardiac Chest Pain. J Neurogastroenterol Motil 2016;22:606-612.
- Min YW, Choi K, Pyo JH, et al. Impaired Esophageal Mucosal Integrity May Play a Causative Role in Patients With Nongastroesophageal Reflux Disease-Related Noncardiac Chest Pain. Medicine 2015;94:e2295.
- Katz PO, Dalton CB, Richter JE, et al. Esophageal testing of patients with noncardiac chest pain or dysphagia. Results of three years’ experience with 1161 patients. Ann Intern Med 1987;106:593-597.
- Dekel R, Pearson T, Wendel C, et al. Assessment of oesophageal motor function in patients with dysphagia or chest pain – the Clinical Outcomes Research Initiative experience. Alimentary Pharmacology & Therapeutics 2003;18:1083-1089.
- Akinsiku O, Yamasaki T, Brunner S, et al. High resolution vs conventional esophageal manometry in the assessment of esophageal motor disorders in patients with non-cardiac chest pain. Neurogastroenterol Motil 2018;30:e13282.
- Lemme EM, Moraes-Filho JP, Domingues G, et al. Manometric findings of esophageal motor disorders in 240 Brazilian patients with non-cardiac chest pain. Dis Esophagus 2000;13:117-121.
- Yadlapati R, Kahrilas PJ, Fox MR, et al. Esophageal motility disorders on high-resolution manometry: Chicago classification version 4.0©. Neurogastroenterol Motil 2021;33:e14058.
- Gomez Cifuentes J, Lopez R, Thota PN. Factors predictive of gastroesophageal reflux disease and esophageal motility disorders in patients with non-cardiac chest pain. Scand J Gastroenterol 2018;53:643-649.
- Johnston BT, Troshinsky MB, Castell JA, et al. Comparison of barium radiology with esophageal pH monitoring in the diagnosis of gastroesophageal reflux disease. Am J Gastroenterol 1996;91:1181-1185.
- Roman S, Kahrilas PJ. Distal Esophageal Spasm. Dysphagia 2012;27:115-123.
- Schima W, Stacher G, Pokieser P, et al. Esophageal motor disorders: videofluoroscopic and manometric evaluation–prospective study in 88 symptomatic patients. Radiology 1992;185:487-491.
- Neyaz Z, Gupta M, Ghoshal UC. How to Perform and Interpret Timed Barium Esophagogram. Journal of Neurogastroenterology and Motility 2013;19:251-256.
- Min YW, Rhee P-L. Esophageal hypersensitivity in noncardiac chest pain. Ann N Y Acad Sci 2016;1380:27-32.
- Bernstein LM, Baker LA. A Clinical Test For Esophagitis. Gastroenterology 1958;34:760-781.
- Fass R, Naliboff B, Higa L, et al. Differential effect of long-term esophageal acid exposure on mechanosensitivity and chemosensitivity in humans. Gastroenterology 1998;115:1363-1373.
- Nasr I, Attaluri A, Coss-Adame E, et al. Diagnostic utility of the oesophageal balloon distension test in the evaluation of oesophageal chest pain. Alimentary Pharmacology & Therapeutics 2012;35:1474-1481.
- Nasr I, Attaluri A, Hashmi S, et al. Investigation of esophageal sensation and biomechanical properties in functional chest pain. Neurogastroenterology & Motility. Epub ahead of print 2010. DOI: 10.1111/j.1365-2982.2009.01451.x
- Drewes AM, Schipper K-P, Dimcevski G, et al. Multi-modal induction and assessment of allodynia and hyperalgesia in the human oesophagus. European Journal of Pain 2003;7:539-549.
- Clouse RE, Carney RM. The psychological profile of non-cardiac chest pain patients. Eur J Gastroenterol Hepatol 1995;7:1160-1165.
- Campbell KA, Madva EN, Villegas AC, et al. Non-cardiac Chest Pain: A Review for the Consultation-Liaison Psychiatrist. Psychosomatics 2017;58:252-265.
- Ortiz-Olvera NX, González-Martínez M, Ruiz-Flores LG, et al. [Causes of non-cardiac chest pain: multidisciplinary perspective]. Rev Gastroenterol Mex 2007;72:92-99.
- Clouse RE, Lustman PJ. Psychiatric illness and contraction abnormalities of the esophagus. N Engl J Med 1983;309:1337-1342.
- Yamasaki T, Fass R. Noncardiac chest pain. Current Opinion in Gastroenterology 2017;33:293-300.
- Lima JJ, Franciosi JP. Pharmacogenomic testing: the case for CYP2C19 proton pump inhibitor gene-drug pairs. Pharmacogenomics 2014;15:1405-1416.
- Graham DY, Tansel A. Interchangeable Use of Proton Pump Inhibitors Based on Relative Potency. Clin Gastroenterol Hepatol 2018;16:800-808.e7.
- Bautista J, Fullerton H, Briseno M, et al. The effect of an empirical trial of high-dose lansoprazole on symptom response of patients with non-cardiac chest pain – a randomized, double-blind, placebo-controlled, crossover trial. Alimentary Pharmacology & Therapeutics 2004;19:1123-1130.
- Borjesson M, Rolny P, Mannheimer C, et al. Nutcracker oesophagus: a double-blind, placebo-controlled, cross-over study of the effects of lansoprazole. Alimentary Pharmacology & Therapeutics 2003;18:1129-1135.
- Burgstaller JM, Jenni BF, Steurer J, et al. Treatment Efficacy for Non-Cardiovascular Chest Pain: A Systematic Review and Meta-Analysis. PLoS ONE 2014;9:e104722.
- Abdul Kadir NP, Ma ZF, Abdul Hafidz MI, et al. Comparing Efficacy and Safety of Empirical vs. Guided Therapy for Non-cardiac Chest Pain: A Pragmatic Randomized Trial. Front Med 2021;8:605647.
- Konturek JW, Gillessen A, Domschke W. Diffuse Esophageal Spasm: A Malfunction That Involves Nitric Oxide? Scandinavian Journal of Gastroenterology 1995;30:1041-1045.
- Cattau EL Jr, Castell DO, Johnson DA, et al. Diltiazem therapy for symptoms associated with nutcracker esophagus. Am J Gastroenterol 1991;86:272-276.
- Fox M, Sweis R, Wong T, et al. Sildenafil relieves symptoms and normalizes motility in patients with oesophageal spasm: a report of two cases. Neurogastroenterol Motil 2007;19:798-803.
- Storr M, Allescher HD, Rösch T, et al. Treatment of symptomatic diffuse esophageal spasm by endoscopic injections of botulinum toxin: a prospective study with long-term follow-up. Gastrointest Endosc 2001;54:754-759.
- Miller LS, Pullela SV, Parkman HP, et al. Treatment of Chest Pain in Patients With Noncardiac, Nonreflux, Nonachalasia Spastic Esophageal Motor Disorders Using Botulinum Toxin Injection Into The Gastroesophageal Junction. American Journal of Gastroenterology 2002;97:1640-1646.
- Vanuytsel T, Bisschops R, Farré R, et al. Botulinum toxin reduces Dysphagia in patients with nonachalasia primary esophageal motility disorders. Clin Gastroenterol Hepatol 2013;11:1115-1121.e2.
- Winters C, Artnak EJ, Benjamin SB, et al. Esophageal bougienage in symptomatic patients with the nutcracker esophagus. A primary esophageal motility disorder. JAMA 1984;252:363-366.
- Irving JD, Owen WJ, Linsell J, et al. Management of diffuse esophageal spasm with balloon dilatation. Gastrointest Radiol 1992;17:189-192.
- Sharata AM, Dunst CM, Pescarus R, et al. Peroral endoscopic myotomy (POEM) for esophageal primary motility disorders: analysis of 100 consecutive patients. J Gastrointest Surg 2015;19:161-70; discussion 170.
- Andolfi C, Fisichella PM. Meta-analysis of clinical outcome after treatment for achalasia based on manometric subtypes. Br J Surg 2019;106:332-341.
- Khan MA, Kumbhari V, Ngamruengphong S, et al. Is POEM the Answer for Management of Spastic Esophageal Disorders? A Systematic Review and Meta-Analysis. Dig Dis Sci 2017;62:35-44.
- Khashab MA, Familiari P, Draganov PV, et al. Peroral endoscopic myotomy is effective and safe in non-achalasia esophageal motility disorders: an international multicenter study. Endosc Int Open 2018;6:E1031-E1036.
- Albers D, Frieling T, Dakkak D, et al. Peroral endoscopic myotomy (POEM) is effective in treatment of noncardiac chest pain caused by hypercontractile esophageal motility disorders: results of the POEM-HYPE-Study. Z Gastroenterol 2018;56:1337-1342.
- Leconte M, Douard R, Gaudric M, et al. Functional results after extended myotomy for diffuse oesophageal spasm. Br J Surg 2007;94:1113-1118.
- Zikos TA, Triadafilopoulos G, Clarke JO. Esophagogastric Junction Outflow Obstruction: Current Approach to Diagnosis and Management. Curr Gastroenterol Rep 2020;22:9.
- Clayton SB, Shin CM, Ewing A, et al. Pneumatic dilation improves esophageal emptying and symptoms in patients with idiopathic esophago-gastric junction outflow obstruction. Neurogastroenterol Motil 2019;31:e13522.
- Filicori F, Dunst CM, Sharata A, et al. Long-term outcomes following POEM for non-achalasia motility disorders of the esophagus. Surg Endosc 2019;33:1632-1639.
- Patel DA, Yadlapati R, Vaezi MF. Esophageal Motility Disorders: Current Approach to Diagnostics and Therapeutics. Gastroenterology 2022;162:1617-1634.
- Fass R, Shibli F, Tawil J. Diagnosis and Management of Functional Chest Pain in the Rome IV Era. Journal of Neurogastroenterology and Motility 2019;25:487-498.
- Drossman DA, Tack J, Ford AC, et al. Neuromodulators for Functional Gastrointestinal Disorders (Disorders of Gut−Brain Interaction): A Rome Foundation Working Team Report. Gastroenterology 2018;154:1140-1171.e1.
- Cannon RO, Quyyumi AA, Mincemoyer R, et al. Imipramine in Patients with Chest Pain Despite Normal Coronary Angiograms. New England Journal of Medicine 1994;330:1411-1417.
- Kaski JC, Cox ID, Robert Crook J, et al. Differential plasma endothelin levels in subgroups of patients with angina and angiographically normal coronary arteries. American Heart Journal 1998;136:412-417.
- Maradey-Romero C, Fass R. New therapies for non-cardiac chest pain. Curr Gastroenterol Rep 2014;16:390.
- Dickman R, Maradey-Romero C, Fass R. The role of pain modulators in esophageal disorders – no pain no gain. Neurogastroenterology & Motility 2014;26:603-610.
- Sindrup SH, Otto M, Finnerup NB, et al. Antidepressants in the treatment of neuropathic pain. Basic Clin Pharmacol Toxicol 2005;96:399-409.
- Atluri DK, Chandar AK, Fass R, et al. Systematic review with meta-analysis: selective serotonin reuptake inhibitors for noncardiac chest pain. Aliment Pharmacol Ther 2015;41:167-176.
- Doraiswamy PM, Varia I, Hellegers C, et al. A randomized controlled trial of paroxetine for noncardiac chest pain. Psychopharmacol Bull 2006;39:15-24.
- Spinhoven P, Van der Does AJW, Van Dijk E, et al. Heart-focused anxiety as a mediating variable in the treatment of noncardiac chest pain by cognitive-behavioral therapy and paroxetine. Journal of Psychosomatic Research 2010;69 227-235.
- Varia I, Logue E, O’Connor C, et al. Randomized trial of sertraline in patients with unexplained chest pain of noncardiac origin. American Heart Journal 2000;140:367-372.
- Keefe FJ, Shelby RA, Somers TJ, et al. Effects of coping skills training and sertraline in patients with non-cardiac chest pain: A randomized controlled study. Pain 2011;152:730-741.
- Gutierrez MA, Stimmel GL, Aiso JY. Venlafaxine: A 2003 update. Clinical Therapeutics 2003;25:2138-2154.
- Lee H, Kim JH, Min B-H, et al. Efficacy of Venlafaxine for Symptomatic Relief in Young Adult Patients With Functional Chest Pain: A Randomized, Double-Blind, Placebo-Controlled, Crossover Trial. American Journal of Gastroenterology 2010;105:1504-1512.
- Viazis N, Keyoglou A, Kanellopoulos AK, et al. Selective serotonin reuptake inhibitors for the treatment of hypersensitive esophagus: a randomized, double-blind, placebo-controlled study. Am J Gastroenterol 2012;107:1662-1667.
- Manolakis AC, Broers C, Geysen H, et al. Effect of citalopram on esophageal motility in healthy subjects-Implications for reflux episodes, dysphagia, and globus. Neurogastroenterol Motil 2019;31:e13632.
- Rao SSC, Mudipalli RS, Mujica V, et al. Digestive Diseases and Sciences. 2002;47:2763-2768.
- Rao SSC, Mudipalli RS, Remes-Troche JM, et al. Theophylline Improves Esophageal Chest Pain?A Randomized, Placebo-Controlled Study. The American Journal of Gastroenterology 2007;102:930-938.
- Jaggar SI, Hasnie FS, Sellaturay S, et al. The anti-hyperalgesic actions of the cannabinoid anandamide and the putative CB2 receptor agonist palmitoylethanolamide in visceral and somatic inflammatory pain. Pain 1998;76:189-199.
- Malik Z, Bayman L, Valestin J, et al. Dronabinol increases pain threshold in patients with functional chest pain: a pilot double-blind placebo-controlled trial. Dis Esophagus 2017;30:1-8.
- Keefer L, Palsson OS, Pandolfino JE. Best Practice Update: Incorporating Psychogastroenterology Into Management of Digestive Disorders. Gastroenterology 2018;154:1249-1257.
- Kisely SR, Campbell LA, Yelland MJ, et al. Psychological interventions for symptomatic management of non-specific chest pain in patients with normal coronary anatomy. Cochrane Database Syst Rev 2015;CD004101.
- Jonsbu E, Dammen T, Morken G, et al. Short-term cognitive behavioral therapy for non-cardiac chest pain and benign palpitations: a randomized controlled trial. J Psychosom Res 2011;70:117-123.
- Riehl ME, Keefer L. Hypnotherapy for Esophageal Disorders. American Journal of Clinical Hypnosis 2015;58:22-33.
- Vasant DH, Whorwell PJ. Gut-focused hypnotherapy for Functional Gastrointestinal Disorders: Evidence-base, practical aspects, and the Manchester Protocol. Neurogastroenterol Motil 2019;31:e13573.
- Riehl ME, Pandolfino JE, Palsson OS, et al. Feasibility and acceptability of esophageal-directed hypnotherapy for functional heartburn. Diseases of the Esophagus 2016;29:490-496.
- Jones H. Treatment of non-cardiac chest pain: a controlled trial of hypnotherapy. Gut 2006;55:1403-1408.
Correspondencia: María Mercedes Manresa
Correo electrónico: dramercedesmanresa@gmail.com
Acta Gastroenterol Latinoam 2022;52(4):424-438
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE