Agustín Castillo Luna,1 Cristina Longo,1 Graciela Landeira,1 Adriana Fernández Lausi,2 Graciela Priore,2 Gisela Gualano,1 Nora Domínguez,1 Gabriela Ruffillo,1 Carolina Zulatto,1 Susana di Bartolomeo,2 Eduardo Fassio1
1 Sección Hepatología.
2 Sección Bacteriología. Laboratorio Central.
Hospital Nacional Prof. Alejandro Posadas. El Palomar, Provincia de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2017;47(4):243-251
Recibido: 22/10/2016 / Aprobado: 15/05/2017 / Publicado en www.actagastro.org el 18/12/2017
Resumen
En pacientes cirróticos, las infecciones bacterianas (IBs) pueden precipitar disfunción circulatoria, insuficiencia renal, encefalopatía, hemorragia variceal o muerte. Se ha propuesto que habría una incidencia creciente de IBs por bacterias multirresistentes (BMR) que tendrían peor pronóstico, menor respuesta a la terapia empírica y mayor mortalidad hospitalaria. Objetivo. Revisar la epidemiología de las IBs en un período de 3 años, evaluando la prevalencia de las IBs por BMR y su relación con el pronóstico. Material y métodos. Se analizaron 210 internaciones de pacientes cirróticos, edad media 53 años (rango: 17-80); 149 de sexo masculino. Se efectuaron cultivos bacterianos en las indicaciones habituales. Se analizó la asociación de IBs con variables categóricas por medio del test de Chi cuadrado y con variables cuantitativas por medio de la prueba de T para muestras independientes, considerándose a una p < 0,05 como de significancia estadística. Se investigó la asociación de IBs por BMR con las mismas variables y con óbito; y con la variable compuesta óbito y/o derivación para trasplante hepático. Resultados. Se constató IBs en 89 de las 210 internaciones (42%). Se obtuvo aislamiento bacteriano en 50 casos, en 8 por BMR (16%). La presencia de IBs se asoció en forma significativa con la clase de Child y el score de MELD, pero no con óbito durante la admisión ni óbito y/o derivación para trasplante. En cambio, la presencia de IBs por BMR se asoció en forma significativa tanto con óbito (25% versus 5% en IBs por bacterias no MR versus 4% en pacientes sin aislamiento bacteriano, p = 0,0225); como con óbito y/o derivación para trasplante (38% en pacientes con IBs por BMR versus 7% en IBs por bacterias no MR versus 7% en pacientes sin aislamiento, p = 0,0080). Conclusión. Se demostró una BMR en 16% de las IBs con aislamiento. Se enfatiza la implicancia pronóstica del problema, ya que las infecciones por BMR se asociaron a mayor mortalidad y/o necesidad de trasplante.
Palabras claves. Cirrosis, infecciones bacterianas, bacterias multirresistentes, pronóstico, mortalidad.
Infections by multiresistant bacteria in cirrhosis do modify prognosis of patients
Summary
In cirrhosis, bacterial infections (BIs) may trigger circulatory dysfunction, renal failure, variceal bleeding or even death. Furthermore, there would be an increasing incidence of BI by multiresistant bacteria (MRB) with a lower response to empirical therapy and higher mortality. Aim. To revise epidemiology of BIs in a 3-year period, prevalence of MRB and its association with outcomes. 210 admissions of cirrhotic patients [age median 53 years (range: 17-80) male gender in 149] were analyzed. Bacterial cultures were performed in the usual indications. Association of BIs and BIs by MRB with qualitative variables (gender, etiology of liver disease, HIV infection, ascites, Child class, etc.) was analyzed by using Chi2 test; and with quantitative variables (serum albumin, bilirubin, prothrombin activity, etc.) by using Student T test. Results. BIs were shown in 89 out of 210 (42%) admissions. There was bacterial isolation in 50 episodes, due to MRB in 8 cases (16%). Presence of BI was associated with Child class and MELD score but was not with mortality. In contrast, BI caused by MRB were significantly associated either with death (25% versus 5% in BI with not MRB and 4% in patients without BI, p = 0.0225); or with the composed variable death and/or referral for liver transplant (38% versus 7% in both, patients with BI by non-MRB and patients without BI, p = 0.0080). Conclusion. BIs by MRB were shown in 16% of cases with bacterial isolation and involved a poor prognosis, higher mortality or need for liver transplant.
Key words. Liver cirrhosis, bacterial infections, multiresistant bacteria, prognosis, death.
Abreviaturas
IBs: infecciones bacterianas.
PBE: peritonitis bacteriana espontánea.
TB: translocación bacteriana.
BGN: bacilos gram negativos.
CGP: cocos gram positivos.
CTG: cefalosporina de tercera generación.
BMR: bacterias multirresistentes.
BLEE: beta-lactamasa de espectro extendido.
SARM: Staphylococcus aureus resistente a meticilina.
VSE: Enterococcus sensible a vancomicina.
VRE: Enterococcus resistente a vancomicina.
HCV: virus de la hepatitis C.
HBV: virus de la hepatitis B.
MELD: model for end-stage liver disease.
ACS: asociadas al cuidado de la salud.
AC: adquiridas en la comunidad.
AST: aspartato aminotransferasa.
ALT: alanina aminotransferasa.
TMS: trimetoprima/sulfametoxasol.
En pacientes con cirrosis, las infecciones bacterianas (IBs) se asocian a progresión de la insuficiencia hepática y a mortalidad. Las IBs pueden ser un factor precipitante de hemorragia digestiva,1 empeoramiento de la disfunción circulatoria,2 encefalopatía hepática, insuficiencia renal3 e inducir una respuesta inflamatoria excesiva que podría contribuir al desarrollo de la insuficiencia hepática aguda sobre crónica y shock séptico.4-6 En pacientes cirróticos, los factores que están asociados con un mayor riesgo de tener una IB son la insuficiencia hepática, la hemorragia variceal, la disminución de la concentración de proteínas totales en el líquido ascítico, la historia de peritonitis bacteriana espontánea previa y la hospitalización.7
Las IBs están presentes al ingreso o se desarrollan durante la hospitalización en el 25 a 47% de los pacientes cirróticos.8-11 La incidencia de IBs durante la internación es 4-5 veces mayor que la observada en la población general,4 siendo los tipos más frecuentes la peritonitis bacteriana espontánea (PBE), las infecciones urinarias, la neumonía y la bacteriemia espontánea.4,12 En pacientes cirróticos hospitalizados con IBs la mortalidad es casi 4 veces mayor (30% al mes y 63% a los 12 meses) que en los cirróticos no infectados.13
La mayor incidencia de IBs en el paciente cirrótico se debe a múltiples factores que incluyen cambios en la microbiota intestinal (sobrecrecimiento bacteriano o disbiosis),14-16 aumento de la permeabilidad intestinal,17, 18 translocación bacteriana patológica19, 20 y alteraciones del sistema inmune (disminución de la capacidad de fagocitosis y quimiotaxis de los macrófagos y neutrófilos, disfunción del sistema retículo-endotelial hepático por la presencia de shunts portosistémicos que reducen la eliminación de las bacterias intestinales, disminución de síntesis de factores del complemento necesarios para la opsonización bacteriana, etcétera.).4
En años recientes, se han constatado cambios importantes en la epidemiología de las IBs en cirróticos, que pueden tener implicancias en el pronóstico de dichos pacientes y obligar a implementar modificaciones en la terapia antibiótica empírica. En los años ’80 y ‘90, se observaba que la mayor proporción de IBs en cirróticos eran adquiridas en la comunidad y la mayoría de ellas eran causadas por bacilos gram negativos (BGN) de origen intestinal.8, 21, 22 En un estudio publicado en 2002, Fernández y col. observaron que cocos gram positivos (CGP) habían sido los agentes etiológicos en el 53% de las infecciones bacterianas con cultivo positivo.9 Entre las IBs adquiridas en la comunidad, los BGN continuaban siendo la causa principal (60% de las infecciones con cultivo positivo). En cambio, entre las infecciones nosocomiales, los CGP eran los gérmenes más frecuentes (59% de las infecciones con cultivo positivo).9 Otro hallazgo importante de ese estudio fue que, entre los pacientes que venían recibiendo profilaxis con norfloxacina, el 50% de los episodios de PBE fueron causados por BGN resistentes a quinolonas.9 Sin embargo, la resistencia a las cefalosporinas de tercera generación (CTG), que constituyen la terapia empírica recomendada en pacientes cirróticos, no era aún frecuente, observándose en el 1,2% de las infecciones causadas por enterobacterias.9 Más recientemente, Fernández y col. reanalizaron la epidemiología de las IBs en cirróticos in-ternados en el Hospital Clìnic de Barcelona, encontrando que el 18% de los episodios eran causados por bacterias multirresistentes (BMR), más frecuentemente en las in-fecciones nosocomiales (35%) que en las adquiridas en la comunidad (4%).10 Como consecuencia, la eficacia de la terapia empírica actualmente recomendada (CTG) fue muy baja en las IBs nosocomiales (40%), significati-vamente menor que en las adquiridas en la comunidad (83%) (p < 0,001) y la mortalidad fue significativamente mayor en pacientes con IBs por BMR que en aquellos con IBs por bacterias sensibles o sin aislamiento (25% versus 12%, respectivamente) (p = 0,001).10
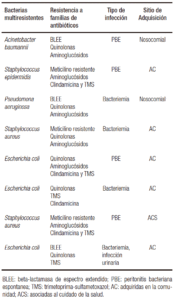
Las bacterias multirresistentes son patógenos resistentes a tres o más de las principales familias de antibióti-cos, incluyendo a los beta-lactámicos. Las más frecuentes son: enterobacterias productoras de beta-lactamasa de espectro extendido (BLEE) o, en idioma inglés, ESBL (extended-spectrum ß-lactamase) (Escherichia coli, Klebsiella pneumoniae, Enterobacter spp., Citrobacter spp.); BGN no fermentadores (Pseudomona aeruginosa, Acinetobacter baumannii); Staphylococcus aureus resistente a meticilina (SARM) o, en inglés, MRSA y Enterococcus faecium sen-sible o resistente a vancomicina (VSE o VRE).4 El patrón epidemiológico de las infecciones por BMR varía entre las distintas áreas geográficas e incluso entre distintos hospi-tales de la misma región.4
La prevalencia de las infecciones bacterianas por BMR en el paciente cirrótico está aumentando. En el Hospital Clìnic de Barcelona, fue de 10% en el período 1998-2000 y de 23% en el período 2010-2011.23 Sin embargo, existe alguna controversia sobre si tienen impacto en el pronóstico de los pacientes. En 3 estudios de Corea, España e Italia no se demostraron diferencias en la mortalidad de los pacientes con IBs por BMR;24-26 mientras que en diferentes publicaciones de los mismos países se observó una mayor mortalidad hospitalaria de dichos pacientes con respecto a los que no tenían BMR.10, 27-29
El objetivo de este estudio observacional retrospectivo fue revisar la epidemiología de las IBs en pacientes cirróticos hospitalizados en el Hospital Nacional Prof. Alejandro Posadas durante un período de 3 años, evaluando la prevalencia de las infecciones bacterianas por bacterias multirresistentes y su relación con el pronóstico.
Material y métodos
Se analizaron 210 internaciones consecutivas de pacientes cirróticos, internados en el hospital Nacional Prof. Alejandro Posadas por presentar un episodio de descompensación de la hepatopatía. El diagnóstico de cirrosis fue confirmado por el examen histopatológico o sugerido por hallazgos de laboratorio, de imágenes o endoscópicos inequívocos.
La edad mediana de los pacientes estudiados fue 53 años (rango: 17-80); 149 de sexo masculino. Las etiolo-gías principales de la cirrosis fueron alcoholismo crónico en 102 casos, HCV + alcoholismo crónico en 40, HCV en 20, criptogénica en 17, hepatitis autoinmune en 15, HBV en 6.
En cuanto a las pruebas de función hepática, los va-lores medios ± DE (desvío estándar) de bilirrubina total fueron 4,4 ± 4,4 mg/dl, de albúmina sérica 2,63 ± 0,6 g/dl y de actividad de protrombina 51 ± 17%. De acuerdo a la clasificación de Child-Pugh, 16 pacientes correspondían a la clase A, 97 a la B y otros 97 a la C. El score de MELD mediana fue de 16 (rango intercuartil 12-20). Los principales rasgos clínico-demográficos y de laboratorio de los pacientes analizados se muestran en la Tabla 1.
Tabla 1. Datos demográficos, clínicos y de laboratorio de los pacientes estudiados.*

Los principales motivos de internación fueron encefalopatía porto-sistémica en 64 admisiones, hemorragia digestiva alta en 47, ascitis en 32, infección bacteriana en 32 y hepatitis alcohólica en 17. Aunque no haya sido ese el motivo de la internación, 148 de los 210 pacientes (70%) tenían ascitis en el momento del ingreso. En 39 casos (19%), se confirmó además el diagnóstico de diabetes.
Se efectuaron cultivos bacterianos en las indicaciones habituales: en la admisión, en pacientes con ascitis, encefalopatía hepática, hemorragia digestiva alta, o ante la sospecha clínica de infección; además, en los pacientes con ascitis, se analizó el recuento de leucocitos polimorfonucleares para descartar la infección. Durante la internación, se reiteraron pancultivos ante deterioro del sensorio o de la función renal o por sospecha clínica de infección.
Los criterios para el diagnóstico de las infecciones fueron los siguientes: PBE: recuento de leucocitos polimorfonucleares en líquido ascítico ≥ 250/mm³ en ausencia de una causa intraabdominal de la infección; empiema bacteriano espontáneo: recuento de leucocitos polimorfonucleares en líquido pleural ≥ 250/mm³, en ausencia de una causa pleuropulmonar de la infección; infección urinaria: urocultivo positivo; bacteriemia espontánea: hemocultivos positivos en ausencia de foco primario de la infección; infecciones asociadas a catéter: hemocultivo y cultivo de catéter positivos; neumonía: cuadro clínico compatible asociado a imágenes (radiografía y/o tomografía de tórax) características, con o sin aislamiento bacteriano; otras infecciones, como celulitis, colangitis o colecistitis, de acuerdo a los criterios convencionales.
Las infecciones diagnosticadas en el momento del ingreso o durante los primeros 2 días en pacientes que no hubieran tenido contacto con un ambiente sanitario dentro de los 90 días previos se definieron como adquiridas en la comunidad (AC). En cambio, se clasificaron como asociadas al cuidado de la salud (ACS) las IBs diagnosticadas durante las primeras 48 h del ingreso en pacientes con contacto previo con un ambiente sanitario (por ejemplo, hospitalización durante al menos 2 días en los últimos 90 días, la residencia en un hogar de ancianos, centros de rehabilitación o hemodiálisis crónica). Cuando la infección se diagnosticó después de las 48 horas del ingreso se consideró como nosocomial.
Análisis estadístico
En la población estudiada se describen las variables continuas por medio de medidas de tendencia central (media o mediana) y de variabilidad (desviación estándar o rango intercuartil) de acuerdo con su distribución (gaussiana o no gaussiana) y las variables categóricas por medio de porcentajes.
Se analizó la asociación de infecciones bacterianas con variables categóricas (etiología de la cirrosis, motivo de la internación, positividad de anti-HIV, diabetes, uso de quinolonas o de inhibidores de la bomba de protones preinternación, ascitis, clase de Child) por medio del test de Chi2 y con variables cuantitativas (edad, score de MELD, hemoglobina, recuento de leucocitos, recuento de plaquetas, albúmina, bilirrubina, actividad de protrombina, AST, ALT, urea, creatinina) por medio de la prueba de T para muestras independientes, considerándose una p < 0,05 como de significancia estadística. Se investigó la asociación de infección bacteriana por BMR con las mismas variables y con óbito, y con una variable compuesta: óbito y/o derivación para trasplante hepático durante la admisión.
Resultados
Se constató la presencia de infecciones bacterianas en 89 de las 210 internaciones (42%). Los principales tipos de infección bacteriana fueron PBE en 29 episodios, bacteriemia en 26, respiratoria en 23 y urinaria en 17. Según el sitio de adquisición, se detectaron 65 IBs adquiridas en la comunidad (73%), 14 asociadas al cuidado de la salud (16%) y 10 nosocomiales (11%).
Se obtuvo aislamiento bacteriano en 50 casos, de los cuales 31 eran BGN, 18 eran CGP y en un caso, mycoplasma. No se logró aislar el agente etiológico en 39 episodios de IBs: en 19 de las 23 infecciones respiratorias, en 14 de las 29 PBE, en 3 celulitis, en 2 colecistitis y en un caso de colangitis.
En las infecciones AC, 19 de los gérmenes fueron BGN y 12 CGP. En las infecciones ACS se aislaron 6 BGN y 4 CGP, y en las infecciones nosocomiales, 6 fue-ron por BGN y 2 por CGP (Tabla 2). La bacteria más frecuentemente aislada fue la Escherichia coli, en 25 casos (50%), seguido de Streptococcus viridans en 4 casos (8%), Staphylococcus aureus en otros 4 (8%) y Enterococcus faecalis en 3 casos (Figura 1).
Tabla 2. Tipos de bacterias aisladas según el sitio de adquisición.

Figura 1. Aislamiento bacteriano en infecciones bacterianas en 210 internaciones de pacientes cirróticos.
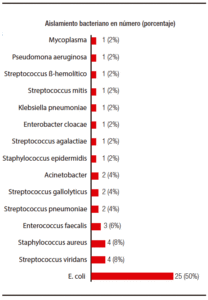
En 8 internaciones se confirmó el desarrollo de una BMR, lo que corresponde al 9% del total de episodios de infección bacteriana, 16% del total de infecciones bacterianas con aislamiento. Según el sitio de adquisición, las bacterias aisladas fueron multirresistentes en 5 de 31 (16%) IBs adquiridas en la comunidad con aislamiento, en 1 de 10 (10%) IBs asociadas al cuidado de la salud con aislamiento y en 2 de 10 (20%) IBs nosocomiales. Las BMR fueron bacilos gram (-) en 5 casos y cocos gram (+) en 3. Las bacterias multirresistentes aisladas fueron Acinetobacter baumannii, Staphylococcus epidermidis, Pseudomona aeruginosa, Staphylococcus aureus en 2 casos y Escherichia coli en 3. La Tabla 3 muestra la lista de BMR aisladas en relación con el tipo de IB y el sitio de adquisición (en la comunidad, asociada al cuidado de la salud o nosocomial).
Tabla 3. Bacterias multirresistentes aisladas en 210 internacio-nes de pacientes cirróticos y su relación con el tipo de infección y sitio de adquisición.
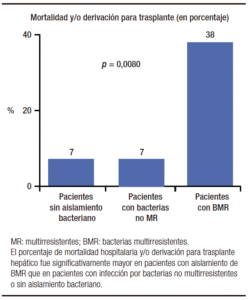
La presencia de infecciones bacterianas se asoció en forma significativa con la reserva funcional hepática de los pacientes, representada por la clase de Child-Pugh. Se diagnosticó una IB en 13%, 42% y 47%, en los pacientes de clases A, B y C de Child-Pugh (p = 0,032) respectivamente. También se observó una asociación estadísticamente significativa entre la presencia de IBs y el score de MELD, y otras variables como albúmina sé-rica, hemoglobina, recuento de leucocitos, AST y ALT; pero no con óbito durante la admisión ni con la variable compuesta óbito y/o derivación para trasplante hepático durante la internación. En cambio, la presencia de infecciones bacterianas por BMR se asoció en forma signi-ficativa tanto con óbito como con óbito y/o derivación para trasplante hepático. Entre los pacientes con IBs por BMR, se produjo el óbito en 25% de ellos, comparado con 5% entre aquellos que tuvieron IBs por bacterias no multirresistentes versus 4% en pacientes sin aislamien-to bacteriano (p = 0,0225) (Figura 2). El porcentaje de óbito y/o derivación para trasplante hepático durante la internación ascendió a 38% en pacientes con IBs por BMR, mientras que fue de 7% en pacientes con IBs por bacterias no multirresistentes y de 7% en pacientes sin aislamiento bacteriano (p = 0,0080) (Figura 3).
Figura 2. Mortalidad durante la internación en 210 pacientes cirróticos, en relación con ausencia de aislamiento bacteriano, in-fección por BMR o por bacterias no multirresistentes.
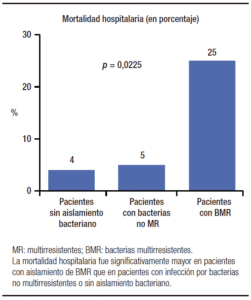
Figura 3. Mortalidad y/o derivación para trasplante hepático durante la internación en 210 pacientes cirróticos, en relación con ausencia de aislamiento bacteriano; infección por BMR o por bacterias no multirresistentes.
Discusión
Es bien conocido que los pacientes con cirrosis tienen un riesgo aumentado de presentar infecciones bacteria-nas.4, 6, 7 La infección puede estar presente al ingreso o desarrollarse durante la hospitalización en el 25 a 47% de estos pacientes.8-11 Las IBs en el paciente cirrótico se asocian con mal pronóstico y elevada mortalidad hospitalaria13 Cuando la PBE fue descripta por primera vez, su mortalidad era superior al 90%. Sin embargo, con su mayor reconocimiento, el diagnóstico precoz y el uso en forma empírica de antibióticos eficaces y de menor toxicidad, la mortalidad se ha reducido a aproximadamente un 20%.30 Además, con infusiones de albúmina humana para evitar el empeoramiento de la disfunción circulatoria y la insuficiencia renal, se ha logrado disminuir la mortalidad de la PBE a aproximadamente un 10%.31 Por lo tanto, el diagnóstico precoz y el tratamiento empírico adecuado son muy importantes en el manejo de estos pacientes; se debe instaurar la terapia antibiótica sin esperar los resultados de los cultivos bacterianos. Por ello, es trascendental conocer la epidemiología de las IBs en pacientes cirróticos en los diferentes países y aun en cada institución.4
La PBE y las infecciones urinarias son las infecciones bacterianas más frecuentes, seguidas de neumonía y bac-teriemia.9 El presente estudio, aún con los defectos de un análisis retrospectivo, mostró que, en nuestro hospital, la PBE es la IB más frecuente, seguida de bacteriemia, infección respiratoria e infección urinaria. Nuestros resultados mostraron que una buena proporción de las IBs diagnosticadas en el paciente cirrótico de nuestro medio son adquiridas en la comunidad, siendo los BGN la principal etiología (59%) y el germen aislado con más frecuencia fue la Escherichia coli (50% de los casos) (Figura 1). Se confirmó una infección bacteriana nosocomial en 10 casos, y en 8 de ellos se obtuvo aislamiento bacteriano, de los cuales 6 fueron por BGN y 2 por CGP.
Las bacterias multirresistentes (BMR) son patógenos resistentes a tres o más de las principales familias de antibióticos, incluyendo a los beta-lactámicos. Dos estudios del mismo centro publicados en 2002 y 2012 por Fernández y col. mostraron que la prevalencia de IBs por BMR en la cirrosis había aumentado de 10% a 23%, respectivamente.9, 10 Además, en el estudio más reciente se observó que las BMR fueron más frecuentes en las IBs nosocomiales (35-39%), que en las ACS (14-20%) y AC (0-4%).10 En nuestro estudio, la prevalencia de las infecciones por BMR fue de 9% sobre el total de episodios de IBs, y de 16% al considerar solo aquellas en las que hubo aislamiento bacteriano. Estos porcentajes podrían subestimar la prevalencia real, ya que en nuestro estudio se confirmó un número bajo de infecciones bacterianas nosocomiales, que son aquellas en las cuales puede haber un porcentaje mayor de aislamiento de BMR. Una posible explicación para el bajo número de IBs nosocomiales demostradas sería que no se hayan indicado los pancultivos en situaciones clínicas que así lo requirieran. Esta eventualidad no puede descartarse, dada la naturaleza retrospectiva del estudio. Esta es la principal debilidad del mismo y la problemática de las infecciones bacterianas por BMR se está analizando, en la actualidad, en forma prospectiva en el Hospital Nacional Prof. Alejandro Posadas.
De acuerdo a lo descripto en la literatura, las infecciones por BMR se pueden asociar con una mayor frecuencia de fracaso del tratamiento antibiótico empírico, mayor incidencia de shock séptico y mortalidad hospitalaria. En el estudio de Fernández y col. la mortalidad hospitalaria en pacientes cirróticos con infección por BMR duplicó a la observada en infecciones causadas por bacterias sensibles (25% versus 12%);10 dicha diferencia no se había encontrado en estudios de Corea, España e Italia.24-26 En nuestra revisión, la mortalidad durante la internación fue de 25% en pacientes con infección por BMR, significativamente mayor que la observada en pacientes infectados por bacterias no multirresistentes y en aquellos sin aislamiento bacteriano, 5 y 4% respectivamente (p = 0,0225).
El diagnóstico precoz para el inicio del tratamiento antibiótico en forma oportuna y adecuada es esencial para el manejo de los pacientes cirróticos que cursan infecciones bacterianas. La infección por BMR podría tener un impacto importante en el pronóstico de los pacientes cirróticos infectados, por la baja eficacia de la terapia antibiótica empírica estándar. Las BMR no solo se observan en las infecciones nosocomiales, sino también en las infecciones adquiridas en la comunidad. Debido a esto, es importante identificar factores de riesgo que estén relacionados con el desarrollo de BMR para la elección del antibiótico, ya que las cefalosporinas de tercera generación son poco eficaces en estas infecciones. La elección de los antibióticos empíricos se debe basar en el tipo, la gravedad, el origen de la infección (nosocomial, adquiridas en la comunidad o asociadas al cuidado de la salud) y en los datos epidemiológicos locales sobre resistencia a los antibióticos.4 El tratamiento empírico de las IBs nosocomiales y las asociadas al cuidado de la salud debe adaptarse de acuerdo con el patrón epidemiológico local de las BMR.4 Por lo tanto, es recomendable que cada institución sanitaria analice su epidemiología particular.
La prevalencia creciente de IBs por BMR en pacientes cirróticos en diversos estudios y regiones ha producido consecuentemente cambios en los algoritmos propuestos para el tratamiento antibiótico empírico ante la sospecha de una infección.4, 5 En las infecciones adquiridas en la comunidad sigue siendo eficaz el tratamiento empírico con las cefalosporinas de tercera generación.4, 12, 32 Así, tenemos que, en la PBE, el tratamiento empírico de primera línea es con CTG (cefotaxima o ceftriaxona).33 Las opciones alternativas incluyen amoxicilina/ácido clavulánico y quinolonas (ciprofloxacina u ofloxacina).33 Sin embargo, las quinolonas no deben considerarse en pacientes que ya están tomando norfloxacina como profilaxis de la PBE, debido a la alta tasa de infección por BGN resistentes a quinolonas. El tratamiento empírico de las infecciones urinarias adquiridas en la comunidad incluye ß-lactámicos (CTG o amoxicilina/ácido clavulánico), quinolonas o trimetoprima-sulfametoxazol. Las neumonías adquiridas en la comunidad en pacientes cirróticos están producidas por los mismos gérmenes que en la población general. El tratamiento empírico recomendado incluye amoxicilina/ ácido clavulánico o ceftriaxona en combinación con levofloxacina, moxifloxacina o un macrólido.
En las infecciones nosocomiales, las CTG no son apropiadas para el tratamiento empírico, debido a la alta prevalencia de BMR. En las zonas con alta prevalencia de enterobacterias BLEE (beta-lactamasa de espectro extendido), se deben utilizar los carbapenems (meropenem) para el tratamiento de la PBE, empiema bacteriano espontáneo y bacteriemia espontánea. Un glucopéptido (vancomicina o teicoplanina) debe añadirse a este tratamiento en zonas con alta prevalencia de Staphylococcus aureus resistente a meticilina o Enterococcus sensible a vancomicina (VSE). En zonas con alta prevalencia de Enterococcus resistente a vancomicina (VRE), el glucopéptido debe ser reemplazado por linezolid o daptomicina.12, 32 En las áreas de baja prevalencia de BMR pero alta para Enterococcus faecalis, se debe utilizar piperacilina-tazobactam.32 En infecciones urinarias nosocomiales sin sepsis se puede indicar nitrofurantoína o fosfomicina, y en aquellas con sepsis, carbapenem más glucopéptido para cubrir enterobacterias BLEE y VSE o linezolid/daptomicina para VRE.4, 12, 23 En la celulitis nosocomial se recomienda ampliar la cobertura contra SARM y Pseudomona aeruginosa con ceftazidima o carbapenem (meropenem) más un glucopéptido.4, 23 El tratamiento empírico de la neumonía nosocomial debe seguir el manejo local para la población general.23
En las infecciones ACS, los ß-lactámicos todavía son eficaces para el tratamiento de la PBE y la celulitis.12, 23 El tratamiento empírico para los pacientes con neumonía, infecciones urinarias y PBE asociadas al cuidado de la salud con factores de riesgo para BMR y/o sepsis grave o shock séptico debe seguir el mismo esquema recomendado en las infecciones nosocomiales.12, 23
En conclusión, la presencia de una infección bacteriana por bacterias multirresistentes tuvo una gran implicancia pronóstica en nuestra población de pacientes cirróticos, asociándose en forma muy significativa a resultados desfavorables, como una mayor mortalidad hospitalaria o necesidad de derivación para trasplante hepático dentro de la misma admisión. La epidemiología en particular de estas infecciones debe continuar siendo estudiada en forma prospectiva y con un mayor número de pacientes, para poder arribar a nuestra propia guía de manejo del tratamiento antibiótico empírico en pacientes cirróticos.
Sostén financiero. Ninguno de los autores ha recibido becas u otro aporte económico para esta investigación.
Referencias
- Thalheimer U, Triantos CK, Samonakis DN, Patch D, Burroughs AK. Infection, coagulation, and variceal bleeding in cirrhosis. Gut 2005; 54: 556-563.
- Ginès P, Schrier RW. Renal failure in cirrhosis. New Engl J Med 2009; 361: 1279-1290.
- Follo A, Llovet JM, Navasa M, Planas R, Forns X, Francitorra A, Rimola A, Gassull MA, Arroyo V, Rodés J. Renal impairment after spontaneous bacterial peritonitis in cirrhosis: incidence, clinical course, predictive factors and prognosis. Hepatology 1994; 20: 1495-1501.
- Jalan R, Fernández J, Wiest R, Schnabl B, Moreau R, Angeli P, Stadlbauer V, Gustot T, Bernardi M, Canton R, Albillos A, Lammert F, Wilmer A, Mookerjee R, Vila J, García Martínez R, Wendon J, Such J, Córdoba J, Sanyal A, García Tsao G, Arroyo V, Burroughs AK, Ginès P. Bacterial infections in cirrhosis: a position statement based on the EASL Special Conference 2013. J Hepatol 2014; 60: 1310-1324.
- Acevedo J, Fernández J. New determinants of prognosis in bacterial infections in cirrhosis. World J Gastroenterol 2014; 20: 7252-7259.
- Foreman MG, Mannino DM, Moss M. Cirrhosis as a risk factor for sepsis and death: analysis of the National Hospital Discharge Survey. Chest 2003; 124: 1016-1020.
- Fernández J, Gustot T. Management of bacterial infections in cirrhosis. J Hepatol 2012; 56: S1-S12.
- Caly WR, Strauss E. A prospective study of bacterial infections in patients with cirrhosis. J Hepatol 1993; 18: 353-358.
- Fernández J, Navasa M, Gomez J, Colmenero J, Vila J, Arroyo V, Rodés J. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology 2002; 35: 140-148.
- Fernández J, Acevedo J, Castro M, Garcia O, Rodríguez de Lope C, Roca D, Pavesi M, Sola E, Moreira L, Silva A, Seva-Pereira T, Corradi F, Mensa J, Ginès P, Arroyo V. Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study. Hepatology 2012; 55: 1551-1561.
- Borzio M, Salerno F, Piantoni L, Cazzaniga M, Angeli P, Bissoli F, Boccia S, Colloredo-Mels G, Corigliano P, Fornaciari G, Marenco G, Pistarà R, Salvagnini M, Sangiovanni A. Bacterial infection in patients with advanced cirrhosis: a multicentre prospective study. Dig Liver Dis 2001; 33: 41-48.
- Fernández J, Arroyo V. Bacterial infections in cirrhosis: A growing problem with significant implications. Clin Liv Dis 2013; 2: 102-105.
- Arvaniti V, D’Amico G, Fede G, Manousou P, Tsochatzis E, Pleguezuelo M, Burroughs AK. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis. Gastroenterology 2010; 139: 1246-1256.
- Bauer TM, Steinbruckner B, Brinkmann FE, Ditzen AK, Schwacha H, Aponte JJ, Pelz K, Kist M, Blum HE. Small intestinal bacterial overgrowth in patients with cirrhosis: prevalence and relation with spontaneous bacterial peritonitis. Am J Gastroenterol 2001; 96: 2962-2967.
- Pande C, Kumar A, Sarin SK. Small-intestinal bacterial overgrowth in cirrhosis is related to the severity of liver disease. Aliment Pharmacol Ther 2009; 29: 1273-1281.
- Chang CS, Chen GH, Lien HC, Yeh HZ. Small intestine dysmotility and bacterial overgrowth in cirrhotic patients with spontaneous bacterial peritonitis. Hepatology 1998; 28: 1187-1190.
- Assimakopoulos SF, Tsamandas AC, Tsiaoussis GI, Karatza E, Triantos C, Vagianos CE, Spiliopoulou I, Kaltezioti V, Charonis A, Nikolopoulou VN, Scopa CD, Thomopoulos KC. Altered intestinal tight junctions’ expression in patients with liver cirrhosis: a pathogenetic mechanism of intestinal hyperpermeability. Eur J Clin Invest 2012; 42: 439-446.
- Assimakopoulos SF. Uncovering the molecular events associated with increased intestinal permeability in liver cirrhosis: the pivotal role of enterocyte tight junctions and future perspectives. J Hepatol 2013; 59: 1144-1146.
- Wiest R, Garcia-Tsao G. Bacterial translocation (BT) in cirrhosis. Hepatology 2005; 41: 422-433.
- Chesta J, De Filippi C. Abnormalities in proximal small bowel motility in patients with cirrhosis. Hepatology 1993; 17: 828-832.
- Rimola A, Bory F, Planas R, Xaubert A, Bruguera M, Rodés J. In-fecciones bacterianas agudas en la cirrosis hepática. Gastroenterol Hepatol 1981; 4: 453-458.
- Levi D, Terg R, Podestá A, Abecasis R, de Glé G, Rafaelli C. Infec-ciones bacterianas en el paciente cirrótico. Gastroenterol Hepatol 1989; 12: 384-388.
- Acevedo J. Multiresistant bacterial infections in liver cirrhosis: Clinical impact and new empirical antibiotic treatment policies. World J Hepatol 2015; 7: 916-921.
- Song JY, Jung SJ, Park CW, Sohn JW, Kim WJ, Kim MJ, Cheong HJ. Prognostic significance of infection acquisition sites in spon-taneous bacterial peritonitis: nosocomial vs. community acquired. J Korean Med Sci 2006; 21: 666-671.
- Cereto F, Herranz X, Moreno E, Andreu A, Vergara M, Fonta-nals D, Roget M, Simó M, González A, Pratz G, Genescà J. Role of host and bacterial virulence factors in Escherichia coli sponta-neous bacterial peritonitis. Eur J Gastroenterol Hepatol 2008; 20:
- 924-
- Angeloni S, Leboffe C, Parente A, Venditti M, Giordano A, Merli M, Riggio O. Efficacy of current guidelines for the treatment of spontaneous bacterial peritonitis in the clinical practice. World J Gastroenterol 2008; 14: 2757-2762.
- Merli M, Lucidi C, Giannelli V, Giusto M, Riggio O, Falcone M, Ridola L, Atili AF, Venditti M. Cirrhotic patients are at risk for health care-associated bacterial infections. Clin Gastroenterol Hepatol 2010; 8: 979-985.
- Heo J, Seo YS, Yim HJ, Hahn T, Park SH, Ahn SH, Park JY, Kim MY, Park SK, Cho M, Um SH, Han KH, Jim HS, Baik SK, Kim BI, Cho SH. Clinical features and prognosis of spontaneous bacterial peritonitis in Korean patients with liver cirrhosis: a mul-ticenter retrospective study. Gut Liver 2009; 3: 197-204.
- Umgelter A, Reindl W, Miedaner M, Schmid RM, Huber W. Fai-lure of current antibiotic first-line regimens and mortality in hos-pitalized patients with spontaneous bacterial peritonitis. Infection 2009; 37: 2-8.
- Navasa M, Follo A, Llovet JM, Clemente G, Vargas V, Rimola A, Marco F, Guarner C, Forné M, Planas R, Bañares R, Castells L, Jimenez de Anta MT, Arroyo V, Rodés J. Randomized, comparati-ve study of oral ofloxacine intravenous cefotaxime in spontaneous bacterial peritonitis. Gastroenterology 1996; 111: 1011-1017.
- Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruiz del Arbol L, Castells L, Vargas V, Soriano G, Guevara M, Ginès P, Rodés J. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. New Engl J Med 1999; 341: 403-409.
- Acevedo J, Fernández J. New determinants of prognosis in bacte-rial infections in cirrhosis. World J Gastroenterol 2014; 20: 7252-7259.
- EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis and hepatorenal syndrome in ci-rrhosis. J Hepatol 2010; 53: 397-417.
Correspondencia: Eduardo Fassio
Av. Presidente Illia y Marconi, s/n (CP 1684). El Palomar, Provincia de Buenos Aires, Argentina
Teléfono: +54 11 44699300 (int. 1621-1615)
Correo electrónico: efassio@intramed.net
Acta Gastroenterol Latinoam 2017;47(4): 243-251
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE





