María Inés Molejon,1, 2 Gisela Weiz,1 Juan Ignacio Tellechea,3 Javier Breccia,1 María Inés Vaccaro2
1 INCITAP-CONICET (Instituto de Ciencias de la Tierra y Ambientales de La Pampa – Consejo Nacional de Investigaciones Científicas y Técnicas), Departamento de Química, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de La Pampa. Santa Rosa, La Pampa.
2 IBIMOL-CONICET (Instituto de Bioquímica y Medicina Molecular – Consejo Nacional de Investigaciones Científicas y Técnicas), Departamento de Fisiopatología, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Ciudad Autónoma de Buenos Aires.
3 Institución Médica Profensa. Santa Rosa, La Pampa. Argentina.
Acta Gastroenterol Latinoam 2019;49(3):208-221
Recibido: 14/11/2018 / Aprobado: 19/02/2019 / Publicado en www.actagastro.org el 17/09/2019
Resumen
El adenocarcinoma pancreático (PDAC), que constituye el 90% de los cánceres de páncreas, es la cuarta causa mundial de muertes relacionadas al cáncer. Debido a sus características moleculares y genéticas, PDAC pertenece al grupo de tumores con más resistencia al tratamiento quimioterápico. En la actualidad, las opciones terapéuticas disponibles incluyen la cirugía, la radiación, la quimioterapia, la inmunoterapia y drogas dirigidas. Sin embargo, la mayoría de los tratamientos son paliativos, con el objeto de disminuir los síntomas relacionados con la enfermedad. Por lo tanto, nuestro objetivo es evaluar el efecto de un compuesto glicosilado, la hidroquinona-rutinósido, sobre células tumorales pancreáticas primarias con el fin de buscar mayor efectividad de los tratamientos quimioterápicos actuales. Encontramos que la utilización de glicocompuestos como segunda línea de
terapia mejora significativamente el efecto antitumoral de la gemcitabina. Estos resultados sugieren un potencial interés en la utilización de compuestos glicoconjugados como terapias complementarias a los tratamientos estándares contra el cáncer.
Palabras claves. Adenocarcinoma pancreático, hidroquinona, proteína de membrana de vacuola 1, aspiración con aguja fina, biopsia.
Abreviaturas
PDAC: Adenocarcinoma pancreático.
HQ: Hidroquinona.
VMP1: Vacuole-membrane protein 1.
PAAF: Punción aspirativa con aguja fina.
El adenocarcinoma pancreático (PDAC) involucra el 90% de los tumores que afectan el páncreas. El PDAC es uno de los tumores malignos con peor pronóstico, con un estimativo de 367.000 nuevos casos en el mundo durante 2015, y con 359.000 muertes en ese mismo año.1 El cáncer de páncreas actualmente constituye la cuarta causa de muerte por cáncer en los países desarrollados, sin embargo, si no se produce un avance en las terapias utilizadas, se cree que la enfermedad llegará a ser la segunda causa de muerte en la próxima década.2 La razón de este grave pronóstico se relaciona en parte con la insensibilidad a la quimioterapia, radioterapia e inmunoterapia. Además, los signos y síntomas del PDAC aparecen en la última etapa de la enfermedad, por lo que la mayoría de los pacientes se presenta con estadios avanzados del tumor al momento del diagnóstico. Así, aunque la resección quirúrgica ha demostrado tasas de supervivencia de hasta el 40%, el 85% de los pacientes con PDAC no son elegibles para cirugía.3 Del 15% que es sometido a cirugía, el 85% presenta relapso tumoral.4-8
La autofagia es un proceso de degradación de componentes citoplasmáticos altamente conservado, que sirve como un mecanismo de supervivencia en condiciones de ayuno.9, 10 La autofagia ocurre a nivel basal en la mayor parte de los tejidos y contribuye al recambio rutinario de los componentes citoplasmáticos. Está implicada en el desarrollo, la diferenciación y la remodelación de tejidos en distintos organismos.11, 12 El rol de la autofagia en la salud y la enfermedad ha sido descripto como un arma de doble filo, debido a que se encuentra relacionada tanto con la sobrevida como con la muerte celular.13 Esta decisión depende del estado de la carcinogénesis, del contexto célula/tejido, de las características moleculares de la célula blanco y de la naturaleza del estrés.14-16 Yang y col. han demostrado que la autofagia esta activada constitutivamente en tumores que presentan la mutación Kras. El Kras se encuentra activado en casi todos los tumores pancreáticos, incluidos los tres tipos de lesiones precursoras del PDAC descriptas: PanINs (pancreatic intraepithelial neoplasias), neoplasias papilares mucinosas intraductales y neoplasias quísticas mucinosas.17 La inactivación genética o farmacológica de la autofagia impide la tumorigenesis mediada por Kras. Previamente hemos demostrado que Kras induce la expresión de VMP1 (vacuole membrane protein 1) en células de cáncer de páncreas. VMP1 se expresa tempranamente durante numerosas patologías, incluyendo la diabetes mellitus, los procesos inflamatorios del páncreas (pancreatitis) y el cáncer de páncreas.18, 19
Los flavonoides son compuestos fenólicos con un grupo funcional benzopirónico.20 La hesperidina (hesperetin 7-O-rutinósido), que se encuentra en plantas del género citrus, está compuesta por la aglicona hesperetina y el disacárido rutinosa (6-O-α-L-ramnopiranosil-β-D-glucopiranosa).21-23 Se ha demostrado que tiene actividades farmacológicas, incluyendo antioxidantes, vasoprotectoras, y efectos antitumorales.24-31
La síntesis enzimática de enlaces glicosídicos ha sido objeto de estudio durante más de 60 años y se han desarrollado diferentes estrategias que evitan o complementan la síntesis química, que generalmente requiere múltiples etapas de protección y desprotección para obtener los oligosacáridos deseados.32 En la naturaleza, las glicósido transferasas (GT) son los principales catalizadores para la síntesis de uniones glicosídicas. Sin embargo, debido a dificultades en su expresión y purificación, sumado al elevado costo económico para su obtención, sus aplicaciones son restringidas. Una alternativa es utilizar enzimas glicósido hidrolasas (GH) como catalizadores de enlaces glicosídicos, ya que son más abundantes, fáciles de obtener y presentan amplio rango de especificidad, además de ser más económicas.33
En nuestro laboratorio se aisló y caracterizó una GH, denominada 6-O-α-ramnosil-b-glucosidasa proveniente del hongo Acremonium sp. DSM 24697. Esta enzima es capaz transferir el disacárido rutinosa, desde la hesperidina a diversos aceptores hidroxilados, como por ejemplo la hidroquinona.34, 35 En este trabajo nos propusimos evaluar el efecto del rutinósido de hidroquinona sobre células tumorales pancreáticas primarias.
Métodos
Muestras tumorales
Los protocolos a utilizar para la obtención de las muestras de los tumores, los criterios de inclusión y exclusión de pacientes en el estudio, y los modelos estadísticos a utilizarse fueron aprobados por el Comité de Ética e Investigación Independiente Patagónico (CEIP). Las muestras tumorales se obtuvieron a partir de PAAF (punciones aspirativas con aguja fina) guiadas por ecoendoscopía (EE) a partir de pacientes con diagnóstico de cáncer de páncreas sin haber recibido tratamiento previo a la punción. Este proyecto fue aprobado por el Comité de Ética Independiente Patagónico.
Criterios de elección de los pacientes
Criterios de inclusión: pacientes mayores de 18 años con sospecha de tumor o diagnóstico que conducen a un procedimiento quirúrgico o a una ecoendoscopía.
Criterios de exclusión: toda persona en situación de urgencia, o adulto sujeto a una medida de protección legal o toda aquella persona incapaz de dar su consentimiento, o diagnóstico final diferente a PDAC.
Se realizó el estudio del páncreas con un ecoendoscopio lineal (UCT-140 AL5; Olympus, Tokyo, Japón). Las lesiones tumorales fueron punzadas con agujas de 22 Gauge (EchoTip; Wilson Cook, Winstom Salem, NC, EE.UU.) (Expect; Boston Scientific, Burlington, MA, EE.UU.). Luego de retirar el estilete y aplicar succión anexando una jeringa (20 cc con presión negativa), la aguja al vacío realizó al menos 20 pasajes dentro de la lesión, aplicando la técnica de fanning. Se retiró la aguja y el estilete fue reintroducido, el primer material protruído se posó sobre porta-vidrios y se fijó en alcohol 96% (citología). Luego con una jeringa con solución fisiológica se recuperó el material aspirado en un tubo con líquido de preservación (BD CytoRich Red Preservative, destinado para el cultivo de células). Se realizó otra punción repitiendo los mismos pasos, dichas muestras se recuperaron, se fijaron en formol al 10% y se enviaron para estudio de anatomía patológica.
Cultivo celular
Dentro de un cuarto de cultivo seguridad 2 las muestras tumorales fueron tratadas de la siguiente manera: centrifugación de la pieza a 1200 rpm/ 7 minutos a R/T. Luego se resuspendió el pellet obtenido en 3 mL de colagenasa (1 mg/ ml) (Sigma) y se incubó a 37°C en baño maría. Luego de 10’ de incubación, las muestras se centrifugaron a 700 rpm 4’ a temperatura ambiente (R/T). Se resuspendió el pellet celular en 5ml de Tapón de lisis para glóbulos rojos (1 x RBC Lisis Buffe, eBiosciences). Se agitaron suavemente 5’ y se centrifugaron a 700 rpm 4’ R/T. Finalmente se resuspendió el pellet en Medio DMEM F10 (Invitrogen) en una placa previamente cubierta con una matriz extracelular. Incubar las células a 37°C en un ambiente con 5% de CO2.
Cada cultivo primario se mantuvo en medio de cultivo completo hasta la aparición de confluencia, que varió de 15 días a 30 días, según el tumor. Cuando las células alcanzaron un 70% de confluencia, se trataron con alfazima (PAA LAboratories) durante 20’. Este tratamiento permitió la eliminación de células estromales, obteniendo un cultivo primario de células tumorales mayormente.
Histología
Las muestras tumorales fueron embebidas en parafina 4% y teñidas con hematoxilina y eosina (H&E) y analizadas con un Microsopio Nikon E200 trinocular acoplado a cámara digital.
Extracción y purificación de RNA
La extracción del RNA de cultivos celulares se realizó con el reactivo Trizol (Invitrogen). Las células se crecieron en un multiwell de 6 y luego se les realizó el tratamiento deseado. Para la purificación del RNA se lavaron las células con PBS, se agregó 1 ml de Trizol por well y se pipeteó para levantar las células. Luego se pasó el contenido de cada well a un tubo de 1,5 ml, en donde se agregaron 0,2 ml de cloroformo. A continuación, se centrifugó a 12.000 xg durante 15 min a 4°C. Se transfirió la fase acuosa a un nuevo tubo en donde se agregaron 0,5 ml de isopropanol. Se dejó incubando 10 min y después se centrifugó a 12.000 xg por 10 min a 4°C. El pellet de RNA obtenido luego de la centrifugación se lavó con etanol 75%, se centrifugó nuevamente y se suspendió en agua. Se determinaron las concentraciones de RNA midiendo la absorbancia a 260 nm. Para chequear su calidad se realizó una corrida en gel de agarosa y se visualizó por tinción con bromuro de etidio.
RT-PCR y Real-Time RT-PCR
Se utilizaron 2 μg del RNA purificado y se trataron con 1 μl de RNase-free DNase I (Invitrogen) en un volumen final de 10 μl conteniendo buffer de RNAsa 1X. Se incubó durante 15 minutos a temperatura ambiente y luego se incubó a 65°C durante 10 min. A continuación, se incubaron los 10 μl del tratamiento DNAsa con 100 nM random primers (N6) a 70°C durante 5 min. A continuación, se utilizó la mezcla de RNA más random primers y se agregó 1 mM dNTPs y 1 μl de la enzima transcripasa reversa MMLV (Promega) en un volumen final de 20 μl conteniendo buffer MMLV 1X. La mezcla se incubó a 25°C durante 5 min y luego a 37°C durante 1 hora. Para la reacción de PCR se utilizaron 0,5 μl de reacción de RT en una mix con 200 μM dNTPs, 4 mM MgCl2, 200 nM de primer Foward y Reverse y 1 μl de la enzima Go Taq (Promega) en un volumen de 25 μl conteniendo buffer Go Taq 1X. Las condiciones de la PCR y los primers utilizados fueron desarrollados en la subsede de fisiopatología del IBIMOL.
Síntesis de compuestos
Hidroquinona (HQ) (benzene-1,4-diol) fue obtenida de Sigma-Aldrich (St. Louis, EE.UU.). HQ- rutinósido fue sintetizada enzimáticamente a 30°C durante 24 hs en buffer fosfato de sodio 50 mM pH 6. La mezcla de reacción contenía: 1,8 mM de hesperidina, 1,8 mM de HQ, 0,02 U ml-1 de 6-O-α-ramnosil-β-glucosidasa, y 2%v/v de DMSO. La reacción se finalizó en baño maría hirviente a 100°C por 10 min Los productos de la reacción fueron purificados utilizando la columna Sephadex LH20 (1,5 × 150 cm; flujo 0,1 ml min-1). El producto de tranglicosilación fue identificado mediante resonancia magnética nuclear (RMN) como 4-hidrofenil β-rutinósido (HQ-rutinósido).
Curvas de viabilidad
La quimiosensibilidad se evaluó realizando cruvas de proliferación celular. 5×103 células por pocillo fueron plaqueadas en una multiplaca de 96 pocillos en SFDM. 24 hs después el medio fue suplementado con 200 μM de Gemcitabina (Lilly), y se incubaron por 4 h. Luego, se adicionaron dosis crecientes (0 a 1000 μM) de HQ-rutinósido y a las 24 h se evaluó la citotoxicidad. Cada experimento se realizó por duplicado. La proliferación celular se estimó luego de la incubación con el agente PrestoBlue (Life Technologies) por 3 h, según protocolo del manufactor.
Análisis estadísticos
Los datos fueron expresados como la media ± ES (error estándar). Se realizó un análisis de varianza (ANOVA) factorial para comparar las muestras. Las diferencias se consideraron significativas cuando *p < 0,05; **p < 0,01 vs. control o § p < 0,05; §§ p < 0,001 vs. GEM.
Resultados
Datos clínico-patológicos de los pacientes
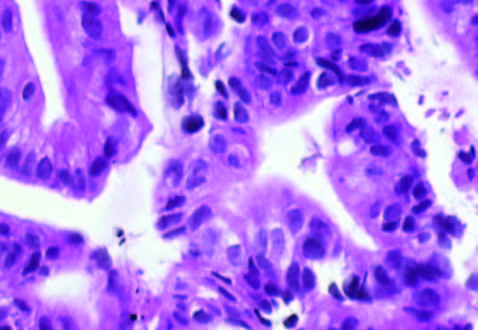
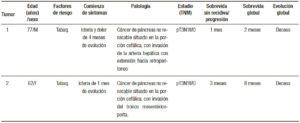
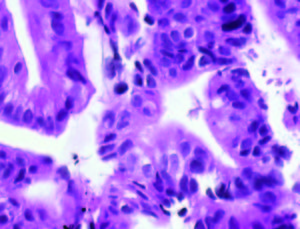
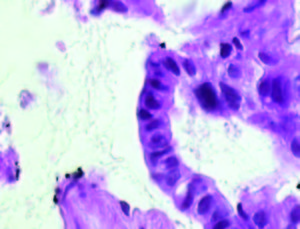
En la Tabla 1 se detallan las características de los pacientes y la evolución del tumor. La Figura 1 muestra la histología de los tumores. El tumor 1 presentó una diferenciación glandular y algunas formas tubulares. En la foto del tumor 2 observamos un estroma desmoplásmico y formaciones glandulares.
Tabla 1. Historia clínica y características clínico-patológicas de los pacientes.
Figura 1. Tinción con hematoxilina-eosina de los tumores obtenidos por ecoendoscopía (A) Tumor 1; (B) Muestra tumoral 2; (HE, 1000X).
Establecimiento de líneas tumorales pancreáticas
Con el fin de corroborar la tumorigenicidad de las líneas celulares primarias, realizamos la caracterización del estado mutacional de Kras por PCR (121). Los resultados de PCR fueron seguidos por la secuenciación del ADN. Ha sido previamente publicado que la mutación de Kras se encuentra entre el 75-95% de los adenocarcinomas pancreáticos. Las líneas celulares estudiadas portaron la mutación Kras, en el cromosoma 12, exón 1 a nivel de los codones 12 (mutación más frecuente). Las formas mutadas contienen GAT (ácido aspártico) y GTT (valina) (Tabla 2). La presencia de estas mutaciones en las líneas celulares establecidas indica el origen epitelial de un proceso tumoral pancreático.
Tabla 2. Secuenciación del estado de Kras de las dos líneas celulares primarias (LT1 y LT2). Se observa que en ambos tumores Kras se encuentra mutado.

Expresión de VMP1 en las líneas tumorales
Se ha descripto la presencia de VMP1, proteína involucrada en las primeras etapas del proceso autofágico en líneas celulares establecidas. VMP1 es una proteína de estrés, que se expresa luego de someter a las células a un estrés como pancreatitis o cáncer de páncreas.
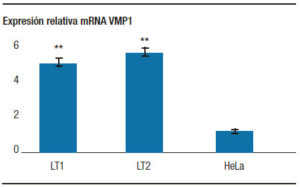
Con el objetivo de evaluar la expresión de VMP1 en las líneas celulares establecidas a partir de muestras humanas, se determinó la expresión del mRNA de VMP1 en las líneas tumorales y se la comparó con la expresión en células HeLa utilizando la técnica de RT-PCR Real Time. Como control interno se amplificó la b-actina. Los niveles de mRNA de VMP1 fueron relativizados al mRNA de b-actina. Los resultados mostraron que la expresión basal del mRNA de VMP1 de las células tumorales pancreáticas es significativamente mayor que el de las células HeLa (Figura 2). Estos resultados sugieren que las células primarias de cáncer pancreático podrían presentar mayores niveles de autofagia, indicados por una mayor expresión de la proteína VMP1.
Figura 2. El mRNA de VMP1 fue evaluado mediante RT-PCR Real Time. Se observó que la expresión de VMP1 es mayor en las líneas celulares primarias (LT1 y LT2) proveniente de tumores pancreáticos. ** p < 0,001 versus células control HeLa.
Evaluación de la quimiosensibilidad de las líneas tumorales
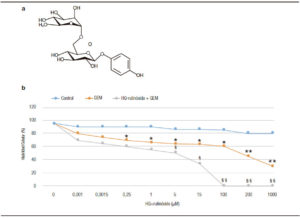
Se analizó la sensibilidad de las células de cáncer pancreático primarias al tratamiento con gemcitabina. Las líneas celulares primarias fueron tratadas con 200 μM de gemcitabina. Luego de 4 horas, se adicionaron de 0 a 1000 μM de HQ-rutinósido y a las 24 h se evaluó la citotoxicidad y se determinó el porcentaje de células viables. En la Figura 3A se detalla la estructura química de la HQ-rutinósido sintetizada enzimáticamente. Luego del tratamiento con HQ-rutinósido por 24 h, observamos que la administración de 15 μM HQ-rutinósido combinado con 10 μM gemcitabina afectó significativamente la sobrevida celular comparada con el tratamiento con gemcitabina únicamente. Podemos concluir que el efecto citotóxico de un glicocompuesto como segunda línea de terapia a la gemcitabina mejora significativamente la efectividad del tratamiento contra el PDAC.
Figura 3. A) Estructura de la HQ-rutinósido sintetizada enzimáticamente. B) Líneas tumorales primarias humanas de PDAC tratadas con diferentes dosis (0 a 1000 μM) de HQ-rutinósido y 200 μM gemcitabina (GEM). Se comparó con células sin tratar (control) y tratadas solo con 200 μM GEM. El porcentaje de viabilidad se obtuvo por absorbancia a 490 nm. Cada punto representa duplicados (± SD). *p < 0,05; **p < 0,001 versus células control; § p < 0,0, §§ p < 0,001 vs. tratamiento con GEM.
Discusión
El cáncer de páncreas es una de las enfermedades más letales en el mundo, y debido a su mal pronóstico se necesita un tratamiento más efectivo. Las causas del PDAC son aún desconocidas, y muchos pacientes con PDAC se encuentran en un estadio avanzado de la enfermedad en el momento de ser diagnosticados. Aun si el tumor es resecado, la recuperación postoperatoria es insatisfactoria, y el pronóstico continúa siendo pobre. La gemcitabina, un nucleósido análogo de base, es el tratamiento que se utiliza en la actualidad para el PDAC. Sin embargo, debido a la alta resistencia a la gemcitabina que presentan las células tumorales pancreáticas, se requiere el descubrimiento de agentes que aumenten la sensibilidad a la droga, buscando mejorar el pronóstico del PDAC.36
Desarrollamos una estrategia en la que biopsias de tumores de páncreas provenientes de 2 pacientes fueron recolectadas y sus células fueron mantenidas en cultivo primario. Este cultivo nos permitió analizar la sensibilidad a la gemcitabina de los dos tumores y ensayar nuevas drogas como segundo tratamiento. Metodológicamente, debe destacarse que fuimos capaces de obtener muestras provenientes de PAAF-EE. Esta estrategia es importante ya que nos permite pensar en aplicaciones clínicas, dado que si se pueden cultivar células a partir de PAAF-EE accedemos a la posibilidad de realizar una biopsia del tumor, estudiar la sensibilidad de las células tumorales a las drogas y de esta manera aplicar un tratamiento personalizado.
Estudiamos además la expresión del RNA del gen VMP1 por RT-PCR, y observamos un aumento de la expresión de este gen en células tumorales pancreáticas. Estudios previos experimentales en que se muestran que la expresión de VMP1 en células tumorales se relaciona con la resistencia tumoral.37, 38 Estos datos de expresión aumentada de VMP1 en las células de tumores portando Kras oncogénicos puede sugerir un rol de esta proteína en la resistencia de las células al tratamiento.
Por otro lado, estudiamos la sensibilidad al tratamiento de las células tumorales provenientes de biopsias humanas. Obtuvimos un perfil de resistencia asociada al tratamiento. Observamos que la IC50 de la gemcitabina fue cuando se utilizó 200 µM de droga.39 Notablemente, la IC50 de gemcitabina disminuyó a 5 μM luego del tratamiento con una segunda línea de terapia, como HQ-rutinósido. Este resultado sugiere que el tratamiento con HQ-rutinósido mejora significativamente la efectividad de la gemcitabina para el tratamiento de PDAC. A pesar de las numerosas investigaciones y los esfuerzos realizados en los últimos años, las estrategias convencionales para el tratamiento de diversos tipos de cáncer, incluyendo la cirugía, radioterapia, quimioterapia, han tenido un impacto moderado en el pronóstico de los tumores y en especial en los cánceres gastrointestinales. La mayor parte de los medicamentos comercializados presentan la gran desventaja de no tener sistemas que los dirijan al órgano o tejido blanco, de manera que gran parte del fármaco que se mantiene circulante en el torrente sanguíneo incrementa los efectos secundarios causando toxicidad en los pacientes. Una estrategia interesante de direccionamiento la constituyen las moléculas glicosiladas debido a la alta especificidad de la interacción con los carbohidratos y la amplia gama de receptores celulares a los que pueden ser dirigidos de manera específica, permitiendo la administración selectiva de fármacos en los sitios activos deseados.40 Por otro lado, la glicosilación de moléculas bioactivas puede modificar su farmacocinética y modular su toxicidad. Se demostró que no solo es importante el número de residuos, sino también el tipo de azúcar que es adicionado para producir efectos sobre la toxicidad, actividad biológica o sobre la solubilidad de la molécula original.41 Esto resulta de interés, ya que el perfil de sensibilidad puede detectar el porcentaje de células resistentes a las drogas, y por tanto servir como herramienta en la selección de la segunda línea de terapia.
En conclusión, en este trabajo mostramos que es posible realizar cultivos primarios de muestras obtenidas por PAAF-EE. Aunque promisorios, estos resultados demuestran la posibilidad de obtener una muestra en la que podría predecirse la sensibilidad de las células tumorales al tratamiento. Asimismo, el modelo de estudio, utilizando muestras de tejido tumoral humano, nos da la posibilidad de detectar proteínas que servirían como marcadores de resistencia. Finalmente, describimos una segunda línea de terapia promisoria para el tratamiento del PDAC a utilizarse en combinación con gemcitabina. Estos resultados sugieren la posible utilización de compuestos glicoconjugados como terapias complementarias contra el cáncer de páncreas.
Agradecimientos. Los autores agradecen a la Revista Acta Gastroenterológica Latinoamericana, a su editor en jefe Dr. Horacio Vázquez y al Comité Editorial por el Premio al mejor Proyecto Científico 2016, que permitió iniciar este ambicioso proyecto y publicar los resultados obtenidos hasta el momento.
Conflicto de intereses. Los autores declaran no tener ningún conflicto de intereses.
Financiamiento. Subsidio otorgado en el año 2016 por Acta Gastroenterológica Latinoamericana al mejor proyecto de Investigación en Gastroenterología Clínica o Endoscopía; Consejo Nacional de Investigaciones Científicas y Técnicas, Universidad Nacional de La Pampa y Agencia Nacional de Promoción Científica y Técnica de la Argentina.
Referencias
- Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136: E359-E386.
- Rahib L, Smith BD, Aizenberg R, Rosenzweig AB, Fleshman JM, Matrisian LM. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res 2014; 74: 2913-2921.
- Yadav D, Lowenfels AB. The epidemiology of pancreatitis and pancreatic cancer. Gastroenterology 2013; 144: 1252-1261.
- Garrido-Laguna I, Hidalgo M. Pancreatic cancer: from state-of-the-art treatments to promising novel therapies. Nat Rev Clin Oncol 2015; 12: 319-334.
- Hidalgo M. Pancreatic Cancer. New England Journal of Medicine 2010; 362: 1605-1617.
- O’Reilly EM. Refinement of adjuvant therapy for pancreatic cancer. JAMA 2010; 304: 1124-1125.
- Ryan DP, Hong TS, Bardeesy N. Pancreatic adenocarcinoma. N Engl J Med 2014; 371: 2140-2141.
- Waddell N, Pajic M, Patch AM, Chang DK, Kassahn KS, Bailey P, Johns AL, Miller D, Nones K, Quek K, Quinn MC, Robertson AJ, Fadlullah MZ, Bruxner TJ, Christ AN, Harliwong I, Idrisoglu S, Manning S, Nourse C, Nourbakhsh E, Wani S, Wilson PJ, Markham E, Cloonan N, Anderson MJ, Fink JL, Holmes O, Kazakoff SH, Leonard C, Newell F, Poudel B, Song S, Taylor D, Waddell N, Wood S, Xu Q, Wu J, Pinese M, Cowley MJ, Lee HC, Jones MD, Nagrial AM, Humphris J, Chantrill LA, Chin V, Steinmann AM, Mawson A, Humphrey ES, Colvin EK, Chou A, Scarlett CJ, Pinho AV, Giry-Laterriere M, Rooman I, Samra JS, Kench JG, Pettitt JA, Merrett ND, Toon C, Epari K, Nguyen NQ, Barbour A, Zeps N, Jamieson NB, Graham JS, Niclou SP, Bjerkvig R, Grützmann R, Aust D, Hruban RH, Maitra A, Iacobuzio-Donahue CA, Wolfgang CL, Morgan RA, Lawlor RT, Corbo V, Bassi C, Falconi M, Zamboni G, Tortora G, Tempero MA; Australian Pancreatic Cancer Genome Initiative, Gill AJ, Eshleman JR, Pilarsky C, Scarpa A, Musgrove EA, Pearson JV, Biankin AV, Grimmond SM. Whole genomes redefine the mutational landscape of pancreatic cancer. Nature 2015; 518: 495-501.
- Kroemer G, Jaattela M. Lysosomes and autophagy in cell death control. Nature Rev Cancer 2005; 5: 886-897.
- Codogno P, Meijer AJ. 2005. Autophagy and signaling: their role in cell survival and cell death. Cell Death Differ 12: 1509-1518.
- Levine B, Klionsky DJ. Development by self-digestion: molecular mechanisms and biological functions of autophagy. Dev Cell 2004; 6: 463-477.
- Choi AM, Ryter SW, Levine B. 2013. Autophagy in human health and disease. N Engl J Med 14; 368: 651-662.
- Pattingre S, Tassa A, Qu X, Garuti R, Liang XH, Mizushima N, Packer M, Schneider MD, Levine B. 2005. Bcl-2 antiapoptotic proteins inhibit Beclin1-dependent autophagy. Cell 2005; 122: 927-939.
- Ogier-Denis E and Codogno P. 2003. Autophagy: a barrier or an adaptive response to cancer. Biochim Biophys Acta 1603: 113-128.
- Abedin M, Wang D, McDonnell M, Lehmann U, Kelekar A. 2007. Autophagy delays apoptotic death in breast cancer cells following DNA damage. Cell Death Differ 14: 500-510.
- Galluzzi L, Pietrocola F, Bravo-San Pedro JM, Amaravadi RK, Baehrecke EH, Cecconi F, Codogno P, Debnath J, Gewirtz DA, Karantza V, Kimmelman A, Kumar S, Levine B, Maiuri MC, Martin SJ, Penninger J, Piacentini M, Rubinsztein DC, Simon HU, Simonsen A, Thorburn AM, Velasco G, Ryan KM, Kroemer G. Autophagy in malignant transformation and cancer progression. EMBO J 2015; 34: 856-880.
- Hidalgo M, Cascinu S, Kleeff J, Labianca R, Löhr JM, Neoptolemos J, Real FX, Van Laethem JL, Heinemann V. Addressing the challenges of pancreatic cancer: Future directions for improving outcomes. Pancreatology 2015; 15: 8-18.
- Ropolo A, Grasso D, Pardo R, Sacchetti ML, Archange C, Lo Re A, Seux M, Nowak J, Gonzalez CD, Iovanna JL, Vaccaro MI. The pancreatitis-induced vacuole membrane protein 1 triggers autophagy in mammalian cells. J Biol Chem 2007; 282: 37124-37133.
- Grasso D, Sacchetti ML, Bruno L, Lo Ré A, Iovanna JL, Gonzalez CD, Vaccaro MI. Autophagy and VMP1 expression are early cellular events in experimental diabetes. Pancreatology 2009; 9: 81-88.
- Guardia T, Rotelli AE, Juarez AO, Pelzer LE. Anti-inflammatory properties of plant flavonoids. Effects of rutin, quercetin and hesperidin on adjuvant arthritis in rat. Farmaco 2001; 56: 683-687.
- Grdina DJ, Murley JS, Kataoka Y. Radioprotectants: current status and new directions. Oncology 2002; 63: 2-10.
- Weiss JF, Landauer MR. Protection against ionizing radiation by antioxidant nutrients and phytochemicals. Toxicology 2003; 189: 1-20.
- Arora R, Gupta D, Chawla R, Sagar R, Sharma A, Kumar R, Prasad J, Singh S, Samanta N, Sharma RK. Radioprotection by plant products: present status and future prospects. Phytother Res 2005; 19: 1-22.
- Javed H, Khan MM, Ahmad A, Vaibhav K, Ahmad ME, Khan A, Ashafaq M, Islam F, Siddiqui MS, Safhi MM, Islam F. Rutin prevents cognitive impairments by ameliorating oxidative stress and neuroinflammation in rat model of sporadic dementia of Alzheimer type. Neuroscience 2012; 210: 340-352.
- Quercetin and rutin prevent scopolamine-induced memory impairment in zebrafish. Richetti SK, Blank M, Capiotti KM, Piato AL, Bogo MR, Vianna MR, Bonan CD. Behav Brain Res 2011; 217: 10-15.
- Nassiri-Asl M, Mortazavi SR, Samiee-Rad F, Zangivand AA, Safdari F, Saroukhani S, Abbasi E. The effects of rutin on the development of pentylenetetrazole kindling and memory retrieval in rats. Epilepsy Behav 2010; 18: 50-53.
- Mellou F, Lazari D, Skaltsa H, Tselepis AD, Kolisis FN, Stamatis H. Biocatalytic preparation of acylated derivatives of flavonoid glycosides enhances their antioxidant and antimicrobial activity. J Biotechnol 2005; 116: 295-304.
- Trumbeckaite S, Bernatoniene J, Majiene D, Jakstas V, Savickas A, Toleikis A. The effect of flavonoids on rat heart mitochondrial function. Biomed Pharmacother 2006; 60: 245-248.
- Schwedhelm E, Maas R, Troost R, Böger RH. Clinical pharmacokinetics of antioxidants and their impact on systemic oxidative stress. Clin Pharmacokinet 2003; 42: 437-459.
- Janbaz KH, Saeed SA, Gilani AH. Protective effect of rutin on paracetamol- and CCl4-induced hepatotoxicity in rodents. Fitoterapia 2002; 73: 557-563.
- La Casa C, Villegas I, Alarcón de la Lastra C, Motilva V, Martín Calero MJ. Evidence for protective and antioxidant properties of rutin, a natural flavone, against ethanol induced gastric lesions. J Ethnopharmacol 2000; 71: 45-53.
- Danby PM, Withers SG. Advances in Enzymatic Glycoside Synthesis. ACS Chem. Biol. 2016; 11 (7): 1784-1794.
- Bissaro B, Monsan P, Fauré R, O’Donohue MJ. Glycosynthesis in a waterworld: new insight into the molecular basis of transglycosylation in retaining glycoside hydrolases. 2015 Apr 1; 467 (1): 17-35.
- Mazzaferro L, Piñuel L, Erra-Balsells R, Giudicessi SL, Breccia JD. Transglycosylation specificity of Acremonium sp. α-rhamnosyl- β-glucosidase and its application to the synthesis of the new fluorogenic substrate 4-methylumbelliferyl-rutinoside. Carbhydr Res 2012; 347: 69-75.
- Minig M, Mazzaferro LS, Erra-Balsells R, Petroselli G, Breccia JD. α-Rhamnosyl-β-glucosidase Catalyzed Reactions for Analysis and Biotransformations of Plant-Based Foods. J Agric Food Chem 2011; 59: 11238-11243.
- Calvaresia EC, Paul J. Hergenrother. Glucose conjugation for the specific targeting and treatment of cancer. Chem Sci 2013; 4: 2319-2333.
- Rodríguez ME, Catrinacio C, Ropolo A, Rivarola VA, Vaccaro MI. A novel HIF-1α/VMP1-autophagic pathway induces resistance to photodynamic therapy in colon cancer cells. Photochem Photobiol Sci. 2017 Nov 8; 16 (11): 1631-1642. doi: 10.1039/ c7pp00161d.
- Gilabert M, Vaccaro MI, Fernández-Zapico ME, Calvo EL, Turrini O, Secq V, Garcia S, Moutardier V, Lomberk G, Dusetti N, Urrutia R, Iovanna JL. Novel role of VMP1 as modifier of the pancreatic tumor cell response to chemotherapeutic drugs. J Cell Physiol 2013; 228: 1834-1843.
- Gemcitabine induces the VMP1-mediated autophagy pathway to promote apoptotic death in human pancreatic cancer cells. Pardo R, Lo Ré A, Archange C, Ropolo A, Papademetrio DL, González CD, Álvarez EM, Iovanna JL, Vaccaro MI. Pancreatology 2010; 10 (1): 19-26.
- Garnier P, Wang XT, Robinson MA, Kasteren S, Perkins AC, Frier M, Fairbanks AJ, Davis BG. Lectin-directed enzyme activated prodrug therapy (LEAPT): Synthesis and evaluation of rhamnose-capped prodrugs. J Drug Target 2010; 18: 794-802.
- Kim HJ, Kang SH, Choi SS, Kim ES. Redesign of antifungal polyene glycosylation: engineered biosynthesis of disaccharide-modified NPP. App Microbiol Biotechnol 2017; 101: 5131-5137.
Correspondencia: María I Vaccaro
Junín 954 (C1113AAD). Ciudad Autónoma de Buenos Aires, Argentina
Tel.: +5411 4964 8268
Correo electrónico: mvaccaro@ffyb.uba.ar
Acta Gastroenterol Latinoam 2019;49(3): 208-221
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE