Javier Molina-Infante,1, 2 Rodolfo Corti,3 Judith Doweck,3 Alfredo J Lucendo2, 4
1 Servicio de Aparato Digestivo, Hospital Universitario San Pedro de Alcántara. Cáceres, España.
2 Centro de Investigación Biomédica en Red Enfermedades Hepáticas y Digestivas (CIBEREHD). Madrid, España.
3 Hospital de Gastroenterología Dr. Carlos Bonorino Udaondo. Ciudad Autónoma de Buenos Aires, Argentina.
4 Hospital General de Tomelloso. Ciudad Real, España.
Acta Gastroenterol Latinoam 2018;48(3):242-252
Recibido: 19/06/2018 / Aprobado: 20/06/2018 / Publicado en www.actagastro.org el 17/09/2018
Resumen
La esofagitis eosinofílica es una enfermedad crónica caracterizada clínicamente por síntomas de mal función esofágica e histológicamente por infiltración densa por leucocitos eosinófilos. Su etiología es inmunoalérgica y es desencadenada en la mayoría de los casos por una alergia alimentaria no IgE mediada. En la actualidad se trata de una enfermedad común en Europa, Estados Unidos y Australia, y emergente en América del Sur y Asia. Durante la última década se han producido mejoras sustanciales en el algoritmo terapéutico de la enfermedad, desde la inclusión de los inhibidores de la bomba de protones como fármaco antiinflamatorio, la aparición de nuevos corticoides tópicos diseñados específicamente para la enfermedad, la simplificación y optimización de las dietas de eliminación y la aceptación de la dilatación endoscópica como un tratamiento coadyuvante altamente eficaz y seguro. Esta revisión trata de actualizar e imbricar, desde un punto de vista práctico, las principales opciones terapéuticas disponibles para esta nueva e intrigante enfermedad.
Palabras claves. Esofagitis eosinofílica, inhibidor de la bomba de protones, corticoides, dieta, dilatación.
Update on therapeutic strategies for eosinophilic esophagitis
Summary
Eosinophilic esophagitis (EoE) is a chronic disease clinically characterized by esophageal dysfunction symptoms and histologically by dense eosinophil infiltration. Pathophysiologically, it is considered a non IgE-mediated immuno-allergic disorder predominantly triggered by food antigens. Currently, it is a common disease in Europe, United States and Australia, with emergent trends in Asia and South America. Over the past decade, notable improvements have been accomplished within the therapeutic algorithm for EoE, including the acceptance of proton pump inhibitor drugs as an anti-inflammatory therapeutic asset, the development of steroid therapy specifically designed for topical delivery, the simplification and optimization of elimination diet schemes, aside from the recognition of endoscopic dilation as a highly effective and safe coadyuvant therapy. This review aims to update and gather, from a practical standpoint, the main therapeutic strategies available for this novel and intriguing disease.
Key words. Eosinophilic esophagitis, proton pump inhibitor, topical corticosteroid, diet, dilation.
Abreviaturas
EoE: esofagitis eosinofílica.
EOS/CGA: eosinófilos por campo de gran aumento.
ERGE: enfermedad por reflujo gastroesofágico.
IBP: inhibidor de la bomba de protones.
La esofagitis eosinofílica (EoE) es una enfermedad inflamatoria del esófago de carácter crónico, caracterizada clínicamente por síntomas de disfunción esofágica, e histológicamente por inflamación esofágica en la que predominan los leucocitos eosinófilos, habitualmente más de 15 eosinófilos por campo de gran aumento (eos/ cga). Actualmente se la considera una forma distinta de alergia alimentaria, no IgE mediada, desencadenada predominantemente pero no exclusivamente por antígenos alimentarios.1, 2 La incidencia y prevalencia (al ser una enfermedad crónica) de la enfermedad se han disparado desde la caracterización inicial de la EoE como un síndrome clínico patológico propio distinto de la gastroenteritis eosinofílica, llevada a cabo a principios de los años 1990 por dos grupos independientes de investigadores en Estados Unidos y Suiza.3, 4 La EoE ha dejado de ser una enfermedad rara y afecta al menos a 1 de cada 1000-2000 habitantes en Europa y Norteamérica,5, 6 mientras que las cifras de incidencia en niños y adultos más recientemente comunicadas en España7, 8 (en el entorno de los 100 casos por cada 100.000 habitantes) son preocupantemente cercanas a las conocidas para la enfermedad inflamatoria intestinal, descrita hace casi un siglo. Como resultado de lo anteriormente mencionado, la EoE representa en la actualidad la segunda causa de esofagitis crónica tras la enfermedad por reflujo gastroesofágico (ERGE) y la principal causa de disfagia e impactación alimentaria en niños y adultos jóvenes. Se desconoce la causa por la que alimentos consumidos por el hombre desde el neolítico; como la leche, el trigo, los huevos y las legumbres, han comenzado, en los últimos 25 años, a provocar esta enfermedad, aunque se sospecha que múltiples factores relacionados con el estilo de vida moderno (mejora de las condiciones higiénicas, cambios en el tipo de alimentos consumidos, modificación genética y contaminación con químicos y aditivos de los alimentos, cría de animales con hormonas y antibióticos, así como los cambios secundarios en la microbiota intestinal humana) pueden estar involucrados en la génesis de la enfermedad.9
Durante la última década, el volumen de evidencia científica disponible sobre los distintos aspectos epidemiológicos, fisiopatológicos, clínicos y terapéuticos de la EoE ha crecido de manera exponencial, y ha sido actualizado secuencialmente en 4 documentos de consenso y guías de práctica clínica desarrollados por grupos de expertos.10-13 Sin embargo, el avance en el conocimiento posterior ha generado varios ensayos clínicos aleatorizados y controlados, artículos originales novedosos y meta análisis con revisiones sistemáticas, ausentes en todas las guías previas, por lo que estas se encuentran actualmente obsoletas. Además, la calidad global de todas las guías previas es limitada, pues ninguna empleó métodos específicos para establecer la calidad de las pruebas o el peso de las afirmaciones y recomendaciones que proporcionaban.14 Una nueva guía clínica desarrollada por un grupo internacional de expertos, utilizando el sistema GRADE para clasificar la evidencia y la fuerza de las recomendaciones, ha sido publicada en el año 2017 bajo el auspicio de la United European Gastroenterology.1 Las recomendaciones de la presente revisión narrativa, únicamente concernientes a los aspectos terapéuticos, están establecidas en las recomendaciones basadas en la evidencia de la guía clínica actualizada combinada con la visión personal de los autores.
-
Historia natural de la EoE
La EoE es una enfermedad crónica, como atestiguaron tres series iniciales publicadas antes de 2010, una en adultos15 y dos en niños,16, 17 con un seguimiento medio de 7 y 8 años. De manera consistente, los síntomas y la infiltración eosinofílica esofágica persistían a lo largo del tiempo sin tratamiento y recidivaban con frecuencia al suspenderlo.
La EoE es también una enfermedad progresiva, desde un fenotipo inflamatorio hacia otro fibroestenosante. En población adulta, la duración de la enfermedad no tratada constituye el principal factor de riesgo para la remodelación fibrosa esofágica y la formación de estenosis,18 cuya prevalencia aumenta del 47% al 88% cuando el retraso diagnóstico (y la ausencia de tratamiento aparejado) pasa de 2 a más de 20 años,19 y se duplica con cada aumento de 10 años en la edad del paciente al diagnóstico.20, 21 Recientemente, se ha demostrado que esta progresión fenotípica puede ocurrir incluso dentro de la edad pediátrica, cuando la distensibilidad esofágica (medida mediante el dispositivo esofágico FLIP) se ve progresivamente reducida en presencia de inflamación activa a medida que la edad de los niños va aumentado, hasta los 18 años.22
Por su carácter crónico y progresivo, la EoE impacta sobre la calidad de vida y el ajuste psicosocial de los niños afectados y de sus familias, dado que produce ansiedad y depresión, deterioro del sueño y problemas escolares.23 Entre los adultos, la EoE afecta el funcionamiento psicosocial, pero no el bienestar físico o el funcionamiento mental.24 Las impactaciones alimentarias de repetición, las limitaciones derivadas de restricciones dietéticas y la duración prolongada de los síntomas son los principales determinantes de calidad de vida en adultos.24 La calidad de vida empeora en todas las edades en los casos con síntomas esofágicos más pronunciados y enfermedad histológica activa.23
-
Objetivos terapéuticos
Los aspectos más importantes para tener en cuenta respecto de los objetivos terapéuticos de la EoE están resumidos en la Tabla 1. Al tratarse de una entidad clínica e histológica, los objetivos terapéuticos mínimos serán la resolución de los síntomas y de la inflamación eosinofílica esofágica, arbitrariamente definida por un umbral de curación por debajo de 15 eos/cga, para prevenir la ulterior aparición de complicaciones fibroestenosantes y mejorar la calidad de vida de los pacientes. La correcta caracterización de los síntomas en la EoE es una tarea difícil en la actualidad, por la mala capacidad de los niños para su correcta transmisión y por la capacidad de adaptación y normalización de la disfagia en adultos, con desarrollo de estrategias adaptativas tales como evitar comidas duras y secas, la masticación excesiva o ayudarse recurrentemente con agua en las comidas. Este hecho fue recientemente constatado en un estudio prospectivo multicéntrico llevado a cabo en 269 pacientes adultos, donde se pudo comprobar la escasa utilidad de los síntomas para predecir la actividad endoscópica e histológica de la EoE (área bajo la curva ROC 0,6).25 Por tanto, un aspecto importante a tener en cuenta es que no parece lógico tratar la EoE a demanda de los síntomas, como se hace en otras enfermedades esofágicas (por ejemplo, la ERGE) o alérgicas (por ejemplo, el asma) y siempre se debe correlacionar la respuesta sintomática con la respuesta histológica (mediante biopsias) a las 6-12 semanas de la instauración de cualquier intervención terapéutica. En este sentido, se han señalado recientemente un número relevante de similitudes entre la EoE y la enfermedad de Crohn en cuanto a su historia natural y sus objetivos terapéuticos.26 Ambas son entidades clínico-patológicas, crónicas y en muchos casos progresivas, donde los síntomas se correlacionan mal con la actividad biológica y donde el objetivo ideal deseado sería la remisión completa de los síntomas y de la inflamación. Desafortunadamente, no existen en la actualidad marcadores no invasivos de actividad de la EoE, como la calprotectina fecal o la enteroresonancia magnética nuclear en la enfermedad de Crohn. El desarrollo del String Test27 y de la citoesponja28 son las primeras exploraciones mínimamente invasivas evaluadas con éxito para la EoE.
Tabla 1. Aspectos claves en los objetivos terapéuticos en la EoE

-
Tratamiento de la enfermedad
Se han alcanzado múltiples avances terapéuticos a lo largo de la última década en el tratamiento farmacológico y dietético de los pacientes con EoE. El más destacado ha sido la aceptación de que los pacientes con datos clínicos, endoscópicos e histológicos que responden a IBP constituyen un sub-fenotipo de pacientes con EoE,1, 29 a diferencia de lo que afirmaban todas las guías clínicas previas,10-13 en las que la respuesta a IBP descartaba la existencia de EoE. Múltiples estudios recientes han demostrado que la expresión genotípica y molecular de los pacientes con EoE es similar, independientemente de la respuesta o ausencia de respuesta a IBP.1, 29, 30 Igualmente, se ha podido confirmar que los IBP condicionan los mismos efectos antiinflamatorios a nivel molecular que los corticoides deglutidos tópicos.1, 29 Como veremos más abajo, la optimización de las formulaciones tópicas de corticoides, la simplificación de los esquemas de restricción dietética y la constatación de la seguridad de la dilatación endoscópica han sido otros hitos destacables en el ámbito terapéutico.
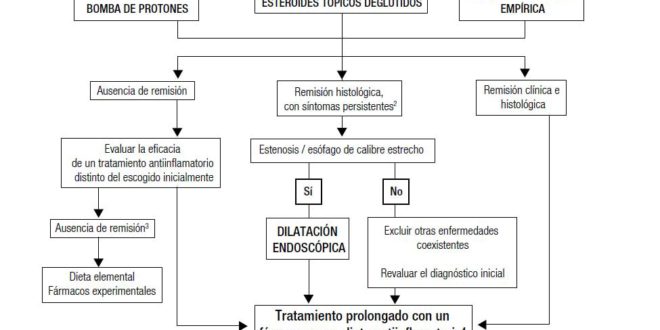
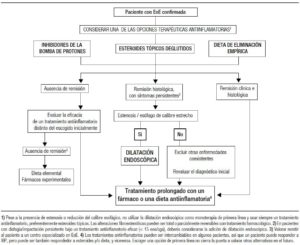
Un concepto clave en el tratamiento EoE es que se debe instaurar siempre un tratamiento antiinflamatorio como tratamiento de inducción, y probablemente de mantenimiento, dado que al interrumpir el tratamiento farmacológico los síntomas y la eosinofilia esofágica recurren típicamente tras un período de 3 a 6 meses.1 La estrategia terapéutica a largo plazo para los tratamientos farmacológicos, por tanto, consistirá en emplear dosis mínimas eficaces para mantener la remisión, mientras que en el tratamiento dietético es evitar a largo plazo exclusivamente los alimentos que se han demostrado causantes de la enfermedad, tras su reintroducción individual.1 Cualquier tratamiento antiinflamatorio eficaz (IBP, corticoides tópicos, dieta) debe asociarse a dilatación endoscópica si existe disfagia persistente o alteraciones del calibre esofágico.1 Las herramientas terapéuticas antiinflamatorias pueden ser intercambiables a lo largo del tiempo, dependiendo del deseo de cambio del paciente, de la aparición de efectos secundarios o de la pérdida de respuesta.26 Dos series recientes prospectivas de pacientes han demostrado que los pacientes respondedores a corticoides o dieta de eliminación responden también a tratamiento con IBP, y viceversa.31, 32 Por tanto, la elección de un tratamiento inicial no impide que el paciente pueda ser transferido a otro tratamiento antiinflamatorio a lo largo de la evolución de la enfermedad. En la Figura 1 se sugiere un algoritmo terapéutico actualizado para el tratamiento de inducción y mantenimiento de la EoE.
3.1. Inhibidores de la bomba de protones (IBP)
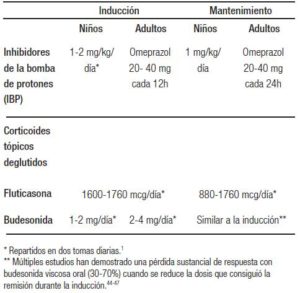
Entre los fármacos con capacidad antiinflamatoria útiles en la EoE, diversos estudios prospectivos han demostrado que el tratamiento con IBP es capaz de inducir la remisión histológica de la enfermedad (definida como una reducción del infiltrado eosinofílico por debajo de los 15 eos/cga) entre el 47% y el 57% de los pacientes adultos y pediátricos.33, 34 Una reciente revisión sistemática con meta análisis, que incluyó 33 estudios con 619 pacientes con EoE, demostró que los IBP inducían la remisión histológica en el 50,5% (IC95%: 42,2-58,7%) y la mejoría sintomática en el 60,8% (IC95%: 48,4-72,2%) de los pacientes tratados, sin documentar diferencias significativas respecto de la edad de los pacientes, el diseño del estudio o el tipo de IBP evaluado.35 Sin embargo, sí se observó una tendencia hacia una mayor eficacia cuando se repartió la dosis total en dos tomas al día, y entre los pacientes con un reflujo gastroesofágico patológico en la pHmetría.35 Las dosis recomendadas de IBP en adultos son omeprazol 20-40 mg dos veces al día o equivalente; en niños, 1-2 mg/kg de omeprazol o equivalente (Tabla 2). Respecto del tratamiento a largo plazo, dos series prospectivas en adultos36, 37 y una más reciente en pacientes pediátricos38 han evidenciado que el 75%-80% de los pacientes pueden conservar la respuesta clínica e histológica a lo largo del tiempo con dosis bajas de mantenimiento (Tabla 2). Entre los pacientes en los que recidiva la inflamación tras la reducción de dosis de IBP, la mayoría (70%) pueden recuperar la remisión con el re-incremento de dosis de IBP.36 No existen datos publicados sobre problemas de seguridad de los IBP en pacientes con EoE.
Tabla 2. Dosis recomendadas para la inducción y el mantenimiento de la enfermedad con IBP y corticoides tópicos deglutidos.
3.2. Corticoides tópicos
Aunque todavía no existe ninguna formulación específica comercializada para tratar la EoE, se han realizado múltiples ensayos aleatorizados en niños y adultos con corticoides tópicos, resumidos en varias revisiones sistemáticas y metaanálisis.39-41 Estos estudios han confirmado la elevada eficacia de estos fármacos para inducir la remisión histológica en la EoE. Sin embargo, la interpretación comparativa de los resultados es compleja por la variabilidad en los criterios de inclusión, los fármacos utilizados (fluticasona o budesonida), las dosis diarias, la duración del tratamiento (de 2 a 12 semanas), los modos de aplicación del fármaco (inhaladores con polvo seco, suspensiones de viscosidad variable, o comprimidos efervescentes buco dispersables), y los criterios para definir remisión histológica (de < 1 a < 20 eos/cga). Sin embargo, parece claro que el sistema de liberación del fármaco a lo largo del esófago resulta esencial para alcanzar una adecuada y mantenida cobertura de la mucosa del órgano, evitando el depósito del corticoide en otros tejidos. Un ensayo clínico que comparó la eficacia de 1 mg de budesonida administrado dos veces como solución viscosa frente a aerosol demostró una tasa de remisión histológica completa significativamente mayor en el primer grupo (64% vs. 27%).42 El tiempo de contacto del fármaco con la mucosa medido mediante escintigrafía fue significativamente más prolongado en los pacientes tratados con budesonida viscosa, y especialmente en el esófago distal.42 Por tanto, se deben evitar los aerosoles y se debe usar preferiblemente la vía oral deglutida. Una nueva fórmula de budesonida en investigación, administrada en comprimidos efervescentes oro-dispersables específicamente diseñados para la liberación del fármaco en el esófago, ha demostrado capacidad para inducir remisión histológica universal en toda la longitud del esófago tras solo 2 semanas de tratamiento.43
A diferencia de la remisión histológica, los datos sobre la eficacia de los corticoides tópicos en la resolución de los síntomas son menos sólidos, sin que varios ensayos pudieran demostrar ventajas significativas frente al placebo.
Figura 1. Algoritmo terapéutico actualizado para el tratamiento de inducción y mantenimiento de la EoE.
El uso de escalas no validadas para evaluar los síntomas, la inclusión de pacientes con enfermedad más grave o no considerar las adaptaciones en el comportamiento alimentario de los pacientes para minimizar la disfagia son posibles explicaciones que están siendo solventadas en estudios más recientes.44 Respecto de la remisión a largo plazo, la pérdida de respuesta es frecuente con la disminución de dosis (30%-70%)45-47 o el tratamiento con budesonida a días alternos (90%),48 mientras que dos estudios recientes con propionato de fluticasona han conseguido demostrar una alta eficacia mantenida (superior al 70%) cuando se administraba fluticasona a la misma dosis o la mitad de dosis de la que consiguiera la inducción previamente.49, 50 Las dosis sugeridas de corticoides tópicos para la inducción y mantenimiento se encuentran resumidas en la Tabla 2.
Los corticoides tópicos deglutidos para el tratamiento de la EoE parecen mostrar un perfil de seguridad favorable, sin efectos adversos graves a corto plazo, y similar al documentado en los pacientes tratados con placebo, según los datos obtenidos de los ensayos clínicos realizados hasta la fecha. La candidiasis esofágica es el efecto adverso más frecuente (5-10%), siendo en la mayoría de los casos asintomática y encontrada incidentalmente durante la valoración endoscópica tras el tratamiento. Las fórmulas viscosas buco dispersables o en aerosol no han mostrado diferencias en la frecuencia de candidiasis asociada. Pequeñas series recientes de pacientes pediátricos tratados de manera prolongada con corticoides tópicos han generado cierta incertidumbre respecto de la potencial supresión del eje hipófiso-suprarrenal,51 que no ha sido confirmado en otras series52, 53 ni en ensayos clínicos frente a placebo.43, 44 En todo caso, la reducción de los niveles de cortisol plasmático ha sido el único efecto documentado, sin signos clínicos de insuficiencia suprarrenal o impacto sobre el crecimiento tras 5 años de tratamiento.50 Hasta que se disponga de datos sólidos de ensayos clínicos a largo plazo, podría aconsejarse la monitorización de cortisol sérico en los niños con EoE que están recibiendo dosis altas de corticoides tópicos deglutidos por largos períodos, o en caso de uso concomitante con corticoides inhalados/ nasales para otras alergias asociadas.1, 53
3.3. Dietas de eliminación empíricas
El gran atractivo del tratamiento dietético para la EoE procede de la posibilidad de mantener la remisión a largo plazo sin necesidad de fármacos en una enfermedad crónica que afecta a niños y jóvenes, con la ventaja de un menor coste para los sistemas sanitarios. En las dos décadas de historia de la EoE se han evaluado varias intervenciones dietéticas, que comprenden la alimentación exclusiva mediante una fórmula elemental (eficaz pero inviable a largo plazo), la eliminación dirigida de alimentos en función de los resultados de las pruebas de alergia (ineficaz en adultos y con resultados contradictorios en niños), y la eliminación empírica de los alimentos más probablemente causantes de EoE, que es el estándar actual en la práctica clínica. En la Tabla 3 se encuentran resumidas una serie de recomendaciones prácticas clave al considerar el tratamiento dietético para un paciente con EoE.54
Tabla 3. Recomendaciones prácticas para la realización de dietas de eliminación empíricas
La dieta elemental (consistente en evitar cualquier alimento sólido y sustituirlo por formulaciones de aminoácidos desprovistas de capacidad antigénica) es la intervención dietética más eficaz para la EoE, capaz de inducir remisión histológica en el 90,8% (IC95%: 84,7-95,5%) de los pacientes pediátricos y adultos.55 Sin embargo, su mal sabor, que requiere el uso frecuente de sonda nasogástrica, la escasa adhesión al tratamiento, sus efectos psicológicos y sociales al evitar todo consumo de alimentos convencionales, y su alto coste, no cubierto en muchos casos por los sistemas sanitarios, limitan de manera evidente su implementación.
La eliminación de alimentos basada en los resultados de las pruebas de alergia alimentaria de prick cutáneos o con parches epicutáneos fue evaluada por vez primera en 2002, en una serie pediátrica, en la que tras excluir una media de cinco alimentos se logró la remisión histológica documentada mediante endoscopía en el 49% de los pacientes.56 Sin embargo, la identificación de los alimentos específicos causantes de la enfermedad, entre los pacientes respondedores, se basó exclusivamente en la recurrencia de los síntomas, evaluada por los padres tras la reintroducción individual de alimentos, sin realización de biopsias esofágicas. Una década más tarde, el mismo grupo de investigación actualizó sus resultados a eficiencia global del 53%.57 Sin embargo, diversos estudios han mostrado peores resultados con esta estrategia en niños.55 Un metaanálisis reveló que la eficacia global de la dieta de eliminación dirigida por pruebas cutáneas para logar remisión histológica era del 45,5% (IC95%: 35,4-55,7%), con una gran heterogeneidad (I2: 75%), indicativa de una baja reproducibilidad.55 Los resultados de esta estrategia en adultos fueron inferiores en este meta análisis (32%)55 y, a diferencia de la bibliografía en niños, todos los estudios son concordantes. En adultos, un primer estudio demostró una baja eficacia, inferior al 25%, combinando pruebas cutáneas y epicutáneas,58 mientras que un segundo estudio guiando la dieta mediante microarrays de IgE a partir de muestras de sangre tuvo que interrumpirse precozmente por una eficacia mínima del 7%.59 Finalmente, un excelente estudio australiano reciente consiguió demostrar una escasa capacidad predictiva de una combinación de los resultados de las pruebas de alergia en piel y de análisis de sangre con mediciones de reacciones inmediatas o tardías en respondedores a dieta empírica de 6 alimentos.60 Por todas estas razones, la Academia Europea de Alergia e Inmunología Clínica (EAACI) ha recomendado no realizar estas pruebas cutáneas o en sangre para tratar de identificar los alimentos responsables de la EoE, porque su precisión diagnóstica es insuficiente para diseñar dietas eficaces.2 Recientemente se ha desarrollado un prick test esofágico mediante la inyección en la mucosa esofágica directa de los alérgenos.60 En un total de 8 pacientes adultos, 5 mostraron reacción local inmediata o difusa en forma de habón tras la inyección de soja (n=2), plátano, manzana, avena y avellana. Esta reacción fue siempre transitoria. Sin embargo, ningún paciente reaccionó con la inyección de leche, trigo y huevos (los alimentos que más frecuentemente provocan la enfermedad) y no se demostró la curación de la enfermedad mediante la retirada exclusiva de estos alimentos.61
Debido a la inviabilidad de la dieta elemental en la práctica clínica y a la baja sensibilidad y especificidad de las pruebas de alergia para identificar los alimentos causantes de EoE, en 2006 se probó la eficacia de una dieta de eliminación empírica de 6 alimentos (consistente en suprimir de la dieta los seis alimentos más comúnmente asociados con alergia en la población pediátrica de Chicago: proteína de leche de vaca, trigo, huevo, soja, frutos secos, y pescados y mariscos). Este estudio demostró una remisión histológica de la enfermedad en el 74% de los niños tratados.62 Resultados similares han sido obtenidos en pacientes de todas las edades, y resumidos en un meta análisis de siete estudios observacionales que proporcionó una eficacia homogénea (I2 =0%) del 72% (IC95%: 66- 78%) en niños y adultos.55 La reintroducción secuencial de cada uno de los alimentos excluidos bajo control endoscópico e histológico permite identificar con certeza a los alimentos responsables de la EoE en cada paciente.63-65 Sin embargo, el alto grado de restricción dietética y el gran número de endoscopías necesarias para completar este proceso, unido al hecho de que la mayoría de los pacientes que responden tendrán únicamente 1 ó 2 alimentos causantes de su EoE ha llevado a esquemas más sencillos, como la dieta de eliminación de 4 alimentos (leche, trigo, huevo y leguminosas/soja) con una eficacia global para lograr la remisión histológica de la EoE del 54% en adultos66 y del 64% en niños.67 Más recientemente un estudio multicéntrico prospectivo ha evaluado sobre 120 pacientes de todas las edades la eficacia de una dieta de eliminación de 2 alimentos (leche y cereales con gluten), seguida por una de 4 alimentos en los casos sin resolución histológica, y reservando la dieta de 6 alimentos como última opción de rescate.68 Este acercamiento terapéutico escalonado (2-4-6) logró tasas de remisión clínica e histológica del 43%, 60% y 79% respectivamente, reduciendo además en un 20% el número de endoscopías y el tiempo de proceso diagnóstico, respecto de comenzar con una dieta de 6 alimentos.68 Una ventaja adicional es que el 90% de los respondedores a una dieta empírica de eliminación de 2 ó 4 alimentos tendrán únicamente uno o dos alimentos causantes.68 Una vez identificados los alimentos responsables de la EoE en cada paciente mediante su reintroducción individual seguida de endoscopía, la evitación a largo plazo mantiene la remisión de la enfermedad. Dos estudios en adultos63, 64 y uno más en pacientes pediátricos62 han confirmado el mantenimiento inicial de la remisión histológica durante al menos 3-4 años sin necesidad de fármacos.
3.4. Dilatación endoscópica
La dilatación con balones, bujías o dilatadores rígidos es el único tratamiento endoscópico disponible para la EoE. Su eficacia ha sido plasmada en un reciente meta-análisis de 27 estudios observacionales sobre un total de 845 pacientes y 1820 dilataciones esofágicas.69 Se documentó una mejoría sintomática en el 95% de los pacientes (IC95%: 90-98%), con una duración del efecto de alivio sintomático muy variable. Las complicaciones fueron infrecuentes, incluyendo perforación (0,38%), hemorragia (0,05%) y hospitalización (0,67%), sin mortalidad.69 En la Tabla 4 aparecen glosados consejos prácticos para optimizar la indicación, la técnica y la seguridad del procedimiento endoscópico.70, 71
La dilatación esofágica no controla la inflamación crónica que contribuye al remodelado esofágico, por lo que no debería emplearse de manera aislada sin un tratamiento antiinflamatorio (IBP, corticoides tópicos o dieta) eficaz concomitante. De hecho, estudios recientes han confirmado la existencia de pacientes con estenosis complejas resueltas con tratamiento médico.72, 73 De igual manera, la reducción de la distensibilidad esofágica y no necesariamente las alteraciones en el calibre del órgano parecen claves para la aparición de disfagia e impactación alimentaria.74 En línea con lo expresado recientemente, se ha demostrado una mejoría de la distensibilidad con tratamiento farmacológico o dietético sin dilatación,75, 76 así que el tratamiento médico o dietético puede revertir parcial o totalmente la remodelación fibrosa.
Tabla 4. Recomendaciones prácticas para la realización de dilatación endoscópica.
Referencias
- Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, AmilDias J, Bove M, González-Cervera J, Larsson H, Miehlke S, Papadopoulou A, Rodríguez-Sánchez J, Ravelli A, Ronkainen J, Santander C, Schoepfer AM, Storr MA, Terreehorst I, Straumann A, Attwood SE. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J 2017; 5: 335-358.
- Simon D, Cianferoni A, Spergel JM, Aceves S, Holbreich M, Venter C, Rothenberg ME, Terreehorst I, Muraro A, Lucendo AJ, Schoepfer A, Straumann A, Simon HU. Eosinophilic esophagitis is characterized by a non-IgE-mediated food hypersensitivity. Allergy 2016; 71: 611-620.
- Attwood SE, Smyrk TC, Demeester TR, Jones JB. Esophageal eosinophilia with dysphagia. A distinct clinic-pathologic syndrome. Dig Dis Sci 1993; 38: 109-116.
- Straumann A, Spichtin HP, Bernoulli R, Loosli J, Vögtlin J. Idiopathic eosinophilic esophagitis: a frequently overlooked disease with typical clinical aspects and discrete endoscopic findings. Schweiz Med Wochenschr 1994; 124: 1419-1429.
- Arias A, Pérez-Martínez I, Tenías JM, Lucendo AJ. Systematic review with meta-analysis: The incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther 2016; 43: 3-15.
- Dellon ES, Hirano I. Epidemiology and natural history of eosinophilic esophagitis. Gastroenterology 2018; 154: 319-332.
- Molina-Infante J, Gonzalez-Cordero PL, Ferreira-Nossa HC, Mata-Romero P, Lucendo AJ, Arias A. Rising incidence and prevalence of adult eosinophilic esophagitis in mid-western Spain (2007-2016). United European Gastroenterol J 2018; 6: 29-37.
- Arias A, Lucendo AJ. All ages incidence and prevalence of eosinophilic oesophagitis increase continuously in central Spain: A 12-year population-based study. Dig Liver Dis 2018 (in press).
- Spechler SJ. Speculation as to why the frequency of eosinophilic esophagitis is increasing. Curr Gastroenterol Rep 2018; 20: 26.
- Furuta GT, Liacouras CA, Collins MH, Gupta SK, Justinich C, Putnam PE, Bonis P, Hassall E, Straumann A, Rothenberg ME; First International Gastrointestinal Eosinophil Research Symposium (FIGERS) Subcommittees. Eosinophilic esophagitis in children and adults: a systematic review and consensus recommendations for diagnosis and treatment. Gastroenterology 2007; 133: 1342-1363.
- Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, Burks AW, Chehade M, Collins MH, Dellon ES, Dohil R, Falk GW, Gonsalves N, Gupta SK, Katzka DA, Lucendo AJ, Markowitz JE, Noel RJ, Odze RD, Putnam PE, Richter JE, Romero Y, Ruchelli E, Sampson HA, Schoepfer A, Shaheen NJ, Sicherer SH, Spechler S, Spergel JM, Straumann A, Wershil BK, Rothenberg ME, Aceves SS. Eosinophilic esophagitis: Updated consensus recommendations for children and adults. J Allergy Clin Immunol 2011; 128: 3-20.
- Dellon ES, Gonsalves N, Hirano I, Furuta GT, Liacouras CA, Katzka DA; American College of Gastroenterology ACG clinical guideline: Evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis (EoE). Am J Gastroenterol 2013; 108: 679-692.
- Papadopoulou A, Koletzko S, Heuschkel R, Dias JA, Allen KJ, Murch SH, Murch SH, Chong S, Gottrand F, Husby S, Lionetti P, Mearin ML, Ruemmele FM, Schäppi MG, Staiano A, Wilschanski M, Vandenplas Y; ESPGHAN Eosinophilic Esophagitis Working Group and the Gastroenterology Committee. Management guidelines of eosinophilic esophagitis in childhood. J Pediatr Gastroenterol Nutr 2014; 58: 107-118.
- Lucendo AJ, Arias Á, Redondo-González O, Molina-Infante J. Quality assessment of clinical practice guidelines for eosinophilic esophagitis using the AGREE II instrument. Expert Rev Gastroenterol Hepatol 2017; 11: 383-390.
- Straumann A, Spichtin H-P, Grize L, Bucher KA, Beglinger C, Simon H-U. Natural history of primary eosinophilic esophagitis: a follow-up of 30 adult patients for up to 11.5 years. Gastroenterology 2003; 125: 1660-1669.
- Assa’ad AH, Putnam PE, Collins MH, Akers RM, Jameson SC, Kirby CL, Buckmeier BK, Bullock JZ, Collier AR, Konikoff MR, Noel RJ, Guajardo JR, Rothenberg ME. Pediatric patients with eosinophilic esophagitis: an 8-year follow-up. J Allergy Clin Immunol 2007; 119: 731-738.
- Spergel JM, Brown-Whitehorn TF, Beausoleil JL, Franciosi J, Shuker M, Verma R, Liacouras CA. 14 years of eosinophilic esophagitis: clinical features and prognosis. J Pediatr Gastroenterol Nutr 2009; 48: 30-36.
- Lipka S, Kumar A, Richter JE. Impact of diagnostic delay and other risk factors on eosinophilic esophagitis phenotype and esophageal diameter. J Clin Gastroenterol 2016; 50: 134-140.
- Schoepfer AM, Safroneeva E, Bussmann C, Kuchen T, Portmann S, Simon H-U, et al. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a time-dependent manner. Gastroenterology 2013; 145: 1230-1236.
- Dellon ES, Kim HP, Sperry SLW, Rybnicek DA, Woosley JT, Shaheen NJ. A phenotypic analysis shows that eosinophilic esophagitis is a progressive fibrostenotic disease. Gastrointest Endosc 2014; 79: 577-585.
- Warners MJ, Oude Nijhuis RAB, de Wijkerslooth LRH, Smout AJPM, Bredenoord AJ. The natural course of eosinophilic esophagitis and long-term consequences of undiagnosed disease in a large cohort. Am J Gastroenterol 2018; Apr 27. doi: 10.1038/s41395- 018-0052-5.
- Menard-Katcher C, Benitez AJ, Pan Z, Ahmed FN, Wilkins BJ, Capocelli KE, Liacouras CA, Verma R, Spergel JM, Furuta GT, Muir AB. Influence of age and eosinophilic esophagitis on esophageal distensibility in a pediatric cohort. Am J Gastroenterol 2017; 112: 1466-1473.
- Lucendo AJ, Arias-González L, Molina-Infante J, Arias Á. Systematic review: health-related quality of life in children and adults with eosinophilic oesophagitis-measure instruments and determinant factors. Aliment Pharmacol Ther 2017; 46: 401-409.
- Lucendo AJ, Arias-González L, Molina-Infante J, Arias Á. Determinant factors of quality of life in adult patients with eosinophilic esophagitis. United European Gastroenterol J 2018; 6: 38-45.
- Safroneeva E, Straumann A, Coslovsky M, Zwahlen M, Kuehni CE, Panczak R, Haas NA, Alexander JA, Dellon ES, Gonsalves N, Hirano I, Leung J, Bussmann C, Collins MH, Newbury RO, De Petris G, Smyrk TC, Woosley JT, Yan P, Yang GY, Romero Y, Katzka DA, Furuta GT, Gupta SK, Aceves SS, Chehade M, Spergel JM, Schoepfer AM. International Eosinophilic Esophagitis Activity Index Study Group. Symptoms have modest accuracy in detecting endoscopic and histologic remission in adults with eosinophilic esophagitis. Gastroenterology 2016; 150: 581-590.
- Molina-Infante J, Schoepfer AM, Lucendo AJ, Dellon ES. Eosinophilic esophagitis: What can we learn from Crohn’s disease? United European Gastroenterol J 2017; 5: 762-772.
- Furuta GT, Kagalwalla AF, Lee JJ, Alumkal P, Maybruck BT, Fillon S, Masterson JC, Ochkur S, Protheroe C, Moore W, Pan Z, Amsden K, Robinson Z, Capocelli K, Mukkada V, Atkins D, Fleischer D, Hosford L, Kwatia MA, Schroeder S, Kelly C, Lovell M, Melin-Aldana H, Ackerman SJ. The oesophageal string test: a novel, minimally invasive method measures mucosal inflammation in eosinophilic oesophagitis. Gut 2013; 62: 1395-1405.
- Katzka DA, Smyrk TC, Alexander JA, Geno DM, Beitia RA, Chang AO, Shaheen NJ, Fitzgerald RC, Dellon ES. Accuracy and safety of the cytosponge for assessing histologic activity in eosinophilic esophagitis: A Two-Center Study. Am J Gastroenterol 2017; 112: 1538-1544.
- Molina-Infante J, Bredenoord AJ, Cheng E, Dellon ES, Furuta GT, Gupta SK, Hirano I, Katzka DA, Moawad FJ, Rothenberg ME, Schoepfer A, Spechler SJ, Wen T, Straumann A, Lucendo AJ. PPI-REE Task Force of the European Society of Eosinophilic Oesophagitis (EUREOS). Proton pump inhibitor-responsive oesophageal eosinophilia: An entity challenging current diagnostic criteria for oeosinophilic oesophagitis. Gut 2016; 65: 521-531.
- Peterson KA, Yoshigi M, Hazel MW, Delker DA, Lin E, Krishnamurthy C, Consiglio N, Robson J, Yandell M, Clayton F. RNA sequencing confirms similarities between PPI-responsive oesophageal eosinophilia and eosinophilic oesophagitis. Aliment Pharmacol Ther 2018; 48: 219-225.
- Lucendo AJ, Arias Á, González-Cervera J, Olalla JM, Molina-Infante J. Dual response to dietary/topical steroid and proton pump inhibitor therapy in adult patients with eosinophilic esophagitis. J Allergy Clin Immunol 2016;137: 931-934.
- Sodikoff J, Hirano I. Proton pump inhibitor-responsive esophageal eosinophilia does not preclude food-responsive eosinophilic esophagitis. J Allergy Clin Immunol 2016; 137: 631-633.
- Molina-Infante J, Ferrando-Lamana L, Ripoll C, Hernández-Alonso M, Mateos JM, Fernández-Bermejo M, Dueñas C, Fernández-González N, Quintana EM, González-Núñez MA. Esophageal eosinophilic infiltration responds to proton pump inhibition in most adults. Clin Gastroenterol Hepatol 2011; 9: 110-117.
- Gutiérrez-Junquera C, Fernández-Fernández S, Cilleruelo ML, Rayo A, Echeverría L, Quevedo S, Bracamonte T, Román E. High prevalence of response to proton-pump inhibitor treatment in children with esophageal eosinophilia. J Pediatr Gastroenterol Nutr 2016; 62: 704-710.
- Lucendo AJ, Arias Á, Molina-Infante J. Efficacy of proton pump inhibitor drugs for inducing clinical and histologic remission in patients with symptomatic esophageal eosinophilia: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2016; 14: 13-22.
- Molina-Infante J, Rodríguez-Sánchez J, Martinek J, van Rhijn BD, Krajciova J, Rivas MD, Barrio J, Moawad FJ, Martínez-Alcalá C, Bredenoord AJ, Zamorano J, Dellon ES. Long-term loss of response in proton pump inhibitor-responsive esophageal eosinophilia is uncommon and Influenced by CYP2C19 genotype and rhino-conjunctivitis. Am J Gastroenterol 2015; 110: 1567-1575.
- Gómez-Torrijos E, García-Rodríguez R, Castro-Jiménez A, Rodríguez-Sánchez J, Méndez Díaz Y, Molina-Infante J. The efficacy of step-down therapy in adult patients with proton pump inhibitor-responsive oesophageal eosinophilia. Aliment Pharmacol Ther 2016; 43: 534-540.
- Gutiérrez-Junquera C, Fernández-Fernández S, Cilleruelo ML, Rayo A, Echeverría L, Borrell B, Román E. Long-term treatment with proton pump inhibitors is effective in children with eosinophilic esophagitis. J Pediatr Gastroenterol Nutr 2018 Mar 5. doi: 10.1097/MPG.0000000000001952.
- Chuang M-YA, Chinnaratha MA, Hancock DG, Woodman R, Wong GR, Cock C, et al. Topical steroid therapy for the treatment of eosinophilic esophagitis (EoE): A systematic review and meta-analysis. Clin Transl Gastroenterol 2015; 6: e82.
- Murali AR, Gupta A, Attar BM, Ravi V, Koduru P. Topical steroids in eosinophilic esophagitis: Systematic review and meta-analysis of placebo-controlled randomized clinical trials. J Gastroenterol Hepatol 2016; 31: 1111-1119.
- Sawas T, Dhalla S, Sayyar M, Pasricha PJ, Hernaez R. Systematic review with meta-analysis: Pharmacological interventions for eosinophilic oesophagitis. Aliment Pharmacol Ther 2015; 41: 797- 806.
- Dellon ES, Sheikh A, Speck O, Whitlow AB, Hores JM, Ivanovic M, Chau A, Woosley JT, Madanick RD, Orlando RC, Shaheen NJ. Viscous topical is more effective than nebulized steroid therapy for patients with eosinophilic esophagitis. Gastroenterology 2012; 143: 321-324.
- Miehlke S, Hruz P, Vieth M, Bussmann C, von Arnim U, Bajbouj M, Schlag C, Madisch A, Fibbe C, Wittenburg H, Allescher HD, Reinshagen M, Schubert S, Tack J, Müller M, Krummenerl P, Arts J, Mueller R, Dilger K, Greinwald R, Straumann A. A randomised, double-blind trial comparing budesonide formulations and dosages for short-term treatment of eosinophilic oesophagitis. Gut 2016; 65: 390-399.
- Dellon ES, Collins MH, Hamdani M, Gupta SK, Hirano I. MP-101-06 Investigators. Budesonide oral suspension improves symptomatic, endoscopic, and histologic parameters compared with placebo in patients with eosinophilic esophagitis. Gastroenterology 2017; 152: 776-786.
- Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, Schoepfer A, Simon HU. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011; 9: 400-409.
- Eluri S, Runge TM, Hansen J, Kochar B, Reed CC, Robey BS, Woosley JT, Shaheen NJ, Dellon ES. Diminishing effectiveness of long-term maintenance topical steroid therapy in ppi non-responsive eosinophilic esophagitis. Clin Transl Gastroenterol 2017; 8: e97.
- Reed CC, Fan C, Koutlas N, Stefanadis Z, Eluri S, Shaheen NJ, Dellon ES. Compounded oral viscous budesonide is effective and provides a durable response in eosinophilic esophagitis. HSOA. J Gastroenterol Hepatol Res 2018; 7: 2509-2515.
- Rubinstein E, Hait EE, Mitchell PD, Lee JJ. Every-other-day dosing of oral viscous budesonide is not effective in the management of eosinophilic esophagitis. J Pediatr Gastroenterol Nutr 2018; 66: 395-397.
- Butz BK, Wen T, Gleich GJ, Furuta GT, Spergel J, King E, Kramer RE, Collins MH, Stucke E, Mangeot C, Jackson WD, O’Gorman M, Abonia JP, Pentiuk S, Putnam PE, Rothenberg ME. Efficacy, dose reduction, and resistance to high-dose fluticasone in patients with eosinophilic esophagitis. Gastroenterology 2014; 147: 324-333.
- Andreae DA, Hanna MG, Magid MS, Malerba S, Andreae MH, Bagiella E, Chehade M. Swallowed fluticasone propionate is an effective long-term maintenance therapy for children with eosinophilic esophagitis. Am J Gastroenterol 2016; 111: 1187-1197.
- Golekoh MC, Hornung LN, Mukkada VA, Khoury JC, Putnam PE, Backeljauw PF. Adrenal insufficiency after chronic swallowed glucocorticoid therapy for eosinophilic esophagitis. J Pediatr 2016; 170: 240-245.
- Philla KQ, Min SB, Hefner JN, Howard RS, Reinhardt BJ, Nazareno LG, Vogt KS. Swallowed glucocorticoid therapy for eosinophilic esophagitis in children does not suppress adrenal function. J Pediatr Endocrinol Metab 2015; 28: 1101-1116.
- Hsu S, Wood C, Pan Z, Rahat H, Zeitler P, Fleischer D, Menard-Katcher C, Furuta GT, Atkins D. Adrenal insufficiency in pediatric eosinophilic esophagitis patients treated with swallowed topical steroids. Pediatr Allergy Immunol Pulmonol 2017; 30: 135-140.
- Molina-Infante J, González-Cordero PL, Arias A, Lucendo AJ. Update on dietary therapy for eosinophilic esophagitis in children and adults. Expert Rev Gastroenterol Hepatol 2017; 11: 115-123.
- Arias Á, González-Cervera J, Tenias JM, Lucendo AJ. Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: A systematic review and meta-analysis. Gastroenterology 2014; 146: 1639-1648.
- Spergel JM, Beausoleil JL, Mascarenhas M, Liacouras CA. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol 2002; 109: 363-368.
- Spergel JM, Brown-Whitehorn TF, Cianferoni A, Shuker M, Wang ML, Verma R, Liacouras CA. Identification of causative foods in children with eosinophilic esophagitis treated with an elimination diet. J Allergy Clin Immunol 2012; 130: 461-467.
- Molina-Infante J, Martin-Noguerol E, Alvarado-Arenas M, Porcel-Carreño SL, Jiménez-Timón S, Hernández-Arbeiza FJ. Selective elimination diet based on skin testing has suboptimal efficacy for adult eosinophilic esophagitis. J Allergy Clin Immunol 2012; 130: 1200-1202.
- van Rhijn BD, Vlieg-Boerstra BJ, Versteeg SA, Akkerdaas JH, van Ree R, Terreehorst I, Sprikkelman AB, Verheij J, Smout AJ, Bredenoord AJ. Evaluation of allergen-microarray-guided dietary intervention as treatment of eosinophilic esophagitis. J Allergy Clin Immunol 2015; 136: 1095-1097.
- Philpott H, Nandurkar S, Royce SG, Thien F, Gibson PR. Allergy tests do not predict food triggers in adult patients with eosinophilic oesophagitis. A comprehensive prospective study using five modalities. Aliment Pharmacol Ther 2016; 44: 223-233.
- Warners MJ, Terreehorst I, van den Wijngaard RM, Akkerdaas J, van Esch BCAM, van Ree R, Versteeg SA, Smout AJPM, Bredenoord AJ. Abnormal responses to local esophageal food allergen injections in adult patients with eosinophilic esophagitis. Gastroenterology 2018; 154: 57-60.
- Kagalwalla AF, Sentongo TA, Ritz S, Hess T, Nelson SP, Emerick KM, Melin-Aldana H, Li BU. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis. Clin Gastroenterol Hepatol 2006; 4: 1097-1102.
- Lucendo AJ, Arias Á, González-Cervera J, Yagüe-Compadre JL, Guagnozzi D, Angueira T, Jiménez-Contreras S, González-Castillo S, Rodríguez-Domínguez B, De Rezende LC, Tenias JM. Empiric six-food elimination diet induced and maintained prolonged remission in patients with adult eosinophilic esophagitis: A prospective study on the food cause of the disease. J Allergy Clin Immunol 2013; 131: 797-804.
- Gonsalves N, Yang G-Y, Doerfler B, Ritz S, Ditto AM, Hirano I. Elimination diet effectively treats eosinophilic esophagitis in adults; food reintroduction identifies causative factors. Gastroenterology 2012; 142: 1451-1459.
- Kagalwalla AF, Shah A, Li BUK, Sentongo TA, Ritz S, Manuel- Rubio M, Jacques K, Wang D, Melin-Aldana H, Nelson SP. Identification of specific foods responsible for inflammation in children with eosinophilic esophagitis successfully treated with empiric elimination diet. J Pediatr Gastroenterol Nutr 2011; 53: 145-149.
- Molina-Infante J, Arias A, Barrio J, Rodríguez-Sánchez J, Sánchez-Cazalilla M, Lucendo AJ. Four-food group elimination diet for adult eosinophilic esophagitis: A prospective multicenter study. J Allergy Clin Immunol 2014; 134: 1093-1099.
- Kagalwalla AF, Wechsler JB, Amsden K, Schwartz S, Makhija M, Olive A, Davis CM, Manuel-Rubio M, Marcus S, Shaykin R, Sulkowski M, Johnson K, Ross JN, Riffle ME, Groetch M, Melin-Aldana H, Schady D, Palac H, Kim KA, Wershil BK, Collins MH, Chehade M. Efficacy of a four-food elimination diet for children with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2017;15: 1698-1707.
- Molina-Infante J, Arias Á, Alcedo J, García-Romero R, Casabona-Frances S, Prieto-García A, Modolell I, González-Cordero PL, Pérez-Martínez I, Martin-Lorente JL, Guarner-Argente C, Masiques ML, Vila-Miravet V, García-Puig R, Savarino E, Sánchez-Vegazo CT, Santander C, Lucendo AJ. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: The 2-4-6 study. J Allergy Clin Immunol 2018; 141: 1365-1372.
- Moawad FJ, Molina-Infante J, Lucendo AJ, Cantrell SE, Tmanova L, Douglas KM. Systematic review with meta-analysis: Endoscopic dilation is highly effective and safe in children and adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2017; 4105-4696.
- Richter JE. Eosinophilic esophagitis dilation in the community-try it-you will like it-but start low and go slow. Am J Gastroenterol 2016; 111: 214-216.
- Madanick RD, Shaheen NJ, Dellon ES. A novel balloon pull-through technique for esophageal dilation in eosinophilic esophagitis (with video). Gastrointest Endosc 2011; 73: 138-142.
- Nicodème F, Hirano I, Chen J, Robinson K, Lin Z, Xiao Y, Gonsalves N, Kwasny MJ, Kahrilas PJ, Pandolfino JE. Esophageal distensibility as a measure of disease severity in patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2013; 11: 1101-1107.
- Carlson DA, Hirano I, Zalewski A, Gonsalves N, Lin Z, Pandolfino JE. Improvement in esophageal distensibility in response to medical and diet therapy in eosinophilic esophagitis. Clin Transl Gastroenterol 2017; 8: e119.
- Silva D, Santos F, Piedade S, Morais-Almeida M. Can esophageal dilation be avoided in the treatment of severe esophageal stricture caused by eosinophilic esophagitis? Eur Ann Allergy Clin Immunol 2015; 47: 132-136.
- Kavitt RT, Ates F, Slaughter JC, Higginbotham T, Shepherd BD, Sumner EL, Vaezi MF. Randomized controlled trial comparing esophageal dilation to no dilation among adults with esophageal eosinophilia and dysphagia. Dis Esophagus 2016; 29: 983-991.
- Al-HussainiA. Savary Dilation Is Safe and Effective Treatment for Esophageal Narrowing Related to Pediatric Eosinophilic Esophagitis. J Pediatr Gastroenterol Nutr 2016; 63: 474-480.
Acta Gastroenterol Latinoam 2018;48(3): 242-252
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE