Leandro Steinberg,1 Lisandro Pereyra2
1 Fundación Favaloro. Servicio de Gastroenterología.
2 Hospital Alemán, Servicio de Gastroenterología y Endoscopía.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2020;50:96-103
Introducción
El cáncer colorrectal (CCR) es un problema de salud pública que ocupa los primeros puestos en incidencia y mortalidad por cáncer a nivel mundial. Según las cifras de la base de datos GLOBOCAN, elaborada por la Internacional Agency Research Cancer (IARC), en 2018 murieron en el mundo casi 900.000 personas por CCR.
En el 80-90% de los casos, el proceso de carcinogénesis se inicia a partir de mutaciones sobre las células de la mucosa colónica, que dan lugar inicialmente a una lesión precursora llamada pólipo adenomatoso y luego al CCR. Este proceso se denomina secuencia adenoma-carcinoma y se desarrolla en un lapso de diez a quince años.
Esta ventana de tiempo sienta el fundamento de la prevención del CCR, que se basa en interrumpir el proce-so de neoformación. Las principales estrategias utilizadas para este fin son la pesquisa y la vigilancia co-lonoscópica. La pesquisa es el estudio que se realiza a pacientes asintomáticos con el fin de detectar y resecar en forma precoz lesiones premalignas, disminuyendo así la incidencia y la mortalidad del CCR. La vigilancia es la realización de los procedimientos endoscópicos subsecuentes, ajustados al riesgo individual de acuerdo a la colonoscopía índice. A partir de los hallazgos de la colonoscopía inicial pueden definirse grupos de riesgo para el desarrollo de nuevas lesiones posteriores (llamadas lesiones metacrónicas) y de esta forma determinar los intervalos en los que se recomienda repetir los estudios.
El objetivo de la vigilancia endoscópica es entonces detectar y resecar lesiones metacrónicas, como una herramienta adicional de la prevención del cáncer colorrectal.
Importancia de la indicación correcta
La implementación de programas de pesquisa y vigilancia puede disminuir la incidencia y mortalidad del CCR, pero para que estos resulten efectivos deben cumplir una serie de condiciones. Una de ellas es la indicación correcta de los estudios endoscópicos.
De acuerdo con un reciente metaanálisis solo una minoría de los pacientes que se realizan colonoscopías en la práctica cotidiana tiene una indicación correcta, con una adherencia a los intervalos de vigilancia propues-tos por las guías científicas menor al 50%. En una encuesta de distintos escenarios clínicos sobre vigilancia de CCR realizada a 1432 médicos por Patel y colaboradores solamente el 37% indicó correctamente la reali-zación de estudios de acuerdo con las recomendaciones. Esto puso de manifiesto que el conocimiento de los gastroenterólogos acerca de las guías de práctica clínica es muy pobre. Si bien existen muchos motivos de falta de adherencia (desacuerdo, temor al cáncer de intervalo, aspectos económicos), un adecuado conocimiento sobre las recomendaciones de las guias es fundamental para lograr un nivel de adhesión aceptable.
La falta de adherencia puede manifestarse tanto en forma de sobreindicación como también de subindica-ción, y ambas pueden atentar contra la efectividad de un programa de prevención.
En cuanto a la sobreindicación, un estudio retrospectivo de 1500 pacientes mostró acortamiento del intervalo de vigilancia en casi el 30% de la muestra y de hasta un 50% en aquellos pacientes a los que se les habían detectado adenomas en la colonoscopía índice. En nuestro país también hay evidencia de esta problemática: un estudio de Kapitowsky y colaboradores mostró acortamiento del intervalo del 20% luego de la detección de pólipos hiperplásicos y de hasta el 46% luego de la detección de adenomas pequeños. Si bien la colonoscopía es un estudio seguro, no está exenta de complicaciones, como perforación (0,05%), sangrado (0,25%) y muerte (0,003%), y su sobreutilización genera un incremento neto de estos eventos adversos. La sobreindicación entonces genera un aumento de los costos con beneficios marginales y solo contribuye a la sobrecarga y posterior fatiga de las unidades de endoscopía que deben atender a un porcentaje mayor de pacientes en vigilancia innecesaria. En Europa, por ejemplo, los estudios de vigilancia representan hasta un 40% del total de las endoscopías. La sobreindicación genera un retraso en los estudios de pesquisa, seguimiento o vigilancia en pacientes con indicación correcta, atentando contra la efectividad de la prevención del CCR. En nuestro país, según los datos de la 4ta Encuesta Nacional de Factores de Riesgo, solamente 31,6% de los argentinos de entre 50 y 75 años realizó algún estudio de prevención de CCR, por lo que todavía hay un largo camino por recorrer para lograr una protección universal. Para poder incorporar nuevos individuos a los programas y realizar colonoscopías a la población naive, debe evitarse repetir estudios innecesarios, disminuir al máximo la sobreutilización de la práctica y poner mayor energía en identificar también a las per-sonas en riesgo aumentado de CCR que aún no se han realizado procedimientos de pesquisa.
Finalmente, la subindicación también conlleva importantes riesgos, ya que podría demorar el control de pacientes con alto riesgo de desarrollar lesiones metacrónicas y cáncer. Un estudio de cohorte longitudinal demostró que el 76% de las muertes por CCR fueron por fallas en la indicación de estudios de pesquisa y vigilancia, y que los pacientes con retrasos en los estudios de vigilancia motivados por hallazgos endoscó-picos presentaron hasta siete veces más de riesgo de desarrollar CCR.
Por todo lo mencionado puede entenderse por qué la indicación adecuada de la vigilancia colonoscópica es considerada un marcador de calidad de las unidades de endoscopía y representa una pieza clave para lograr un programa de prevención efectivo.
Herramientas para mejorar la indicación y optimizar recursos
La gran transcendencia de la correcta indicación de los estudios de vigilancia, el bajo rendimiento de los especialistas para indicarlos correctamente y la excelente voluntad de la comunidad médica para adoptar nuevas herramientas digitales estimularon el desarrollo de CaPtyVa APP. Esta es la primera APP inteligente que contiene toda la información de las guías locales y asiste a los médicos en indicar correctamente los estudios de pesquisa y vigilancia (Figura 1). En un estudio randomizado de 215 médicos gastroenterólogos y coloproctólogos realizado en la Argentina y Uruguay, recientemente sumidito para publicación, el uso de CaPtyVa se asoció con un incremento de hasta un 50% de la indicaciones correctas según las guías en comparación con el grupo control.
Figura 1. Capturas de pantalla de CaPtyVa. De izquierda a derecha pantalla principal, pantalla de carga de datos de vigilancia y pantalla de resultados de vigilancia. En este caso se ejemplifica la indicación de vigilancia de un adenoma de bajo riesgo

La calidad de la colonoscopía índice es la clave
La correcta indicación no es suficiente para garantizar la prevención si durante la colonoscopía índice o basal no se cumplen los estándares de calidad que aseguren la detección y remoción completa de todas las lesio-nes presentes al momento del estudio. De hecho, el déficit de estos parámetros se relaciona directamente con la aparición de CCR poscolonoscopía. Se denomina cáncer de intervalo (CCRI) a aquel que aparece después de una colonoscopía, pero antes de que se cumpla el intervalo de vigilancia estipulado por las guías. El CCRI se relaciona inversamente con la calidad y con la efectividad de la colonoscopía. En otras palabras, solo las colonoscopías de calidad pueden brindar una verdadera protección contra el CCR y lograr un programa efectivo. Una colonoscopía de calidad debe examinar de forma segura la mayoría de la muco-sa colónica para detectar las lesiones presentes y resecarlas en forma completa. Un estudio con más de 9000 pacientes demostró que más del 50% de los cánceres de intervalo se debieron a lesiones perdidas (pólipos pasados por alto durante la colonoscopía) y casi un 20% a resecciones incompletas. Las lesiones perdidas pueden explicarse básicamente por tres mecanismos: estudios incompletos (que no llegan hasta el ciego y queda una porción del intestino sin examinar), mala preparación intestinal, y fallas en la detección por parte del endoscopista.
En relación con la importancia de un estudio completo y bien preparado, un trabajo de Atkin y colaboradores mostró que una colonoscopía subóptima (incompleta y/o mal preparada) se asoció a una duplicación del riesgo de CCR, independientemente de las lesiones encontradas. Un estudio de Rex y colaboradores en pacientes con colonoscopías incompletas demostró un alto porcentaje de lesiones perdidas al repetir el estudio dentro del año, entre ellas varios cánceres. Por lo mencionado, solo las colonoscopías que son completas (que alcanzan a llegar hasta el fondo cecal), y que cuentan con una preparación satisfactoria (con escaso o nulo restos de materia fecal, de manera que sea posible examinar la mayoría de la mucosa) son consideradas de calidad. Aquellas que no cumplen con estos criterios deben ser consideradas como no efectivas y repetirse antes del año. Aunque esto parezca una obviedad, en un registro de colonoscopías negativas (sin evidencia de pólipos), en pacientes con preparaciones no satisfactorias, la recomendación de repetir el estudio dentro del año solo se cumplió en el 10% de los casos.
La habilidad por parte del endoscopista para encontrar lesiones durante el estudio también representa un parámetro de calidad fundamental para garantizar la protección contra el CCR y puede ser evaluada de forma objetiva a través de la tasa de detección de adenomas (TDA). Esta se define como la cantidad de colonos-copías motivadas por pesquisa de CCR en las que un mismo operador detecta al menos un adenoma sobre el total de colonoscopías realizadas también por pesquisa. Kaminski y colaboradores demostraron que cuando era inferior al 20% se asoció en forma independiente con un incremento del riesgo de CCRI. Posteriormente Corley y su equipo demostraron que por cada 1% de aumento en la TDA se reduce un 3% la mortalidad por CCR, alcanzando un efecto protector máximo con una TDA del 34%. En otras palabras, solo las colonoscopías realizadas por endoscopistas que poseen una tasa mayor al 20% pueden dar garantía de protección contra el CCR y por este motivo representa hoy en día uno de los estándares de calidad más importantes y con mayor evidencia científica.
Por último, la resección completa de las lesiones colónicas es otro de los aspectos imprescindibles que debe considerarse. El estudio CARE evaluó prospectivamente 346 resecciones de pólipos hallando por lo menos un 10% de resecciones incompletas. La falla en la resección tiene consecuencias, demostradas en un estudio que siguió prospectivamente durante una media de 47 meses a 9167 pacientes luego de una colonoscopía y encontró 52 cánceres de intervalo, entre ellos un 19% fue debido a resecciones incompletas. Es por esto que la resección completa de las lesiones encontradas durante la colonoscopía también es considerada un estándar indispensable de una colonoscopía de calidad.
Todo lo expuesto pone de manifiesto que la calidad del procedimiento influye en la probabilidad de desarro-llar CCRI y, según algunos autores, tendría un efecto protector aún mayor que el intervalo recomendado en sí mismo. Es por esto que las guías estadounidenses publicadas recientemente han propuesto requisitos para definir una colonoscopía basal de calidad. La Tabla 1, confeccionada por los autores para esta revisión pre-senta esos criterios junto con la sugerencia de cómo evaluar su cumplimiento a fin de garantizar una colonoscopía de calidad. En caso contrario se recomienda no asignar el intervalo de vigilancia correspondiente y repetir el estudio antes del año.
Tabla 1. Check-list para evaluar la calidad de la colonoscopía índice previo a realizar el cálculo para asignar la fecha del próximo estudio de vigilancia

Esquema de seguimiento
Los intervalos de vigilancia se proponen en función del riesgo de desarrollar CCR metacrónico. Para su re-comendación se tienen en cuenta, principalmente, el tamaño, el número y las características histológicas de los pólipos hallados en la colonoscopía índice.
En la Tabla 2 se resumen las recomendaciones de vigilancia comparando las guías locales (INC) con las principales guías extranjeras recientemente publicadas.
Tabla 2. Resumen de las principales recomendaciones de las Guías del Instituto Nacional del Cáncer (Argentina), United States Multi Society Task Force (EE. UU.) y European Society of Gastrointestinal Endoscopy (Europa)
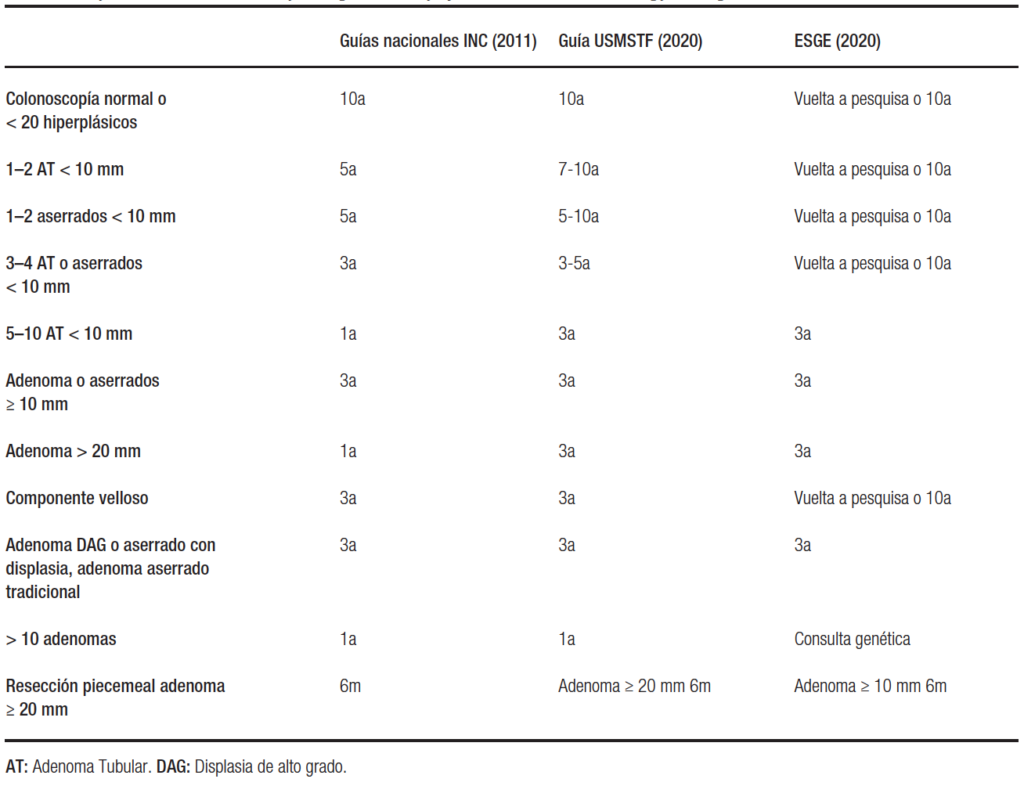
Las modificaciones propuestas por estas guías surgen de nueva evidencia disponible en los últimos años, demostrando un muy bajo riesgo de CCR metacrónico luego de colonoscopías normales o con lesiones de bajo riesgo, extendiéndose entonces los intervalos de seguimiento.
Dos estudios de cohorte con un gran número de pacientes demostraron una reducción significativa en la incidencia y la mortalidad de CCR luego de una colonoscopía normal (HR 0,44 y 0,12, respectivamente). En este contexto la reducción de riesgo se extiende por al menos diez años, aportando evidencia que sustenta la recomendación de intervalos prolongados de vigilancia luego de un estudio normal.
En el caso de los pacientes con lesiones de bajo riesgo, como uno a dos adenomas tubulares menores a 10 mm, se demostró mínimo riesgo de desarrollar CCR. De hecho, de acuerdo con un estudio noruego luego de la resección de estas lesiones se observa una disminución del 25% del riesgo de morir por CCR en relación con la población general. Además, gracias a las mejoras en calidad y equipamiento, los endoscopistas tienen mayor capacidad de detección (y por ende menor cantidad de lesiones perdidas) por lo que el hallazgo actual de 3-4 pólipos representa un riesgo similar de 1-2 en el pasado.
En el caso de las lesiones de alto riesgo definidas como aquellas mayores a 10 mm, o con componente velloso, o displasia de alto grado, información actualizada con mejor calidad de evidencia refuerza la importancia de una vigilancia más estrecha por su significativa asociación con CCR.
Finalmente, en cuanto a las lesiones aserradas aisladas, la evidencia es débil y proviene de estudios de casos y controles y de cohorte. Sin embargo, cuando estas son mayores a 10 mm tienen un riesgo aumentado para el desarrollo de CCR, por lo que se propone vigilarlas en forma más estrecha. La presencia de lesiones aserradas en asociación sincrónica con adenomas de alto riesgo se ha asociado a mayor incidencia de lesiones metacrónicas avanzadas, aunque la evidencia no es aún suficiente para emitir una recomendación al respecto.
Cabe aclarar que la vigilancia de los pacientes con síndromes genéticos heredofamiliares que predisponen al cáncer de colon o enfermedad inflamatoria intestinal representa un capítulo aparte que escapa a la presente revisión. En la Tabla 3 se enumeran los escenarios en los cuales deben sospecharse síndromes genéticos que puedan requerir intervalos de seguimiento diferenciales y que ameritan realizar consulta con genetista.
Tabla 3. Situaciones clínicas durante la vigilancia colonoscópica en donde se sugiere realizar consulta con el genetista por sospecha de síndromes genéticos heredofamiliares

Finalización de la vigilancia
El beneficio de la vigilancia puede verse limitado a partir de determinada edad o en pacientes con comorbili-dades. Según el estudio de Atkin y colaboradores previamente citado, el riesgo de desarrollo de CCR en pacientes con adenomas de riesgo intermedio sin vigilancia (1-2 adenomas ≥ 10 mm o 3-4 adenomas < 10 mm) en un período de 8 años es del 3,3%. Considerando que la mortalidad anual a los 75 años es mayor al 20% en países desarrollados, la vigilancia perdería su efecto. Por lo tanto, se recomienda que la vigilancia endoscópica se omita en los pacientes con expectativa de vida menor a diez años y en los candidatos a vigilancia se sugiere que finalice a los 75 años, o excepcionalmente a los 80 años en casos seleccionados.
Conclusión
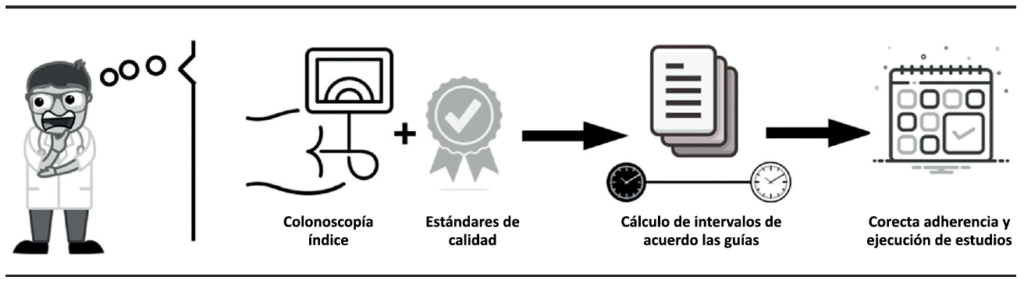
El CCR puede prevenirse a través de la realización de pesquisa poblacional. La vigilancia colonoscópica es una pieza fundamental de la prevención, sin la cual esta no sería efectiva. Sin embargo, lograr una vigilancia adecuada no es una tarea sencilla y representa un gran desafío. Requiere del manejo de una gran cantidad de información para estratificar a los pacientes e indicar correctamente los intervalos de repetición de los estudios, de la realización de colonoscopías seguras y con los más altos estándares de calidad y de una alta adherencia a los estudios de seguimiento (Figura 2). Podría considerarse la vigilancia colonoscópica como el talón de Aquiles de la prevención del CCR, ya que la falta de cumplimiento de estos requisitos pue-de generar un uso inadecuado de recursos, un aumento de los costos en salud, saturación de las unidades de endoscopía y hasta un mayor número de complicaciones de las prácticas, poniendo finalmente en jaque la efectividad de todo un programa de prevención de CCR.
Figura 2. Secuencia de pasos que se deben cumplirse correctamente para lograr una vigilancia efectiva
Bibliografía recomendada
- Bray F, Ferlay J, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68 (6): 394-424.
- Bond JH. Clinical evidence for the adenoma–carcinoma sequence, and the management of patients with colorectal adenomas. Semin Gastrointest Dis 2000; 11: 176-184.
- Kahi CJ, Pohl H. Colonoscopy and Colorectal Cancer Mortality in the Veterans Affairs Health Care System. Annals of Internal Medicine 2018; 168 (7): 481.
- Jayasekara H, Reece JC, Buchanan DD, et al. Risk factors for metachronous colorectal cancer or polyp: A systematic review and meta-analysis. J Gastroenterol Hepatol 2017; 32 (2): 301-326.
- Ladabaum U, Schoen RE. Post-Polypectomy Surveillance That Would Please Goldilocks—Not Too Much, Not Too Little, but Just Right. Gastroenterology 2016; 150 (4): 791-796.
- Levin TR, Corley DA, Jensen CD, et al. Effects of organized colorectal cancer screening on cancer incidence and mortality in a large, community-based population. Gastroenterology 2018; 155: 1383-1391.e.5
- Djinbachian R, Dubé AJ, Durand M, et al. Adherence to post-polypectomy surveillance guidelines: a system-atic review and meta-analysis. Endoscopy 2019; 51: 673-683.
- Patell R, Karwa A, Lopez R, et al. Poor Knowledge of Colorectal Cancer Screening and Surveillance Guide-lines in a National Cohort of Digestive Disease Specialists. Dig Dis Sci 2019; 64: 391-400.
- Johnson MR et al. Physician Non-adherence to Colonoscopy Interval Guidelines in the Veterans Affairs Healthcare System. Gastroenterology 2015.
- Verna M, Vietto V, Kopitowski K y col. Conocimiento de médicos de un Hospital Universitario de Buenos Aires respecto de las recomendaciones de vigilancia colonoscópica luego del hallazgo de un pólipo colóni-co: estudio de corte transversal. Archivos de medicina familiar y general 2014; 11: 13-20.
- Reumkens A, Rondagh EJA, Bakker CM, et al. Post-colonoscopy complications: a systematic review, time trends, and meta-analysis of population-based studies. Am J Gastroenterol 2016; 111: 1092-110.
- Van Hees F, Zauber AG, et al. The appropriateness of more intensive colonoscopy screening than recom-mended in Medicare beneficiaries: a modeling study. JAMA Intern Med 2014.
- Van Heijningen E-MB, Lansdorp-Vogelaar I, et al. Adherence to surveillance guidelines after removal of colorectal adenomas: a large, community-based study. Gut 2015; 64: 1584-1592.
- Lieberman DA, Holub J, Eisen G, et al. Utilization of colonoscopy in the United States: Results from a national consortium. Gastrointest Endosc 2005; 62: 875-883.
- Marzo-Castillejo M, et al. Appropriateness of colonoscopy requests according to EPAGE-II in the Spanish region of Catalonia. BMC Fam Pract 2015; 16: 154.
- 4° Encuesta Nacional de Factores de Riesgo. Resultados definitivos. (1a ed.) Ciudad Autónoma de Buenos Aires: Instituto Nacional de Estadística y Censos – INDEC; Ciudad Autónoma de Buenos Aires: Secretaría de Gobierno de Salud de la Nación, 2019.
- Doubeni CA. et al. Modifiable Failures in the Colorectal Cancer Screening Process and Their Association With Risk of Death. Gastroenterology 2019; 156 (1): 63-74.e6
- Kaminski MF, Thomas-Gibson S, Bugajski M, et al. Performance measures for lower gastrointestinal endos-copy: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy 2017; 49 (4): 378-397.
- Lieberman D, Nadel M, Smith RA, et al. Standardized colonoscopy reporting and data system: report of the Quality Assurance Task Group of the National Colorectal Cancer Roundtable. Gastrointest Endosc 2007; 65 (6): 757-766.
- Pereyra L, Steinberg L, et al. Efficacy of a Mobile Clinical Decision Support System (CaPtyVa CCR App) to Improve Performance of Gastroenterology and Coloproctology Specialists in Colorectal Cancer Screening and Surveillance According to Guideline Recommendations: A Randomized Clinical Trial. Submited Un-published data.
- Rutter MD. et al. World Endoscopy Organization Consensus Statements on Post-Colonoscopy and Post-Imaging Colorectal Cancer. Gastroenterology 2018; 155 (3): 909-925.e3
- Robertson DJ, Lieberman DA, Winawer SJ, et al. Colorectal cancers soon after colonoscopy: a pooled multi-cohort analysis. Gut 2014; 63: 949-956.
- Atkin W, Wooldrage K, Brenner A, et al. Adenoma surveillance and colorectal cancer incidence: a retrospec-tive, multicentre, cohort study. Lancet Oncol 2017; 18: 823-834.
- Bick BL, Vemulapalli KC, Rex DK. Regional center for complex colonoscopy: yield of neoplasia in patients with prior incomplete colonoscopy. Gastrointest Endosc 2016; 83 (6): 1239-1244.
- Butterly LF, Nadel MR, Anderson JC et al. Impact of colonoscopy bowel preparation quality on follow-up interval recommendations for average-risk patients with normal screening colonoscopies: data from the New Hampshire Colonoscopy Registry. J Clin Gastroenterol 2020; 54: 356-364.
- Kaminski MF, Regula J, Kraszewska E, et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010; 362: 1795-803.
- Corley DA, Jensen CD, Marks AR, et al. Adenoma detection rate and risk of colorectal cancer and death. N Engl J Med 2014; 370: 1298-1306.
- Pohl H, Srivastava A, Bensen SP, et al. Incomplete polyp resection during colonoscopy-results of the complete adenoma resection (CARE) study. Gastroenterology 2013; 144: 74-80.e1.
- Robertson DJ, Lieberman DA, Winawer SJ, et al. Colorectal cancers soon after colonoscopy: a pooled multi-cohort analysis. Gut 2014; 63: 949-956.
- Rex DK, Schoenfeld PS, Cohen J, et al. Quality indicators for colonoscopy. Gastrointest Endosc 2015; 81: 31-53.
- Nishihara R, Wu K, Lochhead P, et al. Long-term colorectal-cancer incidence and mortality after lower endoscopy. N Engl J Med 2013; 369: 1095-1105.
- Lee JK, Jensen CD, Levin TR, et al. Long-term risk of colorectal cancer and related deaths after a colonos-copy with normal findings. JAMA Intern Med 2019; 179: 153-160.
- Click B, Pinsky PF, Hickey T, et al. Association of colonoscopy adenoma findings with long-term colorectal cancer incidence. JAMA 2018; 319: 2021-2031.
- Vemulapalli KC, Rex D. Risk of advanced lesions at first follow-up colonoscopy in high-risk groups as defined by the United Kingdom post-polypectomy surveillance guideline: data from a single U.S. center. Gastrointest Endosc 2014; 80: 299-306.
- Løberg M, Kalager M, Holme Ø, et al. Long-term colorectal-cancer mortality after adenoma removal. N Engl J Med 2014; 371: 799-807.
- Holme O, Bretthauer M, Eide TJ, et al. Long-term risk of colorectal cancer in individuals with serrated polyps. Gut 2015; 64: 929-936.
- Anderson JC, Butterly LF, Robinson CM, et al. Risk of metachronous high-risk adenomas and large serrated polyps in individuals with serrated polyps on index colonoscopy: data from the New Hampshire Colonosco-py Registry. Gastroenterology 2018; 154: 117-127.e2.
- Pereyra L, Zamora R, Gomez EJ, et al. Risk of metachronous advanced neoplastic lesions in patients with sporadic sessile serrated adenomas undergoing colonoscopic surveillance. Am J Gastroenterol 2016; 111: 871-878.
- Mangas-Sanjuan C, y cols Vigilancia tras resección de pólipos de colon y de cáncer colorrectal. Actualización 2018. Gastroenterol Hepatol 2018.
- Gupta S, Lieberman D, Anderson JC, Burke CA, Dominitz JA, Kaltenbach T, Robertson DJ, Shaukat A, Syngal S, Rex DK. Recommendations for Follow-Up After Colonoscopy and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastrointest Endosc. 2020; 91 (3): 463-485.e5.
- Baxter N, Sutradhar R, Forbes DD, et al. Analysis of administrative data finds endoscopist quality measures asociated with post-colonoscopy colorectal cancer. Gastroenterology 2011; 140: 65-72.
- Kaminski MF, Thomas-Gibson S, Bugajski M, et al. Performance measures for lower gastrointestinal endos-copy: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy 2017; 49 (4): 378-397.
- Clark BT, Protiva P, Nagar A, et al. Quantification of adequate bowel preparation for screening or surveillance colonoscopy in men. Gastroenterology 2016; 150: 396-405.
- Harewood GC, Sharma VK, de Garmo P. Impact of colonoscopy preparation quality on detection of sus-pected colonic neoplasia. Gastrointest Endosc 2003; 58: 76-79. 5.
- Froehlich F, Wietlisbach V, Gonvers JJ, et al. Impact of colonic cleansing on quality and diagnostic yield of colonoscopy: the European Panel of Appropriateness of Gastrointestinal Endoscopy European multicenter study. Gastrointest Endosc 2005; 61: 378-384.
- Lebwohl B, Kastrinos F, Glick M, et al. The impact of suboptimal bowel preparation on adenoma miss rates and the factors associated with early repeat colonoscopy. Gastrointest Endosc 2011; 73: 1207-1214.
- Johnson DA, Wallace MB, Kaul V, Kaltenbach T. Incomplete Resection Rates in Polyps Smaller Than 2 Centimeters. In Clinical Roundtable Monograph, Gastroenterology & Hepatology August 2018. In Proceedings of the from a Live Clinical Roundtable Held during Digestive Disease Week, Washington, DC, USA 2018: 2-5.
- Le Clercq CM, Bouwens MW, Rondagh EJ, Bakker CM, Keulen ET, de Ridder RJ, et al. Postcolonoscopy colorectal cancers are preventable: A population-based study. Gut 2014; 63: 957-963.
- Gualdrini U, y cols. Propuesta del Programa de prevención y detección temprana, y acciones para su implementación. INC 2011.
- Hassan C, Antonelli G, Dumonceau JM, et al. Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – Update 2020. Endoscopy 2020; 52 (8): 687-700.
- Rutter MD, et al. British Society of Gastroenterology/Association of Coloproctology of Great Britain and Ireland/Public Health England post-polypectomy and post-colorectal cancer resection surveillance guidelines. Gut 2020; 69: 201-223.
- Vasen HF, Watson P, Mecklin JP, Lynch HT. New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative group on HNPCC. Gastroenterology 1999; 116 (6): 1453-1456.
- Dekker E, Bleijenberg A, Balaguer F; Dutch-Spanish-British Serrated Polyposis Syndrome collaboration. Update on the World Health Organization Criteria for Diagnosis of Serrated Polyposis Syndrome. Gastroenterology 2020; 158 (6): 1520-1523.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE