Guillermo Rubén Fernández1 ID· Matías Zanetti1 ID· Mariano Rubén Argüello1 ID· Liria Salomé Martínez Rejtman2 ID· Marisa Francisco1 ID· Jorge Gomila1 ID· Paula Valdemoros3 ID
1 Médico de planta, Hospital Teodoro Juan Schestakow. San Rafael.
2 Residente, Hospital Teodoro Juan Schestakow. San Rafael.
3 Médico de planta, Hospital Alfredo Ítalo Perrupato. San Martín.
Mendoza, Argentina.
Acta Gastroenterol Latinoam 2021;51(3):358-362
Recibido: 21/04/2021 / Aceptado: 25/08/2021 / Publicado en www.actagastro.org el 27/09/2021 / https://doi.org/10.52787/sdee3831
Resumen
Las úlceras pépticas gigantes se definen por presentar un diámetro superior a 2 cm, en el caso de las duodenales y superior a 3 cm, en el caso de las gástricas. La presentación es infrecuente, pero abre el interrogante sobre cuál es el factor etiológico y su tratamiento definitivo. La bibliografía sobre su fisiopatología es escasa y los casos descriptos son inusuales. Se presenta el siguiente caso para revisar la conducta a seguir ante la presencia de una úlcera gigante gástrica. Destacamos la dificultad en el diagnóstico diferencial de esta patología maligna, intentando enfatizar el valor de los factores predictores de malignidad para definir la conducta a seguir. Finalmente, resaltamos la relación entre la presentación clínica de la úlcera gigante gástrica con los linfomas gástricos primarios y sus variantes de comportamiento clínico.
Palabras claves. Úlcera gigante, cáncer, péptico, AINEs.
Gastric Giant Ulcer as a Presentation of Primary Gastric Lymphoma. A Case Report and Literature Review
Summary
Giant peptic ulcers are defined as having a diameter greater than 2 cm in the case of duodenal ulcers, and greater than 3 cm in the case of gastric ulcers. The presentation is infrequent, but raises questions about the etiological factor and the definitive treatment. The literature on its physiopathology is scarce and the cases described are unusual. The following case is presented to review the conduct to be followed in the presence of a giant gastric ulcer. We highlight the difficulty to assess the differential diagnosis of malignant pathology, trying to emphasize the value of the predictive factors of malignancy to define the conduct to follow. Finally, we focus on the relationship between the clinical presentation of gastric giant ulcer with primary gastric lymphomas and their clinical characteristics.
Keywords. Giant ulcer, cancer, peptic, NSAIDs.
Abreviaturas
AAS: Ácido acetilsalicílico.
VEDA: Videoendoscopía digestiva alta.
ADS: Arcada dentaria superior.
AP: Anatomía patológica.
IBP: Inhibidores de la bomba de protones.
UD: Úlcera duodenal.
UG: Úlcera gástrica.
AINEs: Antinflamatorios no esteroideos.
H. pylori: Helicobacter pylori.
ASGE: American Society of Gastrointestinal Endoscopy.
MALT: Linfoma de tejido linfoide asociado a mucosa.
Introducción
Ante el hallazgo endoscópico de una lesión ulcerada gigante en el estómago o duodeno, el profesional se interroga sobre su etiología, la asociación y la correlación con sus comorbilidades y, finalmente, las alternativas sobre la conducta terapéutica a seguir. Presentamos el caso de un paciente masculino de 44 años con una úlcera gigante gástrica.
Caso clínico
Paciente masculino de 44 años, sin antecedentes patológicos, automedicado con ibuprofeno 600 mg/d + AAS 500 mg/d con cafeína 40 mg/d durante al menos 3 meses previos a la consulta; por referir un mejor rendimiento laboral. Consultó en la guardia por hematemesis y melena, con repercusión hemodinámica. Al ingreso: Hto 35%; Hb 11,5 g/dl; GB 16600 cel/mm3; urea 0,84 mg/dl. Debido a la inestabilidad hemodinámica y considerando el sangrado activo, se le indicó la transfusión de 2 unidades de glóbulos rojos sedimentados y omeprazol 80 mg en bolo EV. Se continuó con omeprazol 40 mg c/4 h EV y metoclopramida 10 mg c/6 h por 72 h.
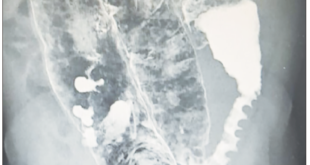
Se le realizó una VEDA en la cual se detectó una úlcera con fondo de fibrina y de bordes regulares, de 4,5 cm de diámetro en la curvatura mayor hacia el techo gástrico; que no fue biopsiada por decisión del endoscopista.
Se progresó con dieta y se externo a las 48 hs. Con tratamiento médico con IBP por evolucionar favorablemente¨ Se lo citó para realizar una VEDA control que mostró, en la cara posterior del sector medio del cuerpo gástrico, una úlcera de 2 cm con bordes definidos y centro cubierto con fibrina y una región mucosa elevada de 2 cm. Se tomaron biopsias de sus bordes notando rigidez mucosa.
El informe de anatomía patológica refirió gastritis crónica intersticial Helicobacter pylori positivo, aflujo linfoide intersticial y cambios epiteliales reactivos moderados. Mucosa gástrica con úlcera y coágulo fibrino- leucocitario, detritus y tejido de granulación, compatible con una una úlcera péptica.
Se le indicó tratamiento con amoxicilina 1 g c/8 h, claritromicina 500 mg c/12 h y metronidazol 500 mg c/12 h por 14 días y doble dosis de pantoprazol por 30 días. Se le solicitó un control endoscópico para evaluar la erradicación de H. pylori y la cicatrización de las lesiones gástricas. La tercera endoscopía mostró nuevamente una úlcera de mayor tamaño e igual localización, que se extendía hasta el ángulo gástrico. El fondo estaba cubierto de fibrina, con bordes sobreelevados. Se tomaron biopsias de los bordes, los cuales presentaron friabilidad ante la pinza de biopsia. Se observó el píloro permeable.
El informe de anatomía patológica refirió gastritis crónica inactiva H. pylori negativo. La histolgía de la úlcera de cuerpo gástrico informó la presencia de un tumor redondo celular a determinar por inmunohistoquímica. Los cortes histológicos evidenciaron fragmentos de mucosa gástrica, uno de ellos con infiltración del corion por tumor caracterizado por nidos de células atípicas, de núcleos ovales, con cromatina delicada y citoplasma escaso claro o ligeramente eosinófilo, que se disponía en patrón difuso, sin formación de estructuras tubulares o glandulares. En superficie, se observó exudado fibrino-hemático y material necrótico. Se le realizaron las siguientes técnicas de inmunohistoquímica con sistema automatizado Ventana Benchmark XT (Ventana Medical Systems Tucson AZ, método de revelado Ultraview Universal DAB Detection u Optiview DAB detection Kit), según el protocolo con los siguientes anticuerpos y resultados: citoqueratina AE1-Ae3, negativas; CD20, positivo difuso; Bc12, positivo focal; CD10, negativo; CD5 y CD3, negativos en células grandes y positivos en linfocitos pequeños dispersos acompañantes; CD23, negativo; Bc16, positivo, y Ki67, positivo en el 80%. Estos datos permitieron concluir el diagnóstico de proceso linfoproliferativo B de células grandes con alto recambio celular (DLBCL).
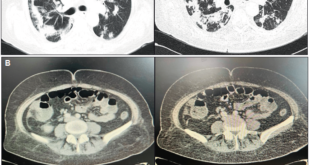
Con el objetivo de estadificar la lesión, se realizó un estudio tomográfico que no detectó lesiones ocupantes de espacio a nivel torácico ni mediastinal. Se observó un engrosamiento de las paredes gástricas, a correlacionar con los antecedentes e historia clínica del paciente.
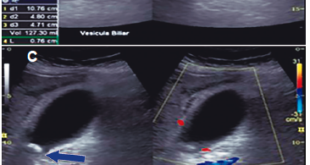
Se le realizó una ecoendoscopía gástrica que mostró una lesión ulcerada con disminución de la elasticidad a nivel del cuerpo, la cual era hipoecoica, ocupaba toda la pared, presentaba un grosor de 15 mm como máximo y no se extendía más allá de la pared. Se presentaron ocho imágenes ganglionares de hasta 11 mm perigástricos y peripancreáticos.
Finalmente, se arribó al diagnóstico de linfoma gástrico primario de células grandes B, estadio E2 y ganglionar II1, según la clasificación de Lugano, por implicar el compromiso de gnaglios locales, serosa y tejidos adyacentes.
Discusión
Las úlceras pépticas gigantes se definen por presentar un diámetro superior a 2 cm, en el caso de las duodenales y superior a 3 cm, en el caso de las gástricas.1
Los pacientes pueden presentarse con antecedentes típicos de larga data o referir escasos síntomas previos. La pérdida de peso es más frecuente en las úlceras gigantes, en las cuales aumenta la sospecha de malignidad.1
Las UD gigantes, por lo común, se hallan en la pared posterior y pueden asociarse con un dolor que se irradia a la espalda. Las UG, típicamente, ocurren en el cuerpo gástrico y en la región prepilórica.1
Las úlceras gigantes tienen mayor riesgo de complicaciones, tales como: recaídas (sobre todo las que tienen cicatrices densas que resultan en deformaciones, incluyendo obstrucción pilórica), hemorragia severa (aumenta dos veces el riesgo de sangrado) y perforación (riesgo cuatro a cinco veces mayor). Las UD gigantes tienen mayor frecuencia de complicaciones y mortalidad, por lo que se sugiere la consulta precoz con cirugía, aunque el requerimiento de cirugía no sea los más común, actualmente.2
En cuanto a la fisiopatología de las úlceras gigantes, no se ha descrito un aspecto fisiopatológico diferente al de las de menor tamaño.1 En general, se asocian al consumo de AINEs. Pueden estar presentes en pacientes con enfermedad de Crohn, trasplante y uso de metanfetaminas. Por otra parte, se han informado úlceras gigantes duodenales o prepilóricas vinculadas a la presencia de insuficiencia renal en estadio terminal.1, 2
Las UG pueden conllevar un mayor riesgo de alojar un carcinoma, el cual debe sospecharse y excluirse, dado que el riesgo de ser secundaria a una lesión maligna se encuentra aumentado cuatro veces.2 El diagnóstico suele demorarse en una tercera parte de los casos, aproximadamente.1
El diagnóstico radiológico, en particular de la UD gigante, suele ser difícil. Las úlceras gigantes pueden simular un bulbo deformado o un divertículo. La forma, la rigidez, las contracciones y el patrón de la mucosa proporcionan indicios.1 El estrechamiento posbulbar es frecuente y pueden observarse defectos de relleno, a menudo debidos a trombos.1 En la mayoría de los casos, la endoscopía proporciona el diagnóstico, aunque la extensión de la úlcera puede no ser apreciada.1 Cicatrizan lentamente y necesitan tratamiento médico sostenido. Se espera un ritmo de cicatrización de 3 mm por semana.2
Las úlceras gigantes requieren de un seguimiento más frecuente y, a veces, de más de un estudio histológico para llegar al diagnóstico. Las guías británicas, sugieren realizar endoscopias de control con una periodicidad de 6 a 8 semanas, con tomas de al menos siete muestras de la base y de los bordes de la mismas, para aumentar la sensibilidad diagnóstica. La persistencia o progresión de la lesión, sugeriría malignidad, en caso de no ser certificada por histología.3
Si bien existen casos en la bibliografía que refieren sangrado luego de biopsias gástricas, incluyendo casos que requieren atención hospitalaria o tratamientos endoscópicos, los mismos tienen, habitualmente, una buena evolución. Por todo esto, no está aconsejado diferir la toma de biopsia para no retrasar el diagnóstico y aumentar los costos de salud por procedimientos endoscópicos reiterados, tal como sucedió en nuestro paciente.4-6 La frecuencia de sangrado posterior a la biopsia varía de 0,03 a 10,14%. La hemorragia fatal es un hecho infrecuente, reportada en un rango entre el 0,01% en un estudio noruego y a un 0,007% en un estudio británico. Dichos estudios, adjudican dichas diferencias a mecanismos diversos, entre los que se encuentran: biopsias de arteria esplénica, trastornos de coagulación entre otros. En reportes de la ASGE, la tasa de mortalidad fue menor, 0,0004%.7 Por lo dicho, no sería aconsejable dejar de biopsiar estas lesiones, aún en el contexto de un sangrado activo.
Se han intentado buscar factores predictores de malignidad ante el diagnóstico de una úlcera gástrica gigante. Según el artículo de Lord et al.,3 existen factores protectores asociados, tales como: localización de la úlcera, mayor probabilidad en úlceras de fundus, cardias o incisura vs. cuerpo y antro (OR 4,417 [IC 95% 1,10 – 17,76]), ausencia de sospecha endoscópica por las características de la lesión (OR 0,138 [IC 95% 0,05 – 0,39]), edad del paciente (OR 0,202 [IC 95% 0,06 – 0,71]), comparado el rango etario entre 20 – 59 años, con los que tienen entre 60 – 99 años.3
Los linfomas gástricos primarios son poco frecuentes, representan entre el 2 y el 8% de las neoplasias gástricas.8 En su mayoría, se originan en linfocitos B clonales, siendo muy raros los de origen T y los linfomas tipo Hodgkin.9 Los linfomas no Hodgkin nodales o de otra localización pueden comprometer en forma secundaria al estómago y ser diagnosticados cuando afectan a este órgano. El estómago es el órgano más afectado del tracto gastrointestinal. Se considera que representa entre un 60 y un 70% de las afectaciones del tracto digestivo y puede representar entre el 30 y el 45% de todos los linfomas extra nodales.8, 10-12
Los linfomas no Hodgkin extra nodales representan cifras variables de prevalencia en diversos estudios desde un 24% en países de Norteamérica, hasta un 48% en países del mediterráneo. El tracto gastrointestinal es el sitio más frecuentemente afectado por los linfomas extranodales.8-10 Representa, según algunos autores, entre el 10 y el 15% de todos los linfomas no Hodgkin y entre el 30 y el 40% de todos los linfomas no Hodgkin extra nodales.11
El linfoma de la zona marginal o, también llamado, linfoma MALT (linfoma de tejido linfoide asociado a mucosa, por su sigla en inglés) y el linfoma difuso de células grandes B son los tipos histológicos más frecuentes. Además, existen otras variantes informadas, por lo general, como reportes de caso que corresponden a linfomas de Burkitt, linfoma de células del manto, linfoma folicular, linfoma T periférico y linfoma de Hodgkin.10, 11
En la mayoría de los casos, el linfoma MALT (de la zona marginal extranodal) se comporta como una enfermedad indolente, con un espectro de síntomas que van desde la dispepsia, hasta el sangrado gastrointestinal o vómitos persistentes. Las manifestaciones clínicas más comunes son la pérdida de peso, el dolor abdominal y la hemorragia del tracto gastrointestinal. La inmunohistoquímica es indispensable para realizar el diagnóstico, mostrando un perfil de linfocito B (CD20 positivo) con restricción de cadena ligeras (kappa o lambda). En lo que respecta a los linfomas de alto grado que pueden desarrollarse de novo o a partir de un linfoma MALT preexistente, su curso clínico es más agresivo. Su presentación es similar a la del carcinoma de estómago, presentándose principalmente con dolor epigástrico, dispepsia y pérdida de peso. En este caso, el inmunoperfil también es indispensable para establecer el diagnóstico diferencial con otras clases de linfoma, así como para subclasificar el tipo de linfoma difuso, mostrando un inmunoperfil de linfocitos B (CD20 positivo) y su grado de diferenciación: como son tipo centro germinal, postcentro germinal o anaplásico (CD10, BCL2, BCL6, MUM1, ALK1).10, 11 La infección por H. pylori se relaciona hasta en el 90% de los casos con linfoma tipo MALT y su asociación es clara, mientras que con el linfoma difuso este vínculo es menor (35%) siendo el rol en la fisiopatología controversial.8 La ubicación más frecuente es la parte media y distal del estómago, seguidos por las formas difusas y los ubicados en forma proximal.10, 11
El paciente descrito por nuestro grupo debuta con un episodio de hemorragia digestiva causada por una úlcera gigante gástrica, la cual finalmente representó una lesión por linfoma gástrico primario extra nodal B de células grandes de alto recambio celular. Dicha lesión se asoció a H. pylori y se localizó en la región media del estómago sobre la cara posterior.
Al revisar las formas de presentación clínica de los linfomas gástricos, la úlcera gigante gástrica no está descrita dentro de las más frecuentes. Como se mencionó, la dispepsia, el dolor abdominal inespecíficos y los síntomas de impregnación son los motivos de consulta habitual. Se han descrito ejemplos de debut de perforación gástrica espontánea como reportes de casos aislados.
Por lo antes mencionado, nos resulta de utilidad presentar este caso clínico para considerar la presencia de linfomas gástricos primarios dentro de las etiologías a tener en cuenta en el diagnóstico diferencial de dichas lesiones, así como a la inversa, reconocer a la úlcera gástrica gigante como una forma de presentación de estos linfomas.
Consentimiento para la publicación. Se obtuvo el consentimiento informado por escrito del paciente o su padre, tutor o familiar, para la publicación de los datos y/o imágenes clínicas en beneficio de la ciencia. La copia del formulario de consentimiento se encuentra disponible para los editores de esta revista.
Propiedad intelectual. Los autores declaran que los datos que figuran en el manuscrito son originales y fueron realizados en sus instituciones pertenecientes.
Aviso de derechos de autor
 © 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
© 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Fernandez GR, Zanetti M, Argüello MR y col. Úlcera gigante gástrica como forma de presentación del linfoma gástrico primario. Presentación de un caso y revisión de la bibliografía. Acta Gastroenterol Latinoam. 2021;51(3):358-62. https://doi.org/10.52787/sdee3831
Referencias
- Feldman M, Scharschmidt B, Sleisenger MH. Enfermedades gastrointestinales y hepáticas. 6ta edición. Capítulo 40: Úlcera péptica y sus complicaciones. Editorial médica panamericana. 2000;1:691-2.
- Podolsky DK, Camilleri M, Fitz JG. et al. Yamada´s Textbook of Gastroenterology. 6ta Edición. Capítulo 56: Peptic ulcer. disease. Wiley Blackwell. 2016;1:1052.
- Lord R, El-Feki M, Tomos L. et al. Giant gastric ulcers: Malignancy yield and predictors from a 10-year retrospective single centre cohort. United European Gastroenterology Journal. 2018:6(7):1000-6.
- Domellöf L, Enander LK, Nilsson F. Bleeding as a Complication to Endoscopic Biopsies from the Gastric Remnant after Ulcer Surgery. Scand J Gastroenterol. 1983;18(7):951-4.
- Rezapour M, Verhille M. Upper GI endoscopy complication: a case of a post- gastric biopsy bleeding from a visible vessel. MOJ Clin Med Case Rep. 2017;6(2):39-40.
- Zubarik R, Eisen G, Mastropietro C, et al. Prospective Analysis of Complications 30 days after Outpatient Upper Endoscopy. Am. J. Gastroenterol. 1999; 94:1539-1545.
- Vu CKF, Korman MG, Bejer I, et al. Bleeding After Cold Biopsy. Am J Gastroenterol. 1998;93(7):1141-3.
- Zullo A, Hassan C, Ridola L, et al. Gastric MALT Lymphoma: Old and New Insights. Ann Gastroenterol. 2014;27(1):27-33.
- Ferruci PF, Zucca E. Primary Gastric Lymphoma Patoghenesis And Treatment: What Has Changed Over The Past 10 Years? Br J Haematol. 2007;136(4):521-38.
- Teco-Cortes JA, Grube-Pagola P, Alderete-Vázquez G. Linfoma gástrico primario. Serie de 28 casos: ¿Es el linfoma MALT el único que se presenta? Acta Gastroenterol Latinoam. 2017;47(4):307-10.
- Psyrri A, Papageorgiou S, Economopoulos T. Primary extranodal lymphomas of stomach: clinical presentation, diagnostic pitfalls and management. Ann Oncol. 2008;19:1992-9.
Correspondencia: Guillermo Rubén Fernández
Correo electrónico: gaheend@gmail.com
Acta Gastroenterol Latinoam 2021;51(3):358-362
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE