Fernando De la Garza-Salazar, Manuel Nicolás Guerra-Villa, Arturo Ramírez-Rosales, Juan Jacobo-Ayala Gaytán
Departamento de Medicina Interna, Christus Muguerza Hospital Alta Especialidad, Universidad de Monterrey. Nuevo León, México.
Acta Gastroenterol Latinoam 2019;49(3):245-249
Recibido: 06/02/2018 / Aprobado: 06/04/2018 / Publicado en www.actagastro.org el 17/09/2019
Resumen
Un hombre de 57 años con antecedente de artritis psoriásica en tratamiento con leflunomida y adalimumab se presentó con disfagia, odinofagia y pérdida de peso de 2 meses de evolución. En cavidad oral se encontró gingivitis con edema granuloso, ulceraciones en el paladar duro, paladar blando, úvula, faringe y carrillo derecho. No había datos patológicos en la exploración física de los pulmones. En la radiografía de tórax no se mostraron alteraciones y la prueba de tuberculina fue negativa. Se realizó una biopsia de la lesión que evidenció una tinción de Ziehl-Neelsen positiva para bacilos ácido alcohol resistentes, reacción de cadena de polimerasa e interferon-gamma release asays para Mycobacterium tuberculosis positivos y granulomas con células epiteloides, células gigantes multinucleadas de Langhans e infiltrado linfocítico y de células plasmáticas. El paciente recibió esquema de antimicrobianos con isoniacida, rifampicina, pirazinamida y etambutol con buena respuesta clínica. En conclusión, la tuberculosis de la cavidad oral se presenta en el 0,1-5% de los casos de tuberculosis extrapulmonar. La afectación del paladar duro es, dentro de las manifestaciones orales, la menos común de todas, con solo siete casos publicados en la bibliografía revisada. Hasta donde tenemos conocimiento es el único caso reportado de tuberculosis de cavidad oral secundario al uso de antagonistas del factor de necrosis tumoral y el único caso de tuberculosis con afectación del paladar duro reportado en México. La alta sospecha clínica y el cumplimiento de las guías de tratamiento tienen buenos resultados incluso en las localizaciones más raras de la tuberculosis.
Palabras claves. Tuberculosis, adalimumab, cavidad oral, paladar duro, factor de necrosis tumoral.
Oral tuberculosis with hard palate lesions in a Mexican patient after initiation of anti-tumour necrosis factor therapy for psoriatic arthritis
Summary
A 57-year-old man with a history of psoriatic arthritis under treatment with leflunomide and adalimumab presented with dysphagia, odynophagia and unintentional weight loss since 2 months ago. In the oral cavity, gingivitis with granular edema, ulcerations in the hard palate, soft palate, uvula, pharynx and right cheek was found. The rest of the physical examination was normal. There were no pathological data in the physical examination of the lungs. A chest x-ray and tuberculin test were negative. Therefore a biopsy of the lesion was performed, that reported a Ziehl-Neelsen stain positive for acid-fast bacilli, polymerase chain reaction and interferon-gamma release assays for Mycobacterium tuberculosis positive and granulomas with epitheloid cells, Langhans multinucleated giant cells and infiltrated lymphocytic and plasma cells. The patient received isoniazid, rifampin, pyrazinamide and ethambutol with a good clinical response. In conclusion, tuberculosis of the oral cavity occurs only in 0.1-5% of the cases of extrapulmonary tuberculosis. Involvement of the hard palate is considered one of the least common oral manifestations with only seven cases reported in the medical literature. To our knowledge, it is the only reported case of oral cavity tuberculosis secondary to the use of tumor necrosis factor antagonists and the only case of tuberculosis with the involvement of the hard palate reported in Mexico. The high clinical suspicion and adherence to the treatment guidelines have a good clinical outcome even in the rarest locations of tuberculosis.
Key words. Tuberculosis, adalimumab, oral cavity, hard palate, anti-tumour necrosis factor.
Abreviaturas
CDM: diabetes mellitus.
TBC: tuberculosis.
PCR: proteína C reactiva.
FNTα: factor de necrosis tumoral alfa.
PPD: derivado de proteína purificada.
IGRA: interferon-γ release assays.
Con el aumento de la incidencia del síndrome de inmunodeficiencia adquirida, Mycobacterias multidroga resistentes y de la diabetes mellitus (DM) se espera que aumenten las manifestaciones extrapulmonares de la tuberculosis (TBC). Dentro de las manifestaciones extrapulmonares, la afectación de la cavidad oral se presenta solamente en el 0,1-5%.1 Los lugares de afectación que se han descrito son: lengua, mandíbula, labios, mucosa, paladar blando y paladar duro.1, 2 El compromiso del paladar duro es considerado la forma de presentación menos frecuente de todas.1 A continuación se presenta un caso de TBC de paladar duro en un paciente con artritis psoriásica en tratamiento con un antagonista del factor de necrosis tumoral que respondió de manera favorable al tratamiento antifímico.
Caso clínico
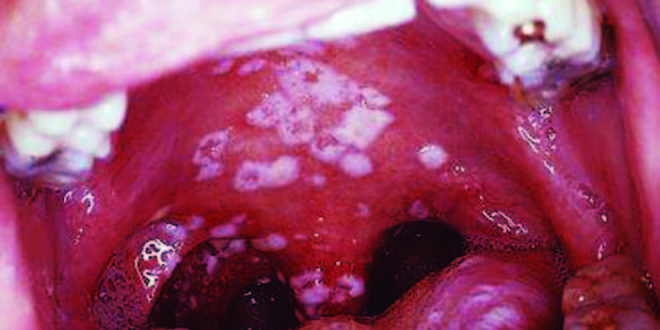
Un hombre de 57 años concurre por odinofagia, disfagia progresiva y pérdida de 6 kg de peso en los últimos 2 meses. Como antecedente relevante padece artritis psoriásica desde hace 5 años y recibe tratamiento con adalimumab 40 mg subcutáneos cada 2 semanas y leflunomida 20 mg/día vía oral hace 2 años. El paciente negó conductas sexuales de riesgo, contacto con tosedores crónicos o con personas con TBC, traumatismos previos en la cavidad oral, malestar general, tos, hemoptisis y fiebre nocturna. Fue tratado hace un mes con itraconazol vía oral y nistatina tópica durante 14 días sin ninguna mejoría. A su llegada los signos vitales eran normales. La exploración física no mostró hallazgos relevantes, a excepción de una gingivitis con edema granuloso y ulceraciones en el paladar duro, paladar blando, úvula, faringe y carrillo derecho (Figura 1). No se encontraron adenopatías a ningún nivel, ni cicatriz de vacunación con el bacilo Calmette-Guerin. La exploración pulmonar era normal. Los datos de laboratorio iniciales solicitados fueron: linfopenia de 799 células/mm3 como único hallazgo relevante, velocidad de sedimentación globular y proteína C reactiva elevados con valores de 43 mm/h y 46,7 mg/dL respectivamente. La radiografía de tórax no mostró alteraciones. Por la evolución y las características de la lesión se solocitaron otros estudios (anticuerpos antinucleares, anti-ADN de doble cadena, anti-Smith, anti-RNP, anti-Ro, anti-La, anti- SCL70, anti-Jo1 y prueba de tuberculina), que resultaron ser negativos. El paciente recibió por 5 días caspofungina 50 mg IV al día, clindamicina 300 mg VO cada 6 horas y ceftriaxona 1 gr IV cada 12 horas sin mejoría, por lo que se decidió realizar una biopsia de la lesión (Figuras 2 y 3). Se solicitaron tinciones especiales como el hidróxido de potasio, ácido peryódico de Schiff, auramina-rodamina y cultivos para hongos y Mycobacterias, que resultaron negativos. La tinción de Ziehl-Neelsen mostró bacilos ácido alcohol resistentes y la reacción en cadena de la polimerasa (PCR) y el quantiferon para TBC resultaron también positivos. Estos hallazgos junto con los histopatológicos hicieron el diagnóstico de TBC palatina, por lo que el adalimumab fue suspendido y se inició tratamiento con isoniazida, rifampicina, pirazinamida y etambutol. El paciente presentó mejoría clínica dentro de las primeras dos semanas de tratamiento con disminución de la lesión en aproximadamente un 70%. A los dos meses de seguimiento el paciente se encuentra con buen control de la artritis psoriásica, no tiene sintomatología digestiva superior y la lesión en cavidad oral se resolvió por completo.
Figura 1. Ulceraciones en la cavidad oral secundarias a tuberculosis. Múltiples lesiones ulcerativas en paladar duro, paladar blando, úvula, faringe y carrillo derecho.
Figura 2. Biopsia de lesión en paladar duro. Tinción de hematoxilina y eosina vista a 10x. Se encuentran infiltrados inflamatorios compuestos por células plasmáticas y linfocitos, además de granulomas con células epiteloides y células gigantes multinucleadas de tipo Langhans.
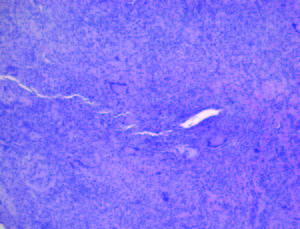
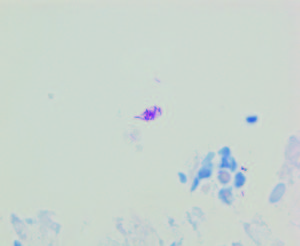
Figura 3. Micobacterias en biopsia de la lesión. Tinción de Ziehl-Neelsen vista a 100x. Se muestran bacilos ácido alcohol resistentes.
Discusión
La TBC es una enfermedad infecciosa causada por las bacterias pertenecientes a la familia Mycobacterium; la Mycobacterium tuberculosis es la más frecuente.2, 3 Según la Organización Mundial de la Salud la TBC se encuentra en estado latente en una tercera parte de la población mundial y es la causa número uno en el mundo de muerte de origen infeccioso con 1,4 millones de defunciones en el 2015.1, 4 Todos los órganos pueden afectarse, pero el pulmón es el órgano más frecuentemente involucrado.3 La TBC de la cavidad oral es muy poco común, probablemente porque la mucosa oral intacta, la producción de saliva y la presencia de flora saprófita son factores protectores que evitan la invasión de micobacterias.1, 5-13 El uso de inmunosupresores de tipo anti-FNTα, puede modificar la respuesta inmune frente a la invasión microbiana y hacer más prevalente estas manifestaciones. Una revisión sistemática publicada en el 2010 por Kakisi y col. incluyó 145 casos de TBC en la cavidad oral (ninguno de ellos en tratamiento con anti-FNTα). El paladar duro es la estructura menos frecuentemente involucrada con solo 7 (4,8%) casos reportados.1 En estos pacientes el promedio de edad fue de 43,5 años, la ulceración fue la lesión elemental más común (n = 5, 75%), la mitad tenían lesiones pulmonares concomitantes, 80% tuvieron reacción positiva frente al derivado de proteína purificada (PPD, purified protein derivative) y el 67% presentó positividad tanto en la tinción de Ziehl-Neelsen como en el cultivo para micobacterias.1 Los siete casos publicados respondieron de manera favorable al tratamiento antifímico.1
Es importante mencionar que dentro del estudio de las lesiones en la cavidad oral la TBC siempre debe ser considerada como una posibilidad, sobre todo en zonas endémicas y países subdesarrollados, como en México, donde la TBC continúa siendo un problema de salud pública.14 El compromiso del paladar duro puede darse en el contexto de TBC primaria o secundaria. El mecanismo de diseminación en estos dos casos es por inoculación directa (TBC primaria) o diseminación linfática o hematógena (TBC secundaria).15 Los autores, considerando los resultados de la PPD no reactiva y ante la ausencia de lesiones características en la radiografía de tórax, interpretan que puede tratarse de una forma primaria de la enfermedad.
El FNTα es una citocina que aumenta la capacidad fagocítica de los macrófagos y mantiene la formación óptima del granuloma de la TBC, como lo describen Bekker y col.16 El adalimumab es uno de los cinco anti-FNTα que se encuentran actualmente en el mercado. Este grupo de fármacos son ampliamente utilizados para tratar enfermedades autoinmunes y reumatológicas, entre otras. Los anti-FNTα han sido asociados con reactivación de TBC latente en muchos estudios.17 Un metaanálisis publicado en el 2017 por Zhang Z y col. que incluyó 29 ensayos clínicos controlados (14 de infliximab, 9 de adalimumab, 2 de golimumab, 1 de etarnecept y 3 de certolizumab pegol) con 11.879 pacientes (7.912 en el grupo de anti-FNTα y 3.967 en el grupo control) encontró 45 (0,57%) casos de TBC en el grupo en tratamiento con anti-FNTα y solo 3 (0,07%) casos en el grupo control, el odds ratio que obtuvieron fue de 1,94 (IC95%: 1,10- 3,44; p = 0,02) para el grupo de anti-FNTα sin encontrar heterogeneidad relevante (I2 = 0%).17 En el análisis de subgrupos basados en el tipo de anti-FNTα utilizado no se encontraron diferencias estadísticamente significativas con respecto al riesgo de reactivación de TBC.17 La mayoría de las reactivaciones asociadas a los anti-FNTα ocurren en el pulmón, aunque en algunas ocasiones pueden estar involucrados otros órganos. Un caso publicado en el 2016 reportó a un hombre con enfermedad de Crohn en tratamiento con adalimumab y protocolo de tamizaje para TBC latente negativo que incluyó radiografía de tórax, PPD e interferon-γ release assays (IGRA). El paciente presentó 7 meses después del inicio del anti- FNTα fiebre, dolor y distensión abdominal secundario a líquido de ascitis, por lo que se realizó una paracentesis que resultó positiva para TBC (cultivo y biopsia), con buena respuesta al tratamiento antifímico.18 El protocolo de tamizaje de TBC latente para iniciar tratamiento con anti-FNTα ha disminuido considerablemente la reactivación de la TBC, pero debemos recordar que estos pacientes por lo general se encuentran en tratamiento con otros inmunosupresores que disminuyen la sensibilidad y aumentan los falsos negativos de la PPD y del IGRA, siendo estas dos pruebas fundamentales en el diagnóstico de TBC latente en primer lugar.18 Además de los factores ya mencionados, la TBC de la cavidad oral se ha asociado a una disminución en la sensibilidad del cultivo y de la tinción de Ziehl-Neelsen con sensibilidades reportadas de 58% y 52% respectivamente.1 La ventaja del cultivo es que permite la distinción entre diferentes micobacterias y su sensibilidad a antibióticos. No existen casos reportados de TBC de la cavidad oral causados por micobacterias resistentes a la rifampicina, aunque se espera que surjan en un futuro. La localización de la TBC en nuestro paciente y el uso de anti-FNTα podrían explicar la falta de positividad en el cultivo.1 Por este motivo, para aumentar el rendimiento diagnóstico, algunos autores recomiendan realizar una biopsia de tejido.1 Cualquier lesión oral con características macroscópicas sospechosas, que no responda a tratamiento antibiótico o que aparezca en el contexto de inmunosupresión, debe biopsiarse para descartar patologías sistémicas como poliangitis granulomatosa, enfermedad de Behcet, enfermedad de Crohn, cáncer, TBC, entre otras.1 Se ha descrito que hasta el 3% de las lesiones pueden coexistir con un carcinoma y que esta a su vez es una causa de falta de respuesta al tratamiento antifímico.1 La guía de tratamiento de la TBC del 2016 refiere que los mismos principios generales para el manejo de la TBC extrapulmonar deben de ser aplicados en TBC de la cavidad oral.19 El esquema antimicrobiano con mayor efectividad es isoniacida, rifampicina, pirazinamida y etambutol una vez al día por 56 dosis como fase intensiva e isoniacida, y rifampicina una vez al día por 126 dosis como fase de sostén, aunque existen algunas variaciones.19 Existen muchas indicaciones de iniciar tratamiento antifímico de manera empírica. En nuestro caso, el uso concomitante de anti-FNTα y la positividad para TBC en la tinción de Ziehl-Neelsen, PCR e IGRA de la lesión fueron los factores determinantes para iniciar un tratamiento temprano. Otra consideración importante es la suspensión del anti-FNTα en el contexto de TBC (si la enfermedad de base lo permite) y, aunque no existe un consenso, la mayoría de los expertos opina que puede reanudarse al terminar la fase intensiva del tratamiento antifímico siempre y cuando el paciente haya tenido una respuesta clínica favorable.19, 20
Conclusión: hasta donde tenemos conocimiento, este es el primer caso de TBC en paladar duro asociado al uso de anti-FNTα y el primer caso de TBC en paladar duro reportado en México. En países con alta prevalencia de TBC se espera un aumento en la incidencia de las manifestaciones extrapulmonares de la TBC, incluidas las orales. La alta sospecha clínica y la toma de biopsia son claves para iniciar un tratamiento oportuno y evitar complicaciones serias. El cumplimiento de las guías de tratamiento es fundamental incluso en las localizaciones más raras de la TBC.
Conflicto de intereses. Los autores declaran no tener ningún conflicto de intereses.
Sostén financiero. No se solicitó ningún apoyo financiero para la elaboración del caso clínico.
Referencias
- Kakisi OK, Kechagia AS, Kakisis IK, Rafailidis PI, Falagas ME. Tuberculosis of the oral cavity: a systematic review. Eur J Oral Sci 2010; 118: 103-109.
- Chen I, Jamal S, Pua K. Primary tuberculosis of palate. Malays Fam Physician 2015; 10: 32-34.
- Lawn SD, Zumla AI. Tuberculosis. Lancet 2011; 378: 57-72.
- Gilpin C, Korobitsyn A, Weyer K. Current tools available for the diagnosis of drug-resistant tuberculosis. Ther Adv Infect Dis 2016; 3: 145-151.
- Ray P, Halder A, Chowdhury J, Roy A-K. Primary tuberculosis in soft palate: Case report of a rare entity. Indian J Dermat 2014; 59: 423.
- Saroch A, Pannu AK. A case of hard palate perforation. J Family Med Prim Care 2016; 5: 865-867.
- Piasecka-Zeyland E, Zeyland J. On the inhibitory effect of human saliva on the growth of tubercle bacilli. Tubercle 1937; 19: 24-27.
- Molina M, Ortega G, Vera V, Pérez Luján R. Tuberculosis of the palate. Enferm Infecc Microbiol Clín 1996; 14: 630-631.
- Kamala R, Sinha A, Srivastava A, Srivastava S. Primary tuberculosis of the oral cavity. Indian Journal Dental Research 2011; 22: 835-838.
- Kumar V, Singh A-P, Meher R, Raj A. Primary tuberculosis of oral cavity: a rare entity revisited. Indian J Pediatr 2011; 78: 354-356.
- Zaki S-A, Bhongade S, Vartak S-S. Perforation of the hard palate due to tuberculosis. Dent Res J (Isfahan) 2012; 9: 804-806.
- Sierra C, Fortun J, Pais J, Gomez-Mampaso E. Tuberculosis of the palate without lung involvement. Enferm Infecc Microbiol Clin 1992; 10: 509-510.
- Mignogna M, Muzio L, Favia G, Ruoppo E, Sammartino G, Zarrelli C, Bucci E. Oral tuberculosis: a clinical evaluation of 42 cases. Oral Dis 2000; 6: 25-30.
- Delgado-Sánchez G, García-García L, Castellanos-Joya M, Cruz- Hervert P, Ferreyra-Reyes L, Ferreira-Guerrero E, Hernández- Hernández A, Ortega-Baeza VM, Montero-Campos R, Sulca JA, Martínez-Olivares ML, Mongua-Rodríguez N, Baez-Saldaña R, González-Roldán JF, López-Gatell H, Ponce-de-León A, Sifuentes-Osornio J, Jiménez-Corona ME. Association of pulmonary tuberculosis and diabetes in Mexico: analysis of the national tuberculosis registry 2000–2012. PloS One 2015; 10: 0129312.
- Solanki S, Gadre UC, Solanki M, Kaur R. Tuberculosis of palate. Lung India: official organ of Indian Chest Society 2015; 32: 188.
- Bekker LG, Freeman S, Murray PJ, Ryffel B, Kaplan G. TNF-α controls intracellular mycobacterial growth by both inducible nitric oxide synthase-dependent and inducible nitric oxide synthase-independent pathways. J Immunol 2001; 166: 6728-6734.
- Zhang Z, Fan W, Yang G, Xu Z, Wang J, Cheng Q, Yu M. Risk of tuberculosis in patients treated with TNF-α antagonists: a systematic review and meta-analysis of randomised controlled trials. BMJ open 2017; 7: 012567.
- Tranah TH, Luk SY, Gess M. Extra-pulmonary Reactivation of Latent Tuberculosis After Initiation of Anti-tumour Necrosis Factor Therapy for Inflammatory Bowel Disease-Are Current Screening Strategies Adequate? Journal of Crohn’s & Colitis 2017; 762-763.
- Nahid P, Dorman SE, Alipanah N, Barry PM, Brozek JL, Cattamanchi A, Chaisson LH, Chaisson RE, Daley CL, Grzemska M, Higashi JM, Ho CS, Hopewell PC, Keshavjee SA, Lienhardt C, Menzies R, Merrifield C, Narita M, O’Brien R, Peloquin CA, Raftery A, Saukkonen J, Schaaf HS, Sotgiu G, Starke JR, Migliori GB, Vernon A. Official American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America Clinical Practice Guidelines: Treatment of Drug-Susceptible Tuberculosis. Clin Infect Dis 2016; 63: e147-e195.
- Cantini F, Prignano F, Goletti D. Restarting biologics and management of patients with flares of inflammatory rheumatic disorders or psoriasis during active tuberculosis treatment. J Rheumatol Suppl 2014; 91: 78-82.
Correspondencia: Fernando De la Garza Salazar
Monte Blanco #605 Col. Residencial San Agustín, San Pedro Garza García, Nuevo León, México
Tel.: Tel.: +52 811-080-2131
Correo electrónico: fernandodelagarza@gmail.com
Acta Gastroenterol Latinoam 2019;49(3): 245-249
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE