Juan Ignacio Olmos1 ID· Carlos Robles-Medranda2 ID
1 Servicio de Gastroenterología, Hospital de Clínicas “General José de San Martín”. Buenos Aires, Argentina.
2 Jefe del Servicio de Endoscopía del Instituto Ecuatoriano de Enfermedades Digestivas – IECED. Guayaquil, Ecuador.
Acta Gastroenterol Latinoam 2022;52(2):166-173
Recibido: 27/05/2022 / Aceptado: 22/06/2022 / Publicado online el 27/06/2022 / https://doi.org/10.52787/agl.v52i2.219
Resumen
La enfermedad por reflujo gastroesofágico continúa siendo la enfermedad gastrointestinal que con mayor frecuencia se diagnostica en los Estados Unidos, y su incidencia y prevalencia se encuentran en aumento a nivel global. El pilar de tratamiento tradicional se basa en el manejo médico, incluyendo modificaciones en los estilos de vida y en la dieta. Sin embargo, una proporción significativa de los pacientes presenta una pobre respuesta al tratamiento con inhibidores de bomba de protones en el largo término o se niega a tomar la medicación de manera crónica por miedo a sus efectos adversos. En estos pacientes refractarios al manejo médico o con contraindicación para este, el siguiente paso es el procedimiento quirúrgico antirreflujo. Recientemente, se han desarrollado avances innovadores en lo que respecta a la terapéutica endoscópica, que ofrecen numerosas alternativas mínimamente invasivas en el manejo endoscópico de la enfermedad por reflujo gastroesofágico para estos pacientes. No obstante, el rol de los procedimientos endoscópicos continúa siendo un tema controversial debido a los limitados datos comparativos a largo término, aunque se empiezan a tener en consideración en las ultimas guías de manejo de enfermedad por reflujo gastroesofágico. En esta revisión discutiremos las diferentes opciones terapéuticas endoscópicas disponibles actualmente.
Palabras claves. Enfermedad por reflujo gastroesofágico, transoral incisionless fundoplication, stretta, anti-reflux mucosal ablation, MUSE™.
Endoscopic Anti-Reflux Therapy for Gastroesophageal Reflux Disease: A Present-Day Perspective
Summary
Gastroesophageal reflux disease has consistently been the most frequently diagnosed gastrointestinal disease in the USA and has an increasing incidence and prevalence worldwide. The mainstay of therapy has traditionally been medical management, including lifestyle and dietary modifications. Nevertheless, a significant proportion of patients have a suboptimal response to proton pump inhibitors or are unwilling to take lifelong medication due to concerns about long-term adverse effects. In those patients found to be refractory to medical management or with a contraindication to medications, the next step up has been surgical anti-reflux procedures. Recently, innovative advancements in therapeutic endoscopy have created numerous options for the endoscopic management of gastroesophageal reflux disease offering a minimally invasive option for these patients. Nonetheless, the role of endoscopic procedures remains controversial due to limited long-term and comparative data, although they are beginning to be taken into consideration in the latest gastroesophageal reflux disease management guidelines. In this review we will discuss the various endoscopic therapy options available.
Keywords. Gastroesophageal reflux disease, transoral incisionless fundoplication, stretta, anti-reflux mucosal ablation, MUSE™.
Abreviaturas
ERGE: Enfermedad por reflujo gastroesofágico.
IBP: Inhibidor de bomba de protones.
GERD: Gastroesophageal reflux disease.
TIF: Transoral incisionless funduplication.
EAE: Exposición ácida esofágica.
GERD-HRQL: Gastroesophageal reflux disease health related quality of life.
LNF: Laparoscopic Nissen fundoplication.
EEI: Esfínter esofágico inferior.
MUSE: Medigus ultrasound surgical endostapler.
Stretta: Nonablative radiofrequency treatment.
RF: Radiofrecuencia.
ARMS: Anti-reflux mucosectomy.
ARMA: Anti-reflux mucosal ablation.
Introducción
La enfermedad por reflujo gastroesofágico (ERGE) es una condición en la cual el material gástrico refluido provoca manifestaciones esofágicas y extraesofágicas.1,2 Su presentación clínica clásica incluye la pirosis y la regurgitación, pero también se asocia a una variedad de síntomas como la disfagia, la odinofagia, la salivación excesiva, el dolor de pecho atípico, la tos crónica, la ronquera y las sibilancias.
La ERGE es una patología frecuente a nivel global, con una prevalencia que oscila desde un 7,4% en Asia hasta un 19,6% en América Central,3 siendo el trastorno gastroenterológico más prevalente en los Estados Unidos.4 Esta enfermedad tiene un impacto negativo en la calidad de vida de los pacientes y presenta una gran pérdida económica y de productividad. La edad y el índice de masa corporal se asocian a un mayor riesgo de ERGE y, en la actualidad, la población es cada vez más añosa y se observa además un aumento en la obesidad a nivel mundial, por lo que su impacto en el futuro podría ser mayor.5
El tratamiento estándar de la ERGE incluye la modificación del estilo de vida (pérdida de peso, suspensión de tabaco, sugerencias con respecto a la postura y la alimentación) y la supresión ácida, dejando reservada la funduplicatura para aquellos pacientes con falta de respuesta al tratamiento médico. Sin embargo, alrededor del 30%-40% de los pacientes presenta una pobre respuesta al tratamiento con inhibidores de bomba de protones (IBP), siendo esta probablemente la indicación más frecuente de tratamiento quirúrgico.6 No obstante, la funduplicatura quirúrgica es un procedimiento invasivo que está asociado a efectos adversos posteriores, como disfagia (24%), diarrea y síndrome de distensión por el gas deglutido y la imposibilidad de eructar.7 Esta necesidad de que existan procedimientos mínimamente invasivos que puedan crear una barrera antirreflujo sin los efectos adversos quirúrgicos condujo al desarrollo de técnicas novedosas endoscópicas para el tratamiento de la ERGE.
Tratamientos endoscópicos actuales
Transoral incisionless funduplication (TIF)
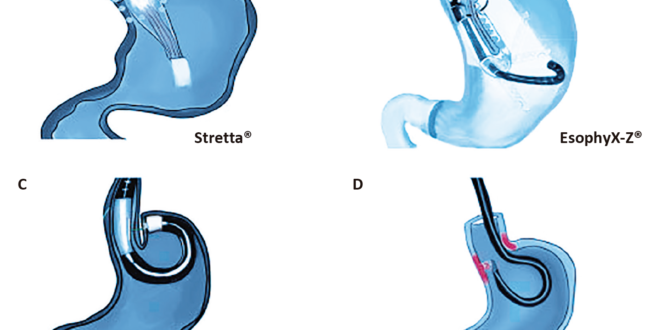
La transoral incisionless funduplication (TIF) se realiza utilizando el dispositivo EsophyX® device (EndoGastric Solutions, Inc., Redmond, WA, Estados Unidos), el cual fue aprobado en 2007 por la Food and Drug Administration (FDA) para el tratamiento endoscópico de la ERGE. Hasta la fecha se han realizado más de 25.000 procedimientos con esta modalidad. El dispositivo está diseñado para crear una plicatura “full-thickness” de serosa a serosa y reconstruir la válvula de aproximadamente 3 cm de longitud, con una circunferencia de entre 270 a 300 grados, basándose en los principios de la funduplicatura laparoscópica (Figura 1).8,9
Figura 1. Los principales fundamentos técnicos de la cirugía antirreflujo aplican tanto para la TIF como para la funduplicatura laparoscópica

Este procedimiento comienza con la realización, bajo anestesia, de una endoscopía digestiva alta para evaluar la presencia de hernia hiatal, evaluar la válvula de acuerdo con la clasificación de Hill y descartar anormalidades a nivel de la mucosa.10 Posteriormente, el endoscopio es retirado y se adjunta a este el dispositivo EsophyX®; luego se avanza con el endoscopio hasta el estómago y, bajo visión directa del cardias gástrico y de la unión gastroesofágica, el estómago es traccionado por el dispositivo, logrando envolver el esófago distal, y utilizando sujetadores de polipropileno no absorbibles se logra crear una funduplicatura parcial de 270-300 grados con una válvula de 3 cm de longitud.8,11 En la Figura 2 se detallan los diferentes métodos endoscópicos. El EsophyX® ha pasado por varias modificaciones, siendo la última (TIF 2.0) la más fácil de utilizar, la más automatizada y que tiene la posibilidad de desplegar veinte sujetadores de forma más rápida.9
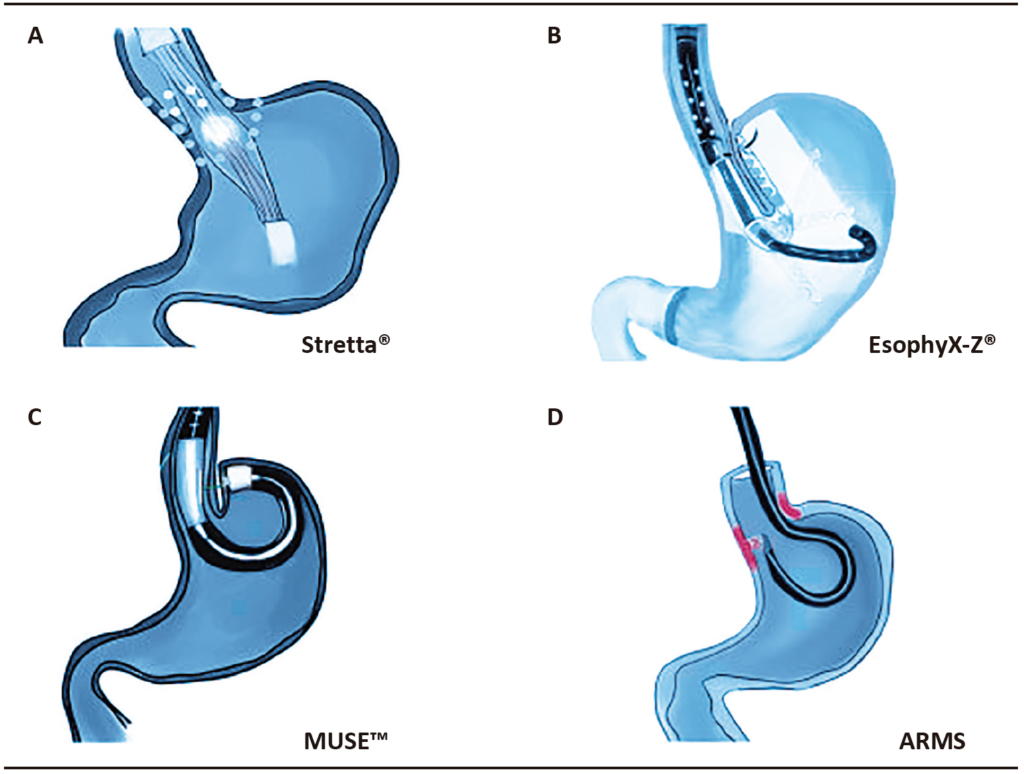
Figura 2. Diagrama esquemático de los actuales tratamientos endoscópicos para la ERGE. (A) Sistema Stretta®: catéter flexible con transmisor de radiofrecuencia y electrodos de titanio, liberando energía de radiofrecuencia por encima y por debajo de la línea Z. (B) Dispositivo TIF EsophyX®: creación de una funduplicatura esofagogástrica proximal a la línea Z. (C) MUSE™: el tejido es sujetado y suturado con asistencia de un catéter de ultrasonido. (D) ARMS: se realiza mucosectomía de 3 cm de longitud (rojo) por encima y por debajo de la línea Z, remodelando la barrera antirreflujo por medio de estenosis cicatrizal posprocedimiento. Figura adaptada de la publicación de Sheng Chen y col.43
Los candidatos óptimos para la TIF son pacientes que presentan incompetencia (Hill Grado II) del esfínter esofágico inferior (EEI) sin hernia hiatal asociada.12
Con respecto a su eficacia, la TIF está asociada a una mejoría de los síntomas de la ERGE, la suspensión o reducción del uso de IBP, la reducción del tiempo de exposición ácida esofágica (EAE) y la mejoría clínica durante diez años.13 Se realizaron ensayos clínicos, como el RESPECT trial que comparó Esophyx® 2.0 vs. placebo+IBP y, en el análisis por intención de tratar, se encontró una mejoría subjetiva de los síntomas para el grupo tratado (67% vs. 45%, p = 0,023), reducción de la EAE de 9,3% a 6,3% (p < 0,001) y del score de DeMeester de 33,6 a 23,9 (p < 0,001).14 Resultados similares fueron obtenidos en el TEMPO trial, con una mejoría sintomática superior al 62% en el brazo de pacientes que realizaron TIF.15 Se realizaron cinco ensayos clínicos, incluidos en una revisión sistemática, que dan cuenta de 886 pacientes con ERGE moderado, excluyendo a pacientes con hernia hiatal grande, esofagitis los Ángeles C o D y esófago de Barrett. En estos trabajos, la mejoría clínica tuvo una variación desde un 50% a los 12 meses hasta un 92% a los 10 años. Los eventos adversos severos fueron reportados en el 2,4% de los pacientes.13 En una revisión sistemática con más de 550 procedimientos, se observó una mejoría significativa con TIF en los scores de calidad de vida relacionada a la ERGE (GERD-HRQL) (21,9 vs. 5,9, p = 0,0001) y en el índice sintomático de reflujo (RSI) (24,5 vs. 5,4; p ≤ 0,0001). La satisfacción global de los pacientes fue del 72% y la tasa global de suspensión de IBP fue del 67% en todos los estudios incluidos, con una media de seguimiento de 8,3 meses.16 No existen hasta la actualidad ensayos clínicos que comparen la TIF con la funduplicatura laparoscópica (LNF), pero hay un estudio caso-control que comparó la TIF con la LNF, en el que se encontró una mejoría sintomática significativa en todos los grupos, pero con menor tiempo operatorio y estadía hospitalaria en el grupo TIF.17 Richter JE y col. publicaron una revisión sistemática con metaanálisis, que compara la eficacia de la TIF vs. la LNF en pacientes con ERGE. Se incluyeron siete ensayos clínicos con 1128 pacientes. En el análisis de los resultados, concluyen que la LNF tuvo mayor habilidad para mejorar parámetros fisiológicos de la ERGE, incluyendo el aumento de presión del EEI (0,78 vs. 0,72) y una disminución del porcentaje de tiempo con pH < 4 (0,99 vs. 0,32). La TIF presentó una mejor calidad de vida reportada por los pacientes (0,96 vs. 0,66), aunque esto puede deberse a los períodos más cortos de seguimiento en comparación con la LNF. Por lo expuesto, el estudio concluye que la TIF es un procedimiento endoscópico mínimamente invasivo, pero no lo recomiendan como alternativa al uso de IBP por largo término o a la LNF como tratamiento de ERGE.18
Siendo la técnica TIF un procedimiento antirreflujo endoscópico firmemente establecido, existen diferentes escenarios para ser explorados, como puede ser el caso del POEM, ya que lo beneficios de esta técnica son superiores en comparación con la miotomía laparoscópica de Heller. Sin embargo, los pacientes sometidos a POEM presentan una mayor incidencia de ERGE posprocedimiento.19 Por lo pronto, se necesitan futuros trabajos correctamente diseñados que demuestren la eficacia y durabilidad de la TIF post-POEM, pero podría tratarse de una alternativa terapéutica promisoria en este grupo de pacientes.
Medigus Ultrasonic Surgical Endostapler
El sistema Medigus Ultrasonic Surgical Endostapler (MUSE™) system (Medigus, Omer, Israel) posee la capacidad de combinar grapado microvisual, ultrasónico y quirúrgico en un solo dispositivo, lo que permite que un solo endoscopista realice la funduplicatura transoral anterior. Fue aprobado por la FDA en 2014. Posee una porción larga flexible y un extremo distal de 5 cm rígido, que es en donde se encuentran los cartuchos con 5 grapas de titanio cada uno. Posee un transductor ultrasónico, cámara, luz, canales de insuflación y succión, y 2 tornillos (21 gauges) que ayudan a la compresión del tejido en el momento del grapado. El procedimiento se realiza con anestesia e intubación orotraqueal y precisa de un sobre-tubo para avanzar el equipamiento hasta el estómago. La porción grapadora se coloca 3 cm por encima de la unión gastroesofágica y se liberan los tornillos distales permitiendo la compresión del fundus gástrico sobre el esófago. El grosor del tejido es monitorizado por ultrasonido y se liberan las grapas cuando el espesor de este es de 1,4 a 1,6 cm. El procedimiento se repite de la misma manera, recargando el contenedor de grapas según el protocolo, hasta finalizar (Figura 1).
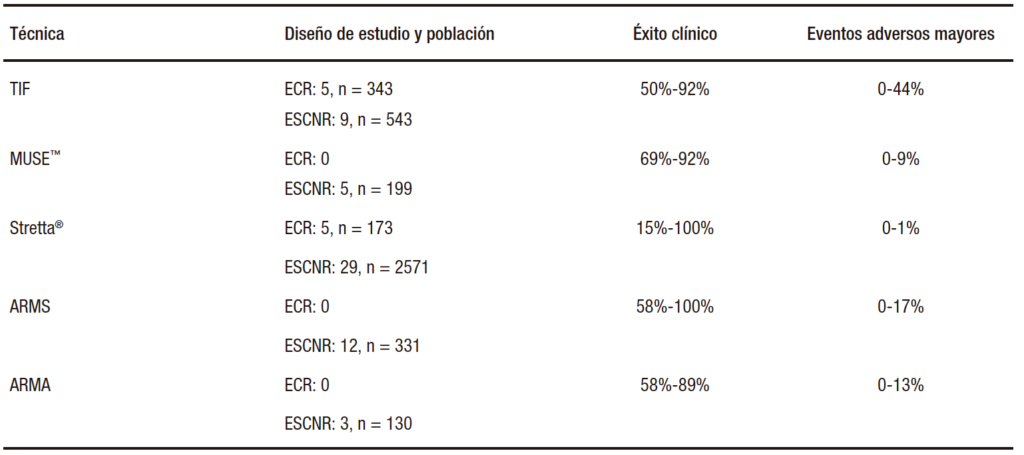
Este sistema fue evaluado en cuatro estudios no comparativos20-23 y en una serie de casos a dos brazos que incluyó a 209 pacientes con ERGE con hernia hiatal < 3 cm. El éxito clínico osciló entre el 69% y 92%, con un tiempo de seguimiento de entre 6 meses y 5 años. El riesgo de complicaciones severas (empiema, hemorragia, perforación esofágica) fue del 3,5%. Sin embargo, faltan datos y evidencia en cuanto a la seguridad y eficacia del método y deben desarrollarse ensayos clínicos controlados para obtener mejores conclusiones.
Nonablative radiofrequency treatment
El Sistema Nonablative radiofrequency treatment (Stretta®, Mederi Therapeutics, Greenwich, CT) fue aprobado en el año 2000 por la FDA para el tratamiento de la ERGE y, hasta la fecha, se han realizado más de 25.000 procedimientos. Este método utiliza energía de radiofrecuencia (RF), la cual se aplica a los músculos del EEI y del cardias gástrico a través de cuatro electrodos con una aguja de nitinol (22 gauges) que se extienden desde un catéter con balón dentro del músculo en seis niveles de la unión gastroesofágica, induciendo una reacción térmica (Figura 1). El mecanismo por el cual produce su efecto no está del todo dilucidado, aunque existen algunas teorías, entre las cuales se propone que la energía de la RF causa necrosis del tejido tratado, seguido de fibrosis.25-27 Sin embargo, la temperatura del dispositivo no llega a temperaturas de ablación, por lo que este mecanismo es discutido.28 Otros estudios postulan que Stretta® provoca afectación a nivel neuromuscular del EEI.29 Este procedimiento está indicado en pacientes con ERGE que presentan contraindicación para tratamiento médico o se rehúsan a tomar IBP a largo término, y en aquellos que no califican para tratamiento quirúrgico o se niegan a realizarlo.30
Este procedimiento fue evaluado en numerosos estudios de cohorte y en 5 ensayos clínicos controlados, 3 que lo compararon con placebo, y 2 contra IBP.31 En estos estudios no se vieron resultados significativos con respecto a cambios en EAE a los 6 meses, en comparación con el grupo IBP.32 No obstante, los pacientes tratados con Stretta® presentaron mejoras significativas en el síntoma pirosis y en la calidad de vida en comparación con placebo, mejoras que parecen mantenerse por al menos 12 meses.33-35 Un metaanálisis de 2468 pacientes36 demostró una mejoría significativa posprocedimiento en la calidad de vida y en el síntoma de pirosis, sin observarse una mejoría en la presión basal de EEI. Es un procedimiento bien tolerado y seguro, con efectos adversos severos que son muy infrecuentes (1%), entre los que se reportaron erosiones, laceraciones de mucosa, gastroparesia, inflamación intestinal, neumonía y derrame pleural.37
Anti reflux mucosectomy y anti reflux ablation (ARMS)
La mucosectomía antirreflujo (ARMS) fue desarrollada a partir de pacientes con esófago de Barrett que eran expuestos a disección endoscópica submucosa. La cicatriz posterior al procedimiento mejoraba los síntomas de la ERGE en estos pacientes y normalizaba el score de DeMeester. Esta observación condujo a la primera serie de casos publicada por Inoue y col. en 2014.38 En ARMS, se realiza una resección endoscópica de la mucosa cardial gástrica con el objetivo de reducir la apertura de la unión gastroesofágica. Inicialmente, los casos se hacían con resección endoscópica submucosa, pero, con el paso del tiempo, se demostró que la resección mucosa, asistida con cap o bandas, resulta más rápida, es más fácil y es igualmente efectiva.39-41 En el año 2020, se propuso la ablación de la mucosa cardial gástrica con argón plasma (ARMA), con el objetivo de simplificar el procedimiento, reducir el riesgo de perforación y facilitar el retratamiento en pacientes que fallaron a ARMS.42 Estas técnicas tienen como ventaja que no requieren dispositivos o accesorios costosos y pueden llevarse a cabo en una sala de endoscopía estándar. El procedimiento no está del todo estandarizado, pero la mayoría de los autores realizan el tratamiento (mucosectomía o ablación) en 270-320° del cardias gástrico, respetando parte de la mucosa esofágica, adquiriendo la forma de una “mariposa”, al dejar sin tratar 1 cm de la mucosa de la curvatura menor y mayor, como puede observarse en la Figura 2.40,42
Con respecto a su eficacia, se han llevado a cabo un total de 15 estudios no aleatorizados (12 ARMS, 3 ARMA), que evaluaron la seguridad y la efectividad de la técnica.12 El tiempo de seguimiento varió de 2 meses a un máximo de 3 años. El éxito clínico osciló entre el 58%-100% a los 2-6 meses y 72-76% a los 3 años. El evento adverso más común fue la disfagia, la cual estuvo presente en el 5% a 10% de los pacientes. Sin embargo, la disfagia asociada a este procedimiento es fácilmente tratable por medio de dilatación con balón. Ante la falta de ensayos clínicos e investigaciones a largo término, este tratamiento es actualmente considerado experimental y estaría reservado únicamente para pacientes que se incluyan en protocolos de investigación.
Consideraciones de las guías clínicas actuales para el tratamiento de la ERGE
En la última revisión de las guías clínicas de la ERGE del ACG 2022, se exponen las siguientes recomendaciones basadas en las evidencias actuales:2
• Se recomienda que la cirugía antirreflujo sea realizada por un grupo quirúrgico con experiencia, como opción de tratamiento a largo término en pacientes con evidencia objetiva de ERGE, en especialen aquellos con esofagitis severa (Los Ángeles grado C o D), grandes HH y/o síntomas de ERGE de difícil manejo (recomendación fuerte, moderado nivel de evidencia).
• Debido a que los datos de la eficacia de Stretta® son inconsistentes y con alta variabilidad, no podemos recomendar su utilización como alternativa a las terapias médicas o quirúrgicas (recomendación condicional, bajo nivel de evidencia).
• Sugerimos considerar la TIF en pacientes con regurgitación de difícil manejo o pirosis que no desean someterse a una cirugía antirreflujo y que no presentan esofagitis por reflujo severa (Los Ángeles grado C o D), o HH > 2 cm (recomendación condicional, bajo nivel de evidencia).
Conclusión
Antes de contemplar el tratamiento endoscópico de la ERGE, deberían tenerse en cuenta las siguientes consideraciones:
Cuidadosa selección del paciente: el paciente ideal es el que presenta ERGE no erosivo o esofagitis Los Ángeles grado A o B sin una alteración anatómica severa -como pueden ser la hernia hiatal grande o la dismotilidad esofágica-, o aquel que no desee tomar IBP a largo término, se niegue a realizar la funduplicatura o que persista con síntomas a pesar del tratamiento óptimo con IBP. Adicionalmente, estos pacientes, antes de la intervención, deberían ser evaluados correctamente con manometría de alta resolución, para evaluar la funcionalidad esofágica (para descartar principalmente acalasia y ausencia de contractilidad), y testeo de pH, para investigar exposición ácida patológica, las cuales deben ser documentadas previo al procedimiento endoscópico terapéutico.
Educar al paciente: Se debe dar información y consejo al paciente con respecto al tratamiento endoscópico, y remarcar que no se trata de una alternativa al tratamiento médico o a la funduplicatura quirúrgica, que en el seguimiento a largo plazo la efectividad parece disminuir y que existe la probabilidad de que deba retomar el tratamiento con IBP.
Por lo expuesto, el tratamiento endoscópico para la ERGE tiene como objetivo ofrecer una opción más ante el tratamiento médico con IBP y la cirugía antirreflujo, en pacientes seleccionados que no presenten una afectación significativa de la crura diafragmática. La TIF se posiciona como la técnica con mayor evidencia, habiéndose demostrado una mejoría en los síntomas de la ERGE y en el tiempo de exposición ácida, como así también en la reducción del consumo de IBP. La radiofrecuencia no ablativa (Stretta®) es el método con la menor tasa de eventos adversos severos, pero su eficacia ha sido puesta en duda en recientes metaanálisis. ARMS, ARMA y los nuevos sistemas de plicatura han mostrado resultados promisorios en los primeros reportes y se aguardan resultados de ensayos clínicos controlados y a largo término para sacar conclusiones definitivas. En resumen, el tratamiento endoscópico de la ERGE presenta varias técnicas novedosas, cuyo éxito clínico (Tabla 1) depende de la adecuada selección de los pacientes y de dispositivos que se encuentran en constante mejoría técnica, respecto de los cuales aún se precisa un mayor número de trabajos que presenten la mejor calidad de evidencia para consolidarse como una alternativa terapéutica mínimamente invasiva. No obstante, en las guías clínicas actuales para el manejo de la ERGE, se los comienza a considerar y recomendar para el tratamiento antirreflujo de estos pacientes, por lo cual el futuro del tratamiento endoscópico es promisorio.
Tabla 1. Éxito clínico y seguridad de las diferentes terapias endoscópicas. ECR: ensayo clínico randomizado, ESCNR: estudio serie de casos no randomizado
Propiedad intelectual. Los autores declaran que los datos, las figuras y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Olmos J I, Robles-Medranda C. Tratamiento endoscópico antirreflujo para la enfermedad por reflujo gastroesofágico: perspectiva actual. Acta Gastroenterol Latinoam. 2022;52(2):166-173. https://doi.org/10.52787/agl.v52i2.219
Referencias
- Vakil N, Van Zanten S V, Kahrilas P, Dent J, Jones R, Bianchi LK, et al. The Montreal definition and classification of gastroesophageal reflux disease: A global evidence-based consensus. Am J Gastroenterol. 2006;101(8):1900-20.
- Katz PO, Dunbar KB, Schnoll-Sussman FH, Greer KB, Yadlapati R, Spechler SJ. ACG Clinical Guideline for the Diagnosis and Management of Gastroesophageal Reflux Disease. Am J Gastroenterol. 2022;117(1):27-56.
- Eusebi LH, Ratnakumaran R, Yuan Y, Solaymani-Dodaran M, Bazzoli F, Ford AC. Global prevalence of, and risk factors for, gastro-oesophageal reflux symptoms: A meta-analysis. Gut. 2018;67(3):430-40.
- Richter JE, Rubenstein JH. Presentation and Epidemiology of Gastroesophageal Reflux Disease. Gastroenterology [Internet]. 2018;154(2):267-76. Disponible en: http://dx.doi.org/10.1053/j.gastro.2017.07.045
- Diaz-Rubio M, Moreno-Elola-Olaso C, Rey E, Locke GR, Rodríguez-Artalejo F. Symptoms of gastro-oesophageal reflux: Prevalence, severity, duration and associated factors in a Spanish population. Aliment Pharmacol Ther. 2004;19(1):95-105.
- Richter JE. The patient with refractory gastroesophageal reflux disease. Dis Esophagus. 2006;19(6):443-7.
- Fuchs KH, Babic B, Breithaupt W, Dallemagne B, Fingerhut A, Furnee E, et al. EAES recommendations for the management of gastroesophageal reflux disease. Surg Endosc. 2014;28(6):1753-73.
- Ihde GM. The evolution of TIF: transoral incisionless fundoplication. Therap Adv Gastroenterol. 2020;13:1-16.
- Chang KJ, Bell R. Transoral Incisionless Fundoplication. Gastrointest Endosc Clin N Am [Internet]. 2020;30(2):267-89. Disponible en: https://doi.org/10.1016/j.giec.2019.12.008
- Ebright MI, Sridhar P, Litle VR, Narsule CK, Daly BD, Fernando HC. Endoscopic fundoplication effectiveness for controlling symptoms of gastroesophageal reflux disease. Innov Technol Tech Cardiothorac Vasc Surg. 2017;12(3):180-5.
- Frazzoni M, Conigliaro R, Manta R, Melotti G. Reflux parameters as modified by EsophyX or laparoscopic fundoplication in refractory GERD. Aliment Pharmacol Ther. 2011;34(1):67-75.
- De Santiago ER, Albéniz E, Estremera-Arevalo F, Sánchez-Vegazo CT, Lorenzo-Zúñiga V. Endoscopic anti-reflux therapy for gastroesophageal reflux disease. World J Gastroenterol. 2021;27(39):6601-14.
- Huang X, Chen S, Zhao H, Zeng X, Lian J, Tseng Y, et al. Efficacy of transoral incisionless fundoplication (TIF) for the treatment of GERD: a systematic review with meta-analysis. Surg Endosc. 2017;31(3):1032-44.
- Hunter JG, Kahrilas PJ, Bell RCW, Wilson EB, Trad KS, Dolan JP, et al. Efficacy of transoral fundoplication vs omeprazole for treatment of regurgitation in a randomized controlled trial. Gastroenterology [Internet]. 2015;148(2):324-333.e5. Disponible en: http://dx.doi.org/10.1053/j.gastro.2014.10.009
- Trad KS, Barnes WE, Simoni G, Shughoury AB, Mavrelis PG, Raza M, et al. Transoral incisionless fundoplication effective in eliminating GERD symptoms in partial responders to proton pump inhibitor therapy at 6 months: The TEMPO randomized clinical trial. Surg Innov. 2015;22(1):26-40.
- Wendling MR, Melvin WS, Perry KA. Impact of transoral incisionless fundoplication (TIF) on subjective and objective GERD indices: A systematic review of the published literature. Surg Endosc. 2013;27(10):3754-61.
- Toomey P, Teta A, Patel K, Ross S, Sukharamwala P, Rosemurgy AS. Transoral incisionless fundoplication: Is it as safe and efficacious as a nissen or toupet fundoplication? Am Surg. 2014;80(9):860-7.
- Richter JE, Kumar A, Lipka S, Miladinovic B, Velanovich V. Efficacy of Laparoscopic Nissen Fundoplication vs Transoral Incisionless Fundoplication or Proton Pump Inhibitors in Patients With Gastroesophageal Reflux Disease: A Systematic Review and Network Meta-analysis. Gastroenterology [Internet]. 2018;154(5):1298-1308.e7. Disponible en: https://doi.org/10.1053/j.gastro.2017.12.021
- Repici A, Fuccio L, Maselli R, Mazza F, Correale L, Mandolesi D, et al. GERD after per-oral endoscopic myotomy as compared with Heller’s myotomy with fundoplication: a systematic review with meta-analysis. Gastrointest Endosc [Internet]. 2018;87(4):934-43.e18. Disponible en: https://doi.org/10.1016/j.gie.2017.10.022
- Zacherl J, Roy-Shapira A, Bonavina L, Bapaye A, Kiesslich R, Schoppmann SF, et al. Endoscopic anterior fundoplication with the Medigus Ultrasonic Surgical Endostapler (MUSETM) for gastroesophageal reflux disease: 6-month results from a multi-center prospective trial. Surg Endosc. 2015;29(1):220-9.
- Testoni PA, Testoni S, Mazzoleni G, Pantaleo G, Cilona MB, Distefano G, et al. Transoral incisionless fundoplication with an ultrasonic surgical endostapler for the treatment of gastroesophageal reflux disease: 12-month outcomes. Endoscopy. 2020;52(6):469-73.
- Roy-Shapira A, Bapaye A, Date S, Pujari R, Dorwat S. Trans-oral anterior fundoplication: 5-year follow-up of pilot study. Surg Endosc. 2015;29(12):3717-21.
- Kim HJ, Kwon C Il, Kessler WR, Selzer DJ, McNulty G, Bapaye A, et al. Long-term follow-up results of endoscopic treatment of gastroesophageal reflux disease with the MUSETM endoscopic stapling device. Surg Endosc. 2016;30(8):3402-8.
- Danalioglu A, Cipe G, Toydemir T, Kocaman O, Ince AT, Muslumanoglu M, et al. Endoscopic stapling in comparison to laparoscopic fundoplication for the treatment of gastroesophageal reflux disease. Dig Endosc. 2014;26(1):37-42.
- Sowa P, Samarasena JB. Nonablative Radiofrequency Treatment for Gastroesophageal Reflux Disease (STRETTA). Gastrointest Endosc Clin N Am [Internet]. 2020;30(2):253-65. Disponible en: https://doi.org/10.1016/j.giec.2019.12.006
- Fry LC, Mönkemüller K, Malfertheiner P. Systematic review: Endoluminal therapy for gastro-oesophageal reflux disease: Evidence from clinical trials. Eur J Gastroenterol Hepatol. 2007;19(12):1125-39.
- Triadafilopoulos G. Stretta: An effective, minimally invasive treatment for gastroesophageal reflux disease. Am J Med. 2003;115(3 SUPPL. 1):192-200.
- Triadafilopoulos G. Stretta: A valuable endoscopic treatment modality for gastroesophageal reflux disease. World J Gastroenterol. 2014;20(24):7730-8.
- Utley DS, Kim M, Vierra MA, Triadafilopoulos G. Augmentation of lower esophageal sphincter pressure and gastric yield pressure after radiofrequency energy delivery to the gastroesophageal junction: A porcine model. Gastrointest Endosc. 2000;52(1):81-6.
- Lee DP, Chang KJ. Endoscopic Management of GERD. Dig Dis Sci [Internet]. 2022;(0123456789). Disponible en: https://doi.org/10.1007/s10620-022-07390-2
- Xie P, Yan J, Ye L, Wang C, Li Y, Chen Y, et al. Efficacy of different endoscopic treatments in patients with gastroesophageal reflux disease: a systematic review and network meta-analysis. Surg Endosc [Internet]. 2021;35(4):1500-10. Disponible en: https://doi.org/10.1007/s00464-021-08386-1
- Coron E, Sebille V, Cadiot G, Zerbib F, Ducrotte P, Ducrot F, et al. Clinical trial: Radiofrequency energy delivery in proton pump inhibitor-dependent gastro-oesophageal reflux disease patients. Aliment Pharmacol Ther. 2008;28(9):1147-58.
- Corley DA, Katz P, Wo JM, Stefan A, Patti M, Rothstein R, et al. Improvement of gastroesophageal reflux symptoms after radiofrequency energy: A randomized, sham-controlled trial. Gastroenterology. 2003;125(3):668-76.
- Abdel Aziz AM, El-Khayat HR, Sadek A, Mattar SG, McNulty G, Kongkam P, et al. A prospective randomized trial of sham, single-dose Stretta, and double-dose Stretta for the treatment of gastroesophageal reflux disease. Surg Endosc. 2010;24(4):818-25.
- Arts J, Bisschops R, Blondeau K, Farré R, Vos R, Holvoet L, et al. A double-blind sham-controlled study of the effect of radiofrequency energy on symptoms and distensibility of the gastro-esophageal junction in GERD. Am J Gastroenterol. 2012;107(2):222-30.
- Fass R, Cahn F, Scotti DJ, Gregory DA. Systematic review and meta-analysis of controlled and prospective cohort efficacy studies of endoscopic radiofrequency for treatment of gastroesophageal reflux disease. Surg Endosc. 2017;31(12):4865-82.
- Vaezi MF, Shaheen NJ, Muthusamy VR. State of Evidence in Minimally Invasive Management of Gastroesophageal Reflux: Findings of a Scoping Review. Gastroenterology [Internet]. 2020;159(4):1504-25. Disponible en: https://doi.org/10.1053/j.gastro.2020.05.097
- Inoue H, Ito H, Ikeda H, Sato C, Sato H, Phalanusitthepha C, et al. Anti-reflux mucosectomy for gastroesophageal reflux disease in the absence of hiatus hernia: A pilot study. Ann Gastroenterol. 2014;27(4):346-51.
- Monino L, González J-M, Vitton V, Barthet M. Antireflux mucosectomy band in treatment of refractory gastroesophageal reflux disease: a pilot study for safety, feasibility and symptom control. Endosc Int Open. 2020;08(02):E147-54.
- Sumi K, Inoue H, Kobayashi Y, Iwaya Y, Abad MRA, Fujiyoshi Y, et al. Endoscopic treatment of proton pump inhibitor-refractory gastroesophageal reflux disease with anti-reflux mucosectomy: Experience of 109 cases. Dig Endosc. 2021;33(3):347-54.
- Debourdeau A, Vitton V, Monino L, Barthet M, Gonzalez JM. Antireflux Mucosectomy Band (ARM-b) in Treatment of Refractory Gastroesophageal Reflux Disease After Bariatric Surgery. Obes Surg. 2020;30(11):4654-8.
- Inoue H, Tanabe M, de Santiago ER, Abad MRA, Shimamura Y, Fujiyoshi Y, et al. Anti-reflux mucosal ablation (ARMA) as a new treatment for gastroesophageal reflux refractory to proton pump inhibitors: a pilot study. Endosc Int Open. 2020;08(02):E133-8.
- Chen S, Du F, Zhong C, Liu C, Wang X, Chen Y, et al. Gastroesophageal reflux disease: Recent innovations in endoscopic assessment and treatment. Gastroenterol Rep. 2021;9(5):383-91.
Correspondencia: Juan Ignacio Olmos
Correo electrónico: juan.ignacio.olmos@gmail.com
Acta Gastroenterol Latinoam 2022;52(2):166-173
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE