María Eugenia Linares1 ID· Claudia Fuxman2 ID· Maricel Bellicoso3 ID
1 Hospital de Clínicas José de San Martín, Universidad de Buenos Aires.
2 Fundación Favaloro, Hospital Universitario.
3 Inmunología Buenos Aires.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2022;52(3):322-333
Recibido: 21/08/2022 / Aceptado: 21/09/2022 / Publicado online el 29/09/2022 / https://doi.org/10.52787/agl.v52i3.244
Resumen
Las enfermedades inflamatorias intestinales, incluidas la enfermedad de Crohn y la colitis ulcerosa, son enfermedades crónicas, progresivas e inmunomediadas, que hasta el momento no tienen cura. Pueden causar una morbilidad significativa y dar lugar a complicaciones como estenosis, fístulas, cirugías, infecciones y cáncer. Es una patología heterogénea, con una severidad que varía de leve a grave, y síntomas que van de leves a debilitantes. El diagnóstico temprano y la pronta institución del tratamiento son las piedras angulares para maximizar los resultados y mejorar la calidad de vida de los pacientes. En la última década, se han aprobado varias terapias nuevas con diferentes mecanismos de acción para el manejo de las enfermedades inflamatorias gastrointestinales. Aunque el arsenal terapéutico está creciendo, un porcentaje importante de pacientes no responde a los tratamientos. Las decisiones sobre la terapia farmacológica óptima son complejas, con orientación limitada sobre la eficacia comparativa y la seguridad de los diferentes tratamientos, lo que lleva a una considerable variabilidad en la práctica. La estratificación del riesgo de la gravedad de la enfermedad, basada en factores pronósticos, puede guiar la elección del tratamiento de primera línea. Después de iniciar la terapia adecuada, es importante confirmar la remisión mediante objetivos preestablecidos (T2T o estrategia de tratamiento por objetivos), a través de un control en forma continua de la inflamación con ajuste de la terapia. El objetivo de esta revisión es proporcionar una descripción general orientada del tratamiento actual de la colitis ulcerosa y de la enfermedad de Crohn en adultos.
Palabras claves. Colitis ulcerosa, enfermedad de Crohn, enfermedad inflamatoria intestinal, tratamiento personalizado, objetivos terapéuticos.
Update on the Treatment of Inflammatory Bowel Disease
Summary
Inflammatory bowel diseases, including Crohn’s disease and Ulcerative Colitis, are chronic, progressive, immune-mediated diseases that have no cure until now. Inflammatory bowel disease can cause significant morbidity and lead to complications such as strictures, fistulas, surgery, infections, and cancer. Inflammatory bowel disease is highly heterogeneous, with severity ranging from mild to severe and symptoms ranging from mild to debilitating. Early diagnosis and prompt institution of treatment are the cornerstones for maximizing outcomes and improving quality of life. In the last decade, several new therapies with different mechanisms of action have been approved for the management of inflammatory bowel disease. Although the therapeutic arsenal is growing, a significant percentage of patients do not respond to the established treatments. Decisions about optimal drug therapy in inflammatory bowel disease are complex, with limited guidance on comparative efficacy and safety of different treatments, leading to considerable practice variability. Risk stratification of disease severity, based on prognostic factors, can help guide selection of first-line therapy. After starting appropriate therapy, it is important to confirm remission using objective end points (treat to target) with continued control of inflammation with adjustment of therapy (tight control). In this review we provide a physician-oriented overview of clinical management of ulcerative colitis and Crohn’s disease in adults.
Keywords. Ulcerative colitis, Crohn’s disease, inflammatory bowel diseases, treatment, personalized therapy, therapeutic goals.
Introducción
La enfermedad inflamatoria intestinal (EII) comprende un grupo heterogéneo de condiciones que afectan el tracto gastrointestinal, siendo la enfermedad de Crohn (EC) y la colitis ulcerosa (CU) las dos principales entidades reconocidas. El curso de la enfermedad es variable, ya que en algunos pacientes es indolente con largos períodos de remisión, mientras que, en otros, se presenta como de manera mucho más agresiva.1
Por lo tanto, es esencial como primera medida luego del diagnóstico poder estratificar el riesgo pronóstico, que va a permitir seleccionar la estrategia de tratamiento más adecuada. Ciertas características clínicas están asociadas con un curso más agresivo de la enfermedad y con un mayor riesgo de progresión y complicaciones.
Por otro lado, en las últimas décadas, se ha producido un gran avance en las terapéuticas disponibles, siendo clave la evaluación de los riesgos, beneficios y alternativas de tratamiento para desarrollar un plan terapéutico individualizado para cada paciente.
Si pudiéramos predecir los subgrupos de pacientes con más probabilidades de tener una peor evolución y, además, identificar a quienes obtendrían el mayor beneficio de los tratamientos disponibles, podríamos seleccionar y adaptar la estrategia de tratamiento y seguimiento más adecuada para cada caso. Este enfoque minimizaría la toxicidad, maximizaría la eficacia y conduciría a un uso más eficiente de los recursos disponibles.
Estratificación del riesgo
La estratificación del riesgo es un elemento clave para determinar la selección inicial del tratamiento de la EII. Es importante diferenciar como primera medida la actividad de la severidad de la enfermedad. La actividad se refiere a la carga inflamatoria en un momento dado, y la severidad tiene en cuenta el fenotipo y el curso de la enfermedad y es útil para determinar el pronóstico y predecir complicaciones.2 Por ejemplo, un paciente con baja actividad de la enfermedad podrá presentar escasos o mínimos síntomas y marcadores inflamatorios bajos, pero, en realidad, puede tener una gran severidad, debido a un fenotipo o comportamiento de la propia enfermedad que aumente el riesgo de progresión, y deberá entonces manejarse de forma más proactiva.
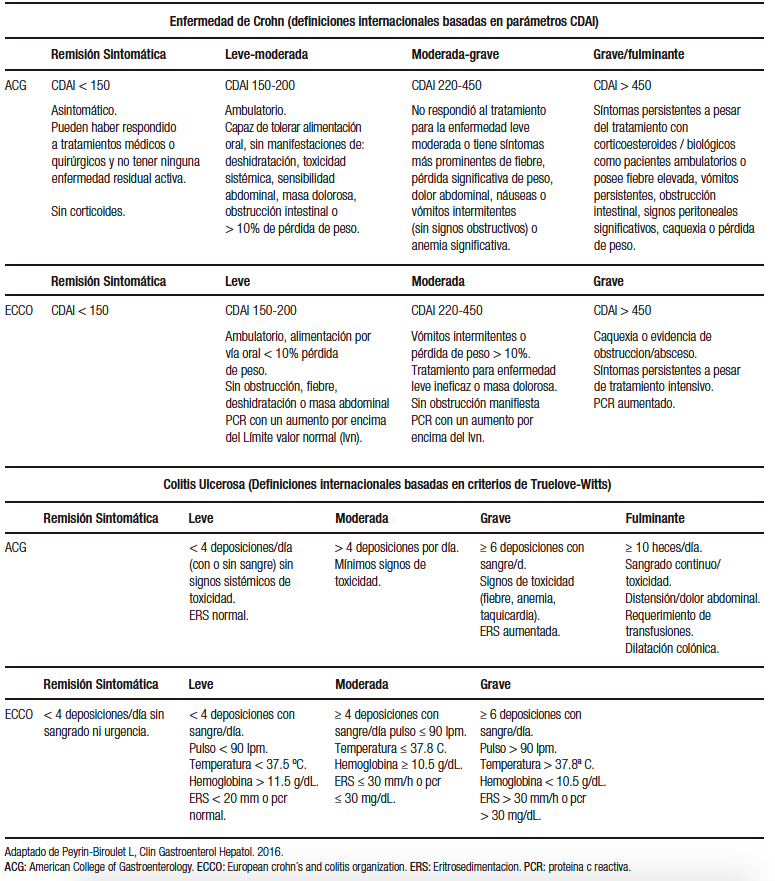
Para evaluar la actividad de la enfermedad en un punto en el tiempo fueron desarrollados diferentes índices clínicos tanto para EC como para CU, algunos de ellos representados en la Tabla 1.3
Tabla 1. Definiciones internacionales de actividad de la enfermedad en la enfermedad de en Crohn y la Colitis Ulcerosa
La actividad puede definirse como leve, moderada y grave, según las herramientas anteriores.4
Si la terapia eficaz se reserva hasta que la enfermedad activa, de moderada a grave, sea evidente, perderemos la oportunidad de tratar con éxito a los pacientes para lograr la remisión. Para mirar más allá de los síntomas y reconocer mejor a los pacientes con mayor riesgo debido a su EII, se han identificado algunos atributos claves que contribuyen a la severidad general de la de la patología.4
En este sentido, en la EC hay determinados factores que se asocian con un mayor riesgo de recaída o un curso de la enfermedad más agresivo o complicado. Estos son: la edad temprana al diagnóstico, el tabaquismo, el compromiso anatómico extenso, el compromiso ileal o ileocolónico, la enfermedad perianal y/o rectal grave, el comportamiento penetrante o estenosante, las ulceraciones profundas en la endoscopía5 y determinados marcadores de laboratorio (hemoglobina baja, albúmina baja, PCR alta y niveles altos de calprotectina fecal).6-9
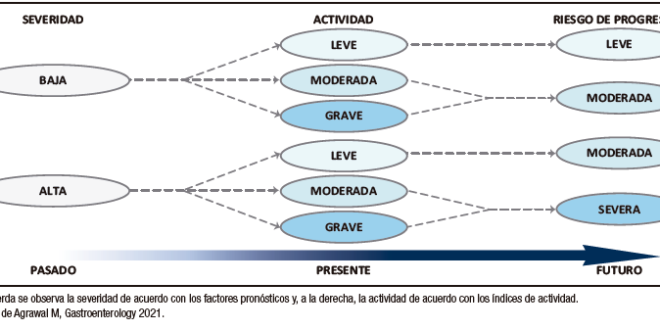
En relación con la CU, los predictores asociados con un curso más agresivo, mayor riesgo de colectomía y/u hospitalización son: el diagnóstico a una edad temprana (< a 40 años), la colitis extensa, la actividad endoscópica severa (presencia de úlceras profundas), los brotes frecuentes que necesitan esteroides u hospitalización,10 las infecciones agregadas por citomegalovirus y Clostridium difficile5 y la progresión de la enfermedad de distal a extensa o pancolitis 11 (Figura 1).
Figura 1. Estratificación de la progresión de la EII sobre la base de la severidad y la actividad 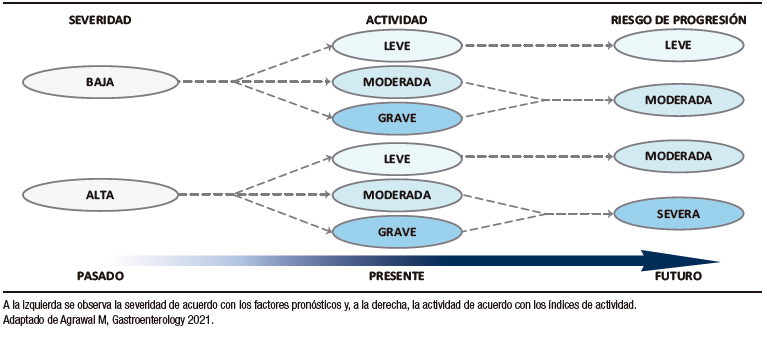
Con este mismo fin, la Organización Internacional para el Estudio de las Enfermedades Inflamatorias Intestinales (IOIBD, por sus siglas en inglés) selecciónó, con base en la opinión de expertos en un panel Delphi modificado, los factores más importantes de severidad de la EII, y los clasificaron en orden de importancia y luego crearon un índice de severidad. En pacientes con EC, los factores más importantes que sugieren una alta severidad de la enfermedad, en orden de pesos relativos, basados en una combinación de daño estructural, carga inflamatoria e impacto de la calidad de vida, son: lesiones mucosas grandes o profundas en la endoscopía o las imágenes, presencia de fístulas y/o abscesos perianales, resecciones intestinales, particularmente de segmentos mayores a 40 cm. Teniendo en cuenta la presencia o no de todos los factores seleccionados, puede clasificarse a los pacientes en alta o baja severidad (Tabla 2).4 En la CU, los factores considerados más importantes fueron: la presencia de úlceras mucosas, seguido del impacto en las actividades diarias, la proteína C reactiva elevada y el uso previo de biológicos.4 Sin embargo, estos índices aún no han sido validados.
Tabla 2. Índice de severidad de Enfermedad de Crohn 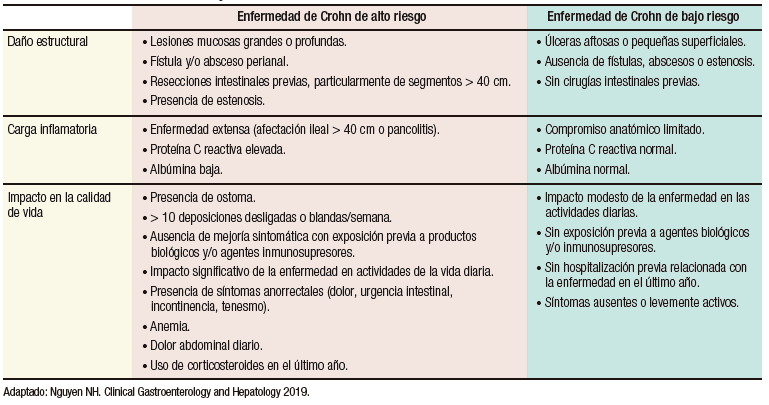
Al comparar la EC y la CU, la severidad general de la EC se asocia más con la acumulación de daño intestinal, en contraste con la gravedad general de la CU, que depende más de los síntomas y el impacto en la vida diaria. Esto es consistente con cómo se aborda a los pacientes en la práctica real. Por ejemplo, cuando un paciente con EC es evaluado por el médico, aunque los síntomas actuales son tenidos en cuenta, la carga previa de la enfermedad (por ej., cirugías, fístulas, etc.) se pondera más alto que los síntomas del día a día al momento de considerar un tratamiento a largo plazo. En cambio, en la CU, la inflamación es más manifiesta sintomáticamente y el daño intestinal es menos evidente, por lo que se abordará de manera diferente.
Objetivos del tratamiento
La elección de la terapia inicial debería ir acompañada de un enfoque o estrategia que implique la identificación de un objetivo predefinido a alcanzar con el tratamiento, seguido de la optimización de este y de un seguimiento regular hasta que se logre ese objetivo, fundamental para prevenir resultados adversos a largo plazo.
En los últimos años los objetivos del tratamiento fueron modificándose, pasando del mero control sintomático a la curación mucosa.12 En este sentido, el programa STRIDE-I, iniciado por la IOIBD, publicó una declaración de consenso en el año 2015 sobre estrategias de tratamiento por objetivo (treat to target o T2T), en donde la meta terapéutica principal fue la remisión clínica y endoscópica. Para la CU, la remisión clínica/PRO (resultados informados por el paciente) se definió como la resolución del sangrado rectal y diarrea/alteración del hábito intestinal, con remisión endoscópica, descrita como aquella con resolución de la friabilidad o la ulceración (puntuación endoscópica de Mayo de 0-1). En el caso de la EC, la remisión clínica/PRO se identificó por la resolución del dolor abdominal y diarrea/alteración del hábito intestinal, con endoscopía en remisión, definida como la resolución de las ulceraciones en la ileocolonoscopía o resolución de los hallazgos de inflamación en los estudios por imágenes. Este enfoque puesto en la curación de la mucosa de las recomendaciones del STRIDE fue apoyado por la evidencia indirecta de su asociación con un menor riesgo de recaída, menos cirugías y hospitalizaciones, y el descenso exitoso de esteroides.12
Este consenso se actualizó en 2020 (STRIDE-II) y estableció objetivos ordenados en forma cronológica: la respuesta clínica, la remisión y la normalización de la proteína c reactiva (PCR) son objetivos inmediatos y a corto plazo; la reducción de la calprotectina a un rango aceptable (100-250 ug/g) se ha agregado como un objetivo intermedio formal de tratamiento, y la restauración de la calidad de vida y la ausencia de discapacidad se sumaron a la curación mucosa como objetivos a largo plazo. Asimismo, se introdujo el tiempo esperado para los diferentes tratamientos iniciados para alcanzar estos objetivos.13
Manejo terapéutico de la CU
El manejo de un paciente con diagnóstico de CU dependerá de la actividad y la extensión de la enfermedad. La actividad desde el punto de vista clínico podemos dividirla, según los criterios de Truelove y Witts adaptados,14 en leve, moderada y grave (Tabla 1). Con respecto a la extensión. podemos dividirla, de acuerdo con la clasificación de Montreal, en proctitis (E1), colitis izquierda (E2) y colitis extensa (E3), según si afectan solo el recto, el colon hasta el ángulo esplénico o más allá del ángulo esplénico, respectivamente.14-15
Las drogas utilizadas en el tratamiento de la CU incluyen los 5-aminosalicilatos, corticosteroides, inmunosupresores, fármacos biológicos y, más recientemente, las pequeñas moléculas.
Enfermedad leve a moderada
Las drogas que habitualmente se utilizan de inicio para inducir remisión en la mayor parte de los brotes leves a moderados son los salicilatos, los corticoides de acción tópica y los corticoides sistémicos. Se dispone de formulaciones orales y tópicas.14
Uno de los primeros medicamentos efectivos para tratar la CU son los 5-aminosalicilatos (5-ASA), que incluyen a la sulfasalazina y la mesalazina, y se consideran drogas extremadamente seguras. Aunque el arsenal terapéutico para la CU se encuentra en permanente expansión, el 5-ASA sigue siendo el pilar del tratamiento para la CU en los pacientes con un brote leve a moderado.16
La sulfasalazina, que consta de 5-ASA ligado a sulfapiridina, fue el primero en ser desarrollado, pero se indica con menor frecuencia de forma rutinaria debido a los efectos secundarios de la sulfapiridina. La mesalazina oral está disponible en diferentes formulaciones (comprimidos, gránulos) con distintas características de liberación, todas con una eficacia similar.16 En cuanto a la forma de administración, una dosis única diaria vía oral es al menos tan eficaz como las dosis repartidas, favoreciendo una mayor adherencia de parte del paciente.14 Además de las formulaciones orales, la mesalazina también se presenta para el uso tópico, en forma de supositorios, espuma o enema. La elección de una u otra formulación dependerá de la extensión de la enfermedad y de la aceptación por parte del paciente. Los supositorios son útiles en la afectación rectal; la espuma en la localización recto-sigmoidea, y el enema en lesiones que abarquen hasta el ángulo esplénico.14 En líneas generales, podemos indicar supositorios de mesalazina en la proctitis, y mesalazina oral y/o tópica en la proctosigmoiditis, mientras que en la colitis extensa siempre debe recibirse mesalazina oral.16 En este último escenario, si el paciente presenta síntomas rectales intensos podemos ofrecer un tratamiento combinado (oral y tópico). Sin embargo, dada la especial incomodidad de la vía de tratamiento, la opinión de cada paciente es importante.14 La mesalazina oral generalmente actúa en 2-4 semanas.16
Si los síntomas del paciente no mejoran, debe iniciarse tratamiento con corticosteroides orales. Estos proporcionan un beneficio a corto plazo para los pacientes que no responden a los 5-ASA, o bien que presentan de inicio una actividad moderada de la enfermedad, pero no son útiles para el mantenimiento de la remisión y producen efectos secundarios clínicos significativos. Por lo tanto, una meta importante del tratamiento es lograr la remisión libre de corticosteroides.17 Una vez iniciados los esteroides, deben retirarse lentamente reduciendo en forma gradual la dosis hasta su suspensión, y el tratamiento no debería extenderse más allá de las 12 semanas. También existen formulaciones de corticoides tópicos (enemas, espumas); sin embargo, no son más efectivos que los preparados tópicos de mesalazina.18
Los corticoides son drogas efectivas en la inducción de la remisión, pero no para el mantenimiento ni pacientes que se comportan como corticodependientes (definidos como aquellos en los cuales no es posible reducir la dosis al equivalente a 10mg/día de prednisolona, o que presentan recaída dentro de los tres meses de haber suspendido la medicación),18 en quienes será necesario escalar en el tratamiento.
Las tiopurinas se utilizan a menudo para mantener la remisión inducida por esteroides. Sin embargo, un 30-40% de los pacientes son no respondedores, incluyendo un 10-20% de casos en los que no se toleran. Además, la remisión clínica libre de esteroides se alcanza en un 30-50% de los pacientes y la curación mucosa en un tercio de ellos.19 El comienzo de la acción lenta de las tiopurinas impide su uso durante el brote de la enfermedad. La aparición de efectos adversos lleva a la retirada del fármaco en el 10-20% de los pacientes que reciben tiopurinas.20
Para CU moderada o moderada severa que presenta respuesta inadecuada, intolerancia a la terapia convencional o corticorrefractariedad (definida en el paciente ambulatorio como la enfermedad activa a pesar de recibir prednisolona hasta 0,75 mg/kg/día o su equivalente durante 4 semanas),18 contamos con las drogas biológicas: anti-TNFs (infliximab [IFX], adalimumab [ADA], golimumab, vedolizumab (VDZ) y ustekinumab (UST), y con las pequeñas moléculas, (tofacitinib). El número de terapias biológicas disponibles está aumentando y hay muchos estudios en los que se evalúan la eficacia y la seguridad de cada terapia por separado. Sin embargo, la falta de ensayos directos dificulta la elección de la mejor terapia para un paciente específico entre las opciones disponibles.21
En el ensayo VARSITY, el único ensayo directo de dos productos biológicos en CU (n = 769), VDZ fue superior a ADA para lograr la remisión clínica (31,3 % frente a 22,5 %; p = 0,006) y la mejoría endoscópica (39,7% frente a 27,7%; p < 0,001) en la CU de moderada a grave.22
En las guías americanas,23 sobre la base del metaanálisis de Singh, se recomiendan todas las opciones de biológicos y pequeñas moléculas como primera línea de tratamiento, aunque se sugiere IFX o VDZ antes que ADA. En las europeas,24 de forma similar a las americanas, recomiendan las mismas opciones en primera línea de tratamiento, aunque no realizan sugerencias sobre su posicionamiento. Sin embargo, las guías son una orientación o lineamiento, pero no pueden ni deben sustituir el criterio clínico;14 es el médico tratante quien considerará las características individuales de cada paciente, tales como la edad, sus preferencias y las comorbilidades, así como los costos en el momento de elegir el primer biológico.21
Cabe recordar, en un escenario de falla terapéutica, la posibilidad de la cirugía electiva como una opción de tratamiento.14
Enfermedad grave
El tratamiento farmacológico del brote grave se basará, en la mayoría de los casos, salvo contraindicación absoluta por toxicidad grave o situación de urgencia quirúrgica, en la administración de corticoides endovenosos. Esta terapia sigue siendo la primera opción en el brote grave de CU, ya que reduce claramente (de > 20% a < 2%) la mortalidad en este escenario clínico.14
En caso de falla, se trata de un paciente corticorresistente, definido en el paciente internado con falta de respuesta luego de 3-5 días de corticoides endovenosos.18 En este punto, disponemos de tres opciones: ciclosporina, infliximab o cirugía. En relación con el tratamiento médico, solo hay suficiente evidencia para recomendar IFX. La alternativa al IFX es la ciclosporina, sin diferencias en cuanto a la tasa de colectomía.25 Cuando se usa ciclosporina como inducción, es necesario un tratamiento de mantenimiento diferente. Tradicionalmente, las tiopurinas fueron los fármacos utilizados para el mantenimiento; sin embargo, hay pruebas recientes que respaldan la utilidad de algunos biológicos.14
En caso de falla al tratamiento médico, la opción en la CU grave es la cirugía. Otras causas de cirugía de urgencia mucho menos frecuentes son el megacolon tóxico, la perforación del colon y la hemorragia masiva.26 Una vez que se ha tomado la decisión de someter al paciente a una cirugía de urgencia, la colectomía subtotal seguida del pouch ileoanal es el procedimiento de elección.2
Manejo terapéutico de la EC
En el pasado, estos pacientes eran tratados con 5-aminosalicilatos, corticoides y agentes inmunosupresores, con el objetivo de mejorar los síntomas relacionados con la enfermedad.
Como ya mencionamos, el enfoque del tratamiento ha evolucionado en los últimos años, debido a un mejor entendimiento de la importancia de modificar la historia natural de la enfermedad, y con la introducción temprana de terapias avanzadas, altamente efectivas.27
Desde un punto de vista práctico, para hablar del tratamiento de los pacientes con EC, nos basamos en los factores de severidad propuestos por IOBD (Tabla 2), que los divide en alto riesgo y bajo riesgo de progresión de la enfermedad.
Bajo riesgo
Los tratamientos mejor evaluados en este escenario son los aminosalicilatos y la budesonida.27
La mesalazina, incluso en dosis altas, no fue efectiva para inducir la remisión sintomática ni en el mantenimiento en pacientes con EC leve a moderada. Sin embargo, hay trabajos que sugieren que la sulfasalazina es eficaz para inducir la remisión sintomática en pacientes con EC de colon, aunque es discutible su eficacia para inducir respuesta endoscópica. Teniendo en cuenta estos datos, las guías clínicas del American College of Gastroenterology y la European Crohn’s and Colitis Organization desaconsejan el uso de mesalazina en pacientes con EC activa; se sugiere considerar la sulfasalazina para el tratamiento de la EC leve a moderadamente activa con compromiso colónico.28,29
El uso de 5-ASA tópico (enema o supositorio) para el tratamiento de la EC no se ha estudiado en ensayos clínicos.29
Con respecto a la budesonida, se recomienda su uso para la inducción de la remisión clínica en pacientes con EC con actividad de leve a moderada limitada al íleon y/o colon ascendente.29
Los antibióticos como el metronidazol y la ciprofloxacina, entre otros, no demostraron eficacia para inducir la remisión clínica o la cicatrización de la mucosa en comparación con el placebo. Por otro lado, sus eventos adversos limitan su uso.29,30
Hay estudios que sugieren que las terapias dietéticas en adultos, incluidas las dietas elementales, semielementales y definidas, pueden ser efectivas en algunos pacientes con EC, con reducción de los indicadores objetivos de inflamación de la mucosa. Estos beneficios no son duraderos y los síntomas y la inflamación activa reaparecen cuando se reanuda una dieta sin restricciones. Por lo tanto, las terapias dietéticas pueden considerarse como complemento de otras terapias en la inducción.28
Asimismo, como parte de la estrategia de tratamiento, a todos los pacientes con EC se les debe aconsejar el cese del hábito tabáquico. El tabaco está claramente asociado a una peor evolución y es el único factor de riesgo modificable.28
Alto riesgo
El manejo de estos pacientes requiere seleccionar una terapia inmunosupresora para uso a corto (corticoides, biológicos) y largo plazo (tiopurinas, metotrexato [MTX], biológicos) para lograr la remisión y disminuir el riesgo de complicaciones relacionadas con la enfermedad.27
En pacientes con EC de moderada a grave, se sugiere el uso de corticosteroides sistémicos a corto plazo, para aliviar los síntomas (inducción de la respuesta y remisión clínica).28,29 En dos estudios que incluyeron a 267 pacientes, se concluyó que los corticosteroides eran dos veces más efectivos para inducir la remisión clínica que el placebo (RR: 1,99; IC 95%: 1,51-2,64).31 Los esteroides convencionales no logran la cicatrización de la mucosa de manera consistente y deben usarse con moderación debido a sus eventos adversos.28
Con respecto a las tiopurinas (6 mercaptopurina, azatioprina), debido al lento inicio de acción, no se recomiendan para la inducción de la remisión en pacientes con EC activa de moderada a grave.32 Son efectivas y deben considerarse para el tratamiento de mantenimiento de la remisión de estos pacientes.28
Con respecto al MTX, en las guías ECCO, no hubo consenso sobre la recomendación de su uso en la inducción de la remisión clínica. Sin embargo, el MTX parenteral, pero no el oral, puede ser eficaz para mantener la remisión clínica, y se lo puede considerar como una opción para el mantenimiento en pacientes corticodependientes con enfermedad de moderada a grave, cuando no pueden utilizarse otras opciones.29, 33
Como parte del arsenal terapéutico de este grupo de pacientes, se encuentran los biológicos: anti TNFs (IFX, ADA y certolizumab [CTZ), anti Integrinas (VDZ) y anti Interleukinas (UST) (Tabla 3).
Tabla 3. Arsenal terapéutico en enfermedad inflamatoria intestinal 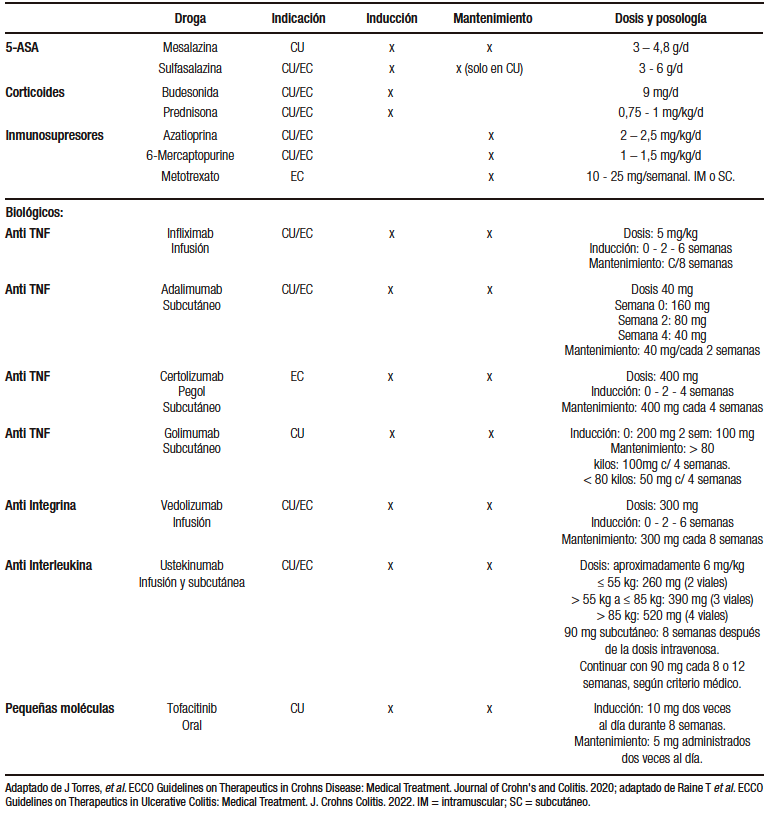
Los anticuerpos monoclonales dirigidos contra el TNF-α son agentes antiinflamatorios potentes y de acción rápida. Se recomienda su uso para inducir la remisión y para su mantenimiento en pacientes con EC de moderada a grave que no han respondido a la terapia convencional (corticoides e inmunosupresores).28
Hay estudios que informan que los anti-TNFs podrían ser más efectivos si se introdujeran en forma temprana, durante los primeros dos años desde el diagnóstico, influyendo en la prevención de complicaciones.34 Esta estrategia suele utilizarse en la práctica diaria.
Un tema ampliamente discutido es la comboterapia (anti-TNFα más inmunosupresores) versus la monoterapia con anti-TNFα. Varios trabajos han demostrado la superioridad de la comboterapia, específicamente la combinación de infliximab y tiopurinas, en pacientes con EC activa de moderada a grave. La terapia combinada de IFX y tiopurina fue superior a la monoterapia con IFX y a la monoterapia con tiopurina para lograr la remisión clínica sin corticosteroides y la remisión endoscópica.35 El beneficio observado de la terapia combinada se adjudica, al menos en parte, al logro de una mayor concentración del biológico y una menor inmunogenicidad en comparación con la monoterapia con biológicos.27 Los anti-TNFα han significado un gran avance en el tratamiento de la EII, así como en la calidad de vida de estos pacientes. Sin embargo, hasta 1/3 de los que reciben anti-TNFα no responden (falla primaria del tratamiento), falla definida como falta de respuesta al tratamiento de inducción (entre las 8 y 12 semanas desde su inicio).36,37 Otros experimentan falla secundaria, definida como la respuesta inicial a un fármaco biológico que luego presenta una disminución o una menor duración de esta en el tiempo,37 o bien una intolerancia al tratamiento. Estos escenarios suponen un reto terapéutico para los gastroenterólogos. Hasta hace pocos años, se utilizaba un segundo fármaco anti-TNFα cuando el primero había fracasado, independientemente de si el paciente era un no respondedor primario, no respondedor secundario o intolerante. La eficacia de un segundo anti-TNFα en pacientes con EC, en general, es menor y depende, en gran medida, de la causa del cambio.36
Por tales motivos, fue necesario el desarrollo de nuevos tratamientos para la EII, dirigidos hacia otras dianas terapéuticas.38. Así, surgieron moléculas como el VDZ y el UST. VDZ es un anticuerpo monoclonal IgG1 que actúa bloqueando la integrina α4β7, lo que resulta en una actividad antiinflamatoria selectiva en el intestino. UST es un anticuerpo monoclonal IgG1 que se une a la subunidad p40 compartida por las interleukinas proinflamatorias 12 y 23. Las guías recomiendan el uso de ambos para la inducción de la remisión y mantenimiento en pacientes con EC moderada a grave con respuesta inadecuada a la terapia convencional y/o a la terapia anti-TNFα.28, 29
Hay pocos estudios que comparan en forma directa biológicos entre sí. Uno de ellos es el SEAVUE que compara UST vs ADA. Incluyó a 386 pacientes con EC de moderada a grave durante un año. Ambos fármacos fueron altamente efectivos, sin diferencias estadísticamente significativas a la semana 52, en remisión clínica (65% y 61% con UST y ADA, respectivamente), remisión libre de esteroides, respuesta clínica y remisión endoscópica. Las infecciones fueron más frecuentes con ADA (34% frente a 40,5%), pero las infecciones graves ocurrieron en una tasa similar (2,1% y 2,6%).39
La elección del tratamiento biológico es compleja y depende de las características y preferencias del paciente, de la enfermedad, la accesibilidad y los costos.29 En este sentido, las guías europeas recomiendan, para los pacientes con EC de moderada a grave con respuesta inadecuada o intolerancia a la terapia convencional, el uso de anticuerpos monoclonales (IFX, ADA, CTZ, UST, VDZ). Todos estos agentes son efectivos tanto en poblaciones con EC sin experiencia biológica previa (naive), como con experiencia.29
Las guías americanas (AGA) recomiendan, en pacientes naive, el uso de IFX, ADA o UST sobre certolizumab pegol para la inducción de la remisión, y sugieren VDZ sobre certolizumab pegol en estos pacientes.40
Situaciones especiales
Si bien excede a los objetivos de esta revisión, hay determinadas circunstancias que merecen una mención especial.
Crohn ileal o ileocecal
La EC puede afectar a cualquier segmento del tubo digestivo, siendo las localizaciones más frecuentes la afectación ileal aislada, presente en hasta un tercio de los pacientes, y la afectación ileocecal.41
Se considera el tratamiento médico como terapia de primera línea en la EC, y se reserva la cirugía para el fracaso o la intolerancia a este, o para el tratamiento de fenotipos estenosantes o perforantes. Sin embargo, el advenimiento de las técnicas quirúrgicas mínimamente invasivas y la subespecialización de cirujanos colorrectales han permitido que la cirugía se posicione como una alternativa a considerar de inicio frente al tratamiento médico, en ciertas ocasiones.42 Es así, que al tratamiento quirúrgico se lo reconoce en la actualidad como una opción de primera línea en la enfermedad ileocecal localizada, la cual es definida como aquella cuyo compromiso ileal es menor de 40 cm.43
El estudio LIRIC (Laparoscopic Ileocolic Resection Versus Infliximab Treatment of Distal Ileitis in Crohn’s Disease), un ensayo que compara IFX versus resección ileocólica laparoscópica en pacientes adultos con enfermedad ileal terminal localizada, no encontró entre los dos grupos diferencias en seguridad o medidas de calidad de vida al año.43
Crohn estenosante
Se ha informado que las tasas acumulativas de complicaciones en pacientes con EC oscilan entre el 48% y el 52% a los 5 años, y entre el 69% y el 70% a los 10 años después del diagnóstico.44
La estenosis es la complicación más común de la EC y ocurre en aproximadamente un tercio de todos los pacientes con esta condición. Puede presentarse en cualquier segmento del tubo digestivo, con una localización preferente en el íleon terminal y en las anastomosis ileocólonicas.44, 45 Aproximadamente el 40% de los pacientes necesitará cirugía después de 10 años de enfermedad.44, 45
Es sabido que las estenosis no son puramente fibróticas ni inflamatorias, sino que suelen tener un patrón mixto. Si lo que predomina es el componente inflamatorio, estas tienen más posibilidades de responder al tratamiento médico. Por el contrario, las de predominio fibrótico (evaluado con endoscopía, calprotectina fecal y ausencia de realce mural en la entero RM) y en las estenosis que son cortas en pacientes naive de cirugía, se consideran una indicación para tratamiento quirúrgico.46
Si una estenosis fibrótica es menor a 4 cm, podría intentarse la dilatación endoscópica y, si es mayor a 4 cm, la estricturoplastía. En caso de ser más larga, debería realizarse la resección quirúrgica del segmento.44, 45
Crohn fistulizante
En esta revisión no se incluyó la EC perianal, ya que este tópico requiere de una revisión exclusiva.
El tratamiento precoz con anti-TNFs es un factor importante para el manejo de la EC fistulizante. Los pacientes que tienen síntomas debido a la presencia de fístulas entre asas intestinales o hacia órganos vecinos presentan un alto porcentaje de refractariedad al tratamiento médico (anti TNF y/o IMM). Sin embargo, el hallazgo incidental en una técnica de imagen (entero -TC o entero-RM) de una fístula interasas asintomática no constituye per se una indicación quirúrgica.47
Ante la presencia de abscesos intraabdominales, debe tenerse una conducta más conservadora, con antibióticos y/ o drenaje percutáneo. A pesar de que esta opción sea exitosa, en algunas series se recomienda la cirugía resectiva de forma electiva.48 El tratamiento quirúrgico estaría indicado también en pacientes que presentan estenosis concomitante o fístulas enterocutáneas.
Debido a la complejidad del cuadro, se requiere un equipo interdisciplinario (gastroenterólogo, cirujano, imagenólogo, nutricionista y, en ocasiones, infectólogo) para un manejo integral de estos pacientes.
Conclusión
Las decisiones sobre la terapia farmacológica óptima en la EII son complejas. En la actualidad, determinamos la estrategia a seguir teniendo en cuenta la actividad y la severidad de la enfermedad. Sin embargo, a pesar de los avances en el tratamiento, todavía queda un gran grupo de pacientes que no responde adecuadamente a las drogas disponibles. Además, si bien existen estudios que evalúan la eficacia y la seguridad de cada terapia por separado, la falta de ensayos directos dificulta la elección de la mejor terapia para un paciente específico entre las opciones disponibles. Estamos entrando en una era de medicina de precisión y hemos comenzado a explorar los factores que predicen la respuesta o su falta. En el futuro, es probable que las terapias para la EII se utilicen de manera más selectiva en función de la evaluación del riesgo/beneficio específico de cada paciente individual.
Aún no podemos determinar selectivamente si un individuo responderá a un tratamiento en particular.
Propiedad intelectual. Los autores declaran que los datos, las tablas y las figuras presentes en el manuscrito son veraces. Asimismo, dieron reconocimiento al autor original de cada tabla y figura.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Linares M E, Fuxman C y Bellicoso M. Tratamiento actual de la enfermedad inflamatoria intestinal. Acta Gastroenterol Latinoam. 2022;52(3):322-333. https://doi.org/10.52787/agl.v52i3.244
Referencias
- Peyrin-Biroulet L, Loftus EV Jr, Colombel J-F, Sandborn WJ. The natural history of adult Crohn’s disease in population-based cohorts. Am J Gastroenterol. 2010;105:289-97.
- Agrawal M, Spencer EA, Colombel J-F, Ungaro RC. Approach to the Management of Recently Diagnosed Inflammatory Bowel Disease Patients: A User’s Guide for Adult and Pediatric Gastroenterologists. Gastroenterology. 2021;47-65. doi: 10.1053/j.gastro.2021.04.063
- Peyrin-Biroulet L, Panés J, Sandborn WJ, Vermeire S, Danese S, Feagan BG, et al. Defining Disease Severity in Inflammatory Bowel Diseases: Current and Future Directions. Clin Gastroenterol Hepatol. 2016;14:348-54.e17.
- Siegel CA, Whitman CB, Spiegel BMR, Feagan B, Sands B, Loftus EV Jr, et al. Development of an index to define overall disease severity in IBD. Gut. 2018;67:244-54.
- Torres J, Caprioli F, Katsanos KH, Lobatón T, Micic D, Zerôncio M, et al. Predicting Outcomes to Optimize Disease Management in Inflammatory Bowel Diseases. J Crohns Colitis. 2016;10:1385-94.
- Kiss LS, Papp M, Lovasz BD, Vegh Z, Golovics PA, Janka E, et al. High-sensitivity C-reactive protein for identification of disease phenotype, active disease, and clinical relapses in Crohn’s disease: a marker for patient classification? Inflamm Bowel Dis. 2012;18:1647-54.
- Beaugerie L, Sokol H. Clinical, serological and genetic predictors of inflammatory bowel disease course. World J Gastroenterol. 2012;18:3806-13.
- Mao R, Xiao Y-L, Gao X, Chen B-L, He Y, Yang L, et al. Fecal calprotectin in predicting relapse of inflammatory bowel diseases: a meta-analysis of prospective studies. Inflamm Bowel Dis. 2012;18:1894-99.
- Gisbert JP, Marín AC, Chaparro M. Systematic review: factors associated with relapse of inflammatory bowel disease after discontinuation of anti-TNF therapy. Aliment Pharmacol Ther. 2015;42:391-405.
- Dassopoulos T, Cohen RD, Scherl EJ, Schwartz RM, Kosinski L, Regueiro MD. Ulcerative Colitis Care Pathway. Gastroenterology. 2015;149:238-45.
- Etchevers MJ, Aceituno M, García-Bosch O, Ordás I, Sans M, Ricart E, et al. Risk factors and characteristics of extent progression in ulcerative colitis. Inflamm Bowel Dis. 2009;15:1320-5.
- Peyrin-Biroulet L, Sandborn W, Sands BE, Reinisch W, Bemelman W, Bryant RV, et al. Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE): Determining Therapeutic Goals for Treat-to-Target. Am J Gastroenterol. 2015;110:1324-38.
- Turner D, Ricciuto A, Lewis A, D’Amico F, Dhaliwal J, Griffiths AM, et al. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Deter-mining Therapeutic Goals for Treat-to-Target strategies in IBD. Gas-troenterology. 2021;1570-83. doi: 10.1053/j.gastro.2020.12.031
- Sicilia B, García-López S, González-Lama Y, Zabana Y, Hinojosa J, Gomollón F. Guía GETECCU 2020 para el tratamiento de la colitis ulcerosa. Elaborada con metodología GRADE. Gastroenterología y Hepatología. 2020;43:1-57.
- Satsangi J, Silverberg MS, Vermeire S, Colombel J-F. The Montreal classification of inflammatory bowel disease: controversies, consensus, and implications. Gut. 2006;55:749-53.
- Ordás I, Eckmann L, Talamini M, Baumgart DC, Sandborn WJ. Ulcerative colitis. The Lancet. 2012;1606-19. doi: 10.1016/S0140-6736(12)60150-0
- Tripathi K, Dong J, Mishkin BF, Feuerstein JD. Patient Preference and Adherence to Aminosalicylates for the Treatment of Ulcerative Colitis. Clin Exp Gastroenterol. 2021;14:343-51.
- European evidence-based consensus on the diagnosis and management of ulcerative colitis: definitions and diagnosis. J Crohns Colitis. Disponible en: https://academic.oup.com/ecco-jcc/article-abstract/2/1/1/443275
- Bermejo F, Aguas M, Chaparro M, Domènech E, Echarri A, García-Planella E, et al. Recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) sobre el uso de tiopurinas en la enfermedad inflamatoria intestinal. Gastroenterología y Hepatología. 2018;41:205-21.
- Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatment of inflammatory bowel disease: a 30 year review. Gut. 2002;50:485-9.
- Laredo V, Gargallo-Puyuelo CJ, Gomollón F. How to Choose the Biologic Therapy in a Bio-naïve Patient with Inflammatory Bow-el Disease. J Clin Med Res. 2022;11. doi:10.3390/jcm11030829
- Sands BE, Peyrin-Biroulet L, Loftus EV Jr, Danese S, Colombel J-F, Törüner M, et al. Vedolizumab versus Adalimumab for Moderate-to-Severe Ulcerative Colitis. N Engl J Med. 2019;381:1215-26.
- Feuerstein JD, Isaacs KL, Schneider Y, Siddique SM, Falck-Ytter Y, Singh S, et al. AGA Clinical Practice Guidelines on the Management of Moderate to Severe Ulcerative Colitis. Gastroenterology. 2020;158:1450-61.
- Raine T, Bonovas S, Burisch J, Kucharzik T, Adamina M, Annese V, et al. ECCO Guidelines on Therapeutics in Ulcerative Colitis: Medical Treatment. J Crohns Colitis. 2022;16:2-17.
- Singh S, Andersen NN, Andersson M, Loftus EV Jr, Jess T. Comparison of Infliximab and Adalimumab in Biologic-Naive Patients with Ulcerative Colitis: A Nationwide Danish Cohort Study. Clin Gastroenterol Hepatol. 2017;15:1218-25.e7.
- Aseni P, De Carlis L, Mazzola A, Grande AM. Operative Tech-niques and Recent Advances in Acute Care and Emergency Sur-gery. Springer. 2019.
- Nguyen NH, Singh S, Sandborn WJ. Positioning Therapies in the Management of Crohn’s Disease. Clin Gastroenterol Hepatol. 2020;18:1268-79.
- Lichtenstein GR, Loftus EV, Isaacs KL, Regueiro MD, Gerson LB, Sands BE. ACG Clinical Guideline: Management of Crohn’s Disease in Adults. American Journal of Gastroenterology. 2018;481-517. doi:10.1038/ajg.2018.27
- Torres J, Bonovas S, Doherty G, Kucharzik T, Gisbert JP, Raine T, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Medical Treatment. J Crohns Colitis. 2020;14:4-22.
- Khan KJ, Ullman TA, Ford AC, Abreu MT, Abadir A, Marshall JK, et al. Antibiotic therapy in inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol. 2011;106:661-73.
- Benchimol EI, Seow CH, Steinhart AH, Griffiths AM. Traditional corticosteroids for induction of remission in Crohn’s disease. Cochrane Database Syst Rev. 2008;CD006792.
- Chande N, Townsend CM, Parker CE, MacDonald JK. Azathio-prine or 6-mercaptopurine for induction of remission in Crohn’s disease. Cochrane Database of Systematic Reviews. 2016. doi: 10.1002/14651858.CD000545.pub5
- Patel V, Wang Y, MacDonald JK, McDonald JWD, Chande N. Methotrexate for maintenance of remission in Crohn’s disease. Cochrane Database Syst Rev. 2014;CD006884.
- Schreiber S, Reinisch W, Colombel JF, Sandborn WJ, Hommes DW, Robinson AM, et al. Subgroup analysis of the placebo-controlled CHARM trial: increased remission rates through 3 years for adalimumab-treated patients with early Crohn’s disease. J Crohns Colitis. 2013;7:213-21.
- Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med. 2010;362:1383-95.
- D’Haens GR, Panaccione R, Higgins PDR, Vermeire S, Gas-sull M, Chowers Y, et al. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD With the European Crohn’s and Colitis Organization: When to Start, When to Stop, Which Drug to Choose, and How to Predict Response? American Journal of Gastroenterology. 2011;199-212. doi: 10.1038/ajg.2010.392
- Paredes JM, Moreno-Osset E. Manejo práctico de la intensifica-ción del tratamiento biológico en los pacientes con enfermedad inflamatoria intestinal. Enfermedad Inflamatoria Intestinal al Día. 2016;96-103. https://doi.org/10.1016/j.eii.2016.04.004
- Chaparro M, Gisbert JP. Nuevas moléculas en el tratamiento de la enfermedad inflamatoria intestinal. Gastroenterología y Hepatología. 2016;411-23. https://doi.org/10.1016/j.gastrohep.2015.09.017
- Sands BE, Irving PM, Hoops T, Izanec JL, Gao L-L, Gasink C, et al. Ustekinumab versus adalimumab for induction and maintenance therapy in biologic-naive patients with moderately to severely active Crohn’s disease: a multicentre, randomised, double-blind, parallel-group, phase 3b trial. Lancet. 2022;399:2200-11.
- Shmidt E, Ho EY, Feuerstein JD, Singh S, Terdiman JP. Spotlight: Medical Management of Moderate to Severe Luminal and Perianal Fistulizing Crohn’s Disease. Gastroenterology. 2021;160:2511.
- Chaparro M, Gisbert JP. Actualización del diagnóstico y trat-amiento de la enfermedad de Crohn. Medicine – Programa de Formación Médica Continuada Acreditado. 2016;217-26. DOI: 10.1016/j.med.2016.02.018
- Bemelman WA, Allez M. The surgical intervention: Earlier or never? Best Practice & Research Clinical Gastroenterology. 2014;497-503. doi: 10.1016/j.bpg.2014.04.013
- Ponsioen CY, de Groof EJ, Eshuis EJ, Gardenbroek TJ, Bossuyt PMM, Hart A, et al. Laparoscopic ileocaecal resection versus infliximab for terminal ileitis in Crohn’s disease: a randomised controlled, open-label, multicentre trial. Lancet Gastroenterol Hepatol. 2017;2:785-92.
- Rieder F, Zimmermann EM, Remzi FH, Sandborn WJ. Crohn’s disease complicated by strictures: a systematic review. Gut. 2013;62:1072-84.
- Vrabie R, Irwin GL, Friedel D. Endoscopic management of inflammatory bowel disease strictures. World J Gastrointest Endosc. 2012;4:500-5.
- Dignass A, Van Assche G, Lindsay JO, Lémann M, Söderholm J, Colombel JF, et al. The second European evidence-based Con-sensus on the diagnosis and management of Crohn’s disease: Cur-rent management. Journal of Crohn’s and Colitis. 2010;28-62. doi:10.1016/j.crohns.2009.12.002
- Sánchez, Rodríguez. Tratamiento médico versus quirúrgico en la estenosis ileal como debut de enfermedad de Crohn estenosante. Rev Andal Med Deport. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=6758902
- Groof EJ de, Carbonnel F, Buskens CJ, Bemelman WA. Abdom-inal Abscess in Crohn’s Disease: Multidisciplinary Management. Digestive Diseases. 2014;103-9. doi: 10.1159/000367859
Correspondencia: María Eugenia Linares
Correo electrónico: docmariaelinares@gmail.com
Acta Gastroenterol Latinoam 2022;52(3):322-333
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE