Fabio Alberto Castillo Bustamante, Christiano Makoto Sakai, Eduardo Guimarães Horneaux de Moura, Paulo Sakai
Serviço de Endoscopia Gastrointestinal. Hospital Das Clinicas, Faculdade de Medicina, Universidade de São Paulo. Brasil.
Acta Gastroenterol Latinoam 2017;47(2):106-109
Recibido: 24/02/2016 / Aprobado: 30/08/2016 / Publicado en www.actagastro.org el 03/07/2017
Resumen
El cáncer gástrico precoz (CGP) se define como el cáncer gástrico invasivo que invade hasta la submucosa, con independencia de la metástasis de los ganglios linfáticos (T1, cualquier N). Su proporción se elevó hasta el 57% en algunas regiones con la introducción de los programas de cribado, impulsando el desarrollo de nuevas técnicas de resección endoscópica, entre las que encontramos la disección endoscópica de la submucosa (DES). Objetivos. Describir por medio de video la técnica de “bolsillo submucoso” (TBS) modificada. Métodos. Videograbación de la técnica descrita. Resultados. Esta TBS modificada facilita la realización de movimientos de corte final de la mucosa y la exéresis de lesiones más grandes (ver video). Conclusiones. La TBS es una técnica de disección que debería ser considerada entre las diferentes técnicas disponibles y quizás en un futuro podría establecerse como técnica estándar.
Palabras claves. Procedimientos quirúrgicos, endoscópico, neoplasias gástricas, endoscopía.
Modified «submucosal pocket» endoscopic dissection technique. Experience in swine.
Summary
Early gastric cancer (EGC) is defined as invasive gastric cancer invading into the submucosa, regardless of lymph node metastases (T1, any N). Their proportion rose to 57% in some regions with the introduction of screening programs, fostering the development of new techniques of endoscopic resection, among which are the Endoscopic Submucosal Dissection (ESD). Objectives. To describe by video Technique «Pocket Submucous» modified (TPS). Methods. Videotaping of the technique described. Results. This TPS modified, facilitates performing final cut movements and mucosal resection of larger lesions (see video). Conclusions. TPS is a dissection technique that should be considered among the different techniques available and perhaps in the future could be established as a standard technique.
Key words. Surgical procedures, endoscopic, stomachneoplasms, endoscopy.
Abreviaturas
CGP: cáncer gástrico precoz.
DES: disección endoscópica de la submucosa.
TBS: técnica de “bolsillo submucoso” modificada.
REM: resección endoscópica de la mucosa.
El cáncer gástrico demuestra marcada variabilidad geográfica, tanto a nivel regional como dentro de cada país.1 Las áreas de mayor incidencia incluyen América Latina, Asia Oriental, y partes de Europa y Oriente Medio.1, 2 En Estados Unidos, las tasas de incidencia global son modestas, pero se incrementan en los grupos étnicos y raciales no caucásicos incluyendo los hispanos y los afroamericanos, con aumento de la incidencia entre los adultos jóvenes.3-5 El cáncer gástrico precoz (CGP) se define como el cáncer gástrico invasivo que invade hasta la submucosa, con independencia de la metástasis a ganglios linfáticos (T1, cualquier N). El CGP ha impulsado el desarrollo de nuevas tecnologías de diagnóstico por imágenes (por ejemplo, la cromoendoscopía de magnificación y la imagen de banda estrecha), así como técnicas de resección endoscópica avanzadas, por ejemplo, la resección endoscópica de la mucosa (REM) y la disección endoscópica de la submucosa (DES).6
La incidencia de CGP varía en función de la población; en Japón y Asia Oriental, hasta la mitad de las resecciones por adenocarcinoma gástrico representan CGP. En Japón, la proporción se elevó de 15% al 57% con la introducción de los programas de cribado, en Corea las cifras alcanzan hasta el 30% y en los países occidentales representan el 21%.7-10
Criterios estándar para la resección endoscópica son: alta probabilidad de resección en bloque, histología deadenocarcinoma tipo intestinal, tumor confinado a la mucosa, ausencia de invasión linfática o venosa, morfología tumoral, tamaño menor de 20 mm de diámetro y ausencia de ulceración.12, 13
La ampliación de estos criterios puede considerarse como un área de investigación activa y emergente.14, 15 Tumores de mucosa de cualquier tamaño sin ulceración, tumores de mucosa menores de 30 mm con ulceración, tumores de la submucosa menores de 30 mm con menos de 0,5 mm de profundidad sin invasión linfovascular; los pacientes que cumplen estos criterios expandidos tienen poco riesgo de metástasis en los ganglios linfáticos y si desean evitar la cirugía, la DES es capaz de lograr un margen de resección profunda y en bloque.6, 13, 16 La DES también se ha combinado con disección del ganglio centinela por laparoscopía, lo que ampliará aún más su indicación.17, 18
En la DES se utilizan varios tipos de bisturí para realizar el corte de la mucosa que rodea el tumor. La mucosa se diseca posteriormente lejos de la submucosa subyacente y todo el tumor se elimina en bloque. La DES es técnicamente más difícil que la REM. Si bien la técnica ha demostrado ser prometedora, se han descrito complicaciones importantes que incluyen: tasas de perforación de 1% a 5%; de perforación tardía 0,5%; hemorragia tardía 3,6% a 16%; estenosis 0,7% a 2% en general, con tasas hasta 17% y 7% para cardias y resecciones peri-pilórica, respectivamente; neumonía por aspiración 0,8% a 2%.19-21 Los pacientes con un tumor presente en el borde lateral de la pieza de DES tienen una tasa particularmente alta de tumor residual hasta del 63%.22 Por otro lado, buenos resultados en los pacientes con márgenes laterales positivos se han visto cuando se siguen con una estrecha observación endoscópica en vez de la gastrectomía, sin mortalidad y con tasas de supervivencia global a los cinco años de 94%.23
La tasa de supervivencia global a cinco años para CGP tratado en la mayoría de las series recientes es de más del 90%, casi el 100% en los tumores de la mucosa, y de 80% a 90% en los tumores submucosos, con tasas similares entre los pacientes sometidos a resección endoscópica y en los que se someten a resección quirúrgica, siempre y cuando sean adecuadamente seleccionados.24-29 Sin embargo, la DES gástrica tiene varias dificultades a superar incluyendo: la ubicación de la lesión, los vasos sanguíneos abundantes, el enfoque vertical a la capa muscular y el movimiento respiratorio.
Método
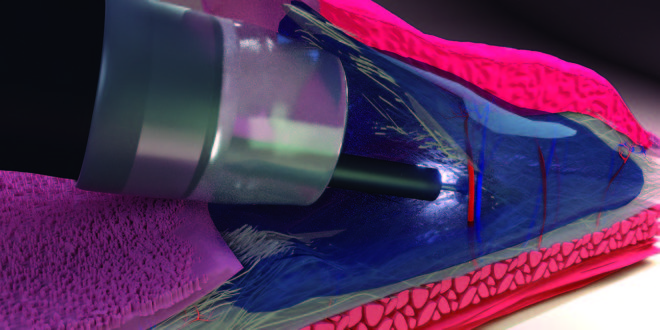
La técnica descrita a continuación fue desarrollada y perfeccionada en procedimientos seriados de DES en puercos. La técnica de bolsillo submucoso (TBS) es una nueva estrategia para superar estas dificultades en DES.30 La TBS se lleva a cabo mediante el diseño de un “bolsillo submucoso” con posterior disección dentro del mismo, usando un endoscopio con capucha plástica transparente en la punta, un electrobisturí y un catéter inyector. El procedimiento consiste en realizar, previa marcación e infiltración submucosa de la lesión, una incisión mínima proximal de la mucosa; la incisión circunferencial no es completada intencionalmente creando así un “bolsillo submucoso” (Figura 1). El endoscopio es introducido en el “bolsillo” continuando con la disección submucosa de la lesión con bisturí endoscópico (Flush Knife Ball Tiped, y unidad electroquirúrgica VIO 300 ERBE) evitando entonces la fuga de la solución inyectada y estabilizando el movimiento de la punta del endoscopio. Además, esto permite una clara visualización de la capa submucosa y su vasculatura, con una buena tracción del tejido submucoso, mejorando el control del sangrado, ajustando el ángulo de aproximación a la muscular y sincronizando el endoscopio con el «bolsillo submucoso», disminuyendo el efecto del movimiento respiratorio. En nuestra experiencia modificamos el corte final de la mucosa, la cual se realizó desde el “bolsillo submucoso” hacia la cavidad gástrica, para luego realizar la exéresis circunferencial total de la pieza usando el I-T Knife (Figura 2). La pieza de resección se muestra en la Figura 3.
Figura 1. «Bolsillo submucoso».
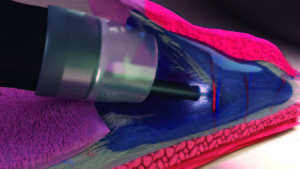
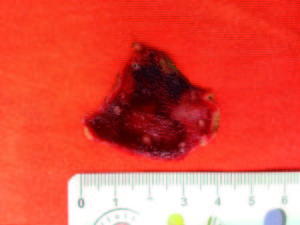
Figura 3. Producto de la exéresis experimental.
Resultados
Este trabajo fue realizado en el laboratorio de cirugía experimental de la Facultad de Medicina de la Universidad de San Pablo, Brasil. La técnica descrita fue desarrollada y perfeccionada en procedimientos seriados de DES en cerdos; la filmación del procedimiento fue realizada después de considerar que la técnica estaba en condiciones de reproducirse (Video). Este estudio se llevó a cabo cumpliendo las reglas establecidas por la Ley 11.794/08, de regulación de procedimientos para uso científico de animales en el Brasil.
Discusión
La TBS puede convertirse en la estrategia estándar para varios casos de DES gástrico. En el presente trabajo mostramos la experiencia en el Laboratorio de Cirugía Experimental Porcino de la Facultad de Medicina de la Universidad de San Pablo, Brasil, en la que tomamos los elementos básicos expuestos por Yamamoto y col, modificando el corte final de la mucosa, la cual incidimos desde el “bolsillo submucoso” hacia la cavidad gástrica, para luego realizar la exéresis circunferencial total de la pieza usando el I-T Knife.
Partiendo de nuestra experiencia descrita, podemos sugerir que esta TBS modificada facilita la realización de movimientos de corte final de la mucosa y exéresis de lesiones más grandes (Figura 3). Nuevos trabajos de investigación tanto en animales como en humanos se requieren para comparar esta técnica con las técnicas estándar de DES, evaluando los tiempos de procedimiento, los resultados en cuanto a resección, recidiva y complicaciones. La TBS es una técnica de disección que debería ser considerada entre las diferentes técnicas disponibles y quizás en un futuro podría establecerse como técnica estándar.
Sostén financiero. Este trabajo fue realizado en su totalidad con el apoyo del Servicio de Endoscopía Gastrointestinal del Hospital de Clinicas de la Faculda de Medicina de la Universidad de San Pablo, Brasil.
Referencias
- Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 2010; 127: 2893-2917.
- Correa P, Piazuelo MB, Wilson KT. Pathology of gastric intestinal metaplasia: clinical implications. Am J Gastroenterol 2010; 105: 493-498.
- Siegel R, Naishadham D, Jemal A. Cancer statistics for Hispanics/Latinos, 2012. Cancer J Clin 2012; 62: 283-298.
- Anderson WF, Camargo MC, Fraumeni JF Jr, Correa P, Rosenberg PS, Rabkin CS. Age-specific trends in incidence of noncardia gastric cancer in US adults. JAMA 2010; 303: 1723-1728.
- de Moura EG, Bustamante FA, Bernardo WM. Reviewing the reviewers: critical appraisal of «Effect of intragastric injection of botulinum toxin A for the treatment of obesity: a meta-analysis and meta-regression». Gastrointest Endosc 2016; 83: 478.
- Gotoda T. Endoscopic resection of early gastric cancer: the Japanese perspective. Curr Opin Gastroenterol 2006; 22: 561-569.
- Shimizu S, Tada M, Kawai K. Early gastric cancer: its surveillance and natural course. Endoscopy 1995; 27: 27-31.
- Noguchi Y, Yoshikawa T, Tsuburaya A, Motohashi H, Karpeh MS, Brennan MF. Is gastric carcinoma different between Japan and the United States? Cancer 2000; 89: 2237-2246.
- Kang HJ, Kim DH, Jeon TY, Lee SH, Shin N, Chae SH, Kim GH, Song GA, Kim DH, Srivastava A, Park DY, Lauwers GY. Lymph node metastasis from intestinal-type early gastric cancer: experience in a single institution and reassessment of the extended criteria for endoscopic submucosal dissection. Gastrointest Endosc 2010; 72: 508-515.
- Everett SM, Axon AT. Early gastric cancer in Europe. Gut 1997; 41: 142-150.
- Everett SM, Axon AT. Early gastric cancer: disease or pseudo-disease? Lancet 1998; 351: 1350-1352.
- Soetikno R, Kaltenbach T, Yeh R, Gotoda T. Endoscopic mucosal resection for early cancers of the upper gastrointestinal tract. J Clin Oncol 2005; 23: 4490-4498.
- Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma: 3rd English edition. Gastric Cancer 2011; 14: 101-112.
- Gotoda T, Yanagisawa A, Sasako M, Ono H, Nakanishi Y, Shimoda T, Kato Y. Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer 2000; 3: 219-225.
- Ahn JY, Jung HY, Choi KD, Choi JY, Kim MY, Lee JH, Choi KS, Kim DH, Song HJ, Lee GH, Kim JH, Park YS. Endoscopic and oncologic outcomes after endoscopic resection for early gastric cancer: 1370 cases of absolute and extended indications. Gastrointest Endosc 2011; 74: 485-493.
- Lee JH, Choi MG, Min BH, Noh JH, Sohn TS, Bae JM, Kim S. Predictive factors for lymph node metastasis in patients with poorly differentiated early gastric cancer. Br J Surg 2012; 99: 1688-1692.
- Nonaka S, Oda I, Nakaya T, Kusano C, Suzuki H, Yoshinaga S, Fukagawa T, Katai H, Gotoda T. Clinical impact of a strategy involving endoscopic submucosal dissection for early gastric cancer: determining the optimal pathway. Gastric Cancer 2011; 14: 56-62.
- Bok GH, Kim YJ, Jin SY, Chun CG, Lee TH, Kim HG, Jeon SR, Cho JY. Endoscopic submucosal dissection with sentinel node navigation surgery for early gastric cancer. Endoscopy 2012; 44: 953-956.
- Oda I, Suzuki H, Nonaka S, Yoshinaga S. Complications of gastric endoscopic submucosal dissection. Dig Endosc 2013; 25: 71-78.
- Chung IK, Lee JH, Lee SH, Kim SJ, Cho JY, Cho WY, Hwangbo Y, Keum BR, Park JJ, Chun HJ, Kim HJ, Kim JJ, Ji SR, Seol SY. Therapeutic outcomes in 1.000 cases of endoscopic submucosal dissection for early gastric neoplasms: Korean ESD Study Group multicenter study. Gastrointest Endosc 2009; 69: 1228- 1235.
- Kosaka T, Endo M, Toya Y, Abiko Y, Kudara N, Inomata M, Chiba T, Takikawa Y, Suzuki K, Sugai T. Long-term outcomes of endoscopic submucosal dissection for early gastric cancer: a single-center retrospective study. Dig Endosc 2014; 26: 183-191.
- Jung H, Bae JM, Choi MG, Noh JH, Sohn TS, Kim S. Surgical outcome after incomplete endoscopic submucosal dissection of gastric cancer. Br J Surg 2011; 98: 73-78.
- Sekiguchi M, Suzuki H, Oda I, Abe S, Nonaka S, Yoshinaga S, Taniguchi H, Sekine S, Kushima R, Saito Y. Risk of recurrent gastric cancer after endoscopic resection with a positive lateral margin. Endoscopy 2014; 46: 273-278.
- Percivale P, Bertoglio S, Muggianu M, Aste H, Secco GB, Martines H, Moresco L, Cafiero F. Long-term postoperative results in 54 cases of early gastric cancer: the choice of surgical procedure. Eur J Surg Oncol 1989; 15: 436-440.
- Schlemper RJ, Itabashi M, Kato Y, Lewin KJ, Riddell RH, Shimoda T, Sipponen P, Stolte M, Watanabe H, Takahashi H, Fujita R. Differences in diagnostic criteria for gastric carcinoma between Japanese and western pathologists. Lancet 1997; 349: 1725-1729.
- Abe S, Oda I, Suzuki H, Nonaka S, Yoshinaga S, Odagaki T, Taniguchi H, Kushima R, Saito Y. Short- and long-term outcomes of endoscopic submucosal dissection for undifferentiated early gastric cancer. Endoscopy 2013; 45: 703-707.
- Pimentel-Nunes P, Mourão F, Veloso N, Afonso LP, Jácome M, Moreira-Dias L, Dinis-Ribeiro M..Long-term follow-up after endoscopic resection of gastric superficial neoplastic lesions in Portugal. Endoscopy 2014; 46: 933-940.
- Sekiguchi M, Suzuki H, Oda I, Abe S, Nonaka S, Yoshinaga S, Taniguchi H, Sekine S, Kushima R, Sait Y. Favorable long-term outcomes of endoscopic submucosal dissection for locally recurrent early gastric cancer after endoscopic resection. Endoscopy 2013; 45: 708-713.
- Oka S, Tanaka S, Kaneko I, Mouri R, Hirata M, Kanao H, Kawamura T, Yoshida S, Yoshihara M, Chayama K. Endoscopic submucosal dissection for residual/local recurrence of early gastric cancer after endoscopic mucosal resection. Endoscopy 2006; 38: 996-1000.
- Miura Y, Hayashi Y, Lefor AK, Osawa H, Yamamoto H. The pocket-creation method of ESD for gastric neoplasms. Gastrointestinal Endoscopy 2016; 83: 457-458.
Correspondencia: Fabio Alberto Castillo Bustamante
Av. Dr. Enéas de Carvalho Aguiar, 255 – Bloco 3, São Paulo-SP, Brasil.
Telefono-fax: 55 (11) 3069-7579
Correo electrónico: facastillobu@gmail.com
Acta Gastroenterol Latinoam 2017;47(2): 106-109
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE