Mariana Omodeo, Lisandro Pereyra, Estanislao J Gómez, Pablo Luna, Raquel González, Carolina Fischer, José M Mella, Guillermo N Panigadi, Daniel G Cimmino, Silvia C Pedreira, Luis A Boerr
Servicio de Gastroenterología y Endoscopía Digestiva, Hospital Alemán. Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2018;48(2):124-130
Recibido: 19/07/2017 / Aprobado: 23/01/2018 / Publicado en www.actagastro.org el 18/06/2018
Resumen
Objetivo. Determinar en pacientes con esófago de Barrett (EB) durante la vigilancia endoscópica la tasa de progresión a displasia de alto grado (DAG) y adenocarcinoma de esófago (ACE) e identificar los factores de riesgo de progresión. Material y métodos. Estudio observacional de cohorte longitudinal. Se incluyeron pacientes con EB con seguimiento endoscópico mayor a 1 año, en un período mayor de 10 años. Se utilizó el test de Chi cuadrado para comparar las variables categóricas y la regresión de Cox para estimar el riesgo de progresión. Resultados. Se incluyeron 210 pacientes con un seguimiento medio de 51 meses. Cinco pacientes (2,5%) desarrollaron DAG (4/5) o ACE (1/5) durante el seguimiento (tiempo medio de progresión: 56 meses) con tasa anual de progresión: 0,56% y tasa de incidencia de progresión por paciente-año de seguimiento: 0,508. De los 42 pacientes con DBG, 5 progresaron a DAG (12%) y ninguno a ACE (tiempo medio: 40 meses). La tasa anual de progresión fue de 3,4% y la de incidencia de progresión por paciente-año de seguimiento fue de 3,57. Los factores de riesgo de progresión fueron la edad > a 65 al diagnóstico de EB, EB largo (> 3 cm), nodularidad e historia familiar de EB. En DBG el riesgo de progresión fue mayor en DBG persistente y edad avanzada (> 65). Conclusión. Los pacientes añosos al diagnóstico, con historia familiar de EB, segmento largo o nodularidad, presentan mayor riesgo, mientras que en los pacientes con DBG, la persistencia de la DBG y la edad avanzada al diagnóstico presentan mayor riesgo. Estos pacientes se beneficiarían con un plan más estricto de vigilancia.
Palabras claves. Esófago de Barrett, displasia de bajo grado, displasia de alto grado, adenocarcinoma de esófago.
Predictors of progression to High Grade Dysplasia and Esophagus Adenocarcinoma during Barrett’s Esophagus endoscopic surveillance
Summary
Aim. To determine the rate of progression to high grade dysplasia (HGD) and esophagus adenocarcinoma (EAC) and to identify risk factors for progression; in patients with Barrett esophagus (BE), during endoscopic surveillance. Material and methods. An observational longitudinal cohort study was performed. Patients with BE in a ten-year period, who were endoscopically followed for at least 1 year were included. Chi Square test was used to compare categorical variables. Cox regression analysis was performed to determine predictors of progression to DAG or ACE. Results. 210 patients were included. Median follow-up: 51 months with a median of 4.2 (2-14) endoscopies per patient. Five patients (2.5%) developed HGD (4/5) or EAC (1/5) during follow-up. The annual rate of progression was 0.56%. The rate of disease progression per patient-year of follow-up was 0.508. The mean time of progression was 56 months (SD+/- 50). From 42 patients with low grade dysplasia (LGD), 5 progressed to HGD (12%) and none to EAC. The annual rate of progression was 3.4% and the rate of disease progression per patient-year of follow-up was 3.57. Mean time to progression: 40 months. Age > 65 years at BE diagnosis, long segment (> 3 cm), nodularity and family history of BE were independently associated with an increased risk of developing HGD or EAC during surveillance. In patients with LGD, the risk of progression was higher in patients with persistent LGD and in > 65 years. Conclusion. Patients with older age at diagnosis, long segment, nodularity and family history of BE have an increased risk for progression to HGD and EAC, and in patients with LGD with persistent LGD have increased risk of progression and therefore should be considered for more intensive surveillance.
Key words. Barrett’s esophagus, low-grade dysplasia, high grade dysplasia, esophagus adenocarcinoma.
El esófago de Barrett (EB) se define como la condición en la que cualquier extensión de metaplasia columnar que predisponga a cáncer reemplace el epitelio escamoso estratificado del esófago. Afecta al 2% de la población mundial.1
Es una lesión premaligna, de hecho, es el único precursor conocido del adenocarcinoma esofágico (ACE) y su importancia radica en que aumenta unas 40 veces el riesgo de ACE.1, 2 La incidencia de ACE continúa en aumento en el mundo occidental, siendo la tasa de supervivencia muy sombría cuando se realiza el diagnóstico en etapas tardías.3 Por este motivo las estrategias actuales para mejorar la supervivencia en pacientes con ACE se centran en la detección del cáncer en una etapa temprana y potencialmente curable.
El desarrollo de ACE en pacientes con EB es un proceso gradual de progresión desde la displasia de bajo grado (DBG) a la displasia de alto grado (DAG), y eventualmente al ACE. Sin embargo, la mayoría de las pacientes con EB no desarrollarán displasia o ACE durante su vida. La gran mayoría de los pacientes con EB fallecerán de causas no relacionadas con el ACE, siendo la causa más frecuente de muerte la secundaria a enfermedades cardiovasculares.4
La estimación de este riesgo de progresión a ACE es altamente heterogénea según los datos aportados por diferentes trabajos epidemiológicos, y varían en las diferentes series.1 En Argentina no se publicaron datos con estimaciones locales de progresión.
La presencia y el grado de displasia es un marcador imperfecto del riesgo de progresión a cáncer, pero es el mejor que tenemos.5 El grado de displasia sigue siendo el marcador más utilizado para evaluar el riesgo de ACE en EB.
Si bien la tasa de progresión reportada a ACE es baja, sabemos también el mal pronóstico que conlleva esta enfermedad, con una tasa de supervivencia a 5 años de menos del 15%.6 Por lo tanto, la vigilancia endoscópica es vital para pacientes con EB, con el fin de detectar neoplasia en fase inicial y posteriormente mejorar la supervivencia.7
En la literatura hay trabajos que demostraron que los pacientes en los que se detectó ACE dentro de un programa de vigilancia han presentado tanto la enfermedad en estadio más temprano como una mejor supervivencia que aquellos pacientes con ACE detectado fuera de un programa de vigilancia.8, 9 Sin embargo, hay poca evidencia de que los programas de vigilancia masivos hayan evitado las muertes por ACE.10 Esto pone en duda la costo-efectividad de una estrategia de vigilancia masiva. Por lo tanto, identificar los factores de riesgo y conocer la tasa de progresión del EB a DAG y ACE y evaluar la tasa de progresión de aquellos que ya presentan DBG es importante para poder realizar una estrategia de vigilancia más racional, estratificando a los pacientes según su riesgo individual.
Material y métodos
Diseño y pacientes
Se realizó un estudio observacional de cohorte longitudinal, que incluyó a todos aquellos pacientes con diagnóstico de EB realizado en el Hospital Alemán de Buenos Aires, durante un período mayor a 10 años, comprendido entre el 1º de enero de 2004 y el 31 de octubre de 2014. La información acerca del diagnóstico de EB fue obtenida a través de las bases electrónicas de los servicios de endoscopía digestiva y anatomía patológica. Las características demográficas y clínicas (edad, sexo, síntomas de enfermedad por reflujo, historia personal o familiar de EB o ACE, índice de masa corporal y estatus tabáquico) fueron recolectadas de la historia clínica electrónica y mediante el contacto telefónico. Fueron incluidos los pacientes con seguimiento endoscópico mayor a un año, y aquellos con DBG solo se incluyeron en el análisis si tenían al menos dos endoscopías de seguimiento. Se excluyó a los pacientes que presentaban EB con DAG o ACE al diagnóstico.
Endoscopía
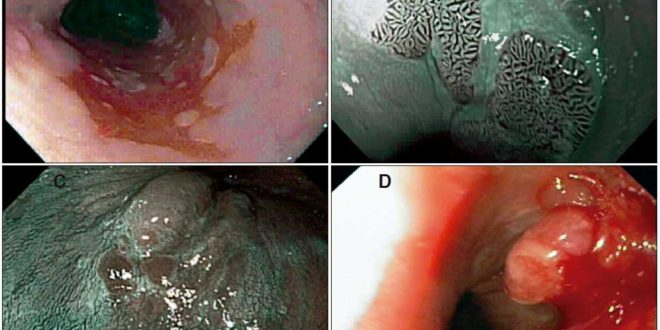
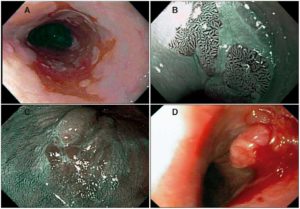
El diagnóstico de EB fue sospechado durante la evaluación endoscópica cuando se observaron islotes, lengüetas, o extensión circular de epitelio rojizo o “asalmonado” (sospecha de epitelio columnar) por encima de la unión esófago-gástrica (E-G). En pacientes con hernia hiatal, la unión E-G fue identificada por el margen proximal de los pliegues gástricos. La extensión del EB fue medida desde la unión E-G hasta la extensión más proximal de epitelio columnar, considerando una longitud de 3 cm o mayor como EB largo, y una longitud menor a 3 cm como EB corto. Para la evaluación del epitelio columnar, los endoscopistas utilizaron a discreción algunas de las herramientas que han demostrado ser de utilidad en este escenario (capuchones para lograr una distancia focal óptima, tinción con ácido acético y/o Narrow Band Imaging – NBI a partir del año 2010). La presencia de nodularidad u otra lesión endoscópicamente visible sobre el epitelio columnar fue registrada en el informe endoscópico, tomándose biopsias en forma dirigida (Figura 1). En el resto de los casos, aunque no se realizó un protocolo específico, se tomaron biopsias seriadas al azar, una en cada cuadrante, cada 1 o 2 cm de epitelio columnar. Los intervalos de seguimiento clínico y endoscópico se basaron en los criterios personales de los médicos tratantes.
Figura 1. Evaluación endoscópica durante la vigilancia de pacientes con EB. A. Esófago de Barrett de segmento largo (mayor a 3 cm), cuya biopsia arrojó DBG. B. Lengüetas de epitelio columnar evaluadas con NBI y asistencia con CAP. C. Área de epitelio columnar con presencia de nódulos. D. Adenocarcinoma sobre epitelio columnar de EB.
Análisis histopatológico
Todos los fragmentos de biopsias fueron fijados y teñidos con hematoxilina-eosina para ser evaluados por el médico patólogo experto en aparato digestivo. El EB fue definido por la presencia de epitelio columnar especializado (tipo intestinal) en el esófago distal. La DBG fue definida por la presencia de atipia nuclear que involucra a la mucosa superficial, criptas con estratificación de núcleos en la base y preservada arquitectura. La DAG fue definida por la presencia de marcada atipia nuclear, distorsión de la arquitectura de criptas, y estratificación nuclear que se extiende hasta la superficie. En todos los casos en que se diagnosticó displasia, un segundo médico patólogo evaluó y confirmó el diagnóstico. El ACE fue diagnosticado cuando se observó que los cambios displásicos atraviesan la membrana basal de las glándulas.
Desenlaces
El desenlace primario fue la progresión neoplásica a DAG y ACE (desenlace compuesto) en pacientes con EB. El desenlace secundario fue la progresión neoplásica a DAG y ACE (desenlace compuesto) en la subpoblación de pacientes con EB y DBG.
Análisis estadístico
Las variables categóricas que describen la población del estudio se expresan como números absolutos y porcentajes, mientras que las variables continuas se muestran como medias (con desviaciones estándar [DE]). La tasa de progresión a DAG/ACE fue determinada por el número total de pacientes que progresaron a DAG o ACE sobre el total de pacientes con EB (con y sin displasia). Además, se calculó la tasa de incidencia de progresión de la enfermedad por paciente-año de seguimiento, dividiendo el total de nuevos casos con DAG o ACE sobre el total de pacientes EB-año de seguimiento. Se realizaron curvas de sobrevida de Kaplan-Meier comparando a los pacientes con y sin DBG persistente durante el seguimiento, utilizando log-rank test para realizar el análisis comparativo.
Para evaluar la relación entre variables categóricas se utilizó el test de Chi cuadrado. Con el objetivo de determinar predictores independientes de progresión a DAG/ ACE se realizó regresión proporcional de Cox. El riesgo fue expresado en hazard ratio (HR) con sus correspondientes intervalos de confianza de 95% (IC 95%). Valores de p < 0.05 se consideraron estadísticamente significativos. Para realizar el análisis estadístico se utilizó SPSS para Windows Inc. Versión 22. Chicago, Illinois.
Resultados
De un total de 532 pacientes con EB entre enero de 2004 y octubre de 2014, se incluyeron 210 pacientes (Tabla 1). En todos los pacientes el diagnóstico fue confirmado por dos patólogos. La mediana de edad de los pacientes fue de 58 años (rango: 32-93), la mayoría hombres (79%). El 97% eran pacientes occidentales y un 6% (12 pacientes) presentaban historia familiar de EB o ACE. El 80% de los pacientes refirieron haber presentado síntomas de reflujo frecuente.
Un 19% de los pacientes tenían un BMI > 30, es decir que eran pacientes obesos, y el 33% eran tabaquistas o ex tabaquistas.
En cuanto a los hallazgos endoscópicos, el 70% de los pacientes (150) tenían hernia hiatal y el 28% segmento largo EB (> 3 cm).
La mediana de seguimiento fue de 51 meses (rango: 12-136) con un promedio de 4,2 (2-14) endoscopías por paciente (Tabla 2). Cinco pacientes (2,5%) desarrollaron DAG o ACE durante el seguimiento endoscópico, 2% (4/5) DAG y 0,5% (1/5) ACE. La tasa anual de progresión fue de 0,56 %/año. El tiempo medio de progresión fue: mediana 56 meses (rango: 14-116). La tasa de incidencia de progresión de la enfermedad por paciente-año de seguimiento fue de 0,508.
Con respecto a la DBG, del total de 210 pacientes con EB, 42 (20%) presentaron DBG y cumplieron los criterios de inclusión (Tabla 1). La edad mediana fue de 61 años (rango: 37-93) y 69% fueron hombres. El tiempo de seguimiento fue de 42 meses (rango: 12-119). Cinco pacientes progresaron a DAG (5/42; 12%) y ninguno a ACE (0%). La tasa anual de progresión fue de 3,4%/año. El tiempo de progresión tuvo una mediana de 40 meses (Tabla 2). La tasa de incidencia de progresión de la enfermedad por paciente-año de seguimiento fue de 3,57.
Al realizar el análisis uni y multivariado de regresión Cox se observó que las variables independientes que se asociaron a progresión a DAG o ACE durante la vigilancia endoscópica fueron (Tabla 3): edad > a 65 años al momento del diagnóstico de EB (HR: 9,7; IC 95%: 1,01-234; p = 0,014), EB largo (> 3 cm ) (HR: 10,9; IC 95%: 1,11-262; p = 0,009), presencia de nodularidad (HR: 12.6; IC 95%: 1,03-187; p = 0,009) e historia familiar de EB (HR: 10; IC 95%: 1,02-137; p = 0,02).
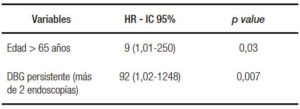
En los pacientes con DBG, el riesgo de progresión a DAG o ACE fue mayor en pacientes con DBG persistente (5/18 pacientes, 28% vs. 0/24, 0%; HR 92; IC 95%: 1,02-1248; p = 0,007) (Figura 2) y en aquellos de edad avanzada (> 65 años) (4/15 pacientes, 27% vs. 1/27 4%; HR 9; IC 95%: 1,01-250; p = 0,03) (Tabla 4).
Tabla 1. Características de los pacientes con EB (n = 210) y del subgrupo con DBG (n = 42).
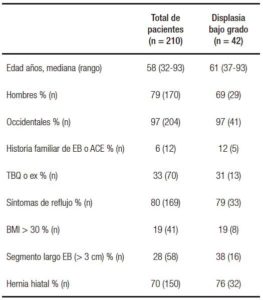
Tabla 2. Total de pacientes con EB y subgrupo con DBG.
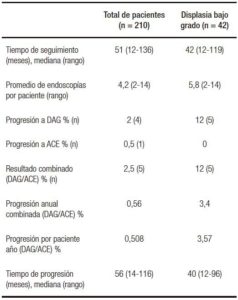
Tabla 3. Factores de riesgo de progresión a DAG o ACE en los pacientes con EB (n = 210).
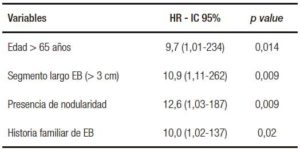
Figura 2. Curva de sobrevida libre de ACE/DAG en el seguimiento endoscópico hasta 42 meses, en aquellos pacientes con DBG única o persistente (n = 42). Aquellos pacientes con DBG persistente (en más de 1 endoscopía) tuvieron mayor riesgo de progresión que aquellos con una única biopsia con DBG (p = 0,007).
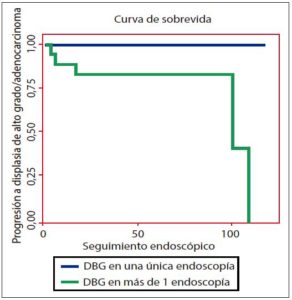
Tabla 4. Factores de riesgo de progresión a DAG o ACE en los pacientes con EB con DBG (n = 42).
Discusión
El aumento de la incidencia de ACE en los últimos años es alarmante, con una predicción de duplicación de las tasas de mortalidad para el año 2030.2 El EB es el único factor de riesgo identificado para su desarrollo, sin embargo, la inmensa mayoría de los pacientes con EB nunca desarrollará este cáncer. Esto lleva a una imperiosa necesidad de identificar cuales pacientes progresarán.
En el presente estudio la tasa de progresión de EB global a DAG y ACE fue baja y similar a la reportada en la literatura. La progresión a DAG fue del 2% y 0,5% a ACE y la tasa de progresión anual fue del 0,56%/año.
Cuando uno evalúa la bibliografía, la estimación de este riesgo de progresión a ACE es altamente heterogénea según los datos aportados por diferentes trabajos epidemiológicos, especialmente en lo que a DBG respecta,1 oscilando entre el 0,4-13,4%/año.14 Nuestra tasa de progresión en los pacientes con DBG a DAG o ACE fue del 12% en 40 meses, es decir 3,4%/año.
Sabemos que existe una considerable variabilidad entre patólogos en la interpretación de displasia en la comunidad y el ámbito académico. A su vez, es considerablemente más dificultosa la interpretación de DBG y es la probable causa de esta gran oscilación en la progresión en los diferentes trabajos.15, 16 En dos estudios recientes de los Países Bajos, dos patólogos gastrointestinales encontraron que de 147 pacientes con diagnóstico de DBG en la comunidad, el 85 % de los pacientes se rebajó a un diagnóstico de no displasia.17
Por lo que un dato de suma importancia en este estudio es que en aquellos pacientes con DBG, la persistencia de esta en al menos 2 endoscopías sucesivas es un factor de riesgo de progresión. La hipótesis podría ser que en esos pacientes en donde persiste la DBG en las subsecuentes endoscopias sean los verdaderos positivos con DBG mientras que en los otros podría estar en juego esa variabilidad interobservador y no ser verdaderas displasias.
Como se mencionó anteriormente, mundialmente el manejo de DBG permanece en controversia,18, 19 ya que se observa una gran heterogeneidad en este grupo, no quedando claro cuál de ellos progresará y cuál retrogradará, cuál debemos vigilar y cuáles erradicar endoscópicamente. Poder estratificar a estos pacientes con mayor riesgo de progresión, permite realizarles tratamiento o vigilancia más intensiva y no al resto de los pacientes con DBG, racionalizar de esta manera los recursos y no someter innecesariamente a vigilancias estrictas o tratamientos a aquellos pacientes que no lo requieren.
En el presente trabajo encontramos también que los factores de riesgo de progresión en EB son similares a lo reportado previamente, como la edad > a 65 años al momento del diagnóstico de EB, el EB largo (> 3 cm), la presencia de nodularidad y la historia familiar de EB. En nuestra población no pudimos relacionar la obesidad y el tabaquismo como factores de riesgo de progresión, como sí están descriptos en la bibliografía.11-13
Nosotros obtuvimos que la progresión de DBG a ACE es de 0%. Nuestra hipótesis es que probablemente la progresión de DBG a ACE sea muy baja, pero no 0%, y el resultado que nosotros obtuvimos podría deberse al número de pacientes incluidos en el trabajo. Esto seguramente cambiaría si aumentáramos el número de pacientes.
Como limitaciones de este estudio, podemos mencionar que es un estudio unicéntrico y que tuvimos poca cantidad de eventos para el desenlace secundario como fue la progresión de DBG a ACE.
En conclusión, la tasa de progresión de EB a DAG o ACE es baja. Aquellos pacientes añosos al diagnóstico, con historia familiar de EB, y con segmento largo o nodularidad presentan mayor riesgo de progresión a DAG y ACE. En el caso de la DBG, la edad avanzada y sobre todo la DBG persistente identifican a aquellos pacientes que presentan un riesgo incrementado para desarrollar DAG o ACE. Estos hallazgos podrían sugerir la reducción de los intervalos de vigilancia en este subgrupo de pacientes.
References
- Shaheen NJ, Crosby MA, Bozymsky EM, Sandlr RS. Is there publication bias in the reporting of cancer risk in Barrett’s esophagus? Gastroenterology 2000; 119: 333-338.
- Kong CY, Kroep S, Curtius K, Hazelton WD, Jeon J, Meza R, Heberle CR, Miller MC, Choi SE, Lansdorp-Vogelaar I, van Ballegooijen M, Feuer EJ, Inadomi JM, Hur C, Luebeck EG. Exploring the recent trend in esophageal adenocarcinoma incidence and mortality using comparative simulation modeling. Cancer Epidemiol Biomarkers Prev 2014; 23: 997-1006.
- Hur C, Miller M, Kong CY, Dowling EC, Nattinger KJ, Dunn M, Feuer EJ. Trends in esophageal adenocarcinoma incidence and mortality. Cancer 2013; 119: 1149-1158.
- Sikkema M, de Jonge PJ, Steyerberg EW, Kuipers EJ. Risk of esophageal adenocarcinoma and mortality in patients with Barrett’s esophagus: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2010; 8: 235-244.
- Shaheen NJ, Falk GW, Iyer PG, Gerson LB. ACG Clinical Guideline: Diagnosis and Management of Barrett’s Esophagus. Am J Gastroenterol 2016; 111: 30-50.
- Lund O, Kimose HH, Aagaard MT, Hasenkam JM, Erlandsen M. Risk stratification and long-term results after surgical treatment of carcinomas of the thoracic esophagus and cardia. A 25-year retro-spective study. J Thorac Cardiovasc Surg 1990; 99: 200-209.
- Wang KK, Sampliner RE. Updated guidelines 2008 for the diagnosis, surveillance and therapy of Barrett’s esophagus. Am J Gastroenterol 2008; 103: 788-797.
- Corley DA, Levin TR, Habel LA, Weiss NS, Buffler PA. Surveillance and survival in Barrett’s adenocarcinomas: a population-based study. Gastroenterology 2002; 122: 633-640.
- Incarbone R, Bonavina L, Saino G, Bona D, Peracchia A. Outcome of esophageal adenocarcinoma detected during endoscopic biopsy surveillance for Barrett’s esophagus. Surg Endosc 2002; 16: 263-266.
- Dulai GS, Guha S, Kahn KL, Gornbein J, Weinstein WM. Preoperative prevalence of Barrett’s esophagus in esophageal adenocarcinoma: a systematic review. Gastroenterology 2002; 122: 26-33.
- Anderson LA, Cantwell MM, Watson RGP, Johnston BT, Murphy SJ, Ferguson HR, McGuigan J, Comber H, Reynolds JV, Murray LJ. The association between alcohol and reflux esophagitis, Bar-rett’s esophagus, and esophageal adenocarcinoma. Gastroenterology 2009; 136: 799-805.
- Kubo A, Levin TR, Block G, Rumore G, Quesenberry CP, Patricia Buffler Jr, Corley DC. Alcohol types and sociodemographic characteristics as risk factors for Barrett’s esophagus. Gastroenterology 2009; 136: 806-815.
- Hampel H, Abraham NS, El-Serag HB. Meta-analysis: obesity and the risk for gastroesophageal reflux disease and its complications. Ann Intern Med 2005; 143: 199-211.
- Singh S, Manickam P, Amin AV, Samala N, Schouten LJ, Iyer PG, Desai TK. Incidence of esophageal adenocarcinoma in Barrett’s esophagus with low-grade dysplasia: a systematic review and meta-analysis. Gastrointest Endosc 2014; 79: 897-909.
- Kerkhof M, van Dekken H, Steyerberg EW, Meijer GA, Mulder AH, De Bruïne A, Driessen A, Ten Kate FJ, Kusters JG, Kuipers EJ, Siersema PD for the CYBAR study group. Grading of dys-plasia in Barrett’s oesophagus: substantial interobserver variation between general and gastrointestinal pathologists. Histopathology 2007; 50: 920-927.
- Montgomery E, Bronner MP, Goldblum JR, Curvers WL, Ten Kate FJ, Krishnadath KK. Low-grade dysplasia in Barrett’s esophagus: overdiagnosed and underestimated. Am J Gastroenterol 2010; 105: 1523-1530.
- Curvers WL, ten Kate FJ, Krishnadath KK, Visser M, Elzer B, Baak LC, Bohmer C, Mallant-Hent RC, van Oijen A, Naber AH, Scholten P, Busch OR, Blaauwgeers HG, Meijer GA, Bergman JJ. Low-grade dysplasia in Barrett’s esophagus: overdiagnosed and underestimated. Am J Gastroenterol 2010;105:1523–1530.
- Spechler SJ, Sharma P, Souza RF, Inadomi JM, Shaheen NJ. American Gastroenterological Association medical position statement on the management of Barrett’s esophagus. Gastroenterol-ogy 2011; 140: 1084-1091.
- Fitzgerald RC, di Pietro M, Ragunath K, Ang Y, Kang JY, Watson P, Trudgill N, Patel P, Kaye PV, Sanders S, O’Donovan M, Bird- Lieberman E, Bhandari P, Jankowski JA, Attwood S, Parsons SL, Loft D, Lagergren J, Moayyedi P, Lyratzopoulos G, de Caestecker J. British Society of Gastroenterology. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett’s oesophagus. Gut 2014; 63: 7-42.
Correspondencia: Mariana Omodeo
Pueyrredón 1640. Ciudad Autónoma de Buenos Aires, Argentina
Tel: 5493814149709
Correo electrónico: mariana_omodeo@hotmail.com
Acta Gastroenterol Latinoam 2018;48(2): 124-130
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE