Solución del caso
Se decide conducta quirúrgica con diagnóstico de tumor submucoso gástrico. En enero del 2017 se realiza la gastrectomía vertical tubular laparoscópica. En el intraoperatorio se constata un tumor sólido en el fondo gástrico, subcardial, cara posterior, cercana al ángulo de Hiss.
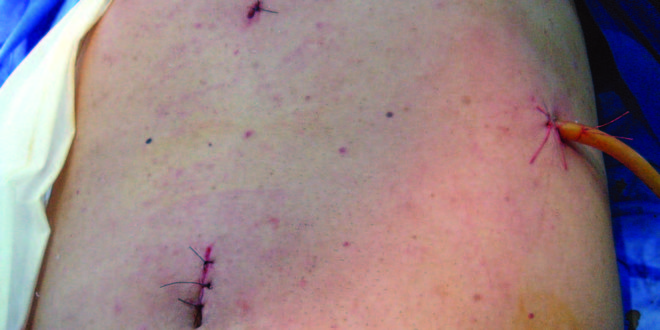
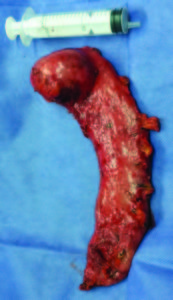
Figura 3. Vista posoperatoria del tumor y el margen quirúrgico.
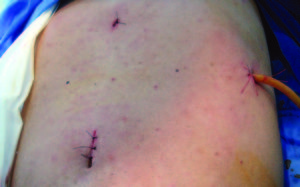
La paciente presenta buena evolución posoperatoria. Se otorga el egreso sanatorial al 2º día de la cirugía, imagen de ports en posquirúrgico inmediato (Figura 4).
Se recibe la anatomía patológica (Figuras 5 y 6), que informa una lesión nodular de 4,5 x 4 x 3,5 cm, duro elástica y con márgenes libres de resección. Ganglios del tronco coronario con hiperplasia nodular focal. Vimentina y S 100 positivo. AML, DOG 1, CD 34 negativos. Ki 67 positivo 2%. Compatible con Schwanoma gástrico o GANts tumor neuroautonómico gastrointestinal.
Figura 4. Imagen de los puertos de ingresos laparoscópicos.
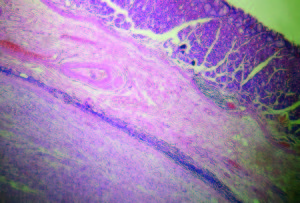
Figura 5. Microscopía del tumor. Schwannomas gástrico. Imagen de tinción H&E mucosa (arriba), los linfocitos en corona y tumor (abajo) magnificación por 4 aumentos.
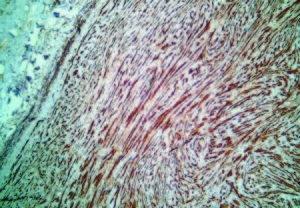
Figura 6. Microscopía del tumor. Imagen histopatológica del tumor que muestra células fusiformes.
Discusión
La primera descripción de un tumor mesequimático la realizó Morgagni en 1762. En 1984, Schaldenbrand usó el término estromal tipo miogénico o neurogénico, GISTs y GANTs respectivamente.1
Los schwannomas gástricos representan menos del 0,2% de todos los tumores del estómago; es una patología sumamente infrecuente y constituye el 4% de todos los tumores benignos.
Son generalmente benignos y pueden aparecer en extremidades, cabeza y cuello; son muy raros en el tubo digestivo y el sitio más prevalente es el estómago. Ocurre primero en la submucosa gástrica, en segundo lugar, en el colon, y menos frecuentemente en el intestino delgado y el esófago. La peculiar morfología y localización de los schwanomas gástricos se plantea con los GIST y otros tumores mesenquimáticos típicos. La lesión estaba compuesta principalmente de nidos y cordones de células fusiformes y de células epitelioides raras, con un patrón de crecimiento fasciculado y esteliforme; el citoplasma es eosinofílico y los núcleos son oscuros y ocasionalmente polimórficos.2, 3
Aparece entre los 40 y 60 años, no hay diferencia de sexos, aunque hay un ligero predominio masculino, lo que difiere de nuestra paciente. Su frecuencia aumenta en pacientes con neurofibromatosis. Macroscópicamente son tumores que pueden comprometer todas las capas del intestino, pueden crecer hacia la luz, protruir hacia la mucosa y ulcerarla, o bien crecer hacia la serosa. Se confirma por inmunohistoquímica, el S100 es positivo en el 100% de los casos y vimentina positivo, el CD 117, CD 34, SMA y desmina son negativos.4, 5
Diagnóstico diferencial con los adenocarcinomas, linfomas, GISTs, leiomiomas, leiomiosarcomas, tumor miofibroblásticos inflamatorios (TMI), etc.6
Se ha descripto recientemente la asociación con Helicobacter Pylori (Hp) y schwannomas gástricos. Tuvimos el diagnóstico luego de haber recibido el resultado de la VEDA, realizándose tratamiento con bloqueantes H2 y antibioticoterapia.7
La mayoría son diagnosticados a raíz de un hallazgo endoscópico. Cuando desarrollan síntomas, la hemorragia digestiva es el más frecuente, y fue el motivo de consulta de nuestra paciente.
La seriada gastroduodenal muestra defecto de relleno e imágenes lacunares. La endoscopía muestra la protrusión del tumor submucoso. La ecoendoscopía nos ayuda para demostrar su relación con la pared muscular y determinar presencia de adenopatías regionales. La tomografía computada (TC) con doble contraste o la hidrotomografía ponen de manifesto lesiones de hasta 2 centímetros, siendo uno de los mejores métodos auxiliares para el diagnóstico, y que permite estadificar y planear la cirugía.4-6
En 1991 se describe la resección gástrica laparoscópica. Las resecciones laparoscópicas se han convertido en la mejor vía de abordaje para los tumores submucosos gástricos.
Para realizar el diagnóstico se cuenta con la clínica, parámetros de laboratorio e imágenes. La VEDA es la mejor herramienta para el diagnóstico. La punción con aguja fina e histología debe reservarse solo para pacientes que no son pasibles de cirugía por su mal estado general, o cuando hay fuerte sospecha de patología no quirúrgica (ejemplo: linfoma) puede realizarse por endoscopia, ecoendoscopía o TC.5, 6
El schwannoma gástrico es una infrecuente patología, que en nuestro caso se presentó con HDA, asociado a la presencia de Hp y en una paciente del sexo femenino. La resección laparoscópica es factible y segura para este tipo de tumores.
Referencias
- Ruiz H, Palermo M, Moreno L, Zorraquín C, Bruno M, Obredor C, Tarsitano F, Albertengo JC. Tumores estromales del tubo digestivo. Rev Argent Cirug 2006; 91: 147-153.
- Aminder S, AnKur M, Garg B, Sood N. Schwannoma of the stomach: a case report: Journal of Medical Case Reports 2016; 10: 4.
- Sreevathsa M, Pipara G. Gastric Schwannoma: A case report and review of literature. Indian J Surg Oncolog 2015; 6: 123-126.
- Tatangelo F, Cantile M, Collina F, Belli A, de Franciscis S, Bianco F, Botti G. Gastric schwannoma misdiagnosed as GIST: A case report wiht immunohistochemical and molecular study. Oncology Letter 2016; 11: 2501-2516.
- Álvarez JF, Ben-David K. Gastric schwannoma: a rare find. J Gastrointest Surg 2013; 17: 2179-2181.
- Ruiz HD, Ritondale O, Álvarez F, Musso J, Duzza G, Tarsitano F. Tumor fantasma de epigastrio. Acta Gastroenterol Latinam 2010; 40: 312.
- Lavy DS, Paulin ET, Parker MI, Zhang B, Parker GS, Schwartz MR. H. Pylori in a gastric schwannoma: a case report. Ann Transl Med 2016; 4: 137.
Acta Gastroenterol Latinoam 2018;48(3): 254-255
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE