María Josefina Sobrero
Hospital Italiano de Buenos Aires.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2020;50:88-91
Introducción
Las enfermedades inflamatorias intestinales (EII) se caracterizan por la presencia de actividad inflamatoria crónica en el tracto gastrointestinal, con un curso remitente – recidivante. El aumento de incidencia y prevalencia de las EII en países de Latinoamérica ha sido evidente en los últimos años. Los dos fenotipos principales corresponden a la Enfermedad de Crohn (EC) y colitis ulcerosa (CU). En un pequeño porcentaje de casos la distinción entre CU, EC y otras causas de colitis no puede ser establecida luego de múltiples exámenes y se agrupan dentro de las colitis no clasificadas (IBDU). El término colitis indeterminada se reserva para la descripción de especímenes de colectomía con patrones superpuestos compatibles con CU y EC.
Diagnóstico de EII
Al momento no existe una técnica diagnóstica única que sea considerada “gold standard” y la confirmación de la enfermedad se alcanza a través de la combinación de hallazgos clínicos, bioquímicos, endoscópicos, histológicos y de diagnóstico por imágenes. La identificación de mutaciones o genes relacionados, o la detección de anticuerpos no forman parte en la actualidad de las evaluaciones diagnósticas de primera línea.
Endoscopía en el diagnóstico de EII
Frente a la sospecha de EII con presencia de marcadores de actividad inflamatoria elevados, la ileocolonoscopia con toma de biopsias se constituye como una estrategia diagnóstica de primera línea. Este procedimiento índice permite establecer extensión y actividad inflamatoria al momento del diagnóstico, pero también aporta datos que pueden resultar indispensables en la consideración de los múltiples diagnósticos diferenciales. Sin embargo, la colonoscopía inicial, idealmente realizada previo al inicio del tratamiento, debe cumplir determinados requisitos para alcanzar su máxima utilidad:
• Colonoscopía con intubación ileal
• Descripción completa y exhaustiva de los hallazgos endoscópicos
• Toma de muestras para estudio histopatológico de sectores sanos y afectados (al menos 2 biopsias de 5 segmentos: íleon, colon ascendente, colon transverso, colon descendente y recto).
Hallazgos endoscópicos
A pesar de su gran utilidad y de ser la única herramienta diagnóstica que permite la toma de biopsias, una de las grandes dificultades de los hallazgos endoscópicos radica en que éstos pueden ser altamente sugestivos pero ninguno de ellos es específico.
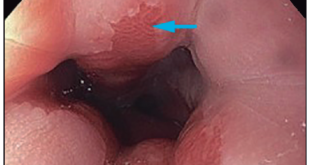
La Colitis Ulcerosa (CU) suele mostrar un patrón endoscópico consistente en un compromiso ascendente, continuo y simétrico, de inicio en recto con un límite neto con mucosa sana. Según el grado de actividad mucosa puede visualizarse desde pérdida del patrón vascular, granularidad fina, friabilidad, erosiones superficiales hasta úlceras profundas en sacabocado o sangrado difuso y al roce.
En el caso de la Enfermedad de Crohn (EC), uno de los hallazgo más característicos radica en el compromiso segmentario y asimétrico. También puede observarse recto preservado, presencia de úlceras heterogéneas (aftoides, profundas, serpiginosas), aspecto en empedrado, afección del íleon terminal, identificación de orificios fistulosos o la presencia de enfermedad anal o perianal al momento del procedimiento.
Existen algunas situaciones complejas donde los hallazgos endoscópicos pueden resultar dudosos:
Preservación de recto en CU: la ausencia de compromiso rectal macro y microscópico puede verse en pacientes pediátricos sin tratamiento. En adultos esta situación es más habitual en forma secundaria a la administración de tratamiento tópico.
Parche cecal: la presencia de un islote inflamatorio a nivel cecal en pacientes con colitis izquierda. Su evolución a largo plazo sería similar a la de los pacientes con colitis izquierda típica. Sin embargo, al igual que ante la presencia de mucosa rectal preservada, en ambos casos está recomendado completar la evaluación con estudios por imágenes de intestino delgado en combinación con la ileocolonoscopía, ante la necesidad de establecer diagnóstico diferencial con EC.
Compromiso apendicular: el compromiso apendicular aislado en pacientes con CU ha sido descripto hasta en 75% de los pacientes. Esta localización se correlaciona con un curso evolutivo con buena respuesta al tratamiento médico pero mayor riesgo de pouchitis luego de la realización de una anastomosis íleo-anal.
Backwash ileitis: este término describe la extensión continua (macroscópica y/o histológica) de la actividad inflamatoria desde el ciego hasta el íleon. Se observa en hasta 20% de los pacientes con pancolitis. Este compromiso parece relacionarse a un curso más refractario de la enfermedad y mayor riesgo de progresión a displasia o cáncer. También debería considerarse la realización de estudios por imágenes adicionales para diferenciar de EC.
Toma de biopsias
La correcta definición macroscópica de la extensión de la enfermedad repercute en el tratamiento y su vía de administración, aunque puede subestimar la extensión real de la enfermedad. La definición microscópica del compromiso máximo determina la necesidad de ingresar en programas de pesquisa de cáncer colorrectal. La adecuada toma de biopsias es necesaria para establecer la extensión real, provee información pronóstica y contribuye a estratificar el riesgo para los programas de cribado. Como mínimo deben obtenerse dos muestras de cada segmento inflamado y, en forma separada, dos muestras de cada uno de los segmentos evaluados en la videocolonoscopía. Los hallazgos histológicos habitualmente no evidencian patrones patognomónicos y requieren ser interpretados con el conocimiento de hallazgos clínicos, endoscópicos, bioquímicos y radiológicos.
Scores endoscópicos en EII
La utilidad de la endoscopía en la EII no radica exclusivamente en el diagnóstico, sino que se mantiene durante el curso evolutivo de la enfermedad transformándose en una herramienta sumamente útil para el seguimiento, confirmación objetiva de recaídas, respuesta al tratamiento, alcance de objetivos terapéuticos y pesquisa de displasia. La importancia de definir adecuadamente el concepto de “curación mucosa” se ha convertido en un elemento clave, al establecerse como el objetivo terapéutico a alcanzar, con un alto impacto en el pronóstico. Las formas de reportar la actividad endoscópica representan un desafío hasta el día de hoy, principalmente por la necesidad de interpretar adecuadamente y codificar los hallazgos endoscópicos. Múltiples scores endoscópicos se han diseñado y perfeccionado a lo largo de los años, pero pocos han sido validados, su utilización aún hoy es subóptima y principalmente restringida a ensayos clínicos. La utilización de scores endoscópicos provee de información objetiva y tangible, a diferencia de los scores clínicos subjetivos. Las características operativas que un índice endoscópico ideal debiera cumplir consisten en: ser: validado, confiable, modificador de conducta terapéutica y útil tanto en ensayos clínicos como en la práctica habitual.
Scores endoscópicos en CU
Subscore endoscópico de Mayo (1987): descripto originalmente dentro del score global de Mayo con inclusión de parámetros clínicos, el subscore endoscópico utiliza una escala de cuatro grados, basada en eritema, patrón vascular, friabilidad, sangrado y presencia de erosiones o úlceras. Su sencillez para definir las variables han llevado a que sea uno de los scores más difundidos. Sin embargo, sus limitaciones radican en la utilización de parámetros que pueden resultar subjetivos y generar variabilidad inter-observador, la falta de validación externa, la ausencia de descriptores específicos en cuanto a la profundidad de las úlceras o extensión macroscópica de la enfermedad.
UCEIS (UC Endoscopic Index of Severity – 2012): diseñado a partir de la revisión de videos de procedimientos endoscópicos, se basa en tres descriptores: patrón vascular, sangrado y erosiones/úlceras a evaluar en el segmento de colon más afectado, excluye a la friabilidad. Constituye un score con una adecuada variabilidad inter-observador y muestra buena correlación con los resultados referidos por el paciente. Sin embargo, no se encuentra ampliamente difundido debido a la falta de familiaridad por parte de los endoscopistas.
UCCIS (UC Colonoscopic Index of Severity – 2013): considera seis variables dentro de su descripción: patrón vascular, granularidad, ulceración, sangrado/fiabilidad, la impresión global de actividad endoscópica (escala predefinida de 4 puntos) y la impresión global de actividad endoscópica según escala visual análoga. Gracias a su desarrollo riguroso, cuenta con un adecuado acuerdo inter-observador y está validado, pero carece de un nivel de corte definido para curación mucosa. Sin embargo la complejidad para obtener el puntaje final lo convierte en una herramienta poco útil para la práctica habitual.
Scores endoscópicos en EC
CDEIS (CD Endoscopic Index of Severity – 1989): se calcula combinando los hallazgos endoscópicos en descriptos en cinco segmentos ileocolónicos, lo que permite definir un rango de actividad (0 a 44). Su fortaleza radica en la alta correlación con la severidad de la enfermedad y la baja variabilidad inter-observador. Sin embargo, la complejidad en el cálculo y la necesidad de entrenamiento para su uso han limitado su utilidad a ensayos clínico, con poca aplicación en la práctica clínica.
SES-CD (Simple Endoscopic Score for CD – 2004): diseñado inicialmente para simplificar al score CDEIS, demuestra adecuada correlación con éste. Incluye cuatro variables a ser evaluados en cinco segmentos ileocolónicos: tamaño de úlceras, superficie ulcerada, superficie afectada y estenosis. El score final se obtiene de la sumatoria de todos los descriptores en cada segmento. La ausencia de un corte preciso para definir curación mucosa ha limitado su utilidad.
Score de Rutgeerts (1984): es el único score postoperatorio que evalúa íleon terminal y anastomosis ileocolónica luego de la resección. Reconocido como el gold standard para establecer el pronóstico de recaída clínica post operatoria ante la evidencia de recurrencia endoscópica post quirúrgica. Como desventajas, su utilidad se limita a casos de resección ileocolónica con anastomosis, carece de validación y evaluación de acuerdo inter-observador.
EII, displasia y cáncer colorrectal
Las EII se agrupan dentro de las entidades de alto riesgo para el desarrollo de cáncer colorrectal (CCR) e inclusive dentro de esta población, el riesgo de cáncer del intervalo es significativamente mayor comparado a la población general. Sin embargo algunos paradigmas se han modificado y actualmente se acepta que la mayoría de las lesiones displásicas colónicas son visibles.
El incremento del riesgo de desarrollo de CCR es particularmente significativo a partir de los diez años de evolución de la enfermedad, aunque la evidencia actual sugiere que el riesgo no sería tan elevado, respondiendo tal vez al efecto quimiopreventivo asociado a la optimización de tratamientos farmacológicos con el consecuente control profundo de la actividad inflamatoria y a la implementación de programas de pesquisa endoscópica.
La actividad inflamatoria histológica juega un doble rol, ya que por un lado ha sido reconocida como un factor de riesgo independiente para el desarrollo de displasia vía una carcinogénesis distintiva, pero por otro lado interviene como un factor confundidor en la interpretación de las muestras al momento de la búsqueda de displasia. Esto lleva a reconocer la importancia de lograr y mantener la remisión de la enfermedad, pero también seleccionar el momento adecuado para la realización de la pesquisa.
Un rastreo adecuado de displasia en EII se fundamenta en:
• La adecuada selección de pacientes: identificando factores de riesgo y estratificando en grupos con sus consecuentes intervalos.
• La realización de procedimientos endoscópicos de alta calidad (preparación colónica, operador entrenado y tiempo de retirada adecuado para lograr una meticulosa visualización de la mucosa).
• La correcta utilización de técnicas adicionales disponibles para incrementar la identificación de lesiones sospechosas con su correcta descripción y eventual resección.
Conclusiones
La ileocolonoscopía juega un rol fundamental dentro de los elementos disponibles en la actualidad para arribar al diagnóstico de EII, aportando datos iniciales relevantes. Sin embargo su papel no se limita al debut de la enfermedad, ya que constituye una herramienta sumamente útil para el monitoreo, detección y tratamiento de complicaciones y pesquisa de displasia.
La posibilidad de utilizar scores que permiten guiar las decisiones apunta a optimizar las herramientas terapéuticas disponibles para alcanzar y mantener la remisión mucosa. A pesar de las limitantes que puedan evidenciar los distintos sistemas de puntuación, permiten codificar los hallazgos y unificar criterios y definiciones, mientras se intenta alcanzar el objetivo de un score ideal.
Bibliografía recomendada
- Role of endoscopy in inflammatory bowel disease Gastroenterology Report 2018; 6 (2): 75-82.
- Progression of Inflammatory Bowel Diseases Throughout Latin America and the Caribbean: A Systematic Review. Clinical Gastroenterology and Hepatology 2020; 18: 304-312.
- Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra-intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo-anal Pouch Disorders. Journal of Crohn’s and Colitis 2017: 649-670.
- ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. Journal of Crohn’s and Colitis 2019: 144-164.
- Endoscopic assessment of inflammatory bowel disease: colonoscopy / esophagogastroduodenoscopy. Gastroenterol Clin North Am 2012; 41 (2): 271-290.
- The role of endoscopy in inflammatory bowel disease. Gastrointest Endosc 2015; 81 (5): 1101-1121.e1-e13.
- Reporting Colonic Biopsies in Patients With Inflammatory Bowel Disease; a Practical Approach. Inflamm Bowel Dis 2019; 25 (4): 679-684.
- Chronological Review of Endoscopic Indices in Inflammatory Bowel Disease. Clin Endosc 2019; 52: 129-136.
- Endoscopic scores for inflammatory bowel disease in the era of ‘mucosal healing’: Old problem, new perspectives. Dig Liver Dis 2016; 48 (7): 703-708.
- Endoscopic scoring indices for evaluation of disease activity in ulcerative colitis Cochrane Database Syst Rev 2018; 1 (1): CD011450.
- ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 2: IBD scores and general principles and technical aspects. Journal of Crohn’s and Colitis 2018: 273-290.
- The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001; 48 (4): 526-535.
- SCENIC international consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastroenterology 2015; 148 (3): 639-651.
- Decreasing risk of colorectal cancer in patients with inflammatory bowel disease over 30 years. Gastroenterology 2012; 143 (2): 375-381.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE