Natalia Marina Zeytuntsian, José Tawil, Ana Adet Caldelari, Álvaro Falzone, Patricio Sheridan, Gustavo Bello, Christian Sánchez, Luis Caro, Cecilio Cerisoli
GEDyT (Gastroenterología Diagnóstica y Terapeútica). Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2021;51(2):173-180
Recibido: 05/03/2021 / Aceptado: 10/05/2021 / Publicado en www.actagastro.org el 21/06/2021 / https://doi.org/10.52787/oqgh3367
Resumen
Introducción. El parche de mucosa gástrica heterotópica o inlet patch es la presencia de mucosa columnar gástrica fuera del estómago, con localización más frecuente en el esófago proximal. Sus manifestaciones varían desde síntomas esofágicos y extraesofágicos de reflujo, a complicaciones mayores, siendo la mayoría asintomáticos. Objetivo. Determinar la prevalencia de mucosa gástrica heterotópica cervical en nuestro medio y su asociación con síntomas esofágicos y extraesofágicos de reflujo. Material y métodos. Estudio prospectivo de corte transversal y observacional. Se incluyeron pacientes consecutivos que acudieron a nuestra institución entre diciembre de 2018 y octubre de 2019, para la realización de videoendoscopía digestiva alta diagnóstica, previo cuestionario sobre manifestaciones clínicas. Resultados. Se incluyeron 1408 pacientes. En 89 (6,3%), se describió islote de mucosa gástrica heterotópica cervical. La edad promedio en años de pacientes sin esta afección fue de 54,6, y de 55,5 en pacientes con ella. La presencia de síntomas esofágicos de reflujo gastroesofágico (pirosis, regurgitación y dolor torácico) en pacientes con mucosa gástrica heterotópica cervical fue: 40 (44,9% / p = 0,473), 12 (13,5% / p = 0,783) y 4 (4,5% / p = 0,199) pacientes, respectivamente. La presencia de síntomas extraesofágicos (globus, tos crónica, disfonía y carraspera) en pacientes con mucosa gástrica heterotópica cervical fue: 9 (10,1% / p = 0,011); 7 (7,9% / p = 0,155); 4 (4,5% / p = 0,458) y 9 (10,1% / p = 0,036), respectivamente. Conclusiones. Se encontró asociación estadísticamente significativa entre la presencia del islote de mucosa gástrica heterotópica cervical y síntomas de globus (p = 0,011) y carraspera (p = 0,036). Podría interpretarse que este grupo de pacientes se vería beneficiado con la búsqueda y tratamiento de esta afección, con la intención de mejorar los síntomas.
Palabras claves. Mucosa gástrica heterotópica, reflujo gastroesofágico, síntomas esofágicos y extraesofágicos.
Prevalence of Cervical Heterotopic Gastric Mucosa and Its Relationship with Gastroesophageal Reflux Symptoms. An Observational Study
Summary
Introduction. The heterotopic gastric mucosal patch or inlet patch is the presence of gastric columnar mucosa outside the stomach, most frequently located in the proximal esophagus. Its manifestations vary from esophageal and extraesophageal reflux symptoms to major complications, most of them being asymptomatic. Aim. To determine the prevalence of cervical heterotopic gastric mucosa in our environment and its association with esophageal and extraesophageal reflux symptoms. Material and methods. Prospective cross-sectional and observational study; consecutive patients who came to our institution between December 2018 and October 2019 for diagnostic upper gastrointestinal videoendoscopy were included, following a questionnaire on clinical manifestations. Results. A total of 1,408 patients were included. In 89 (6.3%), a cervical heterotopic gastric mucosal patch was described. The mean age of the patients without this condition was 54.6 and 55.5 in patients with it. The esophageal symptoms of gastroesophageal reflux (heartburn, regurgitation, and chest pain) in patients with cervical heterotopic gastric mucosa was observed in 40 (44.9% / p = 0.473), 12 (13.5% / p = 0.783) and 4 (4.5% / p = 0.199) patients respectively. The presence of extraesophageal symptoms (globus, chronic cough, dysphonia, and throat clearing) in patients with cervical heterotopic gastric mucosa was: 9 (10.1% / p = 0.011); 7 (7.9% / p = 0.155); 4 (4.5% / p = 0.458) and 9 (10.1% / p = 0.036) respectively. Conclusions. A statistically significant association was found between the presence of cervical heterotopic gastric mucosal patch and symptoms of globus (p = 0.011) and throat clearing (p = 0.036). It could be interpreted that this group of patients would benefit from the research and treatment of this condition with the intention of improving their symptoms.
Keywords. Heterotopic gastric mucosa, gastroesophageal reflux, esophageal and extraesophageal symptoms.
Abreviaturas
MGH: Mucosa gástrica heterotópica.
VEDA: Videoendoscopía digestiva alta.
NBI: Narrow band imaging.
H. pylori: Helicobacter pylori.
APC: Argón plasma.
ERGE: Enfermedad por reflujo gastroesofágico.
Introducción y objetivo
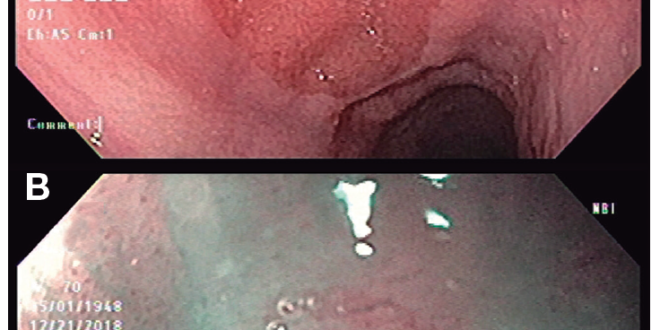
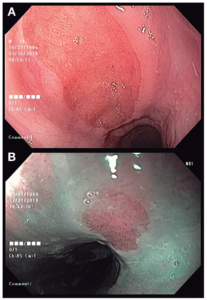
El término inlet patch cervical hace referencia a un islote o parche de mucosa gástrica heterotópica (MGH) que se encuentra en el esófago proximal y que tendría la capacidad de producir ácido.1 Si bien no se conoce su origen con certeza, se ha postulado que podría ser congénito o adquirido.2-4 Puede estar presente en todo el tubo digestivo o en sitios extraintestinales, como la vesícula biliar, el conducto cístico, el conducto onfalomesentérico, el ombligo y el hígado.2, 3 La localización más frecuente es el esófago cervical, principalmente en los tres primeros centímetros.1, 5 Su prevalencia varía entre el 1% y el 13,8%,6 aunque se ha reportado hasta en un 70% en autopsias1 (Figura 1).
Figura 1. A: Islote de MGH en esófago cervical con luz blanca; B: Islote visualizado con NBI.
Dentro de las manifestaciones, se han descrito: tos crónica, globus, disfagia,3 estenosis,7 úlcera,8 fístulas con o sin absceso subcutáneo,9, 10 perforación11 y pólipos.12, 13
La manometría y la monitorización del pH de 24 horas demostraron que algunos pacientes con MGH cervical tienen trastornos motores esofágicos y episodios independientes de producción de ácido por parte del parche, lo que contribuiría a la aparición de algunos de los síntomas.14
La asociación entre la MGH y el esófago de Barrett no es contundente. Algunos estudios han informado asociaciones positivas,5, 15-17 mientras que otros no.5, 18-22
Con respecto a la asociación con síntomas de reflujo gastroesofágico, para algunos autores la mayoría de los casos de MGH cervical serían asintomáticos y solo se detectan incidentalmente durante la realización de una videoendoscopía digestiva alta (VEDA),20, 23, 24 mientras que otros reportan hasta un 73,1% de pacientes con asociación sintomática.21
La transformación neoplásica es rara, se han reportado 47 casos en la literatura.25 Se ha informado la presencia de metaplasia intestinal en asociación con el adenocarcinoma que se desarrolla en la MGH.26 En el estudio de Alagozlu et al.,27 se encontró solo un caso de adenocarcinoma entre 64 pacientes con MGH. Se estima que la incidencia de neoplasias malignas desarrolladas a partir de la MGH varía entre 0 y 1,56%.16, 27
Se ha propuesto una clasificación clínico-patológica en función de sus características clínicas, endoscópicas e histológicas:3 la categoría I incluye a pacientes asintomáticos sin otros hallazgos endoscópicos, la categoría II a pacientes sintomáticos con reflujo laringofaríngeo, la categoría III a pacientes sintomáticos con complicaciones benignas (estenosis, fistulas, sangrado), la categoría IV a pacientes con displasia intraepitelial y la categoría V a pacientes con transformación maligna, tanto asintomáticos o con disfagia.
El diagnóstico se realiza mediante VEDA, aumentando la detección con narrow band imaging (NBI),28 y la confirmación histológica. El tipo histológico más común es la mucosa cardial u oxíntica, seguido de la antral. Dependiendo del tipo de mucosa, algunos parches pueden producir ácido y, dada su proximidad al complejo laringofaríngeo, pueden refluir en esta área y producir síntomas.29, 30
La MGH puede estar colonizada por Helicobacter pylori (H. pylori) hasta en un 82% de los casos.31 Aunque el papel de H. pylori en el islote de MGH sigue siendo incierto, podría causar cambios similares a los observados en el estómago,5 lo que puede exacerbar las complicaciones y los síntomas relacionados. En el estudio de Alagozlu et al., todos los pacientes que tenían colonización del parche por H. pylori presentaban sensación de globo, siendo el único estudio que menciona esta asociación.27
Algunos pacientes presentan mejoría sintomática con los inhibidores de la bomba de protones (IBP). Otra opción es la terapéutica endoscópica, como el argón plasma (APC), la mucosectomía, la disección submucosa y la ablación con radiofrecuencia. Un estudio prospectivo, aleatorizado y controlado demostró que el 82% de los pacientes tratados con APC tuvieron mejoría sintomática y el 90% tuvo curación endoscópica.32, 33 La mucosectomía y la disección submucosa se reservan para los casos de displasia de alto grado en el parche o adenocarcinoma.34 La radiofrecuencia mostró mejoría sintomática en pacientes con globus, dolor de garganta y tos, en los casos de islotes mayores a 20 mm con alivio sintomático aún a los doce meses del tratamiento.35
La prevalencia de MGH cervical en la Argentina es desconocida, ya que no hay estudios realizados en nuestro país. El objetivo de este trabajo fue determinar su prevalencia en pacientes consecutivos que acudieron para la realización de una VEDA en nuestro centro, y su asociación con síntomas esofágicos y extraesofágicos de reflujo gastroesofágico.
Material y métodos
Estudio prospectivo de corte transversal y observacional
Se realizó en la Ciudad Autónoma de Buenos Aires en un centro de endoscopía ambulatoria, entre diciembre de 2018 y octubre de 2019. Se incluyeron pacientes consecutivos de entre 18 a 80 años que acudieron a nuestra institución para la realización de VEDA diagnóstica, a los que se les realizó previamente un cuestionario sobre manifestaciones clínicas. Se excluyeron pacientes cuya VEDA no pudo finalizarse por motivos técnicos, como la falta de ayuno o complicaciones anestésicas, o que hayan sido derivados para realizar VEDA de urgencia (hemorragia digestiva, cuerpo extraño). A los pacientes que cumplieron con los criterios de inclusión, se les realizó antes del procedimiento endoscópico, obteniendo su consentimiento informado, un cuestionario desarrollado por nuestro equipo para recabar datos sociodemográficos (edad y sexo) y síntomas presentes (basado en el Gastroesophageal Reflux Disease Questionnaire [Gerd Q] y el Reflux Symptom Index [RSI]), asi como su presencia y frecuencia (Anexo 1). También se indagó sobre la utilización de IBP.
Procedimiento endoscópico
La VEDA fue realizada con la búsqueda intencionada de MGH cervical, bajo sedación anestésica con Propofol, administrada por anestesiólogo. Se utilizaron endoscopios de alta resolución (Olympus 180/190) con cromoendoscopía (NBI). La VEDA se completó hasta la segunda porción duodenal, haciendo una observación minuciosa del esófago proximal en la retirada. En caso de encontrar MGH, se informó la localización y se tomaron biopsias para su estudio histopatológico.
Estudio histopatológico
Las biopsias fueron remitidas a patólogos especialistas en la materia para determinar la presencia y tipo de mucosa gástrica, y la presencia o no de H. pylori.
Análisis estadístico
Los datos fueron volcados en una base de datos (Excel) y analizados, empleando los paquetes estadísticos: SPSS 16 BY SPSS INC (1989-2007) y el Statistica V10 de StatSoft. Inc (1984-2011). Se analizaron las distribuciones de frecuencias y las estadísticas descriptivas adecuadas para cada variable, según su escala de medición y distribución. Cuando fue necesario, se realizó la estimación de intervalos de confianza del 95%, el ODDS RATIO, la razón de momios o de productos cruzados, el Chi cuadrado y ANOVA a 2 vías. El nivel de significación establecido fue de 0,05.
Resultados
Se incluyeron 1408 pacientes, de los cuales 816 (58%) eran de sexo femenino. Del total de pacientes, en 89 (6,3%), se describió el parche de mucosa asalmonada, que luego fue confirmado por anatomía patológica como MGH. La edad promedio en años de los sujetos sin MGH fue de 54,6 ± 13,8 y de 55,5 ± 13,4 en sujetos con MGH (Tabla 1). En todos los casos, la localización del parche de MGH fue en el tercio superior del esófago.
Tabla 1. Datos epidemiológicos de los pacientes estudiados

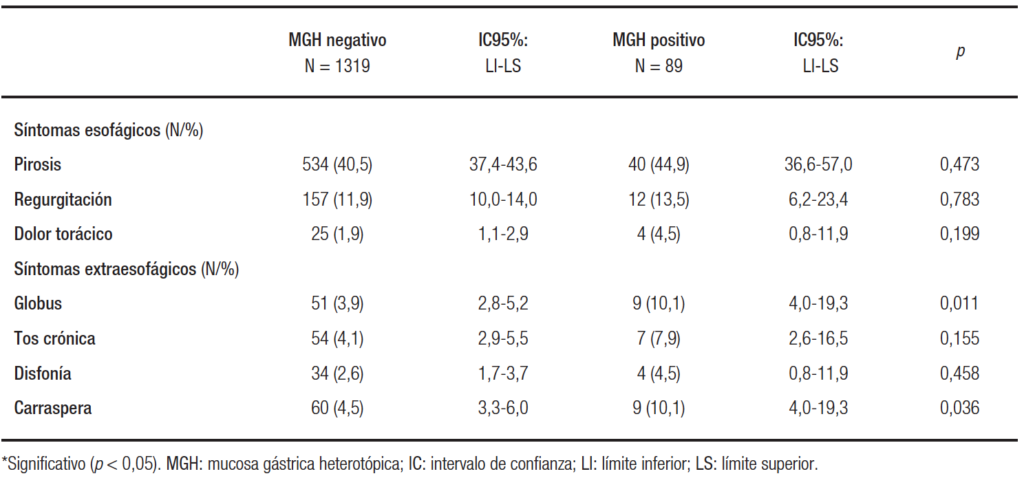
En cuanto a los síntomas típicos de reflujo gastroesofágico, se observó, en pacientes sin MGH cervical, la presencia de pirosis, regurgitación y dolor torácico en 534 (40,5% / intervalo de confianza 95% [IC95%] 37,4-43,6), 157 (11,9%/ IC95% 10,0-14,0) y 25 (1,9%/ IC95% 1,1-2,9) pacientes, respectivamente. En el grupo con MGH cervical la presencia de pirosis, regurgitación y dolor torácico se observó en 40 (44,9%, IC95% 32,6-57,0 / p = 0,473); 12 (13,5%, IC95% 6,2-23,4 / p = 0,783) y 4 (4,5%, IC95% 0,8-11,9 / p = 0,199) pacientes, respectivamente. En relación con la presencia de síntomas extraesofágicos (globus, tos crónica, disfonía y carraspera), en pacientes sin MGH cervical fue de 51 (3,9%/ IC 2,8-5,2); 54 (4,1%/ IC 2,9-5,5); 34 (2,6%/ IC 1,7-3,7), y 60 (4,5%/ IC 3,3-6,0), mientras que en aquellos pacientes con MGH cervical fue en 9 (10,1%, IC 4,0-19,3 / p = 0,011); 7 (7,9%, IC 2,6-16,5 / p = 0,155); 4 (4,5%, IC 0,8-11,9/ p = 0,458), y 9 (10,1%, IC 4,0-19,3/ p = 0,036) pacientes, respectivamente (Tabla 2).
Tabla 2. Síntomas en pacientes con y sin MGH cervical
Cuando se compararon las poblaciones sin MGH y con MGH cervical en relación con la utilización de IBP, se observó que el uso de IBP en pacientes sin MGH fue del 33,8% (N = 446, IC 30,9-36,8) y en pacientes con MGH, del 36% (N = 32, IC 24,5-48,0) p = 0,766, por lo que no hubo diferencia estadísticamente significativa.
En el análisis histopatológico, predominó la mucosa corporofúndica (51%), seguido de mucosa de tipo cardial/fúndica (31%) y antral (18%). En relación con los síntomas extraesofágicos asociados al parche de MGH cervical, se observó que, en los síntomas de globus y carraspera, predominaba la mucosa corporofúndica. Por último, no se evidenció displasia ni infección por H. pylori, así como tampoco se reportaron complicaciones asociadas al parche de MGH.
Durante el desarrollo del presente estudio, se identificó una familia de cuatro miembros (madre y sus tres hijos) con MGH cervical.
Discusión
El aspecto endoscópico del parche de MGH es de un islote de mucosa asalmonada que se ubica en la mayoría de los casos en el esófago proximal, aunque ha sido descrito en múltiples localizaciones.2, 3 En nuestro estudio, todos los parches fueron hallados en el esófago superior, entre los 13 y 21 cm desde la arcada dentaria.
El origen del parche de MGH cervical se desconoce, siendo la teoría más ampliamente aceptada la del origen congénito.2-4 Durante el desarrollo del esófago, el revestimiento escamoso reemplazaría al revestimiento columnar, comenzando desde el esófago medio y extendiéndose en ambas direcciones, siendo el esófago proximal la última parte en estratificarse, lo que explicaría por qué el esófago proximal es la localización más frecuente. Su incidencia es mayor en niños y su prevalencia no aumenta con la edad.1, 3, 23 Es tal vez por estos motivos que se la considera una entidad clínicamente irrelevante.
La prevalencia reportada varía entre el 1% y el 13%.1 En nuestro estudio, observamos una prevalencia del 6,3%. El diagnóstico se realiza mediante VEDA, siendo una lesión que muchas veces puede pasar inadvertida debido a la incorrecta exploración del esófago proximal. Si bien en el presente estudio no se comparó la tasa de detección utilizando luz blanca vs. NBI, otros estudios han demostrado que el NBI aumenta la probabilidad de detectarla.28
Actualmente, se desconoce el mecanismo por el cual el islote de MGH cervical produce síntomas, aunque se observó su capacidad de producir ácido,29, 30 pudiendo, a partir de este mecanismo, generar manifestaciones clínicas, así como también complicaciones. Según el consenso de Lyon,36 se considera ERGE patológico a la presencia de uno de los siguientes: esofagitis C/D, estenosis péptica, Barrett mayor a 1 cm, exposición al ácido mayor a 6%. Nuestro trabajo no estuvo dirigido a pacientes con diagnóstico de ERGE patológico, pero, sin embargo, se observó asociación estadísticamente significativa entre la presencia del islote de MGH y síntomas extraesofágicos de reflujo, como globus (9/89, 10,1%, p = 0,011) y carraspera (9/89, 10,1%, p = 0,036). En la literatura, la prevalencia de síntomas como estos dos últimos varían desde el 20% al 73,1%.21 En el estudio de Neumann et al.16 se incluye 487.229 VEDA y se demuestra que la disfagia, la odinofagia y los síntomas superiores de globus y carraspera fueron significativamente más frecuentes en pacientes con MGH cervical. No se observaron, en este estudio, pacientes con complicaciones por esta entidad. La mayoría de los pacientes se encontraron en las categorías I y II de la clasificación clínico-histopatológica.3
Dependiendo del tipo de mucosa, algunos islotes de MGH cervical pueden producir ácido29, 30 y, dada su proximidad al complejo laringofaríngeo, pueden refluir fácilmente en esta área y producir síntomas. La mucosa laríngea es particularmente susceptible a la lesión por ácido, incluso con una secreción débilmente ácida. En nuestras biopsias, se observó que la mucosa tipo corporofúndica está presente en la mayoría de los casos, en concordancia con la literatura evaluada.30, 31 En cuanto a la relación entre los síntomas extraesofágicos asociados al islote de MGH cervical, se observó que tanto en globus como en carraspera predomina la mucosa de tipo corporofúndica, y en menor medida, las mucosas cardial y antral. Si se tiene en cuenta que este tipo de mucosa gástrica es la responsable de la secreción ácida en la porción más proximal del esófago, podría asociársela a la presencia de síntomas tales como globus y carraspera y explicar así por qué algunos pacientes responden a los IBP. Otras terapéuticas que demostraron mejoría sintomática son el APC32, 33 o radiofrecuencia.35 Así, podría resultar útil, en el grupo de pacientes que manifiestan globus y/o carraspera, la búsqueda intencionada del islote cervical, su corroboración anatomopatológica y su tratamiento, para poder ofrecer alivio sintomático.
Por otra parte, se ha reportado en diversos estudios la presencia de H. pylori hasta en un 82% de los casos.31 En nuestro estudio, las biopsias fueron todas negativas para H. pylori, aun en aquellos pacientes con sintomatología de globus y carraspera. No hay trabajos que evalúen la eficacia del tratamiento antibiótico de erradicación y la mejoría de los síntomas asociados a la MGH cervical, aunque podría pensarse que la erradicación del H. pylori del parche podría ser beneficiosa para el alivio sintomático.
La incidencia de metaplasia intestinal, displasia y adenocarcinoma del parche es muy baja y varía entre 0 y 1,56%.16, 27 En nuestro estudio, no se han reportado metaplasia intestinal, displasia ni trasformación neoplásica.
Nuestro grupo considera la importancia de un examen cuidadoso y exhaustivo del esófago superior, especialmente en pacientes con síntomas tales como tos crónica, carraspera, sensación de cuerpo extraño, disfonías recurrentes, e incluso en aquellos pacientes con laringitis en las cuales el reflujo sea sospechado como causante. No hay consenso claro acerca de si tomar o no biopsias de estas lesiones. Más discutible aún es si deben tomarse biopsias del parche en la población asintomática. Debido a la asociación con displasia y transformación neoplásica descrita en algunas publicaciones, consideramos correcto el análisis histopatológico de estas lesiones. Tampoco es clara aún la necesidad de vigilancia endoscópica de la MGH.25, 26
Respecto del hallazgo en nuestro estudio de familiares directos con islote cervical de MGH, no hay casos descritos en la bibliografía; probablemente, esto se deba a que, además de ser una patología de poca prevalencia, no todos los grupos familiares tienen realizada una endoscopía digestiva alta.
Como limitantes del estudio, se utilizó un cuestionario de diseño propio, aunque basado en cuestionarios avalados, no se registró el número ni el tamaño del islote, ni tampoco se comparó la tasa de detección del mismo con luz blanca versus la utilización de NBI, a fin de evaluar una mayor detección con NBI. Otra limitante fue no haber hecho el seguimiento de pacientes tratados, ya sea en forma médica o endoscópica, y evaluar la respuesta.
Conclusión
La detección de MGH cervical aumenta con la búsqueda intencionada y la revisión minuciosa del esófago proximal, así como con el uso de tecnología como el NBI. La prevalencia en nuestro estudio fue de 6,3%. Se encontró asociación estadísticamente significativa entre globus y carraspera y la presencia de MGH cervical, por lo que podría interpretarse que este subgrupo de pacientes se vería beneficiado con la búsqueda intencionada de la misma, la toma de biopsias para diagnóstico anatomopatológico y tratamiento con el objetivo de mejorar los síntomas.
Responsabilidades éticas, confidencialidad de datos y conflictos de intereses. No se ha experimentado con humanos ni animales. Se han preservado los datos de pacientes incluidos y excluidos en el estudio.
Protocolo aceptado previamente por el Comité de Docencia e Investigación y el Comité de Ética de GEDyT.
No hay conflicto de intereses ni financiamiento externo.
Aviso de derechos de autor
 © 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
© 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Zeytuntsian NM, Tawil J, Caldelari AA y col. Prevalencia de mucosa gástrica heterotópica cervical y su relación con síntomas de reflujo gastroesofágico. Estudio observacional. Acta Gastroenterol Latinoam. 2021;51(2):173-180. https://doi.org/10.52787/oqgh3367
Referencias
- Chong VH. Clinical significance of heterotopic gastric mucosal patch of the proximal esophagus. World J Gastroenterol. 2013;19:331-8.
- Gurol S, Gokhan A, Bora K, et al. Is cervical inlet patch important clinical problem? Int J Biomed Sci. 2014;10:129-35.
- Von Rahden BH, Stein HJ, Becker K, et al. Heterotopic gastric mucosa of the esophagus: literature-review and proposal of a clinicopathologic classification. Am J Gastroenterol. 2004;99:543-51.
- Meining A, BajboSauj M. Erupted cysts in the cervical esophagus result in gastric inlet patches. Gastrointest Endosc. 2010;72:603-5.
- Akbayir N, Alkim C, Erdem L, et al. Heterotopic gastric mucosa in the cervical esophagus (inlet patch): endoscopic prevalence, histological and clinical characteristics. J Gastroenterol Hepatol. 2004;19:891-6.
- Ohara M. Incidence of heteroptopic gastric mucosa in the upper esophagus in first time narrow banding image endoscopy of consecutive 900 patients. Gastrointest Endosc 2010;71:AB316-31.
- Ward EM, Ache SR. Gastric heterotopia in the proximal esophagus complicated by stricture. Gastrointest Endosc. 2003;57:131-3.
- Bataller R, Bordas JM, Ordi J, et al. Upper gastrointestinal bleeding: a complication of “inlet patch mucosa” in the upper esophagus. Endoscopy. 1995;27:282.
- Daher P, Francis E, Raffoul L, et al. Ectopic gastric mucosa in the cervical esophagus presenting as a recurrent neck abscess: a case report. J Pediatr Surg. 2010;45:e15-7.
- Katsanos KH, Christodoulou DK, Kamina S, et al. Diagnosis and endoscopic treatment of esophago-bronchial fistula due to gastric heterotopy. World J Gastrointest Endosc. 2010;2:138-42.
- Sánchez-Pernaute A, Hernando F, Díez-Valladares L, et al. Heterotopic gastric mucosa in the upper esophagus (“inlet patch”): a rare cause of esophageal perforation. Am J Gastroenterol. 1999;94:3047-50.
- Rana SS, Panda N, Sinha SK, et al. Heterotopic gastric mucosa in the upper esophagus manifesting as a polypoidal mass causing dysphagia. Gastrointest Endosc. 2006;63:185-7.
- Schmulewitz N, Tobias J, Singh P. Hyperplastic polyp arising from heterotopic gastric epithelium in the esophagus. Gastrointest Endosc. 2007;66:1221-2; discusión 1222.
- Korkut E, Bektaş M, Alkan M, et al. Esophagealmotility and 24-h pH profiles of patients with heterotopic gastric mucosa in the cervical esophagus. Eur J Intern Med. 2010;21:21-4.
- Yüksel I, Uskudar O, Köklü S, et al. Inlet patch: associations with endoscopic findings in the upper gastrointestinal system. Scand J Gastroenterol. 2008;43:910-4.
- Neumann WL, Luján GM, Genta RM. Gastric heterotopia in the proximal oesophagus (“inlet patch”): Association with adenocarcinomas arising in Barrett mucosa. Dig Liver Dis. 2012;44:292-6.
- Bogomoletz WV, Geboes K, Feydy P, et al. Mucin histochemistry of heterotopic gastric mucosa of the upper esophagus in adults: possible pathogenic implications. Hum Pathol. 1988;19:1301-6.
- Jacobs E, Dehou MF. Heterotopic gastric mucosa in the upper esophagus: a prospective study of 33 cases and review of literature. Endoscopy. 1997;29:710-5.
- Borhan-Manesh F, Farnum JB. Incidence of heterotopic gastric mucosa in the upper oesophagus. Gut. 1991;32:968-72.
- Weickert U, Wolf A, Schröder C, et al. Frequency, histopathological findings, and clinical significance of cervical heterotopic gastric mucosa (gastric inlet patch): a prospective study in 300 patients. Dis Esophagus. 2011;24(2):63-8.
- Chong VH, Jalihal A. Heterotopic gastric mucosal patch of the esophagus is associated with higher prevalence of laryngopharyngeal reflux symptoms. Eur Arch Otorhinolaryngol. 2010;267:1793-9.
- Poyrazoglu OK, Bahcecioglu IH, Dagli AF, et al. Heterotopic gastric mucosa (inlet patch): endoscopic prevalence, histopathological, demographical and clinical characteristics. Int J Clin Pract. 2009;63:287-91.
- Maconi G, Pace F, Vago L, et al. Prevalence and clinical features of heterotopic gastric mucosa in the upper oesophagus (inlet patch). Eur J Gastroenterol Hepatol. 2000;12:745-9.
- Lujan G, Genta R. The inlet patch revisited: A clinicopathologic study of 569 patients with heterotopic gastric mucosa in the proximal esophagus. Am J Gastroenterol. 2010;105:0002-9270.
- Malhi-Chowla N, Ringley RK, Wolfsen HC. Gastric metaplasia of the proximal esophagus associated with esophageal adenocarcinoma and Barrett’s esophagus: what is the connection? Inletpatchrevisited. Dig Dis. 2000;18:183-5.
- Lauwers GY, Scott GV, Vauthey JN. Adenocarcinoma of the upper esophagus arising in cervical ectopic gastric mucosa: rare evidence of malignant potential of so called “inlet patch”. Dig Dis Sci. 1998;43:901-7.
- Alagozlu H, Simsek Z, Unal S, et al. Is there an association between Helicobacter pylori in the inlet patch and globus sensation? World J Gastroenterol. 2010;16:42-7.
- Cheng CL, Lin CH, Liu NJ, et al. Endoscopic diagnosis of cervical esophageal heterotopic gastric mucosa with conventional and narrow-band images. World J Gastroenterol. 2014;20(1):242-9.
- Kim EA, Kang DH, Cho HS, et al. Acid secretion from a heterotopic gastric mucosa in the upper esophagus demonstrated by dual probe 24-hour ambulatory pH monitoring. Korean J Intern Med. 2001;16:14-7.
- Galan AR, Katzka DA, Castell DO. Acid secretion from an esophageal inlet patch demonstrated by ambulatory pH monitoring. Gastroenterology. 1998;115:1574-6.
- Gutierrez O, Akamatsu T, Cardona H, et al. Helicobacter pylori and hetertopic gastric mucosa in the upper esophagus (the inlet patch). Am J Gastroenterol. 2003;98:1266-70.
- Meining A, Bajbouj M. Gastric inlet patches in the cervical esophagus: what they are, what they cause, and how they can be treated. Gastrointest Endosc. 2016;84:1027-9.
- Bajbouj M, Becker V, Eckel F, et al. Argon plasma coagulation of cervical heterotopic gastric mucosa as an alternative treatment for globus sensations. Gastroenterology. 2009;137:440-4.
- Cartabuke RH, Thota PN. High-grade dysplasia in thoracic inlet patch treated by focal endoscopic mucosal resection and radiofrequency ablation. Gastrointest Endosc. 2015;81:1297-8.
- Dunn JM, Sui G, Anggiansah A, et al. Radiofrequency ablation of symptomatic cervical inlet patch using a through the scope device: a pilot study. Gastrointest Endosc. 2016;84:1022-6.
- Gyawali CP, Kahrilas PJ, Savarino E, et al. Modern diagnosis of GERD: the Lyon Consensus. Gut. 2018;67(7):1351-62.
Correspondencia: Natalia Marina Zeytuntsian
Correo electrónico: natyz04@hotmail.com
Acta Gastroenterol Latinoam 2021;51(2):173-180
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE