Mariana Martín Quirán, Leandro Manzotti, José Tawil, Carolina Bolino, Sandra Canseco, Christian Sanchez, Luis Caro, Cecilio Cerisoli
Centro Médico de Gastroenterología Diagnóstico y Tratamiento (GEDYT). Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2020;50(4):418-423
Recibido: 02/09/2020 / Aprobado: 13/11/2020 / Publicado en www.actagastro.org el 14/12/2020
Resumen
Introducción. El Esófago de Barrett se asocia al reflujo gastroesofágico crónico y es el principal factor de riesgo para el desarrollo de adenocarcinoma esofágico. Si bien existe controversia respecto a biopsiar lengüetas menores a 1 cm, la prevalencia de EB-ultracorto oscila hasta un 20%. Objetivo. Determinar la prevalencia de esófago de Barrett ultracorto en una cohorte de pacientes en Argentina y evaluar la presencia de displasia. Métodos. Se realizó un estudio de corte transversal de los reportes endoscópicos y anatomopatológicos de pacientes con sospecha de EB-ultracorto realizados en un centro ambulatorio de endoscopía, durante 2016-2017. Se incluyeron 894 pacientes. Resultados. El 52% de los pacientes era de sexo masculino; con una edad promedio de 56 años (± 12 años). El índice de masa corporal promedio fue de 26 ± 4 kg/m2. El 50% de los casos presentaba hernia hiatal (promedio 2,32 ± 0,59 cm). Se aplicó cromoendoscopía virtual en el 60% de los casos. La prevalencia de EB-ultracorto fue 25% (224/894). La longitud media de la lengüeta fue de 0,74 ± 0,24 cm. El sexo masculino y la presencia de hernia hiatal mostraron asociación estadísticamente significativa con respecto a la presencia de EB en el análisis multivariado. Conclusión. Se diagnosticó esófago de Barrett ultracorto en un 25% de los pacientes, siendo más frecuente en varones y con hernia hiatal; dos variables que se relacionan independientemente con la metaplasia intestinal. No se observó displasia en ninguna de las muestras.
Palabras claves. Esófago de Barrett, Esófago de Barrett ultracorto, endoscopía.
Prevalence of Barrett’s Esophagus in Short Segments Less than 1 cm
Summary
Introduction. Barrett Esophagus is an acquired condition secondary to gastroesophageal reflux disease, and it´s the main risk factor for Esophageal Adenocarcinoma. Although there is controversy about tissue sampling at endoscopy when segments are lesser than 10 mm, the prevalence of ultrashort Barrett´s esophagus is up to 20%. Objective. To estimate ultrashort Barrett Esophagus prevalence in a poblational cohort of Argentina and to assess the presence of dysplasia. Methods. A cross-sectional study of the endoscopic and pathological reports of ultrashort Barrett suspicion in an outpatient endoscopy center was performed during 2016-2017. 894 patients were enrolled. Results. 52% of the cohort were male, whose mean age was 56 years (± 12 years). Average Body Mass Index was 26 ± 4 kg/m2. Endoscopically, 50% had hiatal hernia and mean length was 2.32 ± 0.59 cm. Virtual chromoendoscopy was applied in 60% of patients. Ultrashort Barrett´s Esophagus prevalence was 25% (IC 95%), 224/894 patients. Median length was 0.74 ± 0.24 cm. Male sex and presence of hiatal hernia showed a statistically significant association with ultrashort BE presence in multivariate analysis. Conclusion. Ultrashort BE was identified in 25% of the patients, being more frequent in male sex and in patients with hiatal hernia; two variables that are independently related to intestinal metaplasia. Dysplasia was not observed.
Key words. Barrett Esophagus, Ultra-short Barrett Esophagus, Endoscopy.
Abreviaturas
EB: Esófago de Barrett.
RGE: Reflujo gastroesofágico.
ACE: Adenocarcinoma esofágico.
TBQ: Tabaquismo.
MI: Metaplasia intestinal.
UGE: Unión esófago gástrica.
EB-UC: EB Ultracorto.
DAG: Displasia alto grado.
HD: High definition.
NBI: Narrow band imaging.
ADS: Arcada dentaria superior.
DBG: Displasia bajo grado.
CODEI: Comité de Docencia e Investigación.
COB: Comité de Bioética.
IMC: Indice de masa corporal.
HH: Hernia hiatal.
MI-UGE: Metaplasia intestinal de la UGE.
EB-C: EB Corto.
Puntos clave
- La prevalencia de EB ultracorto (lengüetas esofágicas menores a 1 cm) es desconocida y oscila hasta un 20%.
- Existe controversia respecto a biopsiar estos segmentos; en base a trabajos que demuestran no ser costo-efectivo versus trabajos que demostraron presencia de este tipo de lengüetas en pacientes con ACE en estadios tempranos, evidenciando su potencial malignidad.
- Nuestro trabajo, demostró una prevalencia de 25% de EB ultracorto en pacientes sometidos a una endoscopía digestiva alta diagnóstica; siendo el primer trabajo en Argentina que analiza dicha variable. No se observó displasia en la muestra.
- La presencia de EB ultracorto fue más frecuente en pacientes de sexo masculino y en aquellos pacientes con hernia hiatal.
- Este trabajo constituye la base de futuras investigaciones al respecto.
Introducción
El EB es una condición asociada al RGE crónico, con evidencia endoscópica de mucosa asalmonada en esófago distal, cuya anatomía patológica presenta epitelio metaplásico especializado en sustitución al epitelio escamoso estratificado esofágico.1-6 Esta condición constituye un factor de riesgo de gran importancia en el desarrollo de ACE, debido al riesgo de progresión metaplasia – displasia – carcinoma.7-12
Los factores de riesgo asociados al EB son la edad (mayor a 50 años), el sexo (masculino), la presencia de RGE crónico o mayor a 5 años y obesidad central.2, 3, 6, 13
Los factores de riesgo asociados a la progresión del EB hacia displasia/ACE son la edad avanzada, longitud de EB > 3 cm, obesidad central y TBQ.2-4, 6, 10, 14
La prevalencia de EB es difícil estimar, debido a que es una condición asintomática.15-20 Los datos hasta ahora obtenidos acerca de la presencia de MI en segmentos menores a 1 cm, son muy variables según las diferentes publicaciones. Oscilan entre 1,74 y 20%21-26 de los sujetos asintomáticos que realizan una endoscopía alta de rutina. Una vez biopsiadas dichas lengüetas y rotuladas como EB, los pacientes se someten a un programa de vigilancia con un alto costo financiero y emocional para el individuo.24, 25
Existe controversia bibliográfica con respecto a la toma de biopsias en lengüetas cuya extensión sea igual o menor a 10 mm. Trabajos publicados en 2011 comentaban la no progresión a ACE en pacientes con MI-UGE en línea Z irregular tras un seguimiento de 7 años.23, 27 Sin embargo, más tarde se demostró que la presencia de metaplasia intestinal a nivel de la UGE, en una línea Z irregular debía ser considerado EB-UC y era predictor de desarrollo de EB-C, ya que el 25% de los pacientes desarrollaron EB-C al cabo de 5 años.28 En 2015, se demostró en pacientes con diagnóstico de ACE en estadios tempranos la presencia inicial de EB, de los cuales en un 20% de los pacientes era de extensión menor a 1 cm, es decir EB-UC.24
El último trabajo publicado al respecto es el de Thota et al., en 2017, en el que se evaluó la progresión hacia DAG/ACE en pacientes con EB menor a 1 cm o línea Z irregular, y se demostró que de los 167 pacientes que presentaban estas lengüetas (9,3%), en ninguno de ellos se constató progresión; a diferencia del grupo con lengüetas mayores a 1 cm en el que se constató un 4,4%.25
El presente estudio, tiene como objetivo principal estimar la prevalencia de EB en lengüetas de mucosa asalmonada menor o igual a 1 cm en pacientes que se realizaron una primera endoscopía. Como objetivo secundario, se observó la presencia de displasia.
Material y métodos
Se realizó un estudio de corte transversal de una cohorte de reportes endoscópicos de pacientes que presentaron sospecha de EB-UC por videoendoscopía digestiva alta y que cumplían los criterios de inclusión; realizados en los centros ambulatorios de Gedyt (sede Azcuénaga y Virrey Olaguer y Feliú) durante el período Enero 2016 a Diciembre 2017. Los informes anátomopatológicos fueron analizados por tres médicos patólogos especializados en patología digestiva.
Las videoendoscopías digestivas altas fueron realizadas con equipos Olympus CV 170, 180, 190, Pentax EG-290KP o EG-2990i, tras 8 horas de ayuno, por médicos endoscopistas bajo sedación con propofol, monitoreado por médico anestesiólogo, en sala de endoscopia ambulatoria, tras firmar el consentimiento medico informado.
Durante el procedimiento, se realizó la evaluación endoscópica de la mucosa esofágica en su totalidad, con particular atención al tercio distal. La mucosa fue evaluada con luz blanca de alta definición (HD) y posteriormente, cuando fue posible, con cromoendoscopía virtual (NBI o i-scan, según equipo utilizado).
Se midió la distancia desde la ADS hasta el cambio mucoso o presencia de mucosa asalmonada, unión gastroesofágica y hiato diafragmático. La longitud del epitelio metaplásico se midió en comparación al diámetro máximo de apertura total de pinza fórceps (5 mm).
La presencia de lengüetas esofágicas de mucosa asalmonada menores a 1 cm, sospechosas de metaplasia intestinal, fueron evaluadas con NBI (en caso de ser factible, según el equipo utilizado) y posteriormente biopsiadas. Las muestras fueron analizadas por anatomopatólogos especialistas en la materia.
Los informes de cada estudio endoscópico se cargaron en el sistema de registro informático, en donde fueron almacenados los siguientes datos: fecha del estudio, edad y sexo del paciente, peso y altura, motivo del estudio, tipo de preparación realizada y calidad de la misma, altura en centímetros del cambio mucoso, pliegues gástricos y hiato diafragmático, extensión de mucosa asalmonada compatible con metaplasia intestinal menor a 1 cm y toma de biopsia. En el informe de anatomía patológica, se describieron la presencia de metaplasia intestinal (con presencia de células caliciformes), metaplasia columnar, presencia de DBG o DAG y carcinoma.
Se incluyeron pacientes adultos con presencia de al menos una lengüeta de mucosa asalmonada en tercio distal de esófago menor o igual a 1 cm y se excluyeron quienes presentaron signos endoscópicos de esofagitis por reflujo, lesiones nodulares, antecedentes de cirugía esófago-gástrica, EB ya conocido (vigilancia) o que hayan recibido tratamiento endoscópico previo, diagnóstico de cáncer de esófago, várices esofágicas o estenosis esofágica, estudio incompleto o imposibilidad de toma de biopsia.
El protocolo fue aprobado por el CODEI y el COB.
Se calculó el tamaño de la muestra en base a una prevalencia esperada del 11% (mínimo = 2%, máximo = 20%) con un error alfa = 0,05, y una precisión 3%, el número de casos necesarios fue de 417 casos de pacientes con sospecha endoscópica de EB lengüeta ≤ 1cm.
Análisis estadístico
Los datos fueron volcados en una base de datos (Microsoft Excel 97) y analizados utilizando SPSS V.19 y VCCstat 2.0. Para todas las variables se estableció su distribución de frecuencias o porcentajes en relación con el total de casos. Para aquellas medidas en escala ordinal o superior, se computaron las siguientes medidas estadísticas: número de casos, valor mínimo hallado, valor máximo hallado, media aritmética, desvío típico y error típico. Se utilizaron las pruebas de significación estadística indicadas según la escala de medición de la variable dependiente. El nivel de significación se estableció en alfa 0,05 y se estimaron los intervalos de confianza del 95% según el caso. Se realizó regresión logística binaria para análisis multivariado.
Resultados
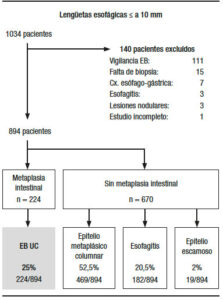
Se revisaron los informes endoscópicos de 1034 pacientes con lengüetas de mucosa asalmonada menor o igual a 1 cm de longitud, de los cuales 140 pacientes fueron excluidos por diferentes motivos (Figura 1).
Se enrolaron 894 informes de pacientes que cumplían los criterios de inclusión y exclusión (Tabla 1).
Tabla 1. Características de la población

La población estuvo compuesta por un 52% de pacientes de sexo masculino y un 48% de pacientes de sexo femenino; cuya edad promedio fue de 56 ± 12 años.
El IMC promedio fue de 26 ± 4 kg/m2, siendo mayor en varones que en mujeres (27,54 kg/m2 vs. 25,12 kg/m2 respectivamente), en forma significativa (p ≤ 0,0001).
En el 50% de los casos se diagnosticó la presencia de hernia hiatal (HH), con un tamaño promedio de 2,32 cm ± 0,59 cm; la diferencia entre proporciones de varones y mujeres con HH no fue estadísticamente significativa.
La utilización de cromoendoscopía virtual se realizó en el 60% de los pacientes (538/894), siendo el patrón vascular y mucoso regular en todos ellos (Tabla 1).
La incidencia de Esófago de Barrett en casos de sospecha endoscópica en lengüetas menores o iguales a 1 cm de longitud fue del 25% (IC 95% 22%-28%), evidenciándose en 224 de 894 pacientes. La longitud media de la lengüeta fue de 0,74 ± 0,24 cm.
Otros diagnósticos obtenidos fueron metaplasia columnar o glandular 52,5% (469 casos de 894); esofagitis 20,5% (182 de 894 casos) y epitelio escamoso 2% (19 de 894 casos).
No se observó displasia ni carcinoma en ningún caso.
La diferencia entre las prevalencias de MI en pacientes mayores y menores de 50 años no fue estadísticamente significativa (26,7% vs. 20,9%, p = 0,09).
Se observaron 137 casos de MI entre pacientes con HH (30,8%) vs. 87 casos entre pacientes sin HH (19,4%), siendo mayor en el primer grupo en forma significativa (p < 0,0001).
En cuanto a la prevalencia de MI según el IMC, el análisis realizado mostró una prevalencia mayor en pacientes con sobrepeso que en aquellos sin esta condición, siendo la misma estadísticamente significativa (28,7% vs. 19,9%, p < 0,004).
La prevalencia de MI fue mayor en pacientes de sexo masculino en comparación a los de sexo femenino (30% vs. 19,8%); siendo esta diferencia estadísticamente significativa (p = 0,001).
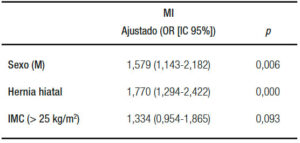
En el análisis multivariado (regresión logística múltiple) se observó que tanto el sexo masculino (OR: 1,57 [IC95% 1,14-2,18; p = 0,006]) como la presencia de hernia hiatal (OR: 1,77 [IC95% 1,29-2,42; p < 0,0001]) se relacionaban independientemente con la presencia de MI (ver Tabla 2).
Tabla 2. Tabla de regresión logística
Discusión
Existe escasa bibliografía acerca de la prevalencia de lengüetas de mucosa asalmonada menores o iguales a 1 cm debido a la discrepancia con respecto a biopsiar o no lengüetas de esta extensión. De acuerdo a los trabajos publicados, la prevalencia de EB en lengüetas de 10 mm oscila entre 1,74%29 y un máximo de 20%.28
Distintos trabajos avalan no biopsiar ante una línea Z irregular, considerando a la MI-UGE como una variante anatómica de normalidad. El estudio de Jung et al. en 2011 demostró, tras un seguimiento de 7 años, la no progresión a ACE en un grupo de 86 pacientes con MI-UGE vs. la progresión a ACE del 7% en el grupo de pacientes con EB-C.27 Sin embargo, un estudio escandinavo en 2012 y el estudio de Soucy et al. en 2016, demostraron que la presencia de células caliciformes en epitelio metaplásico columnar en una línea Z irregular debe ser considerado como EB-ultracorto (EB-UC). Se demostró que, de los pacientes que presentaban índice de metaplasia intestinal en línea Z en la endoscopía, un 25% desarrollaron EB-C al cabo de 5 años, apoyando la progresión de una condición a otra y la importancia del diagnóstico y la vigilancia en este tipo de pacientes.23, 28
Respecto a la posibilidad de displasia en un EB-UC, Pohl et al.24 demostraron riesgo de progresión de metaplasia a displasia/cáncer aún en casos de EB-UC, ya que de 1017 pacientes diagnosticados con ACE estadio T1, 20% de ellos (204 pacientes) presentaban EB menor a 1 cm.
En cambio, Thota et al.25 revelaron los resultados de un estudio de cohorte prospectivo multicéntrico que evaluaba la progresión a displasia/cáncer en 1791 pacientes con línea Z irregular o EB-UC y EB-C, con un seguimiento promedio de 6 años. La prevalencia de EB-UC fue de 9,3% (167 pacientes), de los cuales ninguno desarrolló displasia/cáncer; como sí ocurrió en el 4,4% de los pacientes con EB > 1 cm. Dichos resultados sugieren no realizar vigilancia endoscópica en pacientes con EB < 1 cm. El impacto en la calidad de vida del paciente, así como el impacto económico costo efectivo de la vigilancia endoscópica, replantea la necesidad de determinar precisa y adecuadamente la conducta a seguir en este tipo de pacientes.
Nuestro estudio, siendo el primer trabajo en Argentina que evalúa la prevalencia de EB en lengüetas menores a 1 cm de extensión, incluyó un total de 894 pacientes que presentaban en la endoscopía lengüetas de mucosa asalmonada de dicha longitud, de los cuales el 25% (224 pacientes) fueron diagnosticados como EB debido a la presencia de células caliciformes en la anatomía patológica.
Nuestro trabajo representa homogeneidad en la población total estudiada con respecto a sexos, ya que el 52% de la población era de sexo masculino y el restante 48%, de sexo femenino. En comparación con la literatura publicada, en donde predominaba ampliamente el sexo masculino (73% vs. 26%), nuestro trabajo muestra una diferencia menor entre ambos sexos.28
En comparación con el estudio de Thota y col., en el que se informó una prevalencia del 9% (167 pacientes de un total de 1791),25 nuestro trabajo demostró una prevalencia mayor de EB, siendo la misma del 25%. Cabe destacar que el 52,5% de la población en estudio presentó metaplasia columnar.
Con respecto a los factores de riesgo, en nuestro estudio se observó que el sexo masculino (OR: 1,57 [IC95% 1,14-2,18; p = 0,006]) y la presencia de HH (OR: 1,77 [IC95% 1,29-2,42; p < 0,0001]) son factores independientes para el desarrollo de EB-UC. Estos resultados avalan los ya demostrados previamente en la literatura.
Se evidenció un IMC de 26 ± 4 kg/m2, similar al de otros trabajos publicados (IMC 28,4 kg/m2);28 sin embargo, en el análisis multivariado no se comprobó que fuera un factor independiente.
Nuestro estudio presenta algunas limitaciones. En primera instancia, es un estudio restrospectivo, sin poder realizar seguimiento de los pacientes. Si bien no se observó displasia en ninguna de las muestras histológicas, el seguimiento de estos pacientes a lo largo de los años podría aportar datos valiosos.
Otra limitación la representa el no haber evaluado la variabilidad interobservador, ya que un estudio demostró que existe variabilidad de ± 1 cm entre longitud de la lengüeta medida y su tamaño preciso en el simulador utilizado; con un 47% de sobreestimación y un 37% subestimación.29
Conclusiones
Nuestro trabajo, siendo el primer estudio en Argentina, demostró una prevalencia del 25% de EB-UC en sujetos sometidos a una primera endoscopía en la que se evidenció lengüetas esofágicas menores a 1 cm, siendo mayor al reportado en la literatura internacional. El sexo masculino y la HH se relacionan en forma independiente con la presencia de EB-UC. Se demostró que no existe presencia de displasia en el EB-UC por lo que no se recomendaría biopsiar inicialmente, aunque se necesitarían mayores datos y estudios que evalúen el seguimiento para valorar si sería conveniente realizar screening de estos pacientes.
Conflicto de intereses. No existieron conflictos de interés.
Referencias
- Barreda Bolaños F, et al. Esófago de Barrett. Revista de Gastroenterología del Perú 2002; 22 (1): 46-68.
- Fitzgerald R, et al. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett’s oesophagus. Gut 2014; 63: 7-42.
- Shaheen NJ, Falk GW, Iyer PG, Gerson LB; American College of Gastroenterology. ACG Clinical Guideline: Diagnosis and Management of Barrett’s Esophagus. Am J Gastroenterol 2016; 111 (1): 30-50.
- Kuipers E, Spaander M. Natural History of Barrett´s Esophagus. Digestive Diseases and Sciences 2018; 63: 1997-2004.
- The role of endoscopy in Barrett´s esophagus and other premalignant conditions of the esophagus. Gastrointestinal Endoscopy 2012; 76: 1087-1094.
- Whiteman DC, et al. Australian clinical practice guidelines for the diagnosis and management of Barrett´s esophagus and early esophageal adenocarcinoma. J Gastroenterol Hepatol 2015; 30: 804-820.
- Schlottmann F, Molena D, Patti MG. Gastroesophageal reflux and Barrett’s esophagus: a pathway to esophageal adenocarcinoma. Updates Surg 2018; 70 (3): 339-342.
- Quante M, et al. Insights into the pathophysiology of esophageal adenocarcinoma. Gastroenterology 2018; 154: 406-420.
- Bhat S, et al. Risk of malignant progression in Barrett´s esophagus patients: results from a large population-based study. J Natl Cancer Inst 2013; 105 (8): 581.
- Clermont M, Falk GW. Clinical Guidelines Update on the Diagnosis and Management of Barrett’s Esophagus. Dig Dis Sci 2018; 63 (8): 2122-2128.
- Sharma P, et al. The development and validation of an endoscopic grading system for Barrett´s esophagus: The Prague C&M criteria. Gastroenterology 2006; 131: 1392-1399.
- Allanson BM, et al. Early Barrett esophagus-related neoplasia in segments 1 cm or longer is always associated with intestinal metaplasia. Modern Pathology 2017; 30: 1170-1176.
- Öberg S, et al. Endoscopic Surveillance of Columnar-Lined Esophagus. Ann Surg 2001; 234 (5): 619-626.
- Spechler SJ, et al. American gastroenterological association medical position statement on the management of Barrett´s esophagus. Gastroenterology 2011; 140: 1084-1091.
- Rex D, et al. Screening for Barrett´s Esophagus in Colonoscopy Patients with and without heatburnt. Gastroenterology 2003; 125: 1670-1677.
- Harrison R, et al. Detection of intestinal metaplasia in Barrett’s esophagus: an observational comparator study suggests the need for a minimum of eight biopsies. Am J Gastroenterol 2007; 102: 1154-1161.
- Gatenby PA, Ramus JR, Caygill CP, et al. Relevance of the detection of intestinal metaplasia in non-dysplastic columnar-lined oesophagus. Scand J Gastroenterol 2008; 43: 524-530.
- Kandiah K, et al. International development and validation of a classification system for the identification of Barrett´s neoplasia using acetic acid chromoendoscopy: the Portsmouth acetic acid classification (PREDICT). Gut 2017; 0: 1-7.
- Chaurand-Lara M, et al. Narrow Band Imaging to Identify Short & Ultra-Short Segment Barrett’s Esophagus in the Presence of An Irregular Squamocolumnar Junction. Gastrointestinal Endoscopy 2009; 69 (5): AB354.
- Spechler SJ, et al. Prevalence of metaplasia at the gastro-oesophageal junction. Lancet 1994; 344: 1533-1536.
- Goldblum J. Ultrashort-segment Barrett’s oesophagus, carditis and intestinal metaplasia at the oesophagogastric junction: Pathology, causation and implications. Current Diagnostic Pathology 2003; 9: 228-234.
- Sharma P, et al. Relative risk of dysplasia for patients with intestinal metaplasia in the distal oesophagus and in the gastric cardia. Gut 2000; 46: 9-13.
- Soucy G, et al. Histologic features associated with columnar-lined esophagus in distal esophageal and gastroesophageal junction (GEJ) biopsies from GERD patients: a community-based population study. Am J SurgPAthol 2016; 40: 827-835.
- Pohl H, et al. Length of Barrett’s oesophagus and cancer risk: implications from a large sample of patients with early oesophageal adenocarcinoma. Gut 2015; 0: 1-6.
- Thota P, et al. Low risk of High-Grade Dysplasia or Esophageal Adenocarcinoma among patients with Barrett’s Esophagus less than 1 cm (Irregular Z Line) within 5 years of Index endoscopy. Gastroenterology 2017; 152: 987-992.
- Pascarenco O, et al. Barrett´s Esophagus and Intestinal Metaplasia of Gastric Cardia: Prevalence, Clinical, Endoscopic and Histological Features. J Gastrointestin Liver Dis 2014; 23 (1): 19-25.
- Jung KW, et al. Epidemiology and natural history of intestinal metaplasia of the GOJ and Barrett´s Esophagus: a population-based study. Am J Gastroenterol 2011; 106 (8): 1447-1455.
- Leodolter A, et al. Progression of specialized intestinal metaplasia at the cardia to macroscopically evident Barrett´s esophagus: an entity of concern in the ProGERD study. Scandinavian Journal of Gastreonterology, 2012; 47: 1429-1435.
- Guda N, et al. Inter and intra-observer variability in the measurement of length at endoscopy implications for the measurement or Barrett´s esophagus. Gastrointestinal Endoscopy 2004; 59 (6): 655-658.
Correspondencia: Mariana Martín Quirán
Charcas 3074, piso 7, depto. 32 (C.P.: 1425). Ciudad Autónoma de Buenos Aires, Argentina / Tel.: 011-1561561849
Correo electrónico: marianamartin@gedyt.com.ar
Acta Gastroenterol Latinoam 2020;50(4):418-423
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE