Javier Molina-Infante1, 2 ID · Alfredo J Lucendo2, 3, 4 ID
1 Servicio de Aparato Digestivo, Hospital Universitario de Cáceres, Cáceres, España.
2 Centro de Investigación Biomédica en Red Enfermedades Hepáticas y Digestivas (CIBEREHD), Madrid, España.
3 Hospital General de Tomelloso, Ciudad Real, España.
4 Instituto de Investigación Sanitaria de Castilla-La Mancha (IDISCAM).
Acta Gastroenterol Latinoam 2022;52(4):439-452
Recibido: 30/10/2022 / Aceptado: 11/12/2022 / Publicado online el 21/12/2022 / https://doi.org/10.52787/agl.v52i4.270
Resumen
La esofagitis eosinofílica (EoE) es una enfermedad inmunoalérgica crónica causada, en la mayoría de los casos, por una alergia alimentaria no IgE mediada. Su prevalencia actual es superior a 1 caso por cada 1000 habitantes en España y Europa, mientras que es emergente en el continente sudamericano. Esta revisión trata de actualizar las novedades terapéuticas aparecidas en los últimos 5 años para inducción y mantenimiento en esta patología, incluyendo la aparición de nuevos fármacos antiácidos (inhibidores del ácido competitivos del potasio), la simplificación de los esquemas dietéticos, la aparición de nuevos corticoides deglutidos diseñados específicamente para el tratamiento tópico, así como la incorporación de fármacos biológicos al algoritmo terapéutico de la enfermedad. La dilatación endoscópica continúa siendo un complemento eficaz y seguro para la mejoría sintomática, en combinación con tratamientos antiinflamatorios de la enfermedad.
Palabras claves. Esofagitis eosinofílica, inhibidor de la bomba de protones, corticoides tópicos, dieta, fármacos biológicos, dilatación.
Therapeutic Developments in Eosinophilic Esophagitis
Summary
Eosinophilic esophagitis (EoE) is a chronic immunoallergic disorder caused, in most cases, by a non-IgE mediated food allergy. Its current prevalence exceeds 1 case per 1,000 inhabitants in Spain and Europe, while it is emerging in South America. This review attempts to update the therapeutic novelties that have appeared in the last 5 years for either induction or maintenance in this pathology, including new anti-acid drugs (potassium competitive acid blockers), simplified optimization of dietary schemes, novel swallowed topical corticosteroids specifically developed for esophageal delivery, as well as the incorporation of biologic agents into the therapeutic algorithm of the disease. Endoscopic dilation continues to be a safe and effective complement for symptomatic improvement, in combination with anti-inflammatory treatments for the disease.
Keywords. Eosinophilic esophagitis, proton pump inhibitor, topical corticosteroid, diet, biologics, dilation.
Abreviaturas
EoE: Esofagitis eosinofílica.
eos/cga: eosinófilos por campo de gran aumento.
ERGE: Enfermedad por reflujo gastroesofágico.
IBP: Inhibidor de la bomba de protones.
Introducción
La esofagitis eosinofílica (EoE) es una enfermedad inflamatoria del esófago de carácter crónico, caracterizada clínicamente por presentar síntomas de disfunción esofágica. Histológicamente se observa una inflamación esofágica en la que predominan los leucocitos eosinófilos, habitualmente más de 15 eosinófilos por campo de gran aumento (eos/cga).1 Actualmente, se considera como una forma distinta de alergia alimentaria no mediada por IgE desencadenada en forma predominante, pero no exclusivamente, por antígenos alimentarios.1, 2 La incidencia y prevalencia (al ser una enfermedad crónica) de la EoE han sufrido un crecimiento aritmético constante desde la caracterización inicial de esta condición, a principios de los años 1990, como un síndrome clínicopatológico distinto de la gastroenteritis eosinofílica, por dos grupos independientes de investigadores en Estados Unidos y Suiza.3, 4 Casi 30 años después, la EoE ha dejado de ser una enfermedad rara,5 con cifras actualizadas de prevalencia alrededor de 1 de cada 1000 habitantes en Europa y Norteamérica,6-8 mientras que su frecuencia, aunque notablemente inferior, comienza a ascender progresivamente en el continente sudamericano.9 La EoE representa en la actualidad la segunda causa de esofagitis crónica tras la enfermedad por reflujo gastroesofágico (ERGE) y la principal causa de disfagia e impactación alimentaria en niños y adultos jóvenes.1
Esta revisión trata de actualizar el conocimiento sobre cómo tratar la enfermedad en el momento que se cumplen tres décadas desde su descripción inicial, sin entrar por tanto en consideraciones fisiopatológicas o diagnósticas. El algoritmo terapéutico propuesto en las últimas guías clínicas de 2017 sigue plenamente vigente1 con tres terapias de primera línea a elegir entre fármacos inhibidores de la bomba de protones (IBP), corticoides tópicos deglutidos o restricciones dietéticas empíricas. El papel a desempeñar por los fármacos biológicos y las nuevas moléculas en desarrollo en este algoritmo es el principal cambio a tener en cuenta. Se revisarán de manera detallada los datos actualizados de eficacia y seguridad de cada una de las intervenciones terapéuticas, tanto en las etapas de inducción como de mantenimiento. De igual manera, se expondrá la información emergente sobre nuevos fármacos (bloqueadores de ácido competitivo del potasio, nuevos corticoides tópicos y biológicos) y mejoras dietéticas optimizadas, destacando cuál es el probable lugar que ocuparían en el futuro próximo.
1. Fármacos supresores de la secreción ácida
Inhibidores de la bomba de protones (IBP)
Inducción
Estudios prospectivos iniciales realizados en España documentaron que el tratamiento con IBP es capaz de inducir la remisión histológica de la enfermedad (definida como una reducción del infiltrado eosinofílico por debajo de los 15 eos/cga en el 50% y 57% de los pacientes adultos y pediátricos, respectivamente.10, 11 La primera revisión sistemática con metaanálisis (2016), incluyendo 33 estudios con 619 pacientes con EoE, demostró que los IBP inducían la remisión histológica en el 50,5% (IC del 95%: 42,2 – 58,7%) y mejoría sintomática en el 60,8% de los pacientes tratados, sin documentar diferencias significativas respecto a la edad de los pacientes, el diseño del estudio o el tipo de IBP evaluado.12 Se observó una tendencia hacia una mayor eficacia cuando se repartió la dosis total en dos tomas al día, y entre los pacientes con un reflujo gastroesofágico patológico en la pHmetría.12 Actualmente, las dosis recomendadas de IBP en adultos son omeprazol 20-40 mg dos veces al día o equivalente; en niños, 1-2 mg/kg de omeprazol al día o equivalente. En 2020 se publicó el mayor estudio realizado hasta la fecha, con datos prospectivos de eficacia de IBP como terapia de inducción en 630 pacientes (76 niños) provenientes del Registro Europeo de Esofagitis Eosinofílica (EoE Connect)13 mostrando una eficacia global del 48%, definida como un pico de < 15 eos/cga tras el tratamiento; dos tercios de los respondedores presentaron remisión profunda, definida por < 5 eos/cga. No se observaron diferencias en la eficacia de los distintos fármacos IBP cuando se emplearon a dosis equivalentes. Un subanálisis posterior demostró que, entre los pacientes respondedores, los IBP permitían la reversión de la fibrosis esofágica asociada a la inflamación eosinofílica, aunque más lentamente que los corticoides tópicos.14 En resumen, los IBP como terapia de inducción provocan la remisión histológica de la enfermedad en la mitad de los pacientes pediátricos y adultos.
Mantenimiento
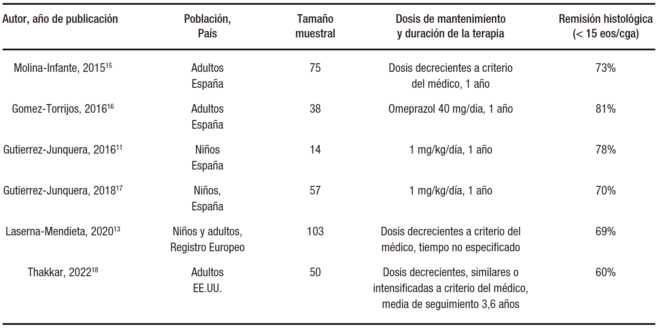
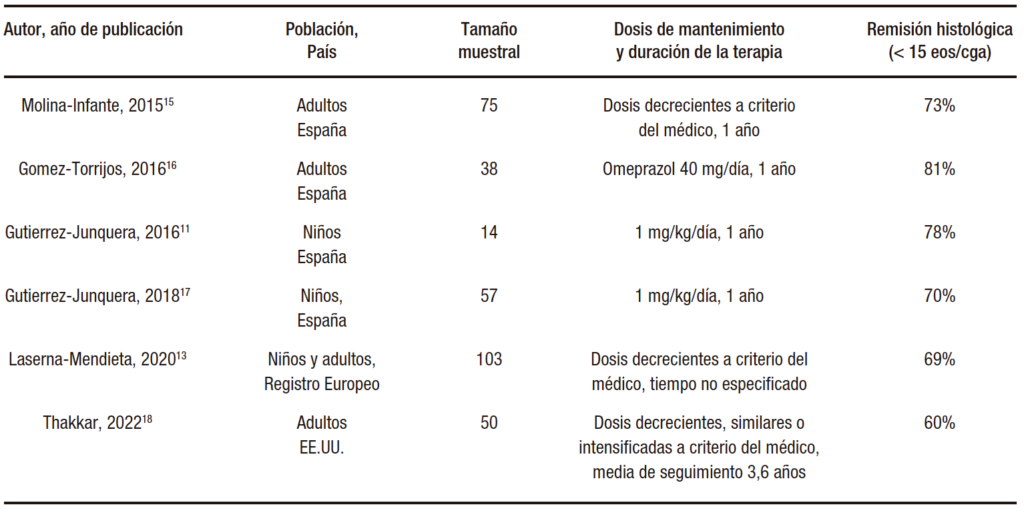
Una vez documentada la remisión de la enfermedad con IBP, diversos estudios han evaluado diferentes esquemas de mantenimiento con resultados de eficacia similares.15-19 Las dosis de IBP y duración, así como la eficacia histológica en estos estudios, se encuentran detalladas en la Tabla 1. De manera global, el uso de dosis decrecientes de IBP de mantenimiento tras el éxito en la inducción condiciona la remisión sostenida histológica en el 60-80% de los pacientes. Entre los pacientes en los que recidiva la inflamación con la bajada de dosis de IBP, la mayoría (70%) pueden recuperar la remisión volviendo a aumentar la dosis de IBP hasta los valores iniciales utilizados en la inducción.15 En la bibliografía médica reciente, los factores predictores de buena respuesta a IBP de mantenimiento son la remisión histológica profunda con el tratamiento de inducción (< 5 o < 1 eos/cga), un perfil metabolizador lento de CYP2C19 y la ausencia de comorbilidades alérgicas, especialmente la rinoconjuntivitis inducida por la sensibilización a los aeroalérgenos.15,19 No existen datos publicados sobre problemas de seguridad de los IBP a mediano plazo en pacientes con EoE.
Tabla 1. Resultados de eficacia de los IBP como tratamiento de mantenimiento, con información sobre dosis de mantenimiento y duración de los estudios
Bloqueador de ácido competitivo del potasio
Existe un nuevo grupo emergente de fármacos bloqueadores del ácido que actúan mediante un mecanismo distinto a los IBP, dado que compiten de manera selectiva y reversible con los canales de potasio de la célula parietal gástrica. Se denominan bloqueadores de ácido competitivo del potasio; fueron originalmente desarrollados en Japón y los más estudiados han sido vonoprazán y, en menor medida, tegoprazán. Comparados con cualquier IBP, se caracterizan por inducir una reducción de la producción de ácido más rápida, más potente, más estable y sostenida en el tiempo y sin estar influida por los alimentos.20 La primera serie de pacientes con EoE tratados con estos fármacos fue publicada en 2016 por autores japoneses. En esta serie, de cuatro pacientes con EoE que no consiguieron la remisión histológica con IBP (esomeprazol 20 mg/día durante 3 meses, dosis tal vez infraterapéuticas), tres de ellos fueron tratados exitosamente a posteriori con vonoprazán 20 mg/12 h durante 3 meses.21 En el año 2021, se publica también en Japón el primer estudio retrospectivo no aleatorizado, que incluyó a 114 pacientes con EoE tratados con rabeprazol 10 mg (n=22) o 20 mg (n=34), esomeprazol 20 mg (n=22) y vonoprazan 20 mg (n=33) administrados una vez al día durante al menos 2 meses, con seguimiento clínico y endoscópico posterior22. Se documentó una remisión histológica similar entre grupos (30-40%), sin poder encontrarse diferencias entre ellos, probablemente debido al bajo tamaño muestral.22 Estos resultados preliminares deben ser validados fuera de Japón. Teniendo en cuenta que tanto los IBP como el vonoprazán son inhibidores de la secreción ácida, uno podría pensar que la ERGE es la causa de la EoE en estos pacientes y que, por tanto, se curan con estos medicamentos simplemente por su acción antiácida. Ya ha sido ampliamente demostrado que la respuesta a IBP puede acontecer con exposición ácida esofágica fisiológica o patológica en la pHmetría,12, 23 además la EoE y la ERGE no son entidades mutuamente excluyentes, sino que es frecuente que coexistan y puedan ser independientes o interaccionar bilateralmente.23 Independientemente del ácido, se han descrito efectos antiinflamatorios (antialérgicos) in vitro del omeprazol, que es capaz de inhibir la secreción de eotaxina-3 (la principal molécula atrayente de eosinófilos al esófago) al ser añadida a cultivos de epitelio esofágico estimulados con IL-4 e IL-13.24 Recientemente, estos mismos efectos antiinflamatorios han sido confirmados en cultivos celulares de EoE para IBP y bloqueadores del ácido competitivo del potasio, efecto que parece estar mediado por una bomba de protones no gástrica.25 De igual manera que fue expresado con anterioridad, los efectos antiácidos y antiinflamatorios de los IBP o el vonoprazán no son excluyentes, sino que incluso pueden coexistir en el mismo paciente con EoE.
2. Dietas empíricas de eliminación
Inducción
El gran atractivo del tratamiento dietético para la EoE procede de la posibilidad de mantener la enfermedad en remisión sin necesidad de fármacos. La alimentación exclusiva mediante una dieta elemental (formulaciones líquidas de aminoácidos desprovistas de capacidad antigénica sin tomar otro alimento alternativo) es la intervención dietética más eficaz (90%), pero inviable a mediano y largo plazo.26 La eliminación dirigida de alimentos en función de los resultados de las pruebas de alergia es ineficaz en adultos y con resultados contradictorios en niños.26 Por tales motivos el estándar actual en la práctica clínica son las dietas de eliminación empírica de los alimentos más frecuentemente implicados en la aparición de EoE. Esta aproximación terapéutica ha sufrido una inversión conceptual en los últimos años, desde dietas iniciales marcadamente restrictivas con eliminación de hasta seis grupos alimentarios (dieta de 6 alimentos)27 hasta los esquemas actuales, donde se inicia retirando leche de vaca en niños o los dos alimentos más comunes en adultos, y se escala en el nivel de retirada progresivamente según la respuesta clínica.28 Los datos de eficacia y aspectos a tener en cuenta en cada nivel de este esquema de eliminación dietética progresiva se encuentran resumidos en la Tabla 2.
Tabla 2. Resultados de eficacia de las dietas de eliminación empírica progresivas como tratamiento de inducción, con aspectos prácticos a tener en cuenta
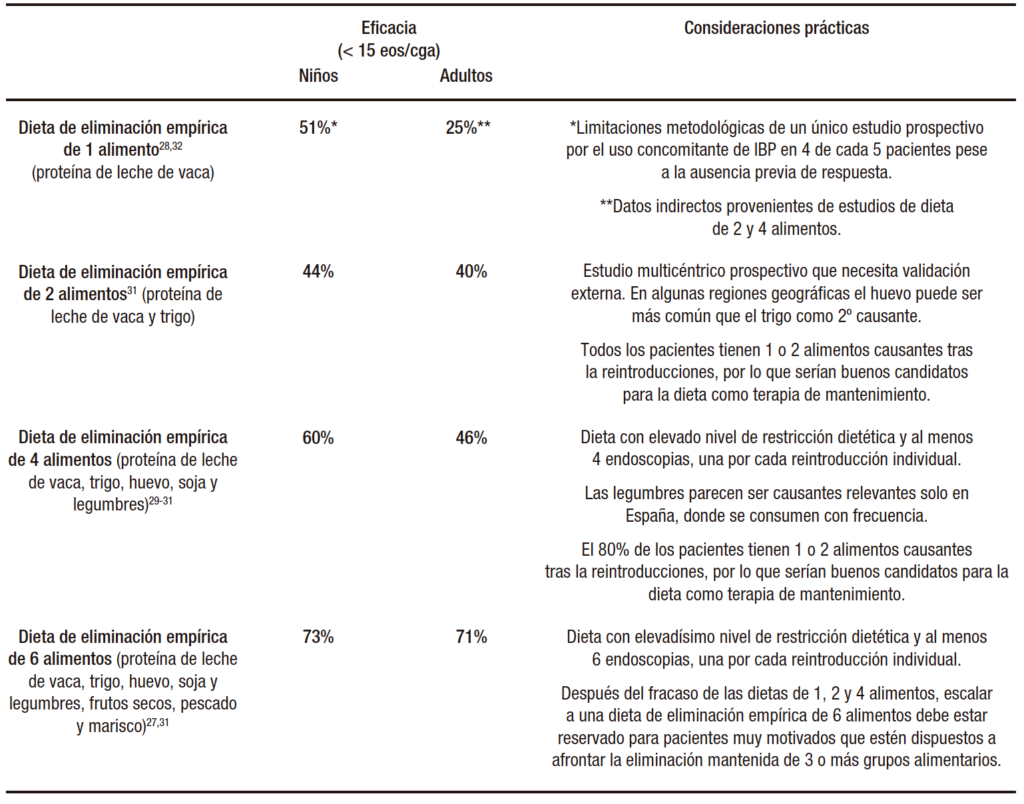
La dieta de 6 alimentos (proteína de leche de vaca, trigo, huevo, soja, frutos secos, pescados y mariscos) tiene una eficacia homogénea del 72% en niños y adultos demostrada en un metaanálisis de siete estudios observacionales.26 Los estudios iniciales, donde se hacían 6 reintroducciones individuales de alimentos con 6 endoscopias en un proceso que se prolongaba casi durante un año, reveló que la leche de vaca es el principal causante de la enfermedad, especialmente en niños, seguido del trigo y los huevos.26 La soja (EE.UU.) y las legumbres (España) parecen relevantes en países con elevado consumo local, mientras que los frutos secos, el pescado y el marisco apenas producen la enfermedad. De igual modo, la gran mayoría de los pacientes respondedores a la dieta de 6 alimentos tienen 1 o 2 alimentos causantes después de un proceso tan largo con tantos procedimientos endoscópicos, es decir, que había margen de simplificación y optimización de las dietas.26, 29 Esta fue la base racional para el diseño de la dieta de 4 alimentos (leche, trigo, huevo y leguminosas/soja), con una eficacia global para lograr la remisión histológica de la EoE del 54% en adultos29 y del 64% en niños.30 Más recientemente un estudio multicéntrico prospectivo ha evaluado la eficacia de una dieta de eliminación de 2 alimentos (leche y trigo) en 125 pacientes pediátricos y adultos, seguida por una de 4 alimentos en los casos sin resolución histológica, reservando la dieta de 6 alimentos como última opción de rescate en ausencia de respuesta a la de 4 alimentos.31 Este acercamiento terapéutico escalonado (2-4-6) logró tasas de remisión clínica e histológica del 43%, 60% y 79%, respectivamente, evitando numerosas restricciones dietéticas innecesarias, reduciendo en un 20% el número de endoscopias y el tiempo de proceso diagnóstico, comparado con comenzar directamente con una dieta de eliminación empírica de 6 alimentos.31 Una ventaja adicional es que el 90% de los respondedores a una dieta empírica de eliminación de 2 o 4 alimentos en este proceso progresivo de escalada tendrá únicamente uno o dos alimentos causantes, siendo éstos los mejores candidatos para el mantenimiento con dieta.31 En 2022 se ha publicado el primer estudio multicéntrico prospectivo en niños (n=41, media de edad 9 años), evaluando la eficacia de la eliminación de la leche de vaca en pacientes con ausencia de respuesta a IBP documentada con anterioridad.32 El 51% de los pacientes alcanzó la remisión histológica con este esquema, aunque cabe destacar que en la inmensa mayoría (85%) de los pacientes evaluados se mantuvo el co-tratamiento con IBP con la dieta evaluada.32 Esta limitación metodológica siembra la duda acerca de si no se incluyeron respondedores parciales o lentos a IBP, que respondieron a esta molécula en un segundo tiempo sin influencia de la dieta, o bien pacientes en los que puede haber una sinergia entre tratamientos combinados con dieta e IBP.
Mantenimiento
Una vez identificados los alimentos responsables de la EoE en cada paciente mediante reintroducción individual seguida de endoscopia, la evitación a largo plazo mantiene la remisión de la enfermedad en el 100% de los pacientes que se adhieren de manera firme a la dieta.19 Desafortunadamente, menos del 40% de los pacientes son capaces de mantener un nivel de restricción dietético continuado en el tiempo, evitando alimentos muy ubicuos en las dietas modernas como la leche, el trigo y el huevo.19, 33 Según recientes descripciones, las dietas altamente restrictivas pueden generar desórdenes alimentarios adaptativos, incluido el recientemente descrito trastorno de evitación/restricción patológica de alimentos.34 Una adecuada selección de pacientes para hacer dieta como tratamiento de inducción y mantenimiento es clave para evitar este tipo de desórdenes psicológicos.
Un avance significativo reciente para el tratamiento de mantenimiento dietético en pacientes con EoE documentada por proteína de leche de vaca es la descripción de la tolerancia a 400 cc diarios de leche esterilizada durante 2 meses (calentada hasta la ebullición durante 20-30 minutos) en el 66% de los pacientes, sin síntomas y sin recidiva histológica.35 Este es un primer paso de gran valor hacia una mejoría o normalización dietética y social en los pacientes cuya enfermedad es provocada por el alimento más comúnmente implicado en la EoE, la proteína de leche de vaca.
3. Corticoides deglutidos tópicos
Inducción
Diversas revisiones sistemáticas y metaanálisis han demostrado la eficacia de los corticoides tópicos deglutidos para inducir la remisión histológica en la EoE.36-38 Sin embargo, los resultados se deben interpretar con cautela por el tamaño muestral bajo y la marcada variabilidad en los criterios de inclusión de los estudios, los fármacos utilizados (fluticasona o budesonida), criterios de remisión histológica (desde < 1 eos/cga a < 15 eos/cga), dosis diarias, duración del tratamiento y modos de aplicación del fármaco. Los resultados de las principales novedades publicadas en los últimos 5 años están esquematizados en la Tabla 3.
Tabla 3. Datos de eficacia de los corticoides tópicos deglutidos como terapia de inducción de la esofagitis eosinofílica en los últimos 5 años, ordenados de mayor a menor remisión histológica
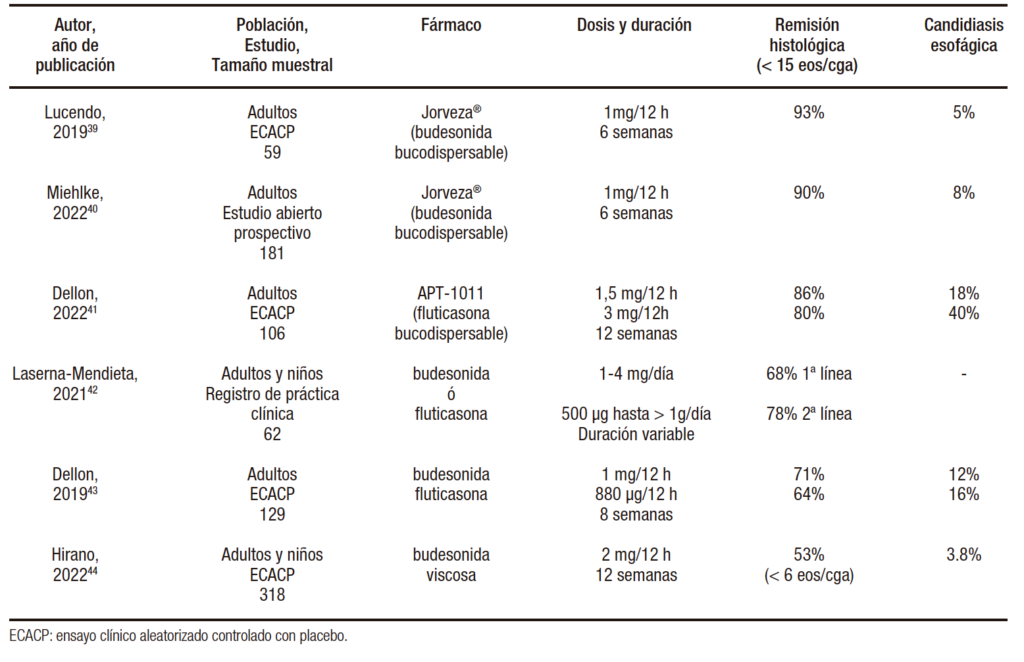
Una nueva fórmula de budesonida, administrada en comprimidos efervescentes orodispersables específicamente diseñados para la liberación del fármaco en el esófago (Jorveza®), tiene hasta la fecha los mejores resultados en términos de remisión histológica (93%) en un plazo de tan sólo seis semanas, en el marco de un ensayo clínico multicéntrico europeo controlado con placebo.39 Estos resultados han sido recientemente corroborados en un estudio abierto de extensión del ensayo clínico inicial fase 3, con una eficacia similar del 90% en 181 pacientes adultos tras el tratamiento durante 6 semanas.40 Un reciente ensayo clínico controlado con placebo ha evaluado la eficacia de una nueva formulación de fluticasona bucodispersable (APT-1011) en varias dosis y horarios de administración durante 12 semanas.41 Las dosis fraccionadas en la mañana y en la noche obtuvieron los mejores resultados en términos de remisión histológica (1,5 mg/12h (86%), 3 mg/12 h (80%), 3 mg/noche (67%), 1,5 mg/noche (48%).41 Destaca la elevada presencia de candidiasis esofágica en el grupo de administración fraccionada, especialmente con dosis más altas (40% en el grupo 3 mg/12h). Un estudio procedente del Registro Europeo de Pacientes EoE Connect42 y un primer ensayo clínico aleatorizado43 no han podido demostrar diferencias en términos de eficacia (entre 60-75%) entre fluticasona y budesonida, bien líquida o en formulación viscosa. Finalmente, estos resultados subóptimos han sido refrendados en un ensayo clínico aleatorizado con placebo de gran tamaño muestral con una formulación diferente de budesonida, que solo alcanzó una eficacia del 53%, si bien se utilizaron criterios histológicos más estrictos (remisión histológica definida como < 6 eos/cga en vez de < 15 eos/cga).44
Mantenimiento
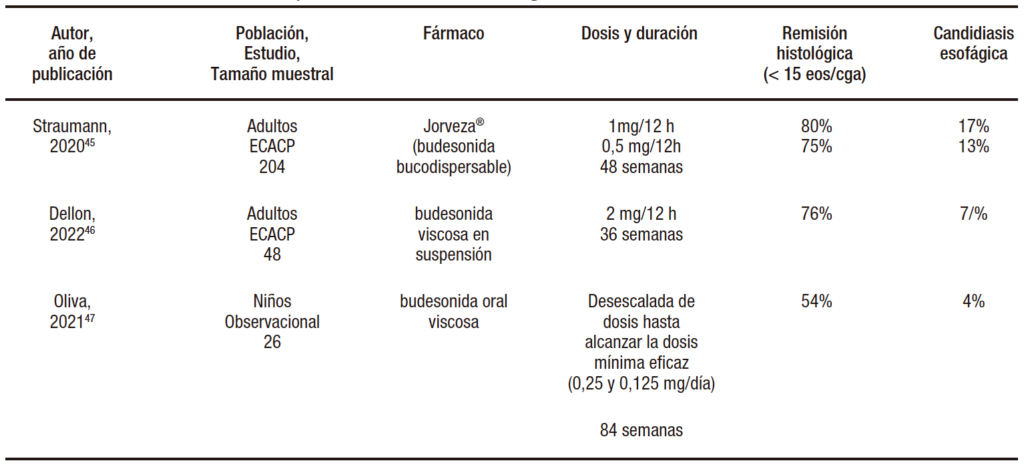
En pacientes respondedores a corticoides en el período de inducción, la pérdida de respuesta durante el tratamiento de mantenimiento, incluso con la misma dosis utilizada durante la inducción, es la norma en el 25 al 50% de los casos. Los datos más relevantes aparecidos en los últimos 5 años han sido resumidos en la Tabla 4. La eficacia de Jorveza®, que es el corticoide más eficaz actualmente en el periodo de inducción, disminuye hasta 80% cuando utilizamos durante 48 semanas la misma dosis que durante la inducción (1 mg/12 h), y hasta 75% usando la mitad (0,5 mg/12 h).45
De igual manera, una formulación específica de solución en gel de budesonida a dosis muy altas (2 mg/12 h) demostró una eficacia del 76% en el tratamiento de mantenimiento.46 Por último, un reciente estudio en niños ha evidenciado similares resultados, siendo la pérdida de eficacia aún mayor (46%) cuando buscamos reducciones de la dosis diaria hasta alcanzar la dosis mínima eficaz.47 Es importante reseñar el buen perfil de seguridad de los corticoides tópicos utilizados de manera continua durante 1 año, con efectos secundarios leves y poco comunes, habitualmente candidiasis oral o esofágica (ver Tabla 4).
Tabla 4. Datos de eficacia de los corticoides tópicos deglutidos como terapia de mantenimiento de la esofagitis eosinofílica en los últimos 5 años, ordenados de mayor a menor remisión histológica
4. Fármacos biológicos
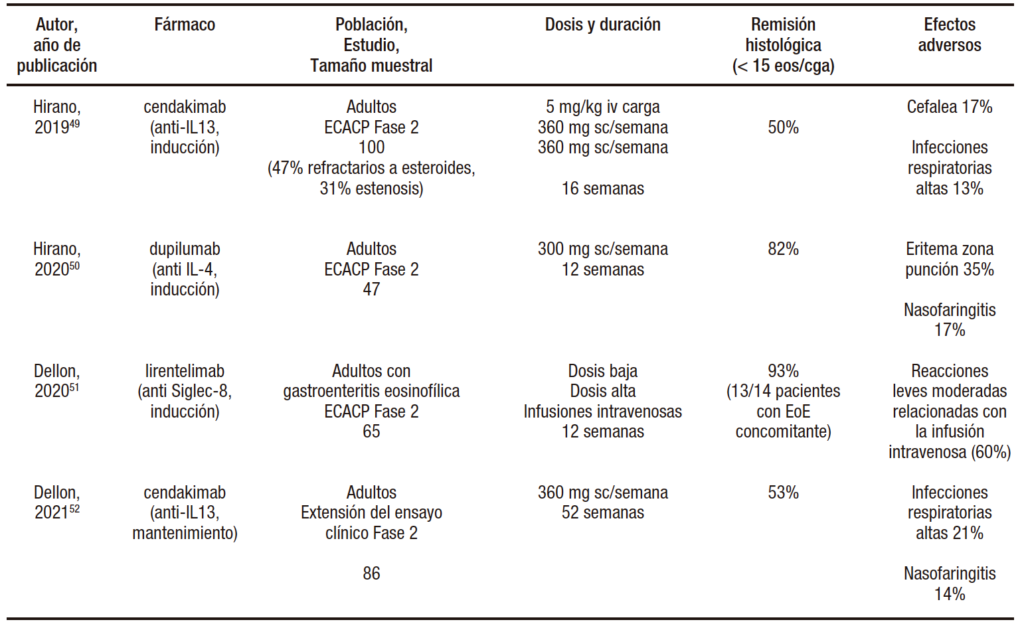
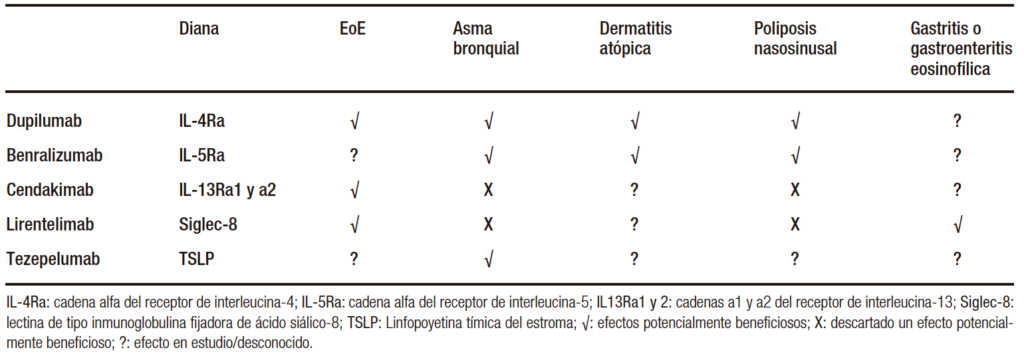
Los fármacos biológicos aparecen en la EoE para dar respuesta a los pacientes refractarios a cualquiera de los tratamientos disponibles. Estos fármacos tratan de controlar la inflamación aberrante Th2 presente en la enfermedad mediante el bloqueo de las principales interleucinas y mediadores inmunológicos implicados (IL-4, IL-5, IL-13, Siglec-8), o bloqueando la migración de los linfocitos hacia los tejidos. Actualmente, los fármacos con ensayos fase 2 completados son cendakimab (anti-IL13) y lirentelimab (anti-Siglec-8), mientras que dupilumab ha completado la fase 3 (anti-IL4).48 De hecho, dupilumab es el primer fármaco aprobado oficialmente en Estados Unidos en Mayo del 2022 para tratar la EoE en adolescentes y adultos, antes que cualquier corticoide tópico. Los resultados de eficacia y seguridad de los principales ensayos clínicos publicados hasta la fecha se encuentran en la Tabla 5.
Tabla 5. Datos actualizados de eficacia de los fármacos biológicos como terapia de inducción y mantenimiento en la esofagitis eosinofílica
Cendakimab (anti-IL13) ha demostrado ser eficaz para reducir el infiltrado inflamatorio eosinofílico por debajo del umbral de diagnóstico de 15 eos/cga en la mitad de los pacientes tratados durante 16 semanas,49 si bien únicamente un 20 a 25% lograron el objetivo primario de < 6 eos/cga. Entre los pacientes respondedores, el tratamiento logró mantener la remisión durante 52 semanas.51 Sin embargo, la mejoría sintomática no fue significativamente superior a la conseguida con placebo. Cabe destacar que en estos 2 estudios consecutivos se incluyó mayoritariamente un perfil de pacientes con una elevada proporción de estenosis esofágica (30%) y de refractariedad previa a los corticoides (47%).
Con respecto a dupilumab (anti-IL4), el ensayo clínico fase 2 evidenció una eficacia superior en términos histológicos (82% de pacientes lograron reducir su inflamación por debajo de 15 eos/cga al cabo de 12 semanas, y un 65% logró < 6 eos/cga), cuando se administró a dosis de 300 mg semanales. El perfil de seguridad fue excelente.50 En un intento de mejorar esta eficacia en la inducción, el ensayo fase 3 extendió la duración de la terapia hasta 24 semanas, a la vez que evaluó una segunda pauta de dupilumab 300 mg administrados cada 2 semanas. Ambas pautas (300 mg cada semana o cada 2 semanas) resultaron igualmente efectivas para inducir la remisión histológica de la EoE (60% de pacientes alcanzaron < 6 eos/cga y 80% < 15 eos/cga), pero únicamente la administración semanal de dupilumab resultó superior al placebo para resolver los síntomas de la EoE.48 Los datos preliminares (sin publicar aún) parecen evidenciar una eficacia similar en niños pequeños. Además de la ganancia terapéutica, la principal ventaja de dupilumab es su eficacia en otras enfermedades alérgicas graves o mal controladas como la dermatitis atópica, el asma bronquial o la poliposis nasosinusal, por lo que podría ser un fármaco capaz de controlar varias enfermedades alérgicas a la vez. Esto ha quedado demostrado en numerosas publicaciones recientes acerca de la eficacia de dupilumab en la EoE cuando era indicado para otras atopías graves.53-55
Lirentelimab (anti-Siglec-8) es un fármaco destinado a generar una apoptosis precoz de los mastocitos y los eosinófilos cuando actúa en un entorno humoral de tipo Th2. Este nuevo fármaco es el primer biológico que ha demostrado una altísima eficacia clínica e histológica en pacientes adultos con gastritis y enteritis eosinofilicas.51 Entre los pacientes reclutados, 14 del grupo asignado a tratamiento activo presentaban EoE concomitante, y 13 de ellos (93%) alcanzaron también respuesta histológica con lirentelimab. De igual manera que el dupilumab, este fármaco podría constituir una excelente alternativa para la EoE cuando existe una enfermedad hipereosinofilica digestiva o extradigestiva concomitante. Ya ha sido completado un ensayo de lirentelimab realizado específicamente en pacientes con EoE, pero sus resultados aún aguardan a ser publicados. En todo caso, son necesarios estudios a largo plazo para determinar la eficacia y principalmente la seguridad de este prometedor fármaco.
Finalmente, existen estudios con otras moléculas en pacientes con EoE. Hace una década tres ensayos clínicos con los anticuerpos dirigidos a bloquear IL-5 con mepolizumab y reslizumab evidenciaron una falta de eficacia para mejorar significativamente los síntomas o la inflamación esofágica de la EoE en niños y adultos.56-58 Sin embargo, el interés terapéutico por bloquear la vía de IL-5 ha resurgido con el desarrollo de benralizumab, un nuevo anticuerpo esta vez dirigido a bloquear el receptor de IL-5Rα, en lugar de la citoquina soluble. Benralizumab ya ha sido aprobado para tratar el asma eosinofílica en adolescentes y adultos.59 Un ensayo fase 3 recién finalizado (no publicado aún) ha demostrado la superioridad de benralizumab frente a placebo para inducir la remisión histológica de la EoE; sin embargo, no se pudo demostrar que este fármaco resultara superior al placebo para controlar los síntomas. Finalmente, tezepelumab, un anticuerpo dirigido a la linfopoyetina estromal tímica, evaluado y aprobado como co-terapia en asma bronquial de difícil control, será evaluado próximamente en la EoE.60 Los fármacos orales ofrecen una administración y conservación más sencilla que los biológicos. Entre ellos, etrasimod, un antagonista de los receptores de esfingosina 1-fosfato que está en estudio en otras enfermedades inflamatorias e inmunomediadas, está siendo estudiado en pacientes adultos con EoE mediante un ensayo fase 2.60
5. Dilatación endoscópica
La dilatación con balones, bujías o dilatadores rígidos es el único tratamiento endoscópico disponible para la EoE, con una eficacia muy marcada en términos de mejoría sintomática (disfagia e impactación alimentaria), pero sin efecto sobre la inflamación subyacente. El más reciente metaanálisis publicado en 2017, que incluía 27 estudios observacionales (845 pacientes y 1820 dilataciones esofágicas), demostró una mejoría sintomática en el 95% de los pacientes tras la dilatación endoscópica (IC 95% 90%-98), siendo infrecuentes las complicaciones, como perforación (0,38% de los casos), hemorragia (0,05%) y hospitalización (0,67%), sin mortalidad alguna reportada.61 Dos artículos recientes desarrollados por el mismo grupo han mostrado que la disociación entre los síntomas y la actividad histológica, común tras cualquier tratamiento en pacientes en la EoE, puede ser anulada tras la dilatación esofágica.62,63 Esto apuntaría a que las alteraciones fibroestenóticas persistentes (incluso con un paso del endoscopio convencional sin resistencia aparente) podrían justificar esta disociación. Un documento de consenso internacional sobre el manejo endoscópico de la EoE, publicado en 2022, ha establecido un objetivo de calibre de referencia para aliviar la disfagia en adolescentes y adultos con EoE de 16 mm.64 Para alcanzar este calibre, la mayoría de los pacientes necesitarán más de una sesión de dilatación. Se recomienda el uso concomitante de medicación antiinflamatoria (que puede incluso mejorar o hacer desaparecer la estenosis), si bien parece seguro realizar una dilatación endoscópica sobre un esófago con inflamación residual no controlada.
6. Incertidumbres terapéuticas para la EoE
De considerarse una enfermedad huérfana de tratamientos específicos y poco interesante para la industria farmacéutica hace poco más de una década, la EoE se ha convertido en muy poco tiempo en una de las áreas de desarrollo farmacológico más activas en la gastroenterología y la alergología. La explosión epidemiológica que ha experimentado la EoE, con un crecimiento continuo en el número de casos, especialmente en la última década, su distribución en todos los continentes, su carácter crónico y las limitaciones en la eficacia de muchas alternativas terapéuticas han abierto un mercado potencial para nuevos fármacos, que con frecuencia son importados desde otras enfermedades inflamatorias o inmunomediadas. La creciente inversión económica en la EoE ha motivado un cierto desinterés científico hacia las opciones terapéuticas vigentes y efectivas, incluyendo los IBP (cuya eficacia a dosis dobles está bien demostrada en la mitad de los pacientes con EoE, según muestran estudios observacionales e incluso pequeños ensayos clínicos aleatorizados),65,66 las dietas de eliminación (con una eficacia entre 42-75%, y que si bien son difíciles de llevar a cabo a largo plazo, en los últimos años han sido objeto de escasísima investigación) y los corticoides convencionales de baja biodisponibilidad, generalmente usados fuera de ficha técnica (fluticasona, budesonida), y con una eficacia dependiente de la capacidad del vehículo en que se administran para llegar a la mucosa esofágica. De hecho, cabe destacar que las nuevas formulaciones dirigidas a alcanzar la mucosa esofágica proporcionan tasas de remisión clínica e histológica superiores a cualquier fármaco biológico, y sugieren que los comprimidos bucodispersables, en los que la saliva disuelve el fármaco que se adhiere a la mucosa esofágica por su capacidad muco-adhesiva, representan el vehículo ideal para el tratamiento tópico de la EoE. Además de Jorveza® (budesonida orodispersable),67 pronto podríamos tener disponible un nuevo comprimido de fluticasona orodispersable con eficacia comparable (APT-1011),41 y EsoCap, un nuevo dispositivo basado en una cinta adhesiva desplegable a lo largo del esófago impregnada en mometasona, actualmente en estudio.60 Cuando estas opciones no están disponibles, las formulaciones viscosas de budesonida serían la segunda alternativa. Sin embargo, no deberían utilizarse aplicaciones de corticoides tópicos liberados desde los sistemas de inhalación por su limitada eficacia, derivada de su escasa capacidad para proporcionar una dosis adecuada de medicación en el esófago. Ninguno de estos fármacos modifica la capacidad de respuesta sistémica del sistema inmune, ni plantearía problemas de inmunogenicidad con el uso a largo plazo.68 Los fármacos biológicos dirigidos contra la inflamación Th2 tienen menos efectos secundarios reportados, pero muchos son medicamentos nuevos y emergentes cuyos efectos adversos pueden materializarse con un uso más extenso, por lo que se requiere una monitorización de su seguridad a largo plazo.69
En cualquier caso, las nuevas terapias biológicas en investigación para la EoE deben considerarse como alternativas convenientes para pacientes que también sufren de asma bronquial, poliposis nasal persistente o dermatitis atópica de difícil control, que podrían beneficiarse de un único tratamiento capaz de controlar simultáneamente varias enfermedades. Mientras que los tratamientos efectivos con dietas, corticoides tópicos, e incluso IBP han demostrado su capacidad para revertir la remodelación fibrosa asociada a la EoE, este efecto aún no ha sido demostrado para ningún fármaco biológico. La Tabla 6 resume la eficacia de los diferentes fármacos biológicos para distintas enfermedades alérgicas.
Tabla 6. Eficacia potencial de los diferentes fármacos biológicos en desarrollo para el tratamiento de la EoE y para tratar diferentes enfermedades inmunoalérgicas concomitantes
El costo del tratamiento de la EoE aún no se ha abordado adecuadamente, pero estudios iniciales han demostrado que triplicaría el de los controles en la misma franja de edad.70 En el caso de la EoE pediátrica, un estudio en Estados Unidos ha mostrado que su costo asistencial superaría al de la enfermedad celiaca e incluso a la enfermedad de Crohn.71 Estos costos derivan principalmente de las visitas frecuentes al médico, los retrasos en el diagnóstico, la necesidad de endoscopias digestivas altas con biopsias para diagnóstico y seguimiento de la actividad de la enfermedad, y de los medicamentos que actualmente se usan fuera de la indicación oficial en muchos entornos.72 Las terapias más caras podrían aumentar aún más los costos de la EoE para las compañías de seguros y los sistemas de salud, dificultando la financiación de nuevas terapias. Hasta la fecha, los estudios de costo-efectividad para la EoE son muy escasos,73 pero representan en el contexto actual, con la aparición de los nuevos fármacos biológicos, una prioridad absoluta.
Es importante resaltar que no se ha explorado adecuadamente aún el papel de las combinaciones terapéuticas (IBP más corticoides, corticoides más dieta, etc.) en pacientes que responden parcialmente a tratamientos únicos, tanto para el tratamiento de inducción como de mantenimiento de la enfermedad. Tampoco se ha evaluado hasta ahora la posibilidad de alternar opciones terapéuticas en diferentes estadios de la enfermedad, como ocurre en otras enfermedades inflamatorias gastrointestinales crónicas. Estudios recientes han demostrado la existencia de diferentes endotipos de EoE, caracterizados por diferencias en la actividad inflamatoria, la intensidad de los síntomas, los cambios en la expresión génica en la mucosa del esófago y la tendencia a desarrollar fibrosis y estenosis.74, 75 Los pacientes con las formas más leves de EoE podrían beneficiarse, potencialmente, de una terapia de mantenimiento intermitente o a demanda, un aspecto que aún debe ser evaluado minuciosamente. En los próximos años las agencias reguladoras deberán considerar la aprobación y financiación de varios medicamentos para tratar la EoE, además de la budesonida bucodispersable ya disponible en la mayor parte de Europa y de dupilumab en Estados Unidos. Su incorporación a la práctica clínica dependerá en gran medida de los costos para los sistemas sanitarios y de una adecuada selección de los perfiles de pacientes candidatos a cada terapia, tanto en inducción como en mantenimiento.
Propiedad intelectual. Los autores declaran que los datos y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Molina-Infante Javier, Lucendo Alfredo J. Novedades terapéuticas en la esofagitis eosinofílica. Acta Gastroenterol Latinoam. 2022;52(4):439-452. https://doi.org/10.52787/agl.v52i4.270
Referencias
- Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, Amil Dias J, Bove M, González-Cervera J, Larsson H, Miehlke S, Papadopoulou A, Rodríguez-Sánchez J, Ravelli A, Ronkainen J, Santander C, Schoepfer AM, Storr MA, Terreehorst I, Straumann A, Attwood SE. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J 2017;5:335-58.
- Simon D, Cianferoni A, Spergel JM, Aceves S, Holbreich M, Venter C, Rothenberg ME, Terreehorst I, Muraro A, Lucendo AJ, Schoepfer A, Straumann A, Simon HU. Eosinophilic esophagitis is characterized by a non-IgE-mediated food hypersensitivity. Allergy 2016;71:611-20.
- Attwood SE, Smyrk TC, Demeester TR, Jones JB. Esophageal eosinophilia with dysphagia. A distinct clinicopathologic syndrome. Dig Dis Sci 1993;38:109-16.
- Straumann A, Spichtin HP, Bernoulli R, Loosli J, Vögtlin J. [Idiopathic eosinophilic esophagitis: a frequently overlooked disease with typical clinical aspects and discrete endoscopic findings]. Schweiz Med Wochenschr 1994;124:1419-29.
- Navarro P, Arias Á, Arias-González L, Laserna-Mendieta EJ, Ruiz-Ponce M, Lucendo AJ. Systematic review with meta-analysis: the growing incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther 2019;49:1116-1125.
- Molina-Infante J, Gonzalez-Cordero PL, Ferreira-Nossa HC, Mata-Romero P, Lucendo AJ, Arias A. Rising incidence and prevalence of adult eosinophilic esophagitis in midwestern Spain (2007-2016). United European Gastroenterol J 2018;6:29-37.
- Arias Á, Lucendo AJ. Incidence and prevalence of eosinophilic oesophagitis increase continiously in adults and children in Central Spain: A 12-year population-based study. Dig Liver Dis 2019;51:55-62.
- Robson J, O’Gorman M, McClain A, Mutyala K, Davis C, Barbagelata C, Wheeler J, Firszt R, Smith K, Patel R, Peterson K, Lowichik A, Guthery S. Incidence and Prevalence of Pediatric Eosinophilic Esophagitis in Utah Based on a 5-Year Population-Based Study. Clin Gastroenterol Hepatol 2019;17:107-114.e1.
- Pierre R, Vieira M, Vázquez R, Ninomiya I, Messere G, Daza W, Dadan S, Higuera M, Sifontes L, Harris P, Gana JC, Rodríguez M, Vasquez M, González M, Rivera J, Gonzales J, Angulo D, Cetraro MD, Del Compare M, López K, Navarro D, Calva R, Wagener M, Zablah R, Carias A, Calderón O, Vera-Chamorro JF, Toca MC, Dewaele MR, Iglesias C, Delgado L, León K, Hassan I, Ussher F, Follett F, Bernedo V, Grinblat V, Agüero N, Oviedo C, García AG, Salazar A, Coello P, Furnes R, Menchaca M, Fernández M, Khoury A, Rojo C, Fernández S, Morao C. Prevalence of eosinophilic esophagitis: A multicenter study on a pediatric population evaluated at thirty-six Latin American gastroenterology centers. Rev Gastroenterol Mex (Engl Ed). 2019;84:427-433.
- Molina-Infante J, Ferrando-Lamana L, Ripoll C, Hernandez-Alonso M, Mateos JM, Fernandez-Bermejo M, Dueñas C, Fernandez-Gonzalez N, Quintana EM, Gonzalez-Nuñez MA. Esophageal eosinophilic infiltration responds to proton pump inhibition in most adults. Clin Gastroenterol Hepatol 2011;9:110-7.
- Gutiérrez-Junquera C, Fernández-Fernández S, Cilleruelo ML, Rayo A, Echeverría L, Quevedo S, Bracamonte T, Román E. High Prevalence of Response to Proton-pump Inhibitor Treatment in Children With Esophageal Eosinophilia. J Pediatr Gastroenterol Nutr 2016;62:704-10.
- Lucendo AJ, Arias Á, Molina-Infante J. Efficacy of Proton Pump Inhibitor Drugs for Inducing Clinical and Histologic Remission in Patients With Symptomatic Esophageal Eosinophilia: A Systematic Review and Meta-Analysis. Clin Gastroenterol Hepatol 2016;14:13-22.e1.
- Laserna-Mendieta EJ, Casabona S, Guagnozzi D, Savarino E, Perelló A, Guardiola-Arévalo A, Barrio J, Pérez-Martínez I, Lund Krarup A, Alcedo J, de la Riva S, Rey-Iborra E, Santander C, Arias Á, Lucendo AJ; EUREOS EoE CONNECT Research group. Efficacy of proton pump inhibitor therapy for eosinophilic oesophagitis in 630 patients: results from the EoE connect registry. Aliment Pharmacol Ther 2020;52:798-807.
- Navarro P, Laserna-Mendieta EJ, Guagnozzi D, Casabona S, Perelló A, Savarino E, et al. Proton pump inhibitor therapy reverses endoscopic features of fibrosis in eosinophilic esophagitis. Dig Liver Dis 2021;53(11):1479-1485.
- Molina-Infante J, Rodriguez-Sanchez J, Martinek J, van Rhijn BD, Krajciova J, Rivas MD, Barrio J, Moawad FJ, Martinez-Alcalá C, Bredenoord AJ, Zamorano J, Dellon ES. Long-Term Loss of Response in Proton Pump Inhibitor-Responsive Esophageal Eosinophilia Is Uncommon and Influenced by CYP2C19 Genotype and Rhinoconjunctivitis. Am J Gastroenterol 2015;110:1567-75.
- Gómez-Torrijos E, García-Rodríguez R, Castro-Jiménez A, Rodríguez-Sanchez J, Méndez Díaz Y, Molina-Infante J. The efficacy of step-down therapy in adult patients with proton pump inhibitor-responsive oesophageal eosinophilia. Aliment Pharmacol Ther 2016;43:534-40.
- Gutiérrez-Junquera C, Fernández-Fernández S, Cilleruelo ML, Rayo A, Echeverría L, Borrell B, Román E. Long-term Treatment With Proton Pump Inhibitors Is Effective in Children With Eosinophilic Esophagitis. J Pediatr Gastroenterol Nutr 2018;67:210-216.
- Thakkar KP, Fowler M, Keene S, Iuga A, Dellon ES. Long-term efficacy of proton pump inhibitors as a treatment modality for eosinophilic esophagitis. Dig Liver Dis 2022;54:1179-1185.
- Lucendo AJ, Molina-Infante J. Current treatment options and long-term outcomes in patients with eosinophilic esophagitis. Expert Rev Clin Immunol 2022;18:859-872.
- Abdel-Aziz Y, Metz DC, Howden CW. Review article: potassium-competitive acid blockers for the treatment of acid-related disorders. Aliment Pharmacol Ther 2021;53:794-809.
- Ishimura N, Ishihara S, Kinoshita Y. Sustained Acid Suppression by Potassium-Competitive Acid Blocker (P-CAB) May Be An Attractive Treatment Candidate for Patients with Eosinophilic Esophagitis. Am J Gastroenterol 2016;111:1203-4.
- Kuzumoto T, Tanaka F, Sawada A, Nadatani Y, Otani K, Hosomi S, Kamata N, Taira K, Nagami Y, Tanigawa T, Watanabe T, Fujiwara Y. Vonoprazan shows efficacy similar to that of proton pump inhibitors with respect to symptomatic, endoscopic, and histological responses in patients with eosinophilic esophagitis. Esophagus 2021;18:372-379.
- Franciosi JP, Mougey EB, Dellon ES, Gutierrez-Junquera C, Fernandez-Fernandez S, Venkatesh RD, Gupta SK. Proton Pump Inhibitor Therapy for Eosinophilic Esophagitis: History, Mechanisms, Efficacy, and Future Directions. J Asthma Allergy 2022;15:281-302.
- Cheng E, Zhang X, Huo X, Yu C, Zhang Q, Wang DH, Spechler SJ, Souza RF. Omeprazole blocks eotaxin-3 expression by oesophageal squamous cells from patients with eosinophilic oesophagitis and GORD. Gut 2013;62:824-32.
- Odiase E, Zhang X, Chang Y, Nelson M, Balaji U, Gu J, Zhang Q, Pan Z, Spechler SJ, Souza RF. In Esophageal Squamous Cells From Eosinophilic Esophagitis Patients, Th2 Cytokines Increase Eotaxin-3 Secretion Through Effects on Intracellular Calcium and a Non-Gastric Proton Pump. Gastroenterology 2021;160:2072-2088.e6.
- Arias Á, González-Cervera J, Tenias JM, Lucendo AJ. Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: A systematic review and meta-analysis. Gastroenterology 2014;146:1639-48.
- Lucendo AJ, Arias Á, González-Cervera J, Yagüe-Compadre JL, Guagnozzi D, Angueira T, Jiménez-Contreras S, González-Castillo S, Rodríguez-Domíngez B, De Rezende LC, Tenias JM. Empiric 6-food elimination diet induced and maintained prolonged remission in patients with adult eosinophilic esophagitis: a prospective study on the food cause of the disease. J Allergy Clin Immunol 2013;131:797-804.
- Molina-Infante J, Lucendo AJ. Dietary therapy for eosinophilic esophagitis. J Allergy Clin Immunol 2018;142:41-47.
- Molina-Infante J, Arias A, Barrio J, Rodríguez-Sánchez J, Sanchez-Cazalilla M, Lucendo AJ. Four-food group elimination diet for adult eosinophilic esophagitis: A prospective multicenter study. J Allergy Clin Immunol 2014;134:1093-9.
- Kagalwalla AF, Wechsler JB, Amsden K, Schwartz S, Makhija M, Olive A, Davis CM, Manuel-Rubio M, Marcus S, Shaykin R, Sulkowski M, Johnson K, Ross JN, Riffle ME, Groetch M, Melin-Aldana H, Schady D, Palac H, Kim KA, Wershil BK, Collins MH, Chehade M. Efficacy of a 4-Food Elimination Diet for Children With Eosinophilic Esophagitis. Clin Gastroenterol Hepatol 2017;15:1698-1707.e7.
- Molina-Infante J, Arias Á, Alcedo J, Garcia-Romero R, Casabona-Frances S, Prieto-Garcia A, Modolell I, Gonzalez-Cordero PL, Perez-Martinez I, Martin-Lorente JL, Guarner-Argente C, Masiques ML, Vila-Miravet V, Garcia-Puig R, Savarino E, Sanchez-Vegazo CT, Santander C, Lucendo AJ. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: The 2-4-6 study. J Allergy Clin Immunol 2018;141:1365-1372.
- Wechsler JB, Schwartz S, Arva NC, Kim KA, Chen L, Makhija M, Amsden K, Keeley K, Mohammed S, Dellon ES, Kagalwalla AF. A Single-Food Milk Elimination Diet Is Effective for Treatment of Eosinophilic Esophagitis in Children. Clin Gastroenterol Hepatol 2022;20:1748-1756.e11.
- Chang JW, Haller E, Dellon ES. Dietary Management of Eosinophilic Esophagitis: Man Versus Food or Food Versus Man?. Gastroenterol Clin North Am 2021;50:59-75.
- Molina-Infante J. Nutritional and Psychological Considerations for Dietary Therapy in Eosinophilic Esophagitis. Nutrients 2022;14:1588.
- González-Cervera J, Arias Á, Navarro P, Juárez-Tosina R, Cobo-Palacios M, Olalla JM, Angueira-Lapeña T, Lucendo AJ. Tolerance to sterilised cow’s milk in patients with eosinophilic oesophagitis triggered by milk. Aliment Pharmacol Ther 2022;56:957-967.
- Hao LX, Lu Y, Li T, Gong B. A meta-analysis of efficacy of topical steroids in eosinophilic esophagitis: From the perspective of histologic, clinical, and endoscopic outcome. Gastroenterol Hepatol 2021;44:251-260.
- Munoz-Osores E, Maldonado-Campos I, Olivares-Labbe MT, Villarroel L, Gana JC. Corticosteroids for Eosinophilic Esophagitis in Children: A Meta-analysis. Pediatrics 2020;146(5):e20200874.
- de Heer J, Miehlke S, Rösch T, Morgner A, Werner Y, Ehlken H, Becher H, Aigner A. Histologic and Clinical Effects of Different Topical Corticosteroids for Eosinophilic Esophagitis: Lessons from an Updated Meta-Analysis of Placebo-Controlled Randomized Trials. Digestion 2021;102:377-385.
- Lucendo AJ, Miehlke S, Schlag C, Vieth M, von Arnim U, Molina-Infante J, Hartmann D, Bredenoord AJ, Ciriza de Los Rios C, Schubert S, Brückner S, Madisch A, Hayat J, Tack J, Attwood S, Mueller R, Greinwald R, Schoepfer A, Straumann A; International EOS-1 Study Group. Efficacy of Budesonide Orodispersible Tablets as Induction Therapy for Eosinophilic Esophagitis in a Randomized Placebo-Controlled Trial. Gastroenterology 2019;157:74-86.e15.
- Miehlke S, Schlag C, Lucendo AJ, Biedermann L, Vaquero CS, Schmoecker C, Hayat J, Hruz P, Ciriza de Los Rios C, Bredenoord AJ, Vieth M, Schoepfer A, Attwood S, Mueller R, Burrack S, Greinwald R, Straumann A; International EOS-2 Study Group. Budesonide orodispersible tablets for induction of remission in patients with active eosinophilic oesophagitis: A 6-week open-label trial of the EOS-2 Programme. United European Gastroenterol J 2022;10:330-343.
- Dellon ES, Lucendo AJ, Schlag C, Schoepfer AM, Falk GW, Eagle G, Nezamis J, Comer GM, Knoop K, Hirano I. Fluticasone Propionate Orally Disintegrating Tablet (APT-1011) for Eosinophilic Esophagitis: Randomized Controlled Trial. Clin Gastroenterol Hepatol. 2022 Feb 16:S1542-3565(22)00139-2.
- Laserna-Mendieta EJ, Casabona S, Savarino E, Perelló A, Pérez-Martínez I, Guagnozzi D, Barrio J, Guardiola A, Asensio T, de la Riva S, Ruiz-Ponce M, Rodríguez-Oballe JA, Santander C, Arias Á, Lucendo AJ; EUREOS EoE CONNECT research group. Efficacy of Therapy for Eosinophilic Esophagitis in Real-World Practice. Clin Gastroenterol Hepatol 2020;18:2903-2911.e4.
- Dellon ES, Woosley JT, Arrington A, McGee SJ, Covington J, Moist SE, Gebhart JH, Tylicki AE, Shoyoye SO, Martin CF, Galanko JA, Baron JA, Shaheen NJ. Efficacy of Budesonide vs Fluticasone for Initial Treatment of Eosinophilic Esophagitis in a Randomized Controlled Trial. Gastroenterology 2019;157:65-73.e5.
- Hirano I, Collins MH, Katzka DA, Mukkada VA, Falk GW, Morey R, Desai NK, Lan L, Williams J, Dellon ES; ORBIT1/SHP621-301 Investigators. Budesonide Oral Suspension Improves Outcomes in Patients With Eosinophilic Esophagitis: Results from a Phase 3 Trial. Clin Gastroenterol Hepatol 2022;20:525-534.e10.
- Straumann A, Lucendo AJ, Miehlke S, Vieth M, Schlag C, Biedermann L, Vaquero CS, Ciriza de Los Rios C, Schmoecker C, Madisch A, Hruz P, Hayat J, von Arnim U, Bredenoord AJ, Schubert S, Mueller R, Greinwald R, Schoepfer A, Attwood S; International EOS-2 Study Group. Budesonide Orodispersible Tablets Maintain Remission in a Randomized, Placebo-Controlled Trial of Patients With Eosinophilic Esophagitis. Gastroenterology 2020;159:1672-1685.e5.
- Dellon ES, Katzka DA, Collins MH, Gupta SK, Lan L, Williams J, Hirano I. Safety and Efficacy of Budesonide Oral Suspension Maintenance Therapy in Patients With Eosinophilic Esophagitis. Clin Gastroenterol Hepatol 2019;17:666-673.e8.
- Oliva S, Volpe D, Russo G, Veraldi S, Papoff P, Giordano C, Ruggiero C, Trovato CM, Terrin G, Rossetti D. Maintenance Therapy With the Lowest Effective Dose of Oral Viscous Budesonide in Children With Eosinophilic Esophagitis. Clin Gastroenterol Hepatol 2021 20:S1542-3565(21)01034-X.
- Dellon ES, Rothenberg ME, Collins MH, Hirano I, Chehade M, Bredenoord AJ, et al. Dupilumab in Adult and Adolescent Patients With Eosinophilic Esophagitis 2022 (in press).
- Hirano I, Collins MH, Assouline-Dayan Y, Evans L, Gupta S, Schoepfer AM, Straumann A, Safroneeva E, Grimm M, Smith H, Tompkins CA, Woo A, Peach R, Frohna P, Gujrathi S, Penenberg DN, Li C, Opiteck GJ, Olson A, Aranda R, Rothenberg ME, Dellon ES; HEROES Study Group. RPC4046, a Monoclonal Antibody Against IL13, Reduces Histologic and Endoscopic Activity in Patients With Eosinophilic Esophagitis. Gastroenterology 2019;156:592-603.e10.
- Hirano I, Dellon ES, Hamilton JD, Collins MH, Peterson K, Chehade M, Schoepfer AM, Safroneeva E, Rothenberg ME, Falk GW, Assouline-Dayan Y, Zhao Q, Chen Z, Swanson BN, Pirozzi G, Mannent L, Graham NMH, Akinlade B, Stahl N, Yancopoulos GD, Radin A. Efficacy of Dupilumab in a Phase 2 Randomized Trial of Adults With Active Eosinophilic Esophagitis. Gastroenterology 2020;158:111-122.e10.
- Dellon ES, Peterson KA, Murray JA, Falk GW, Gonsalves N, Chehade M, Genta RM, Leung J, Khoury P, Klion AD, Hazan S, Vaezi M, Bledsoe AC, Durrani SR, Wang C, Shaw C, Chang AT, Singh B, Kamboj AP, Rasmussen HS, Rothenberg ME, Hirano I. Anti-Siglec-8 Antibody for Eosinophilic Gastritis and Duodenitis. N Engl J Med 2020;383:1624-1634.
- Dellon ES, Collins MH, Rothenberg ME, Assouline-Dayan Y, Evans L, Gupta S, Schoepfer A, Straumann A, Safroneeva E, Rodriguez C, Minton N, Hua SY, Hirano I. Long-term Efficacy and Tolerability of RPC4046 in an Open-Label Extension Trial of Patients With Eosinophilic Esophagitis. Clin Gastroenterol Hepatol. 2021;19:473-483.e17.
- Spergel BL, Ruffner MA, Godwin BC, Liacouras CA, Cianferoni A, Gober L, Hill DA, Brown-Whitehorn TF, Chaiboonma K, Aceves SA, Muir AM, Spergel JM. Improvement in eosinophilic esophagitis when using dupilumab for other indications or compassionate use. Ann Allergy Asthma Immunol 2022;128:589-593.
- Dixit C, Thatayatikom A, Pappa H, Knutsen AP. Treatment of severe atopic dermatitis and eosinophilic esophagitis with dupilumab in a 14-year-old boy with autosomal dominant hyper-IgE síndrome. J Allergy Clin Immunol Pract 2021;9:4167-4169.
- Bawany F, Franco AI, Beck LA. Dupilumab: One therapy to treat multiple atopic diseases. JAAD Case Rep 2020;6:1150-1152.
- Straumann A, Conus S, Grzonka P, Kita H, Kephart G, Bussmann C, Beglinger C, Smith DA, Patel J, Byrne M, Simon HU. Anti-interleukin-5 antibody treatment (mepolizumab) in active eosinophilic oesophagitis: a randomised, placebo-controlled, double-blind trial. Gut 2010;59:21-30.
- Assa’ad AH, Gupta SK, Collins MH, Thomson M, Heath AT, Smith DA, Perschy TL, Jurgensen CH, Ortega HG, Aceves SS. An antibody against IL-5 reduces numbers of esophageal intraepithelial eosinophils in children with eosinophilic esophagitis. Gastroenterology 2011;141:1593-604
- Spergel JM, Rothenberg ME, Collins MH, Furuta GT, Markowitz JE, Fuchs G 3rd, O’Gorman MA, Abonia JP, Young J, Henkel T, Wilkins HJ, Liacouras CA. Reslizumab in children and adolescents with eosinophilic esophagitis: results of a double-blind, randomized, placebo-controlled trial. J Allergy Clin Immunol 2012;129:456-63.
- Massey OW, Suphioglu C. Taking a Breather: Advances in Interleukin 5 Inhibition for Asthma Relief. Int J Mol Sci 2022;23:11166.
- Tamarit-Sebastian S, Ferrer-Soler FM, Lucendo AJ. Current options and investigational drugs for the treatment of eosinophilic esophagitis. Expert Opin Investig Drugs 2022;31:193-210.
- Moawad FJ, Molina-Infante J, Lucendo AJ, Cantrell SE, Tmanova L, Douglas KM. Systematic review with meta-analysis: Endoscopic dilation is highly effective and safe in children and adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2017;4696-105.
- Safroneeva E, Cotton CC, Schoepfer AM, Zwahlen M, Woosley JT, Dellon ES. Dilation Modifies Association Between Symptoms and Esophageal Eosinophilia in Adult Patients With Eosinophilic Esophagitis. Am J Gastroenterol 2020;115:2098-2102.
- Safroneeva E, Pan Z, King E, Martin LJ, Collins MH, Yang GY, Capocelli KE, Arva NC, Abonia JP, Atkins D, Bonis PA, Dellon ES, Falk GW, Gonsalves N, Gupta SK, Hirano I, Leung J, Menard-Katcher PA, Mukkada VA, Schoepfer AM, Spergel JM, Wershil BK, Rothenberg ME, Aceves SS, Furuta GT; Consortium of Eosinophilic Gastrointestinal Disease Researchers. Long-Lasting Dissociation of Esophageal Eosinophilia and Symptoms After Dilation in Adults With Eosinophilic Esophagitis. Clin Gastroenterol Hepatol 2022;20:766-775.e4.
- Aceves SS, Alexander JA, Baron TH, Bredenoord AJ, Day L, Dellon ES, Falk GW, Furuta GT, Gonsalves N, Hirano I, Konda VJA, Lucendo AJ, Moawad F, Peterson KA, Putnam PE, Richter J, Schoepfer AM, Straumann A, McBride DL, Sharma P, Katzka DA. Endoscopic approach to eosinophilic esophagitis: American Society for Gastrointestinal Endoscopy Consensus Conference. Gastrointest Endosc. 2022;96:576-592.e1.
- Peterson KA, Thomas KL, Hilden K, Emerson LL, Wills JC, Fang JC. Comparison of esomeprazole to aerosolized, swallowed fluticasone for eosinophilic esophagitis. Dig Dis Sci 2010;55:1313-9.
- Moawad FJ, Veerappan GR, Dias JA, Baker TP, Maydonovitch CL, Wong RKH. Randomized controlled trial comparing aerosolized swallowed fluticasone to esomeprazole for esophageal eosinophilia. Am J Gastroenterol 2013;108:366-72.
- Miehlke S, Lucendo AJ, Straumann A, Jan Bredenoord A, Attwood S. Orodispersible budesonide tablets for the treatment of eosinophilic esophagitis: a review of the latest evidence. Therap Adv Gastroenterol. 2020;13:1756284820927282.
- Aubin F, Carbonnel F, Wendling D. The complexity of adverse side-effects to biological agents. J Crohns Colitis. 2013;7:257–262.
- Aranez V, Ambrus J Jr. Immunologic adverse effects of biologics for the treatment of atopy. Clin Rev Allergy Immunol 2020;59:220-230.
- Jensen ET, Kappelman MD, Martin CF, Dellon ES. Health-care utilization, costs, and the burden of disease related to eosinophilic esophagitis in the United States. Am J Gastroenterol 2015;110:626-32.
- Anderson J, Moonie S, Hogan MB, Scherr R, Labus B, Word J. Cost of chronic inflammatory disease: The impact of eosinophilic esophagitis in Nevada. J Dig Dis 2020;21:12-19.
- Dellon ES. Cost-effective care in eosinophilic esophagitis. Ann Allergy Asthma Immunol 2019;123:166–172.
- Beauchemin C, Castonguay A, Chan ES, Dellon ES, Feagan BG, Ma C, Waserman S, Cook J, Claveau D. Economic Evaluation of Budesonide Orodispersible Tablets for the Treatment of Eosinophilic Esophagitis: A Cost-Utility Analysis. Adv Ther 2021;38:5737-5751.
- Shoda T, Wen T, Aceves SS, Abonia JP, Atkins D, Bonis PA, Caldwell JM, Capocelli KE, Carpenter CL, Collins MH, Dellon ES, Eby MD, Gonsalves N, Gupta SK, Falk GW, Hirano I, Menard-Katcher P, Kuhl JT, Krischer JP, Leung J, Mukkada VA, Spergel JM, Trimarchi MP, Yang GY, Zimmermann N, Furuta GT, Rothenberg ME; Consortium of Eosinophilic Gastrointestinal Disease Researchers (CEGIR). Eosinophilic oesophagitis endotype classification by molecular, clinical, and histopathological analyses: a cross-sectional study. Lancet Gastroenterol Hepatol 2018;3:477-488
- Erwin EA, Jaramillo LM, Smith B, Kruszewski PG, Kahwash B, Grayson MH, Mejias A, Ramilo O. Sex Differences in Blood Transcriptional Profiles and Clinical Phenotypes in Pediatric Patients with Eosinophilic Esophagitis. J Allergy Clin Immunol Pract 2021;9:3350-3358.
Correspondencia: Javier Molina-Infante
Correo electrónico: xavi_molina@hotmail.com
Acta Gastroenterol Latinoam 2022;52(4):439-452
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE