Gustavo Cernadas,2 Vanina Forestier,2 Karen Stave Salgado,2 Paola Coisson,2 Marylin Castilla,2 María V García Mercader,1 Raúl Matano,2 Ignacio Zubiaurre,1 Rosa I Ramos1, 2
1 Departamento de Gastroenterología. Laboratorio de Motilidad. Hospital Británico, Ciudad de Buenos Aires, Argentina.
2 Departamento de Gastroenterología. Unidad de Motilidad Digestiva. Hospital de Alta Complejidad El Cruce. Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2021;51(1):87-92
Recibido: 07/10/2020 / Aceptado: 06/02/2021 / Publicado en www.actagastro.org el 22/03/2021 / https://doi.org/10.52787/iued6187
Resumen
La necrosis esofágica aguda es una entidad poco frecuente, descripta endoscópicamente como una mucosa esofágica de aspecto negro, en general de distribución circunferencial, que se extiende en sentido proximal desde la unión gastroesofágica y afecta una longitud variable de este órgano. Tiene una etiología multifactorial que comprende una combinación de compromiso mucoso esofágico vascular de tipo isquémico, asociada al contenido de reflujo gástrico, en pacientes con múltiples comorbilidades. El manejo clínico se centra en medidas de sostén general y tratamiento de las comorbilidades subyacentes. A pesar de que esta patología tiende a resolverse en 7-10 días ad integrum, estos pacientes tienen una alta tasa de mortalidad, relacionada con sus condiciones clínicas y no por la propia entidad. Por lo tanto, el diagnóstico temprano es crucial para iniciar un tratamiento adecuado. Presentamos dos casos de necrosis esofágica aguda en pacientes que fueron sometidos a trasplante hepático ortotópico.
Palabras claves. Necrosis esofágica aguda, hemorragia gastrointestinal, trasplante hepático.
Acute Esophageal Necrosis in Post-Liver Transplant Patients. A Dark Tunnel from the Liver to the Esophagus
Summary
Acute esophageal necrosis is a rare entity endoscopically described as a black appearance of esophageal mucosa, generally of circumferential distribution that extends proximally from the gastroesophageal junction, and affects a variable length of this organ. It has a multifactorial etiology that includes a combination of ischemic mucosal esophageal vascular compromise associated with gastroesophageal reflux in patients with multiple comorbidities. Clinical management focuses on general support measures and treatment of the underlying illness and comorbidities. Although this pathology usually tends to a restitution-ad-integrum in 7-10 days, these patients have a high mortality rate more related to their clinical conditions and not due to this entity itself. Therefore, early diagnosis is crucial to initiate proper treatment. We present two cases of AEN in patients who underwent orthotopic liver transplantation.
Keywords. Acute esophageal necrosis, gastrointestinal bleeding, liver transplantation.
Abreviaturas
NEA: Necrosis esofágica aguda.
UGE: Unión gastroesofágica.
TH: Trasplante hepático ortotópico.
MELD: Enfermedad hepática en etapa terminal.
INCUCAI: Instituto Nacional Coordinador de Ablación e Implantes.
VEDA: Videoendoscopía digestiva alta.
PAF: Polineuropatía amiloidótica familiar.
IgG: Inmunoglobulina.
CMV: Citomegalovirus.
EEI: Esfínter esofágico inferior.
Introducción
La necrosis esofágica aguda (NEA) es una entidad poco frecuente, descripta endoscópicamente como una lesión mucosa de aspecto oscura y por lo habitual de distribución circunferencial, que afecta una longitud variable del esófago en sentido proximal y por encima de la unión gastroesofágica (UGE).1 La etiología no se conoce completamente. Parece ser una combinación de hipoperfusión tisular de la mucosa y submucosa, secundaria a un estado de bajo flujo sanguíneo o trombosis vascular en el territorio de la arteria celíaca y sus colaterales, sumados a la agresión de la mucosa esofágica por reflujo gástrico. En general son pacientes en condiciones clínicas críticas, con compromiso hemodinámico y/o con múltiples comorbilidades asociadas.2 Con frecuencia, la presentación clínica es hemorragia digestiva alta y la terapéutica se centra en el tratamiento de la enfermedad subyacente y medidas de sostén general.3, 4 En los últimos años ha sido más reconocida.5 El diagnóstico y manejo temprano de esta entidad podría mejorar los resultados clínicos y prevenir complicaciones.6 Hasta la fecha, existen pocos reportes en la bibliografía y solo tres casos de NEA luego de un trasplante hepático (TH).7-9 Presentamos dos nuevos casos en pacientes que fueron sometidos a un TH, que se presentaron casi simultáneamente en dos centros médicos distintos.
Primer caso clínico
Paciente masculino de 56 años con diagnóstico de cirrosis hepática criptogénica, con enfermedad hepática en etapa terminal (MELD) de 24 puntos, en espera de un TH por el Instituto Nacional Coordinador de Ablación e Implantes (INCUCAI). Sus antecedentes: tabaquista, diabetes mellitus tipo 2 y enfermedad renal crónica sin requerimiento de diálisis.
Presentaba un cuadro clínico de cirrosis hepática descompensada por ascitis, con requerimiento de paracentesis semanal y presencia de varices esofágicas grandes, con dos episodios de sangrado variceal previos con tratamiento endoscópico de ligadura con bandas. Con diagnóstico de síndrome hepatorrenal tipo 1 tratado con octreótido y albúmina.
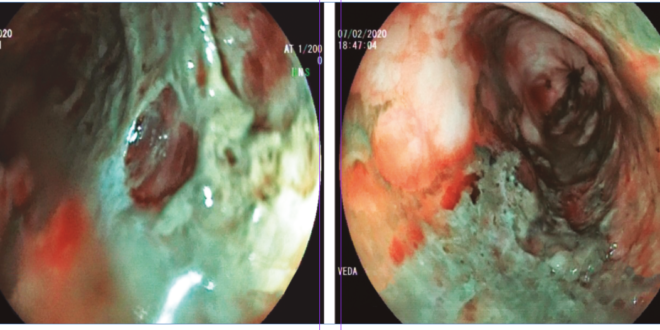
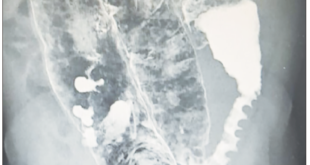
El paciente recibió un TH de donante cadavérico masculino de 60 años. El tiempo quirúrgico total fue de 385 minutos, el tiempo de isquemia en frío (período que transcurre desde que el órgano es preservado en un estado hipotérmico hasta su trasplante en el receptor) fue de 370 minutos, el tiempo de isquemia en caliente (incluye el tiempo que pasa desde la interrupción de la circulación del órgano donado hasta el momento en que es perfundido con la solución hipotérmica de preservación) fue de 45 minutos, con un tiempo de reperfusión orgánica homogénea. A las pocas horas poscirugía, evolucionó con cuadro de inestabilidad hemodinámica asociado a estado de shock multifactorial y cetoacidosis diabética. Recibió tratamiento médico con vasopresores, infusión de cristaloides intravenosos e insulinoterapia durante 24 horas. Al tercer día del TH, presentó una insuficiencia renal crónica reagudizada, con requerimiento de hemodiálisis, y desarrolló una trombosis asociada al catéter de diálisis. Al quinto día postoperatorio se extubó y comenzó con ingesta de alimentos por vía oral. A los treinta días posteriores al TH, presentó un episodio de melena sin compromiso hemodinámico. Se realizó una videoendoscopia digestiva alta (VEDA), en la que se observó un esófago con lumen conservado pero con áreas de mucosa color negruzco de apariencia necrótica, sin signos de sangrado activo, que se extendía desde los 30 cm desde la arcada dentaria superior en sentido distal hasta la unión gastroesofágica, respetando la misma (Figura 1). Se suspendió la ingesta de alimentos por vía oral y comenzó con nutrición parenteral, administración de altas dosis de inhibidores de la bomba de protones por vía intravenosa, sucralfato oral y tratamiento antibiótico empírico. El paciente evolucionó favorablemente y se estabilizó hemodinámicamente. A los diez días del último episodio citado, se realizó una nueva VEDA en la que se observó una superficie mucosa esofágica de aspecto conservado sin evidencia de lesiones. El paciente se mantuvo estable hemodinámicamente, sin nuevos episodios, a la espera del alta sanatorial.
Figuras 1. Hallazgos endoscópicos del primer caso clínico. Fragmentos de mucosa esfacelada, con coloración negro grisácea distal. Ulceración extensa.
Segundo caso clínico
Paciente femenina de 38 años con diagnóstico de polineuropatía amiloidótica familiar (PAF) y cirrosis hepática asociada con puntaje MELD de 22, en espera de trasplante ortotópico por INCUCAI. Tenía antecedentes clínicos de neuropatía periférica sensorial / motora, vejiga neurogénica y motilidad esofágica inefectiva secundario a su enfermedad de base. Además, tenía anticuerpos séricos inmunoglobulina G (IgG) citomegalovirus (CMV) positivos, virus de Epstein Barr y toxoplasmosis.
La paciente recibió un trasplante Split cadavérico de donante femenina de 17 años, sin ninguna patología previa. Se registraron valores positivos de la donante de IgG de CMV y HBSAg y Anti-core negativos.
El tiempo quirúrgico total fue de 775 minutos, con reperfusión orgánica homogénea. El tiempo de isquemia en frío fue de 720 minutos y el tiempo de isquemia en caliente fue de 40 minutos. La paciente se mantuvo hemodinámicamente estable durante toda la operación. A las 24 horas de TH presentó un episodio de disección (trombosis intramural) de la arteria hepática nativa que requirió reconstrucción con injerto de arteria ilíaca del donante y evolucionó sin complicaciones. Después de trece días del TH, la paciente presentó dos episodios de excitación psicomotriz asociados a desorientación temporo-espacial. El primero de ellos se interpretó secundario a hiponatremia sintomática (128 meq/L) y respondió con tratamiento sustitutivo de sodio. El segundo evento se asoció a la presencia de una colección subcapsular hepática, purulenta, que requirió drenaje y tratamiento antibiótico empírico, con respuesta exitosa. A los veintitrés días del TH fue dada de alta hospitalaria, con ingesta alimentaria vía oral y tratamiento médico con inhibidor de la bomba de protones, inmunosupresores, antiagregantes plaquetarios y antihipertensivos orales.
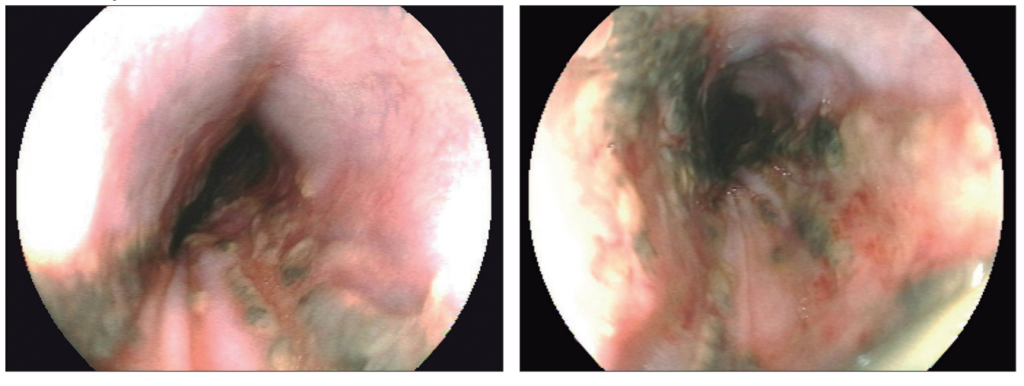
Cinco meses luego del TH presentó un episodio de hematemesis sin descompensación hemodinámica. Se realizó VEDA en la que se observó una luz esofágica de tamaño conservado pero con abundantes coágulos y restos de sangre en su interior, que fueron extraídos con éxito mostrando una mucosa subyacente con áreas de aspecto necrótico desde el tercio proximal en sentido distal hasta inmediatamente por encima de la UEG (Figura 2). Se interpretó como NEA, se suspendió la ingesta de alimentos por vía oral, y se implementó nutrición parenteral y tratamiento médico con inhibidores de bomba de protones endovenosos, sucralfato vía oral y tratamiento antibiótico empírico. En Unidad de Cuidados Intensivos recibió tratamiento de soporte clínico, y evolucionó clínicamente estable. A los siete días de dicho episodio se realizó VEDA de control, que evidenció esófago normal sin lesiones mucosas ni signos de sangrado activo reciente.
Figuras 2. Hallazgos endoscópicos del segundo caso clínico. Esfacelo difuso de la mucosa, áreas negruzcas compatibles con necrosis del tejido.
Discusión
La primera descripción endoscópica de NEA fue reportada en 1990, y posteriormente Gurvits y col. lo han denominado dentro de un síndrome.3 Una revisión sistemática reciente identificó un total de 154 casos reportados en la literatura. Se desconoce la prevalencia real de esta entidad clínica, pero, según las descripciones, oscila entre el 0,01% y el 0,28%, con predominio masculino (4 a 1) y edad mayor de 50 años al momento del diagnóstico, aunque hay reportes de casos en personas más jóvenes.4, 10 Generalmente, esta entidad se encuentra asociada a un estado clínico crítico y/o con múltiples comorbilidades.4, 11 La verdadera prevalencia podría estar subestimada debido a varios factores, como la presentación subclínica, el retraso en la realización de la endoscopia diagnóstica debido a la condición crítica del paciente, así como también un breve período de daño isquémico seguido de una curación temprana de la mucosa esofágica.2, 3 En los últimos años se está convirtiendo en una entidad cada vez más reconocida, probablemente debido a la incorporación rutinaria de la VEDA como método diagnóstico y/o terapéutico.5
La presentación clínica más frecuente es la hemorragia digestiva alta con hematemesis y/o melena en pacientes con compromiso cardiovascular asociado o shock de cualquier etiología.6, 11 Otras presentaciones frecuentes son: dolor abdominal general o epigástrico, vómitos, náuseas y/o disfagia. Esta última podría ser un síntoma poco relacionado a la NEA debido a que una proporción significativa de pacientes suele tener afecciones concomitantes graves, que son las que realmente afectan su capacidad para tragar.6, 12 Si bien un número importante de casos reportados se presentaron con shock o síncope,6 las complicaciones asociadas más frecuentes incluyen mediastinitis/absceso,6 perforación13, 14 y/o estenosis.10, 12 Además, estos pacientes tienen una alta tasa de mortalidad (30-50%), pero se estima que aproximadamente el 6% se debe exclusivamente a la NEA.2, 12 Dentro de las comorbilidades asociadas que presentaron los pacientes con NEA en la literatura, las más comunes reportadas fueron diabetes (38%), hipertensión arterial (37%) e hiperlipidemia (10%).6
Todos estos resultan ser factores de riesgo independientes conocidos de aterosclerosis y, por lo tanto, probables factores de riesgo para el desarrollo de NEA. Se considera también como una causa de hemorragia digestiva alta en pacientes inmunosuprimidos, con abuso de alcohol, cetoacidosis diabética, enfermedad renal crónica, neoplasias, desnutrición y/o pacientes en estado crítico, como aquellos que tuvieron un trasplante de órgano sólido.6, 7, 15
La etiología isquémica del esófago está basada en que este evento ocurre en combinación con procesos isquémicos del territorio esplácnico, como la hepatopatía hipóxica o la colangiopatía isquémica. El esófago distal es el más afectado, debido a un suministro de sangre más débil en la submucosa, una anastomosis vascular deficiente, en comparación con el resto de la extensión esofágica, y una mayor exposición de la mucosa al reflujo del contenido gástrico.14, 16, 17 Asimismo, es importante destacar que la lesión que se produce por reflujo por ácido, pepsina u otros contenidos gástricos suele estar relacionada con el aumento de la relajación transitoria del esfínter esofágico inferior (EEI), la disminución de la presión del EEI en reposo, el tiempo de decúbito prolongado y la disminución de la peristálsis esofágica. El reflujo gastroesofágico está relacionado con la condición crítica como así también con las diferentes comorbilidades observadas en este tipo de pacientes con NEA.3, 16
Nuestros dos pacientes se encontraban bajo tratamiento inmunosupresor luego de un TH tardío y con múltiples comorbilidades e intercurrencias clínicas postoperatorias. Representan la tercera publicación de NEA en pacientes trasplantados hepáticos.7, 8, 18 No parece haber relación, en los tres casos de TH publicados, entre el tiempo quirúrgico, la isquemia fría o la isquemia caliente, pero sí entre las múltiples complicaciones que se presentan en este tipo de pacientes, comprometiendo de alguna manera la vascularización del territorio esplácnico y los mecanismos de defensa de la UEG.
El primer caso presenta la caída brusca de la vascularización sumada a la hiperglucemia severa con requerimiento de goteo de insulina endovenosa, condición altamente asociada a la NEA en un 90%.12
El segundo caso se correlaciona con múltiples comorbilidades, sepsis y trastornos vasculares, situaciones asociadas a factores etiológicos de la NEA. Esta resulta ser la primera descripción de un paciente con una PAF como una posible comorbilidad sistémica asociada a NEA.
Desde un punto de vista endoscópico, se describe como una distribución circunferencial de coloración oscura o negruzca, afecta el esófago distal y se detiene en la UGE, pero también puede afectar toda la extensión del esófago y puede estar acompañada de exudados o úlceras. Otros hallazgos endoscópicos asociados pueden incluir úlceras gástricas y duodenales. Unos pocos casos reportados muestran compromiso limitado al tercio inferior esofágico.6, 15, 16, 18
El diagnóstico de NEA requiere la exclusión de otras causas como la ingesta de cáusticos y debe sustentarse en la presencia histológica de capas difusas de necrosis mucosa y submucosa y cambios inflamatorios inespecíficos sin células escamosas estratificadas reconocibles.16, 18 En nuestros dos casos, y como podemos observar en las imágenes endoscópicas (Figuras 1 y 2), se informan áreas no confluentes de mucosa con aspecto necrótico, no logrando completar en toda su extensión circunferencial el compromiso del órgano. Cabe destacar que la endoscopía es la herramienta fundamental para el diagnóstico de NEA y la realización de biopsias no se asocia a un patrón histopatológico específico de esta entidad. No obstante, la toma de biopsias podría ser una herramienta útil ante la sospecha de diagnósticos diferenciales posibles, como melanosis, pseudomelanosis o acantosis nigricans,6, 11 como también la pesquisa de una posible asociación de etiología infecciosa como Klebsiella pneumoniae, Candida albicans, citomegalovirus o virus del herpes simple,6, 11, 19 por lo que la decisión de obtención de biopsias debería depender de los antecedentes y la presentación clínica de cada paciente en particular.
El manejo de esta entidad se centra en el tratamiento de la enfermedad subyacente. Generalmente, suele implicar la infusión de líquidos por vía intravenosa, la transfusión de glóbulos rojos, supresión del ácido gástrico con inhibidores de la bomba de protones y/o nutrición parenteral. Por lo general, no se recomienda la ingesta oral, excepto la suspensión oral de sucralfato administrada para evitar una mayor lesión del esófago. En algunos reportes se informó también la implementación de tratamiento empírico con antibióticos para el estado de sepsis subyacente. Pocos casos requirieron cirugía para el manejo de complicaciones como la perforación esofágica.6
La sospecha y el reconocimiento tempranos, así como su manejo, podrían mejorar los resultados clínicos y disminuir la tasa de mortalidad asociada.6, 7
Conclusión
La necrosis esofágica aguda debe considerarse en cualquier paciente con hemorragia digestiva alta que tenga múltiples condiciones comórbidas y asociadas a un evento de compromiso hemodinámico o metabólico, como puede ocurrir en los pacientes sometidos a una cirugía de TH.
El diagnóstico temprano, el tratamiento sintomático apropiado y la supresión de ácido son pilares fundamentales para obtener resultados favorables en los pacientes.
La realización de una endoscopía y sus hallazgos característicos son fundamentales para reconocer la NEA. Su diagnóstico precoz es fundamental para iniciar un tratamiento adecuado y efectivo.
Conflictos de intereses. Todos los autores declaran no tener ningún conflicto de intereses ni haber recibido financiación para este estudio. Utilizamos nuestra base de datos para realizar este reporte de casos. No hay datos o imágenes incluidos en este estudio que puedan facilitar la identificación de los pacientes, por lo que es completamente anónimo.
Aviso de derechos de autor  © 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
© 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Cernadas G, Forestier V, Stave Salgado K y col. Necrosis esofágica aguda en pacientes post trasplante hepático. Un túnel oscuro desde el hígado al esófago. Acta Gastroenterol Latinoam. 2021;51(1):87-92. https://doi.org/10.52787/iued6187
Referencias
- Singh D, Singh R, Laya AS. Acute esophageal necrosis: A case series of five patients presenting with ‘Black esophagus’. Indian J Gastroenterol. 2011;30(1):41-5.
- Gurvits GE. Black esophagus: acute esophageal necrosis syndrome. World Journal of Gastroenterology: WJG. 2010;16(26):3219-25.
- Gurvits GE, Shapsis A, Lau N, Gualtieri N, Robilotti JG. Acute esophageal necrosis: a rare syndrome. Journal of Gastroenterology. 2007;42(1):29-38.
- Etienne JP, Roge J, Delavierre P, Veyssier P. Esophageal necrosis of vascular origin. La semaine des hopitaux: organe fonde par l’Association d’enseignement medical des hopitaux de Paris.1969;45(23):1599-606.
- Goldenberg SP, Wain SL, Marignani P. Acute necrotizing esophagitis. Gastroenterology. 1990;98(2):493-6.
- Abdullah HM, Ullah W, Abdallah M, Khan U, Hurairah A, Atiq M. Clinical presentations, management, and outcomes of acute esophageal necrosis: a systemic review. Expert Review of Gastroenterology & Hepatology. 2019;13(5):507-14.
- Planchard JA, Dikstein AF, Koveleskie J, Cohen A, Gurvits GE. Acute esophageal necrosis following orthotopic liver transplantation. Cureus. 2019;11(2):e4090.
- Gómez V, Propst JA, Francis DL, Canabal JM, Franco PM. Black esophagus: an unexpected complication in an orthotopic liver transplant patient with hemorrhagic shock. Digestive Diseases and Sciences. 2014;59(10):2597-9.
- Kim DB, Bowers S, Thomas M. Black and white esophagus: rare presentations of severe esophageal ischemia. Seminars in Thoracic and Cardiovascular Surgery. 2017;29(2):256-9.
- Eren B, Turkmen N, Fedakar R. Black esophagus: a rare autopsy case. Bratislavske Lekarske Listy. 2010;111(7):414-5.
- Soussan EB, Savoye G, Hochain P, Herv S, Antonietti M, Lemoine F, Ducrott P. Acute esophageal necrosis: A 1-year prospective study. Gastrointestinal endoscopy. 2002;56(2):213-7.
- Khan H, Ahmed M, Daoud M, Philipose J, Ahmed S, Deeb L. Acute esophageal necrosis: A view in the dark. Case Reports in Gastroenterology. 2019;13(1):25-31.
- Cappell MS. Esophageal necrosis and perforation associated with the anticardiolipin antibody syndrome. Am J Gastroenterol. 1994; 89(8):1241-5.
- Day A, Sayegh M. Acute oesophageal necrosis: a case report and review of the literature. International Journal of Surgery (London, England). 2010;8(1):6-14.
- Lahbabi M, Ibrahimi A, Aqodad N. Acute esophageal necrosis: a case report and review. The Pan African Medical Journal. 2013;14:109.
- Burtally A, Gregoire P. Acute esophageal necrosis and low-flow state. Can J Gastroenterol. 2007;21(4):245-7.
- Burton PR, Brown W, Laurie C, Richards M, Afkari S, Yap K, O’Brien PE. The effect of laparoscopic adjustable gastric bands on esophageal motility and the gastroesophageal junction: analysis using high-resolution video manometry. Obesity Surgery. 2009;19(7):905-14.
- Kim DB, Bowers S, Thomas M. Black and white esophagus: Rare presentations of severe esophageal ischemia. Seminars in Thoracic and Cardiovascular Surgery. 2017;29(2):256-9.
- Cattan P, Cuillerier E, Cellier C, Carnot F, Landi B, Dusoleil A, Barbier JP. Black esophagus associated with herpes esophagitis. Gastrointestinal Endoscopy. 1999;49(1):105-7.
Correspondencia: Gustavo Cernadas
Marcelo T. de Alvear 1771 (C. P. 1060). Buenos Aires, Argentina
Tel.: +541140788701
Correo electrónico: gustavo.cernadas@hotmail.com
Acta Gastroenterol Latinoam 2021;51(1):87-92
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE