Eugenia Micheletti1 ID· Cristina Eichhorn1 ID· Mariela Antoniska1 ID· Franco García2 ID· Laura Pérez3 ID· Christian Weyersberg1 ID· Mónica Contreras1 ID
1 Servicio de Gastroenterología.
2 Servicio de Farmacia.
3 Servicio de Laboratorio de Inmunologia.
Hospital «Prof. Dr. Juan P. Garrahan». Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2024;54(2):141-146
Recibido: 26/03/2024 / Aceptado: 28/05/2024 / Publicado online el: 30/06/2024 /
https://doi.org/10.52787/agl.v54i2.405
Resumen
Introducción. El infliximab es la droga más utilizada en el tratamiento de pacientes con enfermedad inflamatoria intestinal en pediatría. La monitorización de sus niveles es el mejor predictor de respuesta al tratamiento instituido y es un recurso importante para optimizar su uso, dado que la pérdida de respuesta primaria o secundaria es un factor a tener en cuenta, sobre todo en pediatría donde las opciones terapéuticas son limitadas. Objetivo. Evaluar en pacientes con enfermedad inflamatoria intestinal los niveles séricos de infliximab y los anticuerpos antidroga durante la inducción y el mantenimiento, así como también su relación con las diferentes variables que pueden alterar el clearance de la droga. Materiales y métodos. Estudio prospectivo, descriptivo, longitudinal y observacional, realizado desde octubre 2021 hasta febrero 2023. La población se dividió en 2 grupos: el Grupo A conformado por los pacientes en inducción (determinaciones en semanas 12 a 15) y el Grupo B que agrupó a los pacientes en mantenimiento (determinaciones inmediatamente previas a la siguiente infusión del fármaco). Se estimaron como adecuados los niveles en sangre entre
3-7 ug/ml y los anticuerpos antidroga > 10 AU/ml fueron considerados elevados. Resultados. Se incluyeron 58 pacientes, el 81,03% (n=47) con enfermedad de Crohn y el 18,9% (n=11) con colitis ulcerosa. En el Grupo A el 20.6% se debió optimizar el tratamiento y el 19% mostró una pérdida de la respuesta primaria, mientras que en el Grupo B el 64.4% tuvo pérdida de respuesta secundaria y se pudo determinar el mecanismo subyacente a la misma, siendo inmunogénico en más del 30% de los pacientes. Conclusión. Conocer los niveles de infliximab y de los anticuerpos antidroga es una herramienta útil, que en nuestra experiencia cambió el curso del manejo de los pacientes, permitiendo un seguimiento y tratamiento individualizado.
Palabras claves. Monitoreo proactivo, anticuerpos antifármaco, monitoreo reactivo.
Monitoring Serum Levels of Infliximab and Anti-Infliximab Antibodies in Pediatric Patients with Inflammatory Bowel Disease: Experience in a High Complexity Pediatric Hospital in Buenos Aires, Argentina
Summary
Introduction. Infliximab is the most widely used drug in the treatment of patients with inflammatory bowel disease in pediatrics. Monitoring its levels is the best predictor of response to treatment and is an important resource to optimize its use, since loss of primary or secondary response is a factor to consider, especially in pediatrics where therapeutic options are limited. Aim. To evaluate in patients with inflammatory bowel disease the serum levels of infliximab and anti-drug antibodies during induction and maintenance, as well as their relationship with the different variables that may alter the clearance of the drug. Material and Methods. Prospective, descriptive, longitudinal, observational study, from October 2021 to February 2023. The population was divided into 2 groups: Group A was composed of patients in induction (determinations in weeks 12-15), and Group B was composed of patients in maintenance (determinations immediately before the next drug infusion). Blood levels between 3-7 ug/ml were considered adequate and anti-drug antibodies > 10 AU/ml were considered elevated. Results. Fifty-eight patients were included, 81.03% (n=47) with Crohn’s disease and 18.9% (n=11) with ulcerative colitis. In Group A 20.6% needed treatment optimization and 19% showed loss of primary response, while in Group B , 64.4% showed loss of secondary response and the underlying mechanism of response could be determined, being immunogenic in more than 30% of patients. Conclusion. Knowing the levels of infliximab and anti-drug antibodies is a useful tool that in our experience has changed the course of patient management, allowing individualized follow-up and treatment.
Keywords. Therapeutic drug monitoring, antidrug antibody, proactive TDM, reactive TDM.
Abreviaturas
anti-TNF: Fármacos anti factor de necrosis tumoral.
EII: Enfermedades inflamatorias intestinales.
IFX: Infliximab.
TNF-α: Factor de necrosis tumoral alfa.
TDM: Therapeutic Drug Monitoring.
ATI: Anticuerpos antidroga.
ELISA: Enzyme-Linked Immunosorbent Assay.
IMC: Índice de masa corporal.
VEOIBD: Enfermedad inflamatoria intestinal de comienzo muy temprano.
PCR: Proteína C Reactiva.
Introducción
El desarrollo de las terapias biológicas y específicamente de los fármacos contra el factor de necrosis tumoral (anti-TNF) han modificado el pronóstico de las enfermedades inflamatorias intestinales (EII).
El infliximab (IFX) es un anticuerpo monoclonal IgG1 contra el factor de necrosis tumoral alfa (TNF-α), que ha demostrado ser efectivo para inducir y mantener la remisión en la enfermedad.1 Si bien ha revolucionado el tratamiento de la misma, entre 20 y 30% de los pacientes son refractarios al tratamiento, es decir que tienen pérdida de respuesta primaria, y más del 40% pierden la respuesta en la etapa de mantenimiento, es decir que presentan pérdida de la respuesta secundaria.2
La monitorización terapéutica, o Therapeutic Drug Monitoring (TDM) según sus siglas en inglés, es una estrategia de tratamiento individualizada basada en evaluaciones sistemáticas de las concentraciones séricas del fármaco, que ha sido propuesta como una herramienta clínica para optimizar la eficacia, la seguridad del paciente y el alto costo del uso de infliximab.3 Puede ayudar además a comprender el mecanismo subyacente a la pérdida de respuesta y guiar el enfoque del tratamiento.
Se considera una respuesta adecuada al tratamiento cuando el índice de actividad clínica desciende ≥ 20 puntos con respecto al nivel basal al iniciar el tratamiento. Los mecanismos subyacentes a la falta de respuesta son multifactoriales e incluyen características de la enfermedad (fenotipo, ubicación, gravedad), estrategia de tratamiento (régimen de dosificación) y factores relacionados con el fármaco (farmacocinética, farmacodinamia o inmunogenicidad).
La falla del tratamiento anti-TNF puede ser el resultado de una baja concentración de la droga dada por una dosis inadecuada o debido a un clearence acelerado, es decir, mecanismos farmacocinéticos; o estar presente debido a mecanismos farmacodinámicos, como la formación de anticuerpos antidroga (ATI), mediado por el sistema inmunitario, con concentraciones séricas del fármaco adecuados, hecho que se da en 10 a 60% de los pacientes tratados con infliximab.4 Además, los altos niveles de anticuerpos antidroga pueden influir en la farmacocinética y disminuir así sus concentraciones séricas, pudiendo asociarse también con efectos secundarios graves, como reacciones de hipersensibilidad, como la anafilaxia, que se produce hasta en un 10% de los pacientes.4
Se demostró que el uso combinado de inmunomoduladores como azatioprina, 6-mercaptopurina o metotrexato previene la formación de estos anticuerpos, dando una mejor respuesta terapéutica. Es de suma importancia optimizar el tratamiento en los niños en los que la EII suele ser más extensa y agresiva, con posibles complicaciones graves, como impacto en el crecimiento, la pubertad, la nutrición, la salud ósea y el riesgo acumulativo a largo plazo de complicaciones y discapacidad, a todo lo cual se suma que las opciones de tratamiento son limitadas.5
Varios factores parecen predecir la pérdida de respuesta primaria, como un índice de masa corporal alto, enfermedad grave, presencia de anticuerpos y ausencia de un inmunomodulador concomitante, hipoalbuminemia o anemia y comportamiento fibroestenótico, cirugía previa y mayor tiempo de evolución de la enfermedad.6
La presencia de una carga inflamatoria significativa, asociada a un rápido consumo de fármacos anti-TNF, y un bajo nivel de albúmina que conduce a la pérdida del fármaco a través de las heces, dan como resultado un mayor aclaramiento del fármaco y menores concentraciones séricas del anti-TNF, predisponiendo al desarrollo de anticuerpos antidrogas.7
El objetivo del estudio fue conocer en pacientes con enfermedad inflamatoria intestinal los niveles séricos de infliximab y los anticuerpos antidroga durante la inducción y el mantenimiento, y su relación con diferentes variables que pueden alterar el clearance de la droga.
Materiales y métodos
Estudio prospectivo, descriptivo, longitudinal y observacional llevado a cabo desde octubre 2021 hasta febrero 2023. Se incluyeron 58 pacientes de 0 a 18 años en tratamiento con infliximab (IFX), a quienes se les realizó un monitoreo de niveles séricos y anticuerpos mediante la técnica de ELISA. La población de estudio incluyó a pacientes con EII (enfermedad de Crohn y colitis ulcerosa) en seguimiento por el consultorio de Colitis del Hospital Garrahan. Los pacientes se dividieron en 2 grupos: Grupo A, en inducción (determinaciones en semana 12-15) y Grupo B, en mantenimiento (determinaciones previas inmediatamente a la siguiente infusión del fármaco). Se estimaron los niveles en sangre como adecuados si estaban entre 3-7 ug/ml y los anticuerpos antidroga (ATI) > 10 AU/ml fueron considerados elevados. Todos los datos fueron registrados en una base de datos confeccionada para tal fin y analizados. Se utilizó Chi-cuadrado o test de Fisher, según correspondiera, para las variables categóricas, y test-t / KW-Wilcoxon para las variables numéricas.
El estudio se realizó con la aprobación del Comité de Ética del Hospital «Prof. Dr. Juan P. Garrahan» respetando los principios de la Declaración de Helsinki. Asimismo, se contó con el consentimiento de los pacientes para la publicación de los datos recolectados.
Resultados
Se realizaron 67 determinaciones en 58 pacientes, con una edad comprendida entre 0 a 18 años (mediana de edad de 12 años), de los cuales el 50% (n=29) eran de sexo masculino, siendo más frecuente la enfermedad de Crohn 81,03% (n=47) que la colitis ulcerosa 18,9% (n=11).
En la TABLA 1 se resumen los datos demográficos de la muestra.
Tabla 1. Características demográficas y clínicas
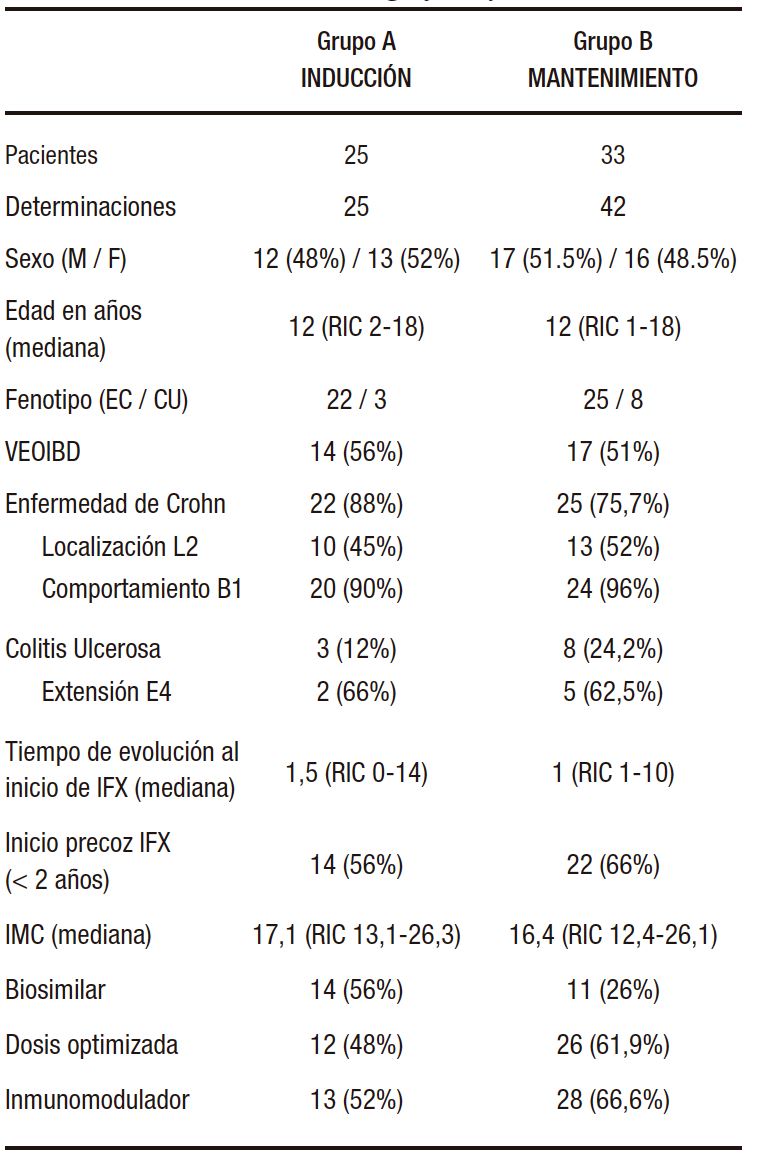
Dentro del Grupo A se incluyeron 25 pacientes a los que se realizaron 25 determinaciones. En este grupo hubo predomino del sexo femenino (52%; n=13), la mediana de edad fue de 12 años y el fenotipo predominante fue enfermedad de Crohn: 88% (n=22). El 56% (n=14) tenía diagnóstico de VEOIBD (“Very Early Onset Inflammatory Bowel Disease” – “Enfermedad inflamatoria intestinal de comienzo muy temprano”). La mediana de IMC para esta muestra fue de 17,1 kg/m2.
En aquellos pacientes con enfermedad de Crohn la localización más frecuente fue la colónica con un 45% (n=10) y el comportamiento inflamatorio (no fistulizante no estenosante) en el 90% (n=20). La extensión más frecuente fue la pancolitis en 66% (n=2) y con compromiso severo también en el 66% (n=2). Estos casos tenían diagnóstico de colitis ulcerosa.
En este grupo, la mediana de tiempo de evolución de la enfermedad hasta el inicio de tratamiento biológico con IFX fue de 1,5 años; el 56% de estos pacientes (n=14) recibió IFX de manera precoz (dentro de los 2 años del diagnóstico).
Treinta y tres pacientes formaron parte del Grupo B, y se les realizaron 42 determinaciones. Predominó el sexo masculino: 51% (n=17) y presentaron una mediana de edad de 12 años. El fenotipo predominante fue la enfermedad de Crohn en 75,7% de los casos (n=25), de los cuales el 51% (n=17) eran VEOIBD. La mediana de IMC para estos pacientes fue de 16,4 kg/m2.
Según las determinaciones realizadas, en aquellos pacientes con Enfermedad de Crohn, la localización más frecuente fue la colónica (52%; n=13) y se encontró comportamiento inflamatorio en el 96% (n=24). En la colitis ulcerosa, la extensión más frecuente fue la pancolitis (62,5%; n=5) y severa, también en el 62,5% de los casos (n=5).
En ese grupo la mediana de tiempo de evolución de la enfermedad hasta el inicio de IFX fue un año, y el 66% de estos pacientes (n=22) inició el tratamiento con IFX de manera precoz.
En la inducción, el 56% de los casos (n=14) recibió una droga biosimilar y en el 44% (n=11) se utilizó la droga innovadora. El 48% (n=12) recibieron dosis optimizada: 33,3% (n=4) en frecuencia, el 33,3% (n=4) en dosis, y 33,3% (n=4) en ambas, mientras que 52% (n=13) utilizaron la dosis estándar. El 52% (n=13) recibió tratamiento combinado con un inmunomodulador: 61,3% (n=8) azatioprina, 30,7% (n=4) 6-mercaptopurina y 4% (n=1) metotrexate.
Según las determinaciones realizadas durante el mantenimiento, el 26% (n=11) de los pacientes se encontraba utilizando un biosimilar y el 73% (n=31) la droga innovadora. De estos últimos, el 61,9% (n=26) se encontraban optimizados y el 38,09% (n=16) utilizaban dosis estándar. El 66,6% (n=28) recibían terapia combinada, correspondiendo 71,4% (n=20) a azatioprina, 21,5% (n=6) 6-mercaptopurina y 7,1% (n=2) a metotrexate.
En ambos grupos, se analizaron las variables relacionadas con el clearance acelerado de la droga resumidas en Tabla 2, como el sexo masculino (p 0.06), PCR elevada (PCR > 5 mg/l) (p 0.85), hipoalbuminemia (albúmina < 3,5 g/dl) (p 0.10), el inicio precoz del tratamiento con IFX (inicio < 2 años) (p 0.65), y número de deposiciones aumentadas (catarsis > 4 al día) (p 0.42), con niveles bajos de IFX (< 3 ug/ml), sin hallar asociaciones estadísticamente significativas.
Tabla 2. Variables relacionadas con el clearance de la droga
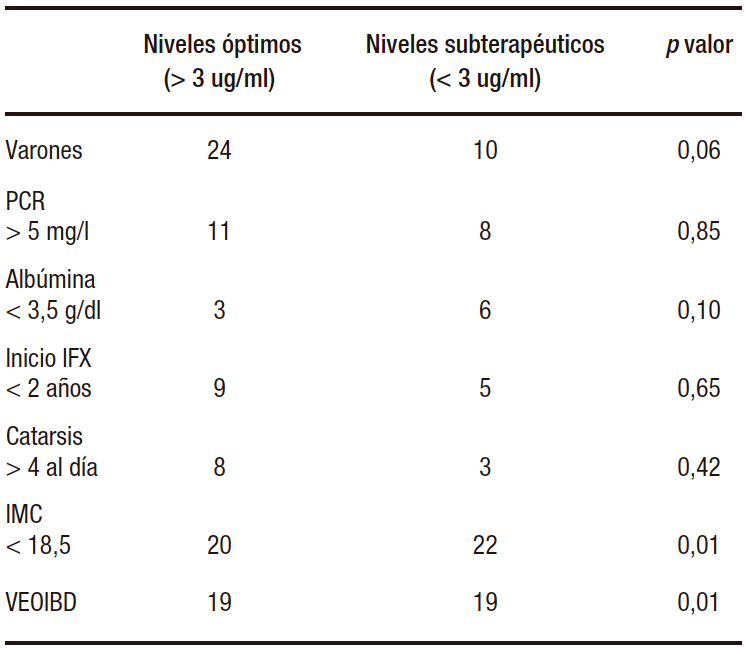
En cambio, con otras variables también relacionadas con el clearance acelerado de la droga se halló una asociación estadísticamente significativa con los niveles bajos de IFX. Esto ocurrió con el IMC bajo (< 18,5 kg/m2) (p 0.01) y los casos con VEOIBD (p 0.01).
En lo que respecta a los niveles séricos de IFX, la mediana en el Grupo A, es decir durante la inducción, fue de 14 ug/ml (RIC 0-45) y para el Grupo B, es decir para aquellos en mantenimiento, fue de 4 ug/ml (RIC 0.6-45).
En cuanto a los niveles de anticuerpos, la mediana para el Grupo A fue de 1 AU/ml (RIC 0-32), y para el Grupo B de 0,98 AU/ml (RIC 0-252).
En aquellos que se encontraban en terapia combinada, tanto en el Grupo A como en el Grupo B, no hubo diferencias significativas en cuanto a los niveles de IFX y la presencia de anticuerpos, en relación a los que no tenían un fármaco inmunomodulador asociado.
De acuerdo a los resultados obtenidos sobre los niveles de IFX y la presencia de anticuerpos, en el Grupo A el 60,3% fueron respondedores, el 20,6% debió optimizar y el 19% tuvo pérdida de respuesta primaria. En el Grupo B, el 64,4% de los pacientes tuvieron pérdida de respuesta secundaria, de éstos, en un 75,9% fue debido a un mecanismo farmacocinético, es decir concentraciones subterapéuticas, y el 24,1% debido a mecanismo farmacodinámico, es decir con concentraciones adecuadas. Dentro de este último grupo, un 31,9% fueron no respondedores debido a un mecanismo inmunológico (ATI > 10 AU/ml).
En ambos grupos, la respuesta clínica global fue del 60%, con remisión clínica en el 12% de los pacientes, mientras que el 28% fueron no respondedores.
Discusión
Este es el primer trabajo sobre la monitorización terapéutica en EII en Argentina. Hasta hace relativamente poco tiempo, el manejo de estos pacientes consistía en modificar de manera empírica el tratamiento, ya sea optimizando el fármaco (aumentando la dosis y/o acortando la frecuencia de administración), o cambiando a otro anti-TNF u otro biológico con diferente mecanismo de acción. Actualmente esta herramienta permite realizar un seguimiento y tratamiento individualizado, optimizando el uso de IFX, ya que se trata de la única alternativa aprobada en pediatría en nuestro medio.
Nuestra cohorte de pacientes en tratamiento con dicha droga eran predominantemente pacientes adolescentes con enfermedad de Crohn de tipo colónico sin diferencias significativas entre ambos sexos, aunque aproximadamente la mitad de ellos habían debutado de manera precoz con la enfermedad (VEOIBD). En los pacientes con diagnóstico de colitis ulcerosa, el compromiso pancolónico fue el más frecuentemente reportado. Dichos datos se correlacionan con lo descripto en la bibliografía.8
Tanto en el grupo de inducción como en el grupo de mantenimiento más del 50% de los pacientes iniciaron el tratamiento con anti-TNF antes de los 2 años del diagnóstico.
El Grupo A en su mayoría inició el tratamiento con un biosimilar a dosis estándar, a diferencia del Grupo B, donde predominantemente los niños recibían droga innovadora a dosis optimizada. En ambos grupos, más de la mitad de los pacientes recibieron tratamiento en terapia combinada, siendo la azatioprina el inmunomodulador más utilizado. Si bien existen estudios que han demostrado el beneficio de los inmunomoduladores en la farmacocinética e inmunogenicidad del IFX,9 no encontramos dicha asociación en nuestra muestra.
Tanto en la inducción como en el mantenimiento, sí encontramos asociación estadística entre los niveles de droga y el IMC bajo (< 18,5 kg/m2), así como niveles bajos entre los pacientes VEOIBD, lo cual coincide con lo reportado,10 y debe ser tenido en cuenta a la hora de ajustar la dosis de IFX.
En el seguimiento de esta enfermedad, el hecho de poder contar con dosajes de los niveles de IFX y la presencia de anticuerpos antidroga, nos permitió adecuar el tratamiento en un gran porcentaje de pacientes. Es importante considerar que los niveles de droga en sangre son dinámicos, dependiendo de la etapa de intervención (inducción versus mantenimiento), los objetivos del tratamiento (remisión clínica o endoscópica vs. histológica) y el comportamiento de la enfermedad (enfermedad luminal vs. perianal). En este trabajo se estimó (de manera arbitraria según los primeros reportes en la bibliografía)11 que los niveles en sangre eran adecuados entre 3-7 ug/ml, mientras que los anticuerpos antidroga (ATI) > 10 AU/ml fueron considerados elevados. En el Grupo A, si bien la mayoría de los pacientes tenían niveles en sangre adecuados (mediana de 14 ug/ml), el 20,6% debió optimizar y en el 19% se determinó pérdida de respuesta primaria, mientras que en el Grupo B, el 64,4% tuvo pérdida de respuesta secundaria, y se pudo determinar el mecanismo subyacente a la misma, siendo inmunogénico en más del 30% de los pacientes. Dichos porcentajes coinciden con lo publicado en la bibliografía en el seguimiento durante el tratamiento con IFX en estos pacientes.12
Dentro de las limitantes con las que nos encontramos durante el trabajo, estuvo la imposibilidad de evaluar la remisión mucosa en todos los pacientes considerados respondedores con niveles adecuados de droga en sangre y sin presencia de anticuerpos antidroga; tampoco fue posible realizar endoscopias en todos aquellos pacientes en los que se hicieron modificaciones terapéuticas según los resultados obtenidos.
Si bien esta herramienta surge como una estrategia que permite optimizar el tratamiento de manera proactiva, actualmente no existen en la bibliografía recomendaciones en cuanto a en qué pacientes y en qué momentos utilizarla.
Conclusión
La posibilidad de medir los niveles de IFX y anticuerpos antidroga es una herramienta útil, considerando la heterogeneidad de los pacientes pediátricos. Este instrumento nos permitió realizar un seguimiento individualizado, garantizando el control de la enfermedad en muchos pacientes, priorizando el beneficio del monitoreo frente a los costos, y teniendo en cuenta, además, que las opciones terapéuticas en pediatría son limitadas.
Asumir la falta de respuesta sin monitoreo implica optar por tratamientos alternativos, lo que supone un reto cuando las opciones son actualmente limitadas. Poder conocer el mecanismo al cual se debe la falta de respuesta nos permite poder adecuar el tratamiento en un gran número de pacientes, optimizando los recursos.
Consentimiento para la publicación. Se obtuvo el consentimiento informado por escrito del paciente o su padre, tutor o familiar, para la publicación de los datos y/o imágenes clínicas en beneficio de la ciencia. La copia del formulario de consentimiento se encuentra disponible para los editores de esta revista.
Propiedad intelectual. Los autores declaran que los datos y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Micheletti E, Eichhorn C, Antoniska M y col. Monitoreo de los niveles séricos de Infliximab y anticuerpos anti-infliximab en pacientes pediátricos con enfermedad inflamatoria intestinal: experiencia en un hospital pediátrico de alta complejidad de Buenos Aires, Argentina. Acta Gastroenterol Latinoam. 2024;54(2):141-146. https://doi.org/10.52787/agl.v54i2.405
Referencias
- Turner D, Ricciuto A, Lewis A, D’Amico F, Dhaliwal J, Griffiths A, et al. “STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD”; Gastroenterology.2021 Apr;160(5):1570-1583.
- Breton J, Kastl A, Conrad M, Baldassano R. “Positioning Biologic Therapies in the Management of Pediatric Inflammatory Bowel Disease”, Gastroenterol Hepatol (N Y). 2020 Aug;16(8):400-414.
- Van Rheenen PF, Aloi M, Assa A, Bronsky J, Escher J, et al. “The medical management of paediatric Crohn’s disease: an ECCO-ESPGHAN guideline update”. J Crohns Colitis. 2020 Oct 7:jjaa161.
- Syversen SW, Goll GL, Jørgensen K, Olsen I, Sandanger Ø, Gehin J, et al. “Therapeutic drug monitoring of infliximab compared to standard clinical treatment with inflix imab: study protocol for a randomised, controlled, open, paral lel-group, phase IV study (the NOR-DRUM study)”. Trials. 2020 Jan 6;21(1):13.
- Turner D, Ruemmele F, Orlanski-Meyer E, Griffiths A, De Carpi J, Bronsky J, et al. “Management of Paediatric Ulcerative colitis, Part 1: Ambulatory Care-An Evidence-Based Guideline from European Crohn’s and Colitis Organization and European Society of Paediatric Gastroenterology, Hepatology and Nutrition”. J Pedi atr Gastroenterol Nutr. (2018) 67:257-91.
- Vande Casteele N, Feagan B, Wolf D, Pop A, Yassine M, Horst S, et al. “Therapeutic Drug Monitoring of Tumor Necrosis Factor Antagonists in Crohn Disease: A Theoretical Construct to Apply Pharmacokinetics and Guidelines to Clinical Practice”. Inflamm Bowel Dis.2021 Jul 27; 27(8):1346-1355.
- Kaija-Leena Kolho, et al. “Therapeutic Drug Monitoring and Outcome of Infliximab Therapy in Pediatric Onset Inflammatory Bowel Disease”, Front. Pediatr., Volume 8 – 2020.
- Turner D, Ruemmele F, Orlanski-Meyer E, Griffiths A, De Carpi J, Bronsky J, et al. “Management of Paediatric Ulcerative Colitis, Part 2: Acute Severe Colitis-An Evidence-Based Consensus Guideline rom the European Crohn’s and Colitis Organization and the European Society of Paediatric Gastroenterology, Hepatology and Nutrition”. J Pediatr Gastroenterol Nutr. (2018) 67:292-310.
- Quera R, Moreno M, Simian D, Ibáñez P, Lubascher J, Figueroa C, et al. “Utilidad de la monitorización terapéutica de infliximab en el manejo de la enfermedad inflamatoria intestinal”. Rev. méd. Chile.2018 Nov;146(11):1241-1251.
- Akshay Kapoor and Eileen Crowley, “Advances in Therapeutic Drug Monitoring in Biologic Therapies for Pediatric Inflammatory Bowel Disease”, Front. Pediatr., Volume 9 – 2021, 2021.
- Pinto País I, Espinheira E, and Amil Días J. “Optimizing Antitumor Necrosis Factor Treatment in Pediatric Inflammatory Bowel Disease with Therapeutic Drug Monitoring”, May, 2020;
71:12-18. - Syversen SW, Goll GL, Jørgensen K, Olsen I, Sandanger Ø, Gehin J, et al. “Therapeutic drug monitoring of infliximab compared to standard clinical treatment with infliximab: study protocol for a randomised, controlled, open, parallel-group, phase IV study (the NOR-DRUM study)”. Trials. 2020 Jan 6;21(1):13.
Correspondencia: Eugenia Micheletti
Correo electrónico: maeugeniamch@gmail.com
Acta Gastroenterol Latinoam 2024;54(2):141-146
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE



