Irina Luzko1 ID· Patricio Medel-Jara2 ID· Joan Llach1 ID· Diego Reyes3 ID Leticia Moreira1 ID Arnoldo Riquelme4 ID
1 Hospital Clínic de Barcelona, Centro de Investigación Biomédica en Red en Enfermedades Hepáticas y Digestivas (CIBERehd), IDIBAPS (Institut d’Investigacions Biomèdiques August Pi i Sunyer), Universidad de Barcelona, Barcelona, Spain.
2 Programa de Farmacología y Toxicología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
3 Departamento de Gastroenterología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
4 Centro de Control y Prevención del Cáncer (CECAN), Santiago, Chile.
Acta Gastroenterol Latinoam 2023;53(3):241-254
Recibido: 13/09/2023 / Aceptado: 25/09/2023 / Publicado online el 29/09/2023 / https://doi.org/10.52787/agl.v53i3.349
Resumen
El cáncer gástrico es uno de los cánceres más frecuentes en todo el mundo. Tiene un mal pronóstico asociado con un diagnóstico en etapa tardía, lo que disminuye significativamente la supervivencia general. Esto resalta la importancia de la prevención y la detección temprana para mejorar el curso clínico de los pacientes. La prevención y el diagnóstico precoz del cáncer gástrico ejemplifican a la perfección el modelo de medicina de precisión, un enfoque de atención médica que busca que la prioridad recaiga más en el individuo que en la población general. Para alcanzarlo, no sólo es imprescindible un extenso conocimiento de la enfermedad, sino que también resultan claves la identificación de los factores individuales, y la comprensión de diferencias genéticas, moleculares y ambientales. Esto permite diseñar estrategias de abordaje mucho más personalizadas. Con esta aproximación en la prevención del cáncer gástrico, el sujeto aparece siempre en el centro. Las medidas se focalizan directamente en el individuo y, secundariamente, conducen a la optimización del uso de los recursos. En esta revisión se analizan brevemente las estrategias de prevención primaria del cáncer gástrico en base a la detección y erradicación del Helicobacter pylori. Por otro lado, se describen como potenciales medidas de prevención secundaria algunos de los biomarcadores más prometedores para la detección y el diagnóstico del cáncer gástrico precoz, identificados en la sangre, la saliva, la orina, las heces y el jugo gástrico.
Palabras claves. Cáncer gástrico, prevención primaria, prevención secundaria, Helicobacter pylori, biomarcadores, medicina de precisión.
Precision Medicine in the Primary and Secondary Prevention of Gastric Cancer
Summary
Gastric cancer is one of the most frequent cancers worldwide. It has a poor prognosis associated with late-stage diagnosis, that significantly decreases overall survival. This highlights the importance of prevention and early detection to improve the clinical course of patients. Prevention and early diagnosis of gastric cancer perfectly exemplify the model of precision medicine, a healthcare approach that seeks to place the burden more on the individual than on the general population. This requires not only a comprehensive knowledge of the disease but also the identification of individual factors and the understanding of genetic, molecular and environmental differences, which are key to the development of much more personalized treatment strategies. With this approach, in gastric cancer prevention the subject is always at the center, the measures focus directly on the individual and, secondarily, lead to the optimization of the use of resources. This review briefly discusses primary prevention strategies for gastric cancer based on detection and eradication of Helicobacter pylori and, on the other hand, describes some of the most promising biomarkers for the detection and diagnosis of early gastric cancer identified in blood, saliva, urine, feces, and gastric juice, all of which are components of potential secondary prevention measures.
Keywords. Gastric cancer, primary prevention, secondary prevention, Helicobacter pylori, biomarkers, precision medicine.
Abreviaturas
CG: Cáncer gástrico.
H. pylori: Helicobacter pylori.
GCA: Gastritis crónica atrófica.
MI: Metaplasia intestinal.
RR: Riesgo relativo.
EDA: Endoscopia digestiva alta.
NIH: Instituto Nacional de Salud.
IBPs: Inhibidores de la bomba de protones.
P-CAB: Bloqueadores de ácido competitivos con potasio.
IMC: Índice de masa corporal.
CEA: Antígeno carcinoembrionario.
miARN: microARN.
circARN: ARN circulares.
lncARN: ARN largos no codificantes.
qRT-PCR: Polimerasa con transcriptasa inversa cuantitativa.
AUC: Área bajo la curva.
PGI/II: Relación pepsinógeno I/II.
TFF3: Factor 3 de trefoil.
hs-RCP: Proteína C reactiva de alta sensibilidad.
MIF: Factor inhibidor de migración de macrófagos.
Introducción
Generalidades del cáncer gástrico
El cáncer gástrico (CG) es uno de los cánceres más frecuentes en el mundo, ocupando el quinto lugar en términos de incidencia y el cuarto en términos de mortalidad, según los datos de GLOBOCAN de 2020.1 Los pacientes habitualmente se encuentran asintomáticos al inicio de la enfermedad, por lo que el diagnóstico se suele realizar en estadios avanzados.2 Este hecho condiciona un pronóstico desfavorable, disminuyendo significativamente la supervivencia, la cual es menor al 5% cuando existe diseminación a distancia. Por ello es fundamental el estudio de nuevos marcadores para la prevención, cribado y diagnóstico precoz del CG para mejorar la evolución clínica de los pacientes.3,4
Prevención primaria
La prevención primaria en el CG se centra en tratar de eliminar o reducir los factores de riesgo conocidos que puedan conducir al desarrollo de esta neoplasia. Se recomienda una dieta equilibrada, la abstinencia de alcohol y tabaco y, cuando corresponda, la detección de Helicobacter pylori (H. pylori).
La correlación entre los factores dietéticos y el riesgo de CG ha sido ampliamente estudiada, recomendándose una dieta rica en frutas y verduras, y baja en carnes rojas y alimentos conservados en sal o ahumados.5 Asimismo, el consumo de alcohol y tabaco también está claramente relacionado con un aumento de la incidencia del CG y ambos factores pueden actuar de forma sinérgica. En un meta-análisis publicado en 20116 se demostró que tanto el consumo leve a moderado de alcohol como el consumo excesivo (definido como > 4 unidades de bebida al día) aumenta de forma significativa el riesgo de esta neoplasia, con un riesgo relativo (RR) de 1,07 (1,01 – 1,013, IC 95%) y 1,20 (1,01 – 1,44, IC 95%), respectivamente. Respecto al tabaco, otro meta-análisis publicado en 2014 demostró que los fumadores, tanto hombres como mujeres, presentaron una asociación dosis-dependiente con el desarrollo de CG.7
Por otro lado, el factor de riesgo mejor establecido para el desarrollo del CG es la infección por H. pylori, que produce inicialmente una inflamación en la mucosa gástrica y desencadena las fases de la carcinogénesis gástrica: gastritis crónica atrófica -GCA-, metaplasia intestinal -MI- y displasia (Cascada de Correa). Los individuos con dicha infección presentan un aumento del riesgo de CG de más del doble respecto a los sujetos no infectados, con un odds ratio de 2,04 (1,69 – 2,45 IC 95%).8 En este mismo sentido, Choi IJ y colaboradores,9 reportaron recientemente un ensayo clínico en el que se aleatorizaron a más de 1.500 individuos con al menos un familiar de primer grado con CG, exponiéndolos a un tratamiento para erradicar el H. pylori o a placebo; se demostró que el tratamiento de erradicación reducía significativamente el riesgo de desarrollar CG en esa población (hazard ratio 0,2; IC 95% 0,1-0,7). Por todo ello se recomienda el tamizaje de H. pylori y su tratamiento en todos los individuos que presenten un familiar de primer grado con CG.
Otro ejemplo de prevención primaria en CG sería el caso de individuos portadores de una variante patogénica germinal en CDH1, alteración causante del síndrome de cáncer gástrico difuso hereditario. Los portadores de esta alteración genética tienen un riesgo tan elevado de desarrollar la enfermedad (56% a 70% a lo largo de la vida) que en ocasiones puede recomendarse la gastrectomía profiláctica.10
Prevención secundaria
La prevención secundaria del CG se centra en la detección y tratamiento de esta neoplasia en etapas precoces y de sus lesiones precursoras. Aquí es donde entran en acción el uso de biomarcadores y los programas de cribado y de vigilancia endoscópica. Nos referimos a “cribado” cuando hablamos de estrategias de prevención a nivel poblacional, y de “vigilancia” cuando hacemos referencia a poblaciones de alto riesgo de desarrollar la neoplasia. Para que ambas estrategias sean efectivas, debe conocerse bien la enfermedad, identificando lesiones que la precedan y nos permitan actuar en etapas iniciales. En este caso, sabemos que la infección por H. pylori produce una inflamación en la mucosa gástrica que desencadena las fases de la carcinogénesis gástrica de tipo intestinal de acuerdo con la ya mencionada Cascada de Correa.11
Actualmente, el gold standard para la detección del CG es la endoscopia digestiva alta (EDA) con biopsias tisulares, con una sensibilidad del 69% y una especificidad del 96%.12 Con los últimos modelos de EDA de alta definición y las técnicas de cromoendoscopia virtual y convencional, esta prueba permite el diagnóstico de lesiones precursoras de CG, de CG precoz y, cuando existe una lesión visible, su tratamiento en las etapas iniciales.
Se han llevado a cabo programas de cribado poblacional en países con alta incidencia de CG como Corea del Sur o Japón, con el objetivo de disminuir la morbimortalidad asociada a esta enfermedad.13 Estos estudios mostraron un aumento en la detección de cánceres tratables y una mejoría de la supervivencia global a cinco años. Sin embargo, son programas de difícil implementación y no son rentables como estrategia masiva de cribado en la mayoría de los países y escenarios clínicos.14-16
Es importante mencionar las poblaciones de riesgo que pueden beneficiarse de programas de vigilancia endoscópica. Es el caso de poblaciones que por sus características tienen un mayor riesgo de desarrollar CG a lo largo de su vida. Además de erradicar la infección por H. pylori si corresponde, se recomienda realizar EDA de vigilancia periódicas a pacientes con lesiones precursoras de alto riesgo (como la MI incompleta o la displasia), y a pacientes con condiciones familiares o hereditarias de alto riesgo. Este último sería el caso de individuos sanos con importante agregación familiar de CG intestinal y pacientes con variantes patogénicas de la línea germinal asociadas al CG. Las estrategias de vigilancia serán seleccionadas en función del área geográfica y del contexto en el que nos encontremos, con el objetivo de detectar lesiones precursoras o CG en etapas iniciales e implementar su tratamiento.
Si bien las estrategias generales de prevención primaria y secundaria de CG son importantes, cada vez cobra más relevancia implementar una medicina de precisión, la cual consiste en estrategias personalizadas que nos dirijan a establecer la medida de prevención o terapéutica más adecuada para cada individuo.
Medicina de precisión
De acuerdo con el Instituto Nacional de Salud (NIH, por sus siglas en inglés) se entiende por Medicina de Precisión, también conocida como Medicina Personalizada, a la aproximación que utiliza información del individuo -ya sea genómica, ambiental o de su estilo de vida- para guiar las decisiones en su manejo clínico. Tiene el propósito de que la prevención, el diagnóstico y tratamiento de la enfermedad sean ejecutados con mayor precisión.17 Este enfoque permite que los médicos predigan precisamente qué estrategia de tratamiento o medida de prevención es la idónea para una persona o un grupo particular de la población, buscando administrar el tratamiento que tenga la mayor probabilidad de éxito.
Es el contraste del enfoque único para todos (del concepto en inglés “one-size-fits-all”), en el cual el tratamiento y la prevención se desarrollan para el promedio de la población, ponderando menos las diferencias entre los individuos que la componen.18
En esta revisión exponemos brevemente las potenciales medidas de prevención primaria y secundaria del CG basadas en la medicina de precisión; quedando fuera del foco, en esta ocasión, las condiciones de alto riesgo de CG y las estrategias con fines terapéuticos.
Medicina de precisión en la prevención primaria del CG: tratamiento personalizado del H. pylori
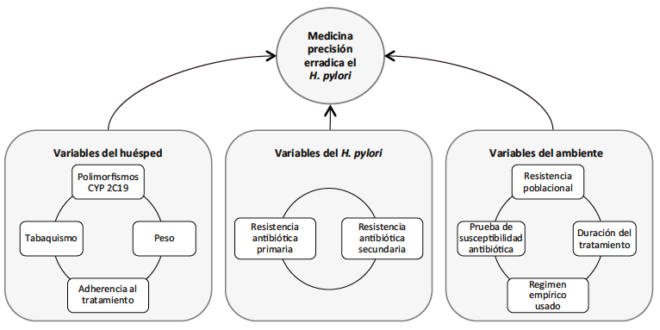
La aplicación del concepto de medicina de precisión para erradicar el H. pylori se observa en la optimización del tratamiento de erradicación. Considerando que es una enfermedad infecciosa, la optimización se hace midiendo variables del huésped (o individuo), del ambiente o de la cepa de H. pylori en cuestión (Figura 1). El proceso de optimizar el esquema de erradicación se concreta con la elección de los antibióticos, inhibidores de la bomba de protones (IBPs) o bloqueadores de ácido competitivos con potasio (P-CAB), las dosis de los fármacos y la duración del tratamiento.
Figura 1. Medicina de precisión para la erradicación del H. pylori
Con respecto al individuo, uno de los parámetros importantes a considerar es el efecto de los polimorfismos del CYP2C19 en la efectividad de la erradicación. Los IBPs son pro-drogas que se metabolizan rápidamente a nivel hepático. Aquellas personas que tienen mayores cantidades de esta enzima son los metabolizadores extensos homocigotos y quienes tienen menor capacidad de la enzima son los metabolizadores lentos, que tienen variantes de los alelos con “pérdida de función”. Entre ambos grupos existen diferencias farmacocinéticas importantes de los IBPs. Los metabolizadores lentos suelen tener mejores tasas de erradicación en los tratamientos con IBPs que son metabolizados por CYP2C19.19
Otro aspecto relacionado con el huésped es la adherencia al esquema de erradicación indicado. Una revisión sistemática reciente de Zeng y colaboradores20 objetivó que los pacientes tuvieron una mejor adherencia terapéutica secundaria a un refuerzo activo a través de comunicaciones directas, llamados telefónicos, mensajes de texto y otros softwares; lo que resultó en una mayor tasa de adherencia, de 89,6% vs. 71,4% (RR = 1,26; 95% CI: 1,16 – 1,37), y en una mayor tasa de erradicación en el análisis por intención de tratar (ITT) de 80,2% vs. 65,9% (RR = 1,25, 95% CI: 1,12 – 1,31) y por protocolo de 86,8% vs. 74,8% (RR = 1,16, 95% CI: 1,09 – 1,23).20
Respecto al tabaquismo y al consumo de alcohol, ambos son factores del individuo que pueden disminuir la tasa de éxito de la erradicación del H. pylori. Yu y colaboradores muestran en su meta-análisis que el tabaquismo aumenta la tasa de falla del tratamiento de erradicación del H. pylori (OR = 1,70, 95% CI = 1,49 – 1,93).21 Respecto al alcohol, el análisis de una gran cohorte de 94.901 pacientes indica que el consumo de alcohol aumenta significativamente la tasa de fallo del tratamiento de erradicación (OR: 1,11-1,29,
p < 0.001).22 En términos de medicina de precisión, estos datos son relevantes, porque ensayos clínicos aleatorizados recientes reportan que este efecto no se ve con el uso de P-CABs,23 lo cual puede constituir una alternativa para los pacientes fumadores o que consumen alcohol, cuando los P-CABs sean introducidos en los mercados latinoamericanos.
El peso del paciente es otro de los factores individuales que pueden afectar el resultado del tratamiento de erradicación. En la cohorte de Pan y colaboradores, con población de un condado en China, se observó que el riesgo de fallo del tratamiento de erradicación aumentaba según el índice de masa corporal (IMC). Las personas con IMC mayor a 30 tuvieron un RR = 1,19, 95% CI = 1,03 – 1,37 de probabilidad de fallo en la erradicación del H. pylori.22 Para la medicina de precisión, esta evidencia indica que puede ser necesario ajustar las dosis de los fármacos de acuerdo con el peso del paciente, tema que está comenzando a ser estudiado por algunos grupos de investigación latinoamericanos.
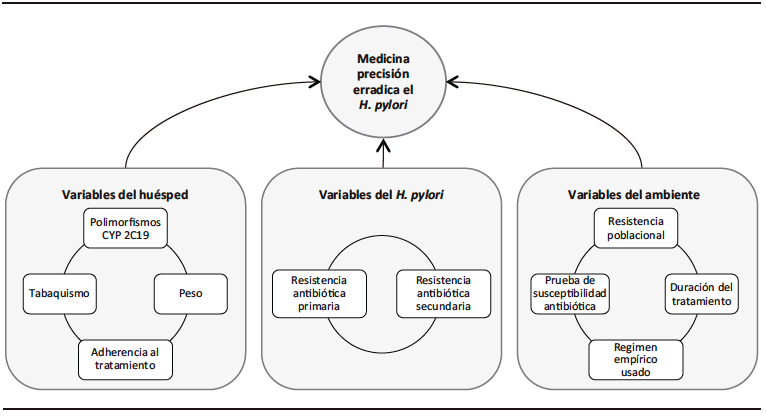
Con respecto a la cepa del H. pylori que haya infectado al paciente, la variable más importante es su resistencia antibiótica. Se distinguen las resistencias primarias, presentes en el paciente antes del primer intento de erradicación, y las resistencias secundarias, presentes después de al menos un intento de erradicación fallido.24 El impacto de la resistencia antibiótica en la tasa de erradicación depende del antibiótico en particular. Un reciente meta-análisis indica que la resistencia a la claritromicina disminuye la probabilidad de erradicación en un 32,8% (RR = 0,682; 95% CI: 0,636 – 0,731), la resistencia al metronidazol la disminuye en un 25,7% (RR = 0,843; 95% CI: 0,810-0,877), la resistencia al levofloxacino la disminuye en un 30,6% (RR = 0,794; 95% CI: 0,669 – 0,941) y la resistencia dual a la claritromicina y al metronidazol la disminuye en un 32,6% (RR = 0,674; 95% CI: 0,590 – 0,770).25 La Tabla 1 otorga detalles sobre los métodos para evaluar la resistencia antibiótica del H. pylori.
Tabla 1. Características de los diferentes métodos para probar la susceptibilidad antibiótica del H. pylori72
Por último, se encuentran las variables que pueden considerarse del ambiente, relacionadas con la resistencia poblacional y que se pueden agrupar como componentes de la práctica clínica habitual: lugar donde se hace el diagnóstico (uso de pruebas de susceptibilidad del H. pylori) y tratamiento (esquema empírico usado y su duración).
Así lo especifica el último “Consenso de Maastricht VI/ Florencia para el manejo de la infección por Helicobacter pylori”, el cual recomienda usar tratamientos guiados por resultados de susceptibilidad previa a la administración del primer tratamiento de erradicación del
H. pylori.26 Esta estrategia ha demostrado ser superior en los tratamientos de primera línea con un RR = 1,14 (95% CI = 1,08 – 1,12) según un meta-análisis de Ma y colaboradores.27
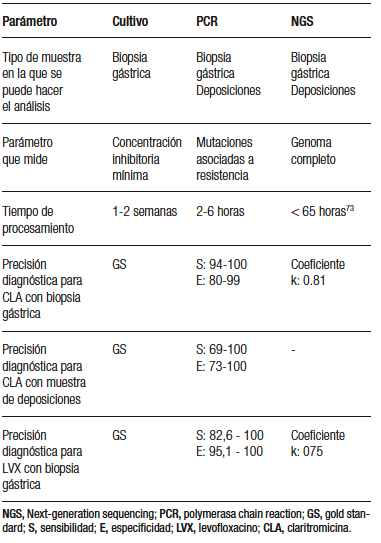
En el caso de que no exista la posibilidad de utilizar tratamientos guiados por ensayos de susceptibilidad, hay que utilizar tratamientos empíricos, en los que la resistencia poblacional es un aspecto esencial. Debe considerarse la información local más actualizada disponible para que el tratamiento tenga la mayor probabilidad de erradicación posible. En concreto, el consenso recomienda utilizar terapia cuádruple con bismuto como tratamiento empírico de primera línea, si existe una prevalencia de resistencia a la claritromicina mayor al 15% o ésta es desconocida.26 En la Figura 2 se muestra el tratamiento del paciente con infección por H. pylori segun la evidencia local en Chile.
Por último, en relación a la elección de la duración del tratamiento de erradicación, los regímenes de 14 días tienen mejores tasas de erradicación que los de menos días de duración, tanto para las terapias triples28 como para las cuádruples.26 Por lo tanto, se recomienda una duración del tratamiento de 14 días.
Figura 2. Manejo del paciente con infección por H. pylori, considerando el uso de la prueba de susceptibilidad antibiótica de la bacteria después del fracaso del tratamiento empírico de primera y segunda línea. Los ejemplos descritos corresponden a la evidencia local en Chile, para más detalles referirse a Reyes et al.74 TD: terapia dual con amoxicilina 1g cada 8 horas + esomeprazol 40mg cada 8 horas. TC: terapia concomitante con esomeprazol 40mg cada 12 horas + amoxicilina 1g cada 12 horas + metronidazol 500mg cada 12 horas + claritromicina 500mg cada 12 horas. TCB: terapia cuádruple con bismuto, usando esomeprazol 40mg cada 8 horas + amoxicilina 1g cada 8 horas + metronidazol 500 mg cada 8 horas + subsalicilato de bismuto 350mg cada 8 horas. TCT: terapia cuádruple con tetraciclina, usando esomeprazol 40mg cada 8 horas + tetraciclina 500mg cada 8 horas, + metronidazol 500mg cada 8 horas + subsalicilato de bismuto 350mg cada 8 horas
Medicina de precisión en la prevención secundaria del cáncer gástrico: biomarcadores de riesgo para el cribado del cáncer gástrico y sus lesiones precursoras
Actualmente, los biomarcadores utilizados con frecuencia en la práctica clínica rutinaria para la detección del CG son el antígeno carcinoembrionario (CEA) o antígenos de carbohidratos como el CA 19-9 o el CA 72-4.
Sin embargo, tienen una sensibilidad y especificidad limitadas, no son exclusivos para el diagnóstico de CG,29 su tasa de detección de CG precoz es muy baja,30 y no son útiles para la detección de lesiones premalignas como GCA, MI y displasia. Por lo tanto, identificar biomarcadores capaces de detectar estos pasos sería de gran ayuda.
Los biomarcadores son moléculas biológicas involucradas parcial o totalmente en el proceso de carcinogénesis y, en consecuencia, pueden revelar cambios anormales en el paciente.31 Idealmente, deberían ser no invasivos, sensibles, específicos, rentables y fáciles de implementar en la práctica clínica diaria. Teniendo esto en cuenta, la biopsia líquida sería una buena herramienta para lograr estos objetivos. En este contexto, la sangre, la orina, las heces, la saliva o el jugo gástrico se consideran fluidos prometedores para encontrar nuevos biomarcadores
(Figura 3).
Figura 3. Esquema de algunos de los biomarcadores no invasivos más importantes en el estudio del cribado de cáncer gástrico. Adaptado de Herrera-Pariente et al.4
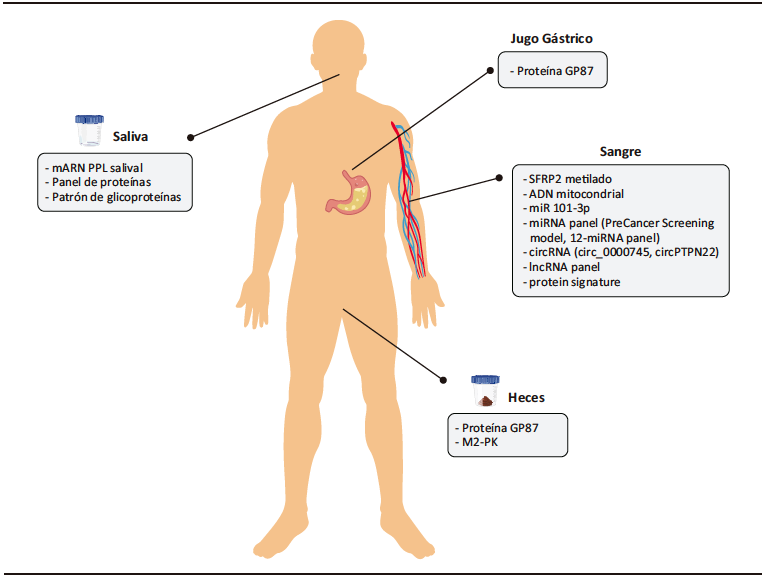
a. Biomarcadores sanguíneos
Una gran variedad de moléculas en la sangre se ha asociado con la carcinogénesis del CG. Entre ellas, se pueden destacar el ADN, las proteínas y las moléculas de ARN no codificantes, como los microARN (miARN), los ARN circulares (circARN) y los ARN largos no codificantes (lncARN). Estas moléculas posibilitan el descubrimiento de nuevos biomarcadores no invasivos para el CG en sangre. Las muestras en sangre tienen ventajas sobre las endoscopias y biopsias al ser mínimamente invasivas, fáciles de obtener y de uso rutinario. Además, son bastante aceptadas por la población general y con un costo sostenible.
i. ADN circulante/ ADN libre (cfDNA)
Varios estudios han identificado la metilación del ADN como un evento epigenético frecuente en la carcinogénesis del CG. Sin embargo, la metilación del ADN puede ocurrir en células no cancerígenas, y los biomarcadores deben ser específicos.32 RUNX3, SFRP2 o RPRML son algunos de los genes metilados sugeridos como biomarcadores no invasivos para la detección temprana del CG.33-35
La metilación del gen SFRP2 obtuvo una sensibilidad del 60,9% y una especificidad del 86% en una cohorte de 92 pacientes con CG y 50 controles. Además, este biomarcador también pudo identificar pacientes con MI con una sensibilidad del 56,3%. Sin embargo, las diferencias entre las tasas de detección positiva de SFRP2 metilado en plasma en pacientes con CG y pacientes con MI no fueron significativas, probablemente debido a que el número de pacientes con MI fue muy bajo.34 Aunque se requieren estudios adicionales, este biomarcador podría ser interesante para el cribado del CG y sus lesiones premalignas.
En lo relativo a lesiones precursoras del CG, se han observado mejores resultados con la metilación del gen RPRML, también conocido como Reprimo-like, que con el gen SFRP2. Se ha descubierto que se encuentra metilado no solo en pacientes con CG, sino también en aquellos con MI, encontrándose niveles más altos en el CG, menores en la displasia, y más bajos en la MI. Un estudio reciente36 analizó un total de 150 muestras de plasma
(50 pacientes con CG, 50 con displasia, 50 con GCA y MI, y 30 individuos sanos) y observó que la metilación de la región promotora del gen RPRML podría ser un evento temprano en la carcinogénesis gástrica, por lo tanto, podría ser un biomarcador interesante para el CG temprano y sus lesiones precursoras.
El ADN mitocondrial también se ha propuesto como un biomarcador sanguíneo, ya que se han observado niveles más altos en pacientes con CG en comparación con individuos sanos. Fernandes y colaboradores identificaron tres intervalos (I, II y III) de valores crecientes de ADN mitocondrial (< 2,2 – 20 y > 20). El intervalo I estaba compuesto por gastritis no atrófica y algunas muestras de CG, el intervalo II estaba compuesto por controles sanos y el intervalo III estaba compuesto exclusivamente por pacientes con CG. Se ha propuesto monitorizar periódicamente por endoscopia como prevención eficaz del desarrollo de CG a los pacientes con niveles disminuidos dado que presentan potencialmente mayor riesgo de CG. En los pacientes que se detecta aumento de niveles, la presencia de lesiones de CG debería sospecharse y realizarse un estudio dirigido. Sin embargo, algunos pacientes con los mismos niveles de ADN mitocondrial que el grupo de pacientes asintomáticos presentaron lesiones precancerosas o de CG; por lo tanto, se necesitan más estudios para aclarar este hallazgo. En este contexto, los autores sugirieron que el nivel de ADN mitocondrial se podría combinar con los niveles de IL-8 para aumentar su valor diagnóstico, aunque esta propuesta debe ser validada en profundidad.37
ii. ARN no codificante
a) microARN
Los miARN son ARNs no codificantes cortos de 20 a 25 nucleótidos. Desempeñan un papel crucial en diversas funciones celulares como la diferenciación, el crecimiento y la apoptosis, y están involucrados en la carcinogénesis gástrica.38 Además, su identificación puede llevarse a cabo mediante diversas técnicas de laboratorio rutinarias, como la reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa (qRT-PCR) o mediante microarrays. Por lo tanto, los biomarcadores basados en la expresión de miARN parecen ser adecuados para el diagnóstico del CG.
En este contexto, una estrategia interesante es el uso de los exosomas, que son vesículas extracelulares de aproximadamente 100 nm de diámetro que contienen ADN, ARN o proteínas, y son liberadas activamente por las células tumorales viables (por lo que podrían ofrecer una representación de la dinámica del tumor).39 Los exosomas han demostrado un papel en la identificación de nuevos biomarcadores diagnósticos, aunque también están involucrados en otras funciones como respuesta inmune, metástasis o resistencia a fármacos.40 Además, previenen la degradación de los miARN por la enzima ribonucleasa (RNasa).41 Sin embargo, para el aislamiento de biomarcadores utilizando exosomas son necesarias técnicas rápidas y precisas, con métodos que pueden ser complejos y costosos. Esto sumado al bajo rendimiento en el aislamiento de exosomas limita su aplicabilidad clínica.
Zheng y colaboradores estudiaron el miR-590-5p exosomal mediante qRT-PCR en 168 muestras de suero de pacientes con CG y 50 controles. Se encontró que la expresión del miR-590-5p exosomal era menor en los pacientes con CG que en los controles sanos. Además, los niveles fueron inferiores en el CG en estadios avanzados en comparación con los estadios más precoces, lo que sugiere que el miARN puede ser un biomarcador prometedor para la detección temprana del CG. Los autores también compararon este biomarcador con los marcadores séricos tradicionales como CA72-4, CEA y CA19-9, obteniendo los mejores valores de sensibilidad y precisión para el diagnóstico de CG utilizando el miR-590-rp exosomal. El área bajo la curva (AUC) para este miARN fue de 0,81 con una sensibilidad de 63,7% y una especificidad de 86%. Aunque se necesite validación en una cohorte externa más extensa, se trata de una estrategia interesante para continuar estudios con otros análisis posteriores.42
El miR-1246 exosomal se ha identificado sobre expresado en muestras séricas de pacientes con CG mediante qRT-PCR. Este miARN fue capaz de discriminar a individuos sanos de enfermos con un AUC de 0,91 y valores de sensibilidad y especificidad de 82,3% y 86% respectivamente.43 Se analizaron un total 85 pacientes con CG, 30 con patología gástrica benigna (úlcera gástrica, GCA y pólipos gástricos) y 50 individuos sanos. Los autores también identificaron que los niveles circulantes de miR-1247 exosomal aumentaron gradualmente en pacientes en estadios I-II hasta los pacientes en estadios III-IV. Asimismo, este miARN pudo distinguir a los pacientes en estadio I de los individuos sanos y de los pacientes con patologías benignas con un AUC de 0,84 y 0,81 respectivamente.43 Esto convierte al miR-1246 en un biomarcador interesante para el diagnóstico del CG precoz.
Los miR-376C, miR-21 o miR-101-3p han mostrado resultados interesantes en el contexto del cribado.44-46 En un estudio, se cuantificó el miR-101-3p en 61 pacientes con GCA, 86 pacientes con CG y 50 controles sanos mediante qRT-PCR. Los autores observaron que el miR-101-3p tuvo un alto valor diagnóstico para la GCA y el CG con un AUC de 0,85 y 0,87 respectivamente. Sin embargo, para distinguir entre pacientes con GCA y pacientes con CG la mejor estrategia fue la combinación de miR-101-3p con el pepsinógeno I y la relación pepsinógeno I/II (PGI/II), con un AUC de 0,856.46
Como se puede observar, la combinación de diferentes biomarcadores puede mejorar el rendimiento diagnóstico. Considerando este supuesto, se han propuesto diferentes combinaciones de biomarcadores. Por ejemplo, se desarrolló una herramienta llamada Modelo de Screening Pre-Cáncer que combina la edad y dos miARN (miR-19-3p y miR-483-5p). La cohorte de estudio incluyó a 70 pacientes con GCA, 20 con neoplasia intraepitelial de bajo grado, 34 con neoplasia intraepitelial de alto grado y 56 con CG en estadios tempranos. Este modelo mostró un AUC de 0,84 con valores de sensibilidad y especificidad del 87,7% y 62,8% respectivamente, para diagnosticar el CG precoz y las lesiones precancerosas, mostrando así un mejor rendimiento que cualquier miARN individual. Sin embargo, aún se necesita validación multicéntrica antes de utilizar el Modelo de Screening de Pre-Cáncer en la práctica rutinaria.47
Otro panel de miARN en suero fue descrito recientemente en un ensayo multitarget de miARN en más de 5000 individuos de Singapur y Corea. Este panel se basó en 12 miARN, y obtuvo en la fase prospectiva un AUC de 0,848 y valores de sensibilidad y especificidad de 87% y 68,4% respectivamente, para distinguir el CG de los controles sanos. Utilizando su panel de miARN pudieron reducir el número de endoscopias de 40 a 15 para detectar un paciente con CG en esta población y aumentar la adherencia como estrategia de cribado masivo, ya que es una prueba no invasiva en comparación con la endoscopia alta. Como se vio previamente en otros estudios, los autores confirmaron que la combinación de este panel de 12 miARN con la edad del paciente, la serología de H. pylori y la PGI/II mejoró el AUC a 0,884 y la especificidad a 69,4%, manteniendo el valor de sensibilidad para la detección del CG. Esto muestra que combinar distintos tipos de biomarcadores aumenta la precisión de detección.48
Considerando que la expresión de los biomarcadores puede cambiar durante el desarrollo del tumor,49 podría ser beneficioso diseñar paneles que abarquen varias fases de la progresión y permitan evaluar el desarrollo de la lesión sin necesidad de una biopsia sólida.
b) ARN circulares
El circARN es también un ARN no codificante que se genera a partir de intrones o exones mediante bucles intrónicos o empalmes inversos. Ha mostrado ventajas como biomarcador para el diagnóstico de tumores debido a sus funciones y propiedades biológicas. Así como se mencionó con otro tipo de moléculas, la combinación de diferentes biomarcadores aumenta la capacidad de detección y esto también se puede aplicar a los circARN. Por ejemplo, el circ_0000745 plasmático aumentó el AUC de 0,683 a 0,775 cuando se combinó con el nivel de CEA para distinguir a los pacientes con CG de los individuos sanos. Sin embargo, la sensibilidad disminuyó mientras que la especificidad aumentó del 45% al 63%.50 Se obtuvieron resultados similares al combinar el circPTPN22 plasmático con los niveles de CEA y CA 19-9. En este último caso, los niveles de AUC, sensibilidad y especificidad fueron 0,892; 83% y 87% respectivamente. Los autores también observaron que los niveles de circPTPN22 aumentaron gradualmente desde los donantes sanos hasta los pacientes con CG, pasando por los pacientes con gastritis, lo que convierte a circPTPN22 en un biomarcador interesante para la clínica.51
c) ARN largos no codificantes
Los lncARN son transcripciones largas (> 200 nucleótidos) con nula o limitada capacidad para codificar proteínas. Regulan distintos procesos biológicos, son altamente estables y circulan en fluidos corporales. Zhang y colaboradores identificaron 5 lncARN plasmáticos regulados al alza (TINCR, CCAT2, AOC4P, BANCR y LINC00857) capaces de distinguir a los pacientes con CG con un AUC de 0,90 en la cohorte de validación (80 pacientes con CG y 80 individuos sanos). Además, identificaron que este lncARN podía distinguir al CG de los pacientes con lesiones preneoplásicas con una sensibilidad del 68% y una especificidad del 89%, y distinguir el CG de los tumores del estroma gastrointestinal con una sensibilidad y especificidad del 68% y 86%, respectivamente.52
Otros lncARN encontrados en exosomas son lncUEGC1 y lncUEGC2. Utilizando muestras de plasma de 10 pacientes con CG en estadio I y 5 individuos sanos, se identificaron 79 lncRNAs exosomales regulados al alza.52 Estos resultados se combinaron con la secuenciación de ARN de líneas celulares de CG y luego se validaron mediante qRT-PCR en 51 pacientes con CG en estadios I-II y 60 controles sanos. Los mejores resultados se obtuvieron utilizando el lncUEGC1, siendo capaz de distinguir a los pacientes con CG en estadio I-II de los controles sanos con un AUC de 0,88; mientras que el lncUEGC2 y el CEA en suero mostraron valores de AUC de 0,76 y 0,66 respectivamente). El lncUEGC1 exosomal también fue capaz de distinguir a los pacientes con CG en estadio I de la GCA con un AUC de 0,84. Por ello, el lncUEGC1 parece prometedor para el desarrollo de biomarcadores tempranos de CG.
iii. Proteínas
Las proteínas también se han estudiado como herramientas para cribado del CG. Mediante el análisis con ELISA del suero de 72 pacientes se encontró que la mejor manera de identificar GCA y MI del cuerpo gástrico fue utilizar la PGI/II (AUC 0,92; sensibilidad de 83% y especificidad del 77,9%), con resultados menos satisfactorios al utilizar niveles aislados de PGI o de PGII.53 Sin embargo, en una cohorte prospectiva española de pacientes con GCA, se encontró que tanto PGI, PGII y PGI/II no mostraron diferencias significativas y no se consideraron biomarcadores suficientemente buenos.54 Se necesitan estudios de cohorte más extensas para determinar su utilidad real en la detección de GCA y MI antes de su aplicación en la práctica.
Otra proteína interesante es el factor 3 de trefoil (TFF3), la cual se ha encontrado incrementada en el suero de pacientes con CG con un AUC 0,89; sensibilidad del 80,9% y especificidad del 81%.55 En otro estudio se encontró que el GC precoz mostró niveles más altos de TFF3 en muestras de plasma, sin diferencias entre GCA y controles normales.56 Así también, se comparó la PGI/II con TTF3 en muestras de suero de pacientes con GCA, mostrando mejores valores con PGI/II que con TTF3 (AUC 0,76 y 0,53 respectivamente).57
Otro biomarcador potencialmente útil para detectar lesiones premalignas podría ser la proteína C reactiva de alta sensibilidad (hs-RCP). Altun y colaboradores estudiaron a 811 pacientes y encontraron que los pacientes con gastritis crónica tenían niveles más altos de hs-CRP.58 En otro estudio con 378 pacientes, encontraron que una combinación de niveles séricos de hs-RCP y la PGI/II mostraba una sensibilidad del 67% y una especificidad del 72% para la detección de pacientes con MI, mientras que la hs-CRP demostró una sensibilidad del 67% y una especificidad del 85% para detectar CG localmente avanzado.59
El factor inhibidor de migración de macrófagos (MIF) es otro potencial biomarcador. Un estudio, cuantificó este factor mediante ELISA en una cohorte de 15 pacientes sanos, 15 con gastritis antral crónica, 20 con MI y 40 con CG; identificando niveles más altos en pacientes con gastritis y aún mayores en aquellos con MI y CG. Todos los pacientes con gastritis crónica eran positivos para H. pylori, no así los pacientes con MI y CG. Por lo tanto, los niveles del MIF en MI y CG fueron independientes de la infección por H. pylori.60
b Biomarcadores en saliva
La utilización de saliva como fuente de biomarcadores es un enfoque interesante para el cribado de CG puesto que su recolección es mínimamente invasiva y las glándulas son estimuladas por mediadores que pueden liberarse por los tumores. En este contexto, en una cohorte de 163 individuos con CG y 131 individuos sanos, se validó un panel que combina tres ARNm (SPINK7, PPL y SEMA4B), dos miARN (miR140-5p y miR301a) y datos demográficos (tabaquismo, sexo y edad); obteniendo un AUC de 0,86; una sensibilidad de 82% y una especificidad de 77%. Este estudio se realizó en una población de alto riesgo (coreana), por lo que debería confirmarse la utilidad del panel en cohortes de baja prevalencia para valorar su utilidad y aplicabilidad en la práctica clínica en estas poblaciones.61 Otro panel que combina el ARNm salival PPL con el CEA en muestras sanguíneas logró una sensibilidad del 92% y una especificidad del 87% en una cohorte de 200 pacientes con GC y 200 individuos sanos.62 Esta combinación de biomarcadores de distintas fuentes puede ser interesante para mejorar las estrategias de cribado.
Otros dos estudios propusieron proteínas salivales como biomarcadores de CG. Se obtuvo un panel de tres proteínas utilizando proteómica cuantitativa y ELISA en una cohorte de 40 pacientes con CG y 40 individuos sanos. Este panel fue capaz de distinguir a los pacientes con CG con un AUC de 0,93. Sin embargo, la cohorte fue pequeña y se necesita replicar el estudio en una cohorte más grande.63 Shu y colaboradores propusieron un patrón de glicoproteínas salivales como biomarcador diagnóstico para el CG en una cohorte de 87 pacientes con CG, 54 pacientes con GCA y 60 controles sanos. Establecieron dos modelos diferentes para distinguir a los pacientes con GCA y GC de los individuos sanos. Obtuvieron un AUC de 0,83 y 0,89; una sensibilidad del 92% y 96%; y una especificidad del 72% y 80%, respectivamente.64
c Biomarcadores en heces
La obtención de muestras en heces tiene la ventaja de no requerir ningún tipo procedimiento invasivo por lo que se ha convertido en una muestra muy útil para el cribado de otros cánceres, como el colorrectal. Sin embargo, en la actualidad existen muy pocos estudios sobre biomarcadores en heces relacionados al CG. En 2003 se propuso la proteína GP87 fecal como biomarcador del CG, con una sensibilidad del 79,3% y del 84,4% para pacientes con CG y con GCA, respectivamente.65 Los autores sugirieron que esta proteína podría ser útil para seleccionar a una subpoblación de alto riesgo de CG que debería ser seguida endoscópicamente. En el mismo año, se propuso la M2-PK como biomarcador del CG, pero se encontró una sensibilidad muy baja y no se realizaron más estudios para evaluar su potencial utilidad.66
Debido a ciertas limitaciones las heces no se utilizan con frecuencia para la detección de biomarcadores de CG. En primer lugar debido a la reticencia que presentan ciertos pacientes para manipular el material fecal. Además, la calidad en la recolección de la muestra y su manipulación por parte de los pacientes e investigadores puede afectar los resultados.67 Por otra parte, pueden no ser específicos del CG, al igual que los biomarcadores encontrados en otras fuentes. Pese a ello, estudios recientes sugieren cierta correlación entre la microbiota intestinal y el desarrollo de CG,68,69 lo que abre un nuevo foco de investigación de biomarcadores no invasivos.
d Biomarcadores en jugo gástrico
Entre los biomarcadores identificados en el jugo gástrico, la mayoría son ARN no codificantes y proteínas, probablemente porque el ADN se degrada fácilmente por acción del ácido gástrico. Un estudio que utiliza exosomas para evitar su degradación, identificó la metilación de BARHL2 y demostró su utilidad para discriminar pacientes con CG de individuos sanos, siendo necesarios estudios en cohortes más grandes para validar la metilación de BARHL2 como biomarcador de cribado del CG.70
En relación con las proteínas en el jugo gástrico, GP87 fue estudiada por Qiao y colaboradores en una cohorte de 80 individuos sanos, 82 pacientes con CG, 20 pacientes con gastritis crónica superficial, 14 pacientes con úlcera, 32 pacientes con GCA y 3 pacientes con pólipos. Observaron que la tasa de positividad de GP87 en el jugo gástrico fue del 86,3% para el CG y del 60% para pacientes con GCA, mientras que las tasas para los grupos con gastritis crónica superficial y los individuos sanos fueron del 26,1% (p < 0,05) y del 16% (p < 0,05), respectivamente.71
Por lo tanto, existen diversos biomarcadores prometedores que podrían desempeñar un papel en el diagnóstico temprano, en la detección de lesiones precursoras y en el cribado del CG. Los biomarcadores en sangre tienen ventajas por su gran aceptación por parte de la población en términos de obtención de muestras. Por otro lado, las muestras de heces o de saliva deben ser estudiadas más a fondo, ya que su obtención fácil podría mejorar el cribado, especialmente la saliva. Aunque la obtención del jugo gástrico es invasiva, su relación directa con el estómago la hace bastante interesante.
La mejor estrategia parece ser la combinación de diferentes biomarcadores, sumado a datos clínicos y bioquímicos para aumentar la precisión diagnóstica. En este contexto, se pueden mencionar los paneles de miARN como una de las estrategias más viables para el futuro. Sin embargo, todavía se necesitan estudios adicionales con muestras más extensas, con un mayor número de pacientes sanos que representen a la población real de cribado, sin dejar de lado a las poblaciones de baja prevalencia o a las condiciones premalignas como la GCA, la MI y la displasia.4
Conclusiones
La prevención y el diagnóstico precoz del CG ejemplifican a la perfección el modelo de medicina de precisión, un enfoque de atención médica que busca que la prioridad recaiga más en el individuo que en la población general. Para alcanzarlo, no sólo es imprescindible un extenso conocimiento de la enfermedad, sino que también resultan claves la identificación de los factores individuales y la comprensión de las diferencias genéticas, moleculares y ambientales. Esto permite diseñar estrategias de abordaje mucho más personalizadas. Con esta aproximación en la prevención del CG, el sujeto aparece siempre en el centro, las medidas se focalizan directamente en el individuo y, secundariamente, conducen a la optimización del uso de los recursos. En cuanto a la prevención primaria, poder controlar y eliminar los factores de riesgo establecidos para el desarrollo del CG requiere de una atención adecuada al contexto del paciente. La erradicación del
H. pylori en ocasiones depende más de los factores genéticos y ambientales que de la propia patogenicidad de la bacteria. Conocer estos factores y aplicarlos en la selección del tratamiento conlleva una mejoría en las tasas de éxito de erradicación de la bacteria.
De la misma manera ocurre en la prevención secundaria, donde este modelo nos ayuda a predecir el riesgo individual de desarrollar la enfermedad, estratificando por grupos de riesgo según factores clínicos o moleculares que nos permiten elaborar las mejores estrategias de vigilancia. En este sentido, existe un gran número de biomarcadores muy prometedores que en un futuro van a tener un papel clave en el abordaje de esta enfermedad.
Propiedad intelectual. Los autores declaran que los datos, las figuras y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. FONIS SA19/0188 (A.R.) «Cost-effectiveness of new population screening strategies for gastric cancer control in Chile», European Union’s Horizon 2020 research and innovation program grant agreement No 825832 (A.R.), FONDECYT 1230504 (A.R.) «Role of the genomic and microbiome profile in gastric carcinogenesis: prospective endoscopic follow-up», ANID FONDAP 152220002 (A.R.) «CECAN: Centro para la prevención y el control del cáncer», FIS PI21/00333 (L.M). Instituto Carlos III: “Investigación y desarrollo de nuevas estrategias para la detección precoz y la prevención del cáncer gástrico en la población española: proyecto EpiGASTRIC / EDGAR”.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2023 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Luzko I, Medel-Jara P, Llach J y col. Medicina de precisión en la prevención primaria y secundaria del cáncer gástrico. Acta Gastroenterol Latinoam. 2023;53(3):241-254. https://doi.org/10.52787/agl.v53i3.349
Referencias
- Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249. DOI:10.3322/caac.21660
- Van Cutsem E, Sagaert X, Topal B, Haustermans K, Prenen H. Gastric cancer. The Lancet. 2016;388(10060):2654-2664. DOI:10.1016/S0140-6736(16)30354-3
- Asplund J, Kauppila JH, Mattsson F, Lagergren J. Survival Trends in Gastric Adenocarcinoma: A Population-Based Study in Sweden. Ann Surg Oncol. 2018;25(9):2693-2702. DOI:10.1245/s10434-018-6627-y
- Herrera-Pariente C, Montori S, Llach J, Bofill A, Albeniz E, Moreira L. Biomarkers for Gastric Cancer Screening and Early Diagnosis. Biomedicines. 2021;9(10):1448. DOI:10.3390/biomedicines9101448
- Larsson SC, Bergkvist L, Wolk A. Fruit and Vegetable Consumption and Incidence of Gastric Cancer: A Prospective Study. Cancer Epidemiology, Biomarkers & Prevention. 2006;15(10):1998-2001. DOI:10.1158/1055-9965.EPI-06-0402
- Tramacere I, Negri E, Pelucchi C, et al. A meta-analysis on alcohol drinking and gastric cancer risk. Ann Oncol. 2012;23(1):28-36. DOI:10.1093/annonc/mdr135
- Nomura AMY, Wilkens LR, Henderson BE, Epplein M, Kolonel LN. The association of cigarette smoking with gastric cancer: the multiethnic cohort study. Cancer Causes Control. 2012;23(1):51-58. DOI:10.1007/s10552-011-9854-0
- Eslick GD, Lim LL, Byles JE, Xia HH, Talley NJ. Association of Helicobacter pylori infection with gastric carcinoma: a meta-analysis. Am J Gastroenterol. 1999;94(9):2373-2379. DOI:10.1111/j.1572-0241.1999.01360.x
- Choi IJ, Kim CG, Lee JY, et al. Family History of Gastric
Cancer and Helicobacter pylori Treatment. New England Journal of Medicine. 2020;382(5):427-436. DOI:10.1056/NEJMoa1909666 - Lott PC, Carvajal-Carmona LG. Resolving gastric cancer aetiology: an update in genetic predisposition. Lancet Gastroenterol Hepatol. 2018;3(12):874-883. DOI:10.1016/S2468-1253(18)30237-1
- Correa P. Gastric cancer: overview. Gastroenterol Clin North Am. 2013;42(2):211-217. DOI:10.1016/j.gtc.2013.01.002
- Choi KS, Jun JK, Park EC, et al. Performance of Different Gastric Cancer Screening Methods in Korea: A Population-Based Study. PLoS One. 2012;7(11):e50041. DOI:10.1371/journal.pone.0050041
- Jun JK, Choi KS, Lee HY, et al. Effectiveness of the Korean National Cancer Screening Program in Reducing Gastric Cancer Mortality. Gastroenterology. 2017;152(6):1319-1328.e7. DOI:10.1053/j.gastro.2017.01.029
- Khanderia E, Markar SR, Acharya A, Kim Y, Kim YW, Hanna GB. The Influence of Gastric Cancer Screening on the Stage at Diagnosis and Survival. J Clin Gastroenterol. 2016;50(3):190-197. DOI:10.1097/MCG.0000000000000466
- Cubiella J, Pérez Aisa Á, Cuatrecasas M, et al. Documento de posicionamiento de la AEG, la SEED y la SEAP sobre cribado de cáncer gástrico en poblaciones con baja incidencia. Gastroenterol Hepatol. 2021;44(1):67-86. DOI:10.1016/j.gastrohep.2020.08.004
- Fernández-Esparrach G, Marín-Gabriel JC, Díez Redondo P, et al. Documento de posicionamiento de la AEG, la SEED y la SEAP sobre calidad de la endoscopia digestiva alta para la detección y vigilancia de las lesiones precursoras de cáncer gástrico. Gastroenterol Hepatol. 2021;44(6):448-464. DOI:10.1016/j.gastrohep.2021.01.002
- Talking Glossary of Genomic and Genetic Terms. National Human Genome Research Institute. Data updated: September 7, 2023. Accessed September 7, 2023. https://www.genome.gov/genetics-glossary/Precision-Medicine
- What is precision medicine? Medline plus. Data updated: May 17, 2022. Accessed September 7, 2023. https://medlineplus.gov/genetics/understanding/precisionmedicine/definition/
- Ierardi E, Losurdo G, Fortezza RF La, Principi M, Barone M, Leo A Di. Optimizing proton pump inhibitors in Helicobacter pylori treatment: Old and new tricks to improve effectiveness. World J Gastroenterol. 2019;25(34):5097-5104. DOI:10.3748/wjg.v25.i34.5097
- Zeng R, Li X, Wang F, Xie J, Song C, Xie Y. Reinforced medication adherence improves Helicobacter pylori eradication rate in developing countries: A systematic review and meta-analysis of randomized controlled trials. Helicobacter. 2023;28(4). DOI:10.1111/hel.12989
- Yu J, Yang P, Qin X, Li C, Lv Y, Wang X. Impact of smoking on the eradication of Helicobacter pylori. Helicobacter. 2022;27(1). DOI:10.1111/hel.12860
- Pan K feng, Zhang L, Gerhard M, et al. A large randomised controlled intervention trial to prevent gastric cancer by eradication of Helicobacter pylori in Linqu County, China: baseline results and factors affecting the eradication. Gut. 2016;65(1):9-18. DOI:10.1136/gutjnl-2015-309197
- Takara Y, Endo H, Nakano R, et al. Smoking and Drinking Did Not Increase the Failure of Therapeutic Helicobacter pylori Eradication by Vonoprazan, Clarithromycin, and Amoxicillin. Digestion. 2019;99(2):172-178. DOI:10.1159/000490889
- Ng HY, Leung WK, Cheung KS. Antibiotic Resistance, Susceptibility Testing and Stewardship in Helicobacter pylori Infection. Int J Mol Sci. 2023;24(14):11708. DOI:10.3390/ijms241411708
- Zou Y, Qian X, Liu X, et al. The effect of antibiotic resistance on Helicobacter pylori eradication efficacy: A systematic review and meta-analysis. Helicobacter. 2020;25(4). DOI:10.1111/hel.12714
- Malfertheiner P, Megraud F, Rokkas T, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut. 2022;71(9):1724-1762. DOI:10.1136/gutjnl-2022-327745
- Ma Q, Li H, Liao J, Cai Z, Zhang B. Tailored therapy for Helicobacter pylori eradication: A systematic review and meta-analysis. Front Pharmacol. 2022;13. DOI:10.3389/fphar.2022.908202
- Gisbert JP, McNicholl AG. Optimization strategies aimed to increase the efficacy of H. pylori eradication therapies. Helicobacter. 2017;22(4):e12392. DOI:10.1111/hel.12392
- Matsuoka T, Yashiro M. Biomarkers of gastric cancer: Current topics and future perspective. World J Gastroenterol. 2018;24(26):2818-2832. DOI:10.3748/wjg.v24.i26.2818
- Feng F, Tian Y, Xu G, et al. Diagnostic and prognostic value of CEA, CA19–9, AFP and CA125 for early gastric cancer. BMC Cancer. 2017;17(1):737. DOI:10.1186/s12885-017-3738-y
- Biomarkers and surrogate endpoints: Preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69(3):89-95. DOI:10.1067/mcp.2001.113989
- Padmanabhan N, Ushijima T, Tan P. How to stomach an epigenetic insult: the gastric cancer epigenome. Nat Rev Gastroenterol Hepatol. 2017;14(8):467-478. DOI:10.1038/nrgastro.2017.53
- Hideura E, Suehiro Y, Nishikawa J, et al. Blood Free-Circulating DNA Testing of Methylated RUNX3 Is Useful for Diagnosing Early Gastric Cancer. Cancers (Basel). 2020;12(4):789. DOI:10.3390/cancers12040789
- Miao J, Liu Y, Zhao G, et al. Feasibility of Plasma-Methylated SFRP2 for Early Detection of Gastric Cancer. Cancer Control. 2020;27(2):107327482092255.DOI:10.1177/
1073274820922559 - Alarcón M, Olivares W, Córdova-Delgado M, et al. The Reprimo-Like Gene Is an Epigenetic-Mediated Tumor Suppressor and a Candidate Biomarker for the Non-Invasive Detection of Gastric Cancer. Int J Mol Sci. 2020;21(24):9472. DOI:10.3390/ijms21249472
- Liu L, Yang X. Implication of Reprimo and hMLH1 gene methylation in early diagnosis of gastric carcinoma. Int J Clin Exp Pathol. 2015;8(11):14977-14982.
- Fernandes J, Michel V, Camorlinga-Ponce M, et al. Circulating Mitochondrial DNA Level, a Noninvasive Biomarker for the Early Detection of Gastric Cancer. Cancer Epidemiology, Biomarkers & Prevention. 2014;23(11):2430-2438. DOI:10.1158/1055-9965.EPI-14-0471
- Ueda T, Volinia S, Okumura H, et al. Relation between microRNA expression and progression and prognosis of gastric cancer: a microRNA expression analysis. Lancet Oncol. 2010;11(2):136-146. DOI:10.1016/S1470-2045(09)70343-2
- Kahroba H, Hejazi MS, Samadi N. Exosomes: from carcinogenesis and metastasis to diagnosis and treatment of gastric cancer. Cellular and Molecular Life Sciences. 2019;76(9):1747-1758. DOI:10.1007/s00018-019-03035-2
- Huang T, Song C, Zheng L, Xia L, Li Y, Zhou Y. The roles of extracellular vesicles in gastric cancer development, microenvironment, anti-cancer drug resistance, and therapy. Mol Cancer. 2019;18(1):62. DOI:10.1186/s12943-019-0967-5
- Koga Y, Yasunaga M, Moriya Y, et al. Exosome can prevent RNase from degrading microRNA in feces. J Gastrointest Oncol. 2011;2(4):215-222. DOI:10.3978/j.issn.2078-6891.2011.015
- Zheng GD, Xu ZY, Hu C, et al. Exosomal miR-590-5p in Serum as a Biomarker for the Diagnosis and Prognosis of Gastric Cancer. Front Mol Biosci. 2021;8. DOI:10.3389/fmolb.2021.636566
- Shi Y, Wang Z, Zhu X, et al. Exosomal miR-1246 in serum as a potential biomarker for early diagnosis of gastric cancer. Int J Clin Oncol. 2020;25(1):89-99. DOI:10.1007/s10147-019-01532-9
- Hung PS, Chen CY, Chen WT, et al. miR-376c promotes carcinogenesis and serves as a plasma marker for gastric carcinoma. PLoS One. 2017;12(5):e0177346. DOI:10.1371/journal.pone.0177346
- Wu J, Li G, Wang Z, et al. Circulating MicroRNA-21 Is a Potential Diagnostic Biomarker in Gastric Cancer. Dis Markers. 2015;2015:1-8. DOI:10.1155/2015/435656
- Zeng W, Zhang S, Yang L, et al. Serum miR-101-3p combined with pepsinogen contributes to the early diagnosis of gastric cancer. BMC Med Genet. 2020;21(1):28. DOI:10.1186/s12881-020-0967-8
- Cheng J, Yang A, Cheng S, et al. Circulating miR-19a-3p and miR-483-5p as Novel Diagnostic Biomarkers for the Early Diagnosis of Gastric Cancer. Medical Science Monitor. 2020;26. DOI:10.12659/MSM.923444
- So JBY, Kapoor R, Zhu F, et al. Development and validation of a serum microRNA biomarker panel for detecting gastric cancer in a high-risk population. Gut. 2021;70(5):829-837. DOI:10.1136/gutjnl-2020-322065
- Zhou B, Zhou Z, Chen Y, et al. Plasma proteomics-based identification of novel biomarkers in early gastric cancer. Clin Biochem. 2020;76:5-10. DOI:10.1016/j.clinbiochem.2019.11.001
- Huang M, He YR, Liang LC, Huang Q, Zhu ZQ. Circular RNA hsa_circ_0000745 may serve as a diagnostic marker for gastric cancer. World J Gastroenterol. 2017;23(34):6330. DOI:10.3748/wjg.v23.i34.6330
- Ma S, Kong S, Gu X, et al. As a biomarker for gastric cancer, circPTPN22 regulates the progression of gastric cancer through the EMT pathway. Cancer Cell Int. 2021;21(1):44. DOI:10.1186/s12935-020-01701-1
- Zhang K, Shi H, Xi H, et al. Genome-Wide lncRNA Microarray Profiling Identifies Novel Circulating lncRNAs for Detection of Gastric Cancer. Theranostics. 2017;7(1):213-227. DOI:10.7150/thno.16044
- Loong TH, Soon NC, Nik Mahmud NRK, et al. Serum pepsinogen and gastrin-17 as potential biomarkers for pre-malignant lesions in the gastric corpus. Biomed Rep. 2017;7(5):460-468. DOI:10.3892/br.2017.985
- McNicholl AG, Forné M, Barrio J, et al. Accuracy of GastroPanel for the diagnosis of atrophic gastritis. Eur J Gastroenterol Hepatol. 2014;26(9):941-948. DOI:10.1097
MEG.0000000000000132 - Aikou S, Ohmoto Y, Gunji T, et al. Tests for Serum Levels of Trefoil Factor Family Proteins Can Improve Gastric Cancer Screening. Gastroenterology. 2011;141(3):837-845.e7. DOI:10.1053/j.gastro.2011.05.040
- Choi B, Lee HJ, Min J, et al. Plasma expression of the intestinal metaplasia markers CDH17 and TFF3 in patients with gastric cancer. Cancer Biomarkers. 2017;19(3):231-239. DOI:10.3233/CBM-160147
- Huang Z, Zhang X, Lu H, et al. Serum trefoil factor 3 is a promising non-invasive biomarker for gastric cancer screening: A monocentric cohort study in China. BMC Gastroenterol. 2014;14(1):74. DOI:10.1186/1471-230X-14-74
- Altun E, Yildiz A, Cevik C, Turan G. The role of high sensitive C-reactive protein and histopathological evaluation in chronic gastritis patients with or without Helicobacter pylori infection. Acta Cir Bras. 2019;34(3). DOI:10.1590/s0102-865020190030000010
- Chung HW, Kim JW, Lee J han, et al. Comparison of the Validity of Three Biomarkers for Gastric Cancer Screening. J Clin Gastroenterol. 2009;43(1):19-26. DOI:10.1097/MCG.0b013e318135427c
- He XX. Increased epithelial and serum expression of macrophage migration inhibitory factor (MIF) in gastric cancer: potential role of MIF in gastric carcinogenesis. Gut. 2006;55(6):797-802. DOI:10.1136/gut.2005.078113
- Li F, Yoshizawa JM, Kim KM, et al. Discovery and Validation of Salivary Extracellular RNA Biomarkers for Noninvasive Detection of Gastric Cancer. Clin Chem. 2018;64(10):1513-1521. DOI:10.1373/clinchem.2018.290569
- Xu F, Jiang M. Evaluation of predictive role of carcinoembryonic antigen and salivary mRNA biomarkers in gastric cancer detection. Medicine. 2020;99(22):e20419. DOI:10.1097/MD.0000000000020419
- Xiao H, Zhang Y, Kim Y, et al. Differential Proteomic Analysis of Human Saliva using Tandem Mass Tags Quantification for Gastric Cancer Detection. Sci Rep. 2016;6(1):22165. DOI:10.1038/srep22165
- Shu J, Yu H, Li X, et al. Salivary glycopatterns as potential biomarkers for diagnosis of gastric cancer. Oncotarget. 2017;8(22):35718-35727. DOI:10.18632/oncotarget.16082
- Qiao SX, Yuan M, Liu YL, Lin XS, Zhang XP, Tobi M. Detection of gastric cancer and premalignant lesions by novel marker glycoprotein 87 using monoclonal antibody Adnab-9. Cancer Epidemiol Biomarkers Prev. 2003;12(10):1095-1099.
- Zhang B. Tumor type M2 pyruvate kinase expression in gastric cancer, colorectal cancer and controls. World J Gastroenterol. 2004;10(11):1643. DOI:10.3748/wjg.v10.i11.1643
- Shimura T. Novel Biomarkers of Gastrointestinal Cancer. Cancers (Basel). 2021;13(7):1501. DOI:10.3390/cancers13071501
- Liu S, Dai J, Lan X, et al. Intestinal bacteria are potential biomarkers and therapeutic targets for gastric cancer. Microb Pathog. 2021;151:104747. DOI:10.1016/j.micpath.2021.104747
- Wu J, Zhang C, Xu S, et al. Fecal Microbiome Alteration May Be a Potential Marker for Gastric Cancer. Dis Markers. 2020;2020:1-17. DOI:10.1155/2020/3461315
- Yamamoto H, Watanabe Y, Oikawa R, et al. BARHL2 Methylation Using Gastric Wash DNA or Gastric Juice Exosomal DNA is a Useful Marker For Early Detection of Gastric Cancer in an H. pylori -Independent Manner. Clin Transl Gastroenterol. 2016;7(7):e184. DOI:10.1038/ctg.2016.40
- Qiao SX, Yuan M, Liu YL, Lin XS, Zhang XP, Tobi M. Detection of gastric cancer and premalignant lesions by novel marker glycoprotein 87 using monoclonal antibody Adnab-9. Cancer Epidemiol Biomarkers Prev. 2003;12(10):1095-1099.
- Graham DY. Implications of the paradigm shift in management of Helicobacter pylori infections. The ap Adv Gastroenterol. 2023;16:175628482311608. DOI:10.1177/17562848231160858
- Understanding the NGS workflow. Illumina. Published 2023. Accessed September 8, 2023. https://www.illumina.com/science/technology/next-generation-sequencing/beginners/ngs-
workflow.html - Reyes D, Ortiz J, Fuentes-López E, et al. Terapias cuádruples son superiores a terapia triple estándar en primera línea de erradicación de Helicobacter pylori en Chile. Gastroenterol Hepatol. 2022;45(7):515-523. DOI:10.1016/j.gastrohep.2021.11.010
Correspondencia: Arnoldo Riquelme – Leticia Moreira
Correo electrónico: ariquelme.perez@gmail.com – lmoreira@clinic.cat
Acta Gastroenterol Latinoam 2023;53(3):241-254
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE