Gloria Fernández-Esparrach, Ana García-Rodríguez
Unidad de Endoscopia, Servicio de Gastroenterología, ICMDM, Hospital Clínic, Barcelona. IDIBAPS. CIBEREHD.
Universidad de Barcelona, Cataluña, España.
Acta Gastroenterol Latinoam 2020;50:106-109
Introducción a la inteligencia artificial
La Inteligencia Artificial (IA) es un subcampo de la informática que se creó en la década de los sesenta. No existe una definición consensuada de IA pero, a grandes rasgos, es la inteligencia llevada a cabo por máquinas, es decir, sistemas que intentan hacer y pensar de manera similar a los humanos.
Hay 4 tipos de IA: 1) Sistemas que piensan como humanos. Estos sistemas tratan de emular el pensamiento humano y automatizan actividades como la toma de decisiones, resolución de problemas y aprendizaje. Los sistemas de soporte a la salud se engloban en este tipo (Figura 1). 2) Sistemas que actúan como humanos; es decir, imitan el comportamiento humano; por ejemplo la robótica. 3) Sistemas que piensan racionalmente, es decir, que imitan el procesamiento lógico de las personas; por ejemplo, los sistemas expertos. 4) Sistemas que actúan racionalmente. Tratan de emular de forma racional el comportamiento humano; por ejemplo los agentes inteligentes que desactivan artefactos.
Figura 1. Gráfico explicativo de los componentes (interfaces gráficas, extracción de características y técnicas de clasificación) y posibles aplicaciones de la IA (los sistemas de soporte a la salud entre ellas)

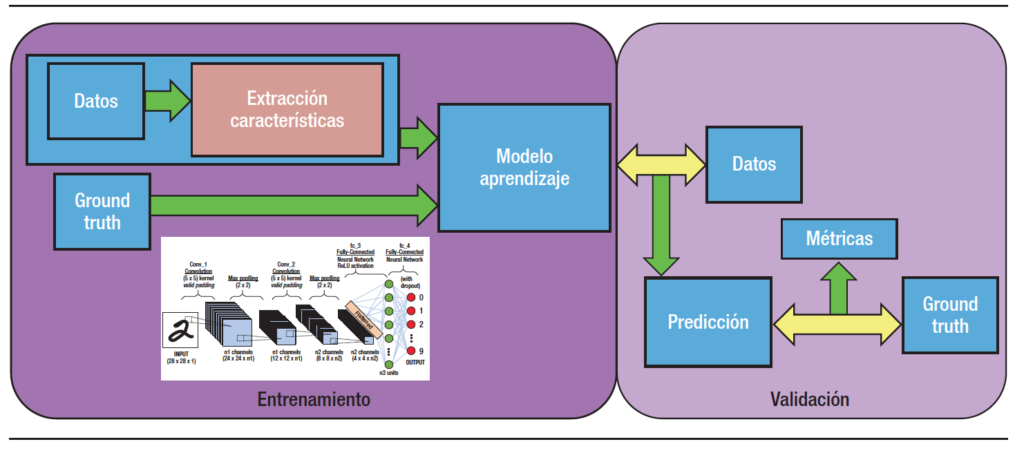
A través de un proceso de aprendizaje previo, la IA es capaz de dar respuestas similares a las que daría un humano en la misma situación. A las técnicas que engloban este aprendizaje se les denomina Machine Learning (ML) o aprendizaje automático. Los modelos de ML tienen 2 fases: una primera llamada “entrenamiento”, en la cual se muestra al modelo una serie de ejemplos de entrada etiquetados previamente y el modelo se crea y aprende; y una segunda llamada “predicción”, en la cual el modelo ya entrenado realiza la predicción con nuevos ejemplos no etiquetados.
El Deep Learning (DL) o aprendizaje supervisado es una forma de ML. En el ML hay que guiar a la máquina en cada una de las fases del proceso para que, a través de la práctica, aprenda a identificar lo que queremos de manera automática. Contrariamente, en el DL la máquina aprende por sí sola con cada nueva entrada de información que recibe (Figura 2).
Figura 2. Representación esquemática del proceso de aprendizaje del ML y DL

El DL lleva a cabo el proceso de ML usando una red neuronal artificial que se compone de un número de niveles jerárquicos. En el nivel inicial de la jerarquía la red aprende algo simple y luego envía esta información al siguiente nivel. El siguiente nivel toma esta información sencilla, la combina, compone una información algo un poco más compleja, y se lo pasa al tercer nivel, y así sucesivamente (Figura 3). Podría decirse que el DL es la técnica que más se acerca a la forma en la que aprendemos los humanos.
Figura 3. Gráfico que muestra el proceso de DL, primero en una fase de entrenamiento y posteriormente en la de validación
Los sistemas inteligentes tienen unas ventajas evidentes sobre los humanos: no se cansan, no se afectan por factores externos y son independientes del operador.
Aplicaciones de la IA en endoscopia
La medicina es uno de los campos más beneficiados por la irrupción de la IA. En la especialidad de Gastroenterología se han descrito aplicaciones en 4 áreas: colonoscopia, cáncer gástrico precoz, esófago de Barrett y cáncer de esófago. En este apartado nos centraremos en el terreno de la endoscopía.
La IA ha sido ampliamente investigada en el marco de la colonoscopía como herramienta para mejorar la detección y clasificación de lesiones. A pesar de que la colonoscopía es el patrón oro para el diagnóstico de cáncer colorectal (CCR), sabemos que no es infalible ya que hasta el 21% de los pólipos, lesiones precursoras del cáncer, no se visualizan durante colonoscopía. Es bien sabido que la tasa de detección de adenomas tiene una correlación inversa con la incidencia del CCR de intervalo y con la tasa de mortalidad asociada al CCR. Esta protección imperfecta contra el CCR puede explicarse por múltiples factores relacionados tanto con el endoscopista como con el equipo. La IA no pretende trabajar de forma autónoma sino en conjunción con el endoscopista, actuando como un segundo observador al ayudarle a mejorar la atención periférica. La IA tiene un futuro prometedor como asistente en la toma de decisiones, lo que favorecería el rendimiento de los endoscopistas con menos experiencia y teóricamente reduciría el número de missed lesions, así como facilitaría la implementación del diagnóstico óptico, con la consecuente reducción de biopsias y polipectomías innecesarias.
Idealmente, la detección y caracterización de pólipos debería ser realizada en tiempo real; esto optimizaría el manejo del paciente (en términos de uso de tiempo y recursos así como prevención de complicaciones asociado con polipectomías innecesarias). Los modelos de IA creados para la detección y caracterización se suelen agrupar en tres grupos según la metodología en la que se basan: a) ‘hand-crafted’, es decir, a través de la extracción manual de las características definitorias para la clasificación de imágenes, b) ML o DL puros; los que actualmente se utilizan, que aprenden las características definitorias a través de la exposición repetida de las imágenes a redes neuronales profundas y c) híbridos, que combinan ambos paradigmas y son útiles cuando los datos de entrenamiento son escasos o, simplemente, para aportar un conocimiento adicional que las redes profundas no son capaces de aprender fácilmente.
Sistemas de detección automática de pólipos
Los métodos de detección tienen como objetivo decidir si hay un pólipo o no en la imagen y habitualmente están diseñados para alertar a los endoscopistas con un sonido o marcador cuando se sospecha la presencia de un pólipo durante la realización de una colonoscopía. Los métodos de localización de pólipos pueden entenderse como una extensión de los métodos de detección de los mismos. En este caso, además de revelar la presencia del pólipo, resaltan el área de la imagen donde está localizado.
En 2016 nuestro grupo publicó un método hand-crafted de detección automática basado en el concepto de pólipo como una sobreelevación redonda de la mucosa que refleja la luz emitida por el endoscopio de forma que en la periferia se forman unos valles más oscuros. Este método se evaluó en grabaciones de video de 31 pólipos y se obtuvo una sensibilidad y especificidad para la detección del 70,4% y 72,4%, respectivamente.
Posteriormente, se han publicado otros estudios con métodos de DL, siendo el más conocido el de Hassan et al. con una sensibilidad del 99,7%.
Sistemas de clasificación automática de pólipos
El umbral que requieren las tecnologías de biopsia óptica para su implementación y adopción en la práctica clínica es > 90% de VPN para el diagnóstico de adenomas diminutos (≤ 5 mm).
En comparación con la detección, se pueden utilizar varias tecnologías ópticas para su clasificación además de luz blanca. La mayoría de los métodos de CAD utilizan imágenes de alta definición y con cromoendoscopía virtual como el narrow band imaging (NBI). La endocitoscopia y la autofluorescencia también se han utilizado para la clasificación automática de pólipos por los grupos japoneses. Es común a todos ellos la identificación semiautomática de la zona correspondiente al pólipo, ya que el endoscopista debe indicar la región de interés centrando el pólipo en la imagen o poniéndolo en contacto con el endoscopio.
El primer trabajo de clasificación de pólipos con NBI fue publicado por Tischendorf et al. en 2010. Estos autores utilizaron 209 imágenes (76,6% pólipos neoplásicos) y obtuvieron una sensibilidad, especificidad y exactitud diagnóstica del 90, 70,2 y 85,3%, respectivamente, en la diferenciación entre pólipo neoplásico y no neoplásico. Posteriormente, Byrne et al. usó DL para el reconocimiento de pólipos en tiempo real (aunque no in vivo) con una eficacia diagnóstica del 98%, una especificidad del 83%, un VPP del 90% y un VPN del 97% mediante el análisis de videos con NBI. Kominami et al. describieron un algoritmo más robusto y adecuado para su uso clínico en tiempo real, que ofrecía clasificación in vivo de pólipos durante la endoscopía. El estudio incluyó 118 imágenes (62% de pólipos neoplásicos), analizó características texturales de las criptas, y obtuvo un rendimiento del 93,2% para la diferenciación de lesión neoplásica/no neoplásica; la sensibilidad, especificidad y valores predictivos también superaron el 90%.
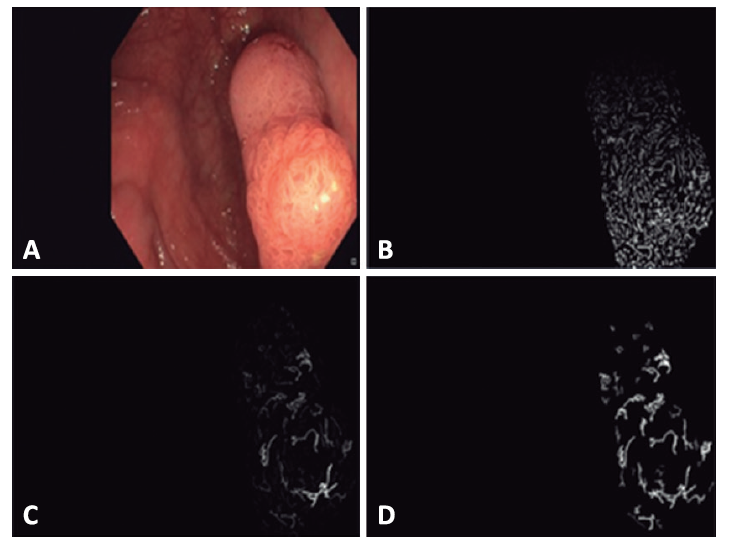
En lo que a predicción automática con luz blanca se refiere, Sanchez-Montes et al. desarrolló un sistema utilizando un modelo predictivo basado en 3 métricas de la superficie del pólipo (contraste, tubularidad y ramificación) (Figura 4). En total se incluyeron 38 adenomas y 13 pólipos no adenomatosos. Mediante una curva ROC se obtuvo el punto de corte de tubularidad de 13,14 y se utilizó este valor para discriminar entre adenoma y no adenoma. Con este punto de corte se obtuvo una exactitud diagnóstica global del 86,3% (44/51), para los adenomas del 94,7% (36/38), pero para los no adenomas descendía a 61,5% (8/13). Posteriormente se perfeccionó el método, analizándose también la ramificación y el contraste de los patrones texturales en superficie y se amplió el número de imágenes (n = 225, 63,1% displásicos), mejorando la exactitud diagnóstica global al 91,1%; en cambio, el VPN global alcanzado fue del 87,1% y por tanto no cumplía el criterio PIVI de la ASGE. No obstante, el VPN ascendía al 96,7% en el subgrupo de pólipos diminutos de recto y sigma (n = 54), con una exactitud diagnóstica del 90,6%.
Figura 4. (A) a partir de una imagen original, (B) se extraen las texturas (C) y se identifican los patrones tubulares (D) y ramificaciones
Limitaciones de la IA
A pesar del tremendo potencial de los sistemas de detección y clasificación de pólipos reportados hasta la fecha, ninguno ha sido implementado en la práctica clínica por los siguientes motivos: a) es necesario que funcionen rápidamente en tiempo real; b) algunos modelos no tienen en cuenta otros elementos endoluminales como pliegues, lesiones subepiteliales, compresiones extrínsecas, vasos sanguíneos y luz; c) se han seleccionado imágenes de “alta calidad”, poco representativas; d) existen todavía ciertos desafíos específicos en imágenes de colonoscopía, como los artefactos o la configuración específica del procesador de video conectado al colonoscopio, y e) la validación de los resultados ha sido realizada en bases de datos pequeñas y limitadas, con un dispositivo específico (marca de endoscopio, resolución y método auxiliar – NBI, AFI, endocitoscopia, luz blanca, etc.) o incluso una dedicación a un solo tipo de pólipo o morfología específica.
La dependencia de la IA puede hacer que la nueva generación de endoscopistas sea menos hábil y meticulosa dada la sensación de seguridad proporcionada por esta herramienta. Los estudios prospectivos futuros deberían evaluar el impacto de estos posibles inconvenientes de la aplicación generalizada de la IA además de su eficacia.
Bibliografía recomendada
- Sánchez-Montes C, Bernal J, García-Rodríguez A, et al. Review of computational methods for the detection and classification of polyps in colonoscopy imaging. Gastroenterol Hepatol 2020; 43: 222-232.
- Fernández-Esparrach G, Bernal J, López-Cerón M, et al. Exploring the Clinical potential of an automatic colonic polyps detection mehtod base don the creation of energy maps. Endoscopy 2016; 48: 837-842.
- Hassan C, Wallace M, Sharma P, et al. New artificial intelligence system: first validation study versus experienced endoscopists for colorectal polyp detection. Gut 2020; 69: 799-800.
- Mori Y, Kudo S, Berzin TM, et al. Computer-aided diagnosis for colonoscopy. Endoscopy 2017; 49: 813-819.
- Sánchez-Montes C, Bernal J, Sánchez FJ, et al. Computer-aided prediction of polyp histology on White light colonoscopy using surface pattern analysis. Endoscopy 2019; 51: 261-265.
Acta Gastroenterol Latinoam – Vol 50 – Sup Nº 4 (BPE – Diciembre 2020)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE