Juan Jacobo Padilla Garrido, Mauricio Sepúlveda Copete
Fundación Clínica Valle del Lili. Cali, Valle del Cauca, Colombia.
Acta Gastroenterol Latinoam 2016;46: 227-229
Recibido: 28/01/2016 / Aprobado: 21/06/2016 / Publicado en www.actagastro.org el 03/10/2016
Resumen
Se presenta el caso de un paciente de 61 años, quien presenta un síndrome convulsivo secundario al drenaje de un hematoma subdural. El paciente inició tratamiento con lamotrigina dos meses antes de su ingreso, en el cual presenta un cuadro febril con episodios convulsivos; los exámenes realizados evidenciaron transaminasas y bilirrubinas elevadas. Se realizaron estudios imagenológicos e infecciosos que descartaron las etiologías más comunes, por lo tanto, se consideró que el inicio reciente de lamotrigina y la recuperación rápida de su perfil hepático y de los síntomas clínicos, se debían a una hepatitis inducida por medicamentos. Es importante considerar que aunque hay descritos diversos efectos adversos asociados al uso de la lamotrigina, la hepatitis tóxica es un fenómeno raro; se han descrito elevaciones de las transaminasas pero los reportes de caso donde se describen hepatitis fulminante son escasos.
Palabras claves. Hepatitis tóxica, anticonvulsivantes, lamotrigina.
Lamotrigine induced toxic hepatitis. Case report and literature review
Summary
Patient has 61 years who convulsive syndrome secondary to drain subdural hematoma occurs. Two months before he entered the patient began treatment with lamotrigine, the entry he has febrile seizure episodes, the test conducted showed elevated transaminases and bilirubin and infectious imaging studies that ruled most common etiologies were made, therefore it was considered that the recent start of lamotrigine and rapid recovery from his liver function and clinical symptoms that your picture was due to a drug-induced hepatitis. It is important to note that although there are described various adverse effects associated with the use of lamotrigine toxic hepatitisis a rare phenomenon, it described transaminase elevations but reports of fulminant hepatitis cases are described where they are weird.
Key words. Toxic hepatitis, anticonvulsive agents, lamotrigine.
La hepatitis tóxica inducida por medicamentos es una complicación potencial de innumerables medicamentos, la mayoría de los casos no ocurren de forma predecible o por efecto dosis-dependiente. Por tal motivo a veces reconocer la droga como un potencial de hepatotóxico es demorado y en los estudios previos a la comercialización de los medicamentos no es encontrado como un efecto adverso.
La lamotrigina es parte del grupo de anticonvulsivantes de última generación y está aprobada para el manejo de convulsiones generalizadas y parciales. Aunque su efecto adverso mayormente reconocido son las erupciones cutáneas, en los últimos años han venido aumentando los reportes que la relacionan con un síndrome de hipersensibilidad potencialmente fatal. La hepatoxicidad también ha sido reportada, sin embargo, la presencia de los casos de falla hepática son poco comunes.
Es por eso que se presenta un caso clínico de un paciente con inicio reciente de lamotrigina, quien ingresó con un cuadro de hepatitis tóxica con criterios de falla hepática pero que mejoró rápidamente al suspender este medicamento.
Presentación del caso
Paciente masculino de 61 años originario procedente de Cali Colombia con antecedentes de hipertensión arterial, secuelas de enfermedad cerebrovascular isquémica en el año 2007 con monoparesia en el miembro superior izquierdo, demencia vascular secundaria y síndrome convulsivo crónico secundario al drenaje de un hematoma subdural crónico en febrero de 2014. Tratamiento que recibe: nifedipina 30 mg cada 12 horas, metoprolol 50 mg cada 12 horas, losartan 100 mg cada 12 horas, lamotrigina 25 mg cada 8 horas (inició dos meses previo al ingreso), ácido valproico 250 mg cada 8 horas (iniciado en el 2014) y atorvastatina 40 mg por día.
Ingresa por un cuadro de cinco días de fiebre no cuantificada asociado a malestar general sin presentar otra sintomatología. Acude a su centro primario de atención dos días previo al ingreso a nuestra institución donde recibe manejo sintomático. Posteriormente desarrolló disminución de la fuerza muscular en las piernas, desorientación, alucinaciones e hiporexia por lo cual ingresa a urgencias para ser valorado. En la revisión de los síntomas refiere orina hiperpigmentada, dolor a la deglución y halitosis. Niega contacto con personas enfermas y visitas a zonas rurales. Refiere que presentó en los últimos tres días tres episodios convulsivos debido a que no estaba tomando su medicación. Al ingreso a la Fundación Valle del Lili Cali, Colombia, se encuentra sin fiebre con frecuencia cardíaca de 88 latidos por minuto, frecuencia respiratoria de 12 por minuto, presión arterial de 178/81, somnoliento con escala de Glasgow 10/15; mucosas húmedas, hipertrofia de amígdalas bilateral sin placas, escleras anictéricas, adenopatía cervical submaxilar derecha, presenta monoparesia del miembro superior izquierdo.
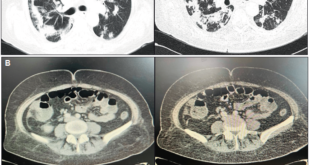
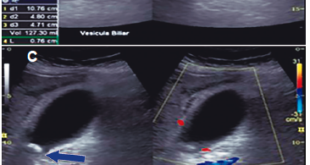
Exámenes de laboratorio: leucocitos 2.300/mm3, neutrófilos 1.160, linfocitos 400, monocitos 120, eosinófilos 370, basófilos 50, hemoglobina 14,9 gr%, hematocrito 44%, plaquetas 100.000/mm3, pt 17,7, RIN 1,26 (control 14,4), ptt 34,3 (control 30), urea 17 mg/dl, creatinina 1,17 mg/dl, alanino aminotrasferasa (ALT) 1.681U/L, aspartato aminotrasferasa (AST) 1.300 U/L, bilirrubina total 3,7 mg/dl, bilirrubina directa 3,47 mg/dl, bilirrubina indirecta 0,30 mg/dl, fosfatasa alcalina 410 U/L, GGT 924 U/L, LDH 1050 U/L, amonio 67 umol/L, sodio 140 mmol/L, potasio 4,4 mmol/L, magnesio 2,0 mmol/L, fósforo 2,8 mmol/L, proteína C reactiva 18,1 mg/dl. Anticuerpos contra el dengue, influenza A/B, H1N1, Elisa VIH, IgM citomegalovirus, toxoplasma IgM, hepatitis C, IgM hepatitis A, antígeno de superficie hepatitis B todos negativos. La carga viral de Epstein Barr fue no detectable, hemocultivos negativos y uroanálisis normales. Estudios radiológicos: ultrasonografía de abdomen total con disminución de la ecogenicidad hepática, con acentuación de las tríadas portales sin hepatomegalia sugestiva de proceso inflamatorio. Sin signos de hepatopatía crónica ni cálculos en la vesícula biliar; una tomografía axial computada de cráneo con áreas de encefalomalacia en el hemisferio cerebral derecho sin evidencia de proceso intracraneal agudo.
El paciente ingresó a la unidad de cuidados intensivos dado su cuadro de encefalopatía, convulsiones y riesgo de falla hepática fulminante. Se trató con el anticonvulsivante levetiracetam y se hizo un control periódico de su función hepática mientras se descartaban otras posibles causas infecciosas causantes de su hepatitis. Durante su estadía el paciente no presentó nuevos episodios comvulsivos, ni alteraciones neurológicas adicionales, y pese a tiempos de coagulación prolongados documetados durante el seguimiento, el paciente, no presentó sangrado clínicamente significativo. Estuvo hospitalizado durante siete días mostrando una tendencia a mejorar las pruebas de función hepática. Al momento del alta presentaba: ALT 476U/L, AST 709U/L, bilirrubina total 1,21 mg/dl, bilirrubina directa 0,5 mg/dl, fosfatasa alcalina:410 U/L y hemograma normal.
Discusión
La toxicidad hepática inducida por medicamentos puede definirse como el daño causado al hígado por toxinas o xenobióticos que causan anormalidades en las pruebas de la función hepática o en la función hepática por sí mismos. Puede variar desde una enfermedad leve con discreto aumento de las aminotrasferasas hasta una hepatitis fulminante que se manifiesta como necrosis hepática.1
Es difícil determinar la frecuencia real y la incidencia de la hepatitis tóxica inducida por medicamentos debido a que los estudios retrospectivos representan sesgos de selección. Los estudios prospectivos están restringidos a los grupos farmacéuticos, los cuales muestran una incidencia de 14 casos por cada 100.000 habitantes, mientras que los estudios retrospectivos muestran una incidencia entre 1 a 3 por cada 100.000 habitantes.
Factores independientes asociados a peor pronóstico incluyen la edad, el sexo femenino y los incrementos de la aspartato aminotransferasa. Otras enfermedades como diabetes, hepatitis B y C, psoriasis y obesidad están asociadas a mayor riesgo de toxicidad. Con respecto a la raza los afroamericanos tienen mayor riesgo de hepatotoxicidad inducida por anticonvulsivantes, los paciente jóvenes están en mayor riesgo de hepatotoxicidad por ácido valproico y los salicilatos. Los pacientes mayores tienden a tener mayor riesgo de desarrollar injuria colestásica.12
El daño a las células hepáticas puede ser causado por distintos mecanismos, la toxina por sí misma puede ser metabolizada permitiendo la acumulación de agentes endógenos. Algunas toxinas pueden unirse covalentemente a las proteínas permitiendo disrupción de la membrana celular y eventualmente la muerte. La unión covalente a las proteínas puede permitir la formación de antígenos que pueden ser blanco del sistema inmune. Estas toxinas pueden ser responsables también de la destrucción de los transportadores y las bombas responsables del flujo de la bilis causando colestasis. Pueden también inhibir la mitocondria disminuyendo su actividad lo que resulta en la formación de especies reactivas de oxígeno de oxidación de lípidos y acumulación de grasa.
El cuadro clínico se caracteriza por síntomas inespecíficos que incluyen astenia, anorexia, náuseas, dolor abdominal, fiebre, ictericia, coluria y prurito. Un incremento leve de las aminotransferasas o presentar falla hepática (coagulopatía o encefalopatía) son comúnmente encontrados en la evaluación de los pacientes.8
Casi todos los anticonvulsivantes con excepción de Gabapentin y Vigabatrin van a biotransformación hepática, los anticonvulsivantes lipofílicos requieren la conversión a su forma hidrofílica para una excreción renal, este proceso requiere metabolismo fase uno y fase dos, reacciones encargadas de permitir metabolitos activos e inactivos. El metabolismo del medicamento depende del flujo sanguíneo hepático, de la unión a la albúmina, de la dosis captada del medicamento por los hepatocitos, la integralidad de los hepatocitos y de la patencia del sistema hepatobiliar. Es un reto para el médico determinar si el medicamento debe continuarse o, de ser suspendido, va a depender de la patología de base, de la injuria hepática establecida y del potencial epiléptico si el paciente debe continuar la droga real.2
Lamotrigina pertenece a la clase fenilpiridina. Fue aprobada para el uso de epilepsia en 1994 para uso en crisis compulsivas parciales y generalizadas, su efectividad también se ha probado para crisis de ausencia y convulsiones atónicas. Bloquea los canales de sodio sensitivos a voltaje inhibiendo la liberación de neurotransmisores incluido glutamato y aspartato.12 Lamotrigina es un tratamiento efectivo para las epilepsias focales y generalizadas, y como la mayoría de los anticonvulsivantes, tiene metabolizaicón hepática. La depuración del medicamento depende del compromiso hepático y se ha propuesto que la reducción de la dosis entre 50 y 75% en pacientes con cirrosis hepática Child-Pugh grado B-C debe ser tenida en cuenta. Algunos experimentos in vitro han demostrado que la duración de lamotrigina no cambia en la presencia de enfermedad hepática.6-9
La elevación de las transaminasas ocurre en menos del 1% de los pacientes; la hepatoxicidad es rara, idiosincrática y usualmente exhibe un patrón hepatocelular.3 Típicamente aparece en el primer mes de iniciado el medicamento y se ha notado que el más frecuente es el aumento rápido de éste y en los estatus epilépticos.4, 5
El compromiso hepático usualmente está sobreagregado a un cuadro de hipersensibilidad compatible con el síndrome de reacción a medicamentos con eosinofilia y síntomas sistémicos, el cual es un proceso de hipersensibilidad que no es mediado por inmunoglobulina E y es considerado una hipersensibilidad tipo IV; esta teoría se ha mostrado in vitro mediante la estimulación de linfocitos.11
En la biopsia se puede observar necrosis hepática aguda o hepatitis focal con inflamación portal leve. En la mayoría de los casos la hepatotoxicidad resuelve con la suspensión del medicamento pero se han descrito casos de hepatitis necrosante fatal.6, 7
Aunque no se reportaron alteraciones en la función hepática en los estudios fase tres y fase cuatro, se ha reportado casos de falla hepática y multiorgánica en pacientes tomando lamotrigina y en algunos casos se ha reportado algún otro síntoma asociado como hipertermia, rash cutáneo, rabdomiólisis y coagulopatía. Basados en estudios en humanos, la lamotrigina debe ser ajustada en presencia de enfermedad hepática. Los reportes de enfermedad hepática son raros y en algunos casos es difícil establecer la causalidad entre la droga y la hepatoxicidad.10
Sostén financiero. No se recibieron aportes económicos para la realización.
Referencias
- López AM, Hendrickson RG. Toxin-Induced Hepatic Injury, Emerg Med Clin N Am 2014; 32: 103-125.
- Ahmed SN, Siddiqi ZA. Antiepileptic drugs and liver disease. Seizure 2006; 15: 156-164.
- Au JS, Pockros PJ. Drug-Induced Liver Injury from Antiepileptic Drugs. Clin Liver Dis 2013; 17: 687-697.
- Marson AG, Al-Kharusi AM, Alwaidh M, Appleton R, Baker GA, Chadwick DW, Cramp C, Cockerell OC, Cooper PN, Doughty J, Eaton B, Gamble C, Goulding PJ, Howell SJ, Hughes A, Jackson M, Jacoby A, Kellett M, Lawson GR, Leach JP, Nicolaides P, Roberts R, Shackley P, Shen J, Smith DF, Smith PE, Smith CT, Vanoli A, Williamson PR; SANAD Study group. The SANAD study of effectiveness of valproate, lamotrigine, ortopiramate for generalised and unclassifiable epilepsy: an unblindedrandomised controlled trial. Lancet 2007; 369: 1016-1026.
- Sauve G, Bresson-Hadni S, Prost P, Le Calvez S, Becker MC, Galmiche J, Carbillet JP, Miguet JP. Acute hepatitis after lamotrigine administration. Dig Dis Sci 2000; 45: 1874-1877.
- Makin AJ, Fitt S, Williams R. Fulminant hepatic failure induced by lamotrigine. BMJ 1995; 311: 292.
- Overstreet K, Costanza C, Behling C, Hassanin T, Masliah E. Fatal progressive hepaticnecrosis associated with lamotrigine treatment: a case report and literature review. Dig Dis Sci 2002; 47: 1921-1925.
- Navarro VJ, Senior JR. Drug-related hepatotoxicity. N Engl J Med 2006; 354: 73.
- Moeller KE, Wei L, Jewell AD, Carver LA. Acute hepatotoxicity associated with lamotrigine. Am J Psychiatry 2008; 165: 539-540.
- Marcellin P, de Bony F, Garret C, Altman C, Boige V, Castelnau C, Laurent-Puig P, Trinchet JC, P Rolan P, Chen C, Mamet JP, Bidault R. Influence of cirrhosis on lamotrigine pharmacokinetics. Br J Clin Pharmacol 2001; 51: 410-414.
- Bohan KH, Mansuri TF, Wilson NM. Anticonvulsant hypersensitivity syndrome: implications for pharmaceutical care. Pharmacotherapy 2007; 27:1425-1439.
- Lucena MI, García-Cortés M, Cueto R, López-Durán J, Andrade RJ. Assessment of drug-induced liver injury in clinical practice. Fundam Clin Pharmacol 2008; 22: 141-158.
Correspondencia: Juan Jacobo Padilla Garrido
Calle 44 # 109-29 apto 104E Cali, Valle del cauca, Colombia
Tel: (+57 2) 3398321- (+57) 3155525187
Correo electrónico: jacobopadilla84@gmail.com
Acta Gastroenterol Latinoam 2016;46(3): 227-229
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE